2015版《药典》中药材标准的变化情况
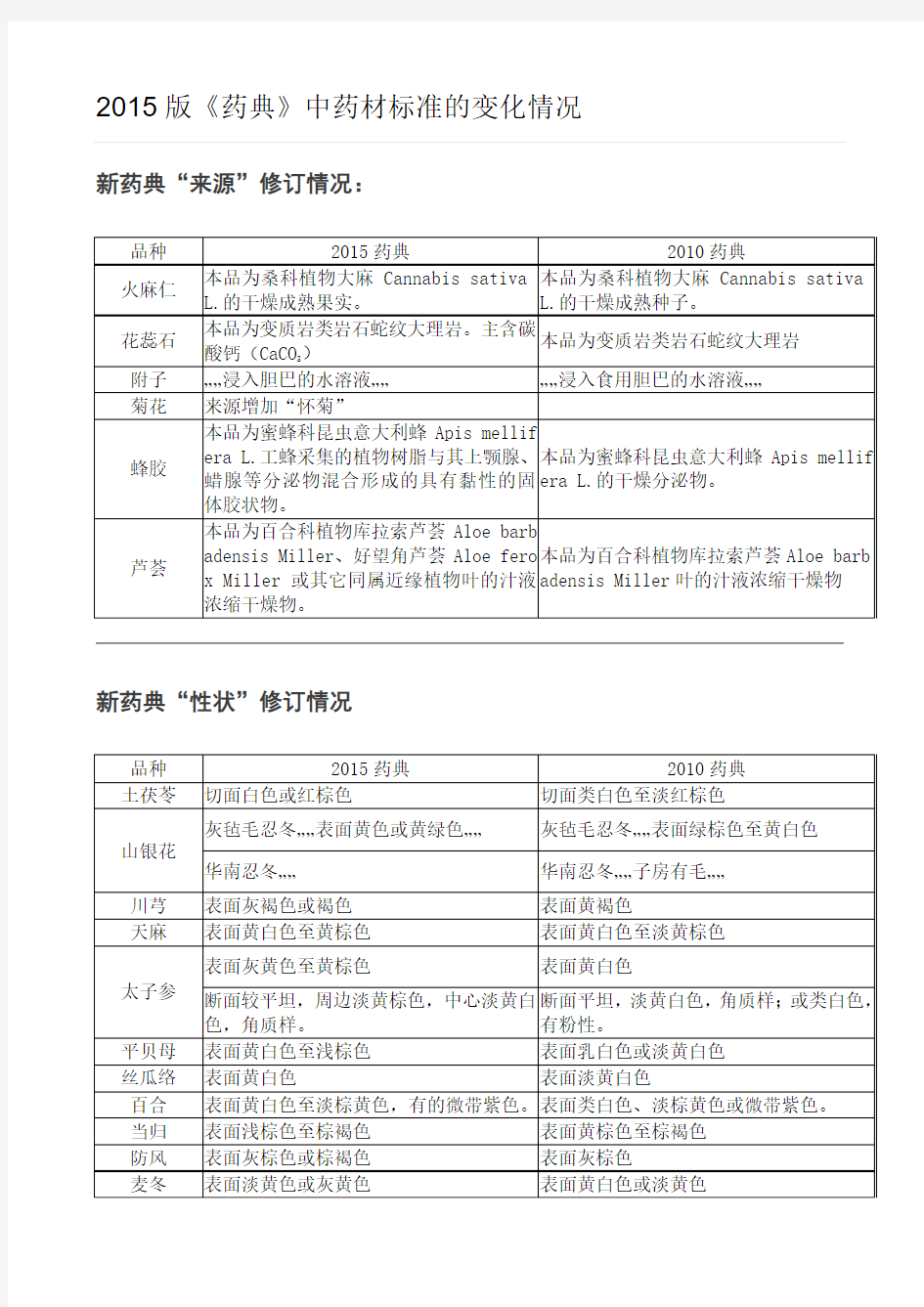
2015版《药典》中药材标准的变化情况新药典“来源”修订情况:
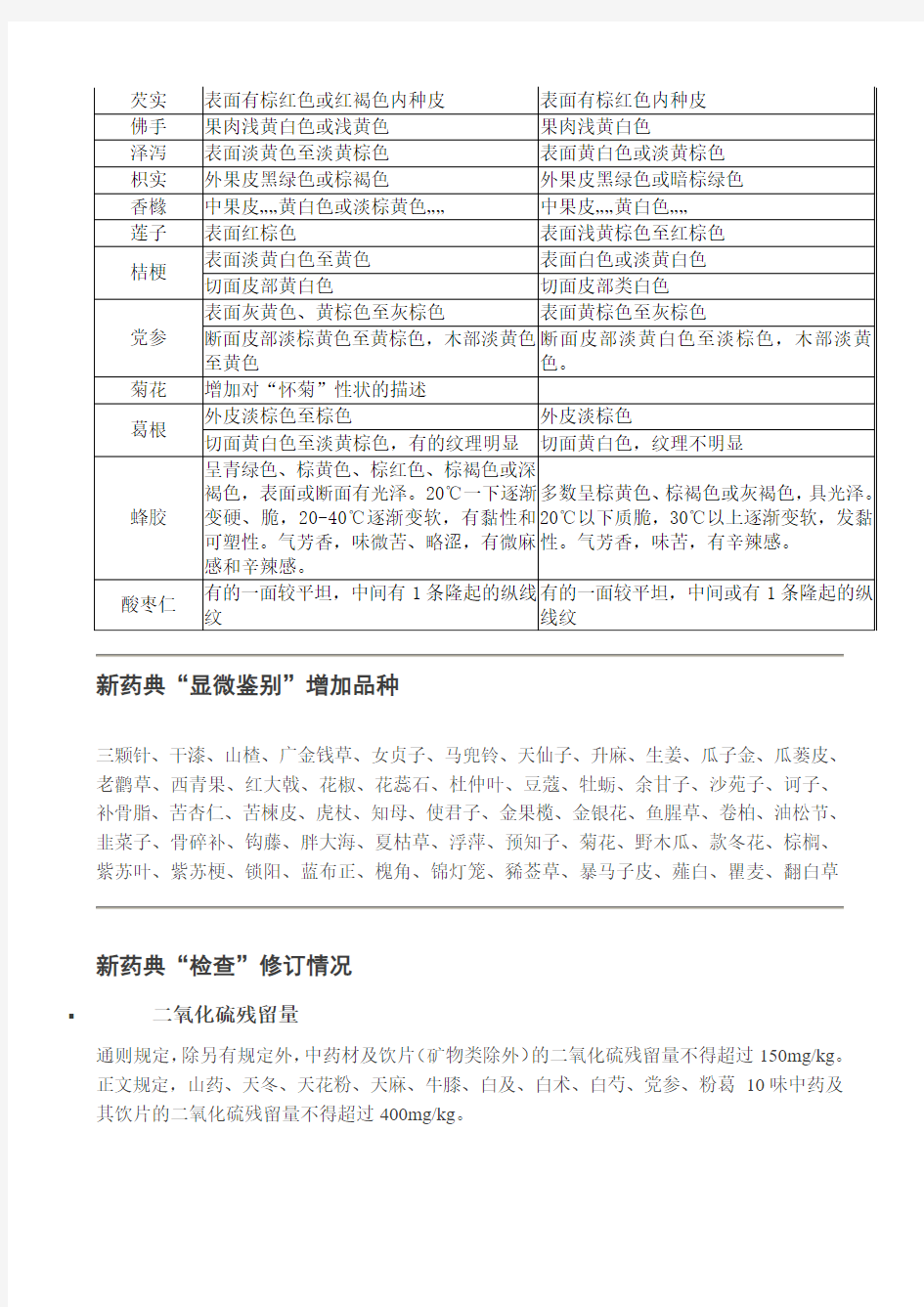
新药典“性状”修订情况
新药典“显微鉴别”增加品种
三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、豨莶草、暴马子皮、薤白、瞿麦、翻白草
新药典“检查”修订情况
二氧化硫残留量
通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
?农药残留量
注:
?总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过0.2mg/kg;?总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过0.2mg/kg;?五氯硝基苯不得过0.1mg/kg;
?六氯苯不得过0.1mg/kg;
?七氯(七氯、环氧七氯之和)不得过0.05mg/kg;
?艾氏剂不得过0.05mg/kg;
?氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
注注:
人参、西洋参为15版药典新增。
?黄曲霉毒素
?重金属及有害元素
10版药典原有重金属限量品种:
山楂、丹参、甘草、石膏、煅石膏、白芍、白矾、玄明粉、地龙、芒硝、西瓜霜、西洋参、冰片、龟甲胶、阿胶、金银花、枸杞子、黄芪、鹿角胶、滑石粉。
新药典“浸出物”变化情况
新药典“含量测定”变化情况
特别鸣谢:
中国食品药品鉴定研究院中药民族药鉴定所-- 研究员-- 鲁静老师
三七灰土回填技术交底和三七灰土回填质量要求
三七灰土回填技术交底和三七灰土回填质量要求 一、三七灰土回填: 1、三七灰土采用机械拌制,拌制前严格按照三七灰土击实试验控制素土含水率,以手紧握土料成团,两指轻捏能碎为宜。三七灰土回填时,同时进行灰土周边放坡范围内的素土回填,避免下雨时基坑积水浸泡三七灰土基础; 2、回填前,试验员应根据基坑平面布置图,并随时观察现场回填进度,报监理工程师见证取样; 3、在三七灰土回填时,必须严格按照施工方案规定灰土虚铺厚度,按每层250~300mm进行回填,分层碾压,碾压遍数不少于4遍,碾压搭接宽度不少于500mm;在进行第一层、第二层三七灰土回填时,压路机只能静压不得振动,以免扰动老土,并增加碾压遍数1~2遍;对基坑周边等压路机碾压不到的部位,使用人工打夯夯实,保证压实系数等符合要求;在灰土回填至垫层底还剩下2~3层时,应及时调整灰土的虚铺厚度,避免灰土顶层过薄(少于15cm),出现“两张皮”的现象,影响灰土粘结质量; 4、灰土回填前,每200㎡打一个木桩进行布点,控制三七灰土的虚铺厚度和碾压后的表面平整度检查; 5、每层回填完后,及时通知试验员进行取样检测合格后方可回填上一层,每层压实系数必须≥0.93;回填过程中,试验员严格按照“三七灰土回填检测方案”及“关于灰土回填检测方案的请示”进行取
样和整理资料;回填过程中,及时了解天气预报,一旦有降雨,应提前做好防雨、排水工作,用彩条布覆盖灰土; 6、本工程采用的三七灰土拌合机拌和原理为:电子计量土和熟石灰质量进行控制配合比,需根据石灰:素土=3:7的体积比将其换算为不同自然堆积密度的石灰和素土质量比进行控制,为能准确的控制三七灰土的拌和比例,需按照如下措施施工: ①土方分包队伍必须在每天拌和前用电子天平对素土和石灰进行密度的检测(测三组数据取平均值),然后根据检测的实际密度根据体积比换算为质量比进行控制,并将检测的密度和换算后的质量比进行挂牌施工,以便我方和监理单位对配比进行控制。 ② 试验员每天进行一次抽查现场素土和熟石灰的堆积密度,然后按照体积比根据检测的密度换算为质量比,并对控制室内质量比进行复核,若偏差≤2%以内将不做调整,偏差大于2%将进行调整,若偏差>2%,应对控制室进行调整,若一旦大于5%,应立即责令其停工,并上报项目部,项目部根据情节轻重进行处罚,并扣除少用的石灰量; ③ 质检员根据试验员检测密度换算的质量比进行配比监控,一旦有 随意调整配合比的立即责令其停工,并上报项目部,项目部根据情节轻重进行处罚,并扣除少用的石灰量; ④ 试验员应随时观察素土的土质变化情况,并根据土质变化而计时 的取样进行三七灰土击实试验,以准确的判定回填的压实系数;同时对素土含水率进行观察,一旦发现含水率过高或偏低,应采取一
2015年版中国药典
1、《中国药典》2015年修订情况介绍。 答:“中国药典”是国家为保证药品质量可控和人民群众用药安全有效而制定的药品法典。是药品开发、生产、经营、使用、管理的法律依据,是国家药品标准体系的核心。2015年版《中国药典》是新中国成立以来的第10版。2010年3月,第十届药典委员会成立,历时5年完成新版药典编制工作。编写期间,将修订后的药典内容全部在网上公示并征求意见,共收到网上反馈意见4000余条,远远超过前几版药典收到的反馈意见数量,体现了社会和公众对新版药典编写的关注度和参与度不断提高。 针对各种反馈意见,药典委员会各专业委员会逐一研究讨论,组织召开标准评审会700余次,向社会反馈意见。可以说,2015年版《中国药典》不仅凝聚了第十届药典委员会全体委员、广大专家学者、药品检验机构、科研院所、高校和药品生产企业的心血,更蕴含着社会公众的共同智慧。 2、2015年版药典实施细则。 答:新版《中国药典》于2015年12月1日起施行,新版《药典》每5年发布一次。自实施之日起,上市药品质量标准应符合2015年版《中国药典》品种质量标准。该品种已列入2015年版药典但未收录的质量标准,也应符合《中国药典总则》的相关要求。对于那些已提交注册、未获批准的品种,在批准时也要符合2015年版药典标准
的相关要求。 3、2015年版《中国药典》主要有哪些变化? 答:首先,收到的品种数量增加了27.4%。2015年版药典计划收录5800个品种,比2010年版药典增加1200多个品种,修订品种751个。 二是通过对《药典》总则、总则、总则的全面增补和修订,整体上进一步提高了对药品质量控制的要求,完善了《药典》标准的技术规定,使《药典》标准更加系统化、规范化。 三是完善了药品标准体系。 特别是药用辅料品种增加到260种,增加了相关指导原则;在归纳、验证、规范的基础上,实现了《中国药典》不同部分常用检测方法的协调统一。 四是2015年版药典附录(总则)和辅料独立卷成册,构成《中国药典》四个部分的主要内容。 五是药用辅料品种明显增加。计划新增128家,共计260家,增速高达97%。 六是安全治理工程大幅提升。 中医药:制定中草药、饮片二氧化硫残留限量标准,建立健全重金属和有害元素、黄曲霉毒素、农药残留等物质检测限量标准;加强中草药重金属和有毒有害物质管控。化学药品:有关物质加强杂质定性定量检测方法研究,实现已知杂质和未知杂质的差异化控制,优化抗生
2015年版中国药典四部凡例
总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药,二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。 本部为《中国药典》四部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。药典收载的凡例与通则对未载入本版药典但经国务院药品监督管理部门颁布的其他中药标准具同等效力。 三、凡例是正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则及与质量检定有关的共性问题的统一规定。 四、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 五、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 六、《中国药典》的英文名称为Pharmacopoeia of The People's Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为ChP。 七、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 正文 八、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音与英文名);(2)有机物的结构式; (3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称及编排 十一、正文收载的药品中文名称通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名称均为法定名称;本版药典收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。 有机药物的化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。 十二、药品化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。 十三、正文按药品中文名称笔画顺序排列,同笔画数的字按起笔笔形一丨丿丶乛的顺序排列;通则包括制剂通则、通用检测方法和指导原则,按分类编码;索引分按汉语拼音顺序排序的中文索引以及英文名和中文名
三七活血片质量标准研究
三七活血片质量标准研究 目的建立三七活血片的质量标准。方法采用薄层色谱法对制剂中的三七、血竭进行鉴别。采用高效液相色谱法测定赤芍中芍药苷的含量,色谱柱为Shim-pack(岛津)C18(150 mm×4.6 mm,5 μm),流动相为乙腈-0.3%磷酸水溶液(15.2∶84.8,V/V),检测波长为230 nm,柱温为30 ℃,流速为1.0 mL/min。结果三七、血竭的薄层色谱特征斑点分离清晰,阴性无干扰。芍药苷在0.269 6~1.348 μg范围内线性关系良好(r=0.999 8);供试品溶液在24 h内稳定,平均加样回收率为98.68%,RSD=0.78%(n=6)。结论本研究所建立的方法简单、准确可靠、重复性好,可用于控制三七活血片的质量。 Abstract:Objective To establish the quality standard for Sanqi Huoxue Tablets. Methods Notoginseng Radix et Rhizoma and Draconis Sanguis in Sanqi Huoxue Tablets were identified by TLC qualitatively;The content of paeoniflorin in Paeoniae Radix Rubra was determined by HPLC. The separation was performed on Shim-pack-C18 column (150 mm×4.6 mm,5 μm)with mobile phase consisted of acetonitrile-0.3% phosphoric acid (15.2:84.8,V/V)at the flow rate of 1.0 mL/min. The detection wavelength was set at 230 nm,and the column temperature was 30 ℃. Results Notoginseng Radix et Rhizoma and Draconis Sanguis in Sanqi Huoxue Tablets could be identified by TLC and separated well. Paeoniflorin was in a good linear relationship between 0.269 6–1.348 μg,with a correlation coefficient of 0.999 8. Solution was stable within 24 h,and the average recovery of paeoniflorin was 98.68%,RSD=0.78%. Conclusion The established method is simple,accurate and sensitive,and can be applied to the quality control of Sanqi Huoxue Tablets. Key words:Sanqi Huoxue Tablets;quality standard;Notoginseng Radix et Rhizoma;Draconis Sanguis;TLC;HPLC;paeoniflorin 三七活血片是在吉林省中医院院内制剂三七活血胶囊基础上确定的实验方剂,由三七、赤芍、血竭、骨碎补等7味中药组成,具有活血止血、散瘀止痛等作用,用于急性软组织损伤等症临床疗效显著,药理 实验表明该制剂在减轻损伤组织,促进血肿吸收和瘀斑消散等方面作用确切[1]。为有效控制三七活血片的质量,保证用药安全有效,本研究建立三七活血片的质量控制方法。采用薄层色谱法,以三七的主要功效成分人参皂苷Rg1、Rb1及三七皂苷R1为对照,对方中三七进行定性鉴别。为增加方法的专属性及信息的全面性,以血竭特征性成分血竭素高氯酸盐及血竭对 照药材为对照,对方中血竭进行定性鉴别。处方中赤芍用量最大且为主要药味,故采用高效液相色谱法(HPLC)对其镇痛抗炎的有效成分芍药苷进行含量测定,并进行方法学验证。 1 仪器与试药
三七分等规格2020版云南省地方标准
DB53/T 055.1—2020 三七分等规格 1 范围 本标准规定了三七的术语和定义、分等规格、质量要求、检测方法、检验规程、包装、储存和运输。 本标准适用于三七的分等。 2 规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 ISO/1575 茶叶中灰分含量测定 ISO/1577 茶叶中酸不溶性灰分含量测定 ISO/18664 中医药 中药材重金属限量 ISO/20409 中医药 三七药材 GB 2763 食品安全国家标准 食品中农药最大残留限量 GB 5009.3 食品安全国家标准 食品中水分的测定 3 术语和定义 下列术语和定义适用于本文件。 3.1 三七(Notoginseng) 五加科人参属植物三七Panax notoginseng(Burk.)F. H. Chen根及根茎的干燥品。 3.2 主根(Tap root) 种植三年及三年以上三七的主根。 3.3 剪口(Rhizome ) 根茎的俗称,连接三七茎和主根的部位。 3.4 筋条(Branch root) 中部直径大于0.4cm支根的俗称。 1
DB53/T 055.1—2020 3.5 醇溶性浸出物(ethanol-soluble extractives) 采用70%甲醇作溶剂,按照中华人民共和国药典规定的方法,测定得到的浸出物含量。 3.6 头数(Tou) 指经干燥后,每500 g三七主根所含有的三七主根个数。 3.7 春三七(Chuen root of Notoginseng) 摘除花蕾后采收的三七主根。 3.8 冬三七(Dong root of Notoginseng) 留种后采收的三七主根。 3.9 菊花心 (radial striations) 三七主根断面维管束与较窄的射线相间排列,形似菊花。 3.10 批次(Batch) 同一时间同一地点采收的少于5000 kg的三七为一批。 4 质量要求 4.1 外形特征 三七具有以下特征,外形参见附录A: a)主根分为“疙瘩七”和“萝卜七”两种,“疙瘩七”呈类圆锥形或不规则球形;“萝卜七”呈长形,似 萝卜状; b)表面灰黄色或灰棕色,有断续的纵皱纹和支根痕,顶端有茎痕,周围有瘤状突起,质坚实; c)断面灰绿色、黄绿色,木质部微呈放射状排列; d)春三七外形饱满、表面皱纹细密而短或不明显,断面常呈黄绿色,木质部菊花心明显,无空隙; e)冬三七外形不饱满、表面皱纹多且深长或呈明显的沟槽状。断面常呈灰绿色、木质部菊花心不 明显,多有空隙。 4.2 显微特征 4.2.1 主根显微鉴别 按以下特征进行主根显微鉴别,参见附录B: a)三七主根横切面可见落皮层少数残留,木栓层为数列排列整齐的扁平细胞,栓内层极窄; b)韧皮部宽厚,内侧韧皮束明显,韧皮射线宽广,向外不甚明显; 2
《中国药典》2015年版 第一部 14
该版药典中现代分析技术得到进一步扩大应用,除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用;药品的安全性保障得到进一步加强,除在凡例和附录中加强安全性检查总体要求外,在品种正文标准中增加或完善安全性检查项目;对药品质量可控性、有效性的技术保障得到进一步提升,除在附录中新增和修订相关的检查方法和指导原则外,在品种正文标准中增加或完善有效性检查项目;为适应药品监督管理的需要,制剂通则中新增了药用辅料总体要求;积极引人了国际协调组织在药品杂质控制、无菌检查法等方面的要求和限度。此外,该版药典也体现了对野生资源保护与中药可持续发展的理念,不再收载濒危野生药材。 第九届药典委员会还完成了《中国药典》2005年版增补本、《药品红外光谱集》(第四卷)、《临床用药须知》(中药材和饮片第一版、中成药第二版、化学药第五版)、《中药材显微鉴别彩色图鉴》及《中药材薄 层色谱彩色图集》(第一册、第二册)的编制工作。 2015年版(第十版)2010年12月国家食品药品监督管理局(2013年3月22日更名为国家食品药品监督管理总局)组建第十届药典委员会。本届药典委员遴选工作按照新修订的《新增委员遴选办法》和《第十届药典委员会委员遴选工作方案》,向全社会公开征集新增委员候选人,并采取差额选举、无记名投票的方式选举新增委员。本届委员会共有委员351名,其中续聘委员248名,新增委员103名。时任第十一届全国人大常委会副委员长桑国卫任名誉主任委员,时任卫生部部长陈竺任主任委员,时任卫生部副部长、国家药品监督管理局局长邵明立任常务副主任委员。本届委员会下设执行委员会和23个专业委员会。执行委员会委员共计67名,其中院士委员28名、资深专家3名、各专业委员会主任20名、相关部委专家4名、总局相关技术单位负责人7名。根据药典标准工作需要,本届委员会以第九届药典委员会专业委员会设置为基础,对专业委员会的设立进行了适当调整;为加强化学药标准的制定工作,增设了化学药品第三专业委员会,扩大化学药委员的人数;同时,根据实际工作需要,取消政策与发展委员会、标准信息工作委员会和注射剂工作委员会。 2010年12月第十届药典委员会成立暨全体委员大会召开。会议审议通过了“《中国药典》2015年版编制大纲”,编制大纲明确了《中国药典》2015年版编制工作的指导思想、基本原则、发展目标和主要任务。 按照《国家药品安全“十二五”规划》的要求,国家药典委员会以实施“国家药品标准提高行动计划”为基础,组织各专业委员会和相关机构开展药典编制工作。药典委员会常设机构首次将I S O 9001质量管理体系引入药典编制的全过程管理,按照规范的“中国药典编制工作程序”开展品种遴选、课题立项、试验研究、标准起草、复核和审定等各项工作,稳步推进本版药典编制工作。2015年2月4日《中国药典》2015年版经第十届药典委员会执行委员会全体会议审议通过,于2015年6月5日经国家食品药品监督管理总局批准颁布,自2015年12月1日起实施。 本版药典进一步扩大药品品种的收载和修订,共收载品种5608种。一部收载品种2598种,其中新增品种440种、修订品种517种、不收载品种7种。二部收载品种2603种,其中新增品种492种、修订品种415种、不收载品种28种。三部收载品种137种,其中新增品种13种、修订品种105种、新增生物制品通则1个、新增生物制品总论3个、不收载品种6种。本版药典首次将上版药典附录整合为通则,并与药用辅料单独成卷作为《中国药典》四部。四部收载通则总数317个,其中制剂通则38个、检测方法240个(新增27个)、指导原则30个(新增15个)、标准品、标准物质及试液试药相关通则9个。药用辅料收载270种,其中新增137种、修订97种、不收载2种。 本版药典完善了药典标准体系的建设,整体提升质量控制的要求,进一步扩大了先进、成熟检测技术的应用,药用辅料的收载品种大幅增加,质量要求和安全性控制更加严格,使《中国药典》的引领作用和技术导向作用进一步体现。 在编制本版药典的过程中,还完成了《中国药典》2010年版第一、二、三增补本,《红外光谱集》(第五卷),《中国药品通用名称》,《国家药品标准工作手册》(第四版),《中国药典注释》的编制和修订工作,组织开展了《中国药典》2015年版英文版、《临床用药须知》2015年版的编制工作。
浅谈2015年版中国药典的变更年版中国药典的变更
浅谈2015年版中国药典的变更 1.基本情况: 1950年1月卫生部成立第一届国家药典委员会,组成8个专家的小组团队,展开中国药典的编制,亦是我国最早的标准化机构。第一部<中国药典>1953年版由卫生部编印发行。至今已组建十屇药典委员会,并经已编制共九版中国药典(英文名称为Pharmacopoeia of The People’s Republic of China; 英文简称为Chinese Pharmacopoeia; 英文缩写为Ch.P.)。中国药典是为保证药品产量、保障人民群众用药安全、有效、稳定、质量可控的技术法典,亦是药品研究、生产、经营、使用和监管的法定依据。 作为国家药品标准体系的核心及对外的竞争 力,药典收载范围遂步扩大,由1953年(第 一版)共531品种增加至现有的2010版(第九 版)共4567种(包括有中药: 2165种(一部),化 学药: 2271种(二部)及生物药制品: 131种(三 部)),当中涵盖了中药材、中药饮片、中药 饮片、中成药、生物制品、药用辅料、凡例、 通则及附录等等。 国家药品标准 国家药品标准是由凡例与正文及其引用的附录共同构成。并且对药典以外的其他国家标准具同等效力。由此可见,药典是国家对药品监控及为企业建立质量体系的重要手段。 药典的法律地位: 依照《药品管理法》规定: 药品必须符合国家药品标准。。” “药品必须符合国家药品标准 管理部门颁布的药典和药品标准为国家药品标准。。” “国务院药品监 国务院药品监督督管理部门颁布的药典和药品标准为国家药品标准 2.基本结构: 凡例: 为正确使用<中国药典>进行药品质控的基本原则,是对正文、附录及与质量检定有关的共性问题的统一规定。 正文: 各品种项下收载的内容统称正文,是根据药物自身的理化与生物学特性,按照批准的来源、处方、制法、和运输、贮藏等条件所制定的、用以检测药品是否达到用药要求,并衡量其质量是否稳定均一的技术规定。
三七质量标准
1 ABC有限责任公司-质量标准三七质量标准 目的:建立公司原药材内控质量标准,控制药材质量,保证成品质量。 责任人:文件制订人及所有相关人员。 内容: 本品为五加科植物三七Panax notoginseng(Burk.)F.H.Chen的干燥根和根茎,秋季花开前采挖,洗净,分开主根、支根及根茎,干燥。支根习称“筋条”,根茎习称“剪口”。 【性状】主根呈类圆锥形或圆柱形,长1~6cm,直径1~4cm。表面灰褐色或灰黄色,有断续的纵皱纹和支根痕。顶端有茎痕,周围有瘤状突起。体重,质坚实,断面灰绿色、黄绿色或灰白色,木部微呈放射状排列。气微,味苦回甜。 筋条呈圆柱形或圆锥形,长2~6cm,上端直径约0.8cm,下端直径约0.3cm。 剪口呈不规则的皱缩块状或条状,表面有数个明显的茎痕及环纹,断面中心灰绿色或白色,边缘深绿色或灰色。 【鉴别】(1)本品粉末灰黄色。淀粉粒甚多,单粒圆形、半圆形或圆多角形,直径4~30μm;复粒由2~10余分粒组成。树脂道碎片含黄色分泌物。梯纹导管、网纹导管及螺纹导管直径15~55μm,草酸钙簇晶少见,直径50~80μm。 (2)取本品粉末0.5g,加水5滴,搅匀,再加以水饱和的正丁醇5m l ,密塞,振摇约10分钟,放置2小时,离心,取上清液,加3倍量以正丁醇饱和的水,摇匀,放置使分层(必要时离心),取正丁醇层,蒸干,残渣加甲醇1ml使溶解,作为供试 品溶液。另取人参皂苷Rb 1对照品、人参皂苷Re对照品、人参皂苷Rg 1 对照品及三七 皂苷R 1 对照品,加甲醇制成每1ml各含0.5mg的混合溶液,作为对照品溶液。照薄层色谱法(附录Ⅵ B)试验,吸取上述两种溶液各1μl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-水(15:40:22:10)10℃以下放置的下层溶液为展开剂,展开,取出,晾干,喷以硫酸溶液(1→10),于105℃加热至斑点显色清晰。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;置紫外光灯(365nm)下检视,显相同的荧光斑点。
如何选择优质文山三七
如何选择三七质量最好? 选择好质量三七的四大标准依据: 一、三七按照规格分为: 15头、20头、30头、40头、60头、80头、120头、160头、200头、无数头、筋条、剪口等12个等级。首先我们先搞清楚“头”的意思。例如:“20头”是指每500克 三七的个数不超过20个三七。也可理解为20头三七就是20个三七。“30头”三七 指每500克三七的个数不超过30个三七。以次类推,三七的个数越少,个头越大,品质越好,价格也越贵,反之则越便宜(如图一)。 备注:三七超过60头以上药用价值就比较低了,所以不建议买60头以上的三七。 二、三七按照外形分为: (一)、团七(俗称狮子头三七和猴头三七)和萝卜三七(长三七) 1、狮子头三七(团七):表面有很多疙瘩,看着就像是雕刻的雄狮头一样,所以叫狮子头。 2、萝卜头三七:三七表面没有那么多的疙瘩,一头大,一头小,相对来说比较光滑,形状很像萝卜,所以叫萝卜七,也叫长七。 备注:团七和萝卜七只是外形不一样,只要头数相同,品质是一样的。 (二)、滑头三七和剪口三七(带帽三七) 1、滑头三七:没有带三七剪口的三七头,称为“滑头三七“ 2、剪口三七(带帽三七):带有三七剪口的三七头,称为“带帽三七”。也就是说剪口是三七主根与茎连接的那一小部分。 备注:剪口这一部分对于人的身体是很难吸收的,所以,滑头三七市场上实际的价格 要比剪口三七贵。 三、按采挖的时间分为:春三七和冬三七 外行的理解可能就是“春三七”就是春天采挖的三七,“冬三七”就是冬天采挖的三七。 这样想就大错特错!“春三七”和“冬三七”的区别在于是否留过红籽
(一)、春三七是指:未留红籽(三七种子)的三年生三七,一般于每年9—11月采挖的三七称为春三七。(并不是春天挖的三七) 春三七的特点: 1、体格:颗粒大而且圆,饱满健壮 2、外貌:细纹紧密无裂缝 3、内在:坚实不空泡 4、品质:优良 (二)、冬三七是指留过红籽的三年生三七,一般于每年1—2月采挖的三七称为冬三七。(并不是冬天挖的三七) 冬三七特点: 1、体格:干瘪瘦小 2、外貌:皱缩不饱满 3、内在:稀疏松泡 4、品质:较差。 四、按照种植的土壤分为: 红土三七、黄土三七、黑土三七、灰土三七等。 不同土壤种植的三七颜色也不一样,三七品质也有差异,其中以红土种植的三七品质最佳。 综合以上三七的分类,购买优质三七的四大标准是: 一、选春三七, 二、选滑头三七, 三、红土三七, 四、三七的头数。 温馨提醒:市面上很多标榜4年、5年、甚至6年生的三七,基本都是假的。 三七一般都是种植三年就采挖,基本没有种植超过三年的。 (因为:一是种植年限越长三七生病的概率越大,产量就越少, 二是种植三七的成本很高,种植三七的土地不能轮种,种过一次后最少要隔至少10年以上才能再种植)
2015版药典凡例中药饮片的规定
2015版药典凡例中药饮片的规定 199个病例的内容为256±199±7。中国药典的英文名称是“中华人民共和国药典”。英文缩写是中国药典;英文缩写是c h p。 11、药材和饮片的名称包括中文名称、汉语拼音和拉丁名称,其中药材和饮片的拉丁名称按属名或属名+专称排序,药用部分次之。植物油和提取物、配方制剂和单一成分制剂的名称没有拉丁文名称。12、未列入正文的饮片及其炮制项目,其名称与药材名称相同,正文与药材饮片标准相同;正文中的饮片炮制项目是干净的、切块的,饮片名称或相关项目也与药材名称或相关项目相同。 13、机体分为三部分:药材和饮片、植物油和提取物、处方制剂和单味制剂 饮片是指经加工后可直接用于中药临床或制剂生产的处方药 饮片一般列在药材正文中,但需单独列名的除外。先列出药材项,后列出饮片项,中间用“饮片”隔开。与药材相同的内容只列出项目名称,要求用“相同药材”表示。与药材的含量不同,其含量是逐项列出的,并规定了相应的指标。为减少篇幅,上述安排仍应视药材和饮片为两个独立的品种。 + 5,单排饮片标准,源项一般描述为“本品经X X加工处理”,并增加“[制剂方法”项,收集相应的加工工艺,其余与药材及饮片标准相同。 16。药材和饮片的质量标准一般根据干品制定。如果需要新鲜产品,还应制定新鲜产品的质量控制指标,并规定新鲜产品的用途和用量。
17、原植物(动物)药材的科名、植物(动物)名、拉丁文学名、药用部位(矿物药注明类、族、矿名或岩名、主要成分)和采收季节及产地加工均属于药材的来源类别。 药材的科名和拉丁学名主要来源于《中国植物志》和《高等植物志》等。 药用部分一般指已除去非药用部分的商品药材药用部分,收获(挖掘等。)和加工系统的原产地 18。产地药材加工加工规定的干燥方法如下:①干燥、晒干、阴干均可,采用“干燥”;(2)如果不适合在较高温度下干燥,使用“日光干燥”或“低温干燥”(一般不超过60℃);(3)干燥和晒干不合适,使用“阴干”或“风干”;(4)如果少数药材需要短时间干燥,使用“暴晒”或“及时干燥” 19、同名药材有多种来源,其特征有明显差异分别描述首先,我们将集中讨论一种类型,其他类型将只描述它们的差异。品种名称单独书写,一般采用传统药材名称。没有通用名称的,应当采用植物(动物)的中文名称。《通则》 0 2 1 1《药材及饮片抽样方法》 《药材及饮片抽样方法》的内容是指对药材或饮片进行检验的抽样方法取样应符合下列有关规定 、取样前,应检查名称、产地、规格等级和包装样式,检查包装的完整性、清洁度和无水痕迹、霉变或其他材料污染等。,详细记录所有异常情况的包装应单独检查和拍照。二、从同一批药材和饮片的包
2015年版中国药典
中华人民共和国药典: 《中国药典》分为四部出版:一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等;二部收载化学药品、抗生素、生化药品以及放射性药品等;三部收载生物制品。 《中华人民共和国药典》2015年版,药典包括凡例、正文及通则,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。所有国家药品标准应当符合中国药典凡例及附录的相关要求。 新版药典进一步扩大药品品种的收载和修订,共收载品种5608种。一部收载品种2598种,其中新增品种440种。二部收载品种2603种,其中新增品种492种。三部收载品种137种,其中新增品种13种、修订品种105种。首次将上版药典附录整合为通则,并与药用辅料单独成卷作为新版药典四部。四部收载通则总数317个,其中制剂通则38个、检测方法240个、指导原则30个、标准物质和对照品相关通则9个;药用辅料收载270种,其中新增137种、修订97种。 1949年10月1日中华人民共和国成立后,党和政府十分关怀人民的医药卫生保健工作,当年11月卫生部召集在京有关医药专家研讨编纂药典问题。1950年1月卫生部从上海调药学专家孟目的教授负责组建中国药典编纂委员会和处理日常工作的干事会,筹划编制新中国药典。 1950年4月在上海召开药典工作座谈会,讨论药典的收载品种原则和建议收载的品种,并根据卫生部指示,提出新中国药典要结合
国情,编出一部具有民族化、科学化、大众化的药典。随后,卫生部聘请药典委员49人,分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,另聘请通讯委员35人,成立了第一届中国药典编纂委员会。卫生部部长李德全任主任委员。 1951年4月24日至28日在北京召开第一届中国药典编纂委员会第一次全体会议,会议对药典的名称、收载品种、专用名词、度量衡问题以及格式排列等作出决定。干事会根据全会讨论的意见,对药典草案进行修订,草案于1952年底报卫生部核转政务院文教委员会批准后,第一部《中国药典》1953年版由卫生部编印发行。 1953年,版药典共收载药品531种,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。药典出版后,于1957年出版《中国药典》1953年版第一增补本。 1955年,卫生部成立第二届药典委员会,聘请委员49人,通讯委员68人,但这届委员会因故未能进行工作。1957年成立第三届药典委员会,聘请委员80人,药学专家汤腾汉教授为这届委员会主任委员(不设通讯委员),同年7月28日至8月5日在北京召开第一次全体委员会议,卫生部李德全部长作了药典工作报告,特别指出第一版中国药典没有收载广大人民习用的中药,是个很大的缺陷。会议在总结工作的基础上,通过了制订药典的原则,讨论了药典的性质和作用,并修改了委员会章程,会议一致认为应把合乎条件的中药收载到药典中。8月27日卫生部批准委员会分设药理与医学、化学
2015版药典中药材标准的变化讲解
新药典变化概述: 1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。 3.完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。 4.制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。 5.中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。 6.不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。 新药典增减药材情况:
删除:紫河车 新药典“来源”修订情况: 品种2015药典2010药典 火麻仁本品为桑科植物大麻Cannabis sativa L.的干燥成熟果实。本品为桑科植物大麻Cannabis sativa L.的干燥成熟种子。 花蕊石本品为变质岩类岩石蛇纹大理岩。主含碳酸钙(CaCO3)本品为变质岩类岩石蛇纹大理岩 附子……浸入胆巴的水溶液…………浸入食用胆巴的水溶液…… 菊花来源增加“怀菊” 蜂胶本品为蜜蜂科昆虫意大利蜂Apis mellifera L.工蜂采集的植物树脂 与其上颚腺、蜡腺等分泌物混合形成的具有黏性的固体胶状物。 本品为蜜蜂科昆虫意大利蜂Apis mellifera L.的干燥分泌物。 芦荟本品为百合科植物库拉索芦荟Aloe barbadensis Miller、好望角芦荟 Aloe ferox Miller或其它同属近缘植物叶的汁液浓缩干燥物。 本品为百合科植物库拉索芦荟Aloe barbadensis Miller叶的汁液 浓缩干燥物 新药典“性状”修订情况
土三七
土三七的质量标准 【拼音名】Tǔ Sān Qī 【拉丁名】Gynura segetum (Lour.) Merr. 【英文名】Herb of Chrysanthemum-like Groundsel 【别名】见肿消、乳香草、奶草、泽兰、叶下红、散血草、和血丹、天青地红、破血丹、血牡丹、三七草、九头狮子草、白田七草、血当归、红背三七、散血丹、血三七、菊叶三七、水三七、紫背三七、狗头三七 【来源】 药材基源:为菊科植物菊叶三七的根或全草。 拉丁植物动物矿物名:Gynura segetum (Lour.) Merr. [G. japonica (Thunb.) Juel.; G.piniatifula (L.) DC.] 采收和储藏:7-8月间生长茂盛时采,或随用随采。 【原形态】菊叶三七多年生草,高达1m左右。宿根肉质肥大,土褐色,具疣状突起及须根,断面灰黄白色。茎直立,具纵棱,绿色略带紫色,上部多分枝,光滑无毛或稍具细毛。基生叶簇生,匙形,边缘锯齿或作羽大辩论分裂,花时凋落;茎下部和中部叶互生,长椭圆形,长10-25cm,宽5-10cm,羽状分裂,裂片卵形以至披针形,边缘浅裂或有疏锯齿,两面近光滑或具细毛,先端短尖或渐尖,基部具2-5浅裂的假托叶2枚;茎上部叶渐小,卵状披针形,边缘羽状齿裂,或有线状披针形。头状花序直径1.5-2cm,排列成伞房状,着生于枝顶;总苞圆柱状;总苞片2层,条状披针形,长约1.5cm,边缘膜质,外层丝状;花全为两性,筒状,金黄色,花冠先端5齿裂,花柱基产小球形,分枝先端有细长浅形具毛的尖端,长约4mm。瘦果狭圆柱形,有条纹,被疏毛;冠毛丰富,白色。花期9-10月。 【生境分布】 生态环境:生于沟边及屋舍旁肥厚湿润的土壤中。 资源分布:分布于河北、陕西、江苏、安徽、浙江、江西、台湾、湖北、湖南、广东、广西、四川、贵州及云南等地。全国大部分地区有栽培。 【栽培】 生物学特性喜湿润和荫蔽环境。以羽松肥沃的砂质壤土最好。 栽培技术用根茎繁殖或托插繁殖。①根茎繁殖:每年4月栽种。先将根茎切开,每块留芽个2-3个。切时应使芽和切口保持4-7mm距离。按沟距30-45cm开沟,然后按株距15cm排放在沟内,芽尖向上,覆土3-5cm。②扦插繁殖:6-7月高温多湿季节,剪取长15-20cm茎枝,斜插于沙土中,土面留出4cm左右,插后需经常保持土壤湿润,如气温在22-33℃范围,约15d即可生根成活,成活后约15d 可移植。行、株距与根茎繁殖法同。 田间管理除注意松土和除草外,雨季要及时排水,以免根部腐烂,影响植株生长。6月中旬每1hm2施人畜粪水300-450担。
2015年版中国药典
中华人民共和国药典(以下简称《中国药典》)是中国药典出版社于2015年6月5日出版的,由国家药典委员会编撰。 中国药典分为四个部分:一个包含药材和煎剂,植物油和提取物,调配制剂和单一风味制剂;第二种是化学品,抗生素,生化药物和放射性药物;第三部分包含生物制品。一般原则有四个,包括制剂的一般原则,测试方法,指导原则,参考物质和测试溶液的相关一般原则,药物赋形剂等。 2020年7月2日,国家药品监督管理局和国家卫生局发布公告,正式颁布了2020年版的《中华人民共和国药典》。新版《中国药典》将于2020年12月30日正式实施。 中华人民共和国药典(以下简称“中国药典”)2015年版,该药典包括一般示例,文本和一般原则(该版本的药典结合了各种药典的常用附录,并重命名了原始附录一般原则[3]),这是药物开发,生产,销售,使用,监督和管理的法律依据。所有国家药品标准均应符合中国药典的有关要求。
新版《药典》进一步扩大了药品品种的收集和修订范围,包括5608种药品。收集了2598个品种,并添加了440个新品种。第二部分有2603个品种,其中492个新品种。三部分共收集到137个品种,包括13个新品种和105个修订品种。首次将上一版《药典》的附录纳入一般原则,并与新药典的第四部分一起,将药物赋形剂分成册。四个部分共收集了317项通用原则,其中包括38项通用制备原则,240项检测方法,30项指导原则和9项相关的参考材料和参考材料通用规则。收集了270种药用辅料,其中新添加的137种和修订的97种。 本版《药典》是中国药品质量保证规范,以科学,先进,规范和权威为基础,着眼于解决制约药品质量和安全的突出问题,并努力提高药品标准的质量控制水平,充分利用世界先进技术和经验,客观地反映出中国目前制药行业的水平,临床用药和检测技术。它在提高药品质量的过程中将发挥积极而重要的作用,并将进一步扩大和增强中国药典在世界范围内的积极影响。
三七灰土回填标准工艺模板
1 适用范围 本工艺标准适用于工业与民用建筑室内地坪、室外散水坡的灰土垫层工程;地基处理时,可参照本标准执行。 2 施工准备 2.1 技术准备 2.1.1 进行技术复核,基(土)层标高、管道敷设符合设计要求,并经验收合格。 2.1.2 施工前应有施工方案,有详细的技术交底,并交至施工操作人员。 2.1.3 各种进场原材料规格、品种、材料等符合设计要求,进场后进行相应验收,并有相应施工配比通知单。 2.1.4 通过压实试验确定垫层每层需铺厚度和压实遍数。 2.2 材料准备 2.2.1 土料 宜优先选用黏土、粉质黏土或粉土,不得含有有机杂物,使用前应先过筛,其粒径不大于15mm。 2.2.2 石灰 石灰应用块灰,使用前应充分熟化过筛,不得含有粒径大于5mm的生石灰块,也不得含有过多的水分。也可采用磨细生石灰,或用粉煤灰、电石渣代替。 2.3 机具准备 使用的主要机具:有蛙式打夯机、机动翻斗车、手扶式振动压路机、筛子(孔径6~10mm和16~20mm两种)、标准斗、靠尺、铁耙、铁锹、水桶、喷壶、手推胶轮车等。 2.4 作业务件及人员准备 2.4.1 基土表面干净、无积水,已检验合格并办理隐检手续。 2.4.2 基础墙体、垫层内暗管埋设完毕,并按设计要求予以稳固,检查合格,并办理中间交接验收手续。 2.4.3 在室内墙面已弹好控制地面垫层标高和排水坡度的水平控制线或标志。 2.4.4 施工机具设备已备齐,经维修试用,可满足施工要求,水、电已接通。
2.4.5 技术人员应熟悉图纸及技术要求,向相关人员进行技术交底,操作人员应经培训上岗。 3工艺流程 3.1 基本规定 3.1.1 在垫层工程施工时,应严格参照本施工技术标准。 3.1.2 垫层材料应按设计要求和《建筑地面工程施工质量验收规范》(GB 50209—2002)的规定选用,并应符合国家标准的规定;使用前,应报监理验收,合格后方准使用。 3.1.3 垫层工程所采用拌合料的配合比应按设计要求确定。 3.1.4 垫层下的沟槽、暗管等工程完工后,经检验合格并做隐蔽记录,方可进行灰土垫层工程的施工。 3.1.5 垫层的铺设,应待其下一层检验合格后方可施工上一层。铺设前与相关专业的分部(子分部)工程、分项工程以及设备管道安装工程之间,应进行交接检验。 3.1.6 室外散水、明沟、踏步、台阶和坡道等附属工程,均应符合设计要求。施工时应按《建筑地面工程施工质量验收规范》(GB 50209—2002)基层铺设中基土和相应垫层的规定执行。 3.1.7 建筑地面的变形缝应按设计要求设置,并应符合下列规定: (1)建筑地面的沉降缝、伸缩缝和防震缝,应与结构相应缝的位置一致,且应贯通建筑地面的垫层; (2)沉降缝和防震缝的宽度应符合设计要求,缝内清理干净,以柔性密封材料填嵌后用板封盖,并应与面层齐平。 3.1.8 垫层工程施工质量的检验,应符合下列规定: (1)垫层的施工质量验收应按每个施工段(或变形缝)作为检验批。 (2)每检验批应以基层的分项工程按自然间(或标准间)检验,抽查数量应随机检验自然间的10%且不应少于3间;不足3间,应全数检查;其中走廊(过道)应以10延长米为1间,工业厂房(按单跨计)、礼堂、门厅应以两个轴线为1间计算。 3.1.9 垫层工程的施工质量检验的主控项目,必须达到本标准规定的质量标准,认定为合格;一般项目80%以上的检查点(处)符合规范规定的质量要求,其他检查点(处)不得有明显影响使用,并不得大于允许偏差值的50%为合格。
《中国药典》2015年版实施通告有关问题的解读(一)
《中国药典》2015年版实施公告 有关问题的解读(一) 1. 问:国家食品药品监督管理总局关于实施《中华人民共和国 药典》2015年版(以下简称“2015年版药典”)有关事宜的公告(以下简称“公告”)(2015年第105号)中规定,为符合2015年版药典而需进行补充申请的,应在2015年 12月1日前进行申报,2015年12月1日后是否仍可提交相应补充申请? 答:对2015年版药典发布前已上市药品,生产企业应在2015年12月1日前完成原标准与新版药典相关要求的研究和比对,并应按公告要求进行相应的备案或补充申报。2015年12月1日以后仍可以提交相应补充申请。 2. 问:企业的注册标准已经对2010年版药典相关品种进行评估 的,且2010年版与2015年版药典品种质量标准和检测方法无变化的,是否需要重新对产品进行评估? 答:虽然品种正文内容与2015年版药典品种规定无变化,但由于2015年版药典通用性要求,包括凡例、通则、制剂通则以及通用性检验方法等进行了全面的增修订,因此,生产企业仍需针对2015年版药典通用性要求方面对本产品进行相应的评估。 3. 问:关于药品执行标准的表述方式的问题
答:对于注册标准不低于《中国药典》项目的制品,执行注册标准,其执行标准表示方式为:“执行药品注册标准且符合《中国药典》2015年版要求”。 4. 问:对于进口药品生产企业,能否使用注册代理公司出具的 说明信来代替国外的声明信,进行备案或补充申请的申报?答:原则上注册代理公司应出具持证商的声明信。如使用说明信代替国外的声明信,应同时提供进口药品生产企业出具的委托注册代理公司办理该事项的委托书。 5. 问:国家食药总局2015年第67号公告中规定,2015年版药 典自2015年12月1日起实施”。如何界定产品的执行日期?答:按是历版药典执行惯例要求,自2015年12月1日起生产或进口的药品应符合2015年版药典的相关规定。 6. 问:按照实施公告要求提出备案或补充申请的品种,审评审 批期间是否仍可执行原标准,期间若有进口再注册申请的是否可按原注册标准核发新证。 答:申请人应按105号实施公告第五款规定执行。出现补充申请与再注册申请交叉情形者,建议补充申请与进口再注册合并审评,如2015年12月1日起前已提交补充申请,可在补充申请期间执行原标准的要求。 7. 问:制剂中间体是否也需要按照制剂的药典标准进行提高?
