如何merge融合免疫荧光图片

如何merge融合免疫荧光图片
工具材料:Photoshop CS5,(蓝)cd34-00.tiff、(绿)cd34-01.tiff、(红)cd34-02.tiff三张tiff图。
第一步:将所有图片组合到同一张图片的不同图层。
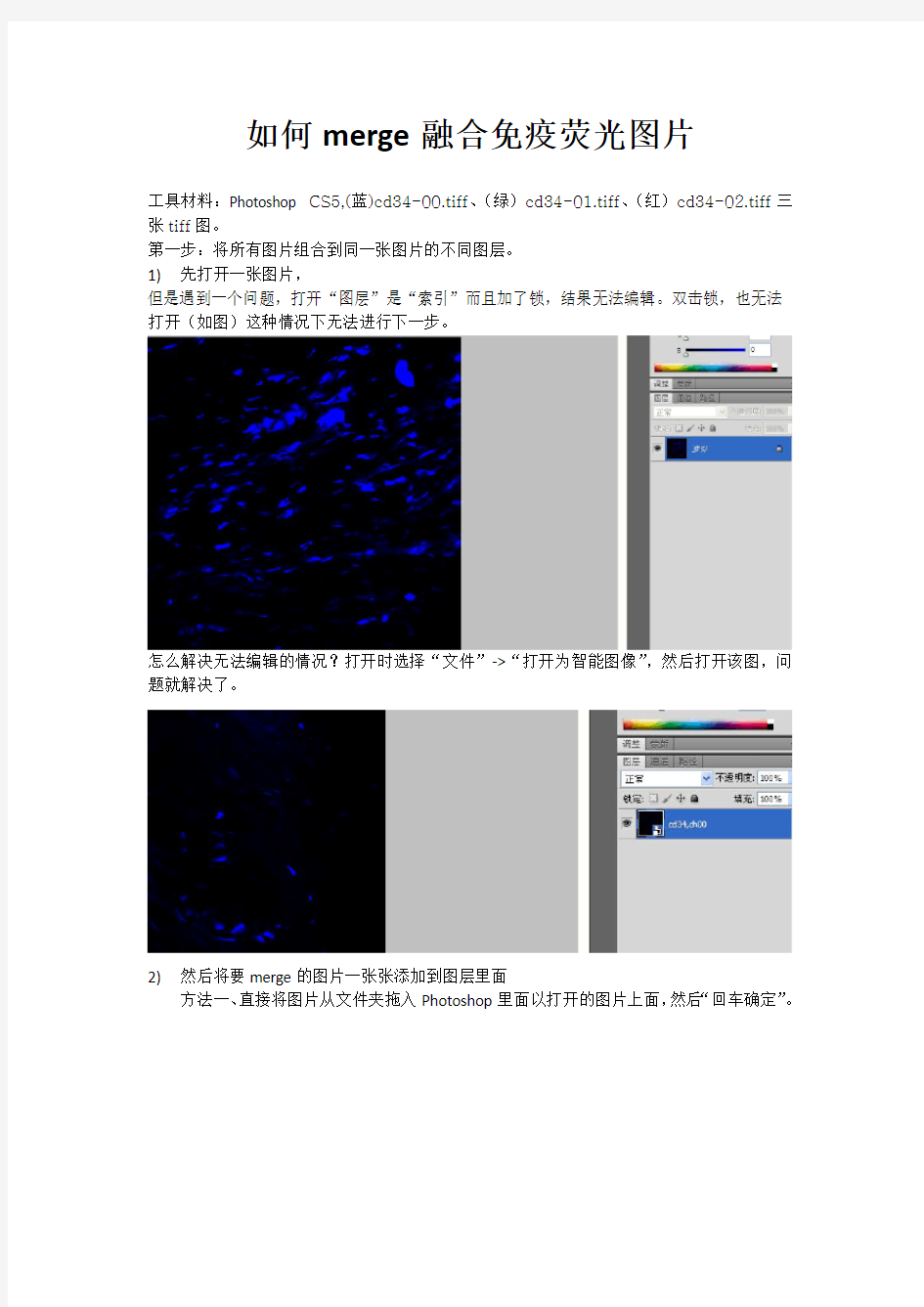
1)先打开一张图片,
但是遇到一个问题,打开“图层”是“索引”而且加了锁,结果无法编辑。双击锁,也无法打开(如图)这种情况下无法进行下一步。
怎么解决无法编辑的情况?打开时选择“文件”->“打开为智能图像”,然后打开该图,问题就解决了。
2)然后将要merge的图片一张张添加到图层里面
方法一、直接将图片从文件夹拖入Photoshop里面以打开的图片上面,然后“回车确定”。
方法二:分别“智能打开”各图片,
a)将cd34-00定位底色,将cd34-01 –>ctrl+A->ctrl+C,
b)移到cd34-00的图层上,Ctrl+V。
c)Ctrl+T,调整图片大小一致,回车确定
添加完所有图片。
3)修改各图片merge属性
a)例子中cd34-00显蓝色,选中cd34-00图层,选择“图层”->“图层样式”->”混合
选项”->“高级混合”->“通道”中,只选择B(B)。蓝色
b)例子中cd34-01显绿色,选中cd34-00图层,选择“图层”->“图层样式”->”混合
选项”->“高级混合”->“通道”中,只选择G(G)。绿色
c)例子中cd34-02显红色,选中cd34-00图层,选择“图层”->“图层样式”->”混合
选项”->“高级混合”->“通道”中,只选择R(R)。红色
4)调整各图层的显示比率
在图层中选择透明度拖动滑条,调节各图层的“不透明度”,直到到达你满意的效果为止,
下图为最终效果图
By:465429727
免疫荧光操作步骤及注意事项
免疫荧光技术是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。它是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(或抗原)作为探针检查细胞或组织内的相应抗原(或抗体)。利用荧光显微镜可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质和定位,以及利用定量技术(比如流式细胞仪)测定含量。 紫外光激发荧光物质放射荧光示意图 免疫荧光实验的主要步骤包括细胞片制备、固定及通透(或称为透化)、封闭、抗体孵育及荧光检测等。细胞片制备(通俗的说法是细胞爬片)是免疫荧光实验的第一步,细胞片的质量对实验的成败至关重要,原因很简单,如果发生细胞掉片,一切都无从谈起。这一步关键的是玻片(Slides or Coverslips)的处理以及细胞的活力,有人根据成功经验总结出许多有益的细节或小窍门,非常值得借鉴。固定和通透步骤最重要的是根据所研究抗原的性质选择适当的固定方法,合适的固定剂和固定程序对于获得好的实验结果是非常重要的。免疫荧光中的封闭和抗体孵育与其它方法(如ELISA或Western Blot)中的相同步骤是类似的,最重要的区别在于免疫荧光实验中要用到荧光抗体,因此必须谨记避光操作,此外抗体浓度的选择可能更加关键。最后需要注意的是,标记好荧光的细胞片应尽早观察,或者用封片剂封片后在4℃或-20℃避光保存,以免因标记蛋白解离或荧光减弱而影响实验结果。 由于操作步骤比较多,同时在分析结果时无法像WB那样可以根据分子量的大小区分非特异性识别,所以要得到一个完美的免疫荧光实验结果,除了需要高质量的抗体,以及对实验条件进行反复优化外,还必须设立严谨的实验对照。总之,免疫荧光实验从细胞样品处理、固定、封闭、抗体孵育到最后的封片及观察拍照,每步都非常关键,需要严格控制实验流程中每个步骤的质量,才能最终达到你的实验目的。 基本实验步骤:
免疫标记技术讲解
课程名称:临床免疫学检验技术课题名称:免疫标记技术 组员:朱恩鹏拉巴卓嘎 张燕培汪婷婷
免疫标记技术 免疫标记技术指用荧光素、放射性同位素、酶、铁蛋白、胶体金及化学(或生物)发光剂等作为追踪物,标记抗体或抗原进行的抗原抗体反应。藉助于荧光显微镜、射线测量仪、酶标检测仪、和发光免疫测定仪等精密仪器,对实验结果直接镜检观察或进行自动化测定,可以在细胞、亚细胞、超微结构及分子水平上,对抗原抗体反应进行定性和定位研究;或应用各种液相和固相免疫分析方法,对体液中的半抗原、抗原或抗体进行定性和定量测定。因此,免疫标记技术在敏感性、特异性、精确性及应用范围等方面远远超过一般免疫血清学方法。近年来,随着分子生物学、细胞生物学、基础免疫学和免疫化学等学科的发展以及现代高新技术建立的仪器分析的应用,免疫标记技术也不断完善和更新。各种新技术和新方法不断涌现,至今已成为一类检测微量和超微量生物活性物质的免疫生物化学分析技术,在医学和其他生物学科的研究领域及临床检验中应用十分广泛。 根据试验中所用标记物的种类和检测方法不同,免疫标记技术分为免疫荧光技术、放射免疫技术、免疫酶技术、免疫电镜技术、免疫胶体金技术和发光免疫测定等。 第一节放射免疫技术 放射免疫标记技术是将同位素分析的高灵敏度与抗原抗体反应的特异性相结合,以放射性同位素作为示踪物的标记免疫测定方法,由于此项技术具有灵敏度高(可检测出毫微克(ng)至微微克(pg),甚至毫微微克(fg)的超微量物质,特异性强(可分辨结构类似的抗原)、重复性强、样品及试剂用量少、测定方法易规范化和自动化等多个优点。因此,在医学及其他生物学科的研究领域和临床实验诊断中广泛应用于各种微量蛋白质、激素、小分子药物及肿瘤标志物等的分析与定量测定。 (一)放射免疫测定(RIA) 放射免疫测定(Radio immunoassay , RIA)是1959 年Yalow 和Berson 首先创建的经典放射免疫分析技术,用于血清中胰岛素含量的测定。30 多年来,由于此项技术灵敏、特异、并已制成多种标准试剂盒,使用方便,应用范围十分广泛。目前国外已成功地应用RIA检测的物质多达300余种,国内研究的被测物质也达百余种,试制的RIA试剂盒已有60余种,是测定各种微量物质不可缺少的手段。 (二)免疫放射测定(IRMA)
免疫荧光操作步骤及注意事项
免疫荧光操作步骤及注意事项 免疫荧光技术是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。它是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(或抗原)作为探针检查细胞或组织内的相应抗原(或抗体)。利用荧光显微镜可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质和定位,以及利用定量技术(比如流式细胞仪)测定含量。 紫外光激发荧光物质放射荧光示意图 免疫荧光实验的主要步骤包括细胞片制备、固定及通透(或称为透化)、封闭、抗体孵育及荧光检测等。细胞片制备(通俗的说法是细胞爬片)是免疫荧光实验的第一步,细胞片的质量对实验的成败至关重要,原因很简单,如果发生细胞掉片,一切都无从谈起。这一步关键的是玻片(Slides or Coverslips)的处理以及细胞的活力,有人根据成功经验总结出许多有益的细节或小窍门,非常值得借鉴。固定和通透步骤最重要的是根据所研究抗原的性质选择适当的固定方法,合适的固定剂和固定程序对于获得好的实验结果是非常重要的。免疫荧光中的封闭和抗体孵育与其它方法(如ELISA或Western Blot)中的相同步骤是类似的,最重要的区别在于免疫荧光实验中要用到荧光抗体,因此必须谨记避光操作,此外抗体浓度的选择可能更加关键。最后需要注意的是,标记好荧光的细胞片应尽早观察,或者用封片剂封片后在4?或-20?避光保存,以免因标记蛋白解离或荧光减弱而影响实验结果。
由于操作步骤比较多,同时在分析结果时无法像WB那样可以根据分子量的大小区分非特异性识别,所以要得到一个完美的免疫荧光实验结果,除了需要高质量的抗体,以及对实验条件进行反复优化外,还必须设立严谨的实验对照。总之,免疫荧光实验从细胞样品处理、固定、封闭、抗体孵育到最后的封片及观察拍照,每步都非常关键,需要严格控制实验流程中每个步骤的质量,才能最终达到你的实验目的。 基本实验步骤: (1) 细胞准备。对单层生长细胞,在传代培养时,将细胞接种到预先放置有处理过的盖玻片的培养皿中,待细胞接近长成单层后取出盖玻片,PBS洗两次;对悬浮生长细胞,取对数生长细胞,用PBS离心洗涤(1000rpm,5min)2次,用细胞离心甩片机制备细胞片或直接制备细胞涂片。 (2) 固定。根据需要选择适当的固定剂固定细胞。固定完毕后的细胞可置于含叠氮纳的PBS中4?保存3个月。PBS洗涤3×5 min. (3) 通透。使用交联剂(如多聚甲醛)固定后的细胞,一般需要在加入抗体孵育前,对细胞进行通透处理,以保证抗体能够到达抗原部位。选择通透剂应充分考虑抗原蛋白的性质。通透的时间一般在5-15min.通透后用PBS洗涤3×5 min. (4) 封闭。使用封闭液对细胞进行封闭,时间一般为30min. (5) 一抗结合。室温孵育1h或者4?过夜。PBST漂洗3次,每次冲洗5min. (6) 二抗结合。间接免疫荧光需要使用二抗。室温避光孵育1h.PBST漂洗3次,每次冲洗5min后,再用蒸馏水漂洗一次。 (7) 封片及检测。滴加封片剂一滴,封片,荧光显微镜检查。 (一)细胞准备 用于免疫荧光实验的细胞可以是直接生长在盖玻片上的贴壁细胞,也可以是经过离心后涂片的悬浮细胞或者是将取自体内的组织细胞悬液离心后涂片。贴壁良好
间接免疫荧光法检测抗核抗体的结果分析
间接免疫荧光法检测抗核抗体的结果分析 目的探讨间接免疫荧光法(IIFA)检测抗核抗体在自身免疫性疾病(AID)患者中的结果应用分析。方法分别采用IIFA和胶乳法检测50例自身免疫性疾病患者血清样本抗核抗体(ANA)。结果IIFA法检测血清ANA的灵敏度为76%,胶乳法检测血清ANA的灵敏度为58%,差异有统计学意义(P<0.01)。结论IIFA 法检测ANA的敏感度明显高于胶乳法,提高了临床的阳性检出率。IIFA法用于ANA的筛查,阳性标本在进行滴度检测,有助于临床诊断。 标签:抗核抗体;间接免疫荧光法;胶乳法 [Abstract] Objective To discuss the results of indirect immunofluorescence in detecting the antinuclear antibodies in patients with autoimmune diseases. Methods The antinuclear antibodies of serum samples of 50 cases of patients with autoimmune diseases were detected respectively by the IIFA and emulsion method. Results The difference in the sensitivity degree of ANA detected by IIFA method and emulsion method had statistical significance(76% vs 58%)(P<0.01). Conclusion The sensitivity degree of ANA detected by IIFA method is obviously higher than that detected by the emulsion method,which improves the positive detection rate in clinic,the application of IIFA method for ANA screening and the application of positive specimens for titer detection contribute to clinical diagnosis. [Key words] Antinuclear antibodies;Indirect immunofluorescence;Emulsion method 抗核抗体(ANA)包括细胞核的自身抗体和细胞质内的核酸和核蛋白的所有成分的自身抗体,是指哺乳动物的细胞中以细胞核为靶抗原的自身抗体的总称[1]。ANA在系统性红斑狼疮、干燥综合征、硬皮病、慢性活动性肝炎等自身免疫疾病中均呈不同程度的阳性。因此在自身免疫性疾病的临床诊断、鉴别以及评价预后中,ANA检测已成为重要的筛查指标[2]。临床上ANA检测方法较多,现阶段最常用、最有效的检测方法是IIFA法。由于不同检测方法检测灵敏性、准确性不同,往往影响到检测结果,使检测结果存在一定的差异,尤其在ANA 呈弱阳性的标本中,不同检测方法的检测成为争议的焦点。为进一步确认IIFA 法和乳胶法检测ANA的效果,进而客观评价该两种检测方法差异性,该文2015年10—12月间选取该院确诊或疑似为AID的患者50例作为观察对象,同时采用IIFA法和乳胶法检测,报道如下。 1 资料与方法 1.1 一般资料 所有标本均来自2015年10—12月到该院确诊或疑似AID的门诊和住院患者50例,男性15例,女性35例,年龄15~65岁。
细胞免疫荧光实验步骤
细胞免疫荧光实验步骤 细胞免疫荧光实验步骤 简单实验步骤如下: 1.漂洗血清蛋白H7.2-7.4 37度 PBS 2小时. 2.-20度甲醇固定20分钟后,自然、干燥 10分钟 3.PBS洗净:3min*3 4.1%Triton:25min-30min.配成50ultriton+5mlpBS 5.PBS洗净:2*5min 6.羊血清封闭:37度,20分钟 7.一抗,4度过夜,一般要大于18小时或者37度1-2小时 8.4度PBS洗净,3min*5次 9.二抗37度小于一小时 10.37度PBS洗净,3*5min 凉干封片(封闭液PH8.5) 活细胞免疫荧光技术-流式细胞仪标本的制备 (一)制备活性高的细胞悬液(培养细胞系、外周血单个核细胞、 胸腺细胞、脾细胞等均可用于本法) ↓ 用10%FCS RPMI1640调整细胞浓度为 5×106~1×107/ml ↓ 取40μl细胞悬液加入预先有特异性McAb(5~50μl) 的小玻璃管或塑料离心管,再加50μl 1∶20(用DPBS 稀释)灭活正常兔血清 ↓4℃ 30min 用洗涤液洗涤2次,每次加洗涤液2ml左右 1000rpm×5min
↓ 弃上清,加入50μl工作浓度的羊抗鼠 (或兔抗鼠)荧光标记物,充分振摇 ↓4℃ 30min 用洗涤液洗涤2次,每次加液2ml左右 1000rpm×5min ↓ 加适量固定液(如为FCM制备标本,一般加入 1ml固定液,如制片后在荧光显微镜下观察, 视细胞浓度加入100~500μl固定液) ↓ FCM检测或制片后荧光显微镜下观察 (标本在试管中可保存5~7天) (二)试剂和器材 1. 各种特异性单克隆抗体。 2. 荧光标记的羊抗鼠或兔抗鼠第二抗体,灭活正常兔血清。 3. 10% FCS RPMI1640, DPBS、洗涤液、固定液(见附录)。 4. 玻璃管、塑料管、离心机、荧光显微镜等。 (三)注意事项 1. 整个操作在4℃下进行,洗涤液中加有比常规防腐剂量高10倍的NaN 3,上述实验条件是防止一抗结合细胞膜抗原后发生交联、脱落。 2. 洗涤要充分,以避免游离抗体封闭二抗与细胞膜上一抗相结合,出现假阴性。 3. 加适量正常兔血清可封闭某些细胞表面免疫球蛋白Fc受体,降低和防止非特异性染色。 4. 细胞活性要好,否则易发生非特异性荧光染色。 附: 1. DPBS (×10, 贮存液)
细胞免疫荧光步骤(仅供参照)
方法一: 1.首先需要把细胞养在玻璃片上(悬浮细胞需要用多聚赖氨酸包被过的玻璃片) 2.然后在4%PFA里面室温下固定30分钟,PBS洗两次,0.1% TX-100室温下作用1-2分 钟使细胞膜通透。 3.接下来进行荧光标记,需要在一个大的容器(面积大,扁平状的,比如大的培养皿)里面, 放一张用水打湿的滤纸,以保持湿度。 4.剪一片合适大小的parafilm,在上面滴上稀释在1%BSA/TBS中的一抗(稀释倍数依具体 抗体而定),每个玻璃片30ul足够,把玻璃片盖在上面(细胞面朝下),室温下孵育30分钟,然后在PBS里洗三次。 5.接下来二抗孵育步骤同上。 6.最后,在载玻片加上mounting medium(大约每个玻璃片加10ul),把玻璃片放上去(细 胞面朝下),37度30分钟,然后就可以在荧光显微镜下观察了。 7.抗体很重要,不能有非特异性结合。你可以先做WB检测一下你的抗体,看看有没有杂带。 8.双标的话,可以把两个一抗一起加或者分别标记两次(可以都试一下看看那种方法合适)。 如果一个抗体需要二抗,一个是直接荧光标记的,可以把荧光标记的那个和另外一个的二抗一起加。 方法二: 1.选取一抗时要来源于两种不同的动物,我用的是来源于rabbit和rat的抗体,二抗则是不 同荧光信号标记的,我用的是donkey anti-rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。 2.我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵育时间要仔细摸索, 我感觉一抗4度孵育过夜比较好,背景比较清晰。 3.我的阳性对照用的是阳性组织切片,阴性对照则分别是家兔和大鼠的IgG,荧光标记物对 照是PBS+荧光标记物。 4.封闭血清与二抗来源动物一致,我用的是10%的正常donkey血清。 5.其余步骤同一般免疫荧光单标操作。 方法三: 1.片子的制作:可以做细胞爬片,细胞甩片,还有直接在24well/12well/96well中直接染色 2.细胞爬片的制作:直接购买公司的已经处理过的细胞爬片,要是自己制作的话,就用无菌 的盖玻片用多聚赖氨酸处理后让细胞自己爬片 3.细胞甩片:需要甩片机将细胞悬液均匀甩到玻片上。
细胞免疫荧光步骤
细胞免疫荧光步骤集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
方法一: 1.首先需要把细胞养在玻璃片上(悬浮细胞需要用多聚赖氨酸包被过的玻 璃片) 2.然后在4%PFA里面室温下固定30分钟,PBS洗两次,0.1% TX-100室 温下作用1-2分钟使细胞膜通透。 3.接下来进行荧光标记,需要在一个大的容器(面积大,扁平状的,比如 大的培养皿)里面,放一张用水打湿的滤纸,以保持湿度。 4.剪一片合适大小的parafilm,在上面滴上稀释在1%BSA/TBS中的一抗 (稀释倍数依具体抗体而定),每个玻璃片30ul足够,把玻璃片盖在上面(细胞面朝下),室温下孵育30分钟,然后在PBS里洗三次。 5.接下来二抗孵育步骤同上。 6.最后,在载玻片加上mounting medium(大约每个玻璃片加10ul),把 玻璃片放上去(细胞面朝下),37度30分钟,然后就可以在荧光显微镜下观察了。 7.抗体很重要,不能有非特异性结合。你可以先做WB检测一下你的抗 体,看看有没有杂带。 8.双标的话,可以把两个一抗一起加或者分别标记两次(可以都试一下看 看那种方法合适)。如果一个抗体需要二抗,一个是直接荧光标记的,可以把荧光标记的那个和另外一个的二抗一起加。 方法二: 1.选取一抗时要来源于两种不同的动物,我用的是来源于rabbit和rat 的抗体,二抗则是不同荧光信号标记的,我用的是donkey anti- rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。 2.我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵 育时间要仔细摸索,我感觉一抗4度孵育过夜比较好,背景比较清晰。 3.我的阳性对照用的是阳性组织切片,阴性对照则分别是家兔和大鼠的 IgG,荧光标记物对照是PBS+荧光标记物。 4.封闭血清与二抗来源动物一致,我用的是10%的正常donkey血清。 5.其余步骤同一般免疫荧光单标操作。 方法三:
第八章荧光免疫技术
第八章荧光免疫技术 FluoreSCenCe ImmunoaSsay 第一部分目的要求和教学内容 一、目的要求 掌握:荧光免疫技术原理、类型及临床应用,常用的荧光物质;熟悉:荧光免疫技术 的技术要点;了解:荧光标记物的制备与保存,镧系稀土元素标记物的制备,荧光免疫技术主要类型的技术要点。 二、教学内容 1.荧光标记物的制备:荧光和荧光物质,荧光标记物的制备。 2.荧光免疫显微技术:基本原理,技术类型,技术要点,方法评价,临床应用。 3.荧光免疫测定技术:时间分辨荧光免疫测定(基本原理,技术类型,技术要点,方法评价和临床应用);荧光偏振免疫测定(基本原理,技术类型,技术要点,方法评价和临床应用)。 第二部分测试题 一、选择题 (一)单项选择题(A型题) 1.如下有关荧光免疫技术正确的提法 A.直观性检测抗原和抗体 B.直观性检测抗原 C.直观性检测抗体 D.间接检测抗原或抗体 E.间接检测抗原和抗体 2.荧光素易受温度影响,操作时通常选择较佳的温度 A.10~15℃ B.15~20℃ C.20~25℃ D.25~30℃ E.30~35℃ 3.荧光抗体保存3~4年,应选择 A.小量分装、4℃ B.瓶分装、4℃ C.瓶分装、-10℃ D.瓶分装,-20℃ E.小量分装、-20℃ 4.下列组成荧光显微镜的结构中,与普通光学显微镜相同的是 A.光源 B.聚光器 C.目镜 D.物镜 E.滤光片
5.下列哪项方法不属于荧光免疫显微技术类型 A.直接法 B.夹心法 C.间接法 D.补体法 E.双标记法 6.荧光抗体染色标本的观察时间 A.当天 B.第二天 C.第三天 D.1周内 E.5天 7.荧光抗体闭接法应标记 A.抗原 B.抗体 C.补体 D.抗抗体 E.抗体及补体 8.荧光显微技术常用于检验血清中各种自身抗体和多种病原体抗体的方法是 A.直接法 B.间接法 C.双抗体夹心法 D.补体法 E.双标记法 9.荧光抗体间接法可检测 A.抗原 B.抗体 C.补体 D.蛋白质 E.抗原和抗体 lO.在荧光显微镜检查中直接影响检测结果的是 A.抗原荧光染色 B.抗体荧光染色 C.补体荧光染色 D.特异性荧光染色 E.非特异性荧光染色 11.主要用于测定各种激素、蛋白质、酶、药物及病毒抗原的技术 A.荧光偏振免疫测定 B.荧光免疫显微技术 C.时间分辨荧光免疫测定 D.底物标记荧光免疫测定 E.流式荧光免疫技术 12.临床药物浓度检测的首选方法
免疫荧光双标操作方法及注意事项
在同一组织细胞标本上需要同时检测两种抗原时,需进行双重荧光染色。双重免疫荧光标记法(double immunofluorescence labeling method)也分为直接法和间接法。 (1)直接法双重免疫荧光标记:将标记有两种不同荧光素的抗体(如抗A 和抗B)以适当比例混合,滴加在标本上孵育,然后洗去未结合的荧光抗体,在荧光显微镜下分别选择两种相应的激发滤片观察,即可对两种抗原进行定位和定量。直接法简便可靠,但灵敏度较低。 (2)间接法双重免疫荧光标记:用未标记的两种特异性第一抗体孵育组织或细胞,洗去多余的第一抗体后,再用两种不同的荧光素分别标记的第二抗体孵育组织或细胞,洗去多余的第二抗体,后在荧光显微镜下分别选择两种相应的激发滤片观察,从而对两种抗原进行定位和定量。使用此法应注意两种特异性第一抗体必须来源于不同种属,且荧光标记第二抗体的种属必须与第一抗体的种属相匹配。 免疫荧光双标技术中操作要点和注意事项 一、免疫荧光技术中标本制作的基本程序近似于酶免疫组化,不同点如下: 1、免疫荧光不需要使用双氧水处理,封闭和一抗孵育与其相同。 2、免疫荧光的二抗使用不同荧光标记的二抗孵育,孵育时间根据抗体的工作浓度确定。 3、二抗孵育之后充分洗片后即可贴片、封片和观察。 4、免疫荧光在封片时常使用专用封片剂或甘油:0.01M PBS (1:1)。条件许可,建议购买抗淬灭的封片液,使标本可以保存更久。
5、荧光抗体的孵育以及后续处理需要避光。 6、荧光抗体染色假阳性可能会多,需要分别设定阳性和阴性对照。 二、注意事项 1、荧光染色后一般在1h内完成观察,或于4℃保存4h,时间过长,可能会使荧光提前衰退。 2、每次试验均需设置以下三种对照: (1) 阳性对照:阳性血清+荧光标记物; (2) 阴性对照:阴性血清+荧光标记物; (3) 荧光标记物对照:PBS+荧光标记物。 三、免疫荧光双标的经验之谈 1、选取一抗时,要求来源于两种不同的动物,我用的是来源于家兔和大鼠的抗体,二抗则是不同荧光信号标记的,我用的是donkey anti-rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。 2、我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵育时间要自我摸索,我感觉一抗4℃孵育过夜比较好,背景比较清晰。 3、我的阳性对照采用的是阳性组织切片,阴性对照则分别是家兔和大鼠的IgG,荧光标记物对照是PBS+荧光标记物。 4、封闭血清是二抗来源动物的正常血清,我用的是10%正常donkey 血清。 5、其余事项同免疫荧光单标操作。 免疫组化双重染色方法和步骤 在生物医学和临床研究实践中,经常需要检测两种不同物质是否在同一
细胞免疫荧光步骤
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 方法一: 1.首先需要把细胞养在玻璃片上(悬浮细胞需要用多聚赖氨酸包被过的玻璃片) 2.然后在4%PFA里面室温下固定30分钟,PBS洗两次,0.1% TX-100室温下作用1 -2分钟使细胞膜通透。 3.接下来进行荧光标记,需要在一个大的容器(面积大,扁平状的,比如大的培养皿) 里面,放一张用水打湿的滤纸,以保持湿度。 4.剪一片合适大小的parafilm,在上面滴上稀释在1%BSA/TBS中的一抗(稀释倍数 依具体抗体而定),每个玻璃片30ul足够,把玻璃片盖在上面(细胞面朝下),室温下孵育30分钟,然后在PBS里洗三次。 5.接下来二抗孵育步骤同上。 6.最后,在载玻片加上mounting medium(大约每个玻璃片加10ul),把玻璃片放上 去(细胞面朝下),37度30分钟,然后就可以在荧光显微镜下观察了。 7.抗体很重要,不能有非特异性结合。你可以先做WB检测一下你的抗体,看看有没 有杂带。 8.双标的话,可以把两个一抗一起加或者分别标记两次(可以都试一下看看那种方法 合适)。如果一个抗体需要二抗,一个是直接荧光标记的,可以把荧光标记的那个和另外一个的二抗一起加。 方法二: 1.选取一抗时要来源于两种不同的动物,我用的是来源于rabbit和rat的抗体,二抗则 是不同荧光信号标记的,我用的是donkey anti-rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。 2.我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵育时间要仔 细摸索,我感觉一抗4度孵育过夜比较好,背景比较清晰。
免疫荧光实验步骤大全(精华版)
免疫荧光染色大全(精华版) 组织免疫荧光法 (1)将待染组织切片置于65摄氏度恒温箱烤片1h,脱蜡 (2)1×PBS 洗涤 3 次,每次 5min。 (3)0.5%Triton X-100(PBS 配制)室温通透 10min (4)1×PBS 洗涤 3 次,每次 5min。 注意:步骤(3)和(4)用于检测细胞核抗原,细胞膜抗原直接跳过此步骤(5)抗原修复:使用柠檬酸盐缓冲液进行抗原修复,微波炉微波高火3min,后转成低火 15min。 (6)1×PBS 洗涤 3 次,每次 5min。 (7)3% H2O2,室温孵育30min,目的是灭活内源性过氧化物酶。 (8)1×PBS 洗涤 3 次,每次 5min。 (9)使用1% BSA进行室温封闭 30min,用于封闭非特异性抗原表位。 (10)按抗体推荐使用说明书孵育特异性一抗,4°C 湿盒中静置过夜。(11)次日取出切片,室温下复温 30min。 (12)1×PBS 洗涤 3 次,每次 5min。 (13)选取相应的免疫荧光二抗滴加于血管组织上,37°C避光孵育30min。(14)1×PBS洗涤 3 次,每次 5min。 (15)避光条件下,DAPI 染液染细胞核,浓度和时间根据试剂说明书使用(16)1×PBS洗涤 3 次,每次5min。 (17)在血管组织上滴加抗荧光淬灭剂进行封片。 (18)使用荧光显微镜进行观察拍照。 贴壁细胞免疫荧光法 (1)在培养板中接种的带染色的细胞爬片用PBS泡洗3次×3min (2)4%多聚甲醛固定细胞爬片15min (3)1×PBS洗涤 3 次,每次5min。 (4)0.5%Triton X-100(PBS配制)室温通透10min (5)1×PBS洗涤 3 次,每次5min。 (6)1%BSA室温封闭30min (7)弃掉封闭液,细胞爬片滴加适量稀释至适当比例的一抗,4℃孵育过夜(8)1×PBS洗涤 3 次,每次5min。 (9)细胞爬片滴加稀释至适当比例的荧光二抗 (10)1×PBS洗涤 3 次,每次5min。 (11)DAPI染细胞核,浓度和时间根据试剂说明书使用 (12)1×PBS洗涤 3 次,每次5min。 (13)用抗荧光淬灭剂封片 (14)荧光显微镜下观察采集图像 细胞免疫荧光(悬浮细胞方法一) (1)收集悬浮细胞,细胞在冰浴中冷却,然后用台式离心机于4℃以800 g 离心5 min,吸去培养液并以4℃ 1×PBS重悬细胞。
直接免疫荧光法测抗原
直接免疫荧光法测抗原 基本原理 将荧光素标记在相应的抗体上,直接与相应抗原反应。其优点是方法简便、特异性高,非特异性荧光染色少。缺点是敏感性偏低;而且每检查一种抗原就需要制备一种荧光抗体。此法常用于细菌、病毒等微生物的快速检查和肾炎活检、皮肤活检的免疫病理检查。 试剂与仪器 l 磷酸盐缓冲盐水(PBS):0.01mol/L,pH7.4 l 荧光标记的抗体溶液:以0.01mol/L,pH7.4的PBS进行稀释 l 缓冲甘油:分析纯无荧光的甘油9份+ pH9.2 0.2M碳酸盐缓冲液1份配制 l 搪瓷桶三只(内有0.01mol/L,pH7.4的PBS 1500ml) l 有盖搪瓷盒一只(内铺一层浸湿的纱布垫) l 荧光显微镜 l 玻片架 l 滤纸 l 37℃温箱等。 实验步骤 1. 滴加0.01mol/L,pH7.4的PBS于待检标本片上,10min后弃去,使标本保持一定湿度。 2. 滴加适当稀释的荧光标记的抗体溶液,使其完全覆盖标本,置于有盖搪瓷盒内,保温一定时间(参考:30min)。 3. 取出玻片,置玻片架上,先用0.01mol/L,pH7.4的PBS冲洗后,再按顺序过0.01mol/L,pH7.4的PBS三缸浸泡,每缸3-5 min,不时振荡。 4. 取出玻片,用滤纸吸去多余水分,但不使标本干燥,加一滴缓冲甘油,以盖玻片覆盖。 5. 立即用荧光显微镜观察。观察标本的特异性荧光强度,一般可用“+”表示: (-)无荧光;(±)极弱的可疑荧光;(+)荧光较弱,但清楚可见;(++)荧光明亮;(+++
--++++)荧光闪亮。待检标本特异性荧光染色强度达“++”以上,而各种对照显示为(±)或(-),即可判定为阳性。 注意事项 1. 对荧光标记的抗体的稀释,要保证抗体的蛋白有一定的浓度,一般稀释度不应超过1:20,抗体浓度过低,会导致产生的荧光过弱,影响结果的观察。 2. 染色的温度和时间需要根据各种不同的标本及抗原而变化,染色时间可以从10 min到数小时,一般30 min已足够。染色温度多采用室温(25℃左右),高于37℃可加强染色效果,但对不耐热的抗原(如流行性乙型脑炎病毒)可采用0-2℃的低温,延长染色时间。低温染色过夜较37℃30 min效果好的多。 3. 为了保证荧光染色的正确性,首次试验时需设置下述对照,以排除某些非特异性荧光染色的干扰。 (1)标本自发荧光对照:标本加1-2滴0.01mol/L,pH7.4的PBS。 (2)特异性对照(抑制试验):标本加未标记的特异性抗体,再加荧光标记的特异性抗体。 (3)阳性对照:已知的阳性标本加荧光标记的特异性抗体。 如果标本自发荧光对照和特异性对照呈无荧光或弱荧光,阳性对照和待检标本呈强荧光,则为特异性阳性染色。 4. 一般标本在高压汞灯下照射超过3min,就有荧光减弱现象,经荧光染色的标本最好在当天观察,随着时间的延长,荧光强度会逐渐下降。
免疫荧光检测
免疫荧光技术(检测抗核抗体(ANA)的实验方案) 荧光免疫技术是以荧光物质标记的特异性抗体或抗原作为标准试剂,用于相应抗原或抗体的分析鉴定和定量测定。荧光免疫技术包括荧光抗体染色技术和荧光免疫测定两大类。荧光抗体染色技术是用荧光抗体对细胞、组织切片或其他标本中的抗原或抗体进行鉴定和定位检测,可在荧光显微镜下直接观察结果,称为荧光免疫显微技术,或是应用流式细胞仪进行自动分析检测,称为流式荧光免疫技术。荧光免疫测定主要有时间分辨荧光免疫测定和荧光偏振免疫测定等。本次实验以荧光免疫显微技术检测抗核抗体(ANA)为例进行实习。 抗核抗体(antinuclear antibody,ANA)又称抗核酸抗原抗体,是一组将自身真核细胞的各种成分脱氧核糖核蛋白(DNP)、DNA、可提取的核抗原(ENA)和RNA等作为靶抗原的自身抗体的总称,能与所有动物的细胞核发生反应,主要存在于血清中,也可存在于胸水、关节滑膜液和尿液中。 抗核抗体实验原理 以小鼠肝细胞或某些培养细胞(如Hep-2)作抗原片,将病人血清加到抗原片上。如果血清中含有ANA,就会与细胞核成分特异性结合。加入荧光素标记的抗人IgG抗体又可与ANA结合,在荧光显微镜下可见细胞核部位呈现荧光。 试剂与器材 1.抗原片现多用商品试剂。如需自行制备,方法如下: (1)肝印片制备:取4-8周龄小鼠,断颈杀死后,剖腹取肝。将肝脏剪成平面块,用生理盐水洗去血细胞,用滤纸吸干渗出的浆液。将切面轻压于载玻片上,使其在载玻片上留下薄层肝细胞。冷风吹干,乙醇固定,冰箱可保存1周。
(2)Hep-2细胞抗原片制备:Hep-2细胞是建株的人喉癌上皮细胞。经适宜培养在载玻片上形成单层细胞抗原片,用洗涤洗去培养基。干燥后,用无水乙醇固定。 (3)肝切片制备:取小鼠肝组织作冰冻切片,厚4μl。-30℃保存备用。 2.异硫氰酸荧光素(FITC)标记的抗人IgG抗体(FITC-抗人IgG抗体)有商品供应,临用时按效价稀释。 3.L PBS 4.缓冲甘油取甘油9份加PBS 1份。 5.待测血清、阳性和阴性对照血清临床标本筛选获得。 6.器材荧光显微镜、孵箱、有盖湿盒、染色缸、吸管、试管等 操作方法 1.准备:检查加样板,生物载片恢复室温,标记。 2.稀释:PBS-Tween缓冲液稀释血清,设阴阳性对照。 3.加样:加样板放于泡沫塑料板上,加25μl稀释后血清,至加样板的每一反应区,避免气泡。加完所有标本后开始温育。 4.温育:将生物薄片盖于加样板的凹槽里,反应开始,室温温育30分钟。 5.冲洗:用烧杯盛PBS-Tween缓冲液流水冲洗生物薄片,然后立即将其浸入盛有PBS-Tween缓冲液的小杯中至少1分钟。不必混摇。 6.加样:滴加20μl荧光素标记的抗人球蛋白(结合物)至一洁净加样板的反应区,完全加完方可继续温育。荧光素标记的抗人球蛋白用前需混匀并以PBS-Tween缓冲液稀释。
免疫荧光步骤(精)
胞免疫荧光步骤: 1.细胞爬片;首先是玻片的处理,普通的盖玻片用砂轮划成自己要的大小的小方块,先用洗衣粉洗干净,用水冲静烤干,然后泡酸过夜,捞酸后流水洗净,烤干,置于器皿中高压灭菌,然后再烤箱中大约8小时烤干备用。 爬片可以在培养皿六孔板或24孔板中都可,我选择在培养皿中爬。一为节约经费(培养皿可以重复利用)二来觉得培养皿口大,操作比较方便。培养皿消毒同上,消毒时记得消两把镊子 具体操作是:用胰酶消化好细胞,充分吹打,使之成单细胞悬液(注意:这一点很重要,关系到将来爬出来片子的质量) 取出消毒的培养皿,可以先加少量培养基(以使玻片与培养皿紧密接触),将玻片小心放入摆放其中,然后将单细胞悬液一滴一滴的滴到玻片上。最后盖上培养皿置于37度5%CO2的暖箱中培养,根据细胞生长状况,24小时或更长时间适时取出爬片。 爬片置于37度PBS中洗三次,每次3到5秒钟,然后在4%多聚甲醛中固定15分钟,然后再用37度去离子水将甲醛冲干净,注意手法轻柔,要不然掉片很厉害。同时操作过程中注意玻片的正反面,要不然真的是前功尽弃。 将做好的爬片置于滤纸上晾干,然后用中性树胶粘在载玻片上。注意一定要等中性树胶彻底干了之后才能做后续实验,要不然玻片会掉下来的,就又是前功尽弃了做好的细胞爬片可以放在-20保存备用,具体能保存多长时间不太清楚,当然尽量早用。 2.4%多聚甲醛固定10min(固定细胞器用预冷的70%甲醇+30%丙酮); 3.PBS漂洗5min; 4.0.5% Triton 穿孔15min(丙酮固定法不用透化处理); 5.PBS漂洗2次,每次5min; 6.1%BSA封闭30min; 7.加入1%BSA稀释的一抗,于37℃杂交2h; 8.PBS漂洗2次,每次5min; 9.加入1%BSA稀释的二抗,于37℃杂交1h; 10.PBS漂洗2次,每次5min; 11.5ug/ml DAPI染色2min; 12.抗淬灭封片剂封片。
间接免疫荧光
间接免疫荧光法检测Ad-LMP2表达EBV-LMP2蛋白的活性 1 材料和仪器 293细胞 大鼠抗LMP2单克隆抗体 FITC标记山羊抗大鼠IgG抗体 荧光显微镜 2 检测方法 2.1 293细胞接种到24孔板中, 1.5~2.0×105个细胞/孔,37℃,5% CO2培养箱培养过夜,细胞生长成片。 2.2 每个细胞孔感染2.0×106VP供试品重组腺病毒,同时设置293细胞阴性对照孔。37℃,5% CO2培养箱培养两天,细胞完全病变。 2.3 收集293细胞。用PBS洗涤两次,重悬到100μlPBS缓冲液中,每孔10μl 涂于细胞片上,室温自然晾干。 2.4 将细胞片置于4℃丙酮中固定15分钟,PBS洗两次,室温晾干。 2.5 PBS浸泡10min,用PBS(含0.05%Triton-X100)浸泡通透25min。 2.6 用10%胎牛血清室温封闭40min。 2.6 细胞孔使用1:20 PBS稀释抗体,置于湿盒中,37℃孵育1小时。PBS洗8~9遍,保持湿润。 2.7 覆盖1:40稀释的FITC标记(PBS稀释)的羊抗大鼠IgG,置于湿盒中,37℃孵育30分钟。PBS洗8~9遍,室温晾干。(如用PBS有颗粒沉淀) 2.8 伊文氏蓝负染5分钟。超纯H2O洗3遍,室温晾干。 2.9 50%甘油封片。 2.10 显微镜下观察照相。 3 结果判定 显微镜下观察阴性对照孔细胞呈红色,供试品孔细胞可以看到明显的绿色荧光,即判定为阳性。检测结果应为阳性。 注:1、每一步均需晾干,细胞浓度可以比较高。 2、水洗效果要好,无盐粒子颗粒。
3、丙酮固定过夜效果较好。 PBS稀释。当然最好用封闭液直接稀释,再加一点TritonX100效果好。 培养液成分太多了。而且固定之后细胞都死了,用培养液没什么意义,只要保证其pH等条件适合就好了。 抗体说明书上都会有推荐的稀释倍数。上网查一下,有很多protocol。一般一比几百到一万都有,依抗体而定。可以4度过夜,这样染色效果好。 二抗一般较便宜,一般1:50到1:200多。 Jdzhangwenjun525@https://www.360docs.net/doc/20172868.html, 1. 直接免疫荧光法测抗原 (1)基本原理 将荧光素标记在相应的抗体上,直接与相应抗原反应。其优点是方法简便、特异性高,非特异性荧光染色少。缺点是敏感性偏低;而且每检查一种抗原就需要制备一种荧光抗体。此法常用于细菌、病毒等微生物的快速检查和肾炎活检、皮肤活检的免疫病理检查。 (2)试剂与仪器 λ磷酸盐缓冲盐水(PBS):0.01mol/L,pH7.4 λ荧光标记的抗体溶液:以0.01mol/L,pH7.4的PBS进行稀释 λ缓冲甘油:分析纯无荧光的甘油9份+ pH9.2 0.2M碳酸盐缓冲液1份配制 λ搪瓷桶三只(内有0.01mol/L,pH7.4的PBS 1500ml) λ有盖搪瓷盒一只(内铺一层浸湿的纱布垫) λ荧光显微镜
免疫荧光技术
免疫荧光技术(Immunofluorescence technique)又称荧光抗体技术,是标记免疫技术中发展最早的一种。它是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。很早以来就有一些学者试图将抗体分子与一些示踪物质结合,利用抗原抗体反应进行组织或细胞内抗原物质的定位。它是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(或抗原)作为探针检查细胞或组织内的相应抗原(或抗体)。利用荧光显微镜可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质和定位。 一、基本原理: 免疫荧光技术是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素,制成荧光抗体,再用这种荧光抗体(或抗原)作为探针检测组织或细胞内的相应抗原(或抗体)。在组织或细胞内形成的抗原抗体复合物上含有标记的荧光素,利用荧光显微镜观察标本,荧光素受外来激发光的照射而发生明亮的荧光(黄绿色或橘红色),可以看见荧光所在的组织细胞,从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量。 二、应用范围: 其应用范围极其广泛,可以测定内分泌激素、蛋白质、多肽、核酸、神经递质、受体、细胞因子、细胞表面抗原、肿瘤标志物、血药浓度等各种生物活性物质。根据诊断类别,又可分为传染性疾病、内分泌、肿瘤、药物检测、免疫学、血型鉴定等。 三、基本实验步骤:
1、细胞准备。对单层生长细胞,在传代培养时,将细胞接种到预先放置有处理过的盖玻片的培养皿中,待细胞接近长成单层后取出盖玻片,PBS洗两次;对悬浮生长细胞,取对数生长细胞,用PBS离心洗涤(1000rpm,5min)2次,用细胞离心甩片机制备细胞片或直接制备细胞涂片。 2、固定。根据需要选择适当的固定剂固定细胞。固定完毕后的细胞可置于含叠氮纳的PBS中4℃保存3个月。PBS洗涤3×5min. 3、通透。使用交联剂(如多聚甲醛)固定后的细胞,一般需要在加入抗体孵育前,对细胞进行通透处理,以保证抗体能够到达抗原部位。选择通透剂应充分考虑抗原蛋白的性质。通透的时间一般在5-15min.通透后用PBS洗涤3×5min. 4、封闭。使用封闭液对细胞进行封闭,时间一般为30min. 5、一抗结合。室温孵育1h或者4℃过夜。PBST漂洗3次,每次冲洗5min. 6、二抗结合。间接免疫荧光需要使用二抗。室温避光孵育1h.PBST漂洗3次,每次冲洗5min后,再用蒸馏水漂洗一次。 7、封片及检测。滴加封片剂一滴,封片,荧光显微镜检查。 四、注意事项: 1、染完之后没有封片前直接照一些,因为有的时候可能封片会出现问题,再想照反而没有了,另外不要拖太长时间,荧光会崔灭的。 2、荧光的片子一定要避光保存,保存的好的话,过一段时间仍然能照出很好的片子。
细胞免疫荧光实验步骤
细胞爬片免疫荧光实验步骤 第一天: 1. 在培养板中将已爬好细胞的玻片用PBS浸洗3次,每次3min; 2. 用4%的多聚甲醛固定爬片15min, PBS浸洗玻片3次,每次3min; 3. 0.5%Triton X-100( PBS配制 )室温通透20min(细胞膜上表达的抗原省略此步骤); 4. PBS浸洗玻片3次,每次3 min,吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30min; 5. 吸水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的一抗并放入湿盒,4℃孵育过夜; 第二天: 6. 加荧光二抗: PBST 浸洗爬片3次,每次3min,吸水纸吸干爬片上多余液体后滴加稀释好的荧光二抗,湿盒中20-37℃孵育1h,PBST浸洗切片3次,每次3min;注意:从加荧光二抗起,后面所有操作步骤都尽量在较暗处进行。 7. 复染核:滴加DAPI避光孵育5min,对标本进行染核,PBST 5min×4次洗去多余的DAPI;8. 用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。 细胞免疫荧光步骤 1.在24孔板里加500微升培养基,放爬片,接种细胞(做实验以30-50%汇合度较好。10000-30000左右 2.给药处理24h。 3.PBS洗三遍。 4. 4%冷的多聚甲醛固定15分钟,PBS洗三遍,每次5min,摇床。(避光) 5.0.5%Triton X-100(PBS配)破膜15min,PBS洗三遍,每次5min,摇床。 6.5%BSA(牛血清白蛋白,PBS配)封闭60分钟,不用洗。 7.加一抗孵育(5%BSA配),4℃摇床过夜。 8. 收集一抗,PBS洗三遍,每次5min,摇床。孵育二抗Alexa Fluor 488(1:1000 ),室温60min(避光) 9. 回收二抗,PBS洗三遍,摇床,每次5min。 10. 0.5ug/mLDAPI(5%BSA配,2滴/ml)染核15min。(避光) 11. PBS洗三遍,每次5min,摇床。 12.取载玻片,滴加10uL抗荧光衰减封片剂,将爬片有细胞面盖在封片剂上,指甲油封片子的对角线。 All steps for IF
