第3章第3节 沉淀溶解平衡(第2课时)

第3章第3节沉淀溶解平衡(第2课时)
【学习目标】1、掌握沉淀溶解平衡两方面的影响因素,学会Ksp的简单运算。
2、小组合作探究沉淀转化原理,能用沉淀溶解平衡原理解释生产生活实际中的问题。
3、规范严谨,体会沉淀溶解平衡与生产生活的联系。
【重点难点】沉淀溶解平衡影响因素和应用。
自主学习
【生活常识】造成龋齿的主要原因是牙菌斑。牙菌斑是牙齿表面的一层几乎无色的薄膜,含有造成龋齿的细菌。每次进食后,牙菌斑中的这些细菌会和食物中的糖分或淀粉发生化学作用,产生腐蚀牙齿的酸性物质。久而久之,牙齿的珐琅质便会破坏既蛀牙。
【旧知回顾】1、写出CaCO3的沉淀溶解平衡方程式,请结合电离平衡、水解平衡常数影响因素,自己尝试分析Ksp受哪些因素影响?
2、溶度积常数所表征的意义是什么?Ksp大的难溶电解质其溶解度一定越大吗?
3、沉淀转化的实质是什么,沉淀转化的方向?
合作探究
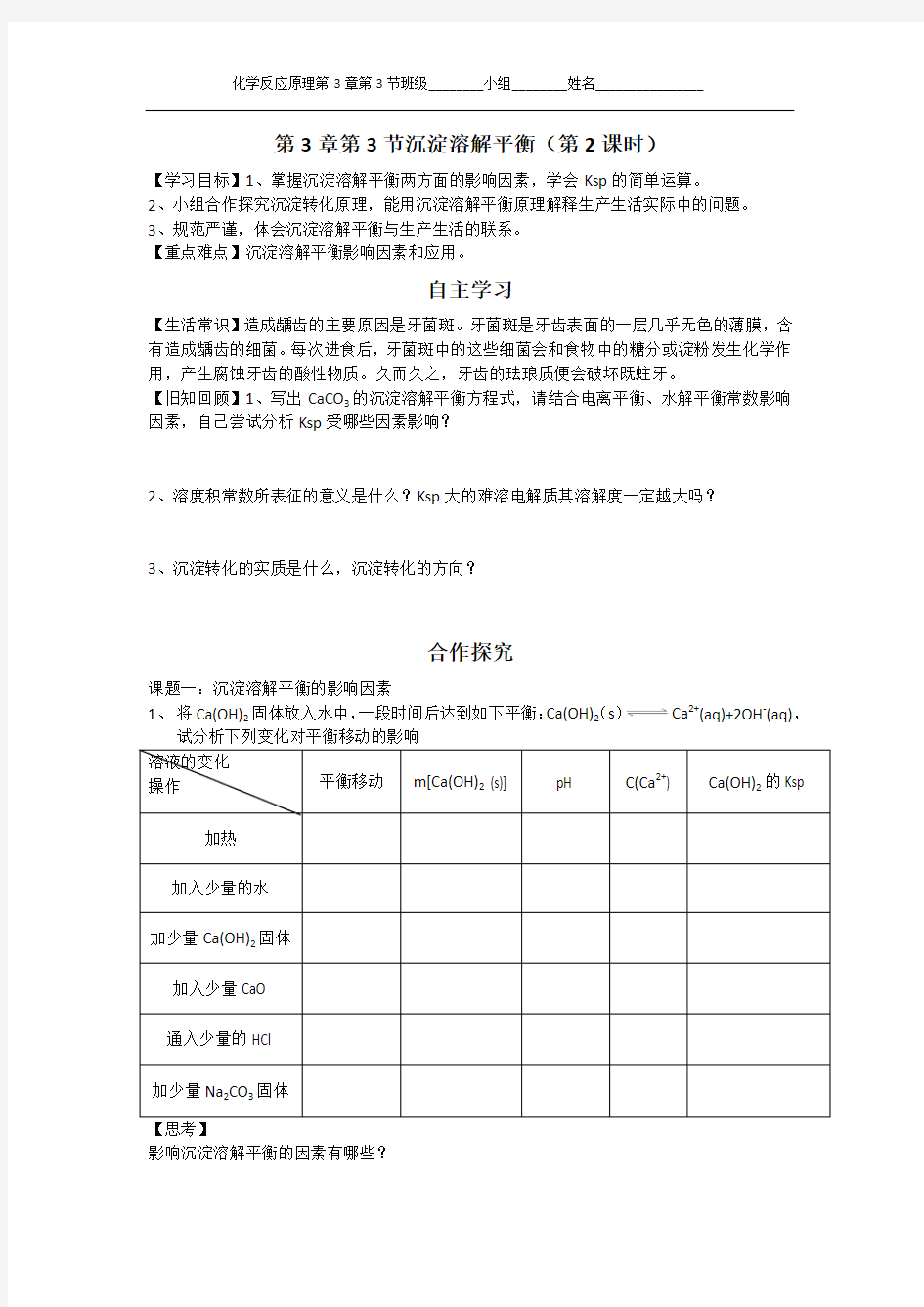
课题一:沉淀溶解平衡的影响因素
1、将Ca(OH)2固体放入水中,一段时间后达到如下平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),
试分析下列变化对平衡移动的影响
【思考】
影响沉淀溶解平衡的因素有哪些?
课题二:沉淀溶解平衡的应用
1、为何在医院中做钡餐透视用的是BaSO4,而不是BaCO3?请用离子方程式和必要的文字
解释原因。
2、钡离子是一种有毒的重金属离子,当人体中钡离子浓度达到2×10-3mol/L时,就会对健
康产生危害。若将BaCl2或Ba(NO3)2误作食盐食用,会造成钡中毒,如何解毒?请用离子方程式和必要的文字解释原因。
3、加热可以使天然水中的Ca(HCO3)2与Mg(HCO3)2分别分解为CaCO3与MgCO3沉淀。有的
同学可能认为水垢的成分为CaCO3与MgCO3沉淀的混合物,但实际上水垢的成分却是CaCO3与Mg(OH)2的混合物,请你从沉淀溶解平衡移动的原理分析其中的Mg(OH)2生成的原因。
4、向少量AgNO3溶液中依次滴加适量的NaCl(aq)、NaBr(aq)、KI(aq)时,会产生怎样的现象?
请运用沉淀溶解平衡原理解释。
5、牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙。在牙齿表面存在着如下平衡:Ca 5(PO4)3OH(s)5Ca2+(aq)+3PO43-(aq)+OH-(aq),Ksp=6.8×10-37mol9.L-9,残留在牙齿上的糖发酵会产生H+,这会对牙釉质产生怎样的影响?应采取什么措施保护牙齿?
课题三:沉淀溶解平衡的简单计算
已知室温下BaCO 3、BaSO 4的Ksp 分别为5.1×10-9mol 2.L -2、1.1×10-10mol 2.L -2,现欲使固体BaCO 3转化为BaSO 4时,所加Na 2SO 4溶液的浓度至少为()
A 、7.14×10-5mol/L
B 、3.3×10-5mol/L
C 、1.54×10-6mol/L
D 、5.1×10-9mol/L 【学以致用】已知Cu(OH)2(s)Cu 2+(aq)+2OH -(aq),Ksp=2.0×10-20mol 3.L -3。
(1) 某CuSO 4溶液里C(Cu 2+)=0.02mol/L ,如果生成Cu(OH)2沉淀,应调整溶液的pH 使之
大于________
(2) 要使0.2mol/LCuSO 4溶液中的Cu 2+沉淀较为完全(使Cu 2+浓度降低到原来的千分之一),
则应向溶液里加入NaOH 溶液,使溶液pH 为__________
巩固练习
1.下列事实不.
能用沉淀溶解平衡原理解释的是( ) A .误食可溶性钡盐,用硫酸钠溶液洗胃
B .除去硫酸铜溶液中的铁离子,可加Cu(OH)2,调节pH
C .在AgI 的沉淀体系中加硫化钠溶液,出现黑色沉淀
D .在配制FeCl 3溶液时,滴加少量盐酸
2.已知BaCO 3和BaSO 4均为难溶电解质,其溶度积分别为K sp (BaCO 3)=5.1×10-9 mol 2·L
-
2
,K sp (BaSO 4)=1.1×10-10 mol 2·L -2,则下列说法中正确的是( ) A .BaSO 4可做钡餐而BaCO 3不能是因为K sp (BaSO 4)<K sp (BaCO 3)
B .在制腈纶纤维的1 L 溶液中含SO 2-4为1.0×10-3mol ,则加入0.01 mol BaCl 2不能使SO 2-
4完全沉淀
C .在清理有关仪器的BaSO 4沉淀时,常加入饱和Na 2CO 3溶液,使BaSO 4转化为BaCO 3再用酸处理
D .用稀H 2SO 4洗涤BaSO 4效果比用水好,BaCO 3也能用此法处理
3.已知25 ℃时,电离度[c (HF )已电离c (HF )起始
]α(HF)=3.6×10-4,溶度积常数K sp (CaF 2)=1.46×10-
12,
现向1 L 0.2 mol·L -1HF 溶液加入1 L 0.2 mol·L -
1CaCl 2溶液,则下列说法中,正确的是( )
A .25 ℃时,0.1 mol·L -
1HF 溶液中pH =1 B .K sp (CaF 2)随温度和浓度的变化而变化
C .该体系中K sp (CaF 2)=1
α(HF )
D .该体系中有CaF 2沉淀产生
4.已知在pH 为4~5的环境中,Cu 2+、Fe 2+几乎不水解,而Fe 3+
几乎完全水解,工业上制CuCl 2是将浓盐酸用蒸气加热到80 ℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解,欲除去溶液中的杂质离子,下述方法中可行的是( )
A .加入纯Cu 将Fe 2+
还原为Fe
B .向溶液中通入H 2S 使Fe 2+
沉淀
C .向溶液中通入Cl 2,再通入NH 3,调节pH 为4~5
D .向溶液中通入Cl 2,再加入纯净的CuO 粉末调节pH
5.牙齿表面由一层坚硬的成分为Ca 5(PO 4)3OH 的物质保护着,它在唾液中存在下列平衡:Ca 5(PO 4)3OH(s)5Ca 2+
+3PO 3-
4+OH -
。
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是___________________________。
(2)已知Ca 5(PO 4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固。当牙膏中配有氟化物添加剂后能防止龋齿的原因是(用离子方程式表示)___________________________
___________________________。
(3)根据以上原理,请你提出另外一种促进矿化的方法:
___________________________。
6.(1)已知硫酸钡和碳酸钡的K sp分别为1.1×10-10mol2·L-2和5.5×10-9mol2·L-2,用平衡移动理论解释透视用“钡餐”选硫酸钡而不选碳酸钡的理由:___________________________ _______________________________________________________________________________ ______________________________________________________________________。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。如果溶液中[Ag+]、[Cl-]的乘积为一个常数,即K sp=1.0×10-10 mol2·L-2,试求:
①沉淀生成后溶液中[Ag+]为___________________________;
②沉淀生成后溶液的pH是________。
7.(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________________沉淀(填化学式),生成该沉淀的离子方程式为____________________________________________________。
已知25 ℃时K sp[Mg(OH)2]=1.8×10-11,K sp[Cu(OH)2]=2.2×10-20。
(2)与K W=[H+][OH-]类似,FeS饱和溶液中存在:FeS(s)Fe2+(aq)+S2-(aq),K sp=[Fe2+][S2-]。常温下K
=8.1×10-17(mol·L-1)2。
sp
①理论上FeS溶解度为___________________________。
②又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2·[S2-]=1.0×10-22,为了使溶液里[Fe2+]达到1 mol·L-1,现将适量酸倒入其饱和溶液中,应调节溶液中的c(H+)为________。
8.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
①HUr(尿酸,aq)Ur-(尿酸根,aq)+H+(aq)(37 ℃时,K a=4.0×10-6)
②NaUr(s)Ur-(aq)+Na+(aq)
(1)37 ℃时,1.0 L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的K sp为___________________________。
(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的K sp________(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。
(3)37 ℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,该病人尿液的c(H+)为____________,pH________7(填“>”、“<”或“=”)。
湖南理工学院2011年无机化学习题及答案第五章沉淀溶解平衡及在分析化学中的应用
第五章 沉淀溶解平衡记载分析花学中的应用 习题1 1 已知Ag 2CrO 4的溶解度为4.74g·L -1,求其溶度积K sp 解:Ag 2CrO 4的溶解度S= 4.74 / 331.74 = 0.0143 (mol/L), K sp = 4s 3 = 4×(0.0143)3 = 1.17×10-5 (题给条件有错) 2 已知Ca(OH)2的K sp =5.5×10-6,计算其饱和溶液的pH 值。 解:)L /mol (1011.1410 5.54K S 2363sp --?=?== c (OH -)= 2S = 2.22×10-2(mol/L) pOH - = 1.65 pH = 12.35 3 根据K sp 值计算下列各难溶电解质的溶解度:(1)Mg(OH)2在纯水中,(2)Mg(OH)2在0.01 mol·L -1 MgCl 2 溶液中,(3)CaF 2在pH=2的溶液中。 解:(1)43123sp 1012.1410 61.54K S --?=?== (mol·L -1) (2)设Mg(OH)2在0.01 mol·L -1 MgCl 2溶液中的溶解度为S -++?OH 2Mg )OH (Mg 22 0.1+S 2S K sp =(S+0.01)(2S)2=5.61×10 -12 ∵S+0.01≈0.01 ∴S=1.18×10-5 (mol·L -1) (3) CaF 2+2H +?Ca 2++2HF K j =2a sp 22222K K )F (c )F (c ) H (c )HF (c )Ca (c =??--++ 2410222)10 53.3(10 46.1)10()s 2(s ---??=? s≈3.08×10-3(mol·L -1) 4 欲从0.002 mol·L -1Pb(NO 3)2溶液中产生Pb(OH)2沉淀,问溶液的pH 至少为多少? 解:c (Pb 2+) = 0.002 mol/L , c (Pb 2+)c 2(OH -)> K sp 才能产生Pb(OH)2沉淀。 c 2(OH -)> K sp /c(Pb 2+) c 2(OH -)> 1.42×10-20/0.002 = 7.1×10-18 c (OH -)> 2.66×10-9(mol/L) pOH < 8.58 pH > 5.42 5下列溶液中能否产生沉淀?(1)0.02 mol·L -1 Ba(OH)2溶液与0.01 mol·L -1 Na 2CO 3溶液等体积混合,(2) 0.05 mol· L -1 MgCl 2溶液与0.1 mol·L -1氨水等体积混合,(3)在0.1 mol·L -1 HAc 和0.1 mol·L -1 FeCl 2混合溶液中通入H 2S 达饱和(约0.1mol·L -1)。 解: (1) 等体积混合浓度减半 c(Ba 2+)=0.01mol/L c(CO 32-)=0.005 mol/L Q B = c(Ba 2+)·c(CO 32-)=0.01×0.005=5×10-5 Q B >K sp (2.58×10-9) 故有BaCO 3沉淀生成 (2) c(OH -)==??= ?-5a 1077.105.0K c 9.41×10-4 mol/l c(Mg 2+)=0.025 mol/L Q B =c(Mg 2+)·c 2(OH -)=0.025×(9.41×10-4)2=2.21×10-8 Q B >K sp (5.61×10-12) 故有Mg(OH)2沉淀生成
第三节沉淀溶解平衡学案第二课时
第三节沉淀溶解平衡学案第二课时 【学习重点】掌握沉淀生成溶解和转化条件的应用。 【知识巩固】 1、Ksp意义:Ksp大小反映了 2、在一定温度下,难溶电解质存在如下沉淀溶解平衡:MmNn(s)mM n+ (aq)+ nN m-(aq)溶度积常数可以表示为: 【新知探究】 二、沉淀溶解平衡的应用 1、沉淀的溶解与生成 离子的浓度积Qc和Ksp的关系: 当Qc > Ksp时反应向方向进行,直到平衡状态(饱和为止)。当Qc = Ksp时反应 当Qc < Ksp时反应向方向进行,直到平衡状态(饱和为止)。 (1)沉淀的溶解 【问题探究】在进行胃部透视时,为取得良好的检查效果,需要在检查之前服用“钡餐”,“钡餐”的主要成分是硫酸钡。在25℃时,1L水中约能溶解2.33×10-3g 硫酸钡,它的溶度积常数Ksp=1.1×10-10 mol2·L-2。 钡离子是一种有毒的重金属离子,当人体中钡离子浓度达到2×10-3mol·L-1时,就会对健康产生危害。请通过计算说明用硫酸钡作为“钡餐”安全吗? 在25℃时,1L水中约能溶解0.018g 碳酸钡,且胃液是酸性的,能否用碳酸钡代替硫 酸钡作为“钡餐”的主要成分? 如果误食了可溶性钡盐,为什么用 5.0%的硫酸钠溶液洗胃,当SO42-浓度为多少时,人才安全? 【总结】沉淀溶解的常见方法 酸碱溶解法 如CaCO3溶于盐酸,离子方程式为_________________________________________。 如Al(OH)3溶于NaOH,离子方程式为______________________________________。 盐溶液溶解法
第七章 沉淀溶解平衡和沉淀滴定法习题及答案
第七章 沉淀溶解平衡和沉淀滴定法习题 1.是非判断题 1-1 CaCO 3和PbI 2的容度积非常接近,皆约为10-8,故两者饱和溶液中,Ca 2+及Pb 2+离子的浓度近似相等。 1-2用水稀释AgCl 的饱和溶液后,AgCl 的溶度积和溶解度都不变。 1-3只要溶液中I -和Pb 2+离子的浓度满足[c(I -)/c θ]2·[c(Pb 2+)/c θ]≥K SP (PbI 2),则溶液中必定会析出PbI 2沉淀。 1-4在常温下,Ag 2CrO 4和BaCrO 4的溶度积分别为2.0×10-12和1.6×10-10,前者小于后者,因此Ag 2CrO 4要比BaCrO 4难溶于水。 1-5 MnS 和PbS 的溶度积分别为1.4×10-15和3.4×10-28,欲使Mn 2+与Pb 2+分离开,只要在酸性溶液中适当控制pH 值,通入H 2S 。 1-6为使沉淀损失减小,洗涤BaSO 4沉淀时不用蒸馏水,而用稀H 2SO 4。 1-7一定温度下,AB 型和AB 2型难溶电解质,容度积大的,溶解度也大。 1-8向BaCO 3饱和溶液中加入Na 2CO 3固体,会使BaCO 3溶解度降低,容度积减小。 1-9 CaCO 3的容度积为2.9×10-9,这意味着所有含CaCO 3的溶液中,c(Ca 2+)=c(CO 32-),且 [c(Ca 2+)/c θ][c(CO 32-)/c θ]=2.9×10-9。 1-10同类型的难溶电解质,K sp θ较大者可以转化为K sp θ较小者,如二者K sp θ 差别越大,转化反应就越完全。 2.选择题 2-1在NaCl 饱和溶液中通人HCl(g)时,NaCl(s)能沉淀析出的原因是 A.HCl 是强酸,任何强酸都导致沉淀 B.共同离子Cl-使平衡移动,生成NaCl(s) C.酸的存在降低了()K NaCl SP 的数值 D.()K NaCl SP 不受酸的影响,但增加Cl-离子浓度,能使()K NaCl SP 减小 2-2对于A 、B 两种难溶盐,若A 的溶解度大于B 的溶解度,则必有 A.()()sp sp K A K B θθ> B.()()sp sp K A K B θθ< C.()()sp sp K A K B θθ ≈ D.不一定 2-3已知CaSO 4的溶度积为2.5×10-5,如果用0.01 mol ·L -1的CaCl 2溶液与等两的Na 2SO 4溶液混合,若要产生硫酸钙沉淀,则混合前Na 2SO 4溶液的浓度(mol ·L -1)至少应为 A.5.0×10-3 B.2.5×10-3 C.1.0×10-2 D.5.0×10-2 2-4 AgCl 与AgI 的sp K θ 之比为2×106,若将同一浓度的Ag +(10-5 mol ·L -1)分别加到具有相同氯离子和碘离子(浓度为10-5 mol ·L -1)的溶液中,则可能发生的现象是 A. Cl -及I -以相同量沉淀 B. I -沉淀较多 C. Cl -沉淀较多 D.不能确定
高中化学 第四节 难溶电解质的溶解平衡教案 新人教版选修4
第四节难溶电解质的溶解平衡 【教学目标】 1.认识什么是沉淀溶解平衡及沉淀溶解平衡是如何建立的,知道哪些外界条件会影响沉淀溶解平衡。 2.认识溶度积的概念,初步学会利用溶度积计算溶液中各离子的浓度。 3.知道沉淀溶解平衡有哪些应用,会用沉淀溶解平衡原理解决有关化学问题(如沉淀转化、沉淀生成等)。 【教学重点、难点】 运用溶度积规则判断分析沉淀的溶解、生成和沉淀的转化及沉淀溶解平衡在生产生活的应用。 【教学过程】 [设问1]:对于平衡AgCl(s)Ag++ Cl—,运用K sp与溶液中的离子积Qc的关系分析:增加C(Ag+)或C(Cl—),平衡为什么向生成沉淀的方向移动? 解析: Qc = C(Ag+) ﹒C(Cl—) Qc >Ksp时:平衡向生成沉淀的方向移动——有沉淀生成 Qc = Ksp时:平衡不移动 Qc ﹤Ksp时:平衡向沉淀溶解的方向移动——沉淀溶解 增加C(Ag+)或C(Cl—),平衡向生成沉淀的方向移动———同离子效应 三、沉淀溶解平衡的应用: [引言]:沉淀溶解平衡作为一种动态的平衡,我们可以通过改变条件,控制其进行的方向,沉淀转为溶液中的离子,或者溶液中的离子转化为沉淀。 1、沉淀的生成:
[归纳1]:当溶液中Qc >Ksp时,平衡向生成沉淀的方向移动——有沉淀生成,因而要使溶液中的某离子生成沉淀而除去,可增加能与之结合成更难溶物质的离子的浓度。 例1: AgCl的Ksp=1.80×10-10,将0.001 mol/L NaCl和0.001 mol/LAgNO3溶液等体积混合,是否有AgCl 沉淀生成? 解: 两溶液等体积混合后, Ag+ 和Cl—浓度都减小到原浓度的1/2. c(Ag+)=c(Cl—)=1/2×0.001mol/L=0.005mol/L 在混合溶液中,则C(Ag+)﹒c(Cl-)=(0.005)2=2.5 ×10-5>Ksp, 所以有AgCl 沉淀生成。 练习1:将足量BaCO3分别加入:①30mL 水②10mL 0.2mol/LNa2CO3溶液③50mL 0.01mol/L 氯化钡溶液④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为:_____ 2、沉淀的溶解 [归纳2]:根据溶度积原理,沉淀溶解的必要条件是溶液中离子积小于溶度积Ksp因此,创造一定条件,降低溶液中的离子浓度,使离子积小于其溶度积,就可使沉淀溶解. 1.生成难解离的物质使沉淀溶解 (1)金属氢氧化物沉淀的溶解 例如:Mg(OH)2(s) + 2HCl MgCl2 + 2 H2O Mg(OH) 2氢氧化物中的OH-,加入HCl后生成H 2O,C(OH-)降低,Qc (Mg(OH) 2)<Ksp (Mg(OH)2),于是沉淀溶解。 (2)碳酸盐沉淀的溶解 例如:CaCO3(s) +2HCl CaCl2 + CO2↑+ H2O CaCO3的CO32-与酸生成难解离的HCO3-,甚至CO2气体,加入HCl后,H+与溶液中
高中化学第三章物质在水溶液中的行为第节沉淀溶解平衡时测试题鲁科版选修
第三章物质在水溶液中的行为第3节沉淀溶解平衡第1课时一、选择题 1.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( ) A. K sp[Fe(OH)3]
第6章 沉淀溶解平衡
第6章 电解质溶液和非电解质溶液 一.强电解质溶液理论 (theory of strong electrolyte solution) (1) 离子氛和离子强度 强电解质在水溶液中是完全电离的,但由于本身带电荷,受周围带异号电荷离子吸引,存在着“离子氛”。 用I — 离子强度表示离子与“离子氛”之间的强弱,Z i 表示溶液中种i 离子的电荷数,b i 表示i 种离子的质量摩尔浓度,则 22 1i i i z b I ∑= ▲ 求0. 1 mol〃kg -1盐酸和0. 1 mol〃kg -1CaCl 2溶液等体积混合后形成的溶液的离子强度. (2) 活度和活度系数 指电解质溶液中离子实际发挥的浓度,称为有效浓度或活度。显然 a = f c 这里,a —活度,c —浓度,f —活度系数 ● Z 越高,I 较大,f 的数值越小 ● c 越大,I 较大,则 a 与 c 的偏离越大 ● c 很低,I 也很小,一般可近似认为f = 1.0,可用 c 代替 a 。一个适于 r 离子 半径 3×10 –8 cm , I < 0.1mol〃kg -1的半经验公式为: ∑?+?+?== ======- + + - ++---)115.0205.0105.0(2 1211,2,1,15.0, 05.0,05.02222 11122i i Cl Ca H Cl Ca H Z m I Z Z Z kg m ol m kg m ol m kg m ol m I I Z Z f +-= ±10509.0lg 21
二.难溶性强电解质的沉淀-溶解平衡(precipitation-dissolution equilibrium of hard-dissolved strong electrolyte) 1.溶度积常数和溶解度 (solubility product constant and solubility) (1) 溶解度 在一定温度和压力下,固液达到平衡时的状态。这时把饱和溶液里的物质浓度称为“溶解度”,常用S (单位mol/dm 3)表示. (2) 溶度积常数 A a B b (s) aA n+(aq) + bB m-(aq) K θsp =[A n+]a [B m-]b (3) 溶度积和溶解度的关系 以AgCl 和Ag 2CrO 4为例:前者为AB 型, S = AgX sp K , 后者为A 2B 或AB 2型,S = 3 4 sp K 两者之间有联系也有差别 ● 与溶解度概念应用范围不同,K θsp 只用来表示难溶电解质的溶解度; ● K θsp 不受离子浓度的影响,而溶解度则不同。 结论:(1) 相同类型K θsp 大的 S 也大; (2) 不同类型的比较要通过计算说明。 2.离子积和溶度积规则 (ion product and rule of solubility product) (1) Q i < K sp 不饱和溶液,无沉淀析出,若原来有沉淀存在,则沉淀溶解 (2) Q i = K sp 饱和溶液,处于平衡
第四节难溶电解质的溶解平衡知识点
第四节难溶电解质的溶解平衡 一、溶解平衡 1、难溶电解质的定义是什么?难溶物的溶解度是否为0?在20℃时电解质的溶解性 2、当 3 AgCl的饱和溶液? 3、难溶电解质(如AgCl)是否存在溶解平衡?仔细阅读、思考理解,并写出AgCl的 溶解平衡表达式。 4、特征:动、等、定、变 5、影响溶解平衡的因素: (1)内因:电解质本身的性质 ①、绝对不溶的电解质是没有的。 ②、同是难溶电解质,溶解度差别也很大。 ③、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。 (2)外因: ①浓度:加水,平衡向溶解方向移动。 ②温度:升温,多数平衡向溶解方向移动。 二、沉淀反应的应用 (1)沉淀的生成 ①沉淀生成的应用:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中, 常利用生成沉淀达到分离或某些离子的目的。 ②废水处理化学沉淀法工艺流程示意图 ③沉淀的方法 a调节PH法: b加沉淀剂法: 写出使用Na 2S、H 2 S作沉淀剂使Cu2+、Hg2+形成沉淀的离子方程式. (2)沉淀的溶解 ①沉淀溶解的原理: 例如CaCO 3 的溶解 ②沉淀溶解的实验探究(实验3-3)[讨论] a、为什么加入1ml盐酸沉淀溶解了?写出反应的化学方程式。 b、为什么加入过量的氯化铵溶液,沉淀也可以溶解?写出反应的化学方程式。(3)沉淀的转化 ①沉淀转化的实验探究(实验3-4) ③沉淀转化的应用 三、溶度积(K sp ) (1)概念: (2)表达式:对于沉淀溶解平衡M m A n Mm n+(aq)+Na m-(aq),K sp = (3) 溶度积常数的意义: ○1对于相同类型的电解质,K sp越大,其在水中的溶解能力越大。 ○2K sp 和S均可衡量物质在水中的溶解能力,只有相同类型的物质,才有K sp 越大S 越大的结论。 ○3同一物质的K sp与温度有关,与溶液中的溶质离子浓度无关。 (4)溶度积规则:比较K sp 与溶液中有关离子浓度幂的乘积(离子积Q c )判断难溶电解质在给定条件下沉淀能否生成或溶解。 Q c >K sp 时 Q c =K sp 时 Q c <K sp 时
人教版(2019)高二选择性必修第一册第三章水溶液中的离子反应与平衡第四节沉淀溶解平衡
人教版(2019)高二选择性必修第一册第三章水溶液中的离 子反应与平衡第四节沉淀溶解平衡 学校:___________姓名:___________班级:___________考号:___________ 一、单选题 1.某温度下向含AgCl 固体的AgCl 饱和溶液中加少量稀盐酸,下列说法正确的是 A .AgCl 的溶解度、K sp 均减小 B .AgCl 的溶解度、K sp 均不变 C .AgCl 的溶解度减小、K sp 不变 D .AgCl 的溶解度不变、K sp 减小 2.向含有MgCO 3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是 A .c(23CO - ) B .c(2+Mg ) C .c(H +) D .K sp (Mg 3CO ) 3.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 A .图中a 和b 分别为T 1、T 2温度下CdS 在水中的物质的量浓度 B .图中各点对应的K sp 的关系为:K sp (m)=K sp (n) A.A B.B C.C D.D 5.用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是() A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10 B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl) C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a D.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动 6.在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 高中化学学习材料 第三节 沉淀溶解平衡 酸碱中和滴定 1. 实验中许多量器的结构不一样,使用时要先了解其构造特点,才能尽可能地减少误差,晓明同学用某种仪 器量取液体体积时,平视时读数为n mL ,仰视时读数为x mL ,俯视时读数为y mL ,若x >n >y ,请你判断她所用的仪器是( ) A .量筒 B .滴定管 C .容量瓶 D .以上均不对 解析:仰视时读数在平视时读数的下面。量筒0刻度(无)在最下边,x 第七章沉淀溶解平衡和沉淀分析法 7.1 本章学习要求 1.了解沉淀滴定法和重量分析法的基本原理、主要步骤和应用 2.掌握难溶电解质的溶度积、溶解度与溶度积的关系、沉淀溶解平衡的特点和有关的计算 3.掌握沉淀生成和溶解的条件 7.2 内容概要 7.2.1 溶度积和溶解度 1.溶度积一定温度下,难溶电解质在其饱和溶液(saturated solution)中各离子浓度幂的乘积是一个常数,称为溶度积常数(solubility product constant),用符号K sp?表示。 对于难溶度电解质A m B n在水溶液中的沉淀溶解平衡(precipitation-dissolution equilibrium),可以表示为: A m B n(s) mA n+(aq)+nB m-(aq) K sp?=c m(A n+)c n(B m-) 2.溶度积和溶解度的关系溶度积K sp?和溶解度S的数值都可用来表示不同物质的溶解能力。但二者概念不同。溶度积K sp?是平衡常数的一种形式;而溶解度S则是浓度的一种形式,表示一定温度下1L难溶电解质饱和溶液(saturated solution)中所含溶质的量。二者可相互换算。K sp?与S的换算时,S的单位必须用物质的量浓度(mol·L-1或mol·dm-3)。 用溶度积直接比较时,必须是相同类型的难溶化合物。 7.2.2 溶度积规则 1.离子积难溶电解质溶液中,其离子浓度乘积称为离子积,用Q表示。如在A m D n溶液中,其离子积Q B=[c(A n+)/c?]m ·[c(D m-)/c?]n。显然Q与K sp?表达式相同,但K sp?表示的是难溶电解质处于沉淀溶解平衡时饱和溶液中离子浓度之积。一定温度下,某一难溶电解质溶液 沉淀溶解平衡教学设计 厦门大学附属实验中学欧昌友 一.教学目标 1.关注沉淀溶解平衡化学体系,深层次理解沉淀的生成、溶解等各种水溶液中的化学行为,掌握利用平衡常数定量分析的科学方法。 2.初步建立利用平衡常数定量判断沉淀生成的科学分析方法。结合实验探究,掌握平衡常数的理论和实际生产应用,并深刻认识到化学对指导生活、生产活动的重要意义。通过开放性实验,培养学生分析问题、解决问题的能力。 3.通过探究实验,激发学生求知的兴趣和理论联系实际的科学态度,培养学生学会探究、思考、合作、交流和创新的品质。通过对生产、生活中与沉淀溶解平衡有关的某些现象的讨论,使学生体会到化学对于提高人类生活质量、促进社会发展的作用,激发学生学习化学的热情。 二.教学重难点 (1)重点:掌握利用平衡常数来定量判断化学反应能否进行的这一学习方法。 (2)难点:如何通过实验探究,认识并应用平衡常数定量指导实际生活、生产中的化学过程。 三.教学思考 课堂教学设计的最终目的是促进学生的发展,如何围绕“化学核心素养”的提高,充分利用教学资源,采用适当的手段和方法,提高学生的学习兴趣,让学生主动参与,成功的完成教学。这是我们课前该独立思考的课题,我们当然可以借鉴别人的课堂设计,但由于地点、对象、以及备用资源的差异,我们有必要思考重整,独立设计。 新课程选修教材《化学反应原理》中的沉淀溶解平衡,是理论性较强的内容。教材中为了将理论变得易懂做了很多工作,举出了许多跟现实有联系的例子。我们是照本宣科呢?还是将其重整,使我们在教学过程中更连贯、更易调动学生的积极性。为此,在教学构想中我提出如下三个调整。 1.利用特别的溶洞奇观引入新课,而将水垢中Mg(OH)2怎样生成以及用FeS处理水中的Cu2+、Hg2+、Pb2+等向后移。 2.将两次“观察与思考”进行整合,利用生成的ZnS沉淀,分成两部分,一部分用来探究沉淀溶解平衡的存在,一部分用来证实沉淀的转化。 3.将一部分沉淀溶解平衡的应用(如食醋除水垢等)提到讲溶度积之前,在第1课时中加强与前面所学化学平衡知识的联系,相当于先定性解释其原理,为后面利用Qc和Ksp定量解释其原理打下基础。 四.教学过程框架设计 第三节沉淀溶解平衡学案 高三化学组2008、12、15 【考纲要求】了解难溶电解质的溶解平衡 【知识梳理】 一、沉淀溶解平衡与溶度积 1、沉淀溶解平衡:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成饱和溶液,达到平衡状态,这种平衡称为沉淀溶解平衡。 2、溶度积常数(溶度积):描述沉淀溶解平衡的常数,用Ksp表示。 [练习1] 写出AgCl、Fe(OH)3、Ag2SO4的沉淀溶解平衡及其Ksp的表达式。 AgCl Fe(OH)3 Ag2SO4 3、溶度积的影响因素 内因:与难溶电解质的性质有关。 外因:它只与温度与沉淀的量(填有关或无关)。 (1)绝大多数难溶盐的溶解是吸热过程。(2)加入电解质离子抑制沉淀的溶解 例1:下列对沉淀溶解平衡的描述正确的是() A、反应开始时,溶液中各离子浓度相等。 B、沉淀溶解平衡达到平衡时,沉淀的速率和溶解的速率相等 C、沉淀溶解平衡达到平衡时,溶液中溶质的离子浓度相等,且保持不变。 D、沉淀溶解平衡达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解。 例2:下列说法中正确的是() A、物质的溶解性为难溶,则该物质不溶于水 B、不溶于水的物质溶解度为0 C、绝对不溶解的物质是不存在的 D、某粒子被沉淀完全是指该粒子在溶液中的浓度为零 例3、在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中() A.[Ba2+]=[SO42-]= Ksp ? B. [Ba2+]·[SO42-]>Ksp [Ba2+] = [SO42-] C. [Ba2+]·[SO42-] =Ksp [Ba2+]>[SO42-] D. [Ba2+]·[SO42-]≠Ksp [Ba2+]<[SO42-] 例4、有关AgCl沉淀的溶解平衡,正确的说法是() A. AgCl 沉淀的生成和溶解不断进行,但速率相等 B. AgCl难溶于水,溶液中没有Ag+和Cl- C.升高温度,AgCl沉淀的溶解度增大 D.向AgCl沉淀中加入NaCl固体,其溶解度不变 4、Ksp的意义:反映了难溶电解质在水中的溶解能力。 注意:(1)溶液中离子浓度改变时能使平衡移动而Ksp不变。 (2)不能仅根据Ksp的大小比较溶解能力的强弱。只有当化学式所表示的组成中阴、阳离子个数比相同时,Ksp数值越大,溶解能力越强。 如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI) 溶解度: AgCl> AgBr> AgI (3)溶解度也能反映物质的溶解能力,溶解度的大小不仅受温度的影响,还受离子浓度的影响。 例5、将足量AgCl分别溶于下列试剂中形成AgCl饱和溶液,沉淀溶解平衡表示式为:AgCl (s) Ag++ Cl-,AgCl的K sp=1.76×10-10 mol2·L-2 ①5ml水②10ml0.2mol·L-1MgCl2③20 ml0.5 mol·L-1NaCl ④40ml0.1 mol·L- 1AlCl3⑤20 ml0.3 mol·L-1AgNO3溶解至饱和,各溶液中Ag+浓度由大到小的顺序是,AgCl的溶解度由大到小的顺序是。 二、沉淀溶解平衡的应用 判据:QcKsp 沉淀溶解 QcKsp 处于沉淀溶解平衡状态 QcKsp 沉淀生成 5、沉淀的生成 (1) 误食可溶性钡盐,会造成钡中毒,应尽快用5.0%的Na2SO4溶液洗胃,这是因为服用Na2SO4溶液后,QcKsp (>、<、=), Ba2+与SO42-结合生成沉淀。 (2) 可用Na2S、NaHS、(NH4)2S、H2S等作为沉淀剂,除去废水中的Cu2+, Hg2+, Pb2+等,写出用(NH4)2S除去Hg2+、Na2S除去Cu2+的离子方程式, 。 6、沉淀的溶解 (1)BaSO4 和BaCO3溶解能力相差不大,为什么钡餐透视选用BaSO4而不用BaCO3 ? 第五章 沉淀溶解平衡 复习题 一、选择题 1.用佛尔哈德返滴定法测定Cl -时,试液中先加入过量的硝酸银,产生氯化银沉淀,加入硝基苯等保护沉淀,然后再用硫氰酸盐进行滴定。若不加入硝基苯等试剂,分析结果会( )。 A 、偏高 B 、偏低 C 、准确 2.荧光黄的710-≈a K ,曙红的210-≈a K ,用法扬司法测定Br -时,若滴定液的pH≈5,选择哪种指示剂为宜?( ) A 、曙红 B 、荧光黄 C 、两者都可以 3.用法扬司法测定Cl -时,用曙红为指示剂,分析结果会( )。 A 、偏高 B 、偏低 C 、准确 4.在pH≈4时,用莫尔法测定Cl -时,分析结果会( )。 A 、偏高 B 、偏低 C 、准确 5.化合物Ag 2CrO 4在0.001mol·dm -3的AgNO 3溶液中的溶解度比在0.001mol·dm -3的K 2CrO 4溶液中的溶解度( )。 A 、较大 B 、较小 C 、一样 6. 以铁铵矾为指示剂,用NH 4CNS 标准溶液滴定Ag +时,应在下列哪种条件下进行? A. 酸性; B .弱酸性; C .中性;D .弱碱性; 7. 下列哪条违反了非晶形沉淀的沉淀条件? A .沉淀作用宜在较浓的溶液中进行. B .沉淀作用宜在热溶液中进行; C .在不断搅拌下,迅速加入沉淀剂; D .沉淀宜放置过夜,使沉淀熟化; 8. 下列哪些要求不是重量分析对称量形式的要求: A .组成要与化学式完全符合 B .相对分子质量要大 C .颗粒要粗大 D .要稳定 9. 以SO 42-沉淀Ba 2+时,加入适量过量的SO 42-可以使Ba 2+离子沉淀更完全。这是利用 A .盐效应; B .酸效应; C .共同离子效应 D .溶剂化效应; 10. 以H 2SO 4作为Ba 2+的沉淀剂,其过量的适宜百分数为: A .10%; B .10~20% C.20~50%; D .50~100%; E.100~200%1-274重量 11. 分析中使用的“无灰滤纸”,是指每张滤纸的灰分重量为: A.没有重量 B .<0.2mg ; C .>0.2mg ;D .等于2mg 高中化学学习材料 第三章第四节沉淀溶解平衡 建议用时实际用时满分实际得分45分钟100分 一、选择题(每小题8分,共64分) 1.有关AgCl的沉淀溶解平衡的说法正确的 是() A.AgCl沉淀生成和溶解在同时不断进行, 且速率相等 B.AgCl难溶于水,溶液中没有Ag+和Cl- C.只要向含有AgCl的饱和溶液中加入盐 酸,一定会有沉淀生成 D.向含有AgCl的悬浊液中加入NaBr固体, AgCl沉淀不变化 2.向饱和BaSO4溶液中加水,下列叙述正确 的是() A.BaSO4溶解度增大、K sp不变 B.BaSO4溶解度、K sp均增大 C.BaSO4溶解度不变、K sp增大 D.BaSO4溶解度、K sp均不变 3.下列说法不正确的是() A. K sp只与难溶电解质的性质和温度有关 B.由于K sp(ZnS)>K sp(CuS),所以ZnS沉 淀在一定条件下可转化为CuS沉淀 C.其他条件不变,离子浓度改变时, K sp不 变 D.两种难溶电解质作比较时, K sp小的,溶 解度一定小 4.已知溶液中存在平衡:Ca(OH)2(s)Ca2 +(aq)+2OH-(aq)ΔH<0,下列有关该 平衡体系的说法正确的是() ①升高温度,平衡逆向移动 ②溶液中c(Ca2+)·c2(OH-)恒为定值 ③向溶液中加入少量碳酸钠粉末能增大 c(Ca2+) ④除去氯化钠溶液中混有的少量Ca2+,可 以向溶液中加入适量的NaOH溶液 ⑤恒温下,向饱和溶液中加入CaO,溶液的 pH升高 ⑥给溶液加热,溶液的pH升高 ⑦向溶液中加入Na2CO3溶液,其中固体质 量增加 ⑧向溶液中加入少量NaOH固体, Ca(OH)2固体质量不变 A.①⑦ B.①②⑦⑧ C.③④⑤⑦ D.①③⑦⑧ 5.已知室温下,Al(OH)3的K sp或溶解度远大 于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3 )3和Al(NO3 )3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是() A B 第七章 沉淀溶解平衡和沉淀滴定分析 (一)选择题 1. 难溶A 2B 的水溶液中有下列平衡A 2B(s) = 2A +aq + B 2-(aq ) ,若平衡时[A +]=x, [B 2+]=y,则难溶物的Ksp 的值可表示为( )。 A. Ksp=212 x ? B. Ksp=x .y C. Ksp=2x y ? D. Ksp=22()x y ? 2. Mg (OH )2在0.1mol .L -1NaOH 溶液中的溶解度(mol .L -1)为( )。 A. 2Mg(OH)10SP K B. 2Mg(OH)100SP K C. 2Mg(OH)200SP K D. 2Mg(OH)400SP K 3. 在AgCl 和Ag 2CrO 4 沉淀共存的溶液中,有关离子浓度与溶度积存在的正确关系是( )。 A. 24,24,Ag CrO []/[CrO ]SP AgCl SP K Cl K --= B. 2424,,Ag CrO ,Ag CrO [][] SP AgCl SP SP K Cl K K -= C. 24,224,Ag CrO []/[CrO ]SP AgCl SP K Cl K --= D. 24[]/[CrO ]Cl --= 4. 25℃时,CaF 2 的饱和溶液浓度为41210mol L --??。则CaF 2 在该温度下溶度积常数Ksp 为( )。 A. 8810-? B. 113.210-? C. 8410-? D. 12810 -? 5. 20℃时,难溶电解质Ca(OH)2 的Ksp=6410-?在该温度下它的饱和水溶液中OH - 离子浓度是( )。 A. 21110mol L --?? B. 312.910mol L --?? C. 21210mol L --?? D. 31410mol L --?? 6. 已知AgCl 的Ksp=101.810 -?,Ag CrO 24的Ksp=121.110-?,若在1升含有浓度约为0.051mol L -?的Cl -和CrO 42-的水溶液中,逐滴滴入0.1 1mol L -?的AgNO 3溶液,则( )。 A. Ag CrO 24 先沉淀 B. AgCl 先沉淀 C.二者同时沉淀 D.二者均不会沉淀 7.难溶电解质Ag CO 23在20℃时Ksp=12410-?,Ag CO 23 在20℃时饱和溶液中Ag +浓度为( )1mol L -?。 A. 51.610-? B. 62.810-? C. 41.010-? D. 4 2.010-? 8. 难溶电解质A 3B 的饱和溶液中[A +]=x 1mol L -?,[B 3-]=y 1mol L -?,则A 3BKsp 的表达式为( )。 A. xy 3 B. x(3y)3 C. x 3y D. xy 2 9. 在下列体系中,难溶电解质溶解度最大的是( )。 高中化学学习材料 (精心收集**整理制作) 第三章第四节沉淀溶解平衡 建议用时实际用时满分实际得分45分钟100分 一、选择题(每小题8分,共64分) 1.有关AgCl的沉淀溶解平衡的说法正确 的 是() A.AgCl沉淀生成和溶解在同时不断 进行,且速率相等 B.AgCl难溶于水,溶液中没有Ag+和 Cl- C.只要向含有AgCl的饱和溶液中加 入盐酸,一定会有沉淀生成 D.向含有AgCl的悬浊液中加入NaBr 固体,AgCl沉淀不变化 2.向饱和BaSO4溶液中加水,下列叙述 正确的是() A.BaSO4溶解度增大、K sp不变 B.BaSO4溶解度、K sp均增大 C.BaSO4溶解度不变、K sp增大 D.BaSO4溶解度、K sp均不变 3.下列说法不正确的是() A.K sp只与难溶电解质的性质和温度 有关 B.由于K sp(ZnS)>K sp(CuS),所以 ZnS沉淀在一定条件下可转化为 CuS沉淀 C.其他条件不变,离子浓度改变时, K sp不变 D.两种难溶电解质作比较时,K sp小 的,溶解度一定小 4.已知溶液中存在平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)ΔH<0,下列有关该平衡体系的说法正确的是() ①升高温度,平衡逆向移动 ②溶液中c(Ca2+)·c2(OH-)恒为定 值 ③向溶液中加入少量碳酸钠粉末能增 大 c(Ca2+) ④除去氯化钠溶液中混有的少量Ca2 +,可以向溶液中加入适量的NaOH溶液 ⑤恒温下,向饱和溶液中加入CaO, 溶液的pH升高 ⑥给溶液加热,溶液的pH升高 ⑦向溶液中加入Na2CO3溶液,其中 固体质量增加 ⑧向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 A.①⑦ B.①②⑦⑧ C.③④⑤⑦ D.①③⑦⑧ 5.已知室温下,Al(OH)3的K sp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3 )3和Al(NO3 )3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是() 内蒙古农业大学理学院普通化学教案 第六章沉淀溶解平衡(4学时) §6.1 难溶电解质的溶度积 6.1.1溶度积原理 溶度积常数 沉淀-溶解平衡是当溶解和结晶速度相等时建立的平衡,是一种动态平衡。 AgCl(s) Ag+ + Cl- 此时的溶液是饱和溶液,它是多相平衡。其平衡关系为: Kθ(AgCl) =c(Ag+)·c(Cl- ) SP Kθ称为溶度积常数,简称溶度积。它反应了物质的溶解能力。 SP 难溶电解质溶度积常数通式: AmBn mA n++ nB m- Kθ=c(A n+)m·c(B m-)n SP m、n分别代表电离方程式中A、B离子的化学计量数。 溶解度常数的意义:一定温度下,难溶强电解质饱和溶液中离子浓度的系数次方之积为一常数。 例如:PbCl2(s) Pb2+(aq) + 2Cl-(aq) Kθ=c(Pb2+)·c(Cl-)2 SP Fe(OH)3 Fe3+ + 3OH- ; Kθ=c(Fe3+)·c(OH-)3 SP 注意: 1)SP K θ 是一个与浓度无关的常数,溶度积常数与其他一切化学平衡常 数一样,其大小决定于难溶电解质的本质,即不同难溶电解质在一 定的温度下有其特定的SP K θ 值。 2)SP K θ受温度的影响不大。 3)SP K θ表示了难溶电解质在水中溶解程度的大小。 4)SP K θ指的是溶解过程的平衡常数,沉淀过程的平衡常数是1/ SP K θ。 5)SP K θ只适用于难溶电解质溶液,不适用于易溶电解质溶液。 6.1.2溶度积与溶解度 1)难溶电解质在纯水中的溶解度 溶度积与溶解度都可表示物质的溶解能力,但它们既有区别又有联系。 一定温度下饱和溶液的浓度,也就是该溶质在此温度下的溶解度。若溶质AmBn 的溶解度为S ,单位为mol ?L -1, 那么:AmBn mA n+ + nB m- c(A n+ )= mS ; c(B m-) = nS SP K θ =c(Ms)m ·c(Ns)n = m m n n C(S)m+n 例:已知AgCl 、Ag 2CrO 4的溶度积,求AgCl 、Ag 2CrO 4的溶解度。 解:查表可知:AgCl 的SP K θ=1.77х10-10,Ag 2CrO 4的SP K θ =1.12х10-12 AgCl(s) Ag + + Cl - S S SP K θ=c(Ag +)·c(Cl -)= S 2 = 1.77х10-10 S AgCl = = х10-5 mol ?L -1 上式为AB 型(1:1)溶解度计算式,同理可导出AB 2和A 2B 型: S(Ag 2CrO 4)= =6.54х10-5 mol ?L -1 注意: 相同类型的难溶电解质,可以通过溶度积数据直接比较溶解度大小,SP K θ 越 大S 越大。 不同类型,不可直接比较,通过计算说明。 严格讲SP K θ 是平衡时的活度之积。因为难溶盐的饱和溶液的浓度肯定非常鲁科版高中化学选修四第三节 沉淀溶解平衡 酸碱中和滴定
第七章 沉淀溶解平衡和沉淀分析法
沉淀溶解平衡教学设计
高三化学--沉淀溶解平衡讲
第五章 沉淀溶解平衡 复习题
人教版高中化学选修四第三章第四节++沉淀溶解平衡.docx
沉淀溶解平衡和沉淀滴定分析题库解读
【重点推荐】人教版高中化学选修四第三章第四节++沉淀溶解平衡
第六章 沉淀溶解平衡
