徐州工程学院物化10年试卷-B-下册
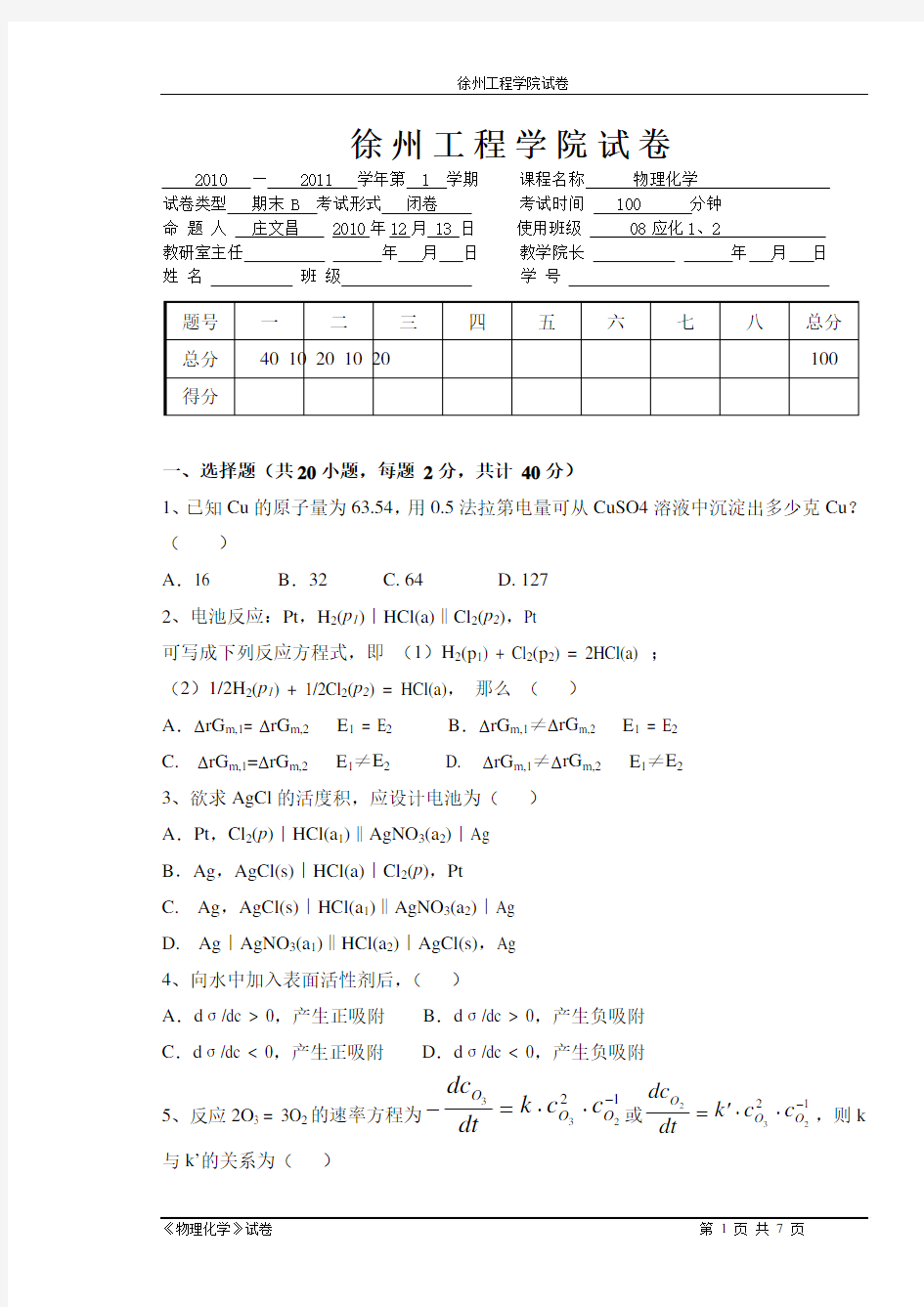

徐州工程学院试卷 2010 — 2011 学年第 1 学期 课程名称 物理化学 试卷类型 期末 B 考试形式 闭卷 考试时间 100 分钟 命 题 人 庄文昌 2010年12月 13 日 使用班级 08应化1、2 教研室主任 年 月 日 教学院长 年 月 日 姓 名 班 级 学 号 一、选择题(共20小题,每题 2分,共计 40分)
1、已知Cu 的原子量为63.54,用0.5法拉第电量可从CuSO4溶液中沉淀出多少克Cu ? ( )
A .16
B .32 C. 64 D. 127
2、电池反应:Pt ,H 2(p 1)|HCl(a)‖Cl 2(p 2),Pt
可写成下列反应方程式,即 (1)H 2(p 1) + Cl 2(p 2) = 2HCl(a) ;
(2)1/2H 2(p 1) + 1/2Cl 2(p 2) = HCl(a), 那么 ( )
A .ΔrG m,1= ΔrG m,2 E 1 = E 2
B .ΔrG m,1≠ΔrG m,2 E 1 = E 2
C. ΔrG m,1=ΔrG m,2 E 1≠E 2
D. ΔrG m,1≠ΔrG m,2 E 1≠E 2
3、欲求AgCl 的活度积,应设计电池为( )
A .Pt ,Cl 2(p )|HCl(a 1)‖AgNO 3(a 2)|Ag
B .Ag ,AgCl(s)|HCl(a)|Cl 2(p ),Pt
C. Ag ,AgCl(s)|HCl(a 1)‖AgNO 3(a 2)|Ag
D. Ag |AgNO 3(a 1)‖HCl(a 2)|AgCl(s),Ag
4、向水中加入表面活性剂后,( )
A .d σ/dc > 0,产生正吸附
B .d σ/dc > 0,产生负吸附
C .d σ/dc < 0,产生正吸附
D .d σ/dc < 0,产生负吸附
5、反应2O 3 = 3O 2的速率方程为12233???=?
O O O c c k dt dc 或1223
2???′=O O O c c k dt dc ,则k 与k’的关系为( ) 题号
一 二 三 四 五 六 七 八 总分 总分
40 10 20 10 20 100 得分
A.k = k’ B.3k = 2k’
C. 2k = 3k’
D. -k/2 = k’ /3
6、某反应的速率常数为0.099 min-1,反应物初始浓度为0.2 mol·L-1,则反应的半衰期为()
A.7 min B.1.01 min C. 4.04 min D. 50.5 min
7、基元反应的级数()
A.总是小于反应分子数B.总是大于反应分子数
C. 总是等于反应分子数
D. 有可能与反应分子数不一致
8、某反应的速率常数k=0.214 min-1,反应物浓度从 0.21 mol·L-1变到0.14 mol·L-1的时间为t1;从0.12 mol·L-1变到0.08 mol·L-1的时间为t2,那么 t1:t2等于()A.0.57 B.0.75 C. 1 D. 1.75
9、下面活化能为0的反应是()
A.A·+ BC = AB + C·B.A·+ A·+ M = A2+ M
C. A2+ M = 2A ·+ M
D. A2 + B2 = 2AB
10、Arrhenius公式适用于()
A.一切复杂反应B.一切气相中的复杂反应
C. 基元反应
D. 具有明确反应级数和速率常数的所有反应
11、H2O2分解成H2O和O2反应的活化能为75.3 KJ·mol-1,用酶作催化剂则活化能降为 25.1 KJ·mol-1,此时其反应速率大致改变了( )
A.5×104倍B.5×1010倍 C. 6×1010倍 D. 6×108倍
12、某反应A→Y,速率常数为6.93 min-1,反应物A的浓度从0.1 mol·L-1变到0.050.1 mol·L-1所需的时间为()
A.0.2 min B.0.1 min C. 1 min D. 2 min
13、稀的砷酸溶液中通入H2S制备As2S3溶胶,H2S适当过量,则胶团结构为()A. [(As2S3)m·nH+,(n-x)HS—]x+·xHS—
B. [(As2S3)m·nHS—,(n-x)H+]x-·xH+
C. [(As2S3)m·nH+,(n-x)HS—]x-·xHS—
D. [(As2S3)m·nHS—,(n-x)H+]x+·xHS-
14、关于ζ-电势,描述错误的是()
A.是指胶粒的相对运动边界与液体内部的电位差
B.其值随外加电解质而变化
C. 其值一般高于热力学电势
D. 有可能因外加电解质而改变符号
15、大分子溶液分散质的粒子尺寸为()
A.> 1μm B.< 1 nm C. 1 nm ~ 1μm D. > 1 mm
16、向碘化银正溶胶中滴加过量的KI溶液,生成的新溶胶在外加直流电场中的移动方向为()
A.向正极移动B.向负极移动 C. 不移动 D.无法确定
17、下面属于水包油型乳状液(O/W型)基本性质之一的是( )
A.易于分散在油中B.导电性强
C. 导电性弱
D. 乳化剂的特点是亲油性强
18、在相同的温度及浓度下,同一高分子化合物在良性溶剂中与在不良性溶剂中其散射强度是()
A. 在良性溶剂中的散射强度大于在不良性溶剂中的散射强度
B. 在良性溶剂中的散射强度小于在不良性溶剂中的散射强度
C. 在良性溶剂中的散射强度等于在不良性溶剂中的散射强度
D. 无法确定
19、在等电点上,两性电解质(如蛋白质、血浆等)和溶胶在电场中()
A.向正极移动 B. 向负极移动
C.不移动 D.无法确定
20、使用明矾KAl(SO4)2·12H2O来净水,主要是利用()
A. 胶体的特性吸附
B. 电解质的聚沉作用
C. 溶胶之间的相互作用
D. 高分子的絮凝作用
二、判断题(共10小题,每题 1 分,共计10 分)
1、对于电池Ag|AgNO3(b1)|AgNO3(b2)|Ag,b较小的一端为负极。()
2、在一定温度下稀释电解质溶液,摩尔电导率Λm肯定增大,而电导率κ的变化不一定。
()
n只能是正值。()3、吉布斯所定义的“表面过剩物质的量”σ
4、液体表面张力的存在力图扩大液体的表面积。 ( )
5、催化剂能改变反应历程,降低反应活化能,但不改变反应的标准摩尔反应吉布斯函
数。 ( )
6、一级反应一定是单分子反应。 ( )
7、对二级反应,反应物转化率相同时,若反应物的初始浓度越低,则所需时间越短。( )
8、过量电解质的存在对溶胶起稳定作用,少量电解质的存在对溶胶起破坏作用。 ( )
9、乳状液必须有乳状剂存在才能稳定。 ( )
10、在外加直流电场中,AgI 正溶胶的胶粒向负电极移动,其扩散层向正电极移动。( )
三、填空题(共 10 小题,每题2分,共计 20 分)
1、无限稀释的HCl 、KCl 、NaCl 三种溶液,在相同温度、相同浓度、相同电场强度下,
溶液中Cl —的迁移速率 ,迁移数 。(相同或不同)
2、在一定温度下,使电池 Pt |H 2(g ,p 1)|H +(a )|H 2(g ,p 2)|Pt 的电动势为正值,则
必须是氢电极中H 2的分压p 1 p 2 。(>,<,=)
3、在298.15K 时,已知 Cu e Cu ?→?+?+22,V E 337.01=Θ;
Cu e Cu ?→?+?+,V E 337.02
=Θ; 那么+?+?→?+Cu e Cu 2,Θ3E = V 。
4、在一定的T 、p 下,向纯水中加入少量表面活性剂。表面活性剂在溶液表面层中的浓
度将 其在溶液本体的浓度,此时溶液的表面张力 纯水的表面张力。(填写>,<,=)
5、爆炸反应有 和 两种。
6、已知某反应的反应物无论其初始浓度c A,0是多少,转化率为0.66时所需要的时间均
相同,则此反应为 级反应。
7、温度为500K 时,某理想气体恒容反应的速率常数k c = 20 mol -1·L ·s -1。则此反应用
压力表示的反应速率常数k p = 。
8、溶胶的电学性质有:由于外加电场作用而产生的 和 ;由于外加压
力或自身重力作用而流动或沉降而产生的 和 。 9、乳状液的类型可分为 ,其符号为 和 ,其符号
为 。
10、电解质Na2SO4、MgCl2、AlCl3对某溶胶的聚沉值分别为148、12.5和0.17,则该溶
胶带电荷。
四、简答题(共 2 小题,每题5分,共计 10 分)
1、总级数为零的反应可能是基元反应么?解释原因。
2、影响胶粒电泳速率的主要因素有哪些?电泳现象说明什么问题?
五、计算题(共 2 小题,每题10分,共计20 分)
1、 在定温300K 的密闭容器中,发生如下气相反应:A (g )+B (g )→Y (g )测知其
速率方程为
B A A d d p kp t
p =? 假定反应开始只有A (g )和B (g )(初始体积比为1:1),初始总压力为200 kPa ,设反应进行到10 min 时,测得总压力为150 kPa ,则该反应在300 K 时的反应速率系(常)数为多少?再过10 min 时容器内总压力为多少?
2、等容气相反应A →Y 的速率系(常)数k 与温度T 具有如下关系式:
( 1 ) 计算此反应的活化能;
( 2 ) 欲使A 在10min 内转化率达到90%,则反应温度应控制在多少?
()19622
ln /s 24.00/K
k T ?=?
四川大学物理化学期末考试题及答案(B卷)
四川大学期末考试试题 (2010—2011学年第一学期) 课程代码:(Ⅰ)—1 课程名称:物理化学任课教师:李泽荣、何玉萼适用专业:化学、应化、材化专业印数:200份班级:学号:姓名:成绩 注:1、试题字迹务必清晰,书写工整。本卷3页,本页为第1页 2、题间不留空,一般应题卷分开教务处试题编号: 3、务必用16K纸打印
注:1、试题字迹务必清晰,书写工整。本卷3页,本页为第2页 2、题间不留空,一般应题卷分开教务处试题编号: 3、务必用16K纸打印 2200 2400 2300 t/℃ a
注:1、试题字迹务必清晰,书写工整。本卷3页,本页为第3页 2、题间不留空,一般应题卷分开教务处试题编号: 3、务必用16K纸打印 2010级物理化学(Ⅰ)-1期末考试题B卷答案
一、选择题(12分,每题2分) 1、B 2、A 3、B 4、C 5、C 6、D 二、填空题(20分,每空2分) 1、> ;> ;> ;= 2、 3、 ; 4、1 ;2 5、y A >0,B x >x A ;纯A ;纯B 6、- 三、(16分) 解:33.3kJ R P vap m Q Q H n H ==?=?= 4分 kJ 2.32.383324.81)(=??==≈?=nRT pV V p W g R 2分 kJ 1.302.33.33=-=+=?W Q U 2分 1-3vap K J 9.862 .383103.33?=?=?==?b m R T H T Q S 体 2分 -186.9J K R Q Q S T T ?==-=-?环环 2分 0R R G H T S Q Q ?=?-?=-= 2分 kJ 2.3-=-=-?=?-?=?R R W Q U S T U F 2分 四、(12分) 解: ∵ A A B B P x P x P ** +=总 ∴ 13 78.844 A B P P **+= 6分 1182.722 A B P P **+= 联立求解得 kPa P A 5.90=* 6分 kPa P B 9.74=* 五、(20分) 解:1.(7分) 2.
物理化学下册试题及答案
OO六一二og 学年第一学期期末考试 物理化学试题A卷 注意:学号、姓名和所在年级班级不写、不写全或写在密封线外者,试卷作废—*.计算题。(本大题6分) 将某电导池盛以0.02 mol dm3 KC l溶液(25C时其电导率为0.277 S m1), 在25C 时测得其电阻为82.4 Q,再换用0.005 mol dm 3K2SO溶液,测得其电阻为326.0 Q。求: (1) 电导池常数K(l/A); (2) KSO溶液的电导率; (3) KSO溶液的摩尔电导率 二. 问答题。请回答下列各题。(本大题4分) 在进行重量分析实验时,为了尽可能使沉淀完全,通常加入大量电解质 (非沉淀剂),或将溶胶适当加热,为什么?试从胶体化学观点加以解释。 三. 计算题。请计算下列各题。(本大题10分) 均相反应2A+B3Y+Z在一定温度体积下进行,测得动力学数据如下: 其中C A,0及C B,0分别表示A及B的初始浓度;A,0表示A的初始消耗速率,即,假定反应速率方程的形式为 (1) 确定分级数,的值和总反应级数; (2) 计算反应的活化能。 四. 计算题。请计算下列各题。(本大题6分) CH 4气相热分解反应2CHGR +H2的反应机理及各元反应的活化能如下:
已知该总反应的动力学方程式为: 试求总反应的表观活化能。 五. 计算题。请计算下列各题。 (本大题8分) 下列电池的电动势在 25C 时为1.448 V : Pt | H 2 ( p ) | HCl ( b=0.1 mol - kg -1, =0.796 ) |Cl < p ) | Pt (1) 写出电极反应和电池反应; (2) 计算氯电极的标准电极电势 E (Cl |Cl 2 |Pt )。 六. 推导题。(本大题6分) 气相反应2A(g) Y(g), 是二级反应,反应开始时只有A ,压力为p”, 试推导反应系统的总压力p 与时间t 的函数关系式。 七. 选择题。在题后括号内,填上正确答案代号。(本大题共 22小题,总计60分) 1、 (3分)在等温等压下影响物质的表面吉布斯函数的因素:( ) (1) 是表面积A; (2)是表面张力 ; (3) 是表面积A 和表面张力 ;(4)没有确定的函数关 系。 2、 (3分)弯曲液面的饱和蒸气压总大于同温度下平液面的蒸气压。是不是 ? 3、 (2分)微小颗粒物质的熔点 与同组成大块物质的熔点 的关系是:( ) (1) ; (2) = ; (3) ; (4)不能确定。 4、 (4分)朗缪尔等温吸附理论的基本假设为: (2) CH CH 3- +H- E I =423 kJ -mol CH + CH4GH +H- 日=201 kJ -mol -+ CH 4 CH 3- +H E 3=29 kJ -mol -+ CH 3- CH 4 E -i =0 kJ -mol (D
徐州工程学院试卷
徐州工程学院试卷
经济体制 C、把我国建设成为富强、民主、文明的社会主义现代化国家 D、超过西方发达国家 7、社会主义法制的基本要求是( ) A.有法可依、有法必依、执法必严、违法必究 B.法律面前人人平等 C.将社会主义民主制度化、法律化 D.必须使每一个公民都增强法制观念 8、建设和谐文化,是构建社会主义和谐社会的重要任务。建设和谐文化的根本是() A、诚信友爱 B、以人为本 C、社会主义核心价值体系 D、社会主义荣辱观 9、构建社会主义和谐社会与全面建设小康社会的关系是() A、两者是并列的 B、两者同时实现同时完成 C、构建社会主义和谐社会既是全面建设小康社会的重要内容,也是全面建设小康社会的重要条件 D、全面建设小康社会既是构建社会主义和谐社会的重要内容,也是构建社会主义和谐社会的重要条件 10、新时期我军建设的总目标是( ) A、革命化、现代化、 B、现代化、正规化
C、现代化、革命化、政治化 D、革命化、现代化、正规化 二、多项选择题(共10题,每小题2分,共20分。下列每题给出的四个选项中,至少有两个选项是符合试题要求的)。 1、毛泽东概括的中国共产党新的工作作风是()。 A、理论和实践相结合 B、和人民群众紧密地联系在一起 C、自我批评 D、原则性与灵活性相结合 E、典型示范与普遍推行相结合 2、中国革命必须走农村包围城市的道路,其主要依据是() A、中国是一个半殖民地半封建大国,经济政治发展的不平衡 B、农村人口占全国人口的绝大多数,农民是革命的主力军 C、大革命失败的深刻教训 D、敌强我弱的形势,广大农村是敌人统治的薄弱环节 E、列宁关于民族殖民地问题的理论 3、在实现农业合作化的过程中,根据自愿互利的原则,采取的循序渐进的步骤是() A.互助组 B.初级社 C.高级社 D.协作组 4、发展才是硬道理的依据是()。
大学物理化学下_期末考试试卷
,反应 1 的关系为 212 = 1212121 2
A
?C2H2(g) + H2(g)是一级反应,在1073.2 K时,反应经10 h有三. 乙烯热分解反应:C2H4(g)?→ 转化率为50%的乙烯分解。已知上述反应的活化能为250.8 kJ?mol-1。欲使10 s内有转化率为60%的乙烯分解,问温度应控制在多少?(12分) 四.镉-甘汞电池反应式为Cd+ Hg2Cl2(s) === Cd2++2Cl-+2Hg,如果各物质均处在标准状态下,其原电池电动势与温度的关系式为: E/ V = 0.67-1.02×10-4(T/K-298) -2.4×10-6(T/K-298)2 (1)写出原电池简式; (2)计算上述电池反应在40℃时的?r G,?r H和?r S各为多少?(12分) 五.反应C2H6+ H2?→ ?2CH4 的反应机理如下: C2H62CH3·; CH3·+ H2k1 ?CH4 + H·; ?→ H·+ C2H6k2 ?→ ?CH4+CH3·。 设第一个反应为快速平衡,平衡常数为K;设H·处于稳定态,试建立CH4生成速率的动力学方程式。 (12分) 六. 电池Zn|ZnCl2(b=0.555 mol·kg-1)|AgCl(s)|Ag,测得25℃时电动势E=1.015V。已知:E(Zn2+|Zn) =-0.763V,E(Cl-|AgCl|Ag) = 0.2223 V。 (1)写出电池反应(得失电子数为2); (2)求上述反应的标准平衡常数K; (3)求溶液ZnCl2的平均离子活度因子(系数)γ±。 (12分)
武汉理工大学教务处 试题标准答案及评分标准用纸 | 课程名称——物理化学(下)— ( A 卷) 一. 选择题答案 : (12分,每题2分) BACDBC 二. 填空题答案 : (40分,每空2分) 1. 0.9 mol ·kg - 1 2. 变大 变小 3. 小 小 4. (γ + 2·γ - 3)15 10815 (γ + 2 ·γ -3) 15(m /b ) 5. > 6. {[Al(OH)3]m n OH -·(n -x )Na +}x -·x Na + 负 7. mol 1-α·dm 3(α-1)·s -1 11y c t m c t k m c d d d d Y A A A =-=?α 8. < < < 9. 散射 大于 10. e r v t ln ln ln ln ln q q q q q +++= 或=q e r v t q q q q 11. 1 12. △p =4γ / r 三. 解:反应为一级,则 k T (.).../1073206930693 1000693121K h h = ==- =1.925×10-5 s -1 (2分) k T t x ()ln =-11 1A =1s 0916.060.011ln s 101-=?? ? ??- (3分) 由阿仑尼乌斯方程: ()()ln ..k T k E R T a 10732110732 1K K ??????? ?=-?? ??? (3分) 代入k (1073.2K),k (T )及E =250.8×103 J ?mol -1 得: T =1535.9 K (4分) 四. 解: (1)Cd ?Cd 2+(a =1) ?? Cl -(a =1) ?Hg 2Cl 2(s)?Hg(l) (3分)
物理化学下册期中试卷及答案
一、单项选择题:(2分×15=30分) 1、·kg-1的CaCl 2水溶液的离子平均活度因子γ ± =,则其离子平均活度a ± 是: (B)。 (A)×10-4;(B)×10-2;(C)×10-2;(D)×10-4。 2、在下列电池中,其电池的电动势与氯离子的活度a(Cl-)无关的是:(D)。 (A)Zn|ZnCl 2(aq)| Cl 2 (p)|Pt; (B)Zn|ZnCl 2 (aq)|KCl(aq)|AgCl|Ag; (C)Pt|H 2(p 1 )|HCl(aq)|Cl 2 (p 2 )|Pt; (D)Ag|AgCl(s)|KCl(aq)|Cl 2 (p)|Pt。 3、电解质溶液的导电能力:(B)。 (A)随温度升高而减小;(B)随温度升高而增大; (C)与温度无关; (D)因电解质溶液种类不同,有的随温度升高而减小,有的随温度升高而增大。 4、蓄电池在充电和放电时的反应正好相反,则其充电时正极和负极、阴极和阳极的关系为:(C)。 (A)正负极不变,阴阳极不变;(B)正负极改变,阴阳极不变;(C)正负极不变,阴阳极正好相反;(D)正负极改变,阴阳极正好相反。 5、电解质溶液的离子强度与其浓度的关系为:(A)。 (A)浓度增大,离子强度增强;(B)浓度增大,离子强度变弱; (C)浓度不影响离子强度;(D)随浓度变化,离子强度变化无规律。 6、无限稀释的KCl 溶液中,Cl-离子的迁移数为,该溶液中K+离子的迁移数为:( C )。 (A) ; (B) ; (C); (D) 7、恒温下某电解质溶液浓度由mol·dm-3变为mol·dm-3,其摩尔电导率:( A )。 (A)减小;(B)增大;(C)不变;(D)不能确定。 8、在温度T时,若电池反应?Cu+?Cl2===?Cu2++Cl?的标准电池电动势为E1, Cu + Cl 2 === Cu2++2Cl?的标准电池电动势为E2,则E1和E2的关系为:( D )。(A)E1/ E2= 2;(B)E1/ E2= 1/2;(C)E1/ E2= 4;(D)E1/ E2= 1。
《物理化学》下册试卷
化学工程与技术学院2014-2015年度第一学期 《物理化学》下册期末考试试题 (化学教育专业、化工、应化专业) 一、选择填空(每小题1.5分,共30分) 1.用同一电导池分别测定浓度为0.01mol ·kg -1和0.1mol ·kg -1的两个电解质溶液,其电阻分别为1000Ω和500Ω,它们的摩尔电导率之比Λm (1) :Λm (2)为( )。 (a )1 : 5 (b )5 : 1 (c )10 : 5 (d )5 : 10 2 CaCl 2的摩尔电导率Λm 与其离子的摩尔电导率λm 关系为( ) (a ))Cl ()Ca ()CaCl (22-++=m m m Λλλ (b ) )Cl ()Ca (2 1)CaCl (22- ++=m m m Λλλ (c ))Cl ()Ca 2 1()CaCl (22- ++=m m m Λλλ (d ) )]Cl ()Ca 2 1([2)CaCl (22- ++=m m m Λλλ 3. 在10cm 3 、1mol ·dm -3 的KOH 溶液中加入10 cm 3 水,其摩尔电导率如何 变化?( ) (a )增大 (b )减小 (c ) 不变 (d )无法判定 4. 浓度为m B 的H 3PO 4溶液,其平均离子活度系数为γ± ,则H 3PO 4的表 观活度a B 可表示为( ) (a )4 θB B 4?? ? ??=±m m a γ (b ) θ B B 4m m a ±=γ (c )?? ? ??=±θB B 27m m a γ (d ) 4 θ B 4B 27??? ??=±m m a γ 5. 电极 OH - (a -)|HgO(s)| Hg(l)作为还原电极的电极反应为( ) (a )Hg Hg →+-+e (b )- -++→+e O H HgO(s)OH Hg(l)22 (c )2O Hg(l)HgO +→+- e 2 (d ) - 2OH Hg(l)O H HgO 22+→++-e 6. 细胞色素(Fe 3+ ) + e →细胞色素(Fe 2+ ),在298K 时标准电极电势为0.25V ,则反应:H 2(g) + 细胞色素(Fe 3+ ) → H + + 细胞色素(Fe 2+ )的θ m r G ?为( )kJ ·mol -1 (a )48.2 (b )24.1 (c )-24.1 (d )-48.2 7. 将一原电池两极短路,此时电池与环境交换的热量与反应焓变的
大学物理化学下_期末考试试卷..doc
B.表明了它是双分子反应 D.表明它为基元反应 衣泓理工槌考试试题纸(A 卷) 课程名称物理化学(下)专业班级 备注:学生不得在试题纸上答题(含填空题、选择题等客观题) %1. 选择题(12分,每题2分) 1. 如图:,在毛细管中装入水,如果在左端加热,毛细管中的水将() A. 保持不变 B.向左移动 C.来回移动 D.向右移动 2. 将2滴K 2[Fe(CN)4]水溶液滴入过量的CuCl 2水溶液中形成亚铁氤化铜正溶液,下列三种电解质聚沉值 最大的是 A. KBr B. K 2SO 4 C. K 4[Fe(CN)6] D. Na 3PO 4 1 H t 3. 298K 时,电池反应H 2(g)+- 02(g) ===H 2O(1)所对应的电池标准电动势& ,反应 2 2 &0⑴===2 H 2(g) + 02(g)所对应的电池标准电动势E : Ej e '和E 2e '的关系为 A. E?. = -2 Ep ' B ?E : =2 E? ' C. E 2° '= - E? ' D. ' 4. 在统计热力学中,若按组成子能否被分辨来对系统分类,那么 A. 气体与晶体均属定域子系统 B.气体与晶体均属离域子系统 C.气体属定域子系统,而晶体属离域子系统 D.气体属离域子系统,而晶体属定域子系统 5. 一定量纯理想气体等温变压时,在分子运动的各配分函数中与压力有关的是: A.电子运动的配分函数 B.平动配分函数 C.转动配分函数 D.振动配分函数 6. 对于任意给定的化学反应A + B — 2Y,则在动力学研究中:( ) A.表明它为二级反应 C.表明了反应物与产物分子间的计量关系
物化试卷下册
一选择题(每题只有一个正确答案,每题1.5分,共24分) 1.描述催化剂特征不正确的是( ) ?? A、催化剂不能实现热力学上不可能进行的反应; ?? B、催化剂在反应前后,其化学性质和物理性质皆不变; ?? C、催化剂不能改变平衡常数; D、催化剂只能缩短反应达到平衡的时间,而不能改变平衡状态。 2 3 4 5. 6) A 7 A、>10-7m; B、<10-9m; C、10-7m ~10-9m; D、任意大小 8.对电动电势(ζ)描述错误的是() A、它是指胶粒的滑动面与溶液本体间的电位差; B、其值随外加电解质而变化; C、其值一般小于热力学电势; D、电动电势等于零的状态称为零电态。 9.溶胶电动现象主要决定于() ??? A、热力学电势;????????? B、电动电势;
C、扩散层电势;??????????? D、紧密层电势。10.配分函数q的定义式为() A、q= exp( ∑- kT i i g ε ;B、n e r v t q q q q q q? ? ? ? =; C、q= exp( kT i i g ε - ;D、exp(/) i i q Ng kT e =-。 11.对下列表面活性剂的归类,正确的是() A、R-COONa属阳离子型; B、R-NH2HCl属两性型; C D 12 13-),若14 15A B C中,如果需要的是中间产物 的浓度; B、增大反应速率; 、控制适当的反应温度; D、控制适当的反应时间。 16.能量零点的选择不同,对下列哪个热力学量的值会有影响()。 A、S; B、H; C、P; D、玻尔兹曼分布 二、填空题(每空1分,共30分) 1.扩散双电层理论中,电动电势是指 ;等电点(态)的电动电势= 。 2.化学吸附与物理吸附的本质差别:前者是,后者 是。
物理化学(下)试题 应化材化
物理化学(下)试题 (应用化学、材料化学专业用) 一、选择题(22分) 1.强电解质CaCl 2的摩尔电导率与其离子的摩尔电导率的关系是 ( ) A.)()()(22-∞+∞∞+=ΛCl Ca CaCl m m m λλ B.)()(5.0)(22- ∞+∞∞+=ΛCl Ca CaCl m m m λλ C.)(2)()(22-∞+∞∞+=ΛCl Ca CaCl m m m λλ D.)]()([2)(22- ∞+∞∞+=ΛCl Ca CaCl m m m λλ
2.强电解质CaCl 2的水溶液,其离子平均活度±α与电解质活度B α之间的关系为 ( ) A. B αα=± B. 3B αα=± C. 2/1B αα=± D. 3 /1B αα=± 3.在不可逆电极过程中,随着电流密度的增大 ( ) A.阴极电势变低,阳极电势变高 B. 电池的电动势降低 C.电解池耗电能增加 D. 以上说法都对 4.某电池反应为-+ +=++OH Hg l O H g O l Hg 42)(2)()(2222,当电池反应达平衡 时,电池的电动势E 必然是 ( ) A. 0>E B. ?E E = C. 0 一、填空题(26分,每空2分) 1.已知水在25~100℃之间平均恒压摩尔热容为75.48 J·K -1·mol -1,则在101.3kPa 下,将1kg 水从25℃加热至100℃所需的热为 。 2.某一温度下,反应C(s) + O 2 (g) == CO 2 (g) 的标准平衡常数为K 1,反应 CO (g) + 1/2O 2 (g) == CO 2 ( g) 的标准平衡常数为K 2,则同样温度下反应 2C (s) + O 2 (g ) == 2CO (g) 的标准平衡常数K 3与K 1和K 2的关系是K 3=??????????。 3.450 ?C 时,将NH 3(g)与N 2(g)混合,由于NH 3(g)的分解,最终得到NH 3(g)、N 2(g)和H 2(g)平衡共存的系统,求该系统的组分数C = ,自由数F =______。 4.克劳修斯不等式的形式是 ;其大于号适用于 过程。 5.对组成不变的均相封闭系统,(?S /?p )T = ;对理想气体,(?S /?p )T = 。 6.Cd(s)的蒸气压与温度的关系为:lg(p /Pa) =5693K /T -6.439,Cd(l)的蒸气压与温度的关系为:lg(p /Pa) = 5218K /T -5.772,则Cd 的三相点的温度为 ,压力为_______Pa 。 7.如果在溶剂A 中加入少量非挥发性溶质B 组成溶液,溶液凝固时析出的固体A 中也溶解有B ,则该液态溶液的蒸气压将比纯A 液体的蒸气压_________,沸点 ,凝固点___________。(填“升高”、“降低”、“不变”) 二、选择填空题(30分,每题2分) 1.反应PCl 5(g) == PCl 3(g) + Cl 2(g)在473 K 时的离解度为48.5%,而573 K 时的离解度为97 %,则可判断为 A.平衡常数K =2 B.两温度的平衡常数K 相等 C.反应是放热的 D.反应是吸热的 3.由A 及B 双组分构成的α和β两相系统,则在一定T ,p 下物质A 由α相自发向β相转移的条件为 A.β A A μμα > B.β A A μμα< C.βα μμA A = D. β αμμB A = 3.理想气体等温自由膨胀过程的 A.Q > 0 B.?U < 0 C.W < 0 D.?H = 0 4.对于只作膨胀功的封闭系统(?A /?T )V 的值是 A.大于零 B.小于零 C.等于零 D.不能确定 5.在温度为T 时,纯液体组分A 和B 的饱和蒸气压分别为p A *和p B *,且p B *=3 p A *,若组分A 和B 形成理想液态混合物,当气液两相平衡时,气相中组分A 和B 的物质的量相等。则组分A 和B 在液相中的摩尔分数各应是 p ) = NH p p p ) = NO ) + p p 一、 填空题(7分) 1.在稀溶液范围内,由于质点间的作用力性质不同,同浓度的非电解质溶液中溶质的活度( 小于 )电解质溶液中溶质的活度。(填“大于”或“小于”) 2.某反应反应掉3/4所需时间为反应掉1/2所需时间的2倍,问这个反应的反应级数是( 一级反应 )。 3.当等体积的0.4mol.kg -1的NaCl 水溶液与0.3 mol.kg -1的BaCl 2水溶液混合,混合溶液的离子强度I=( 0.65 )。 4.反应D B B k 32?→? ,其速率方程可表示为-dc B /dt =k B c B 2/3 ,也可表示为dc D /dt =k D c D 3/2,则-dc B /dt 与 dc D /dt 之间的关系为 ( )。速率常数k B 和k D 的比为( 2比3 )。 5. 一级反应以( ln k )对时间作图为一直线,速率常数等于直线的 ( 斜率 )。 二、选择题(10分)(请将答案填在下列表格里,划在题号上的不得分) 1.在25℃无限稀释的水溶液中,离子摩尔电导率最大的是( D )。 A . La 3+ B. Mg 2+ C .+ 4NH D. H + 2.若向摩尔电导率为1.4×10-2 S ·m 2·mol -1的CuSO 4溶液中加入1m 3的纯水,这时CuSO 4的摩尔电导率( B ) A .降低 B .增高 C .不变 D .不能确定 3.难溶盐的溶度积K SP 可通过电动势的测定来求得,但需要设计一适当的原电池。现欲测定AgBr (s )的溶度积K SP ,下列 电池中的( )电池为所要设计的电池。 A. Ag (s )∣AgBr (s )∣KBr (b )∣Br 2(l )∣Pt B. Ag (s )∣Ag + (a )‖Br -(b )∣Br 2(l )∣Pt C. Ag (s )∣Ag +(a )‖Br -(b )∣AgBr (s )∣Ag (s ) D. Pt ∣Br 2 (l )∣Br -(b )‖Ag +(a )∣Ag (s ) 4.若多孔性物质能被水润湿,则当水蒸气含量较大时,可首先在该多孔性物质的孔隙中凝结,这是因为( ) A .平液面的蒸气压小于凸液面的蒸气压 B .平液面的蒸气压大于凹液面的蒸气压 C .平液面的蒸气压大于凸液面的蒸气压 D .平液面的蒸气压小于凹液面的蒸气压 5.下列哪种说法是错误的?( )。 化学专业《物理化学》下册期末考试试卷 一、单项选择题(每小题2分,共30分) 1、0.001 mol ·kg -1 K 3[Fe(CN) 6] 水溶液的离子强度为:( ) (A) 6.0×10-3 mol ·kg -1 (B) 5.0×10-3 mol ·kg -1 (C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg -1 2、电导测定应用广泛,但下列问题中哪个是不能用电导测定来解决的( ) (A)求难溶盐的溶解度 (B)求弱电解质的解离度 (C)求平均活度系数 (D)测电解质溶液的浓度 3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1 的 NaAc 溶液的离子平均活度系数分别为 γ ±,1和 γ ±,2,则有 ( ) (A) γ ±,1= γ ±,2 (B) γ ±,1> γ ±,2 (C) γ ±,1< γ ±,2 (D) γ ±,1≥ γ ±,2 4、金属与溶液间电势差的大小和符号主要取决于: ( ) (A) 金属的表面性质 (B) 溶液中金属离子的浓度 (C)金属与溶液的接触面积 (D)金属的本性和溶液中原有的金属离子浓度 5、金属活性排在H 2之前的金属离子,如Na + 能优先H +在汞阴极上析出,这是由于:( ) (A) φθ(Na +/ Na) < φ θ(H +/ H 2) (B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2) (D) H 2在汞上析出有很大的超电势, 以至于φ (Na +/Na) > φ (H +/H 2) 6、已知Λ ()K O H m 291,2∞=4.89×10-2-1 2 mol m S ??,此时(291K)纯水中的m (H +) =m (OH -) =7.8×10-8 mol ·kg -1 ,则该温度下纯水的电导率为( ) (A)3.81×10-9 S ·m -1 (B )3.81×10-6 S ·m -1 (C)7.63×10-9 S ·m -1 (D )7.63×10-6 S ·m -1 7、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ; (C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。 8、某反应速率常数k = 2.31 × 10-2mol -1·dm 3·s -1,反应起始浓度为1.0 mol ·dm -3,则其反应半衰期为: ( ) (A) 43.29 s ; (B) 15 s ; (C) 30 s ; (D) 21.65 s 。 9、反应A + B → C + D 的速率方程为r = k[A][B] ,则反应:( ) (A) 是二分子反应 ; (B) 是二级反应但不一定是二分子反应 ; (C) 不是二分子反应 ; (D) 是对A 、B 各为一级的二分子反应 。 10、有关绝对反应速率理论的叙述中,不正确的是: ( ) (A) 反应分子组实际经历途径中每个状态的能量都是最低 ; (B) 势能垒是活化络合物分子在马鞍点的能量与反应物分子的能量之差 ; (C) 活化络合物在马鞍点的能量最高 ; (D) 反应分子组越过马鞍点后可能返回始态 。 11、在低于室温的温度下,在固体表面上的气体吸附一般是什么形式:( ) (A) 形成表面化合物 ; (B) 化学吸附 ; (C) 液化 ; (D) 物理吸附 。 工程学院模拟试卷1 一、填空题(4分×7=28分) 1、函数) 32(22 ),(y x e y x f +-=定义域为 ,它是 点集。 2、 = -+++→11lim 2 2 2 2) 0,0(),(y x y x y x 。 3、函数3 2),,(yz xy z y x f +=在点(2,-1,1)处沿 方向是f 的值增长最快 的方向,其变化率为 。 4、函数))((y x x f y ≠=由方程 x y arctg y x =+22ln 确定,则= dx dy 。 5、 = -Γ)25( 。 6、??= 2 2 2 x y dy e dx 。 7、函数 ?????=≠=000 sin )(y y y xy x f 不连续点的集合为 。 二、选择题(3分×4=12分) 1、二元函数 ??? ??=≠+=)0,0(),(0) 0,0(),(),(2 2y x y x y x xy y x f 在(0,0)处 ( ) A. 连续,偏导数存在 B.连续,偏导数不存在 C. 不连续,偏导数存在 D.不连续,偏导数不存在 2、设函数),(y x f 在点(0,0)附近有定义,且1)0,0(,3)0,0(='='y x f f ,则( ) A. dy dx dz +=3)0,0( B.曲面))0,0(,0,0(),(f y x f z 在点=的法向量为(3,1,1) C.曲线?? ?==0 ) ,(y y x f z ))0,0(,0,0(f 在点的切向量为(1,0,3) D.曲线?? ?==0 ) ,(y y x f z ))0,0(,0,0(f 在点的切向量为(3,0,1) 3、已知2 )()(y x ydy dx ay x +++为某函数的全微分,则a 等于( ) A. –1 B. 0 C. 1 D. 2 4、设空间区域0,0,0:0 :2 22222 2221≥≥≥≤++≥≤++z y x R z y x V z R z y x V 则( ) 考试类型: 太原理工大学 物理化学(一) 试卷A 适用专业: 考试日期: 时间: 120 分钟 共 4 页 一、填空题(每小题 2分,共30分) 1.临界温度是气体能够液化的 ,超过此温度无论加多大压力均不能使气体液化。 2.压缩因子Z 的定义为Z = ,Z 的大小反映出 ; 对理想气体,在任何温度压力下,Z = 。 3.使一过程的?S = 0,应满足的条件是 。 4.25℃时,1 mol CH 3OH(l) 在等容条件下完全燃烧放热725.4 kJ ,则25℃时CH 3OH(l) 的标准 摩尔燃烧焓 ?c H = 。 5.25℃时水的蒸气压力为3.17 kPa ,若有一个甘油水溶液中甘油的摩尔分数为0.002(甘油为 不挥发性溶质),则溶液的蒸气压力为 。 6.亨利定律的数学表达式之一为???????????????;其适用条件为 。 7.理想液态混合物的微观模是 。 8.多组分均相系统中,组分B 的偏摩尔体积定义为V B ===def ????? ??????。 9.已知等温等压下化学反应:aA+bB == yY+zZ ,则该反应的平衡条件若用化学势 ???????????。 10.理想气体混合物中任一组分B 的化学势表达式为: 。 11.1mol 水在101325Pa 、100℃下向真空蒸发为同温同压下的水蒸气,则该过程的 ΔG 0,?S 0,?H 0。(选填>,= 或< ) 12.反应 2NO(g) + O 2(g) == 2NO 2(g) 是放热的, 当反应在某温度、压力下达平衡时,若使平衡 向右移动。则应采取的措施是: 或 。 13.方程2 ln RT H dT p d m ?=可适用于 。 14.电解质溶液的电导率随浓度变化的规律为 。 15.设阳极和阴极的超电势均为0.7V ,电极的平衡电极电势均为1.20V ,则阳极电势为 ,阴极电势为 。 徐州工程学院试卷 —学年度第学期课程名称《毛泽东思想和中国特色社会主义理论体系概论》 试卷类型考试形式考试时间分钟 命题人年月日使用班级 教研室主任年月日教学院长年月日 姓名班级学号 题号一二三四五六七八总分 总分10 20 30 25 15 100 得分 一、单项选择题(共10题,每小题1分,共10分。下列每题给出的四个选项中,只有一个选项是符合试题要求的)。 1、毛泽东之所以提出要实现马克思主义中国化,缘于()。 A.实事求是 B.反对左倾教条主义 C.中国革命进程中正反两个方面的实践经验 D.反对右倾投降主义 2、中国革命的主要斗争形式是() A.政治斗争 B.武装斗争 C.合法斗争 D.秘密斗争 3、在中国大陆,剥削制度被消灭的标志是() A.新中国建立 B.全国大陆地区的解放统一 C.土地革命运动的完成 D.社会主义改造的完成 4、先进生产力的集中体现和主要标志是()。 A.高水平的国内生产总值B.高速发展的国民经济 C.科学技术D.高素质的劳动者 5、坚持四项基本原则,最核心的是坚持() A.社会主义道路B.共产党的领导 C.人民民主专政D.马列主义、毛泽东思想 6、社会主义的基本矛盾是() A.敌我矛盾 B.人民内部矛盾 C.人民日益增长的物质文化需要同落后的社会生产之间的矛盾 D.生产关系和生产力之间的矛盾、经济基础和上层建筑之间的矛盾 7、个人收入分配要坚持效率优先、兼顾公平的原则,这一原则的含义是指() A.既要防止收入过分悬殊,又要防止平均主义 B.既要鼓励先进、促进效率,合理拉开收入差距,又要防止两极分化,逐步实现共同富裕C.既要让一部分人先富起来,又要提倡先富帮后富 D.人民生活水平既要不断提高,又要依法纳税 8、我国实行的人民民主专政和人民代表大会制度是人民奋斗的成果和历史的选择,它们的核心内容 物理化学模拟试卷一 一、判断题(每小题2分,其中正确的写“对”,错误的写“错”) 1.在一定温度、压力下,pV = nRT,( ?U/?V ) = 0的气体为理想气体。 ( 对) 2.H2O(l,100℃,101325 Pa) → H2O(g,100℃,101325 Pa)的ΔG<0。 (错) 3.若一个过程是可逆过程,则该过程的每一步都是可逆过程。 ( 对) 4.CO2的标准生成焓就是同温同压下,石墨的标准燃烧热。 ( 对) 5.Ag|AgNO3(m')||AgNO3(m")|Ag浓差电池,m较小的一端为负极。 (对) 6.1mol理想气体,在273K,从p 定温可逆膨胀到0.1p ,该过程的ΔG 为?5226 J。( 对) 7.已知298K时,反应N2O4 (g) ═ 2NO2 (g)的K为0.1132,今在定温且N2O4 (g)及NO2(g)的分压各为101325 Pa时反应向右进行。 ( 对) 8.定温、定压下,ΔG>0的反应不能自发进行。(错) 9.虽然Qp=ΔH,Qv=ΔU,但Qp、Qv不是状态函数。( 对) 10.定温时,电解质溶液的浓度增大时,其摩尔电导率总是减小的。( 对) 11.溶胶是多组分多相体系。 (对) 12.比表面Gibbs自由能和表面张力是两个根本不同的概念。. (错) 13.表面活性物质是指那些加入到溶液中,可以降低溶液表面张力的物质。( 错) 14.溶胶和真溶液是均相体系。(错) 15.若天空中的水滴要起变化,一定是较大水滴进行蒸发,水汽凝结在小水滴上,使大小不等的小水滴相等。( 错) 二、选择题(每小题给出一个正确答案,请把它的序号填在括号中,每小题2分) 1.298K及101325Pa条件下,1mol过冷水蒸气变成1mol的液态水则ΔG A 。 A. ΔG < 0 B.ΔG > 0 C.ΔG = 0 D.不一定2.某体系经历一个不可逆循环后,下列关系式中不能成立的是 A 。 A. Q = 0 B. ΔCp = 0 C. ΔU = 0 D. ΔH = 0 3.当某溶质溶于某溶剂形成浓度一定的溶液时,若采用不同的浓度表示方法,则下列描述溶质的各种说法中正确的是 C 。 A. 活度数据相同 B. 浓度数据相同 C. 化学势相同 D. 前三个都相同 4.下列体系的状态性质中,不是强度性质的是A 。 2019初二下册物理期末考试试题本文导航1、首页2、2019初二下册物理期末考试试题-2 尽快地掌握科学知识,迅速提高学习能力,由查字典物理网为您提供的2019初二下册物理期末考试试题,希望给您带来启发! 一、选择(18为单选,9、10为多选,每题3分,共30分) 题号12345678910 答案 1.如图,小鱼口中吐出的气泡在升至水面的过程中,体积会逐渐变大,则气泡受到的浮力和气泡内气体压强的变化情况是 A.浮力不变,压强不变 B.浮力变小,压强变小 C.浮力变大,压强变大 D.浮力变大,压强变小 2.下列事实中,目的是为了增大压强的是 A.在坦克的轮子上安装履带 B.书包背带做得宽大而厚实 C.用细线来分割皮蛋 D.将铁路轨道铺设在枕木上 3.把质量相同的铜块和木块分别浸没入水中,则它们所受浮力 A.铜块的大 B.木块的大 C.一样大 D.无法判断 4.猴子能够轻松地倒挂在树枝上,当其倒挂在树枝上静止时,下列说法正确的是 A.树枝对猴子的作用力和猴子所受的重力是一对平衡力 B.猴子对树枝的作用力和猴子所受的重力是一对平衡力 C.猴子对树枝的作用力和树枝对猴子的作用力是一对平衡力 D.猴子很轻,其重力不需要平衡就能使它静止在空中 5.下图所描述的力,有对物体做功的是 6.1970年4月24日,我国第一颗人造地球卫星上天,它绕地球以椭圆轨道 运行,近地点离地面高度为439千米,远地点离地面高度为2384千米,如 图所示,它从近地点向远地点运动时,下列说法正确的是A.势能减小,动能增大B.势能增大,动能减小 C.势能增大,动能不变 D.势能增大,动能增大 7.如图(不计绳重与摩擦,且动滑轮重G动小于物重G),用它们分别 将重相同的甲、乙两物体匀速提升相同的高度,所用的拉力分别为 F甲、F乙,它们的机械效率分别为甲、乙。则下列关系正确的是: A.F甲 8.如图所示,用三种不同的方式分别拉同一物体在水平地面上做匀速直线运动,所用拉力分别为F1、F2和F3,则它们的大小关系正确的是 徐州工程学院试卷A标准答案 2015 — 2016 学年第一学期课程名称管理学原理一、单项选择题(本大题共15小题,每小题1分,共计15分) 二、多项选择题(本大题共7题,每小题2分,共计14分) 计算(6分) E1=270×0.5+150×0.3+(-80)×0.2-100=135+45-16-100=64(万元) E2=160×0.5+80×0.3+(-40)×0.2=80+24-8-50=46(万元) E3=90×0.5+40×0.3=45+12=57(万元) 因为E1值最大,所以应选择方案一:扩建。 六、案例分析题(本大题共2小题,共25分) 1.(1)启明公司目前的组织结构是直线一一参谋型组织结构。(2分) 参谋型组织结构的特点:集中统一指挥、决策迅速,分工细密,职责分明,效率较高,稳定性高,在外部环境变化不大的情况下,易于发挥组织的集团效率。但下级部门的主动性和积极性的发挥受到限制;部门之间互通情报少;各参谋部门和直线指挥部门之间的目标不统一;难于从组织内部培养熟悉全面情况的管理人员;组织适应性较差。(5分) (2)公司目前适合采用事业部制组织(2 分)。 启明公司应在事业部制组织结构下,实行总经理集中领导下的分权管理,公司应成立个人电脑、手机、房地产、餐饮等事业部,由各事业部经理负责产品的全部业务,实行独立经营、单独核算(3分)。 启明公司总经理保持重大人事决策、财务控制以及监督等权力。个人电脑、手机、房地产、餐饮等事业部经理在总公司统一管理下,负责本事业部的采购、研发、生产、销售等工作。实行“集中决策、分散经营”,进行分权管理(3分)。 2.(1)张凡会变得不满,工作动力会减少,工作积极性会降低;(1分) 可以用过程激励理论中的公平理论解释张凡的困惑;(1分) 公平理论认为职工被激励的程度不仅受其所得绝对报酬的影响,而且也受到相对报酬的影响。张凡将他的收入和类似职工的收入比较,结果感觉不公平,影响他积极性的发挥。(2分)(2)不会,因为使张凡产生不公平感的根本原因没有得到解决。(2分) (3)可以对张凡进行公平心理的疏导,引导其实力正确的公平观:绝对的公平是不存在的,不要盲目攀比;不公平感是张凡纯主观的比较,他应当多听听别人的看法,多了解了解周围的环境,可能看待问题就很客观了;不要按酬付劳,按酬付劳必然会造成公平问题的恶性循环。(4分) 化学专业《物理化学》下册期末考试试卷(1)(时间120分钟) 1、0.001 mol ·kg -1 K 3[Fe(CN) 6] 水溶液的离子强度为:( ) (A) 6.0×10-3 mol ·kg -1 (B) 5.0×10-3 mol ·kg -1 (C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg -1 2、电导测定应用广泛,但下列问题中哪个是不能用电导测定来解决的( ) (A)求难溶盐的溶解度 (B)求弱电解质的解离度 (C)求平均活度系数 (D)测电解质溶液的浓度 3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1 的 NaAc 溶 液的离子平均活度系数分别为 γ ±,1和 γ ±,2,则有 ( ) (A) γ ±,1= γ ±,2 (B) γ ±,1> γ ±,2 (C) γ ±,1< γ ±,2 (D) γ ±,1 ≥ γ ±,2 4、金属与溶液间电势差的大小和符号主要取决于: ( ) (A) 金属的表面性质 (B) 溶液中金属离子的浓度 (C)金属与溶液的接触面积 (D)金属的本性和溶液中原有的金属离子浓度 5、金属活性排在H 2之前的金属离子,如Na + 能优先H +在汞阴极上析出,这是由于:( ) (A) φθ (Na +/ Na) < φ θ(H +/ H 2) (B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2) (D) H 2在汞上析出有很大的超电势, 以至于φ (Na +/Na) > φ (H +/H 2) 6、已知Λ()K O H m 291 ,2∞=4.89×10-2 -12mol m S ??,此时(291K)纯水中的m (H +) =m (OH -) =7.8×10-8 mol ·kg -1,则该温度下纯水的电导率为( ) (A)3.81×10-9 S ·m -1 (B )3.81×10-6 S ·m -1 (C)7.63×10-9 S ·m -1 (D )7.63×10-6 S ·m -1 7、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ; (C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。 学院: 年级/班级: 姓名: 学号: 装 订 线 内 不 要 答 题大学物理化学期末考试试卷
物化下册试题
《物理化学》下册期末考试试卷
徐州工程学院数学分析试卷
(完整word版)太原理工大学期末试卷1_物理化学
徐州工程学院试卷1
物理化学试卷
初二下册物理期末考试试题
2015-2016 徐州工程学院管理学原理试卷A标准答案
《物理化学》下册期末考试试卷
