烷基锂
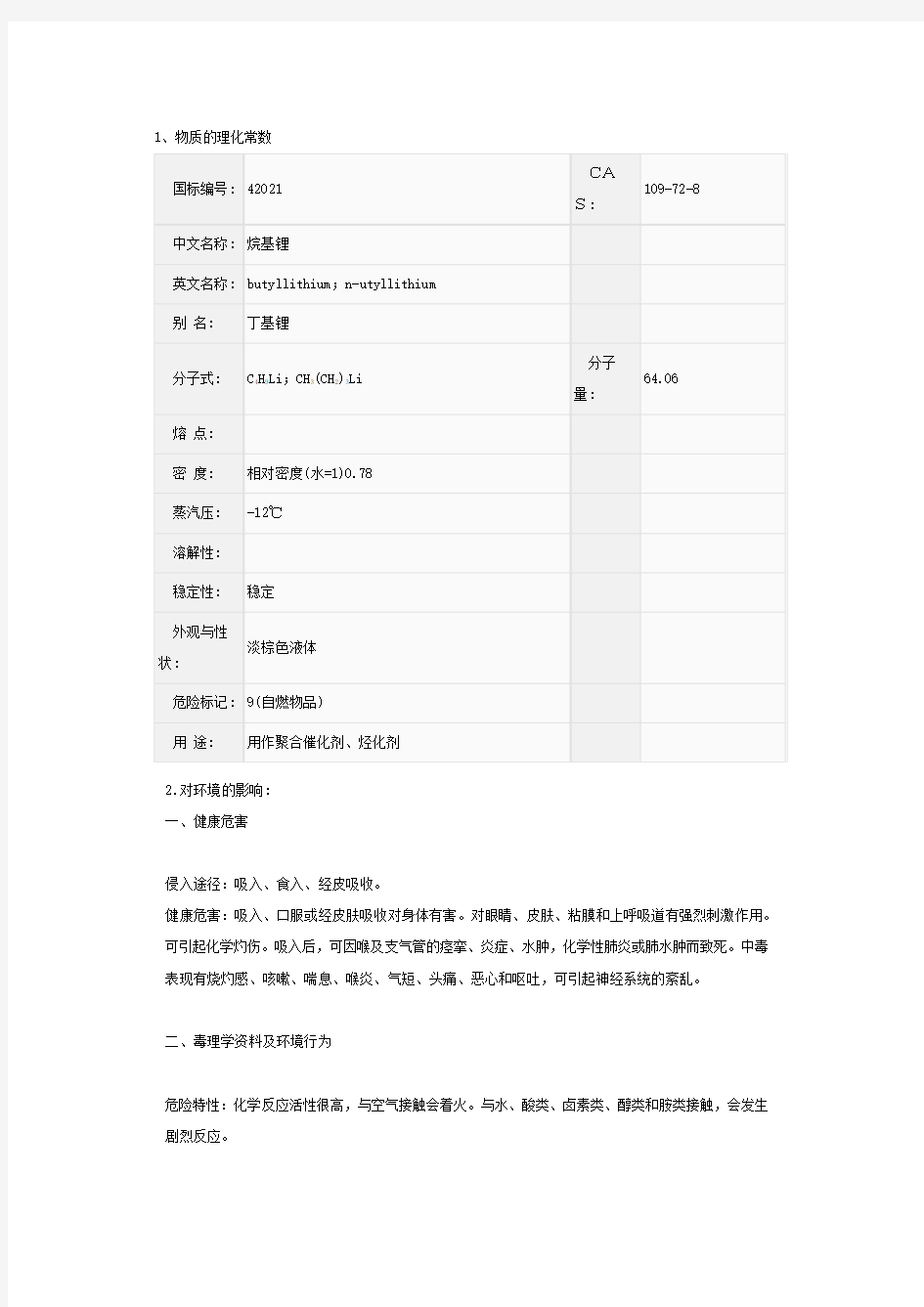

1、物质的理化常数
CA
国标编号: 42021
109-72-8
S:
中文名称: 烷基锂
英文名称: butyllithium;n-utyllithium
别名: 丁基锂
分子
分子式: C4H9Li;CH3(CH2)3Li
64.06
量:
熔点:
密度: 相对密度(水=1)0.78
蒸汽压: -12℃
溶解性:
稳定性: 稳定
外观与性
淡棕色液体
状:
危险标记: 9(自燃物品)
用途: 用作聚合催化剂、烃化剂
2.对环境的影响:
一、健康危害
侵入途径:吸入、食入、经皮吸收。
健康危害:吸入、口服或经皮肤吸收对身体有害。对眼睛、皮肤、粘膜和上呼吸道有强烈刺激作用。可引起化学灼伤。吸入后,可因喉及支气管的痉挛、炎症、水肿,化学性肺炎或肺水肿而致死。中毒表现有烧灼感、咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐,可引起神经系统的紊乱。
二、毒理学资料及环境行为
危险特性:化学反应活性很高,与空气接触会着火。与水、酸类、卤素类、醇类和胺类接触,会发生剧烈反应。
燃烧(分解)产物:一氧化碳、二氧化碳、氧化锂。
3.现场应急监测方法:
4.实验室监测方法:
气相色谱法测定丁基锂——(Buckley,David A;augostini, Peter P.),《Br.Polym.J.》,1980,12,No4,185(英文)。《分析化学文摘》,1982.9
5.环境标准:
6.应急处理处置方法:
一、泄漏应急处理
迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防毒服。不要直接接触泄漏物。尽可能切断泄漏源。小量泄漏:用砂土、蛭石或其它惰性材料吸收。大量泄漏:构筑围堤或挖坑收容。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
二、防护措施
呼吸系统防护:可能接触毒物时,建议佩戴自吸过滤式防毒面具(全面罩)。紧急事态抢救或撤离时,建议佩戴空气呼吸器。
眼睛防护:呼吸系统防护中已作防护。
身体防护:穿胶布防毒衣。
手防护:戴橡胶手套。
其它:工作现场严禁吸烟。工作毕,淋浴更衣。
三、急救措施
皮肤接触:立即脱去被污染的衣着,用大量流动清水冲洗,至少15分钟。就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:误服者用水漱口,给饮牛奶或蛋清。就医。
灭火方法:消防人员必须穿戴全身防火防毒服。灭火剂:干粉、砂土。禁止使用水、泡沫或卤化物灭火剂。
六氟磷酸锂风险分析
六氟磷酸锂风险分析 1 主要风险因素 本项目建设采用国际先进、国内首例的工艺技术,项目的建设和生产存在较低的技术风险,而在市场和原料供应方面的风险也相对较低。本项目建成投产后,可能面临的风险因素主要有: ⑴ 市场风险 从目前我国六氟磷酸锂市场供需平衡及未来项目建设情况分析,预计未来我国六氟磷酸锂市场将总体上呈现供不应求的局面。但由于本产品近期已成大热门,吸引的投资者甚众,因此可能存在较多潜在的竞争者,另外,市场需求量、产品价格等可能会受到行业景气周期的影响而呈现周期性波动,所以,本项目还是存在一定的市场风险。 ⑵ 技术风险 由于六氟磷酸锂具有突出的氧化稳定性和较高的离子电导率, 是目前锂离子电池电解液的首选电解质, 对电解液使用六氟磷酸锂的基本要求是纯度高(电池级)、游离酸与水分低。但由于产品本身极易吸潮分解, 因此生产难度大, 对原料及设备要求苛刻, 属典型的高科技、高危生产环境、高难生产的“三高” 技术产品。本项目所采用的工艺技术虽然有领先优势,但实际生产中的装置、工艺技术管理及包装储存等环节都可能对产品的性能产生影响,因此,本项目也存在一定的技术风险。 ⑶ 原材料价格波动风险本项目装置以五氯化磷,氟化锂为主要原材料。其中氟化锂的价格,主要是由上游资源碳酸锂的价格所决定的。中国的锂资源储量仅次于智利、 阿根廷。其中,西藏矿业拥有的扎布耶盐湖是世界第三大锂资源盐湖,也是世界上唯一的富锂低镁的优质碳酸盐型盐湖。2007年全球碳酸锂产能过剩达万吨,2008 年情况进一步恶化。而国际上的三大碳酸锂生产厂商仍有扩产计划,其中,SMQ 计划将产能扩充到4万吨,Chemetall计划扩产到3万吨,FMCT产到万吨,如 果全部达产,总产能将超过9 万吨。目前,碳酸锂的市场需求并不大,主要集中在药物、玻璃和电池,2008 年,国内电池用碳酸锂需求才3000 多吨。从目前碳酸锂的下游分布来看,电池行业的需求大致占25%左右,集中在生产正极
铜与浓硫酸共热的反应及现象
铜与浓硫酸共热的反应及现象 【摘要】铜与浓硫酸共热反应因两者的量不同,反应时的最终现象不同。若浓硫酸过量 时,主要现象有:铜表面先变黑,形成黑色浊液,随后又变成白色浊液。铜全部反应完后,静置,灰白色物质沉于管底,所得溶液呈淡蓝色,冷却至室温呈无色。反应中还伴有白色烟雾,并有淡黄色物质冷凝在管壁。若铜过量,最终得灰白色固体物质。由此说明铜与浓硫酸共热的反应是很复杂的,且反应后所得溶液颜色随温度变化而变化。 【关键词】铜;浓硫酸;共热反应;现象;原因 高一新教材关于铜与浓硫酸反应的实验描述是这样的:“实验表明,浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊试液变红或使品红溶液褪色的气体,反应后生成物的水溶液显蓝色。说明铜与浓硫酸反应时被氧化为二价铜离子”。 然而该实验的现象这么简单,且实验有两种情况: 一种情况是浓硫酸过量。用下列“实验装置图1”(固定仪器和加热酒精灯均未画出)来完成此实验。其实验现象有(按实验进程):铜与冷的浓硫酸不发生反应,加热时随浓硫酸温度升高铜丝(或铜片)表面变黑,产生气泡,细小黑色颗粒状物质从铜丝(或铜片)表面进入浓硫酸中,形成黑色的悬浊液。随着加热温度继续升高(至沸腾),黑色颗粒状物质与浓硫酸反应,转变成细小灰白色的颗粒状物质,随浓硫酸一起翻滚。在此过程中试管里还产生了大量的白色烟雾,起初部分烟雾在试管上部内壁冷凝析出淡黄色固体物质。在持续加热浓硫酸(沸腾)时,淡黄色固体物质有慢慢消失了。此间导气管出的气体分别使紫色石蕊试液变红,使品红溶液和KMnO4溶液褪色。当铜全部反应后,停止加热静置时,试管内的烟雾也随之慢慢消失了,试管中的液体呈浅蓝色,管底沉积的固体物质呈灰白色。继续冷却试管时,溶液颜色慢慢变浅,至室温时几乎无色。将此无色溶液注入盛有少量水的试管中,所得溶液变为浅蓝色。再向残留有灰白色固体的试管中滴加少量蒸馏水时,所得溶液呈蓝色,试管底部未溶固体的上层部分呈蓝色,下层仍为灰白色(久置时可变为蓝色)。 另一种情况是铜过量。用“实验装置图2”(固定仪器和加热酒精灯均未画出)完成此实验。为了便于观察有关反应现象和验证产物,将细铜丝一端卷成螺旋状没入浓硫酸中,另一端露置在液面上方(如图2所示)。长玻璃导管是让挥发的浓硫酸和水冷凝回流。开始加热反应时的现象与前者相同。随着反应的不断进行,试管和长导气管内壁有少量淡黄色固体物质凝聚。露置于试管液面上方的光亮铜丝逐渐变黑。一会儿后试管里的硫酸全部反应完,试管里的物质变为灰黑色的固体。取出试管中原来露置液面上变黑的铜丝,将其分别置于盛有一定量的浓硫酸和稀硫酸的两支试管中,震荡,铜丝表面的黑色物质不溶。若将光亮的铜丝
六氟磷酸锂—溶解在寂寞的最深处
六氟磷酸锂—溶解在寂寞的最深处 (本文版权归好磷网所有,仅作交流共享之用,转载请注明出处)这几天东北那边雾霾极其严重,PM2.5等污染物已然严重爆表,对人们的出行以及生产生活带来了极为不利的影响。围阻雾霾必需要从根源上解决能源问题才行,这更加坚定了国家发展新能源的决心。当然,我国也一直在行动,对于新能源的重视与投入十分巨大。那作为新能源的核心部件电池,其重要性也不言而喻,对于二次电池的研究,我国也是不遑多让,特别是在锂电领域,我国本土企业的产能已经排到世界第四的位置(比亚迪)。而作为锂离子电池的四大组成要素(正极材料、负极材料、电解液、隔膜)之一的电解液,自然成为科研人员的研究重点。今天我们就介绍一下组成锂电池电解液的宠儿—六氟磷酸锂。 我本无机物奈何存有机 六氟磷酸锂,白色结晶或粉末,相对密度1.50,性烈而厌水,含水量百万分之一(质量分数)即会反应,生成毒性物质氟化氢。加之其热稳定性差,60℃就会分解,所以,通常情况下它只能存放在无水的环境中,低温隔绝空气。当然,保存在有机溶剂中也是不错的选择。而它本身也易溶于碳酸乙烯酯(EC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)、乙二醇二甲醚(DME)、四氢吠喃(THF)等有机溶剂,所以为了保证自己的稳定性与可用性,必然是长存于暗无天日的绝世空间内,这是何等的寂寞与萧索啊! 那么它如何在锂电池里面发挥作用呢?它主要还是依托电解液,电解液相当于是在电池正、负极之间起传导作用的离子导体,承担着正负极之间传输电荷的作用,它对于电池的比容量、工作温度范围、循环效率及安全性能等至关重要。此外,电解液和电极材料之间还存在匹配性问题,即同一电极材料在不同的电解液体系中循环性能是不同的,故选择合适的电解液对电池的性能来说极为重要。传统的水溶剂体系的理论分解电压较低,满足不了锂离子电池的高电压要求,所以必须寻找其它非水电解液体系。因此,以锂盐为溶质溶于有机溶剂中制成的有机电解液便应运而生。含有六氟磷酸锂的有机电解液具有良好的导电性和电化学
六氟磷酸锂
锂离子电池电解液主要物质——六氟磷酸锂基本情况 一、六氟磷酸锂基本情况 在锂电池材料中,电解液是四大关键材料(正极、负极、隔膜、电解液)之一,电解液一般由电解质六氟磷酸锂稀释而来,六氟磷酸锂是电解液成分最重要的组成部分,约占到电解液总成本的43%。六氟磷酸锂作为锂离子电池电解质,主要用于锂离子动力电池、锂离子储能电池及其他日用电池,是近中期不可替代的锂离子电池电解质。 二、六氟磷酸锂国内主要生产厂家 在六氟磷酸锂国产化方面,主要上市公司为江苏国泰(002091)、多氟多 (002407.SZ)和九九久 (002411.SZ)。(2015年12月16日)江苏国泰(002091):控股子公司华荣化工(占78.895%)有2500吨锂电池电解液生产能力,国内市场占有率达到40%。 多氟多六氟磷酸锂现有产能2200吨/年,计划2016年初技改到3000吨/年,2016年第四季度产能扩产至6000吨/年; 九九久计划在现有的年产2000吨六氟磷酸锂装置的基础上,新建年产3000吨六氟磷酸锂生产装置,以形成年产5000吨六氟磷酸锂的生产规模; 江苏新泰材料科技有限公司计划在现有的年产1080吨六氟磷酸锂装置的基础上,投资新建年产6000吨六氟磷酸锂生产装置,以形成年产7080吨六氟磷酸锂的生产规模,项目预计投资2.5亿元; 广州天赐高新材料股份有限公司公告显示,公司六氟磷酸锂以自用为主,待1000吨/年锂离子电池电解质材料项目投产后,公司晶
体六氟磷酸锂产能合计为2000吨/年。天赐材料介绍,年产2000吨固体六氟磷酸锂项目,计划于2015年12月启动,2016年5月实施建设,2017年6月试产。 杉杉股份(600884):公司作为目前我国最大的锂离子电池材料综合供应商,形成了成熟完整的锂离子电池材料产品体系,产品种类覆盖锂电池正极材料、正极材料前驱体、负极材料及电解液产品。公司正极材料、负极材料、电解液市场占有率均位居国内前三位。 新宙邦(300037):公司是国内主要的锂离子电池电解液供应商之一,市场占有率超过20%,公司开始以在华外资锂电厂家为突破口,逐步向国际市场出口。 三、六氟磷酸锂生产工艺
六氟磷酸锂的热分解动力学研究
六氟磷酸锂的热分解动力学研究 姜晓萍,左翔,蔡烽,杨晖 (南京工业大学材料科学与工程学院,江苏南京210009) 六氟磷酸锂(LiPF6)是一种广泛使用的锂离子电池电解质材料,具有良好的导电性和电化学稳定性。但其热稳定性较差,当储存温度过高时易分解生成PF5气体,影响电解液的化学性质和电化学性能。而且六氟磷酸锂易水解,导致其与水反应释放HF气体,对锰酸锂(LiMn2O4)的循环性能有不良影响。目前已有很多针对LiPF6热分解性能的研究,但是LiPF6在不同条件下的热分解动力学还没有人研究过。LiPF6的动力学的研究对锂离子电池的失控模拟及安全性能预测有重要意义。 本文主要利用热重分析法(TGA)和傅里叶变换红外光谱法(FTIR)在线联用对LiPF6的热性质和气体逸出情况进行系统的研究和表征,同时找出LiPF6分解动力学特征。 1 实验 LiPF6标准样品由阿拉丁公司提供,纯度为99%。热重分析仪(TG2960)和傅里叶红外分析仪(FTIR)分别置于充满惰性气体的手套箱中,并使用草酸铜对惰性环境进行检查。所有实验中TG均放置使用连续流动的氩气(40 mL/min)的手套箱中,FTIR (分辨率为4 cm-1) 放置在另一个充满流动氮气(40mL/min)的手套箱中。所有实验均使用温度保持200 ℃的加热管连接TGA 与FTIR。TGA-FTIR 在线联用主要是为了表征逸出的气体。 利用真空容器将LiPF6样品从充满氩气的干燥箱(水含量<10×10-6)中转移到手套箱中。非等温分析是在不同加热速率下进行(2.5、5、10、20 ℃/min),等温分析是在恒定温度下反应1 h(110、130、150、170、190 ℃)。 2 结果与讨论 图1 为纯LiPF6样品的TG-DSC 曲线(TG 加热速率10 ℃/min,手套箱氩气的含水量小于10×10 -6,流动速率40 mL/min)。图1 中,TG曲线表明当温度达到300 ℃时,剩余固体的质量基本保持不变,为样品质量的17%,热分解过程达到稳定;DSC 曲线显示LiPF6的分解是一个吸热过程,分解焓为84.27 kJ/mol,在200 ℃左右有一个小的吸热峰出现在主峰上,原因是LiPF6发生了固相转变,相转变焓的文献值为(2.61±0.03) kJ/mol。 为了研究LiPF6在热分解过程中气态物质产生的原因是由于样品的热分解还是样品本身挥发,在TG测试过程中要同时进行FTIR 测试。图2红外堆积曲线显示热分解过程中PF5是唯一的气态产物。在图3红外谱图中,波数1018cm-1和976cm-1 处有较强的特征谱线,574cm-1 和534 cm-1处有较弱的特征谱线。分子轨道计算显示有两个化学反重合的F,表示PF5中的F(1)和F(2)。F(1)P的弯曲和拉伸模式位置为1 018cm-1和976 cm -1,F(2)P的弯曲和拉伸模式位置为976 cm-1和534 cm-1。弯曲和拉伸模式的波数的下降表明F(2)P的键强度比F(1)P 更弱。图2和图3中表明,通过FTIR探测,在110~300 ℃内,PF5是唯一的气相物质;同时由图1知,残留物质的质量是起始物质质量的17%,与LiF和LiPF6的质量比的计算值相符合。因此反应路径可以
浓硫酸与铜反应的实验改进实验报告
浓硫酸与铜反应的实验改进 长武中学陈宝凤 【问题的提出】 在研究浓H2SO4的化学性质时,Cu与浓H2SO4的反应是用来说明浓H2SO4具有很强的氧化性的一个典型反应,为使学生能全面理解并掌握这一重要化学反应,在教材中设计了有关铜和浓硫酸发生反应的演示实验。人教版教材必修一中的实验装置图为: 但若按教材中所提供的装置进行实验,很难得到预期的实验现象,在实验过程中过多的浪费药品,而且会产生大量的有毒气体污染环境,尾气处理得不够充分.人教版标准实验教科书中针对以上弊端作了如下改进:用长铜丝代替铜片,在胶塞一侧挖一个凹槽,使铜丝从凹槽处伸出,反应结束后,将铜丝抽出液面,反应即停止。但是,在实际操作时发现,在胶塞上挖凹槽大小不好把握,铜丝质地软,穿过胶塞后导致气密性不好,导出的气体不足,品红褪色现象不明显。.因此,我们应该从实验装置入手,在原有的基础上对实验进行必要的改进。 【实验目的】 1.认识浓硫酸与铜的反应,进一步了解SO2的性质。
2.学会发现问题,提出问题,进而学会运用学过的化学知识设计实验方案,从实验中学会得出结论解决问题。 3.培养思考能力和动手能力,体会设计实验以及验证实验的乐趣。【实验原理】 铜与浓硫酸之间反应的化学方程式如下: 2H2SO4(浓)+Cu===CuSO4+2H2O+SO2↑ Cu与浓H2SO4反应生成SO2说明浓H2SO4具有很强的氧化性,而产生的SO2具有漂白性,同时SO2也是一种酸性气体,在实验中可以用品红试纸验证SO2具有漂白性,用蓝色石蕊试纸验证SO2是一种酸性气体。 【实验装置图】 (说明)将5ml的注射器插入胶塞。在注射器的柱塞末端系上一段细铜丝,并在细铜丝的另一端系上一段螺旋状的粗铜丝,用于反应。
六氟磷酸锂的制备研究
六氟磷酸锂的制备研究 1 生产技术现状 目前,六氟磷酸锂的制备方法主要有气 - 固反应法、氟化氢溶剂法、有机溶剂法和离子交换法等 4种 [1-3] 。气 - 固反应法是将氟化锂( LiF )用无水氟化氢( HF )处理形成多孔 LiF ,然后通入五氟化磷( PF 5 )气体与多孔 LiF 反应,从而得到六氟磷酸锂。该方法操作较为简单,不使用任何溶剂,易于操作。但反应在高温高压下进行,反应生成的六氟磷酸锂容易将LiF 完全包覆,阻碍反应继续进行,反应不彻底,产品纯度较低,难以实现大规模工业化生产。有机溶剂法是采用制造锂离子电池电解液的有机溶剂如碳酸乙烯酯( EC )、碳酸二乙酯( DEC )、碳酸二甲酯( DMC )作溶剂,或者采用没有腐蚀性的有机络合剂来替代 HF ,常用的络合剂有乙腈、醚、吡啶等。将 LiF 悬浮于有机溶剂中通入 PF 5 ,反应后制得六氟磷酸锂。该工艺的优点是避免使用氟化氢,操作相对安全,降低了对设备的防腐要求。且反应中生成的六氟磷酸锂不断溶解在有机溶剂中,使反应界面不断更新,产率较高,并且得到的电解液可直接用于锂离子电池。缺点是 PF 5 与有机溶剂发生反应以及有机溶剂与六氟磷酸锂之间形成复合物,从而导致有机溶剂从最终产品中脱除较为困难的问题。离子交换法是将六氟磷酸盐与含锂化合物在有机溶剂中发生离子交换反应得到六氟磷酸锂的方法。该方法避免了使用 PF 5 为原料,反应一步到位;但制得的六氟磷酸锂纯度不高,一般都含有未反应完的其他六氟磷酸盐;原料价格较贵,一般只用于实验室制备。氟化氢溶剂法是将氟化锂溶解在无水氟化氢中形成 LiF · HF 溶液,通入高纯 PF 5 气体进行反应,生产六氟磷酸锂晶体,经过分离、干燥得到六氟磷酸锂产品。由于六氟磷酸锂与LiF 都容易溶解于 HF 中,因此反应在液相中发生均相反应,整个反应易于进 行和控制,具有反应速度快,产物转化率较高等优点。不足之处在于需要适当的耐氟材料,同时反应低温,必须采用惰性气体保护,能耗较大。该方法是目前工业上生产六氟磷酸锂的主要方法。 2 工艺技术进展 刘建文等将高纯氟化锂在密封搅拌条件下充分悬浮于无水乙腈溶液中,加压引入五氟化磷气体,反应合成高纯六氟磷酸锂。该方法使用无水乙腈代替 HF 作为溶剂,避免了 HF 溶剂法生产过程的危险性,使得生产过程对最终产品无杂质污染,同时避免了 HF 对生产设备的腐蚀,生产过程在室温下进行,能耗低;由于整个物相体系中只有 Lip6溶解于无水乙腈中,因此,该工艺反应速度快,生成的六氟磷酸锂纯度高,主含量大于 99.9% , HF 含量小于10ppm ,总杂质金属含量小于 50ppm ,水分含量小于10ppm 。宗哲等 [5] 用无水正磷酸、氟化钙与氧化硫反应,蒸发出 PF 5 气体;将蒸发出的 PF 5 气体脱水,得到高纯无水 PF 5 产品;将乙醚、无水乙腈分别脱水,得到高纯乙醚和无水乙腈;将高纯氟化锂加入乙醚液中;在上述液体中加入乙腈;然后在搅拌状态下,缓慢通入 PF 5 气体,反应完毕后,通入高纯度氮气,进行置换,直到容器内没有 PF 5 气体;将馏干的产物 Li(CH 3 CN) 4 PF 6 加热、分解制得六氟磷酸锂;将六氟磷(酸锂在室温溶解,形成 1M 浓度溶液,通过 0.2μm精密过滤器得到澄清溶液;干燥后得到六氟磷酸锂纯品。 刘红光等 [6] 在反应罐中将 MPF 6 溶于混合溶剂中后, MPF 6 与混合溶剂中的无水 HF 反应生成HPF 6 , HPF 6 在加热条件下不能稳定存在,分解形成PF 5 气体,所产生的 PF 5 气体在吸收罐中与无水LiF反应生成六氟磷酸锂。回流冷凝管中,通入冷却介质,使反应罐中蒸发的无水 HF 有一部分能够被冷凝下来,以保证 MPF 6 不断溶解,
六氟磷酸锂的生产工艺及检测
河南机电高等专科学校 毕业设计论文 论文题目:高纯六氟磷酸锂生产技术及影响因素 系部:电气工程系 专业:应用化工技术 班级:2009级01班 学生姓名:王磊 学号:090316125 指导教师:乔月纯 2012年03 月 9 日
目录 摘要 绪论 第1章六氟磷酸锂的制造工艺 1.1溶液法制备六氟磷酸锂 1.1.1 以有机电解质法制备六氟磷酸锂 1.1.2 以醚类作溶剂的生产工艺法 1.1.3 在络合剂基础上改进法 1.2 用无水氟化氢作溶剂的制备工艺 1.2.1 以无水氟化氢作为溶剂制备方法 1.2.2 改进的方法 1.3 以乙腈作为溶剂的制备工艺 1.3.1 用乙腈作溶剂法制备六氟磷酸锂方法的选择1.3.2 制备方法 1.4生产工艺特点 1.5 结论 第2章杂质对六氟磷酸锂性能的影响 2.1 水和氟化氢含量的影响 2.2 铁、镍、钠、铝等金属杂质影离子的影响2.3 杂质来源分析与产品质量的控制 第3章多方法联用检测六氟磷酸锂 3.1 GB/T 19282-2003分析方法 3.1.1 鉴别试验 3.1.2 六氟磷酸根的测定 3.1.3 锂含量的测定 3.1.4 杂质金属离子的含量 3.1.5 二甲氧基乙烷(DME)不溶物的测定 3.2 检测方法的新改进 3.2.1 定性检测 3.2.2 XRD分析 3.2.3 定量检测 3.3 检测方法的评价 第4章国内外六氟磷酸锂发展现状及市场前景 结束语 致谢 参考文献 附录
高纯六氟磷酸锂生产技术及影响因素 摘要:锂离子电池一般采用LiPF6作为其电解质。合成高纯度LiPF6的关键 是溶剂的选择,本文分别介绍了目前以无水氟化氢溶剂、溶液法和乙腈溶剂的LiPF6制备工艺的现状及优缺点,认为以乙腈做溶剂的工艺法可能是今后工艺开发的最佳方向。生产工艺有的固一液反应,有的为固-固反应,实现工业化比较困难。要实现工业化大生产就尽量减少操作单元,同时避免直接用固体作原料,且生产管线应要全封闭, 目的是避免空气和水分进人而生成可水解的含氧杂质,进而可生产高纯品。特别是用氟化氢作溶剂的工艺,应注意解决以下几个问题:①生产管线的堵塞②原料的经济性。 关键词:锂离子电池;六氟磷酸锂;制备方法;检测;影响因素 ABSTRACT Lithium ion battery generally uses LiPF6 as its electrolyte. Synthesis of high purity LiPF6 is key to the choice of solvent, this paper introduces the present with anhydrous hydrogen fluoride, solvent solution and acetonitrile solvent LiPF6preparation technology status and the advantages and disadvantages, think with acetonitrile as solvent in the process may be the future technology development best direction. Production process of some solid liquid reaction, some for the solid-solid reaction, implementation industrialization is more difficult. In order to realize the industrialized production can minimize the operation unit, while avoiding the direct use of solid material, and the production line should be closed, the purpose is to avoid air and water into the formation of hydrolyzable oxygen impurity, and can produce high purity products. Especially the use of hydrogen fluoride is used as a solvent in the process, should notice to solve the following problems : the production pipeline blockage of raw materials economy. Key Words:Lithium ion battery; six lithium hexafluorophosphate; preparation method; detection; influence factors
六氟磷酸锂的制备研究
六氟磷酸锂的制备研究1 生产技术现状 目前,六氟磷酸锂的制备方法主要有气 - 固反应法、氟化氢溶剂法、有机溶剂法和离子交换法等 4种 [1-3] 。气 - 固反应法是将氟化锂( LiF )用无水氟化氢( HF )处理形成多孔 LiF ,然后通入五氟化磷( PF 5 )气体与多孔 LiF 反应,从而得到六氟磷酸锂。该方法操作较为简单,不使用任何溶剂,易于操作。但反应在高温高压下进行,反应生成的六氟磷酸锂容易将LiF 完全包覆,阻碍反应继续进行,反应不彻底,产品纯度较低,难以实现大规模工业化生产。有机溶剂法是采用制造锂离子电池电解液的有机溶剂如碳酸乙烯酯( EC )、碳酸二乙酯( DEC )、碳酸二甲酯( DMC )作溶剂,或者采用没有腐蚀性的有机络合剂来替代 HF ,常用的络合剂有乙腈、醚、吡啶等。将 LiF 悬浮于有机溶剂中通入 PF 5 ,反应后制得六氟磷酸锂。该工艺的优点是避免使用氟化氢,操作相对安全,降低了对设备的防腐要求。且反应中生成的六氟磷酸锂不断溶解在有机溶剂中,使反应界面不断更新,产率较高,并且得到的电解液可直接用于锂离子电池。缺点是 PF 5 与有机溶剂发生反应以及有机溶剂与六氟磷酸锂之间形成复合物,从而导致有机溶剂从最终产品中脱除较为困难的问题。离子交换法是将六氟磷酸盐与含锂化合物在有机溶剂中发生离子交换反应得到六氟磷酸锂的方法。该方法避免了使用 PF 5 为原料,反应一步到位;但制得的六氟磷酸锂纯度不高,一般都含有未反应完的其他六氟磷酸盐;原料价格较贵,一般只用于实验室制备。氟化氢溶剂法是将氟化锂溶解在无水氟化氢中形成 LiF · HF 溶液,通入高纯 PF 5 气体进行反应,生产六氟磷酸锂晶
六氟磷酸锂资料
多氟多六氟磷酸锂量价齐升 生意社12月04日讯 多氟多(56.00, 0.20, 0.36%)六氟磷酸锂业务将进入量价齐升阶段。多氟多是全球最大的晶体六氟磷酸锂生产供应商之一,国内市场份额约30%,为比亚迪(61.82, -1.47, -2.32%)、杉杉股份(33.04, 0.04, 0.12%)、新宙邦 (41.600, -0.56, -1.33%)等主流电解液生产厂商广泛使用。目前多氟多六氟磷酸锂产能为2200吨,年底将达到3000吨产能,另外多氟多投资2亿元建设的3000吨六氟磷酸锂产能已开工建设,预计明年10月六氟磷酸锂总产能将达到6000吨,规模效应明显。 受上游碳酸锂价格上涨以及下游新能源车爆发式增长的影响,三季度以来六氟磷酸锂供应趋紧,价格持续上涨,目前价格已达到15万元/吨,相比年初涨幅约76%。六氟磷酸锂技术壁垒较高,生产难度较大,预计2016年六氟磷酸锂供应仍然紧张,行业产能增速小于需求增速,价格仍有上涨空间。随着多氟多六氟磷酸锂产能的释放,将进入量价齐升阶段,提升盈利。 锂电池产能快速扩张,在手订单充足,将充分受益于新能源汽车的爆发式增长。多氟多的锂电池已经发展了新大洋、时空、少林等一批稳固的客户,并不断开拓新客户,产品供不应求。为缓解产能瓶颈,多氟多积极扩张锂电池产能。目前动力锂电池产能达到1亿Ah,预计2015年年底或2016年年初将形成3亿Ah的产能。 另外定增6亿元建设的3亿安时能量型动力锂电池项目预计2016年投产,2016年年底公司锂电池总产能将达到6亿Ah。多氟多锂电池在手订单及订单意向充足,与新大洋签订了2016年订货合同,总价14-16亿元,并与南京金龙客车签订了总价6-8亿元的《战略合作意向书》。公司明年大部分锂电池的订单已锁定,新产能投产后将会很快释放,大幅增厚公司业绩。
浓硫酸与铜反应的实验改进实验报告
浓硫酸与铜反应的实验改进 【问题的提出】 在研究浓H2SO4的化学性质时,Cu与浓H2SO4的反应是用来说明浓H2SO4具有很强的氧化性的一个典型反应,为使学生能全面理解并掌握这一重要化学反应,在教材中设计了有关铜和浓硫酸发生反应的演示实验。人教版教材必修一中的实验装置图为: 但若按教材中所提供的装置进行实验,很难得到预期的实验现象,在实验过程中过多的浪费药品,而且会产生大量的有毒气体污染环境,尾气处理得不够充分,因此,我们应该从实验装置入手,在原有的基础上对实验进行必要的改进。 【实验目的】 1.认识浓硫酸与铜的反应,进一步了解SO2的性质。 2.学会发现问题,提出问题,进而学会运用学过的化学知识设计实验方案,从实验中学会得出结论解决问题。 3.培养思考能力和动手能力,体会设计实验以及验证实验的乐趣。【实验原理】 铜与浓硫酸之间反应的化学方程式如下: 2H2SO4(浓)+Cu===CuSO4+2H2O+SO2↑
Cu与浓H2SO4反应生成SO2说明浓H2SO4具有很强的氧化性,而产生的SO2具有漂白性,同时SO2也是一种酸性气体,在实验中可以用品红试纸验证SO2具有漂白性,用蓝色石蕊试纸验证SO2是一种酸性气体。 【实验仪器与试剂】
【实验装置图】 【实验步骤】 1.取适量浓硫酸加入到具支试管中,用量不超过试管体积的三分之一 (约10ml); 2.取铜丝穿过胶塞,使铜丝能在胶塞中上下活动,塞紧胶塞,然后将伸入试管中的铜丝一端拴上一束细铜丝,使铜丝下端没入浓硫酸之中; 3.在硬质玻璃管中分别放上湿润的品红试纸、湿润的石蕊试纸,在烧 杯中加入适量饱和NaOH溶液; 4. 如图组装好装置后,用酒精灯加热浓硫酸 5.待反应结束后,使大试管中浓硫酸与金属铜片发生脱离,移去酒 精灯,加热硬质玻璃管,观察试纸颜色的变化;
铜与浓硫酸反应实验现象的探究与分析
铜与浓硫酸反应实验现象的探究与分析 [摘要]铜与浓硫酸共热反应因两者的量不同,反应时的最终现象不同。若浓硫酸过量时,主要现象有:铜表面先变黑,形成黑色浊液,随后又变成白色浊液。铜全部反应完后,静置,灰白色物质沉于管底,所得溶液呈淡蓝色,冷却至室温呈无色。反应中还伴有白色烟雾,并有淡黄色物质冷凝在管壁。若铜过量,最终得灰白色固体物质。由此说明铜与浓硫酸共热的反应是很复杂的,且反应后所得溶液颜色随温度变化而变化。 高一新教材P131页关于铜与浓硫酸反应的实验叙述是这样的:“实验表明,浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊试液变红或使品红溶液褪色的气体,反应后生成物的水溶液显蓝色。说明铜与浓硫酸反应时被氧化为Cu2+”。 然而该实验的现象并非这么简单,且实验有两种情况: 一种情况是浓硫酸过量。用下列“实验装置图1”(固定仪器和加热酒精灯均未画出)来完成此实验。其实验现象有(按实验进程):铜与冷的浓硫酸不发生反应,加热时随浓硫酸温度升高铜丝(或铜片)表面变黑,产生气泡,细小黑色颗粒状物质从铜丝(或铜片)表面进入浓硫酸中,形成黑色的悬浊液。随着加热温度继续升高(至沸腾),黑色颗粒状物质与浓硫酸反应,转变成细小灰白色的颗粒状物质,随浓硫酸一起翻滚。在此过程中试管里还产生了大量的白色烟雾,起初部分烟雾在试管上部内壁冷凝析出淡黄色固体物质。在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢消失了。此间导气管导出的气体分别使紫色石蕊试液变红,使品红溶液和KMnO4溶液褪色。当铜全部反应后,停止加热静置时,试管内的烟雾也随之慢慢消失了,试管中的液体呈浅蓝色,管底沉积的固体物质呈灰白色。继续冷却试管时,溶液颜色慢慢变浅,至室温时几乎无色。将此无色溶液注入盛有少量水的试管中,所得溶液变为浅蓝色。再向残留有灰白色固体的试管中滴加少量蒸馏水时,所得溶液呈蓝色,试管底部未溶固体的上层部分呈蓝色,下层仍为灰白色(久置时可变为蓝色)。 安全紫色石品红KMO4 NaOH 装置蕊试液溶液溶液溶液 实验装置图1 实验装置图2
铜与浓硫酸反应异常现象的分析
铜与浓硫酸反应异常现象的探究 教案 学院:化学工程学院 班级:2014级化学本科班 姓名:范光鼎 学号:40271114110
铜与浓硫酸反应异常现象的分析 一、教学目标: 知识与能力: 1.学习浓硫酸与铜的反应,了解SO2的性质。 2.掌握铜与浓硫酸反应的实质。 过程与方法: 1.通过铜与浓硫反应的实验现象,学会发现问题,提出问题。 2.运用学过的化学知识设计实验方案,。 情感态度与价值观: 培养思考能力和动手能力,体会设计实验以及验证实验的乐趣。 二、教学方法: 讲授法,演示法,科学探究法,实验法。 三、教学重难点: 难点:解释实验中产生异常现象的原因。 重点:SO2的性质。 四、教学过程: 环节一,创设情境 根据金属活动性顺序表,我们都知道铜的活动性没有氢的大,但因为浓硫酸的强氧化性,铜是可以与浓硫酸反应的,而且反应过程中会发生一些异常现象。今天我们就来学习一下,首先我们先来学一下它们的反应的化学方程式, 主反应:2H2SO4(浓)+Cu===CuSO4+2H2O+SO2↑
注:(Cu+H2SO4(浓) = △ == CuO+SO2↑+H2O CuO+ H2SO4(浓) = △ == CuSO4+ H2O 从上述的方程式可以看出,浓硫酸与铜共热反应是分步进行的,铜先被浓硫酸氧化为黑色的氧化铜,氧化铜再与硫酸反应生成硫酸铜, 环节三:实验设计 提出问题:同学们思考一下,除了上述的现象外,还其他的吗? 学生思考并回答。 归纳总结学生观点,引导学生进行实验设计: 本次课我们需要的实验仪器与试剂有: 仪器:铁架台(带铁夹),酒精灯,,硬质玻璃管,烧杯,弯头导管,直导管,单孔橡胶塞,挡风板,棉花,试管, 试剂:浓硫酸 10ml ,铜片,氢氧化钠溶液,品红溶液,紫色石蕊试纸,高锰酸钾溶液, 环节四:学生实验 1.取适量浓硫酸加入到具支试管中,用量不超过试管体积的三分之一(约10ml); 2.取铜丝穿过胶塞,使铜丝能在胶塞中上下活动,塞紧胶塞,然后将伸入试管中的铜丝一端拴上一束细铜丝,使铜丝下端没入浓硫酸之中; 3.在硬质玻璃管中分别放上湿润的品红试纸、湿润的石蕊试纸,在烧杯中加入适量饱和NaOH溶液; 4. 如图组装好装置后,用酒精灯加热浓硫酸 5. 待反应结束后,使大试管中浓硫酸与金属铜片发生脱离,移去酒
六氟磷酸锂国内外生产概况
六氟磷酸锂国内外生产概况 全球六氟磷酸锂生产企业主要有日本的森田新能源(含森田在中国大陆张家港设的子公司)、关东电化和SUTERAKEMIFA;中国大陆的多氟多、天赐材料、天津金牛、九九久,中国台湾的台塑工业和韩国的蔚山化学,合计产能在10000多吨。这里没有包括韩国厚成以及国内若干小企业的生产。估计现在的实际产量是以上大企业的一倍,约三万吨。且由于生产过程中将产生大量的氯化氢气体,环保问题非常突出。由于无法处理氯化氢气体这个世界性环保难题,导致全球没有一家企业可以突破3000吨的产业规模。六氟磷酸锂全球产能很难跟上未来锂电池行业发展的需求。从数据判断新增产能每套也没有超过3000吨。以3000吨位单位的扩产很快就不能满足市场的需求,市场呼唤万吨级的专业生产厂。因为万吨级意味着不受瓶颈所限,继续就可以扩产到十万吨百万吨。越不过瓶颈的企业最后都会沦为二流六氟磷酸锂生产企业。 多氟多工艺技术路线:
工艺优点:虽然都使用了腐蚀性介质氟化氢,但由于五氟化磷与氟化锂都易溶于氟化氢中,可以在液相中发生均相反应.使整个反应易于进行和控制。 工艺缺点:结晶不易控制。残留在产品中的HF以配合物LiPF ·HF的形式存在于产品中,一般方法极难将HF质量分数降至1xl0-5以下.产品纯度受影响较大:残留HF对电池材料有腐蚀,从而影响电池电性能:该工艺对设备材质及防腐措施以及生产的安全措施要求均高.加大了资金投入:该工艺为深冷工艺,能耗大,生产成本高。 天津金牛电源材料有限责任公司 天津金牛电源材料有限责任公司是邢台矿业(集团)有限责任公司与中海油天津化工研究设计院2001年共同出资组建的集研发、生产、经营、服务与一体的高新技术企业,座落于天津新技术产业园区北辰科技工业园内。 有机溶剂法是采用制造锂离子电池电解液的有机溶剂如碳酸丙烯酯(PC)、碳酸甲乙酯(EMC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)为溶剂,添加催化剂或增溶剂制备液态六氟磷酸锂:或将制备六氟磷酸锂所需原料溶解在溶解性和分散性比较好的有机溶剂中进行反应,此类有机溶剂可选择无水乙腈、碳酸酯类、乙二醇二甲醚、无水乙醚、吡啶、四氢呋喃中的一种或多种。前者以中海油天津化工研究设计院为代表,工艺流程见图 4 E ]:后者以湖北诺邦化学有限公司为代表,工艺流程见图5I6J。
关于六氟磷酸锂热分解的问题
关于LiPF^热分解 六氟磷酸锂(LiPF)是一种广泛使用的锂离子电池电解质材料,具有良好的导电性和电化学稳定性。但其热稳定性较差,当储存温度过 高时易分解生成PH气体,影响电解液的化学性质和电化学性能。而且六氟磷酸锂易水解,导致其与水反应释放HF气体,对锰酸锂LiMn2O4的循环性能有不良影响。 下图对比了LiPF固体在密封体系(无水份)内,LiPFi在充有高纯度氩气(湿度约1ppm)的敞开体系内、LiPF在充有低纯度氩气(湿度约 20ppm)的敞开体系内的DSC热分析。从图中看到,3号曲线在60C处出现一个吸热峰,表明此时LiPF已开始发生分解,其反应式为: LiPF fe(s) + H^Otg) 一LiF(s) + OPF3(g) + 2HF(g) Fiif. I. DSC ihemHi^Riniii fur LiPfik. HhSmJrd pai: (21 upeni pan wilh high purily ■驹fliw*: iS)pan u-wh kw iT^un. 而OPR、HF等是导致锰离子溶解、电解液分解以及气体产生的 重要因素。 该项研究来自于第11届锂电会议,发表在Journal of power sources上,引用频率61次
Thermal stability of lithium*ion battery electrolytes Rar/rfnl, R; Abrahim KM; Grtzondannnr R T ML : 11th Irrfamatior^l Moetiig on I ittinim Batterias ?.1QNTtREY, CALIFORNIA L JUN 24 26, 2Q02 JOURNAL OF 卩 OWEFLEOUFtCES 电 1旧 SI jJl:8D&810 出颅 年 JUN 1 2003 而乔壬岀版南it 胡全丈 直君捕豐 轅弓t 談诫:61 -W 旦 WeijotSc-ence 时声
化学创新实验:铜与浓硫酸反应
化学创新实验: 铜与浓硫酸反应 一、实验名称:铜与浓硫酸反应 二、实验目的: 铜与稀硫酸不反应,但铜与浓硫酸可以发生氧化还原反应,除生成硫酸铜外,还生成二氧化硫和水,这证明了浓硫酸具有强氧化性。反应生成的二氧化硫为无色、有刺激性气味的有毒气体,是大气污染主要成分之一,实验过程中必须控制二氧化硫的生成量,还要进行尾气处理。该实验还助于加强环境教育,提高学生的环境意识,帮助学生认识环境和环境问题,培养学生的社会责任感。课本中给出了该实验的操作方法。为了控制二氧化硫的生成量,在试管侧面开凹槽以便于抽动铜丝而随时终止反应。为了证明二氧化硫的生成及其漂白性,教学参考书又给出了改进实验的操作装置图(如下图)。 我在实际教学过程中感到上述实验有明显的不足之处。开槽时要求既要保证密封性,又要便于抽动铜丝,这一点很难做到。开槽太小虽然密封性好,但在抽动铜丝时易拉动试管塞,由于浓硫酸对皮肤具有很强的腐蚀性,实验时浓硫酸又处于沸腾状态,产生的气压较大,这样浓硫酸易溅出而伤及实验人员。如果开槽稍微大一点,气体穿透能力很强,无法保证二氧化硫不漏出。 基于以上矛盾和问题,我把铜丝改为铜片,一次性加入。教学参考书中给出的装置图,要求控制二氧化硫的量,只要能够观察到品红溶液褪色而石蕊溶液变红色就抽动铜丝使反应停止下来。其实当我们观察到上述实验现象时二氧化硫就
已经过量,不可能恰到好处地通过抽动铜丝而控制二氧化硫的量。相反,我们根据经验控制铜片的量也可以很好地完成该实验。这样不仅保证了实验安全,而且我们还能够集中精力观察实验现象。 三、实验仪器及试剂 仪器:铁架台、酒精灯、试管、玻璃导管。 试剂:98%浓硫酸、铜片、品红溶液、石蕊溶液、氢氧化钠溶液。 四、实验仪器装置图(无论用手或电脑画都必须清晰)及仪器的组装说明 五、实验操作部分 1 放置好酒精灯,根据酒精灯的高度确定好试管的位置。在试管中加好试剂,按从下到上,从左到右的顺序如图安装仪器。 2 观察和分析试管中的实验现象。 六、装置改进的意义 1 避免了在抽动铜丝时产生的实验安全问题。浓硫酸在反应时处于沸腾状态,产生的二氧化硫气体气压较高,操作不慎易拉动试管塞产生浓硫酸的溅射。 2 便于观察和分析实验现象。由于实验减少了抽动铜丝环节,实验人员能够全心投入观察和分析实验现象。 2
关于六氟磷酸锂热分解的问题
关于LiPF^热分解 六氟磷酸锂(LiPF 6)是一种广泛使用的锂离子电池电解质材料, 具有良好的导电性和电化学稳定性。 但其热稳定性较差,当储存温度 过高时易分解生成P 后气体,影响电解液的化学性质和电化学性能。 而且六氟磷酸锂易水解,导致其与水反应释放 HF 气体,对锰酸锂 LiMmO 的循环性能有不良影响。 下图对比了 LiPF 6固体在密封体系(无水份)内,LiPF 6在充有高 纯度 氩气(湿度约1ppm 的敞开体系内、LiPF 6在充有低纯度氩气(湿 度约20ppm 的敞开体系内的DSC 热分析。从图中看到,3号曲线在 60 C 处出现一个吸热峰,表明此时 LiPF 6已开始发生分解,其反应式 为: LiFF 呑⑸ + HiO(g) 一 UF(s) + OPF 3(g) + 2HF(g) Rf. I. DSC U IETH 乍nintd fur LiPfL. 1]^Sndrd poi:(卽 upcni pan wilh high purily Brpxii flwfc : pankw piity 監弔LHI . 而OPF 、HF 等是导致锰离子溶解、电解液分解以及气体产生的 重要因素。 该项研究来自于第 11届锂电会议,发表在 Journal of power sources 上,引用频率61 次
I I 8 Thermal stability of lithium-ion battery electrolytes 乍肴.Rovdel, B. Abraham. KM, Gitzcndanncr, R,等 会议:11th IntemaUonal Meeting on Lithium Battenes 会评地点: MONTFRFY. CAI IFORNIA 合该日餌 JUN 24-28 ?002 JOURNAL OF POWER SOURCES ^119 苓刊 SI 页-805-810 岀绸 年:JUN 1 2003 审丙出版商处的全文 査呑摘要 祓引频次:61 (来刍 Web of Science 的檢 £合匍
Cu与浓硫酸的反应
前述在高中化学的教学当中,我们势必会学到硫与硫酸的章节,在这章里面,为了使学生充分了解到硫处于最高氧化态时的含氧酸——硫酸的氧化性,都会做金属铜和浓硫酸反应的实验。在这个实验里面,铜被氧化体现了浓硫酸的强氧化性,生成二价铜盐又反映出浓硫酸的强酸性。考试时同学们在描述现象会说:“铜溶解,产生蓝色溶液以及能够使品红溶液褪色的刺激性气体。”当我们实际操作的时候却发现,铜和浓硫酸反应过后留下了许多不能解释的黄褐色以至灰色的产物,有时还会出现黑色的小颗粒,这就与简单的理想实验描述大相径庭,这些产物到底是什么呢?究竟以怎么样的物料加入量反应,才能够使学生直观清晰地通过实验现象看到他们所要了解的知识呢? 一实验探究过程论述将分开笔者实验和文献实验。首先是笔者实验。 笔者采取18.4mol/L 的浓硫酸5mL 和一片铜片置于试管内用酒精灯加热,按照课本的要求进行实验,反应持续有4min 左右时试管内反应液沸腾,出现雾状液滴悬浮在管内空间中,另一头连接的品红稀溶液褪色 (由鲜艳的粉红变为透明) 。这证明产生了二氧化硫,实验的确存在我们期待的产物。试管内产生了灰黑色物质,铜尚未完全溶解。待冷却后除去反应装置,经过称重,铜溶解了大概三分之二。对灰色物质干燥以后,笔者提出了自己的猜测。 ①灰黑色物质是硫化亚铜和氧化铜的混合物。 ②灰黑色物质仅仅是铜的硫化物。 ③灰黑色物质可能既有铜氧化物和铜硫化物,也可能产生了硫单质。为了验证自己的假设,笔者有针对性地进行了几个实验。 (1).用湿润的玻璃棒沾取少许灰黑色物质放置在塑料点滴板中,滴加少许浓盐酸,等待一段时间后发现固体 无明显溶解。 (2).以上面的方法取灰黑色物质在塑料点滴板内,滴加浓硝酸若干,经一段时间之后,产生很淡的二氧化氮气体,但固体仍然没有明显发生溶解。
