化学元素核外电子排布表
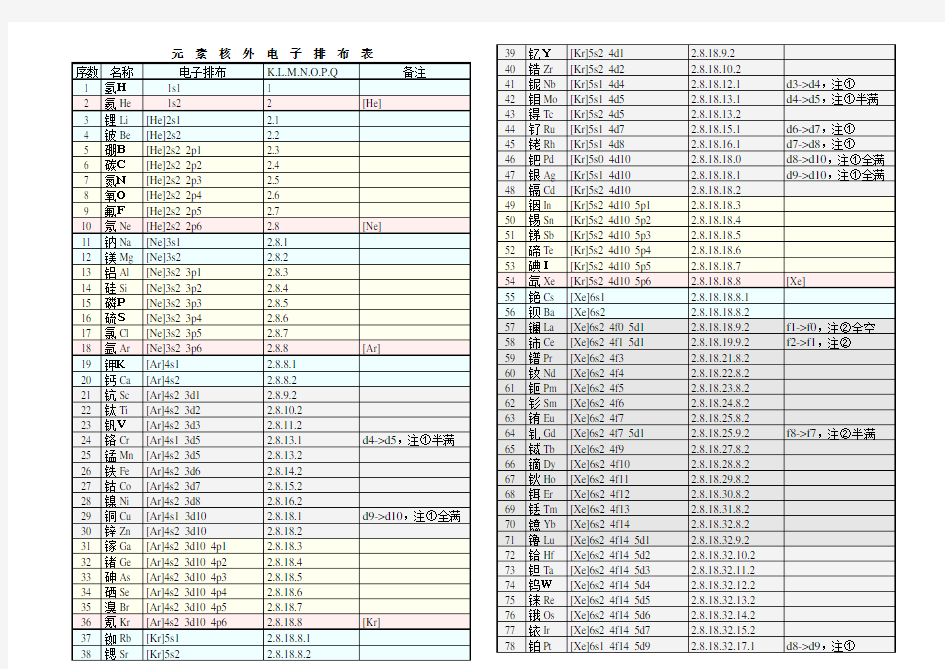
元素核外电子排布表
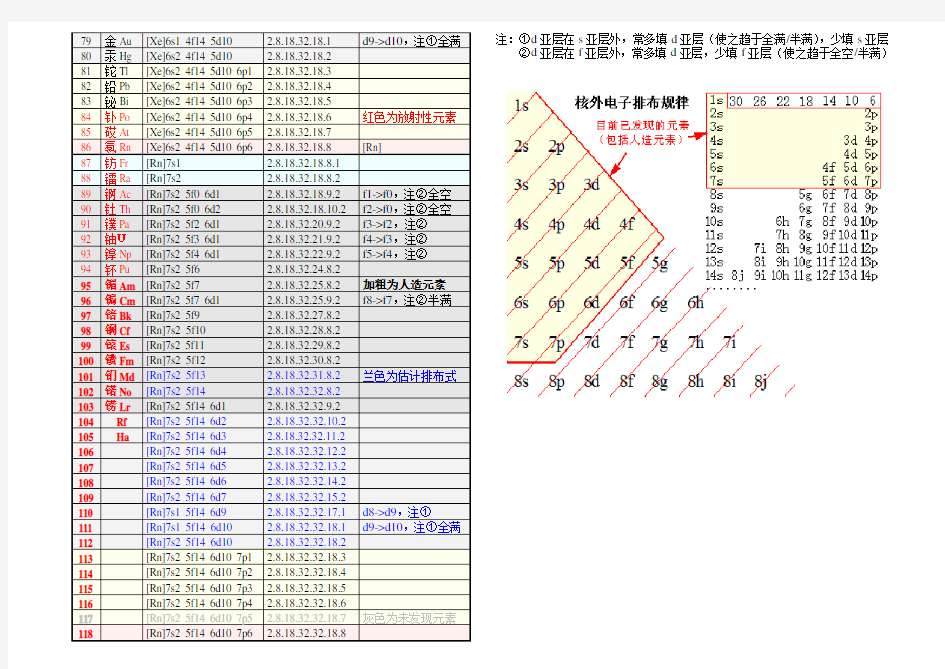
注:①d 亚层在s 亚层外,常多填d 亚层(使之趋于全满/半满),少填s 亚层
②d 亚层在f 亚层外,常多填d 亚层,少填f 亚层(使之趋于全空/半满)
化学元素核外电子排布表教学文稿
元素核外电子排布表 精品文档
76 锇Os [Xe]6s2 4f14 5d6 2.8.18.32.14.2 77 铱Ir [Xe]6s2 4f14 5d7 2.8.18.32.15.2 78 铂Pt [Xe]6s1 4f14 5d9 2.8.18.32.17.1 d8->d9,注① 79 金Au [Xe]6s1 4f14 5d10 2.8.18.32.18.1 d9->d10,注①全满 80 汞Hg [Xe]6s2 4f14 5d10 2.8.18.32.18.2 81 铊Tl [Xe]6s2 4f14 5d10 6p1 2.8.18.32.18.3 82 铅Pb [Xe]6s2 4f14 5d10 6p2 2.8.18.32.18.4 83 铋Bi [Xe]6s2 4f14 5d10 6p3 2.8.18.32.18.5 84 钋Po [Xe]6s2 4f14 5d10 6p4 2.8.18.32.18.6 红色为放射性元素 85 砹At [Xe]6s2 4f14 5d10 6p5 2.8.18.32.18.7 86 氡Rn [Xe]6s2 4f14 5d10 6p6 2.8.18.32.18.8 [Rn] 87 钫Fr [Rn]7s1 2.8.18.32.18.8.1 88 镭Ra [Rn]7s2 2.8.18.32.18.8.2 89 锕Ac [Rn]7s2 5f0 6d1 2.8.18.32.18.9.2 f1->f0,注②全空 90 钍Th [Rn]7s2 5f0 6d2 2.8.18.32.18.10.2 f2->f0,注②全空 91 镤Pa [Rn]7s2 5f2 6d1 2.8.18.32.20.9.2 f3->f2,注② 92 铀U[Rn]7s2 5f3 6d1 2.8.18.32.21.9.2 f4->f3,注② 93 镎Np [Rn]7s2 5f4 6d1 2.8.18.32.22.9.2 f5->f4,注② 94 钚Pu [Rn]7s2 5f6 2.8.18.32.24.8.2 95 镅Am [Rn]7s2 5f7 2.8.18.32.25.8.2 加粗为人造元素 96 锔Cm [Rn]7s2 5f7 6d1 2.8.18.32.25.9.2 f8->f7,注②半满 97 锫Bk [Rn]7s2 5f9 2.8.18.32.27.8.2 98 锎Cf [Rn]7s2 5f10 2.8.18.32.28.8.2 99 锿Es [Rn]7s2 5f11 2.8.18.32.29.8.2 100 镄Fm [Rn]7s2 5f12 2.8.18.32.30.8.2 101 钔Md [Rn]7s2 5f13 2.8.18.32.31.8.2 兰色为估计排布式102 锘No [Rn]7s2 5f14 2.8.18.32.32.8.2 103 铹Lr [Rn]7s2 5f14 6d1 2.8.18.32.32.9.2 104 Rf [Rn]7s2 5f14 6d2 2.8.18.32.32.10.2 105 Ha [Rn]7s2 5f14 6d3 2.8.18.32.32.11.2 106 [Rn]7s2 5f14 6d4 2.8.18.32.32.12.2 107 [Rn]7s2 5f14 6d5 2.8.18.32.32.13.2 108 [Rn]7s2 5f14 6d6 2.8.18.32.32.14.2 109 [Rn]7s2 5f14 6d7 2.8.18.32.32.15.2 110 [Rn]7s1 5f14 6d9 2.8.18.32.32.17.1 d8->d9,注① 111 [Rn]7s1 5f14 6d10 2.8.18.32.32.18.1 d9->d10,注①全满112 [Rn]7s2 5f14 6d10 2.8.18.32.32.18.2 113 [Rn]7s2 5f14 6d10 7p1 2.8.18.32.32.18.3 114 [Rn]7s2 5f14 6d10 7p2 2.8.18.32.32.18.4 115 [Rn]7s2 5f14 6d10 7p3 2.8.18.32.32.18.5 116 [Rn]7s2 5f14 6d10 7p4 2.8.18.32.32.18.6 117 [Rn]7s2 5f14 6d10 7p5 2.8.18.32.32.18.7 灰色为未发现元素118 [Rn]7s2 5f14 6d10 7p6 2.8.18.32.32.18.8 ②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满) 精品文档
高中化学《原子核外电子排布与元素周期律》教案9苏教版必修2.doc
专题一:微观结构与物质的多样性第一单元:原子核外电子排布与元 素周期律第一课时 一、教学目标 课标内容:了解原子核外电子的排布 会考考纲: 1.了解核外电子的排布(B) 2.能画出1~18 号元素的原子结构示意图(B) 教学目标: (一)知识与技能 原子核外电子排布规律 (二)过程与方法 掌握原子核外电子排布规律,通过 1-20 号元素的原子和离子结构示意图的学习,扩展到主族元素的电子排布规律的认识,初步体会归纳与演绎的学习方法。 (三)情感与价值观 通过原子核外电子排布规律,了解物质运动的复杂性和特殊性 二、教学重、难点和突破方法 教学重点:了解原子的结构,能画出1~18 号元素的原子结构示意图 教学难点:核外电子排布规律 三、教学过程: (一)设计思路 由原子的构成→原子核外电子分层排布运动→原子核外电子排布规律 (二)教学媒体和教具 学案、练习题、图表 (三)课堂教学流程 1.创设情境,引入新课 下表是构成原子的各微粒的一些参数,请根据表中所提供的信息回答问题: 表 1 微粒质量 /kg 相对质量电性和电量 /C 质子 1. 673×10 -27 1.007 +1. 602×10 -19 中子 1. 675× 10-27 1.008 0 电子9. 109×10 -31 1/1836 -1. 602×10 -19 问题解决: 1.原子是由、和三部分构成的。 2.在原子中,质量集中在上,其大小是由和之和决定的。 3.在原子中:== 4.原子不显电性的原因: 交流与讨论:原子核带正电荷,核外电子带负电荷,正负电荷相互吸引,那为什么电子 不会落入原子核内呢? 2.进行新课
过渡期元素核外电子排布
一、原子核外电子排布的原理 处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。 1.最低能量原理 电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p…… 2.保里不相容原理 我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的。根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间)。根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子。我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子。 3.洪特规则
人教版高中化学必修2《1.2.1原子核外电子的排布 元素周期律》巩固练习及答案
人教版高中化学必修2《1.2.1原子核外电子的排布元素周期 律》巩固练习及答案 1.元素的性质呈周期性变化的根本原因是( )。 A.元素原子量的递增,量变引起质变 B.元素的原子半径呈周期性变化 C.元素原子的核外电子排布呈周期性变化 D.元素的金属性和非金属性呈周期性变化 【解析】元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果。 【答案】C 2.已知最外层电子数相同的原子具有相似的化学性质。氧原子的核外电子分层排布示意图为 ,则下列原子中,与氧原子的化学性质相似的是( )。 【解析】氧原子最外层电子数为6,C项所示原子最外层电子数也是6。 【答案】C 3.下列叙述中不符合 ...原子核外电子排布基本规律的是( )。 A.核外电子总是优先排在能量最低的电子层上 B.K层是能量最低的电子层 C.N电子层为次外层时,最多可容纳的电子数为18 D.各电子层(n)最多可容纳的电子数为n2 【解析】第n电子层最多可容纳的电子数为2n2。 【答案】D 4.A和B是两种短周期元素,A-和B2+具有相同的电子层结构,下列说法中正确的是( )。 A.原子序数:A>B B.电子总数:A>B C.原子半径:A>B D.离子半径:A->B2+ 【答案】D 5.下列各组元素性质的递变规律错误 ..的是( )。 A.Li、Be、B原子最外层电子数依次增多 B.P、S、Cl元素最高正价依次升高 C.Na、K、Rb的电子层数依次增多 D.N、O、F原子半径依次增大 【解析】此题考查元素性质的递变规律,随着原子序数的递增,原子结构、原子半径、元素的金属性和非金属性呈周期性的变化,A、B、C三项均正确,D项中原子半径应是依次减小。 【答案】D 6.已知33As、35Br位于同一周期,下列关系正确的是( )。 A.原子半径:As>Cl>P
化学元素核外电子排布表
元素核外电子排布表 只供学习与交流
76 锇Os [Xe]6s2 4f14 5d6 2.8.18.32.14.2 77 铱Ir [Xe]6s2 4f14 5d7 2.8.18.32.15.2 78 铂Pt [Xe]6s1 4f14 5d9 2.8.18.32.17.1 d8->d9,注① 79 金Au [Xe]6s1 4f14 5d10 2.8.18.32.18.1 d9->d10,注①全满 80 汞Hg [Xe]6s2 4f14 5d10 2.8.18.32.18.2 81 铊Tl [Xe]6s2 4f14 5d10 6p1 2.8.18.32.18.3 82 铅Pb [Xe]6s2 4f14 5d10 6p2 2.8.18.32.18.4 83 铋Bi [Xe]6s2 4f14 5d10 6p3 2.8.18.32.18.5 84 钋Po [Xe]6s2 4f14 5d10 6p4 2.8.18.32.18.6 红色为放射性元素 85 砹At [Xe]6s2 4f14 5d10 6p5 2.8.18.32.18.7 86 氡Rn [Xe]6s2 4f14 5d10 6p6 2.8.18.32.18.8 [Rn] 87 钫Fr [Rn]7s1 2.8.18.32.18.8.1 88 镭Ra [Rn]7s2 2.8.18.32.18.8.2 89 锕Ac [Rn]7s2 5f0 6d1 2.8.18.32.18.9.2 f1->f0,注②全空 90 钍Th [Rn]7s2 5f0 6d2 2.8.18.32.18.10.2 f2->f0,注②全空 91 镤Pa [Rn]7s2 5f2 6d1 2.8.18.32.20.9.2 f3->f2,注② 92 铀U[Rn]7s2 5f3 6d1 2.8.18.32.21.9.2 f4->f3,注② 93 镎Np [Rn]7s2 5f4 6d1 2.8.18.32.22.9.2 f5->f4,注② 94 钚Pu [Rn]7s2 5f6 2.8.18.32.24.8.2 95 镅Am [Rn]7s2 5f7 2.8.18.32.25.8.2 加粗为人造元素 96 锔Cm [Rn]7s2 5f7 6d1 2.8.18.32.25.9.2 f8->f7,注②半满 97 锫Bk [Rn]7s2 5f9 2.8.18.32.27.8.2 98 锎Cf [Rn]7s2 5f10 2.8.18.32.28.8.2 99 锿Es [Rn]7s2 5f11 2.8.18.32.29.8.2 100 镄Fm [Rn]7s2 5f12 2.8.18.32.30.8.2 101 钔Md [Rn]7s2 5f13 2.8.18.32.31.8.2 兰色为估计排布式102 锘No [Rn]7s2 5f14 2.8.18.32.32.8.2 103 铹Lr [Rn]7s2 5f14 6d1 2.8.18.32.32.9.2 104 Rf [Rn]7s2 5f14 6d2 2.8.18.32.32.10.2 105 Ha [Rn]7s2 5f14 6d3 2.8.18.32.32.11.2 106 [Rn]7s2 5f14 6d4 2.8.18.32.32.12.2 107 [Rn]7s2 5f14 6d5 2.8.18.32.32.13.2 108 [Rn]7s2 5f14 6d6 2.8.18.32.32.14.2 109 [Rn]7s2 5f14 6d7 2.8.18.32.32.15.2 110 [Rn]7s1 5f14 6d9 2.8.18.32.32.17.1 d8->d9,注① 111 [Rn]7s1 5f14 6d10 2.8.18.32.32.18.1 d9->d10,注①全满112 [Rn]7s2 5f14 6d10 2.8.18.32.32.18.2 113 [Rn]7s2 5f14 6d10 7p1 2.8.18.32.32.18.3 114 [Rn]7s2 5f14 6d10 7p2 2.8.18.32.32.18.4 115 [Rn]7s2 5f14 6d10 7p3 2.8.18.32.32.18.5 116 [Rn]7s2 5f14 6d10 7p4 2.8.18.32.32.18.6 117 [Rn]7s2 5f14 6d10 7p5 2.8.18.32.32.18.7 灰色为未发现元素118 [Rn]7s2 5f14 6d10 7p6 2.8.18.32.32.18.8 ②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满) 只供学习与交流
《核外电子排布和元素周期表》
教材分析 《核外电子排布和元素周期表》是人教版九年级化学上册第四单元单元课题 子第一知识点《核外电子的排布》和课题 2:元素第三知识点《元素周期表简介》的内容。 通过核外电子的排布的教学使学生更容易理解元素周期表的特点,这样安排便于让前后知 识贯通,使教学的连贯性更强。本课时是在学生已经较好掌握原子的结构和元素基本知识 的基础上进行的,并为下一课时进行离子形成做好基础铺垫。 学情分析 为顺利完成本课时的教学要求,突出重点,帮助学生突破难点,我将采用讲练相结 合的教学方法,运用以引导讨论和指导练习为主,多媒体 PPt 课件直观展示、总结为辅的 手段进行组织教学。同时引导学生勤动手、多动脑、相互合作的学法来完成本课时的各项 教学任务。 教学目标 1、知道原子核外电子是分层排布的。 2、理解原子结构示意图含义,掌握前 18号元 素的原子结构示意图的书写。 3、通过观察1--18号元素的原子结构示意图,了解元素周期 表的特点。 教学重点和难点 重点:理解原子结构示意图含义,掌握前18号元素的原子结构示意图的书写。 难点:原子结构示意图的书写 和元素周期表的特点。 教学过程 课题 作单位 基本信息 3:离
1、原子是不是实心球体? 2、原子由哪些粒子构成?粒子 间存在什么关系? 3、原子核外电子是怎么排布 的呢? 、核外电子排布(板书) 1、出示原子结构平面图, 让学生数一数质子和电子的个 学生根据质子数,能较好 得出是钠原子的平面图,并 根据电子个数能得出质子数 等于核外电子数。 数。(问)这是什么元素的原 幻灯片,并介绍核外电子排布 3、(问)如果每一种原子结 1、 同心圆不好画。 2、 用圆点代表粒子不好 数 构都用平面图,有很多缺陷, 那怎么办? 教学环 节 教师活动 预设学生行为 设计意图 子是分层排布的。 引课 (设疑引课) 学生能正确完成所涉及 内容 温故所学知识,为 下一步教学做好铺垫 子?从这幅图你能知道什么信 息? 2、引导出示PPt 中第三副 通过幻灯片展示让 抽象的微观粒子直观 化,便于学生的理解掌 握,降低知识认知的难 度。知 道原子核外电 特点。
高中化学 1.2元素周期律(第1课时)原子核外电子的排布学案 新人教版必修2
原子核外电子的排布 1.了解原子的核外电子能量的高低与分层排布的关系。 2.了解原子的核外电子分层排布的规律。 电子层数由内向外 数字表示法 1 2 3 4 5 6 7 字母表示法K L M N O P Q 离核远近由较近到较远 电子能量由较低到较高 【应用思考】 1.讨论分析元素的化学性质主要取决于原子结构的哪部分。 提示:原子核外电子离核越远,能量越高,活泼性越强,故原子发生化学反应时,主要是最外层电子发生变化。所以元素原子的化学性质主要取决于原子核外的电子层数和最外层电子数。 2.前20号元素与稀有气体原子电子层结构相同的离子: (1)与Ne原子电子层结构相同的离子有:________; (2)与Ar原子电子层结构相同的离子有:________。 提示:(1)F-、O2-、N3-、Na+、Mg2+、Al3+ (2)Cl-、S2-、P3-、K+、Ca2+
1.下列叙述正确的是(B) A.电子的能量越低,运动区域离核越远 B.核外电子的分层排布即是核外电子的分层运动 C.稀有气体元素原子的最外层都排有8个电子 D.当M层是最外层时,最多可排布18个电子 2.核电荷数分别是16和4的元素原子相比较,前者的下列数据是后者4倍的是(B) ①质子数②最外层电子数③电子层数④电子总数 A.①②B.①④ C.②③ D.③④ 3.下列各原子结构示意图中所表示的核外电子排布正确的是(C) 基础训练 1.下列微粒中,核外电子总数为10的是(A) A.Na+ B.CO2 C.CO D.N2 解析:A.钠原子有11个电子,Na+核外电子总数为10,故A正确;B.碳原子有6个电子,氧原子有8个电子,CO2中核外电子总数是22,故B错误;C.碳原子有6个电子,氧原子有8个电子,CO中核外电子总数是14,故C错误;D.氮原子有7个电子,N2核外电子总数是14,故D错误;故选A。 2.下列叙述中,正确的是(C) A.核外电子排布完全相同的两种微粒,其化学性质一定相同 B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 C.核外电子排布相同的两原子一定属于同种元素 D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 解析:核外电子排布完全相同的两种微粒,化学性质不一定相同,如K+和Cl-,A项错;
化学,原子核外电子排布规律
原子核外电子排布规律 1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对 2、能量最低原理:电子尽可能占据能量最低的轨道 3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子 另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的: 全充满---p6或d10 或f14 半充满----p3或d5或f7 全空-----p0 或d0或f0 还有少数元素(如某些原子序数较大的过渡元素和镧系、锕系中的某些元素)的电子排布更为复杂,既不符合鲍林能级图的排布顺序,也不符合全充满、半充满及全空的规律。而这些元素的核外电子排布是由光谱实验结构得出的,我们应该尊重光谱实验事实。 对于核外电子排布规律,只要掌握一般规律,注意少数例外即可。 处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前3 6号元素里,没有例外的情况发生。 1.最低能量原理 电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p…… 2.保里不相容原理 我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的。根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯
1~36号元素基态原子的核外电子排布
1~36号元素基态原子的核外电子排布 广东郑春平 基态原子是处于能量最低状态下的原子,基态原子的核外电子排布,决定了元素周期表的划分和原子半径的变化规律。要认识基态原子的核外电子排布,必需要掌握排布原则和电子在原子轨道上的排布顺序。. 一、基态原子的核外电子排布三大原则 1、能量最低原则:核外电子的排布要使整个原子的能量最低,以形成稳定结构。 2、泡利不相容原理:一个原子轨道中最多只能容纳两个电子,并且这两个电子 的自旋方向必须相反。 3、洪特规则:对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占 不同的轨道并且自旋方向相同。 洪特规则实际上是为了更好的遵循能量最低原则,根据光谱实验结果,洪特进一 步指出,能量相同的原子轨道在全充满(p6和d10)、半充满(p3和d5)和全空(p0和 d0)状态时,体系能量最低,原子最稳定。 二、电子在原子轨道上的排布顺序 多电子原子中,电子填充电子轨道时,一般先填满能量低的轨道,再填能量高的轨道原子轨道能量的高低存在以下规律: 1、相同电子层上原子轨道能量的高低:ns 原子核外电子排布规律 ①能量最低原理:电子层划分为K 2021-2022年高中化学第4讲:原子核外电子排布及其元素周期系辅导———————————————————————————————————————— 一、知识补充: 1.核外电子排布 要分清楚核外的填充式和核外电子的排布式。核外电子的排布式是根据主量子数和角量子数的大小确定的。主量子数即电子层数或周期数,角量子数即电子亚层。而电子填充式要考虑能级交错。所谓能级交错现象就是某些亚层电子(如s 电子)钻穿能力很强,能钻穿到离核较近的区域。从第四周期开始,一些元素原子的电子就开始发生能级交错。如:Sc的核外电子排布式:1s22s22p63s23p63d14s2;Sc的核外电子填充式:1s22s22p63s23p64s23d1。 2.元素的性质 元素性质牵涉到元素的电负性、电离能和电子亲合能。 (1)电负性 元素的电负性是指周期表中各元素的原子在分子中对成键电子的吸引能力的一种相对标度。元素的电负性愈大,表明原子在形成化学键时对成键电子的吸引力越强,非金属性也愈强。 (2)电离能 电离能(I)是指基态的气态原子失去电子形成气态阳离子时所吸收的能量。由于原子失去电子必须消耗能量克服核对外层电子的引力,所以电离能总为正值,单位常用kJ?mol-1。 电离能可以定量比较气态原子失去电子的难易,电离能越大,原子越难失去电子,其金属性越弱;反之金属性越强。影响电离能大小的因素是:有效核电荷、原子半径和原子的电子构型。 (3)电子亲合能 元素的气态基态原子获得电子成为气态阴离子所释放的能量称为该元素的电 子亲合能,简称电子亲合能 .....(E)。电子亲合能的大小反映了原子获得电子的难易。亲合能数值越大,则气态原子结合电子释放的能量越多,与电子的结合越稳定,表明该元素的原子越易获得电子,故非金属性越强。反之亦然。 二、考试真题: (xx年北大)已知某元素的原子序数是50,试推测该元素 (1)原子的电子层结构; (2)处在哪一周期哪一族? (3)是金属还是非金属? (4)最高氧化态及其氧化物的酸碱性。核外电子排布规律总结
2021-2022年高中化学 第4讲:原子核外电子排布及其元素周期系辅导
