外生菌根

丛枝菌根真菌在园艺作物上的应用
丛枝菌根真菌在园艺作物上的应用1 邹英宁,吴强盛* 长江大学园艺园林学院,湖北荆州(434025) E-mail:wuqiangsh@https://www.360docs.net/doc/427536468.html, 摘要:丛枝菌根是土壤中的丛枝菌根真菌与植物根系结合的互惠共生体,能帮助植物吸收矿质营养和水分、促进植物生长、提高抗逆性、改善果实品质等。提出了丛枝菌根真菌生产的技术流程,综述了丛枝菌根真菌在果树、蔬菜、花卉植物上的应用与效应。 关键词:丛枝菌根真菌;丛枝菌根;园艺作物;菌剂生产 中图分类号:Q939.96 1. 引言 菌根(Mycorrhizas)是一类与植物根系紧密结合互惠互利的联合体,其互惠互利表现在菌根通过其根系外的菌丝、根系内的丛枝及根内特殊的水分运输通道给寄主植物运送矿质营养和水分,而寄主植物将光合作用产生的碳水化合物通过物质流转运给菌根以维持其生长发育[1]。菌根按照形态学分为三类:外生菌根(Ectomycorrhizas)、丛枝菌根(Endomycorrhizas)和内外生菌根(Ectoendomycorrhizas)[2]。外生菌根指菌根真菌侵入到植物根系的皮层,在间隙里形成哈蒂氏网,大量的菌丝在根系外面形成一个菌套,主要与森林植物共生;丛枝菌根指菌根菌丝不仅侵入到根系皮层,而且还进入到细胞内部,形成丛枝(Arbuscules)结构,有的还在细胞间或者内部形成泡囊(Vesicles),在许多园艺作物如柑桔、桃、苹果、梨、番茄、西瓜、非洲菊、月季等都可以发现和找到这种结构;内外生菌根则同时具备外生菌根和丛枝菌根的特性,菌根菌丝在细胞间隙形成哈蒂氏网,根系表面形成菌套,菌丝在细胞内部也形成各种菌丝团,主要在一些松科和杜鹃花科植物存在。目前的研究表明,在园艺作物上接种丛枝菌根真菌能够促进园艺作物的生长,增强园艺作物对矿质营养的吸收,提高抗逆性,改善水分代谢,提高果树和蔬菜的品质等[3]。因此,在园艺作物根系上没有丛枝菌根的存在反而不正常[4],从而显示丛枝菌根在园艺作物上的重要性 2. 丛枝菌根真菌菌剂的生产 丛枝菌根真菌菌剂的生产是其应用于园艺作物的关键。尽管丛枝菌根真菌至今尚不能进行纯培养,但采用盆栽菌剂生产法[5]仍可以获得一定纯度的菌剂,其具体生产流程是:选择玉米或高梁为寄主植物,对其种子采用10%的次氯酸钠溶液表面消毒5~10 m,然后放置在一个湿巾上,用塑料袋包好进行催芽。一般玉米种子在2~3 d就能够发芽。选择3 mm大小的粉碎玄武岩为栽培基质,目的是基质含有非常低的营养水平,特别是P。然后对基质进行高压蒸汽灭菌,杀死土著丛枝菌根真菌。灭菌的基质与购买的纯菌剂(可以从北京市农林科学院植物营养与资源研究所“中国丛枝菌根真菌种质资源库(BGC)”购买)按照20:1(v/v)的比例混合均匀,装于15~25 cm直径的塑料盆中。将已经催芽的种子每盆播2~6粒,然后放置在温室或良好光照的避雨棚中以减少其他微生物通过风和雨水的污染。一般地,在正常水分管理的6 w后就能够观察到丛枝菌根真菌与寄主植物根系共生。14 w后开始控水,16 w时去除植物地上部分,将基质和根系倒在一个干净的盘中,把根系剪断,与栽培基质混合均匀,此菌剂即可应用于田间。如果菌剂不及时使用,可以保存在4 °C冰箱或凉爽干 1本课题得到长江大学科研发展基金(39210264)的资助。
AMF(丛枝菌根真菌)
AMF(丛枝菌根真菌)对香蕉试管苗的驯化日期:2011年5月24日 摘要:丛枝菌根真菌的影响(AMF)的香蕉试管苗上进行了评估在驯化期。植物接种无 梗scrobiculata,绣球clarum和Glomus etunicatum。在种植后温室3个月,株高,叶面积,鲜重和干物质的根,芽,AMF的殖民化的水平营养水平,光合作用和蒸腾率,水势和气孔导进行了测定。丛枝菌根真菌孢子的生产数量在每个治疗也决心。苗接种与丛枝菌根真菌具有更大的株高,叶面积和新鲜地上部和根系的重量,以及较高的光合作用和蒸腾比对照组。植物与血管球接种均优于在最评估参数。 关键词:穆萨菌,内生菌根,菌根菌,气候适应 引言:水果的营养快繁,观赏和森林物种,是一个良好的生产条件,转基因植物检疫植物 和均匀大量的主要工具。到温室栽培植物体外转移是在结构和生理适应的最重要的准备过程中试管苗的步骤之一。这一阶段,由于水土不服,是一种对植物自养的存在开始,以期为生存所必需的生理过程的开始。在这段时间内,必须增加水的试管苗和矿物质,光合速率的吸收。 试管苗,病免费的,但他们还缺乏丛枝(AMF)的菌根真菌。AMF的是众所周知的增加,增加水和矿物营养素的吸收,尤其是磷(P)植物的活力。此外,AMF的病原体可以保护寄主植物的根和减轻极端温度变化,pH值和水分胁迫(迪克森和马克思1987年的影响; Siqueira 1994年)。接种AMF的成功在驯化期间(格兰杰等人的开始。1983年; Brazanti等。1992年;罗杰古勒明等。1995年),甚至在体外培养已被证实。三是与从组织培养植物的根系形成共生互利的效果表现在蓬勃植物的光合作用和蒸腾速率高,养分和水分,提高抗逆性。 接种丛枝菌根真菌在植物组培苗生长初期当然可以对体外培养,通过积极对rootmeristem活动菌根共生效应,高殖利率。支持这个假说是由伯塔等人的结果。(1995年),谁表明,AMF的协会改变了红叶李根的分枝格局。接种类型的使用是很重要的驯化。福图纳等人(1992)建议的AMF的感染,高效品种的推广使用植物生长迅速增加。这些作者还表明,虽然在促进试管比较红叶李增长的2种AMF效率,该真菌感染影响其效力。更加新鲜,干物,高度增量被发现与血管球比与G. coronatum mosseae的接种植物,但在实验结束两组植物具有相似的增长。 我们工作的目的是评估的三个AMF的来自巴西的半干旱地区灌溉生长的香蕉种植园,营养和生理发展香蕉试管苗接种分离本土物种的影响作用。 材料与方法 植物材料和土壤性质 试管香蕉苗是根据生物技术。在植株形成的根在体外用MS液体培养基,后来转移到(500毫升的容量)与熏蒸基质:土,沙,有机质(1:1:1)。前沙混合料性能的土壤3.2克土壤有机质每公斤,马克土0.84毫克P每分米,pH值5.1(土:水=1:2.5)。接种量(约400每集装箱孢子)放置在以下5个香蕉植株根系与土壤接触面与熏蒸厘米,底层覆盖。滤液接种的土壤添加到所有的治疗方标准化微生物。植物在温室下保持12 h的800-1300勒克斯,光周期25B4 7C及70%-90%的相对湿度。 感染源
正畸过程中的埋伏牙处理
正畸过程中对埋伏牙的处理 定义:超过换牙年龄的牙长期埋伏在牙槽骨内,或由于种种原因使其萌出道受阻而不可能萌出的牙称为阻生牙。对阻生牙的矫治属于早期预防性治疗 一.病因 1.人类咀嚼器官的退化造成牙量大于骨量,临床上常见为第三磨牙及上尖牙的阻生。 2.乳牙早失引起,尤其是乳磨牙早失造成6向近中移动,引起4的垂直埋伏阻生。3由于 替换时间最晚,致其近中腭向倾斜阻生。 3.上3牙胚位于上颌窦的前壁或眼眶下面,位置较高,萌出路径较长。 4.由上颌侧切牙的牙根过短或缺失引起3的萌出位置异常,腭向异位的可能性增加2.4倍。 5.乳牙滞留,乳牙残根,多生牙,先天牙胚受损,牙齿萌出顺序异常,牙冠囊肿,牙瘤, 牙龈纤维增生,牙根早熟,恒牙萌出道上有致密的骨质形成。 6.颌骨或基骨发育不足引起。 7.全身疾病,甲状腺功能减退,垂体功能不足或佝偻病,发热性疾病,不规则的肌肉压力 均可以是阻生牙的原因。 二.危害 1.阻生牙致牙弓形态的不完整,不对称,中线偏移。 2.上3的缺失引起上颌尖牙保护颌的缺失。 3.妨碍正畸治疗。 4.引起骨粘连,牙根外吸收,以及在外伤时的牙槽突骨折。 5.尖牙异位萌出引起侧切或中切牙的牙根吸收。 6.影响咀嚼功能,影响颌骨发育。 7.对全身的影响,各种炎性反应,头痛或神经痛。 三.早期诊断 萌出过程正常的上颌尖牙,在萌出前1~1.5年,可在唇侧前庭沟处能摸到硬性隆起。有资料表明男孩13.1岁,女孩12.3岁时,80%的尖牙已萌出。因此在8岁或9岁时应开始注意尖牙的情况以便及早发现错位的尖牙,特别是对有家庭史、上侧切牙过小或先天缺失的患者。 (一)临床检查 通常在上颌颊部前庭沟或腭侧、侧切牙远中区域进行扣诊,估计或确定未萌尖牙的位置。如果未萌尖牙完全唇侧萌出,可以在该区域扣及骨性隆起。临床出现下面的症状可能预示者尖牙阻生: 1.恒尖牙萌出迟延(即超出萌出时间较久)或乳尖牙的长期滞留。 2.10~11岁时在尖牙的正常位置上摸不到尖牙隆起或左右侧尖牙隆起有明显差异。 3.侧切牙远中腭侧存在骨性隆起。 4.侧切牙的萌出延迟、牙冠远中倾斜或形态异常。 5.临床上如果发现双侧侧切牙远中牙槽骨不对称,可以借鉴全颌曲面断层片,了解 和证实尖牙发育和不对称的位置状况。 (二)X线片检查 如果临床检查怀疑尖牙阻生,可以使用X线片进一步检查。 一般X线片可见恒牙胚已形成2/3,但与恒牙正常萌出时间或与口内其他同名牙的萌
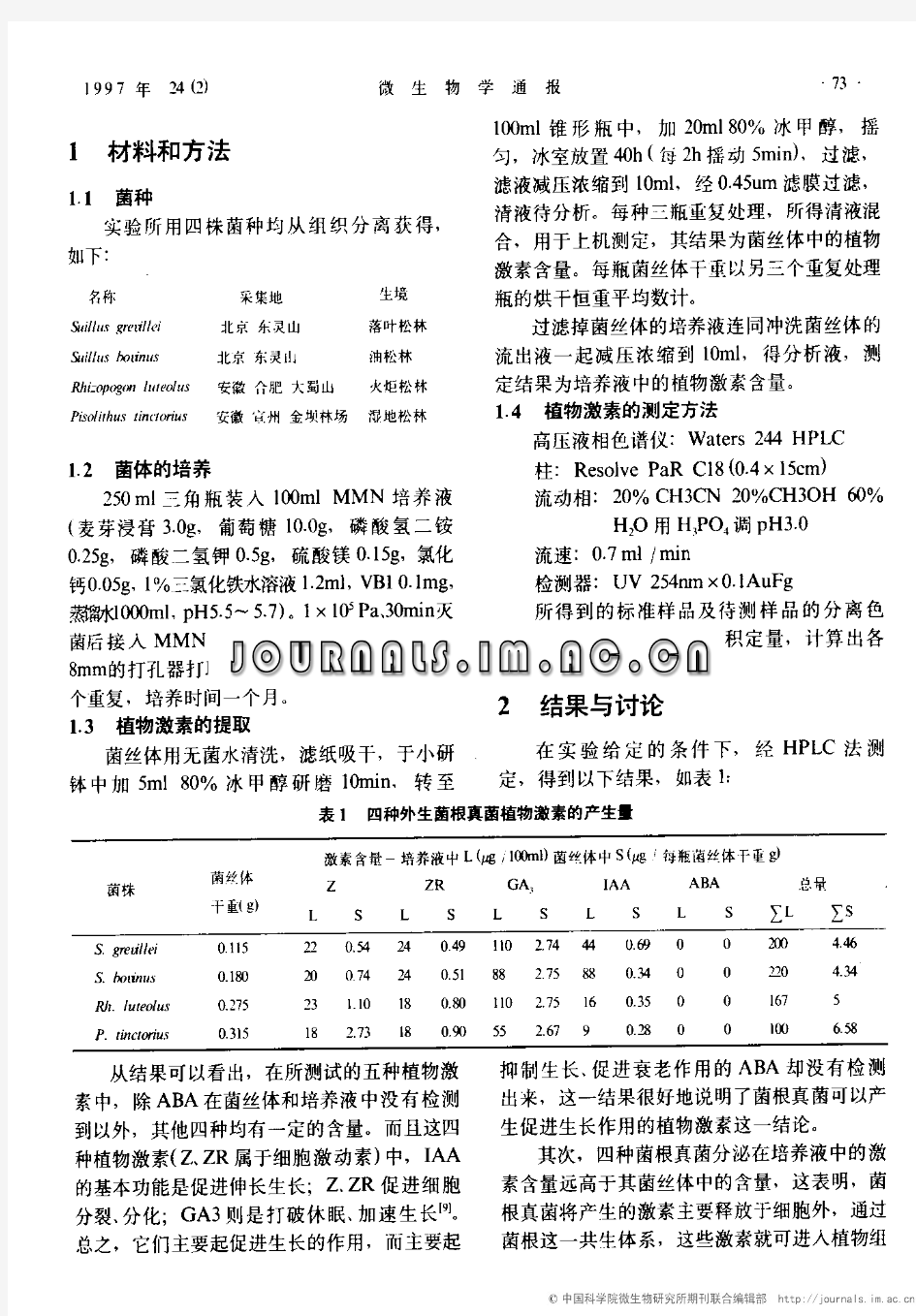
菌根
菌根 mycorrhiz 植物根与真菌组成的共生体。具有这种共生特异性的真菌称为菌根菌。 种类和特征已知能在根部形成菌根的植物有2000多种,能在植物根部组成共生体的真菌种类也很多。根据菌根的形态可区分为外生菌根和内生菌根。 外生菌根在植物根表面缠绕大量的真菌菌丝,形成密实的菌丝鞘,其中部分菌丝伸入根组织的外层细胞间隙中,构成胞间的菌丝网络,称为哈式网,成为菌丝与宿主物质交换的场所(图1)。外生菌根改变了植物根的形态,使根的分枝增多,侧根缩短。外生菌根的真菌主要是Basidio mycetes,宿主主要是树木,如松科、柏科、杨柳科等。 内生菌根包括泡囊—从枝菌根(VA菌根)、兰科菌根和杜鹃花科菌根。其中主要的是VA菌根。菌根的菌丝着生于根组织皮层细胞间隙或细胞中,但不进入内皮层和中柱。一些菌丝伸出根外与土壤接触,但不在根表面形成菌丝鞘。因此,受VA菌感染的根系形态没有改变。这种菌在根皮层细胞内的菌丝末端,可以反复二叉分枝形成类似吸器的丛枝,某些菌丝可以膨大形成直径为50微米的泡囊(图2)。VA菌根的真菌主要为Endogonaceac科。宿主植物很广泛,除十字花科和藜科外,大多数农作物都能感染菌根菌。而且它们与宿主植物之间无专一性。 生长条件VA菌对温度很敏感,在10~20℃以上,扩展迅速,对养分的吸收能力明显增高,而在16℃以下则急剧减小,8℃时几乎停止扩展。 菌根的形成还受土壤肥力水平的影响,尤其是与土壤有效磷的含量和磷肥中水溶性磷含量有关。水平越高,菌根感染率越低。
图1 未感染根与外生菌根剖面 (a)未感染的根(b)外生菌根 1.中柱; 2.表皮层; 3.哈氏网; 4.菌丝鞘 图2 VA菌根着生于植物根组织中的示意图
共生法培养外生菌根菌菌丝体
共生法培养外生菌根菌菌丝体 黄光文1,张 平2 (1.湖南科技学院生命科学与化学工程系,湖南 永州 425006; 2.湖南师范大学真菌研究室,长沙 410081) 摘要:首次报道外生菌根菌的共生培养法。初步研究了一个较好的外生菌根菌菌丝体培养方法,即将宿主的愈伤组织与外生菌根共同培养,可以明显地促进真菌菌丝的萌发和生长。愈伤组织匀浆液也可促进菌丝体早期生长。 关键词:共生培养法;鹅膏菌;外生菌根菌;菌丝体 中图分类号:S646 文献标识码:A 文章编号:1003-8310(2005)03-0016-02 1 材料与方法 111 材料 宿主植物:石栎(Lithocarpus glaber(Thunb.) Nakai),采自长沙县星沙镇,有鹅膏菌共生。 菌根真菌:假褐云斑鹅膏(Amanita pseudopor2 phyria H ong o)、黄盖鹅膏白色变种(A.subjunquillea var.alba Zhu L.Y ang)、欧氏鹅膏(A.ober winkler2 ana Zhu L.Y ang&Y oshim.D oi)。经组织分离纯培养而来,并经RAPD鉴定[1]。 112 培养基 11211 改良MS培养基:K NO3119g,NH4NO31165 g,K H2PO40117g,CaCl2?H2O0144g,MgS O4?7H2O 0137g,FeS O4?7H2O2718mg,Na2E DT A?H2O3713 mg,H3BO3612mg,ZnS O4?5H2O816mg,MnS O4?H2O1619mg,Na2M oO4?2H2O0125mg,KI0183mg, CaS O4?5H2O01025mg,C oCl201025mg,肌醇100 mg,甘氨酸210mg,盐酸硫氨素014mg,烟酸015 mg,盐酸吡哆醇015mg,琼脂18g,蔗糖23g,胡萝卜100g(煮汁),加水至1000m L。 11212 菌丝生长培养基:上述培养基中加入葡萄糖2g、蛋白胨2g、麦芽汁(12波美度)20m L。113 愈伤组织培养方法 改良MS培养基附加2,4-014mg?L-1或6-BA018mg?L-1,24℃/20℃(日/夜)下自然光照。详见文献[2]。 114 菌丝培养方法 对照:用打孔器打出直径为015cm的菌丝块接入装有40m L菌丝生长培养基的100m L三角瓶中,于20℃下培养,各设10瓶。测定萌发时间(以肉眼明显可见菌丝外伸为度),萌发后每10d 量一次菌丝长度。(下同) 方法A:在改良MS培养基中加入经过过滤除菌的菌根浸出液(菌根重量与组织块重量一致)作为生长刺激因子。 方法B:菌丝块接种于(紧贴)愈伤组织旁(即共培养方法)。 方法C:将愈伤组织全部挑出,在剩下的改良MS培养基上接入菌丝块。 方法D:无菌状态下将愈伤组织研磨成匀浆,加入到新的菌丝生长培养基中后接种真菌。 2 结果与分析 实验结果显示,四种方法培养的菌丝在萌发速度(图1)和生长速度(图2)上比对照均有不同程度的提高,其中方法B即共培养方法的效果最为显著。 从图3可以看出,菌丝在改良培养基上的生长比较均衡,在前30d逐渐缓缓加快,然后缓缓减慢。愈伤组织匀浆、菌根提取液和愈伤组织分泌物对菌丝的前期生长有较好的刺激效果,效果依次减小,但相关不大。三种刺激物作用一段时间后失去影响。而共培养的菌丝生长速度比其他四者均高,而且在生长后期效果依然显著。不同的菌株对刺激因子的反映程度略有不同,但总的趋势一致 。 图1 菌丝萌发时间的比较 注: A.pse=假褐云斑鹅膏(A.pseudoporphyria); A.sub=黄盖鹅膏白色变种(A.subjunquillea); A.obe=欧氏鹅膏(A.oberwinklerana) 3 讨论 从实验结果看,菌丝体的共培养法是促进外生 收稿日期:2004-10-18 基金项目:国家科委重点课题项目(96-C02-03-07);湖南省教育厅课题(03C358) 61中国食用菌 E DI BLE FUNGI OF CHI NA V ol124,N o13
两种断冠方法在下颌水平阻生智齿拔除术中的比较
两种断冠方法在下颌水平阻生智齿拔除术中 的比较 【摘要】目的比较垂直断冠法与斜向近中断冠法拔除下颌低位水平阻生第三磨牙的效果。方法将120颗下颌低位水平阻生第三磨牙随机分成2组,每组65颗,分别采用垂直断冠法和斜向断冠法拔除下颌低位水平阻生第三磨牙的手术时间分别为(32.65±7.35)min、(25.35±5.65)min。2种方法术后并发症方面无明显统计学差异,2种方法术后均未出现严重并发症。结论采用斜向近中断冠法拔除低位水平第三磨牙的手术时间短,且术中,术后并发症少。 【关键词】断冠方法阻生第三磨牙牙拔除术 随着人类进化过程中的颌骨发育退化,下颌阻生智齿检出率高达52.3%。其中,下颌低位水平阻生智齿也占到15.4%。拔除下颌水平阻生智齿对门诊医生来讲,是一项复杂的出槽外科手术,邻牙,骨阻力均较大,拔除困难。作者拟通过不同的去除阻力的方法来探讨两种方法的优劣,以供临床参考。 1材料和方法 1.1采集2006年3月—8月(一般资料)在德阳市口腔医院口腔颌面外科门诊就诊的96例患者的120颗下颌低位水平阻生第三磨牙为研究对象。96例患者中男52例,女44例。患者年龄19—36岁,平均年龄24.25岁。低位阻生牙的诊断标准以全景X线检查为准。根据耿温琦分类法,牙冠部远中面接近于邻牙1/2水平或1/2水平以下为低位水平阻生。
将120颗阻生第三磨牙随机分成2组,每组60颗,分别采用垂直断冠法和斜向近中断冠法拔除。 1.2手术方法 患者术前均拍摄全景X片。麻醉采用口内注射法。麻醉药物采用含1:100000肾上腺素的2%利多卡因,阻滞麻醉,为减少术中出血,局部均加浸润麻醉,所有手术均由作者与其助手完成。术后常规给予口服抗生素。 1.2.1直向断冠法 手术切口采用远中切口:由距离第二磨牙远中面约1.5cm处开始,向前切开,直抵达第二磨牙远中面的中央。然后转向颊侧,沿第二磨牙颈部龈缘切开,向下直到第一,二磨牙的牙间隙处。颊侧切口从远中切口的末端向下,并与之约成45°,切至前庭沟上缘处。由远中切口前端开始,向下掀起颊侧粘骨膜瓣,显露阻生智齿,采用高速手机裂钻,去除智齿上方及颊侧骨阻力,再垂直向切断牙冠,此时常因邻牙颈部阻挡,导致牙冠不易取出,需将牙冠分成颊舌两部分,才能取出牙冠,然而再拔除牙根。术后常规缝合。 1.2.2斜向近中断冠法 手术切口及翻瓣均同前,依旧采用高速手机去阻智齿上方及颊侧骨阻力,再斜向近中切断牙冠。此时因是斜向近中切断牙冠,邻牙颈部不再阻挡,牙冠较易取出。术后常规缝合。 1.3效果评价 从手术时间,术中并发症(损伤邻牙及牙龈撕裂),术后并发症(术
菌根菌
谁看过这篇博文 正文字体大小:大中小 国内纯培养出的第一个美味牛肝菌子实体(2011-06-12 09:18:56) 转载▼ 分类:菌根食用菌 标签: 美味牛肝菌 子实体 纯培养 2008年 2008年 2009年
*已在2011年的International Journal of Medicial Mushroomsi(国际药用菌)杂志上发表 分享分享到新浪Qing(奖) 顶 阅读(37)┊评论(0)┊收藏(0) ┊转载(0) ┊顶▼┊打印┊举报 已投稿 排行榜圈子 到: 转载列表: 转载 转载是分享博文的一种常用方式... 前一篇:野生食用菌种质资源采集过程中应注意的几个问题 后一篇:与菌根食用菌有关的几个专业术语 评论重要提示:警惕虚假中奖信息|[商讯]欧洲杯,有红牛更从容! [发评论] 发评论[商讯]爱心签名换梦想,天天派奖|[商讯]提高博客人气新方法 发评论
以上网友发言只代表其个人观点,不代表新浪网的观点或立场。 < 前一篇野生食用菌种质资源采集过程中应注意的几个问题 后一篇 >与菌根食用菌有关的几个专业术语 博主 音乐 与菌根食用菌有关的几个专业术语 (2011-06-12 09:53:02) 转载▼ 分类:菌根食用菌 标签: 菌根菌 菌根食用菌 真菌 edible mycorrhizal mushroom ??1.菌根(M y c o r r h i z a):菌根菌与植 物的活根形成的一种特定结构,其 结构和功能:植物通过这种结构获 取矿物质盐,而菌根菌菌丝则获取 到碳水化合物及其它活性物质。 (V a r m a A.&H o c k B.1998) ?2.菌根食用菌(E d i b l e M y c o r r h i z a l m u s h r o o m):一类能与植物的活根
丛枝菌根真菌名录及新科新属
This is an electronic version of the publication: Schü?ler A, Walker C (2010) The Glomeromycota. A species list with new families and new genera. Arthur Schü?ler & Christopher Walker, Gloucester. Published in December 2010 in libraries at The Royal Botanic Garden Edinburgh, The Royal Botanic Garden Kew, Botanische Staatssammlung Munich, and Oregon State University. Electronic version freely available online at https://www.360docs.net/doc/427536468.html, This electronic version is 100% identical to the printed publication. This includes the errors; therefore the electronic version contains one additional, initial page as a corrigendum, giving corrections of some errors and typos.
Corrections, 2 FEB, 14 FEB, 19 JUL 2011. The corrections are highlighted in red. p 7. FOR Claroidoglomeraceae READ Claroid e oglomeraceae p 10. DELETE Glomus pulvinatum (Henn.) Trappe & Gerd. [as 'pulvinatus'], in Gerdemann & Trappe, Mycol. Mem. 5: 59 (1974) ≡Endogone pulvinata Henn., Hedwigia 36: 212 (1897) p 11. AFTER Botanical Code for formal descriptions after 1 Jan 1935 INSERT) p 14. BELOW ≡ Endogone macrocarpa var. geospora T.H. Nicolson & Gerd., Mycologia 60(2): 318 (1968) INSERT ≡ Glomus macrocarpum var. geosporum (T.H. Nicolson & Gerd.) Gerd. & Trappe [as macrocarpus var. geosporus], Mycol. Mem. 5: 55 (1974) p16. ABOVE Sclerocystis coccogenum (Pat.) H?hn., Sber. Akad. Wiss. Wien, Math.-Naturw. Kl., Abt. 1 119: 399 [7 repr.] (1910) INSERT Sclerocystis clavispora Trappe, Mycotaxon 6(2): 358 (1977) ≡ Glomus clavisporum (Trappe) R.T. Almeida & N.C. Schenck, Mycologia 82(6): 710 (1990) p 19. FOR Rhizophagus irregulare READ Rhizophagus irregularis p 19. FOR Rhizophagus proliferus (B?aszk., Kovács & Balázs) READ Rhizophagus proliferus (Dalpé & Declerck) p 28. FOR Scutellospora arenicola Koske Koske & Halvorson READ Scutellospora arenicola Koske & Halvorson p 29. FOR Scutellospora pernambucana Oehl, Oehl, D.K. Silva, READ Scutellospora pernambucana Oehl, D.K. Silva, p 30. FOR Genus name: Racocetra Oehl, F.A. Souza & Sieverd., Mycotaxon: 334 (2009) READ Genus name: Racocetra Oehl, F.A. Souza & Sieverd., Mycotaxon 106: 334 (2009) p 35. FOR Acaulospora mellea Spain & N.C. Schenck, in Schenck, Spain, Sieverding & Howeler, Mycologia 76(4): 689 READ Acaulospora mellea Spain & N.C. Schenck, in Schenck, Spain, Sieverding & Howeler, Mycologia 76(4): 690 p 39. FOR Entrophospora nevadensis J. Palenzuela, N. Ferrol & Oehl, Mycologia 102(3): 627 (2010) READ Entrophospora nevadensis Palenz., N. Ferrol, Azcón-Aguilar & Oehl, in Palenzuela, Barea, Ferrol, Azcón-Aguilar & Oehl, Mycologia 102(3): 627 (2010) p 41. FOR Generic type: Pacispora chimonobambusae (C.G. Wu & Y.S. Liu) Sieverd. & Oehl ex C. Walker, Vestberg & A. Schü?ler, in Walker, Vestberg & Schü?ler, Mycol. Res. 111(3): 255 (2007) ≡Gerdemannia chimonobambusae (C.G. Wu & Y.S. Liu) C. Walker, B?aszk., A. Schü?ler & Schwarzott, in Walker, B?aszkowski, Schwarzott & Schü?ler, Mycol. Res. 108(6): 717 (2004) ≡Glomus chimonobambusae C.G. Wu & Y.S. Liu, in Wu, Liu, Hwuang, Wang & Chao, Mycotaxon 53: 284 (1995) READ Generic type: Pacispora scintillans (S.L. Rose & Trappe) Sieverd. & Oehl ex C. Walker, Vestberg & A. Schü?ler, in Walker, Vestberg & Schü?ler, Mycol. Res. 111(3): 255 (2007) ≡Glomus scintillans S.L. Rose & Trappe, Mycotaxon 10(2): 417 (1980) ≡Gerdemannia scintillans (S.L. Rose & Trappe) C. Walker, B?aszk., A. Schü?ler & Schwarzott, i n Walker, B?aszkowski, Schwarzott & Schü?ler, Mycol. Res. 108(6): 716 (2004) =Glomus dominikii B?aszk., Karstenia 27(2): 37 (1988) [1987] =Pacispora dominikii (B?aszk.) Sieverd. & Oehl, in Oehl & Sieverding, J. Appl. Bot., Angew. Bot. 78: 76 (2004) Pacispora chimonobambusae (C.G. Wu & Y.S. Liu) Sieverd. & Oehl ex C. Walker, Vestberg & A. Schü?ler, in Walker, Vestberg & Schü?ler, Mycol. Res. 111(3): 255 (2007) ≡Gerdemannia chimonobambusae (C.G. Wu & Y.S. Liu) C. Walker, B?aszk., A. Schü?ler & Schwarzott, in Walker, B?aszkowski, Schwarzott & Schü?ler, Mycol. Res. 108(6): 717 (2004) ≡Glomus chimonobambusae C.G. Wu & Y.S. Liu, in Wu, Liu, Hwuang, Wang & Chao, Mycotaxon 53: 284 (1995) p 41. BELOW Pacispora robigina Sieverd. & Oehl, in Oehl & Sieverding, J. Appl. Bot. (Angew. Bot.) 78: 75 (2004) DELETE Pacispora scintillans (S.L. Rose & Trappe) Sieverd. & Oehl ex C. Walker, Vestberg & A. Schü?ler, in Walker, Vestberg & Schü?ler, Mycol. Res. 111(3): 255 (2007) ≡Gerdemannia scintillans (S.L. Rose & Trappe) C. Walker, B?aszk., A. Schü?ler & Schwarzott, in Walker, B?aszkowski, Schwarzott & Schü?ler, Mycol. Res. 108(6): 716 (2004) ≡Glomus scintillans S.L. Rose & Trappe, Mycotaxon 10(2): 417 (1980) =Pacispora dominikii (B?aszk.) Sieverd. & Oehl, in O ehl & Sieverding, J. Appl. Bot., Angew. Bot. 78: 76 (2004) p 43. FOR≡Glomus aurantium B?aszk., Blanke, Renker & Buscot, Mycotaxon 90: 540 (2004) READ≡Glomus aurantium B?aszk., Blanke, R enker & Buscot, Mycotaxon 90: 450 (2004) p 43. FOR Genus name: Otospora Palenz., Ferrol & Oehl READ Genus name: Otospora Oehl, Palenz. & N. Ferrol p 43. FOR Generic type: Otospora bareae Palenz., Ferrol & Oehl [as 'bareai'] READ Generic type: Otospora bareae Palenz., N. Ferrol & Oehl [as 'bareai'] p 50. FOR Ambispora granatensis J. Palenzuela, N. Ferrol READ Ambispora granatensis Palenz., N. Ferrol p 53. FOR (Morton & Redecker 2001; Kaonongbua 2010). READ(Morton & Redecker 2001; Kaonongbua et al. 2010). Comment on the gender of the epithets in Redeckera. In publishing the new genus Redeckera, in honour of Dirk Redecker, we treated the gender as neuter, thus giving the epithets as pulvinatum, megalocarpum, and fulvum. We had inadvertently missed the recommendation 20A.1(i) in the Botanical Code requesting that all such epithets should be made feminine, and we apologise for this. However, because the names have been formally published, the requirements of Article 62 apply, and the neuter gender must be retained.
中国外生菌根资源的研究进展与展望
收稿日期:2006-03-28 中国外生菌根资源的研究进展与展望 王成彬1 ,林久志 2 (1.黑龙江省林口县林业局虎山林场157600;2.八面通林业局) 菌根(My corrhiza )是自然界土壤中的特定真菌菌 丝与高等植物根系形成的一种特殊联合体,是二者在长期进化过程中协同进化的产物,是土壤微生物和植物相容性共生的普通现象。德国植物病理学家Frank 于1885年首次发现了菌根。随后100多年来,世界各国科学家对菌根分类学、生理学、生态学及其应用技术等方面进行了大量的研究,并已越来越多地认识到菌根真菌在自然界中的重要地位。 菌根真菌从植物体内获取生长必需的营养物质,而植物通过与共生真菌结合,也能更好的从土壤中得到所需的养分及水分等。H acskaylo (1972)把这种关系描述为“生理上平衡良好的互惠寄生”。菌根与植物的根系互为条件形成共生体,在生理上是一个相互协调的整体,并在共同进化的过程中,形成特定的形态特征。菌根真菌与宿主植物的相互关系多数情况下是互利的,但有时也存在嫌性或寄生的,这主要取决于外界环境条件的变化。菌根既具有一般植物根系的特征,又具有由于真菌侵染所特有的生理、生态特性。因此,对菌根进行详细、系统的研究,既可以揭示影响植物体根系和真菌结合后生理生态特性变化的本质原因,又可为我国林业及环境科学的发展提供基础性依据。我国的菌根研究始于20世纪50年代中期,但至50年代末就开始处于长期的停滞状态,直至70年代中期,广东省林科所对从国外引进的接种菌根菌的松树的成活和生长进行了观察研究,菌根研究才又悄然兴起。我国的菌根研究虽然起步晚,但发展迅速,有些技术已达到世界先进水平,并于20世纪80、90年代发表了《林木菌根及应用技术》(郭秀珍、毕国昌,中国林科院1989)、《林木菌根化栽培技术》、《林木菌根研究》(花晓梅,1993,1995),《菌根研究及应用》(弓明钦等,中国林科院亚热带林业研究所,1996)等一系列著作和科技论文。 菌根主要分为三大主要类型:外生菌根(Ectomy -corrhiza ),内生菌根(Endomycorrhiza )和内外生菌根(Ectendomycorrhiza )。除此以外,还有混合菌根(Mixed mycorrhiza ),外围菌根(Pert rophic myco rrhi -za ),假菌根(P seudo mycorrhiza )等。其中外生菌根是菌根真菌菌丝体侵染宿主植物尚未木栓化的根部形成的,其主要特征是菌丝在植物营养幼根表面形成菌套(M ant le ),并在菌根真菌不侵入细胞内部的情况下, 只在根的皮层组织细胞间隙形成可以通过染色切片观察到的哈蒂氏网(Hartig net )[1] 。 外生菌根在许多植物生长过程中扮演了十分重要的角色。形成外生菌根的植物约占世界维管植物的10%,主要是包括许多造林树种在内的乔木及灌木,如松科(Pinaceae )、壳斗科(Fagaceae )、桦木科(Bet u -laceae )、杨柳科(Salicaceae )、胡桃科(Juglandaceae )、榆科(U rnaceae )、槭树科(A ceraceae )、椴树科(T iliaceae )等。据M iller (1982)统计世界上能形成外生菌根的真菌约5000种。我国已经报道的外生菌根真菌约520种隶属于2个亚门子囊菌亚门(A scomycotina )和担子菌亚门(Basidiomycotina ),41科77属[2] 。1 外生菌根的发现、分类鉴定及资源调查 近年来,国内外学者对外生菌根真菌资源的调查及分类进行了大量工作[3,4,5],这对菌根生物资源的开发、利用和保护具有非常重要的意义。我国在外生菌根真菌资源研究方面也取得了很大的进展,主要林区的主要造林树种及重要用材林树种的外生菌根真菌种类、地理分布、生态学特性已基本明确[6]。我国东北、华中、华南、华东等地区的部分树种已知可形成100多个种的外生菌根。华南地区的松、桉树已知可与11种菌根真菌结合形成外生菌根,其中可与多种松、桉形成外生菌根的彩色豆马勃与多根硬皮马勃为本地区的常见种,且在不同立地条件下,菌根的分布也不相同。陈连庆(1989)通过野外调查和室内鉴定,已查明与马尾松共生的外生菌根真菌27个种。陈晔等(1999)的研究表明了庐山不同植物群落下外生菌根真菌的出现的时间、生境及分布等。 由于外生菌根真菌对宿主有选择性,因此受气候等地域性因素影响的宿主的分布在很大程度上决定了外生菌根的分布。M olina 和T rappe (1988)根据适应专化性不同将外生菌根真菌分为三个类群:广性宿主真菌,中等专性宿主真菌和专性宿主真菌〗。同时,宿主植物对与其共生的外生菌根真菌亦有选择性。吴人坚等(1983)将菌根真菌的共生范围划分为5个不同类型,认为菌根真菌的分布除气候条件外,还与其共生的树种分布,尤其与一些主要树种的分布密切相关。2 研究方法 105 第4期(总第83期)中国林副特产 N o .4(GSNO .83) 2006年4月Fo rest By -Product and Speciality in China Aug .2006
各类牙、牙根的拔除方法与局部麻醉方法练习及
《口腔外科学》一、各类牙、牙根的拔除方法与局部麻醉方法 一、A1 1、下颌阻生智齿拔除时,X线片的重要意义不包括 A、阻生情况 B、牙根形态 C、软组织情况 D、周围骨质情况 E、牙根与下颌管的关系 2、牙钳使用时,错误的是 A、钳喙应尽量向根方夹持 B、夹持患牙时要紧,避免断根 C、鹰嘴钳主要用于拔除上前牙 D、手握钳柄近末端处 E、使用牙钳用力时不能过急、过猛 3、关于阻生牙的概念错误的是 A、阻力来源于邻牙 B、阻力来源于骨组织 C、阻力来源于牙龈 D、常见部位为下颌第三磨牙及上颌第一磨牙 E、只能部分萌出或完全不能萌出 4、拔牙手术区的准备不包括 A、术前反复漱口、必要时洁牙
B、1:5000高锰酸钾液冲洗术区 C、1%甲硝唑液擦洗牙齿 D、手术区用1%或2%碘酒消毒 E、复杂牙齿需要切开缝合者,要用75%乙醇消毒口周及面部下1/3的皮肤,并铺消毒巾 5、有关拔牙创的处理,错误的是 A、检查患牙是否完整、有无断根 B、搔刮牙槽窝、清除根尖病变及异物 C、检査创口有无牙碎片、骨碎片及牙结石 D、修整过高、过尖的骨嵴或牙槽中隔 E、所有拔牙创均不必缝合处理 6、拔牙术前的准备不包括 A、详细询问病史 B、检查患者全身情况,确定是否有拔牙禁忌证 C、必要时进行化验检查 D、必要时进行药物过敏试验检查 E、必要时进行牙髓活力检查 7、用牙挺取位于牙槽窝内的断面一侧高,一侧低的牙根时,牙挺插入的位置应该是 A、将断面较高的一侧凿低后 B、将断面根管壁劈开后 C、断面较高的一侧 D、断面较低的一侧
E、牙槽中隔 8、关于拔牙体位,拔除上颌牙时上颌牙咬合平面与地面所成角度是 A、与地面平行 B、15° C、30° D、45° E、70° 二、A2 1、患者,女,38岁。拟左下5残根拔除术,注入少量2%普鲁卡因局麻后,立即发生极严重的症状,病员突然惊厥、昏迷、呼吸呼吸、心跳骤停。该患者情况属于 A、中毒 B、晕厥 C、过敏反应 D、癔病 E、肾上腺素反应 2、女,61岁。右上尖牙残根,拟拔除后修复。局部麻醉最好选择 A、眶下孔阻滞麻醉 B、切牙孔阻滞麻醉 C、腭前神经阻滞麻醉 D、翼腭管传导阻滞麻醉 E、唇、腭侧局部浸润麻醉
菌根简介
菌根简介 自然界中还有许多高等植物的根与土壤中的真菌形成共生关系,这种同真菌的共生体称为菌根(mycorrhiza)。根据菌根形态学及解剖学特征,可将菌根分为外生菌根(ectotrophic mycorrhiza)、内生菌根(endotrophic mycorrhiza)和内外生菌根(ectendotrophic mycorrhiza)三种类型。 (一)外生菌根 与根共生的真菌菌丝体包围宿主植物幼根外表,形成菌丝鞘,菌丝一般不穿透组织细胞,而仅在细胞壁之间延伸生长(图4-45)。形成菌根的根一般较粗,顶端分为二叉,根毛稀少或无。这类菌根只有少数植物如松科、桦木科、山毛榉科、杜鹃花科等植物形成这类菌根。 (二)内生菌根 真菌菌丝分布于根皮层细胞间隙或侵入细胞内部形成不同形状的吸器,如泡囊和树枝状菌丝体。因此。内生菌根也称泡囊-丛枝(VA)菌根或丛枝菌根(AM)(图4-46)。这类菌根宿主植物的根一般无形态及颜色变化。90%以上的植物都能形成内生菌根,典型的内生菌根如兰花菌根。 (三)内外生菌根 有外生菌根和内生菌根的某些形态学或生理特征。它既可在宿主植物根表面形成菌套,又可在根皮层细胞间隙形成VA菌根,亦可在皮层内形成不同形状的菌丝圈。内外生菌根主要发生于松科、桦木属、杜鹃花科以及水晶兰科植物上。 真菌是低等的异养植物,它不能自己制造有机物,与绿色植物共生后,真菌可以从根中得到它生长发育所需的碳水化合物,而菌丝如同根毛一样,可以从土壤中吸收水和无机盐供植物利用,促进细胞内贮藏物质的分解,增进吸收作用。 菌丝还能产生激素,尤其是维生素B1和B6等生长活跃物质,不仅对根的发育有促进作用,使植物生长良好,还能增加豆科植物固氮和结瘤率;提高药用植物的药用成分含量;提高苗木移栽、扦插成活率等。如松树在没有与它共生真菌的土壤中,生长缓慢甚至死亡。因此,在林业上,常用人工方法进行真菌接种,提高抗旱能力,以利于造林成功。 现已发现在根上能形成菌根的高等植物有两千多种,其中很多是造林树种,如银杏、桧、侧柏、毛白杨和椴树等
日本落叶松根际外生菌根真菌多样性
收稿日期:2017-10-20 基金项目:国家自然科学基金项目(No.31400101);辽宁省博士启动基金项目(No.20111143)。 作者简介:王琴(1981-),女,高级工程师,主要从事森保和土壤微生物生态研究。E-mail:wqdora@https://www.360docs.net/doc/427536468.html, 。 root Ectomycorrhizal fungal diversity associate roots s of Larix kaempferi WANG Qin (Liaoning Academy of Forest Science,Shenyang 110032,China ) Abstract:To improve the application of mycorrhizal technology in seedling and afforestation of Larix kaempferi ,ectomy-corrhizal (ECM)fungi associated with L.kaempferi roots were investigated.A total of 40root samples of L.kaempferi were collected in 2012and 2013,and 55ECM morphotypes were detected and 28ECM fungi identified based on ITS se-quence analysis.Of these ECM fungi,Cenococcum geophilum was the most dominant species,which was detected among 95%samples,occupying 34.8%root tips,Russula sp.3,Sebacina sp.2,Tomentella sp.1,Russula sp.2and Sebaci-na sp.1were common species,the other 14species were rare speces. Key Words :Larix kaempferi ;ectomycorrhizal fungi;diversity;molecular identification 2018年第1期 辽宁林业科技 Journal of Liaoning Forestry Science &Technology 日本落叶松根际外生菌根真菌多样性 王 琴 (辽宁省林业科学研究院,辽宁沈阳110032) 摘 要:为在日本落叶松育苗和造林中科学应用外生菌根技术,研究了日本落叶松的根际外生菌 根真菌群落组成。2012年和2013年共采集了40份日本落叶松根系样本,通过形态特征检测到55种外生菌根形态型,ITS 序列分析显示共28种外生菌根真菌与日本落叶松根系共生。其中,土生空团菌是日本落叶松根系外生菌根真菌群落的优势物种,在95%的土壤样本中均检测到,占根尖总数的34.8%;Russula sp.3(编号),Sebacina sp.2,Tomentella sp.1,Russula sp.2和Sebacina sp.1是常见种;其余14个分类单元是稀有种。 关键词:日本落叶松;外生菌根真菌;多样性;分子鉴定中图分类号:S718.81 文献标识码:A 文章编号:1001-1714(2018)01-0017-04 2018№1 外生菌根(Ectomycorrhizae ,ECM )是由土壤真菌与植物根系形成的互惠共生体[1],广泛存在于森林生态系统中,是森林生态系统的重要组成部分。菌根真菌一方面从植物根系获取生长所需的碳源,同时又帮助植物从土壤中吸收N 、P 等矿物营养和水分,改良土壤结构,促进植物生长,提高宿主抗逆性。据保守估计全球约有20000多种[2],我国目前报道了500余种[3-4],还有大量的外生菌根真菌有待发现[5]。 日本落叶松Larix kaempferi 原产地是日本本 州岛中部山区,属温带喜冷湿树种。我国引种日本落叶松己有100多年历史,北起黑龙江省林口县青山林场,南至江西省庐山和四川省西高山都有分布。日本落叶松以其适应性强、早期速生、成材快、用途广、材质优良的优势,正成为我国荒山绿化和营造短周期工业用材林不可替代的树种。日本落叶松作为外来物种,引入我国后与其共生的外生菌根真菌的种类一直没有全面的报道。 本项目运用形态学和分子生物学方法,系统 — —17
