溶剂对紫外吸收光谱的影响

仪器分析实验报告
实验名称:溶剂对紫外吸收光谱的影响
一、实验内容
1、学习高效液相色谱仪的使用
2、利用高效液相色谱法测定溶液中物质的浓度
二、实验步骤
分别向液相仪注射苯、萘、甲苯、混合四种液体,测定谱图,并利用标准曲线,测定其浓度。
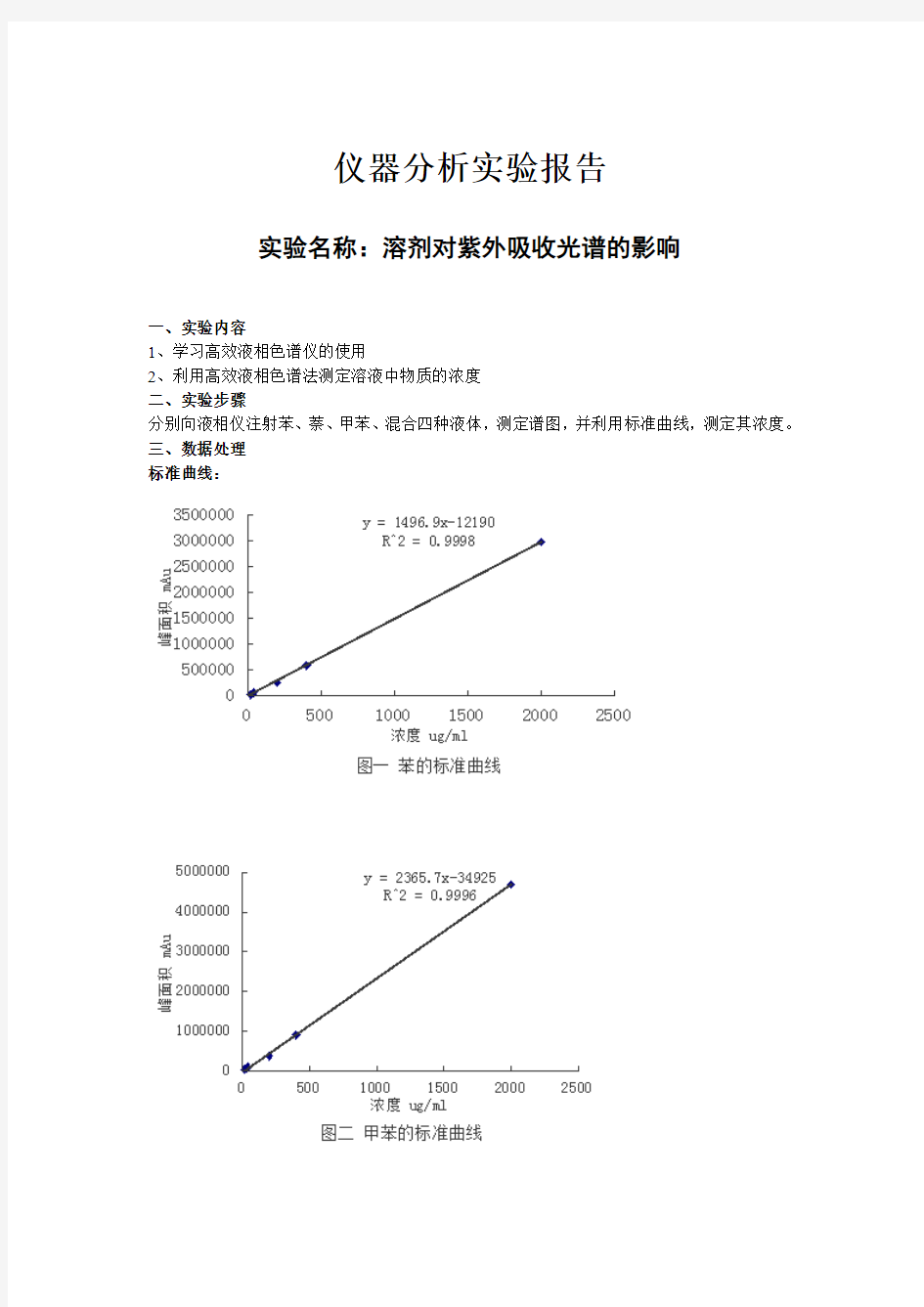
三、数据处理
标准曲线:
实验数据:
0.0
0.5
1.0
1.5
2.0 2.5
3.0 3.5
4.0 4.5
5.0 5.5
6.0 6.5min
-7.5
-5.0-2.50.02.55.07.510.012.5
15.017.520.022.525.0
27.5
30.032.535.037.540.042.545.047.550.0mAU
254nm,4nm (1.00)
1.401/657131
1.872/7192
2.076/44024
2.315/17663
2.542/3297
2.731/1474
3.338/346668
4.311/10707
4.829/72205
5.436/344776
6.381/5633
图四 苯
0.0
0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5min
-10-505101520253035404550556065mAU
254nm,4nm (1.00)
4.280/810108
图五 甲苯
0.00.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5min
-100
100
200
300
400
500
600
700
800
900
1000
1100mAU
254nm,4nm (1.00)
1.281/269201
1.523/112367
1.851/19835
2.054/33951
2.313/5778
2.523/1623
3.361/5654
4.306/4630
4.591/258658
5.394/16492918
图六 萘
0.0
0.5
1.0
1.5
2.0 2.5
3.0 3.5
4.0 4.5
5.0 5.5
6.0 6.5min
-20-1001020
30
405060708090100110120130140150160mAU
254nm,4nm (1.00)
1.363/709335
1.890/48707
2.107/68547
2.299/24056
2.512/8635
2.741/13420
3.331/486538
4.265/852023
4.813/116229
5.403/2652518
6.383/5382
图七 混合
数据计算:
表一 混合液中各物质保留时间、峰面积及浓度计算
物质
苯 甲苯 萘 保留时间(min ) 3.331 4.265 5.403 峰面积(mAu ) 496538 852023 2652518 浓度(ug/ml )
339.854
374.920
8.803
四、数据分析
1.谱图中存在一定的杂峰,可能是由于溶液被污染
2.保留时间存在一定的差异,可能是由于混合溶液中各组分之间会相互影响
3.实验中要注意清洗针头,避免相互污染,并且要尽量排除气泡。
有机溶剂极性表
有机溶剂极性表
下图是混合有机溶剂极性顺序(由小到大,括号内表示的是混合比例) 强极性溶剂:甲醇〉乙醇〉异丙醇 中等极性溶剂:乙氰〉乙酸乙酯〉氯仿〉二氯甲烷〉乙醚〉甲苯 非极性溶剂:环己烷,石油醚,己烷,戊烷 常用混合溶剂: 乙酸乙酯/己烷:常用浓度0~30%。但有时较难在旋转蒸发仪上完全除去溶剂。 乙醚/戊烷体系:浓度为0~40%的比较常用。在旋转蒸发器上非常容易除去。乙醇/己烷或戊烷:对强极性化合物5~30%比较合适。 二氯甲烷/己烷或戊烷:5~30%,当其他混合溶剂失败时可以考虑使用。 3)将1~2mL选定的溶剂体系倒入展开池中,在展开池中放置一大块滤纸。 4)将化合物在标记过的基线处进行点样。我们用的点样器是买来的,此外,点样器也可从加热过的Pasteur吸管上拔下(你可以参照UROP)。在跟踪反应进行时,一定要点上起始反应物、反应混合物以及两者的混合物。 5)展开:让溶剂向上展开约90%的薄板长度。 6)从展开池中取出薄板并且马上用铅笔标注出溶剂到达的前沿位置。根据这个算Rf的数值。 7)让薄板上的溶剂挥发掉。 8)用非破坏性技术观察薄板。最好的非破坏性方法就是用紫外灯进行观察。将薄板放在紫外灯下,用铅笔标出所有有紫外活性的点。尽管在 5.301中不用这种方法,但我们将采用另一常用的无损方法--用碘染色法。(你可以参看UROP)。
9)用破坏性方式观测薄板。当化合物没有紫外活性的时候,只能采用这种方法。在 5.301中,提供了很多非常有用的染色剂。使用染色剂时,将干燥的薄板用镊子夹起并放入染色剂中,确保从基线到溶剂前沿都被浸没。用纸巾擦干薄板的背面。将薄板放在加热板上观察斑点的变化。在斑点变得可见而且背景颜色未能遮盖住斑点之前,将薄板从加热板上取下。 10)根据初始薄层色谱结果修改溶剂体系的选择。如果想让Rf变得更大一些,可使溶剂体系极性更强些;如果想让Rf变小,就应该使溶剂体系的极性减小些。如果在薄板上点样变成了条纹状而不是一个圆圈状,那么你的样品浓度可能太高了。稀释样品后再进行一次薄板层析,如果还是不能奏效,就应该考虑换一种溶剂体系。
常见有机化合物的紫外吸收光谱
常见有机化合物的紫外吸收光谱 1. 饱和烃 饱和单键碳氢化合物只有σ电子,因而只能产生σ→σ*跃迁。由于σ电子最不容易激发,需要吸收很大的能量,才能产生σ→σ*跃迁,因而这类化合物在200nm以上无吸收。所以它们在紫外光谱分析中常用作溶剂使用,如正已烷、环乙烷、庚烷等。 2.不饱和脂肪烃 ◆含孤立不饱和键的烃类化合物。具有孤立双键或三键的烯烃或炔烃,它们都产生π→π*跃迁,但多数在200nm以上无吸收。如已烯吸收峰在171nm,乙炔吸收峰在173nm,丁烯在178nm。若烯分子中氢被助色团如-OH、-NH2、-Cl等取代时,吸收峰发生红移,吸收强度也有所增加。 ◆含共轭体系的不饱和烃。具有共轭双键的化合物,相间的π键相互作用生成大π键,由于大π键各能级之间的距离较近,电子易被激发,所以产生了K吸收带,其吸收峰一般在217~280nm。K吸收带的波长及长度与共轭体系的长短、位置、取代基种类等有关,共轭双键越多,波长越长,甚至出现颜色。因此可据此判断共轭体系的存在情况。 ◆芳香化合物。苯的紫外吸收光谱是由π→π*跃迁组成的三个谱带,即E1、E2、具有精细结构的B吸收带。当苯环上引入取代苯时,E2吸收带和B吸收带一般产生红移且强度加强。稠环芳烃母体吸收带的最大吸收波长大于苯,这是由于它有两个或两个以上共轭的苯环,苯环数目越多,λmax越大。例如苯(255nm)和萘(275nm)均为无色,而并四苯为橙色,吸收峰波长在460nm。并五苯为紫色,吸收峰波长为580nm。
◆杂环化合物。在杂环化合物中,只有不饱和的杂环化合物在近紫外区才有吸收。以O、S或NH取代环戊二烯的CH2的五元不饱和杂环化合物,如呋喃、噻吩和吡咯等,既有π→π*跃迁引起的吸收谱带,又有n→π*跃迁引起的谱带。
紫外吸收光谱的基本原理
紫外吸收光谱的基本原理,应用与其特点 紫外吸收光谱的基本原理 吸收光谱的产生 许多无色透明的有机化合物,虽不吸收可见光,但往往能吸收紫外光。如果用一束具有连续波长的紫外光照射有机化合物,这时紫外光中某些波长的光辐射就可以被该化合物的分子所吸收,若将不同波长的吸收光度记录下来,就可获的该化合物的紫外吸收光谱 紫外光谱的表示方法 通常以波长入为横轴、吸光度 A (百分透光率T% )为纵轴作图,就可获的该化合物的紫外吸收光谱图。 吸光度A,表示单色光通过某一样品时被吸收的程度A=log(l0/I1), 10 入射光强度, 11透过光强度; 透光率也称透射率T,为透过光强度I1与入射光强度I0之比值,T= I1/I0 透光率T与吸光度A 的关系为A=log(1/T) 根据朗伯-比尔定律,吸光度A与溶液浓度c成正比A= b e &为摩尔吸光系数,它是浓度为 1mol/L的溶液在1em的吸收池中,在一定波长下测得的吸光度,它表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数,因而是检定化合物的重要数据;e为物质的浓度,单位为mol/L ; b为液层厚度,单位为cm。 在紫外吸收光谱中常以吸收带最大吸收处波长加ax和该波长下的摩尔吸收系数 max来表征化合物吸收特征。吸收光谱反映了物质分子对不同波长紫外光的吸收能力。吸收带的许多无色透明的有机化合物,虽不吸收可见光,但往往能吸收紫外光。如果用一束具 有连续波长的紫外光照射有机化合物,这时紫外光中某些波长的光辐射就可以被该化合物的 分子所吸收,若将不同波长的吸收光度记录下来,就可获的该化合物的紫外吸收光谱?通常以波长入为横轴、吸光度 A (百分透光率T% )为纵轴作图,就可获的该化合物的紫外吸收光谱图。 吸光度A,表示单色光通过某一样品时被吸收的程度A=log(I0/I1), I0 入射光强度, I1透过光强度; 透光率也称透射率T,为透过光强度I1与入射光强度I0之比值,T= I1/I0 透光率T与吸光度A 的关系为A=log(1/T) 根据朗伯-比尔定律,吸光度A与溶液浓度e成正比A= b e &为摩尔吸光系数,它是浓度为 1mol/L的溶液在1em的吸收池中,在一定波长下测得的吸光度,它表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数,因而是检定化合物的重要数据;e为物质的浓度,单位为mol/L ;b为液层厚度,单位为em。 在紫外吸收光谱中常以吸收带最大吸收处波长加ax和该波长下的摩尔吸收系数 max来表征化合物吸收特征。吸收光谱反映了物质分子对不同波长紫外光的吸收能力。吸收带的形状、?max和max与吸光分子的结构有密切的关系。各种有机化合形状、?max 和max与吸光分子的结构有密切的关系。各种有机化合物的?max和max都有定值, 同类化合物的e max比较接近,处于一个范围。 紫外吸收光谱是由分子中价电子能级跃迁所产生的。由于电子能级跃迁往往要引起分子 中核的运动状态的变化,因此在电子跃迁的同时,总是伴随着分子的振动能级和转动能级的跃迁。考虑跃迁前的基态分子并不是全是处于最低振动和转动能级,而是分布在若干不同的
各种仪器分析的基本原理及谱图表示方法!!!紫外吸收光谱UV分析
各种仪器分析的基本原理及谱图表示方法!!! 紫外吸收光谱UV 分析原理:吸收紫外光能量,引起分子中电子能级的跃迁谱图的表示方法:相对吸收光能量随吸收光波长的变化提供的信息:吸收峰的位置、强度和形状,提供分子中不同电子结构的信息荧光光谱法FS 分析原理:被电磁辐射激发后,从最低单线激发态回到单线基态,发射荧光谱图的表示方法:发射的荧光能量随光波长的变化提供的信息:荧光效率和寿命,提供分子中不同电子结构的信息红外吸收光谱法IR 分析原理:吸收红外光能量,引起具有偶极矩变化的分子的振动、转动能级跃迁谱图的表示方法:相对透射光能量随透射光频率变化提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率拉曼光谱法Ram 分析原理:吸收光能后,引起具有极化率变化的分子振动,产生拉曼散射谱图的表示方法:散射光能量随拉曼位移的变化提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率核磁共振波谱法NMR 分析原理:在外磁场中,具有核磁矩的原子核,吸收射频能量,产生核自旋能级的跃迁谱图的表示方法:吸收光能量随化学位移的变化提供的信息:峰的化学位移、强度、裂分数和偶合常数,提供核的数目、所处化学环境和几何构型的信息电子顺磁共振波谱法ESR 分析原理:在外磁场中,分子中未成对电子吸收射频能量,产生电子自旋能级跃迁谱图的表示方法:吸收光能量或微分能量随磁场强度变化提供的信息:谱线位置、强度、裂分数目和超精细分裂常数,提供未成对电子密度、分子键特性及几何构型信息 质谱分析法MS 分析原理:分子在真空中被电子轰击,形成离子,通过电磁场按不同m/e 分离 谱图的表示方法:以棒图形式表示离子的相对峰度随m/e 的变化提供的信息:分子离子及碎片离子的质量数及其相对峰度,提供分子量,元素组成及结构的信息气相色谱法GC 分析原理:样品中各组分在流动相和固定相之间,由于分配系数不同而分离谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:峰的保留值与组分热力学参数有关,是定性依据;峰面积与组分含量有关反气相色谱法IGC 分析原理:探针分子保留值的变化取决于它和作为固定相的聚合物样品之间的相互作用力谱图的表示方法:探针分子比保留体积的对数值随柱温倒数的变化曲线提供的信息:探针分子保留值与温度的关系提供聚合物的热力学参数裂解气相色谱法PGC 分析原理:高分子材料在一定条件下瞬间裂解,可获得具有一定特征的碎片谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:谱图的指纹性或特征碎片峰,表征聚合物的化学结构和几何构型凝胶色谱法GPC 分析原理:样品通过凝胶柱时,按分子的流体力学体积不同进行分离,大分子先流出谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:高聚物的平均分子量及其分布热重法TG 分析原理:在控温环境中,样品重量随温度或时间变化谱图的表示方法:样品的重量分数随温度或时间的变化曲线提供的信息:曲线陡降处为样品失重区,平台区为样品的热稳定区热差分析DTA 分析原理:样品与参比物处于同一控温环境中,由于二者导热系数不同产生温差,记录温度随环境温度或时间的变化 谱图的表示方法:温差随环境温度或时间的变化曲线提供的信息:提供聚合物热转变温度及各种热效应的信息示差扫描量热分析DSC 分析原理:样品与参比物处于同一控温环境中,记录维持温差为零时,所需能量随环境温度或时间的变化 谱图的表示方法:热量或其变化率随环境温度或时间的变化曲线提供的信息:提供聚合物热转变温度及各种热效应的信息静态热―力分析TMA 分析原理:样品在恒力作用下产生的形变随温度或时间变化谱图的表示方法:样品形变值随温度或时间变化曲线提供的信息:热转变温度和力学状态
实验三、有机化合物的紫外吸收光谱及溶剂效应解读
实验一、有机化合物的紫外吸收光谱及溶剂效应 目的要求: 1、学习用紫外吸收光谱进行化合物的定性分析。 2、学习苯环上取代基的引入对最大吸收波长的影响。 3、了解一元取代苯的紫外光谱的实验规则。 4、熟悉各个吸收带。 基本原理 影响有机化合物紫外吸收光谱的因素,有内因和外因。由于受到溶剂极性的影响,溶质的吸收峰的波长、强度以及形状都会发生不同程度的变化。这是因为溶剂分子和溶质分子间可能形成氢键,或极性溶剂分子的偶极使溶质分子的极性增强,因而在极性溶剂中π→π*跃迁所需能量减消,吸收波 长红移,而在极性溶剂中n→π*跃迁所需能量增大,吸收波长蓝移。 E带和B带是芳香族化合物的特征吸收。它们均由π→π*跃迁产生,当苯环上有取代基时,E带和B带的吸收峰也随之变化。如苯甲酸的E吸收带红移至230nm;ε=11600;B吸收带红移至273nm;ε=970;乙酰苯胺的E吸收带红移至241nm;ε=14000。 本实验通过苯甲酸、乙酰苯胺、苯在乙醇和环己烷的溶剂中紫外吸收光谱的测绘,说明内因和外因对有机化合物紫外吸收光谱的影响;了解一元取代苯的紫外光谱的实验规则,即在苯环上有一元取代基时,复杂的B谱带一般都简单化,并且各谱带的最大吸收波长发生红移,εmax一般增大。 一、仪器 1、紫外-可见分光光度计。型号:760CRT 二、试剂 1、苯甲酸、苯、乙酰苯胺、乙醇和环己烷均为分析纯 2、a 苯甲酸的环己烷溶液0.08g.100ml-1 b 乙酰苯胺的环己烷溶液0.08g.100ml-1 c 苯的环己烷溶液1:250 d 苯甲酸的乙醇溶液0.04g.100ml-1 e 乙酰苯胺的乙醇溶液0.08g.100ml-1 f 苯的乙醇溶液1:250 三、实验条件 1、波长扫描范围:190~300(400) 2、参比: 3、slit: 0.01nm
常见的溶剂极性表有机溶剂表
常见的溶剂极性表有机溶剂表一般有机溶剂根据“相似相溶”的原理来进行选择 化合物名称极性粘度沸点吸收波长 i-pentane(异戊烷) 0 - 30 - n-pentane(正戊烷) 0 0.23 36 210 Petroleum ether(石油醚) 0.01 0.3 30~60 210 Hexane(己烷) 0.06 0.33 69 210 Cyclohexane(环己烷) 0.1 1 81 210 Isooctane(异辛烷) 0.1 0.53 99 210 Trifluoroacetic acid(三氟乙酸) 0.1 - 72 - Trimethylpentane(三甲基戊烷) 0.1 0.47 99 215 Cyclopentane(环戊烷) 0.2 0.47 49 210 n-heptane(庚烷) 0.2 0.41 98 200 Butyl chloride(丁基氯; 丁酰氯) 1 0.46 78 220 Trichloroethylene(三氯乙烯; 乙炔化三氯) 1 0.57 87 273 Carbon tetrachloride(四氯化碳) 1.6 0.97 77 265 Trichlorotrifluoroethane(三氯三氟代乙烷) 1.9 0.71 48 231 i-propyl ether(丙基醚; 丙醚) 2.4 0.37 68 220 Toluene(甲苯) 2.4 0.59 111 285 p-xylene(对二甲苯) 2.5 0.65 138 290 Chlorobenzene(氯苯) 2.7 0.8 132 - o-dichlorobenzene(邻二氯苯) 2.7 1.33 180 295 Ethyl ether(二乙醚; 醚) 2.9 0.23 35 220 Benzene(苯) 3 0.65 80 280 Isobutyl alcohol(异丁醇) 3 4.7 108 220 Methylene chloride(二氯甲烷) 3.4 0.44 240 245 Ethylene dichloride(二氯化乙烯) 3.5 0.78 84 228 n-butanol(正丁醇) 3.7 2.95 117 210 n-butyl acetate(醋酸丁酯;乙酸丁酯) 4 - 126 254 n-propanol(丙醇) 4 2.27 98 210 Methyl isobutyl ketone(甲基异丁酮) 4.2 - 119 330 Tetrahydrofuran(四氢呋喃) 4.2 0.55 66 220 Ethyl acetate(乙酸乙酯) 4.30 0.45 77 260 i-propanol(异丙醇) 4.3 2.37 82 210 Chloroform(氯仿) 4.4 0.57 61 245
紫外光谱答案(学习资料)
第一章紫外光谱 一、简答 1.丙酮的羰基有几种类型的价电子。试绘出其能级图,并说明能产生何种电子跃迁?各种跃迁可在何区域波长处产生吸收? 答:有n电子和π电子。能够发生n→π*跃迁。从n轨道向π反键轨道跃迁。能产生R带。跃迁波长在250—500nm之内。 2.指出下述各对化合物中,哪一个化合物能吸收波长较长的光线(只考虑π→π*跃迁)。 答:(1)的后者能发生n→π*跃迁,吸收较长。(2)后者的氮原子能与苯环发生P→π共轭,所以或者吸收较长。 3.与化合物(A)的电子光谱相比,解释化合物(B)与(C)的电子光谱发生变化的原因(在乙醇中)。 答:B、C发生了明显的蓝移,主要原因是空间位阻效应。 二、分析比较 1.指出下列两个化合物在近紫外区中的区别: 答:(A)和(B)中各有两个双键。(A)的两个双键中间隔了一个单键,这两个双键就能发生π→π共轭。而(B)这两个双键中隔了两个单键,则不能产生共轭。所以(A)的紫外波长比较长,(B)则比较短。 2.某酮类化合物,当溶于极性溶剂中(如乙醇中)时,溶剂对n→π*跃迁及π→π* 跃迁有何影响?用能级图表示。 答:对n→π*跃迁来讲,随着溶剂极性的增大,它的最大吸收波长会发生紫移。而π→π*跃迁中,成键轨道下,π反键轨道跃迁,随着溶剂极性的增大,它会发生红移。
三、试回答下列各问题 1.某酮类化合物λhexane max=305nm,其λEtOH max=307nm,试问,该吸收是由n→π*跃迁还 是π→π*跃迁引起的? 答:乙醇比正己烷的极性要强的多,随着溶剂极性的增大,最大吸收波长从305nm变动到 307nm,随着溶剂极性增大,它发生了红移。化合物当中应当是π→π反键轨道的跃迁。 2.化合物A在紫外区有两个吸收带,用A的乙醇溶液测得吸收带波长λ1=256nm, λ2=305nm,而用A的己烷溶液测得吸收带波长为λ1=248nm、λ2=323nm,这两吸收带分 别是何种电子跃迁所产生?A属哪一类化合物?答:λ1属于π→π*跃迁;λ2属于n→ π*跃迁。属于不饱和苯环化合物。 3.某化合物的紫外光谱有B 吸收带,还有λ1max=240nm,ε1max=130000 及λ2max =319nm,ε2max=50 两个吸收带,次化合物中有何电子跃迁?含有什么基团? 答:λ=240nm,ε=1.34×104吸收带为K带,说明分子中含有生色团,是π→π*跃迁引起 的。B,K,R,苯环及含杂原子的不饱和基团,π→π*,n→π λ=319nm,ε=50吸收带为R吸收带,说明分子中含有助色团,是n→π*跃迁引起的。 4. 已知化合物的分子式为C7H10O,可能具有β,α不饱和羰基结构,其K 吸收带波长 λmax =257nm(乙醇中),请推测结构。 四.计算下述化合物的λmax 略 3.试估计下列化合物中哪一种化合物的λmax最大,哪一种化合物的λmax最小,为什么?. 解:(b) > (a) >≈ (c) (b) 中有两个共轭双键,存在K吸收带,(a)中有两个双键,而(c )中只有一个双键. O OH O CH3 O CH3 (a)(b)(c)
紫外吸收光谱的应用
紫外吸收光谱的应用
第九章紫外吸收光谱分析ultraviolet spectro-photometry, UV 第三节紫外吸收光谱的应用applications of UV 一、定性、定量分析qualitative and quantitative analysis 1. 定性分析 εmax:化合物特性参数,可作为定性依据; 有机化合物紫外吸收光谱:反映结构中生色团和助色团的特性,不完全反映分子特性; 计算吸收峰波长,确定共扼体系等 甲苯与乙苯:谱图基本相同; 结构确定的辅助工具; εmax ,λmax都相同,可能是一个化合物; 标准谱图库:46000种化合物紫外光谱的标准谱图 ?The sadtler standard spectra ,Ultraviolet?2. 定量分析 依据:朗伯-比耳定律 吸光度:A= ε b c 透光度:-lg T = ε b c 灵敏度高:
εmax:104~105 L· mol-1 · cm -1;(比红外大) 测量误差与吸光度读数有关: A=0.434,读数相对误差最小; 二、有机化合物结构辅助解析structure determination of organic compounds 1. 可获得的结构信息 (1)200-400nm 无吸收峰。饱和化合物,单烯。(2)270-350 nm有吸收峰(ε=10-100)醛酮n →π* 跃迁产生的R带。 (3)250-300 nm 有中等强度的吸收峰(ε=200-2000),芳环的特征吸收(具有精细解构的B带)。 (4)200-250 nm有强吸收峰(ε≥104),表明含有一个共轭体系(K)带。共轭二烯:K带(~230 nm);?β,α不饱和醛酮:K带~230 nm ,R带~310-330 nm 260nm,300 nm,330 nm有强吸收峰,3,4,5个双键的共轭体系。 2.光谱解析注意事项 (1) 确认λmax,并算出㏒ε,初步估计属于何种吸收带;
常见有机溶剂极性表
有机溶剂是能溶解一些不溶于水的物质的一类有机化合物,其特点是在常温常压下呈液态,具有较大的挥发性,在溶解过程中,溶质与溶剂的性质均无改变。 有机溶剂的种类较多,按其化学结构可分为10大类:①芳香烃类:苯、甲苯、二甲苯等; ②脂肪烃类:戊烷、己烷、辛烷等;③脂环烃类:环己烷、环己酮、甲苯环己酮等;④卤化烃类:氯苯、二氯苯、二氯甲烷等;⑤醇类:甲醇、乙醇、异丙醇等;⑥醚类:乙醚、环氧丙烷等;⑦酯类:醋酸甲酯、醋酸乙酯、醋酸丙酯等;⑧酮类:丙酮、甲基丁酮、甲基异丁酮等;⑨二醇衍生物:乙二醇单甲醚、乙二醇单乙醚、乙二醇单丁醚等;⑩其他:乙腈、吡啶、苯酚等。 有机溶剂具有脂溶性,因此除经呼吸道和消化道进入机体内外,尚可经完整的皮肤迅速吸收,有机溶剂吸收入人体后,将作用于富含脂类物质的神经、血液系统,以及肝肾等实质脏器,同时对皮肤和粘膜也有一定的刺激性。不同有机溶剂其作用的主要靶器官和作用的强弱也不同,这决定于每一种有机溶剂的化学结构、溶解度、接触浓度和时间,以及机体的敏感性。 常用溶剂的极性顺序: 水(极性最大) > 甲酰胺 > 乙腈 > 甲醇 > 乙醇 > 丙醇 > 丙酮 > 二氧六环 > 四氢呋喃 > 甲乙酮 > 正丁醇 > 醋酸乙酯 > 乙醚 > 异丙醚 > 二氯甲烷 > 氯仿 > 溴乙烷 > 苯 > 氯丙烷 > 甲苯 > 四氯化碳 > 二硫化碳 > 环己烷 > 己烷 > 庚 烷 > 煤油(极性最小) 有机溶剂的极性根据官能团和对称性可初步判断,具体的需参照极性参数,如下
表示有机溶剂的极性,关系到其物理化学性质、如介电常数、偶极矩或折射率。这种表示方法把所有的溶剂看作是连续作用的介质,而不是看作由各个分子组成的非连续统一体,并且未考虑到溶剂和溶质之间的特殊的相互作用。
高中化学实验三: 有机化合物的紫外-可见吸收光谱及溶剂效应
实验三:有机化合物的紫外-可见吸收光谱及溶剂效应 一、实验目的 1、了解紫外-可见分光光度法的原理及应用范围。 2、了解紫外-可见分光光度计的基本构造及设计原理。 3、了解苯及衍生物的紫外吸收光谱及鉴定方法。 4、观察溶剂对吸收光谱的影响。 二、实验原理 紫外-可见分光光度法是光谱分析方法中吸光测定法的一部分。 1、紫外-可见吸收光谱的产生 紫外可见吸收光谱是由于分子中价电子的跃迁而产生的。这种吸收光谱决定于分子中价电子的分布和结合情况。分子内部的运动分为价电子运动、分子内原子在平衡位置附近的振动和分子绕其重心的转动。因此分子具有电子能级、振动能级和转动能级。通常电子能级间隔为1至20eV,这一能量恰落在紫外与可见光区。每一个电子能级之间的跃迁,都伴随着分子的振动能级和转动能级的变化,因此,电子跃迁的吸收线就变成了内含有分子振动和转动精细结构的较宽的谱带。 芳香族化合物的紫外光谱的特点是具有由π→π*跃迁产生的3个特征吸收带。例如,苯在184nm附近有一个强吸收带,ε=68000;在204nm处有一较弱的吸收带,ε=8800;在254nm附近有一个弱吸收带,ε=250。当苯处在气态时,这个吸收带具有很好的精细结构。当苯环上带有取代基时,则强烈地影响苯的3个特征吸收带。 2、紫外-可见光谱分析法的应用 1)化学物质的结构分析; 2)有机化合物分子量的测定; 3)酸碱离解常数的测定; 4)标准曲线法测定有机化合物的含量; 5)络合物中配位体/金属比值的测定; 6)有机化合物异构物的判别等。 3、紫外-可见分光光度计的基本构造 三、实验仪器与试剂 仪器:Cary500紫外-可见-近红外分光光度计 比色管(带塞):5mL10支,10mL3支; 移液管:1mL6支,0.1mL2支
紫外-可见光谱分析-----化合物结构鉴定剖析
化合物结构鉴定紫外-可见光谱分析作业
1.说明纳米Ru、Rh、Ir 等十种纳米材料的紫外可见光谱(附图) 2.说明马尾紫、孔雀绿、多氯代酚、苏丹、peo-ppo-peo、pvp等十种有机物或聚合物的紫外可见光谱(附图) 解答如下: 1(1)、纳米ZnS的紫外-可见光谱分析 紫外吸收光谱表征: 紫外-可见吸收光谱可观察能级结构的变化,通过吸收峰位置变化可以考察能级的变化。由图5可知,硫化锌在200~340 nm波长范围内对紫外光有较强的吸收。 1(2)、NiFeAu纳米材料的紫外-可见光谱分析 紫外吸收光谱表征:
上图比较了相关纳米粒子的紫外-可见吸收光谱.图b是NiFeAu纳米粒子分散在正己烷中的紫外-可见吸收光谱可以看出NiFeAu纳米粒子在约557nm有一个较宽的吸收峰.对比用同样方法合成的NiFe图a在所测试的范围内无特征的吸收峰可以判断多功能性NiFeAu纳米粒子具有源于Au表面等离子共振吸收的光学性质.与用同样方法合成的纳米Au粒径8nm在可见光区526nm有强的吸收峰相比图c NiFeAu纳米粒子的吸收峰形明显变宽并出现红移该观察说明除了粒径大小变化的因素Fe和Ni的存在影响了Au的表面等离子共振吸收也间接证明了NiFeAu纳米复合粒子的生成.Au的特征吸收峰的峰形和强度不同原因在于纳米粒子的组成发生了变化.根据纳米颗粒光学响应模型Mie理论表面等离子共振吸收是由入射光频率和金属纳米颗粒中的自由电子的集体发生共振时产生的而表面等离子共振吸收的共振条件对纳米颗粒周围的环境十分敏感纳米粒子的组成结构尺寸形状电解质或者粒子间的相互作用力不同特征吸收峰的强度和形状都会受到影响而不一样. 1(3)、TiO 纳米材料的紫外-可见光谱分析 2 紫外吸收光谱表征:
常用溶剂极性表
常用溶剂极性表
二:常用溶剂的沸点、溶解性和毒性 溶剂名称沸点℃(101.3kPa) 溶解性毒性 液氨-33.35 特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性 液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒 甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃 二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性 石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似 乙醚34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性 戊烷36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性 二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,
麻醉性强 二硫化碳46.23 微溶与水,与多种有机溶剂混溶麻醉,强刺激性 丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大 1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性 甲醇64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒 己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒,麻醉性,刺激性 三氟代乙酸71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物 1,1,1-三氯乙烷74.0 与丙酮、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒 四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强 乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性 乙醇78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性 丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮 苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性 环己烷80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用 乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒 异丙醇82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇 1,2-二氯乙烷83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌 乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶, 能溶解各种树脂,还是二氧化硫、氯代甲烷、乙烯等气体的优良溶剂吸入和经口低毒 三氯乙烯87.19 不溶于水,与乙醇、乙醚、丙酮、苯、乙酸乙酯、脂肪族氯代烃、汽油混溶有机有毒品 三乙胺89.6 水:18.7以下混溶,以上微溶, 易溶于氯仿、丙酮,溶于乙醇、乙醚易爆,皮肤黏膜刺激性强 丙睛97.35 溶解醇、醚、DMF、乙二胺等有机物,与多种金属盐形成加成有机物高毒性,与氢氰酸相似 庚烷98.4 与己烷类似低毒,刺激性、麻醉性 水100 略略
1实验一有机化合物的紫外吸收光谱及溶剂性质对吸收光谱的影响_.
实验一有机化合物的紫外吸收光谱及溶剂性质对吸收光谱的影响 一、实验目的: 1、熟练紫外—可见分光光度计的操作。 2、学习利用紫外吸收光谱检查物质的纯度的原理和方法。 3、掌握溶剂极性对跃迁,跃迁的影响 二、仪器与试剂 1、仪器 730型紫外—可见分光光度计,带盖石英吸收池1cm 2只。 2、试剂 (1 苯、乙醇、正己烷、氯仿、丁酮。 (2 异亚丙基丙酮:分别用水、氯仿、正已烷配成浓度为0.4g/L溶液。 二、实验原理 具有不饱和结构的有机化合物,如芳香族化合物,在紫外区(200~400nm有特征的吸收,为有机化合物的鉴定提供了有用的信息。 紫外吸收光谱定性的方法是比较未知物与已知纯样在相同条件下绘制的吸收光谱,或将绘制的未知物吸收光谱与标准谱图(如Sadtler紫外光谱图相比校,若两光谱图的和相同,表明它们是同一有机化合物。极性溶剂对有机物的紫外吸收光谱的吸收峰波长、强度及形状有一定的影响。溶剂极性增加,使跃迁产生的吸收带蓝移,而跃迁产生的吸收带红移。 影响有机化合物紫外吸收光谱的因素,有内因(分子内的共轭效应、位阻效应、助色效应等和外因(溶剂的极性、酸碱性等溶剂效应由于受到溶剂极性和酸碱性的影响,将使溶质的吸收峰的波长、强度以及形状发生不同程度的变化,这是因为溶剂分子和溶质分子之间可能形成氢键,使极性溶剂分子的偶极减弱,溶质分子的极性
增强,因而在极性溶剂中跃迁所需的能量减小,吸收波长红移,而在极性溶剂中所需能量增大,吸收波长蓝移,由于物质的紫外吸收光谱是物质分子中生色团和助色团的贡献,也是物质整个分子的特征表现。例如具有键电子的共轭双键化合物、芳香烃化合物等,在紫外光谱区都有强烈吸收,其摩尔吸光系数可达104~105数量级,这与饱和烃化物有明显的不同。利用这一特性,可以很方便地检查纯饱和烃化物中是否含有共轭双键、芳香烃等化合物杂质。 三、实验步骤 1、苯的吸收光谱的测绘 在1cm的石英吸收池中,加入两滴苯,加盖,用手心温热吸收池底部片刻,在紫外分光光度计上,以空白石英吸收池为参比,从220~360nm范围内进行波长扫描,绘制吸收光谱。确定峰值波长。 2、乙醇中杂质苯的检查 用1cm石英吸收池,以乙醇为参比溶液,在230—280nm波长范围内测绘乙醇试样的吸收光谱,并确定是否存在苯的B吸收带? 3、溶剂性质对紫外吸收光谱的影响 (1 在3支5mL带塞比色管中,各加入0.02mL丁酮,分别用去离子、乙醇、氯仿稀释至刻度,摇匀。用1cm的石英吸收池,以各自的溶剂为参比,在220~350nm波长范围内测绘各溶液的吸收光谱。比较它们的的变化。并加以解释。 (2 在3支10mL带塞比色管中,分别加入0.02mL异亚丙基丙酮,并分别用水、氯仿、正已烷稀释至刻度,摇匀。用1cm石英吸收池,以相应的溶剂为参比,测绘各溶液在220~350nm范围内的吸收光谱,比较各吸收光谱的变化,并加以解释。 四、注意事项 1、石英吸收池每一种溶液或溶剂必须清洗干净,并用被测溶液或参比液荡洗三次。
常见溶剂的极性大小
常用溶剂极性2007年04月29日星期日19:35在结晶和重结晶纯化化学试剂的操作中,溶剂的选择是关系到纯化质量和回收率的关键问题。选择适宜的溶剂时应注意以下几个问题:1. 选择的溶剂应不与欲纯化的化学试剂发生化学反应。例如脂肪族卤代烃类化合物不宜用作碱性化合物结晶和重结晶的溶剂;醇类化合物不宜用作酯类化合物结晶和重结晶的溶剂,也不宜用作氨基酸盐酸盐结晶和重结晶的溶剂。 2. 选择的溶剂对欲纯化的化学试剂在热时应具有较大的溶解能力,而在较低温度时对欲纯化的化学试剂的溶解能力大大减小。 3. 选择的溶剂对欲纯化的化学试剂中可能存在的杂质或是溶解度甚大,在欲纯化的化学试剂结晶和重结晶时留在母液中,在结晶和重结晶时不随晶体一同析出;或是溶解度甚小,在欲纯化的化学试剂加热溶解时,很少在热溶剂溶解,在热过滤时被除去。 4. 选择的溶剂沸点不宜太高,以免该溶剂在结晶和重结晶时附着在晶体表面不容易除尽。 用于结晶和重结晶的常用溶剂有:水、甲醇、乙醇、异丙醇、丙酮、乙酸乙 酯、氯仿、冰醋酸、二氧六环、四氯化碳、苯、石油醚等。此外,甲苯、硝基甲烷、乙醚、二甲基甲酰胺、二甲亚砜等也常使用。二甲基
甲酰胺和二甲亚砜的溶解能力大,当找不到其它适用的溶剂时,可以试用。但往往不易从溶剂中析出结晶,且沸点较高,晶体上吸附的溶剂不易除去,是其缺点。乙醚虽是常用的溶剂,但是若有其它适用的溶剂时,最好不用乙醚,因为一方面由于乙醚易燃、易爆,使用时危险性特别大,应特别小心;另一方面由于乙醚易沿壁爬行挥发而使欲纯化的化学试剂在瓶壁上析出,以致影响结晶的纯度。 在选择溶剂时必须了解欲纯化的化学试剂的结构,因为溶质往往易溶于与其结构相近的溶剂中―“相似相溶”原理。极性物质易溶于极性溶剂,而难溶于非极性溶剂中;相反,非极性物质易溶于非极性溶剂,而难溶于极性溶剂中。这个溶解度的规律对实验工作有一定的指导作用。如:欲纯化的化学试剂是个非极性化合物,实验中已知其在异丙醇中的溶解度太小,异丙醇不宜作其结晶和重结晶的溶剂,这时一般不必再实验极性更强的溶剂,如甲醇、水等,应实验极性较小的溶剂,如丙酮、二氧六环、苯、石油醚等。适用溶剂的最终选择,只能用试验的方法来决定。下表可供选择溶剂时参考。 物质的类别溶解度大的溶剂 烃疏水性烃、醚、卤代烃 卤代烃 醚 胺 酯酯
常用有机溶剂极性表
微波化学-溶剂极性 1.前言:只有极性物质能吸收微波,非极性物质不吸收微波,一般介电常数e>15者,称之为极性溶剂,在进行实验时,务必确保反应的试剂中含有极性物质。而介电常数e<15者决不能单独作为反应样品进行微波加热,否则会造成磁控管打火,烧坏仪器。如果试验中所用试剂为非极性时,在不影响实验的情况下,应该混合加入极性溶剂或者极性物质以利反应,如:碳化硅 2.常用有机溶剂的极性表 溶剂介电常数(e) 溶剂介电常数(e) 溶剂介电常数(e) 三甲基苯 1.90 丁酸乙酯 5.10 甲丙酮16.80 环己烷 2.02 溴苯 5.17 苯乙酮17.30 四氯化碳 2.24 丁胺 5.40 苯甲醛17.80 1,2-二氧六环 2.25 丁酸甲酯 5.60 丁醇17.80 苯 2.30 氯苯 5.62 异丙醇17.90 对二甲苯 2.30 苯甲酸乙酯 6.02 环己酮18.20 三甲苯 2.30 乙酸乙酯 6.02 苯乙腈18.30 二甲苯 2.40 乙酸 6.15 丁酮18.50 甲苯 2.40 乙胺 6.30 异丁醇18.70 三乙胺 2.42 乙酸甲酯 6.70 丙酮20.70 萘 2.50 甲酸乙酯7.10 丁腈20.70 7.20 乙酸酐21.00 三甲胺 2.50 1,2-二甲氧基乙 烷 邻二甲胺 2.57 苯胺7.30 甲醛23.00 二硫化碳 2.60 四氢呋喃7.58 酒精24.30 己酸 2.60 正丁醇7.80 乙醇24.50 戊酸 2.60 2,2,2-三氟乙醇8.55 苯甲腈26.00 乙醛 2.90 三氟乙酸8.55 乙二腈27.00 正丁酸 2.90 二氯乙烷8.93 丙腈27.70 丁酸 3.00 邻二氯苯9.93 甲醇32.70 呋喃 3.00 1,2-二氯乙烷10.36 硝基苯34.82 乙苯 3.00 2-甲基2-丙醇10.90 硝基甲烷35.87 36.70 丙酸 3.10 丁酸酐12.00 N,N-二甲基甲 酰胺 丁醚 3.10 吡啶12.50 乙二醇37.00 辛酸 3.20 苯甲醇13.00 乙腈37.50 三氯乙烯 3.40 二苯甲酮13.00 N,N-二甲基乙37.80
有机化合物的紫外吸收光谱及溶剂效应
实验九有机化合物的紫外吸收光谱及溶剂效应 实验目的: (1)学习有机化合物结构与其紫外光谱之间的关系; (2)了解不同极性溶剂对有机化合物紫外吸收带位置、形状及强度的影响。 (3)学习紫外—可见分光光度计的使用方法 实验原理: 与紫外-可见吸收光谱有关的电子有三种,即形成单键的σ电子、形成双键的π电子以及未参与成键的n电子。跃迁类型有:σ→σ*,n→σ* ,n→π*,π→π* 四种。在以上几种跃迁中,只有π-π*和n-π*两种跃迁的能量小,相应波长出现在近紫外区甚至可见光区,且对光的吸收强烈,是我们研究的重点。 影响有机化合物紫外吸收光谱的因素有内因和外因两个方面。 内因是指有机物的结构,主要是共轭体系的电子结构。随着共轭体系增大,吸收带向长波方向移动(称作红移),吸收强度增大。紫外光谱中含有π键的不饱和基团称为生色团,如有C=C、C=O、NO2、苯环等。含有生色团的化合物通常在紫外或可见光区域产生吸收带;含有杂原子的饱和基团称为助色团,如OH、NH2、OR、Cl等。助色团本身在紫外及可见光区域不产生吸收带,但当其与生色团相连时,因形成n→π*共轭而使生色团的吸收带红移,吸收强度也有所增加。 影响有机化合物紫外吸收光谱的外因是指测定条件,如溶剂效应等。所谓溶剂效应是指受溶剂的极性或酸碱性的影响,使溶质吸收峰的波长、强度以及形状发生不同程度的变化。这是因为溶剂分子和溶质分子间可能形成氢键,或极性溶剂分子的偶极使溶质分子的极性增强,从而引起溶质分子能级的变化,使吸收带发生迁移。例如异丙叉丙酮的溶剂的溶剂效应如表1所示。随着溶剂极性的增加K带红移,而R带向短波方向移动(称作蓝移或紫移)。这是因为在极性溶剂中π→π * 跃迁所需能量减小,吸收波长红移(向长波长方向移动)如图(a)所示;而n→π * 跃迁所需能量增大,吸收波长蓝移(向短波长方向移动),溶 剂效应示意图如(b)所示。 图1 电子跃迁类型 σ π * σ * n π?
常用溶剂极性表
溶剂极性表
ethanol 4.30 1.20 79 210 Ethyl acetate 乙酸乙酯 4.30 0.45 77 260 i-propanol(丙醇) 4.30 2.37 82 210 Chloroform(氯仿) 4.40 0.57 61 245 Methyl ethyl ketone(甲基乙 4.50 0.43 80 330 基酮) Dioxane( 二恶烷; 二氧六 4.80 1.54 102 220 环; 二氧杂环己烷) Pyridine(吡啶) 5.30 0.97 115 305 Acetone(丙酮) 5.40 0.32 57 330 Nitromethane(硝基甲烷) 6.00 0.67 101 380 Acetic acid(乙酸) 6.20 1.28 118 230 0.37 82 210 Acetonitrile(乙腈) 6.20 Aniline(苯胺) 6.30 4.40 184 -- Dimethyl formamide(二甲 6.40 0.92 153 270 基甲酰胺) Methanol(甲醇) 6.60 0.60 65 210 Ethylene glycol(乙二醇) 6.90 19.90 197 210 Dimethyl sulfoxide() 7.20 2.24 189 268 water 10.20 1.00 100 268 水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮> 二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小) 溶剂选择的三条通用规律可以遵循。1、极性相似原则。即极性相近的物质可以互溶。如汽车漆中极性比较高的氨基漆一般选择极性比较高的丁醇等做溶剂。2、溶剂化原则。溶剂化是指溶剂分子对溶质分子产生的相互作用,当作用力大于溶质分子的内聚力时,便使溶质分子彼此分开而溶于溶剂中。如极性分子和聚合物的极性基团相互吸引而产生溶剂化作用,使聚合物溶解。3、溶解度参数原则。即如果溶剂的溶解度参数和聚合物的溶解度参数相近或相等时,就能使这一聚合物溶解,应用此原则较易掌握,还可用于电子计算机进行选择。 溶剂化原则: 极性高分子溶解在极性溶剂中的过程,是极性溶剂分子(含亲电基团或亲核基团)和高分子的(亲核或亲电)极性基团相互吸引产生溶剂化作用,使高分子溶解。溶剂化作用是放热的。因而对于有这些基团的聚合物,要选择相反基团的溶剂。比如尼龙6 是亲核的,要选择甲酸、间甲酚等带亲电基团的溶剂;相反聚氯乙烯是亲电的,要选择环己酮等带亲核基团的溶剂。 高分子和溶剂中常见的亲核或亲电基团,按其从强到弱顺序排列如下:亲电基团:- SO3H, -COOH, -C6H4OH, =CHCN, =CHNO2, -CHCl2, =CHCl 亲核基团:-CH2NH2, - C6H4NH2, -CON(CH3)2, -CONH-, ≡PO4, -CH2COCH2-, -CH2OCOCH2-, -CH2OCH2- 非极性高分子与溶剂的越接近,越易溶解。一般认为 <1.7~2 可以溶解。 主要可以用以下三种间接的方法求得: (1)黏度法,使高分子溶液有最大特性黏数的溶剂的对应于高分子的。
实验三_有机化合物的紫外吸收光谱及溶剂对其吸收光谱的影响
实验三 有机化合物的紫外吸收光谱及溶剂对其吸收光谱的影响 一、实验目的: 1、学习并掌握紫外-可见分光光度计的使用; 2、了解不同的助色团对苯的紫外吸收光谱的影响; 3、观察pH 对苯酚的吸收光谱的影响。 二、实验原理: 具有不饱和结构的有机化合物,特别是芳香族化合物,在近紫外区 (200~400nm )有特征的吸收,给鉴定有机化合物提供了有用的信息。苯有三个吸收带,它们都是由*ππ→跃迁引起的, E 1带:11max 180(60000)nm L cm mol λε--==??, E 2带:11max 204(8000)nm L cm mol λε--==??,两者都属于强吸收带。B 带出现在230~270nm ,其11max 254(200)nm L cm mol λε--==?? 。在气态或非极性溶剂中,苯及其许多同系物的B 带有许多精细结构,这是振动跃迁在基态电子跃迁上叠加的结果。在极性溶剂中,这些精细结构消失。当苯环上有取代基时,苯的三个吸收带都将发生显著的变化,苯的B 带显著红移,并且吸收强度增大。 溶剂的极性对有机物的紫外吸收光谱有一定的影响。当溶剂的极性由非极性改变到极性时,精细结构消失,吸收带变平滑。显然,这是由于未成键电子对的溶剂化作用降低了n 轨道的能量使*π→n 跃迁产生的吸收带发生紫移,而*ππ→跃迁产生的吸收带则发生红移。 影响有机化合物的紫外吸收光谱的因素有:内因(共轭效应、空间位阻、助色效应)和外因(溶剂的极性和酸碱性)。 溶剂的极性和酸碱性不仅影响待测物质吸收波长的移动,还影响吸收峰吸收强度和它的形状。 本实验重点在了解不同的助色团对苯的紫外吸收光谱的影响和观察pH 对苯酚的吸收光谱的影响。 三、仪器:
