索非布韦合成路线

合成索菲布韦可行性研究报告一、基本信息:
化学结构
式:
通用名:索非布韦、索菲布韦、索氟布韦
中文化学名:N-[[P(S),2'R]-2'-脱氧-2'-氟-2'-甲基-P-苯基-5'-尿苷酰基]-L-丙氨酸异丙酯
英文化学
名:
GS-7977 CAS登记
号:
1190307-88-0 分子式:C22H29FN3O9P 分子量:529.45
适用症:索非布韦是一种丙型肝炎病毒(HCV) 核苷酸类似物NS5B 聚合酶抑制剂,适用于作为联合抗病毒治疗方
案中的组合成分治疗慢性丙肝(CHC) 感染
制剂及规
格:
400mg片剂
二、商品信息
质量标准医药级
含量≥99.0%;单杂≤0.10%,总杂≤1.0%
外观性状白色结晶性粉末
包装规格铝箔袋
储存低温,遮光密闭保存
国外上市情况
索氟布韦,英文名Sofosbuvir,商品名Sovaldi是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。该药还未在中国上市,只能去国外医院获得。
国内上市情况:暂无
三、工艺概述
1)合成路线选择:
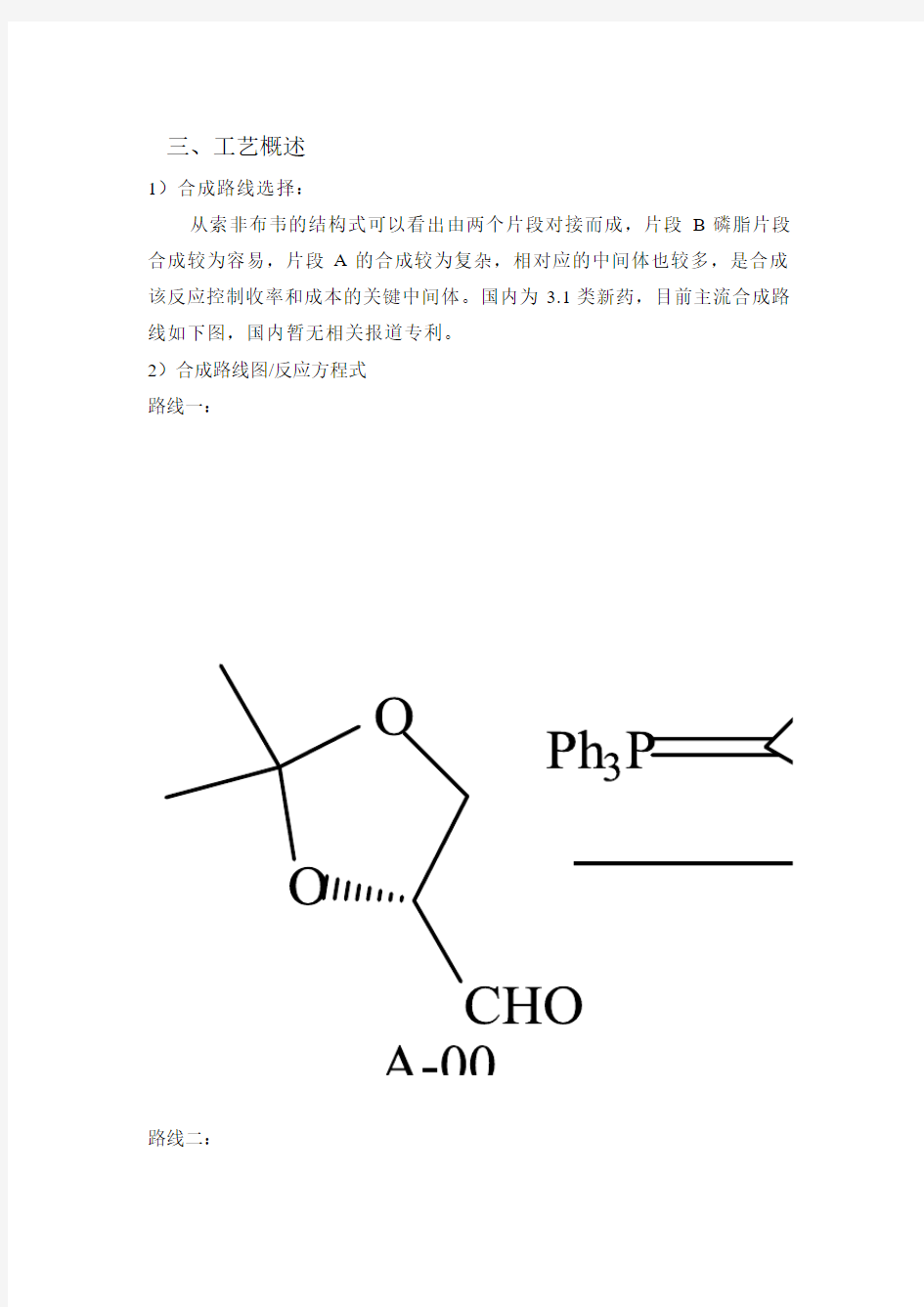
从索非布韦的结构式可以看出由两个片段对接而成,片段B磷脂片段合成较为容易,片段A的合成较为复杂,相对应的中间体也较多,是合成该反应控制收率和成本的关键中间体。国内为3.1类新药,目前主流合成路线如下图,国内暂无相关报道专利。
2)合成路线图/反应方程式
路线一:
路线二:
3)工艺路线描述
路线一:
合成索非布韦的路线是有片段A和片段B对接而成,片段A的合成是由起始原料(R) -2,2-二甲基-1 ,3-二氧戊环-4-甲醛(A-00),经过witting反应,高锰酸钾氧化双键,酯化,氧化,还原,氯代,亲核取代等多步反应得到片段A;片段B是由以L-丙氨酸异丙酯盐酸盐为原料经磷酰化、酯化后再与片段B反应制得索非布韦。总步骤约11步。该路线和起始原料等的选择也是目前国内外研发的主流路线,不排除企业创新设计其他中间体情况,路线中的11步均有相关文献报道,故不存在风险问题,路线不通等情况,在实验当中将根据实验结果可能进行适当改变,从成本,质量,收率等角度进行适当完善适合自己公司的工艺路线资料。
路线二:
路线二与路线一差别不大,片段B的合成略有差别,使用的辅料不同,导致中间体不同,根据实际合成路线选择不同的片段B路线合成。
4)实验方案。(略)
四、相关中间体产品信息情况
四.产品开发时间与资金。
从起始物到制备出索非布韦共11步反应,合成路线长,技术难度较大,需要研发人员有较强的专业知识并且考虑到其它不稳定因素的影响,预计打通工艺路线制备出合格的索非布韦需要时间约4~6月,尤其是合成片段A,但起始原料和片段A和片段
B等有关中间体市场上均有销售,可以减轻研发人员的开发精力等,鉴于市场上索非布韦的及中间体价格较贵,预计开发成本较高。
索非布韦杂质整理
索非布韦相关杂质整理列表 中文名英文名CAS号规格纯度结构式 索非布韦杂质1 Sofosbuvir Impurity 1 874638-94- 5 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质9 Sofosbuvir Impurity 9 1627824-0 9-2 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质15 Sofosbuvir Impurity 15 1337482-1 7-3 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质16 Sofosbuvir Impurity 16 1337482-1 5-1 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质18 Sofosbuvir Impurity 18 1859162-8 0-3 10mg-25mg-50mg-100mg ≥99%
湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD、LGC、TLC、EP、USP、TRC等多个品牌产品,提供上万种标准品 对照品,真诚为您服务。 索非布韦杂质21 Sofosbuvir Impurity 21 1015073-4 3-4 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质26 Sofosbuvir Impurity 26 701-64-4 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质27 Sofosbuvir Impurity 27 1190308-0 1-0 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质28 Sofosbuvir Impurity 28 1496552-5 1-2 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质29 Sofosbuvir Impurity 29 771-61-9 10mg-25mg-50mg-100mg ≥99% 索非布韦杂质30 Sofosbuvir Impurity 30 2041584-9 9-8 10mg-25mg-50mg-100mg ≥99%
索非布韦合成路线
合成索菲布韦可行性研究报告 一、基本信息: 二、商品信息 质量标准医药级 含量≥99.0%;单杂≤0.10%,总杂≤1.0% 外观性状白色结晶性粉末 包装规格铝箔袋 储存低温,遮光密闭保存 国外上市情况 索氟布韦,英文名Sofosbuvir,商品名Sovaldi是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。该药还未在中国上市,只能去国外医院获得。 国内上市情况:暂无
三、工艺概述 1)合成路线选择: 从索非布韦的结构式可以看出由两个片段对接而成,片段B磷脂片段合成较为容易,片段A的合成较为复杂,相对应的中间体也较多,是合成该反应控制收率和成本的关键中间体。国内为 3.1类新药,目前主流合成路线如下图,国内暂无相关报道专利。 2)合成路线图/反应方程式 路线一: 路线二:
3)工艺路线描述 路线一: 合成索非布韦的路线是有片段A和片段B对接而成,片段A的合成是由起始原料(R) -2, 2-二甲基-1 ,3-二氧戊环-4-甲醛(A-00),经过witting反应,高锰酸钾氧化双键,酯化,氧化,还原,氯代,亲核取代等多步反应得到片段A;片段B是由以 L-丙氨酸异丙酯盐酸盐为原料经磷酰化、酯化后再与片段B反应制得索非布韦。总步骤约11步。该路线和起始原料等的选择也是目前国内外研发的主流路线,不排除企业创新设计其他中间体情况,路线中的11步均有相关文献报道,故不存在风险问题,路线不通等情况,在实验当中将根据实验结果可能进行适当改变,从成本,质量,收率等角度进行适当完善适合自己公司的工艺路线资料。 路线二: 路线二与路线一差别不大,片段B的合成略有差别,使用的辅料不同,导致中间体不同,根据实际合成路线选择不同的片段B路线合成。 4)实验方案。(略) 四、相关中间体产品信息情况
索非布韦说明书
索非布韦 索氟布韦,英文名Sofosbuvir,是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为61%-63%。值得一提的是,索非布韦的临床试验还包含了一些丙肝合并肝硬化的患者,疗效也较显著。 治疗丙肝的新药索非布韦片令饱受争议的美国医改再陷窘境。因无力解决医保开支难题,以俄勒冈州为代表的一些州正在想方设法限制对该药的供应,总统奥巴马的医改方案所提出的扩大医疗援助计划因此又大打折扣。 2用法用量 每片400mg,一日一片,空腹或随餐服用 可联合利巴韦林或者联合利巴韦林+聚乙二醇干扰素治疗慢性丙型肝炎(CHC)。 推荐联合治疗方案如下表: HCV单独感染 或HCV /HIV-1合并感染治疗方案治疗持续时间 基因1或4型索非布韦+聚乙二醇干扰素-α+利巴韦林12周 基因2型索非布韦+利巴韦林12周 基因3型索非布韦+利巴韦林24周 无法使用干扰素的1型慢性丙肝患者可考虑使用索非布韦联合利巴韦林治疗24周。 等待肝移植的肝细胞癌患者应使用索非布韦联合利巴韦林治疗慢性丙肝,持续48周或直至接受肝移植,以首先发生为准。 无法对患有严重肾功能损害或处于终末期肾病的患者给出剂量建议。 3剂型 每片:400 mg。 4禁忌症 索非布韦联合聚乙二醇干扰素-α+利巴韦林,或单独联合利巴韦林使用时,所有聚乙二醇干扰素-α和/或利巴韦林的禁忌症也适用于索非布韦联合治疗。 ?由于利巴韦林有可能导致胎儿先天畸形或死胎,因此索非布韦联合聚乙二醇干扰素α+利巴韦林,或索非布韦单独联合利巴韦林应在孕妇和伴侣已怀孕的男性中禁用。 5适应症及用途 索非布韦是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂,适用于作为联合抗病毒治疗方案中的组合成分治疗慢性丙肝(CHC)感染。 索非布韦经试验证实可有效治疗基因1、2、3或4型丙肝受试者,包括符合米兰标准正在等待肝移植的肝细胞癌受试者以及HCV/HIV-1合并感染受试者。 6警告与注意事项 妊娠:利巴韦林有可能导致胎儿先天畸形或死胎,并且动物实验显示干扰素可引发流产。因此,服用此药的女性患者及男性患者的配偶都应避免怀孕。在开始治疗前,患者的妊娠测试必须为阴性,至少使用过两种非激素方法避孕,并且需每月进行妊娠测试。 7不良反应 索非布韦联合利巴韦林引起的已知最常见不良反应(发生率等于或大于20%,所有等级)是头痛与乏力;索非布韦联合聚乙二醇干扰素-α及利巴韦林引起的已知最常见不良反应包括乏力、头痛、恶心、失眠和贫血。 药物相互作用 强效的肠道糖蛋白(P-gp)诱导剂(如利福平)可能改变索非布韦的药物血浆浓度。使用前,药
丙肝新药索非布韦、达卡他韦
丙肝新药索非布韦、达卡他韦 索非布韦 索非布韦(英文名Sofosbuvir,商品名Sovaldi)是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。该药还未在中国上市,只能去国外医院获得。 索非布韦是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率高达(SVR)90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为 61%-63%。值得一提的是,索非布韦的临床试验还包含了一些丙肝合并肝硬化的患者,疗效也较显著。 达卡他韦 达卡他韦(英文名Daclatasvir)是英国和日本上市的一种治疗丙肝药物,效果和治疗周期与索非布韦较为相似。据悉,美国正在研究达卡他韦的联合用药,目前还没有相关的上市消息。 达卡他韦与索非布韦用法及疗效对比:表一: 表二:
什么是丙型肝炎? 丙型肝炎(丙肝)是一种传染性肝脏疾病,严重程度不一,轻度丙肝只出现轻微症状,持续数周,重度丙肝则损害肝脏,持续终身。丙肝源于丙型肝炎病毒(HCV)感染,主要通过接触感染者血液传播。丙肝可分为急性与慢性。 急性丙肝病毒感染:指丙肝病毒感染后最初6个月内的急性病。对于大多数人来说,急性感染通常会转变为慢性感染。 慢性丙肝病毒感染:指丙肝病毒长期存留在人体内的慢性病。丙肝病毒感染可以持续终生,引起严重的肝脏疾病,如肝硬化与肝癌。 作为RNA病毒,HCV的基因组具有高度变异特性。利用现代遗传分类方法,可将HCV分为6个基因型和80多个亚型。我国流行的HCV有1、2、3和6四种基因型,以1b和2a型为主。 丙肝如何传播? 丙肝一般通过血液传播,即丙肝病毒感染者的血液进入未传染者的血液中。人们可能在进行以下活动时感染上丙肝病毒: 共用针头、注射器或其他药物注射仪器 在医疗卫生场所受针刺伤 丙肝病毒的母婴传播 少见的感染途径: 共用可能接触到他人血液的私人物品,如刮胡刀与牙刷 与丙肝病毒感染者进行性接触 丙肝的长期影响有哪些? 丙肝病毒感染者中: 75%-85%会发展成慢性丙肝病毒感染 60%-70%会发展为慢性肝病 5%-20%会在20-30年间发展为肝硬化 1%-5%会死于肝硬化或肝癌
丙肝新药索非布韦片说明书
丙肝新药索非布韦片|Sovaldi(Sofosbuvir Tablets) 2014年1月17日,丙肝新药Sovaldi(sofosbuvir,400mg片剂)获欧盟批准,作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV)成人感染者的治疗。Sovaldi为每日一次的口服核苷类似物聚合酶抑制剂,此次批准,为该药在整个欧盟的上市铺平了道路。 此前,Sovaldi已于2013年11月获得了欧洲药品管理局(EMA)人用医药产品委员会(CHMP)建议批准的积极意见。CHMP通过加速审批程序对Sovaldi上市许可申请(MAA)进行了评估,该药MAA由6个III期研究(NEUTRINO, FISSION, POSITRON, FUSION, VALENCE, PHOTON-1)的数据支持。 在美国,Sovaldi已于2013年12月6获FDA批准,该药是首个获批可用于C型肝炎全口服治疗方案的药物,在用于特定基因型慢性丙型肝炎治疗时,可消除对传统注射药物干扰素(IFN)的需求。 具体而言,FDA已批准sofosbuvir联合利巴韦林(ribavirin)用于基因型2和基因型3慢性丙型肝炎(h epatitis C)成人患者的治疗。同时,FDA还批准sofosbuvir联合聚乙二醇干扰素(PEG-IFN)和利巴韦林,用于基因型1和基因型4慢性丙型肝炎初治(treat-naive)成人患者的治疗。 在欧洲和世界各地,慢性丙型肝炎(HCV)是导致肝癌和肝移植的主要原因。当前的HCV护理标准涉及长达48周的含聚乙二醇干扰素(peg-IFN)/利巴韦林(RBV)方案。这些方案并不总是有效,而且具有显著的副作用,并与其他药物具有用药禁忌。在欧洲,许多患者被认为不适合当前的治疗方案。 适应证和用途 SOVALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂适用为慢性丙型肝炎(CHC)感染的治疗作为组合抗病毒治疗方案的一个组分。 (1)SOVALDI疗效已在有HCV基因型1,2,3或4感染受试者中被确定,包括有肝细胞癌符合米兰[M ilan]标准(等待肝移植)和有HCV/HIV-1共-感染受试者。 剂量和给药方法 (1)一片400 mg片每天1次有或无食物服用。 (2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC 的治疗。建议联合治疗: (3)SOVALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC患者。 (4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC的治疗,以先发生为准。 (5)对有严重肾受损或肾病终末期患者不能建议剂量。
索非布韦的合成工艺研究
索非布韦的合成工艺研究 索非布韦是一种新型抗丙肝病毒药物,具有独特的药理作用和疗效、广阔的市场空间和应用前景。现有的索非布韦合成存在合成路线长、收率低、使用剧毒物质及三废量大的问题。 其关键的中间体是(2R)-2-脱氧-2-氟-2-甲基-D-赤式戊糖酸-γ-内酯-3,5-二苯甲酸酯的合成,存在氟化收率低、Wittig反应立体选择性差、使用剧毒物质四氧化锇等问题。本文通过对现有合成路线的分析,确定了以价格低廉的R-甘油醛缩丙酮为原料的合成路线,着重对索非布韦关键中间体合成工艺进行了探索,通过研究亲核氟代反应、Wittig反应选择性及双羟基化反应,提出了新的合成方法和工艺,完成了关键中间体的合成工艺开发优化,并在此基础上完成了索非布韦整个合成工艺的优化。 通过对环硫酸酯化合物5氟化反应机理分析,选择二乙胺基三氟化硫、四丁基氟化铵、四乙基氟化铵等氟化试剂,研究了不同氟化试剂对反应收率的影响,发现氟化试剂的性质对环硫酸酯开环氟代反应的收率影响较大。研究溶剂对氟代反应的影响发现极性质子溶剂对亲核性的抑制作用显著,不利S_N2亲核取代反应;弱极性非质子溶剂有利于S_N2亲核取代反应;温度升高时,消除反应等副反应显著增加。 通过对氟代试剂、溶剂及温度的优化实验,得到了优化的工艺条件。以四乙基氟化铵作为氟化试剂,1,4-二氧六环为溶剂,反应温度为110℃能有效控制副反应的发生。 四乙基氟化铵作为氟化试剂,具有不易水解、反应条件温和的特点。优化后氟化反应条件温和,收率达到81%。
针对文献中报道的Wittig反应收率低及异构体杂质含量高等问题,采用乙氧甲酰基亚甲基三苯基膦作为稳定的磷叶立德试剂,研究了反应温度、溶剂对Wittig反应的收率及异构体的影响。发现采用稳定的磷叶立德试剂在低温、非质子性溶剂二氯甲烷条件下主要生成反式(E)-构型产物。 经过优化,反应温度为-70℃时,该步收率达到95%,顺式(Z)-烯烃异构体降 低到1.2%,大幅提高了产物收率并降低了异构体杂质。文献报道使用剧毒的四氧化锇进行双羟基化反应。 经过分析采用廉价低毒的高锰酸钾作为双羟基化反应氧化剂,针对高锰酸钾在有机溶剂中不易溶解及在水相中易发生过度氧化的问题,采用相转移催化法对化合物2的双羟基化反应进行了研究,通过研究相转移催化剂、温度、氧化剂用量、溶剂等反应条件对双羟基化反应的影响,发现采用苄基三乙基氯化铵为相转移催化剂,有效解决了双羟基化反应问题。经过优化反应条件,收率达到79%。 关键中间体8的反应收率达到42%,较文献报道提高了18%,且原料价廉易得、反应条件温和及安全环保。在对关键中间体合成优化的基础上,经三叔丁氧基氢化锂铝还原、酰基化、取代、脱保护基、取代等反应完成了索非布韦的合成,并对各步工艺条件进行了优化研究。 成功获得了新的索非布韦的合成工艺路线,新的索非布韦的合成工艺原料价廉易得、中间体易纯化、产品收率高及安全环保,具有重要的应用价值和意义。
索非布韦合成路线
合成索菲布韦可行性研究报告一、基本信息: 二、商品信息 质量标准医药级 含量≥%;单杂≤%,总杂≤% 外观性状白色结晶性粉末 包装规格铝箔袋
储存低温,遮光密闭保存 国外上市情况 索氟布韦,英文名Sofosbuvir,商品名Sovaldi是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。该药还未在中国上市,只能去国外医院获得。 国内上市情况:暂无 三、工艺概述 1)合成路线选择: 从索非布韦的结构式可以看出由两个片段对接而成,片段B磷脂片段合成较为容易,片段A的合成较为复杂,相对应的中间体也较多,是合成该反应控制收率和成本的关键中间体。国内为类新药,目前主流合成路线如下图,国内暂无相关报道专利。 2)合成路线图/反应方程式 路线一:
路线二: 3)工艺路线描述
路线一: 合成索非布韦的路线是有片段A和片段B对接而成,片段A的合成是由起始原料(R) -2, 2-二甲基-1 ,3-二氧戊环-4-甲醛(A-00),经过witting反应,高锰酸钾氧化双键,酯化,氧化,还原,氯代,亲核取代等多步反应得到片段A;片段B是由以 L-丙氨酸异丙酯盐酸盐为原料经磷酰化、酯化后再与片段B反应制得索非布韦。总步骤约11步。该路线和起始原料等的选择也是目前国内外研发的主流路线,不排除企业创新设计其他中间体情况,路线中的11步均有相关文献报道,故不存在风险问题,路线不通等情况,在实验当中将根据实验结果可能进行适当改变,从成本,质量,收率等角度进行适当完善适合自己公司的工艺路线资料。 路线二: 路线二与路线一差别不大,片段B的合成略有差别,使用的辅料不同,导致中间体不同,根据实际合成路线选择不同的片段B路线合成。 4)实验方案。(略) 四、相关中间体产品信息情况
项目名称 阿利吉仑片及原料
项目名称阿利吉仑片及原料 申报类别原料+片:化药3.1+6类 知识产权: 本品有化合物专利,至2015年4月过保护期.阿利吉仑于2007年通过FDA和欧盟的审批,是FDA近10年来首个批准治疗高血压的新化合物。2009年,日本也批准该药加入日本市场。化合物专利2015年到期,诺华陆续申请了约20个化合物合成路线专利保护,以及其他类型的专利。 国家专利号保护内容申请日 美国US 化合物专利(授权) 中国95105037.0 化合物专利(授权)1995.4.17 项目描述 【药理毒理】阿利克仑是第一个新型、高效、口服有效的人肾素非肽类抑制剂,具有与天然肾素的肽链结构类似的长链结构,肾素抑制活性好,ic50达到纳摩尔。良好的理化性质使其有较好的口服吸收性质,和一定的生物利用度。阿利克仑对人类的肾素具有很高的专一性,对体内其它的天冬氨酸酶耐受性良好,优于以往的肾素抑制剂例如瑞米吉仑、扎吉仑、依那吉仑等。阿利克仑在药物联用方面表现出较好的依从性。研究表明,阿利克仑与雷米普利(ramipril)联合应用可降低高血压和糖尿病患者的血压和血浆肾素活性。与arb 联合使用,对ras的抑制有协同作用,并可消除arb导致的angⅱ堆积的效应。 【适应症】肾素抑制剂,用于治疗高血压。 【用法用量】一天1片或2片,每天1次。 【规格】0.15g,0.3g 国外上市情况: 阿利克仑(aliskiren)是诺华公司开发的作用于肾素血管紧张素醛固酮系统(ras)的第二代肾素抑制剂。美国fda已于2007年5月份批准aliskiren上市。 阿利克仑于2007年通过fda和欧盟的审批,是fda近10年来首个批准治疗高血压的新化合物。2009年,日本也批准该药加入日本市场。化合物专利2015年到期,诺华陆续申请了约20个化合物路线专利保护。 市场前景 阿利克仑系一新分子实体,是美国fda批准的首个直接抑制引起血压升高肾脏酶肾素的高血压治疗药。阿利克仑为第二代肾素抑制剂阿利吉仑是新一代非肽类肾素阻滞药,能在第一环节阻断RAS系统,降低肾素活性,减少AngII和醛甾酮的生成,不影响缓激肽和前列腺素的代谢,起到降血压和治疗心血管疾病的作用。从目前研究来看阿利吉仑是强效的、高度选择性的、口服有效的、长效的新一代抗高血压药物。该药作用于肾素依赖性,因此加大剂量给药只会延长时间不会导致血压骤降,与ARB(氯沙坦、替米沙坦)相似,不良反应的发生率与安慰剂组相比无显著差异。 阿利克仑作为研究最为领先的一个口服肾素抑制剂,fda批准用于高血压治疗。不过,鉴于肾素-血管紧张素-醛固酮系统(raas)在心血管疾病发展中的重要性,阿利克仑今后肯定也会寻求其它用途。阿利克仑业临床数据证实它的降压作用优于安慰剂而与其它常用抗高血压药物、包括ace抑制剂和arb相当或更好。阿利克仑治疗能被很好耐受且无特异性副反应事件并罕致发生低血压。阿利克仑似不会影响血清肌酸酐水平,故此实是其优于包括ace抑制剂和arb在内的其它raas抑制剂的一大潜在益处。当然,阿利克仑目前尚还缺乏用于处在发展急性肾衰风险如具充血性心力衰竭或业已存在肾病患者的研究数据。阿利克仑对血清钾水平的影响类于ace抑制剂。阿利克仑和arb一样,它不会引致ace抑制剂那般的干咳。阿利克仑的显著药物相互作用潜力也低。总之,阿利克仑单用或合用其它抗高血压药物治疗轻至
达卡他韦片使用说明书
达卡他韦Daklinza(daclatasvir)片使用说明书2015年第一版 1 适应证和用途 DAKLINZA是适用为与索非布韦使用为有慢性丙型肝炎病毒(HCV)基因型3感染患者的治疗[见剂量和给药方法(2)和临床研究(14)]。 使用的限制: ●在HCV基因型3-感染有硬化患者接受DAKLINZA与索非布韦联用共12周,持续病毒学反应(SVR)率减低。[见临床研究(14)]. 2 剂量和给药方法 2.1 推荐剂量 DAKLINZA的推荐剂量是60 mg,口服,每天1次与索非布韦联用共12周。DAKLINZA 可有或无食物服用。 尚未确定对有硬化患者DAKLINZA和索非布韦的最佳时间[见临床研究(14)]。 对索非布韦特异性推荐剂量,参考相关处方资料。 2.2 由于药物相互作用剂量修饰 对与DAKLINZA共同给药前其他药物参考药物相互作用和禁忌证节。 细胞色素P450酶3A(CYP3A的强抑制剂:减低DAKLINZA剂量至30 mg每天1次当与强CYP3A抑制剂共同给药时用30 mg片[见药物相互作用(7)]。 中度CYP3A诱导剂:当共同给药与中度CYP3A诱导剂增加DAKLINZA的剂量至90 mg每天1次利用适当的片组合(三片30 mg片或一片60 mg和一片30 mg片) [见药物相互作用(7)]。 强CYP3A诱导剂:DAKLINZA是禁忌与强CYP3A诱导剂联用[见禁忌证(4)]。 建议对不良反应不减低DAKLINZA剂量。 2.3 治疗的终止 一例接受DAKLINZA与索非布韦患者如永久地终止索非布韦,然后DAKLINZA也应被终止。 3 剂型和规格 ● 片:60 mg daclatasvir(等于66 mg daclatasvir二盐酸盐),浅绿色,双凸,五边形,和一侧凹陷有“BMS”和另一侧“215”。 ● 片:30 mg daclatasvir(等于33 mg daclatasvir二盐酸盐),绿色,双凸,五边形,和一侧凹陷有“BMS”和另一侧“213”。 4 禁忌证 ● DAKLINZA是禁忌与强烈地诱导CYP3A药物联用和,从而,可能导致DAKLINZA 的较低暴露和丧失疗效。禁忌药物包括,但不限于在表1中列举[见药物相互作用(7)和临床药理学(12.3)]。
阿利克仑的简介及合成工艺
阿利克仑|173334-57-1|的简介及合成工艺 摘要:阿利克仑(Aliskiren)是一种作用于肾素血管紧张素醛固酮系统的肾素抑制剂。临床上,阿利克仑以半富马酸盐的形式使用,是美国FDA批准的首个直接抑制引起血压升高肾脏酶肾素的高血压治疗药。 关键词:阿利克仑,合成,肾素抑制剂,高血压治疗药,专利 阿利克仑的简介 阿利克仑的中文化学名称为:(AS,CS,DS,FS)-D-氨基-氮-(3-氨基-2,2-二甲基-3-氧丙基)-C-羟基-4-甲氧基-3-(3-甲氧丙氧基)-A,F-二(1-甲基乙基)苯辛酰胺;英文化学名称为:(AS,CS,DS,FS)-D-amino-N-(3-amino-2,2-dimethy-l 3-oxopropyl)-C-hydroxy-4-methoxy-3-(3-methoxypropoxy)-A,F-bis(1-methylethyl)benzeneoctan amide;分子式:C30H53N3O6;相对分子质量:551176;CAS登记号:173334-57-1。 阿利克仑是口服具有活性的肾素抑制剂,作用于RAS的初始环节,它阻断血管紧张素原裂解为血管紧张素?(Ang?),显著而持续地减低血浆肾素活性(PRA),降低Ang?和血管紧张素ò( Angò)水平。这是阻断肾素-血管紧张素系统的第一步,同时又是速度限制的一步[1]。与血管紧张素转化酶抑制剂(ACEI)相比,阿利克仑能更有效地减少Angò生成。临床试验证实,阿利克仑与血管紧张素ò受体拮抗剂(ARB)联合应用,对RAS的抑制有协同作用,并可消除ARB致血管紧张素ò堆积的效应。阿利克仑不产生反射性心动过速,不影响心功能。降压作用为肾素依赖型,因此大剂量给药只会延长作用时间,不会导致血压骤降。在代谢过程中不会被肠道、血液及肝脏中的酶降解,大部分以原形排出。阿利克仑不良反应的发生率与安慰剂相比无明显差异。具有不良作用少、半衰期长、安全有效、服用方便的特点[1-2]。文献[3]对其合成路线进行了报道:以(2R)-2,5-二氢-3,6-二甲氧基-2-(1-甲基乙基)-吡嗪和4-[(2R)-2-(溴甲基)-3-甲基丁基]-1-甲氧基-2-(3-甲氧丙氧基)-苯为初始原料,经取代、水解、酰化等一系列反应得到aliskiren。另外,文献[4]也报道了aliskiren的合成。 阿利克仑的合成 方案一:3-羟基-4-甲氧基苯甲醛(2) 经1-甲氧基-3-甲磺酰氧基丙烷醚化得3,还原得4[4];或用5经3-溴代丙基甲基醚醚化得4。4用三溴化磷溴代得6。6和7发生亲电取代得8。用双氧水和氢氧化锂水解生成羧酸,再还原得9。9在三苯膦和NBS作用下得10。10与3,6-二乙氧基-2-异丙基-2,5-二氢吡嗪缩合得11,稀盐酸开环得12。12经Boc保护氨基,再用DIBAL-H 还原成醛得13。13 经格氏反应得到的14接上丙酮叉保护基后,用柱色谱拆分得15。15经氢化还原得16,氧化得羧酸17。17与3-氨基-2,2-二甲基丙酰胺反应后再用稀盐酸脱保护,即得1。 方案二[5]:将(3S,5S,1’S,3’S)-5-(1’-叠氮基-3’-羟甲基-4’-甲基-戊基)-3-异丙基-二氢呋喃-2-酮和氧化剂按摩尔比为1∶(0.01~10)在第一有机溶剂中进行氧化反应,氧化反应温度为-80~50℃,反应时间为1~20小时,得到化合物(I);将化合物(I)、4-甲氧基-3-(3-甲氧基丙氧基)-溴苯和金属试剂按摩尔比为1∶(1~2)∶(1~3)在第二有机溶剂中进行反应,反应温度为-100~0℃,反应时间为1~12小时,得到化合物(II);在氢化催化剂作用下,将化合物(II)与氢气在第三有机溶剂中进行氢化反应,氢化反应温度为20~80℃,反应时间为1~48小时;氢化反应结束后,加入第四有机溶剂和氨基保护试剂进行氨基保护反应,氨基保护反应温度为-10~50℃,反应时间为2~12小时,得到化合物(III);所述的化合物(II)与氨基保护试剂的摩尔比为1∶(1~2);将化合物(III)、3-氨基-2,2-二甲基丙酰胺和氨解催化剂按摩尔比为1∶(1~10)∶(1~5)进行氨解反应,氨解反应温度为25~120℃,反应时间为5~24小时,得到化合物(IV);将化合物(IV)与酸性试剂以摩尔比为1∶(0.1~2)在脱保护溶剂中
索非布韦片Sovaldi(SofosbuvirTablets)丙肝新药说明书(中文版)
索非布韦片|Sovaldi(Sofosbuvir Tablets) 丙肝新药说明书(中文版) 患者可以通过杭州五舟医院管理有限公司前往美国、日本、英国最好肝脏医院问诊并且拿到药物回国治疗。 美国梅奥诊所、哈佛大学医学院附属麻省总医院,英国国王医院,日本麻布医院都可以前往就医并且进行丙肝新药治疗。 索非布韦的价格在美国售价是8.4万美元,在英国售价是5.7万美元,达卡他韦在日本售价是15万人民币。 杭州五舟医院管理有限司是目前国外服务体系最完善的海外就医全程服务 司。杭州五舟医院管理有限司致力于为国内患者提供国外权威医院推荐、国外权威专家预约、出国看病病情材料收集整理、病历材料的医学翻译、病历材料邮寄、国外医院邀请函及费用预估函的翻译、医疗签证的办理、机票住宿预订、出国前指导、国外看病期间的接机住宿及看病接送、国外就医全程医学翻译、在国外期间的生活翻译陪同及护工陪同安排、归国后的病情跟踪、国外药品邮寄、医院费用账单折扣申请等一站式服务。 简介:2014年1月17日,丙肝新药Sovaldi (sofosbuvir ,400mg片剂)获 欧盟批准,作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV成人感染 者的治疗。Sovaldi为每日一次的口服核苷类似物聚合酶抑制剂,此次… 关键字:索非布韦片sofosbuvir商品名sovaldi 丙型肝炎病毒感染突破性 治疗指定第一无需与干扰素共同 2014年1月17日,丙肝新药Sovaldi (sofosbuvir ,400mg片剂)获欧盟批准, 作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV成人感染者的治疗。S ovaldi 为每日一次的口服核苷类似物聚合酶抑制剂,此次批准,为该药在整个欧盟的上市铺平了道路。 此前,Sovaldi已于2013年11月获得了欧洲药品管理局(EMA人用医药产品委员会(CHMP建议批准的积极意见。CHM通过加速审批程序对Sovaldi上市许可申请(MAA
索非布韦最详细介绍
索非布韦基本说明: 索非布韦(英文名Sofosbuvir,商品名Sovaldi)是美国生物技术巨头吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。2015年3月27日在印度正式上市。还未在中国上市。是FDA批准的2013年最为重磅的药物。仅Sovaldi在2014年的销售额就突破100亿美元。 丙肝基础知识 丙型病毒性肝炎,简称为丙型肝炎、丙肝,是一种由丙型肝炎病毒(HCV)感染引起的病毒性肝炎,主要经输血、针刺、吸毒等传播,据世界卫生组织统计,全球HCV的感染率约为3%,估计约1.8亿人感染了HCV,每年新发丙型肝炎病例约3.5万例。丙型肝炎呈全球性流行,可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌(HCC)。未来20年内与HCV感染相关的死亡率(肝衰竭及肝细胞癌导致的死亡)将继续增加,对患者的健康和生命危害极大,已成为严重的社会和公共卫生问题。 索非布韦简介 索非布韦是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林用药24周的SVR为84%。 索非布韦用法用量 药物用法:口服,一天一片。治疗周期:12周-24周。治疗效果:最高可达96%。 如何判断丙肝治愈 丙肝是可以治愈的,以使用索非布韦治疗丙肝来讲,因为丙肝的复制速度达到12次房,所以在疗程结束停药三个月去医院检查丙肝病毒滴度,如果依然检测不到病毒,则说明丙肝彻底治愈了。这是一个通用的判断标准,因为停药后三个月不复发,往后复发的概率几乎为0。 索非布韦药物联用禁忌 索非布韦等丙肝新药对于一些药物联用有禁忌,用索非布韦等丙肝新药的朋友们需要特别注意,下图是常见的药物联用禁忌:
雷迪帕韦的合成及其主要中间体的研究进展
雷迪帕韦的合成及其主要中间体的研究进展 摘要: 雷迪帕韦(Ledipasvir),前身为GS-5885,是由吉利德科学公司开发的一种NS5A蛋白酶抑制剂[1]。雷迪替韦完成III期临床试验后,用于治疗基因型1丙型肝炎的雷迪帕韦/索非布韦的固定剂量组合的片剂,于2014年2月10日被美国药典收录。2014年10月10日组合产品雷迪替韦/索非布韦获得美国FDA批准,商品名Harvoni[2]。雷迪帕韦通过对NS5A 蛋白的抑制作用,从而阻断了病毒RNA的复制[3]。雷迪替韦拥有六个手性中心,其中处于桥杂环化合物1,3,4位与螺杂环6位上,这将是其合成工作中的重点?本文通过参考大量文献综述了雷迪替韦的合成研究进展及其最新的合成路线,并对其关键步骤——主要的中间体做出了深入的研究? 关键词:雷迪帕韦(Ledipasvir),NS5A抑制剂,丙肝,手性,中间体,制备。 1.简介: 丙型病毒性肝炎,简称为丙肝,是一种由丙型肝炎病毒(HCV)感染引起的病毒性肝炎,主要经输血、针刺、吸毒等传播。丙肝的的潜伏期往往是1.5-2个月,经过一段的潜伏期之后,便出现肝炎的常见症状有疲乏、身体无力、食欲减退、部分出现黄疸等症状。丙肝患者右下腹部感觉不舒服,恶心呕吐,食欲减退。丙型肝炎发病机理仍未十分清楚,当HCV在肝细胞内复制引起肝细胞结构和功能改变或干扰肝细胞蛋白合成,可造成肝细胞变性坏死,表明HCV直接损害肝脏,导致发病起一定作用。但多数学者认为细胞免疫病理反应可能起重要作用,发现丙型肝炎与乙型肝炎一样,其组织浸润细胞以CD3+为主,细胞毒T细胞(TC)特异攻击HCV感染的靶细胞,可引起肝细胞损伤。[4] 雷迪帕韦(Ledipasvir),化学名称:GS-5885,英文化学名: Methyl N-[(2S)-1-[(6S)-6-[5-[9,9-Difluoro-7-[2-[(1S,2S,4R)-3-[(2S)-2-(methoxyc arbonylamino)-3-methylbutanoyl]-3-azabicyclo[2.2.1]heptan-2-yl]-3H-benzimidazol -5-yl]fluoren-2-yl]-1H-imidazol-2-yl]-5-azaspiro[2.4]heptan-5-yl]-3-methyl-1-ox obutan-2-yl]carbamate,CAS NO.:1256388-51-8,分子式C49H54F2N8O6,分子量为:889.00,其商品名为:Harvoni (与索非布韦组合)。化学结构为图1.1所示:
索非布韦
吉利德丙型肝炎药物索非布韦 商品名:Sovaldi 药物名称:Sofosbuvir 化学名: (S)-Isopropyl 2-((S)-(((2R,3R,4R,5R)- 5-(2,4-dioxo 3,4-dihydropyrimidin-1(2H)-yl)- 4-fluoro-3-hydroxy-4-methyltetrahydrofuran- 2 yl)methoxy)- (phenoxy)phosphorylamino)propanoate N-[[P(S),2'R]-2'-脱氧-2'-氟-2'-甲基-P-苯基-5'-尿苷酰基]-L-丙氨酸异丙酯;索氟布韦;索非布韦;索氟布韦(索非布韦);索菲布韦;索非布韦:N-[[P(S),2'R]-2'-脱氧-2'-氟-2'-甲基-P-苯基-5'-尿苷酰基]-L-丙氨酸异丙酯 背景:索非布韦(又译为索氟布韦,英文名Sofosbuvir,商品名Sovaldi)是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。还未在中国上市。 简介:该药物是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为 61%-63%。 化学性质: 分子式:C22H29FN3O9P 分子量:529.4525242 密度1.33 熔点133 oC 药理作用:索非布韦是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂,能在细胞内代谢形成药物活性三磷酸尿苷形式(gs-461203),可以被嵌入由NS5B丙肝病毒RNA 聚合酶而中断RNA复制。 治疗疾病:适用于作为联合抗病毒治疗方案中的组合成分治疗慢性丙肝(CHC)感染。经试验证实可有效治疗基因1、2、3或4型丙肝受试者,包括符合米兰标准正在等待肝移植的肝细胞癌受试者以及HCV/HIV-1合并感染受试者。
索菲布韦详细说明书2013中文版
SOVALDITM (sofosbuvir)片,为口服使用 美国初次批准:2013 适应证和用途 SOVALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂适用为慢性丙型肝炎(CHC)感染的治疗作为组合抗病毒治疗方案的一个组分。(1) (1)SOVALDI疗效已在有HCV基因型1,2,3或4感染受试者中被确定,包括有肝细胞癌符合米兰[Milan]标准(等待肝移植)和有 HCV/HIV-1共-感染受试者。(1) 剂量和给药方法 (1)一片400 mg片每天1次有或无食物服用。(2.1) (2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC的治疗。建议联合治疗:(2.1) (3)SOVALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC患者。(2.1) (4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC的治疗,以先发生为准。(2.1) (5)对有严重肾受损或肾病终末期患者不能建议剂量。(2.4,8.6)
剂型和规格 片:400 mg。(3) 禁忌证 (1)当与聚乙二醇干扰素α/利巴韦林或单独利巴韦林联用时,对聚乙二醇干扰素α和/或利巴韦林的所有禁忌证也都应用于SOVALDI 联合治疗。(4) (2)因为利巴韦林可能引起出生缺陷和胎儿死亡,在妊娠妇女和男性其女性伴侣妊娠时禁忌SOVALDI与聚乙二醇干扰素α/利巴韦林或利巴韦林联用。(4) 警告和注意事项 妊娠:利巴韦林可能致出生缺陷和胎儿死亡和动物研究已证明干扰素有流产效应;女性患者和男性患者的女性伴侣避免妊娠。治疗开始前患者必须有一个阴性妊娠测试,使用至少2种有效非激素避孕方法和每月妊娠测试。(5.1) 不良反应 SOVALDI与利巴韦林联用观察到最常见不良事件(发生率大于或等于20%,所有级别)是疲乏和头痛。SOVALDI与聚乙二醇干扰素α和利巴韦林联用观察到最常见不良事件是疲乏,头痛,恶心,失眠和贫血。 (6.1) 为报告怀疑不良反应,联系Gilead Sciences,Inc.电话 1-800-GILEAD-5或FDA电话1-800-FDA-1088或 https://www.360docs.net/doc/6411985010.html,/medwatch.
索非布韦原料及片剂简介
索非布韦原料及片剂简介 【基本信息】 通用名:索非布韦 英文名:Sofosbuvir 别名:索氟布韦 代号:GS-7977、PSI-7977 化学名: (S)-Isopropyl 2-((S)-(((2R,3R,4R,5R)-5-(2,4-dioxo 3,4-dihydropyrimidin-1(2H)-yl)-4-fluoro-3-hydroxy-4-methyltetrahydrofuran-2 yl)methoxy)-(phenoxy)phosphorylamino)propanoate 化学结构式: 分子式:C22H29FN3O9P 分子量:529.45 CAS号:1190307-88-0 【注册分类】化药3+3类 【剂型】原料+片剂 【规格】片剂:400mg, 【英文名称】Sofosbuvir 【有效成分】本品主要有效成分为索非布韦。 【药理药效】 Sofobuvir在细胞内代谢形成药物活性三磷酸尿苷形式(gs-461203),可以被嵌入由NS5B 丙肝病毒RNA聚合酶而中断RNA复制。 【适应症】 SOV ALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂,与其他药物联
合使用用于治疗慢性丙型肝炎(CHC)感染。 与利巴韦林联合治疗基因2/3型慢性丙型肝炎(HCV)或者与利巴韦林、α-干扰素联用治疗基因1/4型的慢性丙型肝炎。 【用法用量】 (1)一片400 mg片每天1次有或无食物服用。 (2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC的治疗。建议联合治疗: (3)SOV ALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC 患者。 (4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC 的治疗,以先发生为准。 (5)对有严重肾受损或肾病终末期患者不能建议剂量。 【国内外上市信息】 2013年12月6日,吉利德(Gilead)的抗丙肝新药Sovaldi(sofosbuvir,400mg片剂)获FDA批准,作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV)的治疗。Sovaldi是首个获批可用于C型肝炎全口服治疗方案的药物。具体而言,FDA已批准sofosbuvir联合利巴韦林(ribavirin)用于基因型2和基因型3慢性丙型肝炎(hepatitis C)成人患者的治疗。同时,FDA还批准sofosbuvir联合聚乙二醇干扰素(PEG-IFN)和利巴韦林,用于基因型1和基因型4慢性丙型肝炎初治(treat-naive)成人患者的治疗。2013年12月13日获得加拿大批准,2014年1月17日获EMA批准。 【知识产权情况】 本品有多个化合物专利(2004.4,2005.7,2007.10,2008.3,2008.11,2009.6申请),并且这些专利存在较大的争议。第200880018024.2号专利即为sofosbuvir在中国申请的化合物专利(申请的专利长达1007页),目前尚处于实质审查阶段,如果获得授权,将于2028年2月25日失效。 【立项优势】 索非布韦(sofosbuvir)是Gilead Sciences 研发的核苷类NS5B 聚合酶抑制剂,分别于2013年12月和2014年1月获FDA和欧盟批准,被FDA 批准用于HCV 感染及HCV/HIV-1 共同感染。具有突破性的疗效:Sovaldi对GT1a、GT1b、GT2、GT3、GT4型HCV感染都有效,SVR12应答率分别为92%、82%、93-95%、56-61%、96%,FDA 已批准sofosbuvir联合利巴韦林(ribavirin)用于基因型2和基因型3慢性丙型肝炎
丙肝新药印度索非布韦印度Sovaldi
印度丙肝新药印度索非布韦印度Sovaldi 印度塔塔药房与美国吉列德公司授权在印度生产丙肝新药索菲布韦(Hepcinat)的NATCO 公司再次携手为国内丙肝患者带来福音。索菲布韦,英文名Sofosbuvir是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市。该药物是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为 61%-63%。值得一提的是,索非布韦的临床试验还包含了一些丙肝合并肝硬化的患者,疗效也较显著。 印度索菲布韦,英文名Sofosbuvir,是一种专门针对丙肝的特校药。该药由吉利德公司开发研制,并于2013年12月6日经美国食品药品监督管理局(FDA)批准正式在美国上市。这次上市,震惊了医学界和所有丙肝患者。据相关科研机构的临床试验发现,索菲布韦针对任何类型的丙肝患者都有着非常好的效果:针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR 为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为61%-63%。甚至是对于丙肝合并肝硬化的患者,索菲布韦效果仍旧让人震惊。如此显著的效果,带来的是全球对于印度索菲布韦的抢购。尤其是印度NATCO公司得到索菲布韦的生产授权之后,相对低的价格更是引得各国患者纷纷前往印度购买。 2014年底,北京患者吴先生在一次常规性的体检中查到转氨酶超标,进一步的检查发现自己得了丙肝。丙肝通常由血液母婴注射器等传播,并不通过唾液等传播。吴先生猜测是年轻时输血导致。丙肝对平时生活并无影响,也无任何外在的症状,但长期看,丙肝有损肝健康,会导致肝硬化,甚至可能转肝癌。吴先生也听说国内目前有很多印度索非布韦代购、印度Sovaldi代购等,但是渠道多且杂,吴先生最后决定亲自前往印度最好的医院阿波罗医院亲自购买索非布韦Sovaldi。 吴先生以前对丙肝丝毫不了解,他开始询问医生并查询各种资料,希望能解除身体潜在的健康隐患。吴先生咨询了出国就医一站式服务公司杭州五舟医院管理有限公司蒋医生,五舟蒋医生告知吴先生美国早于2014年研制出了丙肝特校药Harvoni和索非布韦,此药对丙肝有95%的治愈率。大多数基因1型丙肝患者患者只要吃完两个月疗程8周每天一片Harvoni,或者每日服用一片索非布韦加上一片达卡他韦连续服用12周丙肝就能完全根治。其他有肝硬
