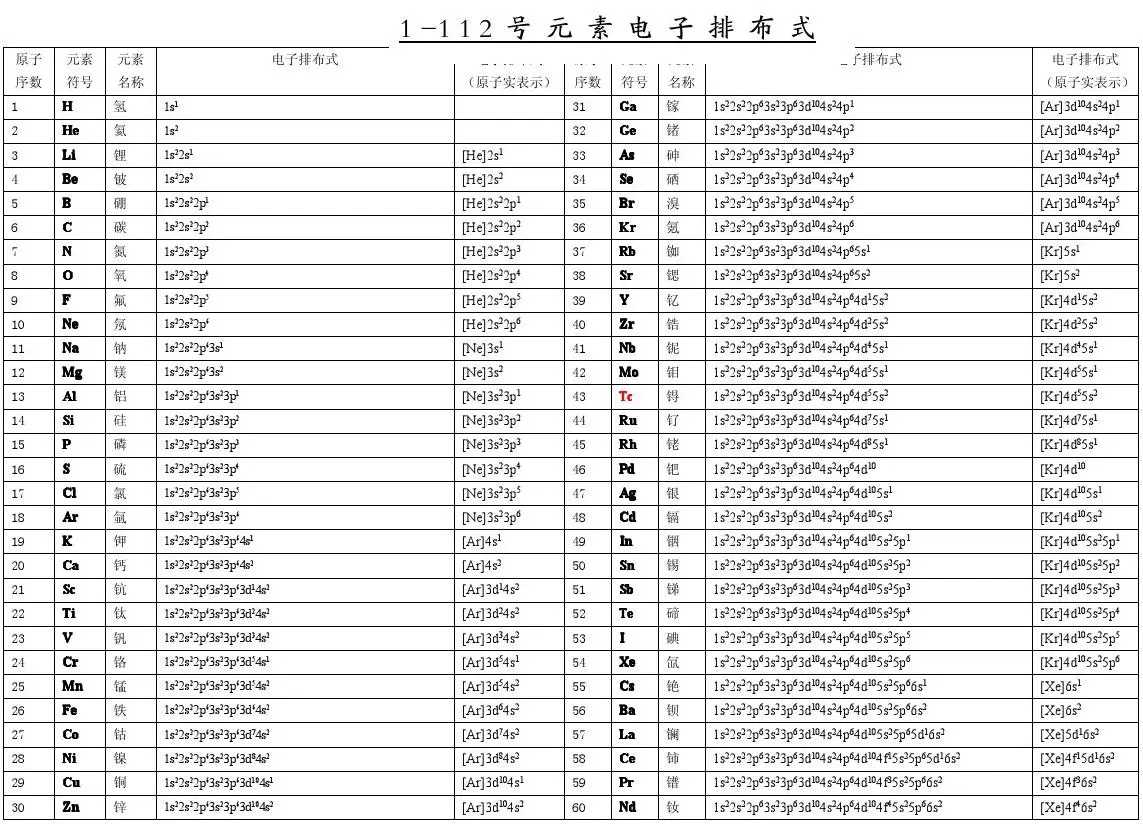
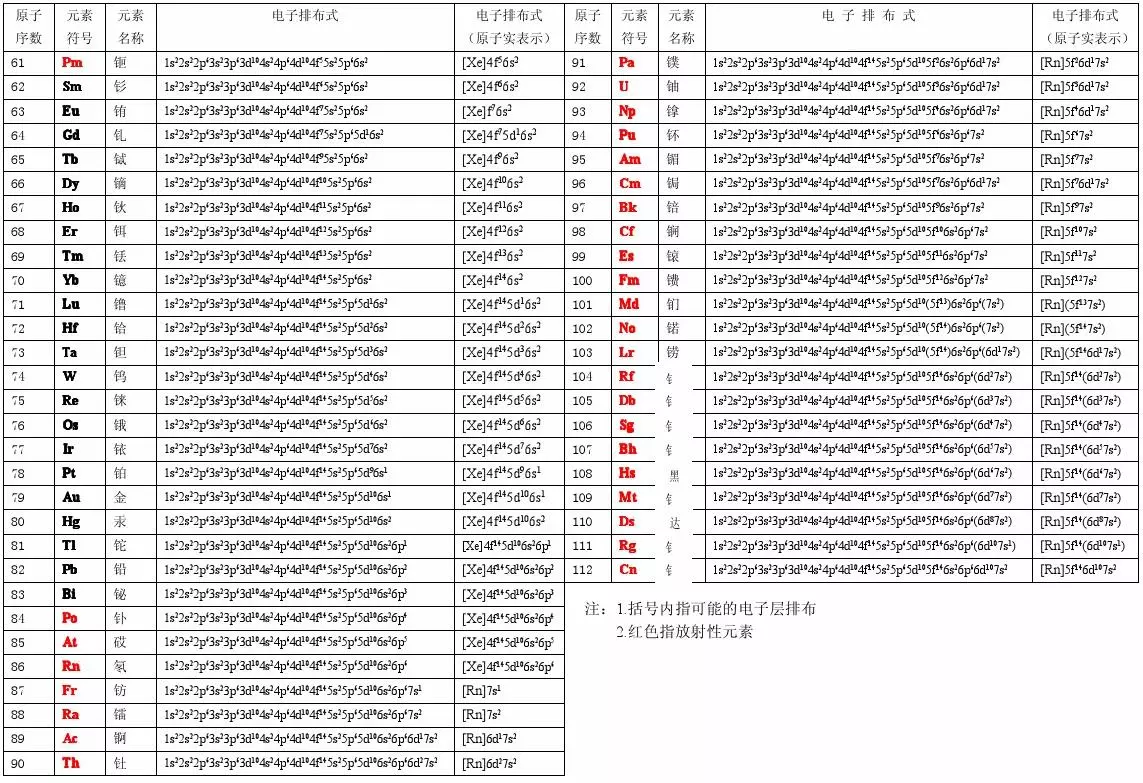
1-112号元素电子排布式
核外电子排布规律和表示方法及其强化练习
核外电子排布规律和表示方法 一、能层、能级与轨道 总规律:元素的原子核外电子按照能量由低到高的顺序依次排布在不同的能级中。 1、核外电子的能量主要取决于电子层和电子亚层。电子层又叫能层,它决定电子的能量高低和离核远近;同一电子层还可以分成一个或几个电子亚层,电子亚层决定同一电子层的电子的能量差异和电子云的形状。s 亚层呈球形,p 亚层呈哑铃形,d 亚层成四瓣花瓣形,f 亚层形状更复杂。能级就由能层和电子亚层共同构造。 2、能层用n 表示,按能量由低到高的顺序依次表示为1、2、 3、 4、 5、 6、7,依次对应K 、L 、M 、N 、O 、P 、Q 层。 电子亚层 s 、p 、d 、f 表示。各电子层最多容纳的电子亚层是n 种。K 层只有s 一种亚层,L 层有s 、p 2种亚层,M 层有s 、p 、d 3种亚层,N 层有s 、p 、d 、f 4种亚层,O 层有 5种亚层,P 层有6种亚层,Q 层有7种亚层。 能层用电子层和电子亚层共同表示,在电子亚层符号的前面加上能层序号就是能级符号。 例如:1s 、2s 、2p 、3s 、3p 、3d 、4s 、4p 、4d 、4f 、5s 、5p 、5d 、5f 、6s 、6p 、6d 、6f 、7s 、7p 、7d 、7f 、 3、同一电子亚层形状相同但伸展方向不同,可以构成不同轨道。s 有1个轨道,p 有3个轨道,d 有5个轨道,f 有7个轨道,可用方框来表示。 s 轨道 p 轨道 f 轨道 4、能量关系:①相同能层的原子轨道能量高低:ns < np < nd < nf ; ②形状相同的原子轨道能量高低:1s < 2s< 3s< 4s ; 同一电子亚层形状相同但伸展方向不同的原子轨道能量相同。2p x =2p y =2p z 51、能量最低原理:原子的核外电子排布遵循构造原理,使整个原子的能量处于最低状态。 也即:原子的核外电子排布总是尽先排布在能量最低的轨道中,然后按能量由低到高的顺序依次排入。 构造原理:即能级顺序:1s 、2s 、2p 、3s 、3p 、4s 、3d 、4p 、5s 、4d 、5p 、6s 、4f 、5d 、6p 、7s 、5f 、6d 、7p 。记忆方法:1,22,33,434,545,6456,7567。 2、泡利原理:一个原子轨道里最多容纳2个电子,而且它们的自旋状态相反。 3、洪特规则:电子排布在同一能级的不同轨道时,基态原子的电子总是优先单独占据一个轨道,而且自旋状态相同。 当能量相同的原子轨道在全满(p 6、d 10、f 14)、半满(p 3、d 5、f 7)、全空(p 0、d 0、f 0)状态时,体系能量最低。这个可以看成洪特规则的特列。 这三个排布规律解释了各电子层最多容纳的电子数为2n 2个,解释了最外层电子数不超
1~36号元素电子排布图(精排版)
. 1~36号元素电子排布式依次如下: 1、氢H 1s1 2、氦He 1s2 3、锂Li 1s2 2s1 4、铍Be 1s22s2 5、硼 B 1s2 2s2 2p1 6、碳 C 1s22s22p2 7、氮N 1s22s22p3 8、氧O 1s22s22p4 9、氟 F 1s22s22p5 10、氖Ne 1s22s22p6 11、钠Na 1s22s22p63s1 12、镁Mg 1s22s22p63s2 13、铝Al 1s22s22p63s23p1
14、硅Si 1s22s22p63s23p2 15、磷P 1s22s22p63s23p3 16、硫S 1s22s22p63s23p4 17、氯Cl 1s22s22p63s23p5 18、氩Ar 1s22s22p63s23p6 19 钾K 1s22s22p63s23p64s1 20、钙Ca 1s22s22p63s23p64s2 21、钪Sc 1s22s22p63s23p63d14s2 22、钛Ti 1s22s22p63s23p63d24s2 23、钒V 1s22s22p63s23p63d34s2 24、铬Cr 1s22s22p63s23p63d54s1 25、锰Mn 1s22s22p63s23p63d54s2
26、铁Fe 1s22s22p63s23p63d64s2 27、钴Co 1s22s22p63s23p63d74s2 28、镍Ni 1s22s22p63s23p63d84s2 29、铜Cu 1s22s22p63s23p63d104s1 30、锌Zn 1s22s22p63s23p63d104s2 31、镓Ga 1s22s22p63s23p63d104s24p1 32、锗Ge 1s22s22p63s23p63d104s24p2 33、砷As 1s22s22p63s23p63d104s24p3 34、硒Se 1s22s22p63s23p63d104s24p4 35、溴Br 1s22s22p63s23p63d104s24p5 36、氪Kr 1s22s22p63s23p63d104s24p6 小结:相关规律 1、基态原子最外层为1个电子的是
电子式及号元素的电子排布图
化学金排机器码:H194-6181-8919注册码:9173-5111-9903 1~36号元素电子排布式依次如下: H:1s1 He:1s2 Li:1s22s1 Be:1s22s2 B:1s22s22p1 C:1s22s22p2 N:1s22s22p3 O:1s22s22p4 F:1s22s22p5 Ne:1s22s22p6 Na:1s22s22p63s1 Mg:1s22s22p63s2 Al:1s22s22p63s23p1 Si:1s22s22p63s23p2 P:1s22s22p63s23p3 S:1s22s22p63s23p4 Cl:1s22s22p63s23p5 Ar:1s22s22p63s23p6 K:1s22s22p63s23p64s1 Ca:1s22s22p63s23p64s2
Sc:1s22s22p63s23p63d14s2 Ti:1s22s22p63s23p63d24s2 V:1s22s22p63s23p63d34s2 Cr:1s22s22p63s23p63d54s1 Mn:1s22s22p63s23p63d54s2 Fe:1s22s22p63s23p63d64s2 Co:1s22s22p63s23p63d74s2 Ni:1s22s22p63s23p63d84s2 Cu:1s22s22p63s23p63d104s1 Zn:1s22s22p63s23p63d104s2 Ga:1s22s22p63s23p63d104s24p1 Ge:1s22s22p63s23p63d104s24p2 As:1s22s22p63s23p63d104s24p3 Se:1s22s22p63s23p63d104s24p4 Br:1s22s22p63s23p63d104s24p5 Kr:1s22s22p63s23p63d104s24p6
1-36号化学元素电子排布图
1--36号元素电子排布式氢H :1s1 1 氦He:1s2 2 锂Li :1s22s1 2 1 铍Be:1s22s2 2 2 硼B :1s22s22p1 2 3 碳C :1s22s22p2 2 4 氮N :1s22s22p3 2 5 氧O :1s22s22p4 2 6 氟F :1s22s22p5 2 7 氖Ne:1s22s22p6 2 8 钠Na:1s22s22p63s1 2 8 1 镁Mg:1s22s22p63s2 2 8 2 铝Al :1s22s22p63s23p1 2 8 3 硅Si :1s22s22p63s23p2 2 8 4 磷P :1s22s22p63s23p3 2 8 5 硫S :1s22s22p63s23p4 2 8 6 氯Cl:1s22s22p63s23p5 2 8 7 氩Ar:1s22s22p63s23p6 2 8 8 钾K :1s22s22p63s23p64s1 2 8 8 1钙Ca:1s22s22p63s23p64s2 2 8 8 2
钪Se:1s22s22p63s23p63d14s2 2 8 9 2 钛Ti :1s22s22p63s23p63d24s2 2 8 10 2 矾V :1s22s22p63s23p63d34s2 2 8 11 2铬Cr:1s22s22p63s23p63d54s1 2 8 13 1锰Mn:1s22s22p63s23p63d54s2 2 8 13 2铁Fe:1s22s22p63s23p63d64s2 2 8 14 2钴Co:1s22s22p63s23p63d74s2 2 8 15 2 镍Ni:1s22s22p63s23p63d84s2 2 8 16 2铜Cu:1s22s22p63s23p63d104s1 2 8 18 1锌Zn:1s22s22p63s23p63d104s2 2 8 18 2 镓Ga:1s22s22p63s23p63d104s24p1 2 8 18 3锗Ge:1s22s22p63s23p63d104s24p2 2 8 18 4 砷As:1s22s22p63s23p63d104s24p3 2 8 18 5硒Se:1s22s22p63s23p63d104s24p4 2 8 18 6溴Br:1s22s22p63s23p63d104s24p5 2 8 18 7氪Kr:1s22s22p63s23p63d104s24p6 2 8 18 8
电子式及元素的电子排布图
化学金排机器码:H 注册码:9 1~36号元素电子排布式依次如下: H:1s1 He:1s2 Li:1s22s1 Be:1s22s2 B:1s22s22p1 C:1s22s22p2 N:1s22s22p3 O:1s22s22p4 F:1s22s22p5 Ne:1s22s22p6 Na:1s22s22p63s1 Mg:1s22s22p63s2 Al:1s22s22p63s23p1 Si:1s22s22p63s23p2 P:1s22s22p63s23p3 S:1s22s22p63s23p4 Cl:1s22s22p63s23p5 Ar:1s22s22p63s23p6 K:1s22s22p63s23p64s1
Ca:1s22s22p63s23p64s2 Sc:1s22s22p63s23p63d14s2 Ti:1s22s22p63s23p63d24s2 V:1s22s22p63s23p63d34s2 Cr:1s22s22p63s23p63d54s1 Mn:1s22s22p63s23p63d54s2 Fe:1s22s22p63s23p63d64s2 Co:1s22s22p63s23p63d74s2 Ni:1s22s22p63s23p63d84s2 Cu:1s22s22p63s23p63d104s1 Zn:1s22s22p63s23p63d104s2 Ga:1s22s22p63s23p63d104s24p1 Ge:1s22s22p63s23p63d104s24p2 As:1s22s22p63s23p63d104s24p3 Se:1s22s22p63s23p63d104s24p4 Br:1s22s22p63s23p63d104s24p5 Kr:1s22s22p63s23p63d104s24p6
第2讲 原子核外电子排布的规律练习题
第二讲原子核外电子的排布规律练习题 一、核外电子的排布规律 在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核近的区域运动,能量高的电子通常在离核远的区域运动。我们常用电子层来表明。离核最近的叫第一层,离核稍远的叫第二层,依次类推,由近及远叫三、四、五、六、七层,也可依次把它们叫做K、L、M、N、O、P、Q层。核外电子的分层运动,又叫核外电子的分层排布。如图。科学研究证明,电子一般总是尽先排布在能量最低的电子层里,即最先排布K层,当K层排满后,再排布L层,依次类推。 1-20号元素原子的电子层排布 核电 荷数 元素 名称 元素 符号 各电子层的电子数核电 荷数 元素 名称 元素 符号 各电子层的电子数 K L M N K L M N 1 2 3 4 5 6 7 8 9 10 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖 H He Li Be B C N O F Ne 1 2 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 11 12 13 14 15 16 17 18 19 20 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 Na Mg Al Si P S Cl Ar K Ca 2 8 1 2 8 2 2 8 3 2 8 4 2 8 5 2 8 6 2 8 7 2 8 8 2 8 8 1 2 8 8 2 核外电子排布的一般规律是:①各电子层最多容纳的电子数目是2n2;②最外层电子数目不超过8个(K层为最外层时不超过2个),次外层电子数目不超过18个,倒数第三层电子数目不超过32个;③核外电子总是尽先排布在能量最低的电子层里,然后再由里往外依次排布在能量逐步升高的电子层里。1-18号元素的原子结构示意图。
1~36号元素基态原子的核外电子排布
1~36号元素基态原子的核外电子排布 广东郑春平 基态原子是处于能量最低状态下的原子,基态原子的核外电子排布,决定了元素周期表的划分和原子半径的变化规律。要认识基态原子的核外电子排布,必需要掌握排布原则和电子在原子轨道上的排布顺序。. 一、基态原子的核外电子排布三大原则 1、能量最低原则:核外电子的排布要使整个原子的能量最低,以形成稳定结构。 2、泡利不相容原理:一个原子轨道中最多只能容纳两个电子,并且这两个电子的 自旋方向必须相反。 3、洪特规则:对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占 不同的轨道并且自旋方向相同。 洪特规则实际上是为了更好的遵循能量最低原则,根据光谱实验结果,洪特进一 步指出,能量相同的原子轨道在全充满(p6和d10)、半充满(p3和d5)和全空(p0和 d0)状态时,体系能量最低,原子最稳定。 二、电子在原子轨道上的排布顺序 多电子原子中,电子填充电子轨道时,一般先填满能量低的轨道,再填能量高的轨道原子轨道能量的高低存在以下规律: 1、相同电子层上原子轨道能量的高低:ns 洪特规则 德国人洪特(F.Hund)根据大量光谱实验数据总结出一个规律,即分子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道,因为这种排布方式原子的总能量最低。所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。例如碳原子核外有6个电子,按能量最低原理和泡利不相容原理,首先有2个电子排布到第一层的1s轨道中,另外2个电子填入第二层的2s轨道中,剩余2个电子排布在2个p 轨道上,具有相同的自旋方向,而不是两个电子集中在一个p轨道,自旋方向相反。1适用范围 该定则只适用于LS 耦合的情况。有少数例外是由于组态相互作用或偏离LS 耦合引起的。该定则可用量子力学理论和泡利不相容原理来解释。该定则对确定自由原子或离子的基态十分有用。 2洪特规则前提 洪特规则前提:对于基态原子来说 在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低。所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。例如碳原子核外有6个电子,按能量最低原理和泡利不相容原理,首先有2个电子排布到第一层的1s轨道中,另外2个电子填入第二层的2s轨道中,剩余2个电子排布在2个不同的2p轨道上,具有相同的自旋方向,而不是两个电子集中在一个p 轨道,自旋方向相反。作为洪特规则的补充,能量相等的轨道全充满、半满或全空的状态比较稳定。 根据以上原则,电子在原子轨道中填充排布的顺序为1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…。3详细信息 具体内容:对于特定电子排布,不同组态的LS耦合,洪特规则确定了能量排列顺序:(1)总自旋S越大,能量越低 (2)S相等情况下,总轨道角动量L越大,能量越低 电子式及元素的电子排 布图 集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN] 化学金排机器码:H 注册码:9 1~36号元素电子排布式依次如下: H:1s1 He:1s2 Li:1s22s1 Be:1s22s2 B:1s22s22p1 C:1s22s22p2 N:1s22s22p3 O:1s22s22p4 F:1s22s22p5 Ne:1s 22s22p6 Na:1s22s22p63s1 Mg:1s22s22p 63s2 Al:1s22s22p63s23p 1 Si:1s22s22p63s23p2 P:1s22s22p63s23p 3 S:1s22s22p63s23p 4 Cl:1s22s22p63s23p 5 Ar:1s22s22p63s23p6 K:1s22s22p63s23p64s1 Ca:1s22s22p63s23p64s2 Sc:1s22s22p63s23p63d14s2 Ti:1s22s22p63s23p63d24s2 V:1s22s22p63s23p63d34s2 Cr:1s22s22p63s23p63d54s1 Mn:1s22s22p63s23p63d54s 2 Fe:1s22s22p63s23p63d64s 2 Co:1s22s22p63s23p63d74s2 Ni:1s22s22p63s23p63d84s2 Cu:1s22s22p63s23p63d104s1 Zn:1s22s22p63s23p63d104s2 Ga:1s22s22p63s23p63d104s24p1 Ge:1s22s22p63s23p63d104s24p2 As:1s22s22p63s23p63d104s24p3 Se:1s22s22p63s23p63d104s24p4 Br:1s22s22p63s23p63d104s24p5 Kr:1s22s22p63s23p63d104s24p6 +321 +11+22+422+5 2 3 +6 1--36号元素电子排布式氢:1s1 氦:1s2 锂:1s22s1 铍:1s22s2 硼:1s22s22p1 碳:1s22s22p2 氮:1s22s22p3 氧:1s22s22p4 氟:1s22s22p5 氖:1s22s22p6 钠:1s22s22p63s1 镁:1s22s22p63s2 铝:1s22s22p63s23p1 硅:1s22s22p63s23p2 磷:1s22s22p63s23p3 硫:1s22s22p63s23p4 氯:1s22s22p63s23p5 氩:1s22s22p63s23p6 钾:1s22s22p63s23p64s1 钙:1s22s22p63s23p64s2 钪:1s22s22p63s23p63d14s2钛:1s22s22p63s23p63d24s2矾:1s22s22p63s23p63d34s2铬:1s22s22p63s23p63d54s1锰:1s22s22p63s23p63d54s2铁:1s22s22p63s23p63d64s2 钴:1s22s22p63s23p63d74s2镍:1s22s22p63s23p63d84s2铜:1s22s22p63s23p63d104s1锌:1s22s22p63s23p63d104s2镓:1s22s22p63s23p63d104s24p1锗:1s22s22p63s23p63d104s24p2 砷:1s22s22p63s23p63d104s24p3 硒:1s22s22p63s23p63d104s24p4溴:1s22s22p63s23p63d104s24p5氪:1s22s22p63s23p63d104s24p6 原子的核外电子排布 1.原子结构行星模型告诉我们,核外电子在原子核外的外周运动,那么原子的核外电子是怎样排布在原子核外的呢?下图是1~20号元素核外电子的排布图,仔细观察图像,回答下列问题:注:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出。 (1)第一层最多排_______个电子,第二层最多排________个电子,第三层最多排______个电子。规律:第n层最多容纳的电子数为______________(用含n的代数式表示)。 (2)最外层最多排_______个电子。 (3)第二层电子的能量比第一层电子的能量_________(填“大”或“小”,提示:从原子核对电子的作用思考)。 2.电子层的表示方法及能量变化: 3.核外电子的排布规律: (1)能量最低原则:核外电子总是先排布在能量______的电子层里,然后再按照由______向______的顺序依次排布在能量逐渐升高的电子层里。 (2)电子分层排布的原则: ①第n层最多容纳的电子数为______。 ②最外层不超过________个(K层为最外层时,不超过_____个)。 4.原子结构示意图:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出,如: 5.阴阳离子的形成: (1)当原子_________(填“得到”或“失去”)电子时便形成阴离子,如N3-、O2-、F-。 (2)当原子_________(填“得到”或“失去”)电子时便形成阳离子,如Na+、Mg2+、Al3+。 规律: a.当原子的最外层电子数大于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。 b.当原子的最外层电子数小于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。 6.“8e”稳定结构:___________________________________________。 由“8e”稳定结构可知,N元素常见的化合价是________,S元素常见的化合价是__________。规律:元素的最高正化合价=__________________,元素的最低负化合价=_________________。 7.原子的电子式:元素的化学性质主要由_________________决定,我们常用小黑点或×来表示 元素原子的最外层上的电子。分别写出下列粒子的电子式: Na_______、Na+__________、Cl_________、Cl-________、NH4+_________、OH-_________。 8.微粒半径大小的比较: (1)电子层数越多,微粒半径越______,如r(O)______ r(Na)。 (2)电子层数相同,核电荷数越大,微粒半径越_________,如r(Mg)______ r(Al)。 (3)电子层数相同,核电荷数也相同,电子数越多,微粒半径约___________,如r(Cl)______ r(Cl—)。规律:不同的原子结构对应不同的性质(如化合价、半径大小等),这就是“结构决定性质”。9.核外有十电子的微粒有:__________________________________________________________。 10.核外有十八电子的微粒有:________________________________________________________。 例1.(核外电子的排布规律) 1.1.下列叙述中,正确的是(A) A.在多电子的原子里,能量高的电子通常在离核较远的区域内运动 B.核外电子总是先排在能量低的电子层上,如M层只有排满18个电子后才能排N层 C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 D.微粒的最外层只能是8个电子才稳定 1.2.A元素原子L层比B元素L层少2电子,B元素的核外电子总数比A元素的核外电子总数多5个,则A、B 可形成(D) A.AB B.A2B C.A2B3 D.B2A3 例2.(原子或离子结构示意图、电子式的书写) 2.写出下列原子或离子的结构示意图和电子式: (1)碳原子(C)_________、______________,(2)钾原子(K)_________、______________,(3)硫离子(S2-)_________、______________,(4)铝离子(Al3+)_________、______________, 【1--36号元素电子排布式】氢:1s1 氦:1s2 锂:1s22s1 铍:1s22s2 硼:1s22s22p1 碳:1s22s22p2 氮:1s22s22p3 氧:1s22s22p4 氟:1s22s22p5 氖:1s22s22p6 钠:1s22s22p63s1 镁:1s22s22p63s2 铝:1s22s22p63s23p1 硅:1s22s22p63s23p2 磷:1s22s22p63s23p3 硫:1s22s22p63s23p4 氯:1s22s22p63s23p5 氩:1s22s22p63s23p6 钾:1s22s22p63s23p64s1钙:1s22s22p63s23p64s2 钪:1s22s22p63s23p63d14s2钛:1s22s22p63s23p63d24s2矾:1s22s22p63s23p63d34s2铬:1s22s22p63s23p63d54s1锰:1s22s22p63s23p63d54s2铁:1s22s22p63s23p63d64s2 钴:1s22s22p63s23p63d74s2 镍:1s22s22p63s23p63d84s2铜:1s22s22p63s23p63d104s1锌:1s22s22p63s23p63d104s2镓:1s22s22p63s23p63d104s24p1锗:1s22s22p63s23p63d104s24p2 砷:1s22s22p63s23p63d104s24p3 硒:1s22s22p63s23p63d104s24p4溴:1s22s22p63s23p63d104s24p5氪:1s22s22p63s23p63d104s24p6 1--36号元素轨道排布图 1~36号元素电子排布式依次如下:1、氢H 1s1 2、氦He 1s2 3、锂Li 1s2 2s1 4、铍Be 1s22s2 5、硼 B 1s2 2s2 2p1 6、碳 C 1s22s22p2 7、氮N 1s22s22p3 8、氧O 1s22s22p4 9、氟 F 1s22s22p5 10、氖Ne 1s22s22p6 11、钠Na 1s22s22p63s1 12、镁Mg 1s22s22p63s2 13、铝Al 1s22s22p63s23p1 14、硅Si 1s22s22p63s23p2 15、磷P 1s22s22p63s23p3 16、硫S 1s22s22p63s23p4 17、氯Cl 1s22s22p63s23p5 18、氩Ar 1s22s22p63s23p6 19 钾K 1s22s22p63s23p64s1 20、钙Ca 1s22s22p63s23p64s2 21、钪Sc 1s22s22p63s23p63d14s2 22、钛Ti 1s22s22p63s23p63d24s2 23、钒V 1s22s22p63s23p63d34s2 24、铬Cr 1s22s22p63s23p63d54s1 25、锰Mn 1s22s22p63s23p63d54s2 26、铁Fe 1s22s22p63s23p63d64s2 27、钴Co 1s22s22p63s23p63d74s2 28、镍Ni 1s22s22p63s23p63d84s2 29、铜Cu 1s22s22p63s23p63d104s1 30、锌Zn 1s22s22p63s23p63d104s2 31、镓Ga 1s22s22p63s23p63d104s24p1 32、锗Ge 1s22s22p63s23p63d104s24p2 33、砷As 1s22s22p63s23p63d104s24p3 34、硒Se 1s22s22p63s23p63d104s24p4 35、溴Br 1s22s22p63s23p63d104s24p5 36、氪Kr 1s22s22p63s23p63d104s24p6 小结:相关规律 1、基态原子最外层为1个电子的是 第ⅠA族、Cu、Cr 2、基态原子最外层为2个电子的是 第ⅡA族、He、21号至30号(Cu和Cr除外)3、基态原子只有1个未成对电子的是 第ⅠA族、第ⅢA族、第ⅦA族、Cr、Cu 电子式及元素的电子排 布图 Document number【980KGB-6898YT-769T8CB-246UT-18GG08】 化学金排机器码:H 注册码:9 1~36号元素电子排布式依次如下: H:1s1 He:1s2 Li:1s22s1 Be:1s22s2 B:1s22s22p1 C:1s22s22p2 N:1s22s22p3 O:1s22s22p4 F:1s22s22p5 Ne:1s 22s22p6 Na:1s22s22p63s1 Mg:1s22s22p 63s2 Al:1s22s22p63s23p 1 Si:1s22s22p63s23p2 P:1s22s22p63s23p 3 S:1s22s22p63s23p 4 Cl:1s22s22p63s23p 5 Ar:1s22s22p63s23p6 K:1s22s22p63s23p64s1 Ca:1s22s22p63s23p64s2 Sc:1s22s22p63s23p63d14s2 Ti:1s22s22p63s23p63d24s2 V:1s22s22p63s23p63d34s2 Cr:1s22s22p63s23p63d54s1 Mn:1s22s22p63s23p63d54s 2 Fe:1s22s22p63s23p63d64s 2 Co:1s22s22p63s23p63d74s2 Ni:1s22s22p63s23p63d84s2 Cu:1s22s22p63s23p63d104s1 Zn:1s22s22p63s23p63d104s2 Ga:1s22s22p63s23p63d104s24p1 Ge:1s22s22p63s23p63d104s24p2 As:1s22s22p63s23p63d104s24p3 Se:1s22s22p63s23p63d104s24p4 Br:1s22s22p63s23p63d104s24p5 Kr:1s22s22p63s23p63d104s24p6 +321 +11+22+422+5 2 3 +6 【1--36号元素电子排布式】氢:1s1 氦:1s2 锂:1s22s1 铍:1s22s2 硼:1s22s22p1 碳:1s22s22p2 氮:1s22s22p3 氧:1s22s22p4 氟:1s22s22p5 氖:1s22s22p6 钠:1s22s22p63s1 镁:1s22s22p63s2 铝:1s22s22p63s23p1 硅:1s22s22p63s23p2 磷:1s22s22p63s23p3 硫:1s22s22p63s23p4 氯:1s22s22p63s23p5 氩:1s22s22p63s23p6 钾:1s22s22p63s23p64s1钙:1s22s22p63s23p64s2 钪:1s22s22p63s23p63d14s2钛:1s22s22p63s23p63d24s2矾:1s22s22p63s23p63d34s2铬:1s22s22p63s23p63d54s1锰:1s22s22p63s23p63d54s2铁:1s22s22p63s23p63d64s2 钴:1s22s22p63s23p63d74s2镍:1s22s22p63s23p63d84s2铜:1s22s22p63s23p63d104s1 锌:1s22s22p63s23p63d104s2镓:1s22s22p63s23p63d104s24p1锗:1s22s22p63s23p63d104s24p2 砷:1s22s22p63s23p63d104s24p3 硒:1s22s22p63s23p63d104s24p4溴:1s22s22p63s23p63d104s24p5氪:1s22s22p63s23p63d104s24p6 1--36号元素轨道排布图氢: 氦: 精心整理 原子核外电子排布规律 ①能量最低原理:电子层划分为K 练习题第二讲原子核外电子的排布规律一、核外电子的排布规律 能在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核近的区域运动,离核稍远的量高的电子通常在离核远的区域运动。我们常用电子层来表明。离核最近的叫第一层,、、O、M、NK叫第二层,依次类推,由近及远叫三、四、五、六、七层,也可依次把它们叫做、L 层。核外电子的分层运动,又叫核外电子的分层排布。如图。科学研究证明,电子一般总是、QP L层,依次类推。K层,当K层排满后,再排布尽先排布在能量最低的电子层里,即最先排布1-20号元素原子的电子层排布 各电子层的电子数各电子层的电子数素元元素素元电元素核核电荷数名称符号符号名称荷数K L M N L K M N 2 氢H 1 8 Na 1 钠11 1 2 Mg 8 2 氦He 12 镁 2 2 2 8 Al Li 3 锂13 铝3 1 2 2 8 4 Be 铍14 Si 硅 2 2 4 2 硼B 15 8 P 磷 3 2 5 5 2 碳C 16 S 8 4 2 硫6 6 2 17 5 2 8 氯Cl 7 氮N 7 2 氩Ar 8 8 18 氧O 8 6 2 2 钾K 9 19 氟7 F 2 8 8 1 2 2 20 8 钙8 Ca 8 10 氖Ne 2 二、核外电子排布的一般规律和表示方法 2;②最外层电子数目不超过8核外电子排布的一般规律是:①各电子层最多容纳的电子数目是2n个(K层为最外层时不超过2个),次外层电子数目不超过18个,倒数第三层电子数目不超过32个;③核外电子总是尽先排布在能量最低的电子层里,然后再由里往外依次排布在能量逐步升高的电子层里。1-18号元素的原子结构示意图。 第二讲 原子核外电子的排布规律 练习题 一、核外电子的排布规律 在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核近的区域运动,能量高的电子通常在离核远的区域运动。我们常用电子层来表明。离核最近的叫第一层,离核稍远的叫第二层,依次类推,由近及远叫三、四、五、六、七层,也可依次把它们叫做K 、L 、M 、N 、O 、P 、Q 层。核外电子的分层运动,又叫核外电子的分层排布。如图。科学研究证明,电子一般总是尽先排布在能量最低的电子层里,即最先排布K 层,当K 层排满后,再排布L 层,依次类推。 核外电子排布的一般规律是:①各电子层最多容纳的电子数目是2n 2;②最外层电子数目不超过8个(K 层为最外层时不超过2个),次外层电子数目不超过18个,倒数第三层电子数目不超过32个;③核外电子总是尽先排布在能量最低的电子层里,然后再由里往外依次排布在能量逐步升高的电子层里。1-18号元素的原子结构示意图。 1.结构示意图(原子、离子) 2.电子式(原子、离子) [课堂练习]写出下列微粒的结构示意图和电子式: 结构示意图:Na+;Cl-;Ar ;K+;N ;O 电子式:S2-;K+;S;P ;He 。 练习 一、选择题 1.以下说法正确的是() A.原子是最小的粒子 B.所有粒子都带中子 C.原子呈电中性,所以原子不含电荷 D.原子质量主要集中在原子核上 2.下列说法中不正确的是() A.原子中电子在核外运动没有确定的轨道 B.电子云中小黑点的疏密表示电子在核外某处出现机会的多少 C.离原子核越近的电子越不容易失去 D.在原子中,除最外层电子层,每层上的电子数必符合2n2个 3.下列各关系式中,正确的是() A.中性原子中:核外电子数=核内中子数 B.中性原子中:核内质子数=核外电子数 C.在R2-中:电子数=核内质子数-2 D.在R2+中:电子数=核内质子数+2 4.在构成原子的各种微粒中,决定原子种类的是() A.质子数 B.中子数 C.质子数和中子数 D.核外电子数 化学金排机器码:H194-6181-8919 注册码:9173-5111-9903 1~36号元素电子排布式依次如下: H:1s1 He:1s2 Li:1s22s1 Be:1s22s2 B:1s22s22p1 C:1s22s22p2 N:1s22s22p3 O:1s22s22p4 F:1s22s22p5 Ne:1s22s22p6 Na:1s22s22p63s1 Mg:1s22s22p63s2 Al:1s22s22p63s23p1 Si:1s22s22p63s23p2 P:1s22s22p63s23p3 S:1s22s22p63s23p4 Cl:1s22s22p63s23p5 Ar:1s22s22p63s23p6 K:1s22s22p63s23p64s1 Ca:1s22s22p63s23p64s2 Sc:1s22s22p63s23p63d14s2 Ti:1s22s22p63s23p63d24s2 V:1s22s22p63s23p63d34s2 Cr:1s22s22p63s23p63d54s1 Mn:1s22s22p63s23p63d54s2 Fe:1s22s22p63s23p63d64s2 Co:1s22s22p63s23p63d74s2 Ni:1s22s22p63s23p63d84s2 Cu:1s22s22p63s23p63d104s1 Zn:1s22s22p63s23p63d104s2 Ga:1s22s22p63s23p63d104s24p1 Ge:1s22s22p63s23p63d104s24p2 As:1s22s22p63s23p63d104s24p3 Se:1s22s22p63s23p63d104s24p4 Br:1s22s22p63s23p63d104s24p5 Kr:1s22s22p63s23p63d104s24p6 1--36号元素电子排布式与轨道表示式电子排布式电子排布简式价电子排布式轨道表示式 氢H :1s1 1s1 1s1 氦He:1s2 [He]1s2 锂Li :1s22s1 [He]2s1 2s1 铍Be:1s22s2[He]2s2 2s2 硼B :1s22s22p1 [He]2s22p1 2s22p1 碳C :1s22s22p2[He]2s22p2 2s22p2 氮N :1s22s22p3[He]2s22p3 2s22p3 氧O :1s22s22p4 [He]2s22p4 2s22p4 氟F :1s22s22p5 [He]2s22p5 2s22p5 氖Ne:1s22s22p6 [Ne] 2s22p6 钠Na:1s22s22p63s1 [Ne]3s1 3s1 镁Mg:1s22s22p63s2 [Ne]3s2 3s2 铝Al :1s22s22p63s23p1 [Ne]3s23p1 3s23p1 硅Si :1s22s22p63s23p2[Ne]3s23p2 3s23p2 磷P :1s22s22p63s23p3[Ne]3s23p3 3s23p3 硫S :1s22s22p63s23p4[Ne]3s23p43s23p4氯Cl:1s22s22p63s23p5[Ne]3s23p5 3s23p5 氩Ar:1s22s22p63s23p6[Ar] 3s23p6 钾K :1s22s22p63s23p64s1[Ar] 4s1 4s1 钙Ca:1s22s22p63s23p64s2 [Ar] 4s2 4s2 钪Sc:1s22s22p63s23p63d14s2[Ar] 3d14s2 3d14s2 钛Ti :1s22s22p63s23p63d24s2[Ar] 3d24s2 3d24s2 矾V :1s22s22p63s23p63d34s2[Ar] 3d34s23d34s2 铬Cr:1s22s22p63s23p63d54s1[Ar] 3d54s13d54s1 锰Mn:1s22s22p63s23p63d54s2[Ar] 3d54s2 3d54s2 铁Fe:1s22s22p63s23p63d64s2 [Ar] 3d64s23d64s2 钴Co:1s22s22p63s23p63d74s2[Ar] 3d74s2 3d74s2 镍Ni:1s22s22p63s23p63d84s2[Ar] 3d84s2 3d84s2元素电子排布规律
电子式及元素的电子排布图
1~36号元素电子排布图
核外电子排布、原子结构示意图、电子式、8电子稳定结构
1、1~36号元素电子排布式、排布图-1到36原子 排布式
1~36号元素电子排布图(精排版)
电子式及元素的电子排布图
11~36号元素电子排布式排布图1到36原子 排布式
核外电子排布规律总结归纳
原子核外电子排布的规律练习题
第2讲 原子核外电子排布的规律练习题
电子式及1-36号元素的电子排布图
1--36号元素电子排布式与轨道表示式(完美版)
