临床常见医疗器械不良事件

临床常见医疗器械及其可疑不良事件
2008年12月《医疗器械不良事件监测及再评价管理办法》(试行)颁布以来,我省医疗器械不良事件监测工作进入了一个新的时期。近年来通过各级监测技术机构不断的培训和宣传,医疗机构上报意识不断增强,上报水平逐渐提高。医疗机构是医疗器械不良事件上报的重要来源,在我省医疗器械可疑不良反应报告系统中,来源于医疗机构的报告占全部报告的95%以上。作为医疗器械的使用者和医疗器械不良反应的发生地,广大医护人员应当是医疗器械不良事件最早发现者。但是在我们的监测工作中发现,由于广大医护人员对医疗器械不良事件的定义和认识存在误区,缺乏监测经验,导致大部分的医疗器械不良事件并未被发现并及时上报。2012年3月国务院颁布的《国家药品安全十二五规划》对医疗器械不良事件监测工作提出来新的要求。针对绝大部分医护人员不了解什么是医疗器械不良事件和如何判定医疗器械不良事件的现状,我中心管理了数据库中历年来的六千余条医疗器械可疑不良事件报告,并查阅文献,结合临床各个科室使用器械的情况进行分类,突出方便、实用性。希望通过这本《临床常见医疗器械不良事件表现汇编》能够帮助我省广大医护人员对医疗器械不良事件监测工作的认识和了解常见的医疗器械不良事件表现,提高我省医疗器械不良事件监测水平,更好保障人民群众用械安全。本汇编资料由于编写时间有限并且数据处理量较大,疏漏之处在所难免,希望广大医护工作者能够提出宝贵意见。
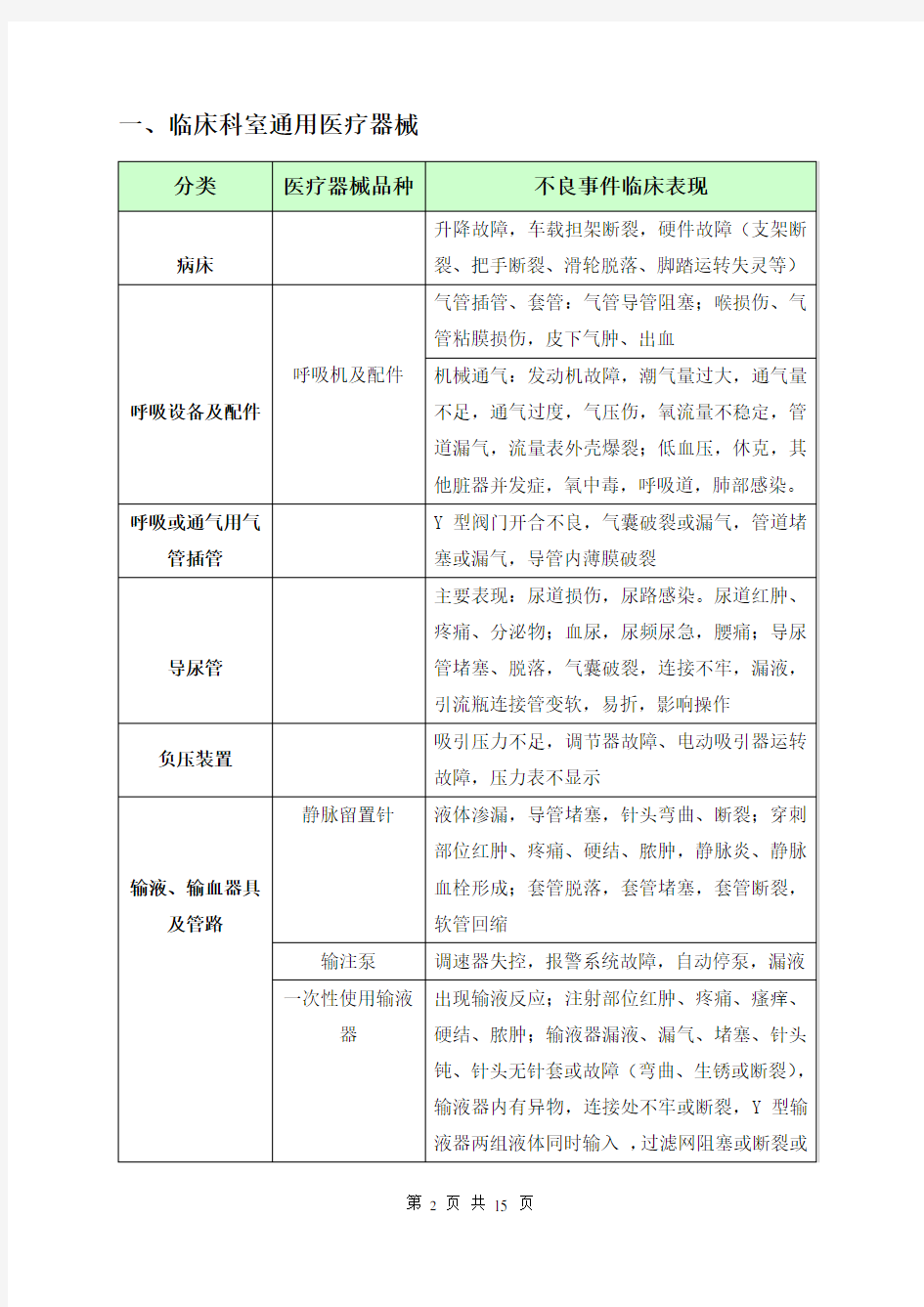
一、临床科室通用医疗器械
分类医疗器械品种不良事件临床表现
病床升降故障,车载担架断裂,硬件故障(支架断裂、把手断裂、滑轮脱落、脚踏运转失灵等)
呼吸设备及配件呼吸机及配件
气管插管、套管:气管导管阻塞;喉损伤、气
管粘膜损伤,皮下气肿、出血
机械通气:发动机故障,潮气量过大,通气量
不足,通气过度,气压伤,氧流量不稳定,管
道漏气,流量表外壳爆裂;低血压,休克,其
他脏器并发症,氧中毒,呼吸道,肺部感染。
呼吸或通气用气
管插管Y型阀门开合不良,气囊破裂或漏气,管道堵塞或漏气,导管内薄膜破裂
导尿管主要表现:尿道损伤,尿路感染。尿道红肿、疼痛、分泌物;血尿,尿频尿急,腰痛;导尿管堵塞、脱落,气囊破裂,连接不牢,漏液,引流瓶连接管变软,易折,影响操作
负压装置吸引压力不足,调节器故障、电动吸引器运转故障,压力表不显示
输液、输血器具
及管路
静脉留置针液体渗漏,导管堵塞,针头弯曲、断裂;穿刺
部位红肿、疼痛、硬结、脓肿,静脉炎、静脉
血栓形成;套管脱落,套管堵塞,套管断裂,
软管回缩
输注泵调速器失控,报警系统故障,自动停泵,漏液一次性使用输液
器
出现输液反应;注射部位红肿、疼痛、瘙痒、
硬结、脓肿;输液器漏液、漏气、堵塞、针头
钝、针头无针套或故障(弯曲、生锈或断裂),
输液器内有异物,连接处不牢或断裂,Y型输
液器两组液体同时输入,过滤网阻塞或断裂或
输液、输血器具
及管路
位置歪斜或颜色不正
一次性注射器/
无菌注射器
针头堵塞,针栓滑落,针头钝或弯曲或断裂,
无针套,针头座松软,漏液;注射后出现寒战、
高热、抽搐等反应;注射部位局部红肿、疼痛,
局部感染
一次性使用溶药
注射器
针头堵塞,针栓滑落,针头钝,针头无针套或
故障(弯曲、生锈或断裂),针头座松软,漏液采血器/输血器采血器漏气或堵塞,渗血,针头钝,针头无针
套或故障(弯曲、生锈或断裂),有异物,针头
与采血器连接不牢,胶塞封闭不严,条码识别
错误,血液进入输血器即发生血凝,分离血清
过程中出现结膜现象,血液回收装置连接不牢一次性中心静脉
导管
穿刺针头和针栓咬合不牢,漏血,导管脱落,
断裂滑入体内,管道阻塞;静脉炎、感染
一次性使用麻醉
穿刺包
穿刺包与导管卡住,加药器折断、破裂,注射
器裂缝,注射器漏液,麻醉平面过低
输液辅助装置化疗泵破裂,药口漏液,滴速过快
医用输液胶带脱落;造成血管水肿
输液泵滴速不准确,加药口开关失灵频繁报警,不能正常工作,贮液球囊漏液,有异物,设置输液量与实际输入量不符,输液管有气体,机器不报警,气温过低致输液泵不能正常工作
注射泵显示工作状态,但并未工作,也不报警、输液倒退、突然停止工作
镇痛泵没有规定时间内用空既定的药物;贮液囊爆裂,不能自行泵注,漏药,固定储液囊支架断裂脱落
身体反应:恶心、呕吐;尿潴留;呼吸抑制;出现呼吸困难,全身发绀,呼吸减弱,呼之不应,瞳孔对光反射迟钝;低血压;四肢软无力发冷、面色苍白,神志不清,呼吸微弱,口齿发绀,脉搏微弱,瞳孔等圆等大,对光反射迟钝;人为气胸;胸闷、心悸、出汗伴四肢颤动、畏寒;皮疹、瘙痒;全身轻微震颤伴恶心
其他:潜在形成空气栓塞;麻醉平而过低,手术开始时自觉疼痛
体温计测量数据不准确;水银外溢;体温计水银不能上升;水银柱无法甩动或自行回落;体温计温度不改变
无创监护仪系统问题:血压、心率、监护仪血氧饱和度、心电导线无法测量;黑屏、蓝屏;开关机正常,时有自动关机现象出现;屏幕一片雪花,看不到数据、间歇性熄灭;突然死机;血氧监测探头不能正常传感到显示屏,监测数据不准确,数据误差大;无体征数据输出;血压监测功能障碍;血氧波形有失真现象,血氧偏低,没接病人就有血氧数据;使用时无脉搏氧饱和度波形和数值
皮肤反应:皮肤烫伤;电极片处出现皮疹
其他反应:压力泵连接管不能除下;监护仪袖带漏气;血压连接管硬化导致监测血压时胶管破裂
无创医用传感器一个换能器中间浑浊,一个出现漏水情况;传感器故障,监测失败;流量监测不准,容易坏皮肤反应:接触部位皮肤红肿、疼痛、瘙痒、
心电电极皮疹、有水泡、有损伤
电极:中间钮机部分剥离;电极贴接触不良;用于心电监护仪的电极片经常接触不良,导致监护仪显示不了波形
其他:损坏监护导联线,影响数据读取;贴粘度不够;导联线质量差,储存卡经常有问题
血压计水银:水银不足;水银柱不回位;水银泄露患者反应:头晕、头痛;受测肢挤压致皮下出血
其他:充气球、血压计漏气;断裂;袖带松坏
压力蒸汽灭菌设
备压力蒸汽灭菌器内胆腐蚀穿孔;消毒完毕消毒机顶盖无法打开;冷气排不完全;门缝漏气,发出刺耳声响
医用粘合剂心衰、休克;血压骤降,心脏骤停;粘结义齿后疼痛;粘性过强;骨水泥过敏毒性反应致死亡;粘贴胶布处皮肤潮红,少或无皮疹
医用制气设备制氧机不制氧或制氧不足;氧气吸入器使用几天后便出现表皮铝纸蜕皮现象
引流容器
肛袋漏水及肛袋粘贴部分粘贴不牢,需要反复更换调节器无法完全关闭(完全关闭时仍在流水)
引流器引流袋关闭阀关闭不全;漏液漏气;无法引尿;
引流袋无止水夹;引流袋和导尿管衔接不紧;
引流管与集尿器分离;盖上吸入口接头与盖体
连处爆裂
患者反应:过敏
其他反应:无负压;有异物;吸痰时痰液收集
不起来;大包装内小包装上无有效期字样,批
号印字不清楚,部分产品封口漏封批号
灌肠袋底部漏水尿袋渗尿
粘贴材料皮肤反应:出现皮疹、皮肤红肿、搔痒、潮红、水泡形成、皮肤溃烂
胶带:胶带不粘、过粘;胶带揭除时损伤皮肤;皮肤残留白色物
其他反应:静脉留置针致静脉炎;患者身上关节处经常性疼痛;医用棉签包装破裂;无菌棉签破损漏气
诊察治疗设备拆开新包装,装好后发现坏的;使用过程中出现发热、不运转
气体灭菌设备床体:薰蒸治疗时体床不稳,侧翻
皮肤反应:皮肤痒,起红疹,可见数个小丘疹;表皮烧伤,伤处疼痛,红肿伴有发热高烧;治疗部位出现水泡
其他反应:头晕;关于气体量只有一半,几次消毒检测都不合格;没电源;电路板故障;雾化时堵塞中断
冲洗、通气、减
压器具
洗胃机洗胃机频繁报警,手冲键失控;吸取不到胃液、
过滤瓶溢出洗胃水
负压引流装置引流过程中负压引流袋发生爆裂
其他反应:进行阴道冲洗时,冲洗头与贮液体
连接处无法拧紧,导致药水漏流;管腔堵塞
专用消毒设备机身渗水;试纸失效;清洗过程中停机;产品不完善,不能使用
二、放射科
分类主要表现医用X线胶片处理装置X光片显示发灰、发黑、影像不清医用X线影像系统及成像器件无法显影
X射线计算机断层摄影设备(CT)开机故障:出现伪影;检查结果错误;死
机
X射线治疗设备启动故障;显示屏显示异常;治疗中断;
暗盒不能正常识别
X射线诊断设备及高压发生装置显示故障:X光片卡住;不能正常点片;
吊塔钢丝绳断裂;探测器异常旋转;电机
保险烧坏;底轮脱落X射线手术影像设备DR检查中断
X线机配套用患者或部件支撑装置
(电动)推注压力异常导致界面经常重新启动;
推杆不能正常运动;连接线断裂
三、B超室常用医疗器械
分类主要表现
超声诊断设备(含B超、彩超设备
及其软件)出现伪影;按键失灵;死机;显像不清晰;
图像及信号不稳定;探头损坏
彩色超声成像设备及超声介入/腔内
诊断设备启动异常;死机;图像显示异常;升降控
制系统故障
超声辅助材料螯合剂漏液,导致过敏反应(红斑、瘙痒、
过敏/接触性皮炎)
电声诊断仪器显示屏无法读数
四、检验科、病理科常用医疗器械
分类主要表现
病理分析前处理设备切片刀难控制;蜡缸无法熔蜡
临床医学检验辅助设备检验结果不准确
免疫分析系统灵敏度低,出现假阳性;软件故障,测试结果不准确;更换试剂时出现异常
尿液分析系统死机;检验结果不准确;灵敏度低
生化分析系统
产品批号不清晰;漏液;结果不准确;出现(K、Na、Cl)离子漂移现象;光源暗
血液分析系统结果不准确;启动及打印故障;有异物
血液化验设备和器具结果不准确,出现假阳性;血滤管侧管不通;滤器与管路配套板脱离;透析器漏血,标本溶血,
凝血异常
医用离心机死机;指示灯不亮五、理疗科常用医疗设备
分类主要表现
超声理疗设备启动故障;治疗头无功率输出;漏气;器械断裂;
雾化不稳定
磁疗设备灯罩脱落;定时功能不灵;出现局部瘙痒、皮肤溃烂、过敏、皮疹、红肿
电疗设备开机时出现较大静电,电刺激较大,引起病人肌肉强烈收缩;治疗过程中突然中断、漏电;电流热效应导致皮肤烫伤;局部皮肤潮红、瘙痒、有
水泡
冷敷器具局部出现红肿,皮疹、瘙痒、红斑、过敏、水疱
理疗康复仪器电脑死机;产品漏电,蒸汽孔、排水孔堵塞,微波管损坏,手柄与一次性阴道洗涤治疗管不能正常连接;烫伤皮肤、局部皮肤潮红、瘙痒、水泡、
皮肤破损;
消化道\腹腔内\患处皮下出血;头晕,脱发,全身无力,全身酸痛、口干、口腔溃疡,眼龈肿痛
微博治疗设备显示器显示不清晰;治疗部位红肿、水泡、皮肤
灼伤
理疗用电极局部皮肤潮红、过敏反应;漏电;异常放电六、外科通用医疗器械
分类主要表现
医用缝合线(带针/不带针)伤口红肿,感染,化脓;愈合不良,不愈合/愈合延迟;缝合线(针)断裂,可吸收缝合线吸收
不良或不吸收
敷料、护创材料导致皮肤瘙痒、皮疹、红肿、疼痛、水泡;感染腹部外科用钩、针手术中持针器尖端断裂
腹部外科用其他器械钳口不能正常动作,钳尖断裂
高频电极电极板故障(漏电),电凝镊故障,绝缘层破损;
导致皮肤潮红、水泡
高频手术和电凝设备漏电,电凝强度过大或过弱;切口皮下脂肪液化,
导致术口渗液、红肿
供氧系统漏气,装置爆裂;鼻腔粘膜损伤;氧气内杂志超
标
基础外科用钳断齿,钳尖断裂基础外科用剪螺丝松动,剪刀片断裂基础外科用钩、针内固定材料断裂
可吸收性止血、防粘连材料过敏反应,感染;吸收材料吸收延迟或者不吸收;结膜充血
手术手套过敏反应
医用供气、输气装置鼻氧管及吸氧面罩有异味,爆裂,漏气;雾化器不能雾化;装置连接处连接不牢;导致鼻孔出血、
胸闷、呼吸困难
医用可吸收缝合线(带针/不
带针)不吸收,造成创口崩裂无法愈合/愈合延迟,切口红肿,局部皮肤发热、疼痛、渗血水、瘙痒、线头不易吸收、反复出血;缝线断裂、线扣子自
然脱掉
低温治疗仪器医用低温设备皮肤发红、水疱
医用手术及诊断用显微设备螺丝易松动、手术切口渗血七、骨科常用医疗器械
分类主要表现矫形(骨科)外科用钩、针断裂,锯拉钩和线锯条不匹配矫形(骨科)外用锯、凿、锉断裂,壳体开裂矫形(骨科)外科用钳折断,螺丝脱落
矫形(骨科)外科用其他器械电钻钻花断裂,扩孔钻钻头断裂,钢板或钛板折断,螺丝松动或断裂
矫形(骨科)外科用有源器械电钻发出尖叫声,钻头力度不足,充气泵
漏气
骨科植入物发热,伤口渗液、疼痛;植入物错位、断裂,螺丝松动或断裂或弯曲,骨折畸形愈合,骨折不愈合,假体松动,断裂;术后
感染
八、普外科、泌尿科常用医疗器械
分类主要表现
泌尿肛肠科用其他器械膀胱镜电脑屏幕显示异常,膀胱钳口不能正常活动,调节器失灵,电切环绝缘瓷断
裂或脱落
泌尿肛肠科用钳术后出血;吻合器闭合不良,把手断裂、
脱钉
肠道插管漏气、漏液、阻塞,连接处不牢,接头脱落,气囊破裂,引流异常
九、口腔科常用医疗器械
分类主要表现
牙科椅治疗中止
洁牙、补牙设备刺激神经产生疼痛;根管长度测量不准确
口腔用其他器械折断
口腔综合治疗设备玻璃灯罩爆裂脱落
暂封性充填材料及有关材料刺激神经引起疼痛,双侧脸颊红肿;过敏反
应;感染、牙髓炎
永久性充填材料及有关材料牙齿酸软,有疼痛感;过敏反应;牙髓炎模型材料牙龈红肿,出血
十、胸外科常用医疗器械
分类主要表现胸腔心血管外科用其他器械钳尖断裂,调节手柄断裂
十一、内科常用医疗器
分类主要表现
电子内窥镜软、硬件故障导致的仪器不能正常开机、死机、黑屏等;纤维镜爆裂,不能调焦,
固定困难
反光器具镜面断离
光谱辐射治疗仪器电源漏电,感应膜破裂;治疗部位烫伤、
红肿、疼痛、麻木感、灼热、丘疹光谱诊断设备冷强光探头光度不够,红外线探头过热
分类主要表现
光学内窥镜及冷光源黑屏、自动停机,部件断裂,电线包皮老
化破裂,光源不亮
用于心脏的治疗、急救装置操作面板容易损坏,屏幕不显示,充电能量与放电不一致,充、放电装置故障
有创式电生理仪器及创新电生理仪
器
黑屏,导联线接触不良,套件自动分离有创医用传感器接头断裂,漏水,测量不准确
十二、心血管内科常用医疗器械
分类主要表现
心电诊断仪器开关失灵,开、关机异常,测量心电数据值不准,电极不粘、易脱落,热笔烧毁
心及血管、有创、腔内手术用内窥镜金属片脱落、脱钉;系统错误,图片资料无法保存;内窥镜钳口不能开合;损伤血管;心痛、心悸、呼吸困难
血流量、容量测定装置无法显示结果,结果显示不正确射频治疗设备出现水泡;恶心、呕吐;血管破裂出血
支架支架脱落、断裂、丢失;血管再狭窄,胸闷、胸痛、头晕;急、慢性血栓形成,心梗;血管破裂,导致栓塞
栓塞器材术后出现残余分流现象或分流现象,弹簧
圈自动解脱,出血
体外反搏及其辅助循环装置震颤;电池电量不足导致起搏装置不能在
有效期内工作
十三、肾内科常用医疗器械
分类主要表现
透析粉、透析液胸闷、乏力;尿毒症症状无明显减轻;透析液钠浓度过高;血液透析无报警;下肢疼痛,
抽搐、酸软
血液净化设备辅助装置出现胸闷、鼻塞、喷嚏、流泪等症状;血液自排气活塞管口流出;腹痛里急后重
血液净化设备和血液净化器具
透析器:破膜
动脉壶:动脉壶破裂导致漏血;动脉壶管端夹子夹不紧管路,密封帽松脱,漏血,失血较多;动脉压传感器漏液
管道问题:静脉管连接脱落;管体粘连;
透析导管包内导丝太软;连接管断裂
灌流器出现凝血堵塞现象
患者反应:出现胸闷、牙关紧咬、四肢抽搐
等症状;
突发畏寒、寒战、发热;出现低血压反应;
静脉负压
十四、肿瘤、放疗科常用医疗器械
分类主要表现
放疗正常反应:放射性脊髓炎;食管炎;内分泌
功能低下;肺脏损伤;放射性肺炎,肺功能损害;
咳嗽,咳血,放射性气管炎,气管狭窄,气管痿
系统问题:计时器显示错误;电脑突然显示系统
出错,但控制盒还是正常操作;治疗时预防门不
受控制;治疗床未复位
胃肠:出现胃肠损害;胃炎,放射性直肠炎,肠
狭窄,肠梗阻,胃肠穿孔,肠出血,肠粘连
医用高能射线治疗设备患者反应:出现全身乏力,食欲下降,恶心,呕
吐,
肝功能异常,放射性肝炎;眩晕;其他部位溃烂脑部:出现脑损伤;急性放射性脑水肿,颅内压升高;高血压,糖尿病引起的脑栓塞;颅内增高引起的疾病,头痛
眼睛:出现放射性白内障,眼底损伤视神经损伤、眼球萎缩、失明,听力障碍等症状
其他:有股骨病理骨折;血小板减少;或出现皮肤和肌肉肿胀、心脏损害;应激光引起的血压下
降伴轻度休克
脊髓:出现脊髓抑制,白细胞减少,血小板减少
超声手术及聚焦治疗设备超声刀头不能合拢;刀头断开十五、妇产科常用医疗器械
分类主要表现
超声母婴监护设备探头:胎监机探头脱落,继线;宫内压探头无法
检测到宫缩
其他:仪器监护胎心结果与实际不符,造成诊断错误;静电(触电的感觉)
妇产科用钩、针探针断裂:取环器钩端断裂;钳尖断裂
阴道扩张器破损、生锈、裂开;虚位过大;出现大量压碎的
情况;旋切器转动不灵
患者反应:心悸气促、恶心,冒冷汗;外阴痒;
尿频,尿急,尿痛伴血尿
其他:窥器手柄断裂
婴儿保育设备频繁报警;不制热,造成新生儿肢端发凉;湿控装置失灵,无报警;湿度不足,<30%;早产儿
温箱门锁断裂十六、眼耳鼻喉科常用医疗器械
分类主要表现耳鼻喉科用刀、凿钻头折断
耳鼻喉科用其他器械灯泡难以更换并且灯泡与镜柄接触不良;麻镜指示灯不亮;乳突撑开器螺丝脱落;负压置破裂;一次性物品检测中发现菌落数超标
激光手术和治疗设备激光发射位置偏移;显示屏黑屏;其他软、
硬件故障
眼科光学仪器仪器升降台皮带断裂不能使用眼科康复治疗仪器治疗过程中发现仪器图片颜色脱落
植入体内或长期接触体内的眼科
光学器具
推进器:刺激角膜,角膜内皮水肿
前端过于锋利,刺伤角膜切口
眼睛:视力下降、眼胀痛、右眼混合充血、角膜水肿;虹膜炎,术后眼部异物感
护理液:使用后双眼出现疼痛、流泪
人工晶体:人工晶体断裂;人工晶体表面出
现沉着
十七、中医科室
分类主要表现
中医用具熏蒸仪器:皮肤颜色变黑;皮肤起泡;蒸汽温度显示异常,与实际不符;药液不能分装灌注
针灸针具:断针
各科室医疗器械不良反应事件
医疗器械不良事件监测相关知识及要求 根据“可疑”即报的原则,濒临事件原则. 造成患者、使用者或其他人员死亡、严重伤害的事件,可能与使用医疗器械有关,需要按可疑医疗器械不良事件报告。可疑医疗器械分为: 一类:通过常规管理足以保证其安全性、有效性的医疗器械。常见的有: (刀子、剪子、钳子、镊子、针、钩、) 听诊器、反光镜、医用放大镜、压舌板、橡皮膏、手术衣、手术帽、检查手套、集液袋等 二类:对其安全性、有效性应当加以控制的医疗器械。常见的有: 血压计、体温计、心电图机、脑电图机、手术显微镜、助听器、避孕套、避孕帽、超声三维系统软件、脉象仪软件、消毒剂、诊断试剂、等 三类: 植入人体,用于支持、维持生命,对人体具有潜在危险,对其安全性、有效性、必须严格控制的医疗器械。常见的有: 心脏起博器、血管内窥镜、超声聚焦刀、高频电刀、微波手术刀、CT机、钴—60治疗机、医用磁共振成像设备、植入式人工器官、血管支架、血管内导管、一次性使用输液器、输血器、生物芯片、医用高分子材料、体外诊断试剂等 其中(内科)常用的医疗器械有: 1.体温计在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为测量结果不准确、水银柱不上升/下降、不能计数等。 2.血糖仪在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为血糖测量值不准确、血糖值显示不清晰、屏幕不显示等。 3.胰岛素注射笔在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为注射部位疼痛、注射针头漏液、推动困难、笔芯密封不严、笔芯变色等。 4.血管内支架在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为支架脱载、无再流、支架内血栓形成、再狭窄等。 5.心脏起搏器在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为电极移位、心外肌肉收缩、静脉血栓/狭窄、电池提前耗竭、电极导线感染等。 6.输液泵在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为为滴速失控、滴量不准、漏液、报警失灵等。 7.导尿管在临床使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为尿道红肿、疼痛、分泌物、血尿、腰痛、导尿管堵塞、脱落、气囊破裂等。 8.一次性使用输液器在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为寒颤、高热、恶心、呕吐、输液器漏液、有异物等。 9.监护仪按照临床应用的地方不同,监护仪一般分为麻醉监护仪、肺功能监护仪、心电监护仪、脑电监护仪。其在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为监测数据不准确或不显示、黑屏、死机等。 10.呼吸机在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为潮气量过大、通气量不足、氧流量不稳定、管路漏气等。 11.静脉留置针又称套管针,在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为留置针漏液(接口处、针尾),套管脱落,套管堵塞,
医疗器械不良事件报告制度通用版
管理制度编号:YTO-FS-PD991 医疗器械不良事件报告制度通用版 In Order T o Standardize The Management Of Daily Behavior, The Activities And T asks Are Controlled By The Determined Terms, So As T o Achieve The Effect Of Safe Production And Reduce Hidden Dangers. 标准/ 权威/ 规范/ 实用 Authoritative And Practical Standards
医疗器械不良事件报告制度通用版 使用提示:本管理制度文件可用于工作中为规范日常行为与作业运行过程的管理,通过对确定的条款对活动和任务实施控制,使活动和任务在受控状态,从而达到安全生产和减少隐患的效果。文件下载后可定制修改,请根据实际需要进行调整和使用。 一、医疗器械不良事件是指获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。 二、医疗器械不良事件主要包括医疗器械已知和未知作用引起的副作用、不良反应及过敏反应等。副作用是指治疗使用的医疗器械所产生的与疾病防治目的无关的作用。 三、医务人员如发现可能与医疗器械有关的不良事件时,应及时报告不良事件专管员及科室负责人。 四、科室负责人发现或接到医疗器械不良事件报告后,应及时到现场察看,协助调查,并填写《医疗器械不良事件报告表》,核实后,提交医务部、护理部、院感科和设备科。特殊情况下,可先口头报告再补报书面材料。《医疗器械不良事件报告表》应包括患者情况、不良事件情况、医疗器械情况、初步处理情况等内容。 五、医务部、护理部、院感科和设备科接到医疗器械不良事件报告后,应联合组织调查,了解事件经过和相关
医疗机构医疗器械不良事件报告举例
医疗机构医疗器械不良事件报告举例 按照医疗器械分类目录对不同品种医疗器械的主要表 现进行了列举,供各医疗机构参考。 医疗器 分类名称产品名称不良事件表现械分类 6801基础外科手术器械 6804眼科手术器械 6805耳鼻喉科手术器械 6806口腔科手术器械医用缝合针 医用缝合针断裂 (不带线) 一次性使用 操作不利 基础外科用刀 备皮刀 手术刀片生锈、折断、缺损 基础外科用剪手术剪生锈、缺损 基础外科用钳 持针钳断裂、缺损 止血钳血管钳使用后有缺损 基础外科用镊 无损伤镊弹力不够 夹 一次性使用 盘底不平,凹槽太浅,导致消毒液外溢 基础外科其它换药盘 器械一次性使用 断裂划破医生手指、异物、边缘不整齐有倒刺压舌板 其他 一次性卫生 导致皮肤破损 垫 眼科手术用其常规眼科手 睫毛镊夹不住睫毛 他器械术器械包 耳鼻喉科用其一次性使用检查时弹簧弹出、闭合欠佳造成鼻腔窥见困他器械鼻镜难 口腔用镊、夹一次性镊子折断 口腔用其它器 械口腔用钩、根管锉针器械分离 针 一次性使用异物、器械盒封闭不严、断裂、生锈
口腔用其它器齿科器械盒 压舌板 械一次性使用毛刺、断裂 1/21
6808腹 部外科手其他 术器械 矫形(骨科) 外科用钳 矫形(骨科)6810矫外科用有源器形外科械 (骨科) 手术器械 其他 6812妇妇产科用剪产科用手妇产科用其他术器械器械 6815注 射穿刺器注射穿刺器械械一次性使用 不能击发、打开包装后,钉已经出仓、手柄开直线型吻合 裂 器 半月板篮钳篮钳头部断裂脱落于膝关节腔内 助力枪助力枪上的螺丝脱落 创伤手术工 钻孔错误 具 脊柱内固定 系统配套工工具断裂遗留在螺钉上 具 会阴剪螺丝脱落、刀刃有破损 阴道牵开器无螺丝 泵用注射器针头弯曲 一次性使用 无菌避光注注射乳头断裂 射器 一次性使用 动静脉瘘穿穿刺针有折痕 刺针 一次性使用 冠状动脉注漏液 射器 注射器乳头端断裂不能使用 包装盒内无针头 动脉血气针 包装封口密闭不严 动静脉穿刺 断裂、脱落、钢针偏斜 器 动脉采血器漏气、异物、漏血 一次性使用 针头外露,刺破针帽、无法推出余下液体、针无菌胰岛素 头脱落、断裂、针头堵塞 注射器 一次性使用 真空采血器包装破损、脱节、漏血配套 用针 一次性使用断裂、疼痛、脱落、裂口、外包装破损、穿刺静脉输液针针平头无尖 2/21
药品不良反应-医疗器械不良事件制度
ADR、MDR管理制度 一、ADR、MDR监测人员岗位职责 药品不良反应监测室负责全院的ADR/MDR监测工作,并在医院领导的领导下履行以下主要职责: (1)、承担全院ADR/MDR报告资料的收集、评价、反馈和上报工作; (2)、对全院ADR/MDR监测工作进行技术指导; (3)、承办全院ADR/MDR信息资料的整理,建立信息档案; (4)、组织ADR/MDR宣传、教育和培训; (5)、参与ADR/MDR相关交流及监测方法的研究。 二、ADR、MDR监测工作考核 医院对ADR/MDR监测工作实行目标管理考核,制定管理考核目标,主要考核办法如下: (1)、收集到一般不良反应/事件并完成在线呈报的,每份奖励30元; (2)、收集到新的或严重的不良反应并完成在线呈报的,每份奖励60元; (3)、未按照要求报告或只提供信息的,不得奖励; (4)、在抽查工作中发现漏报或者匿而不报的扣当事人200元; (5)、按照ADR/MDR监测工作计划少报一例扣科室100元; (6)、在ADR/MDR的不定期考核中不通过者年终不得参加评优。 三、ADR、MDR人员宣传、培训 医院对医务人员定期进行ADR/MDR相关知识进行教育、宣传、培训,必要时需要进行相关知识考核,具体执行如下: (1)、ADR/MDR相关知识教育、宣传、培训计划 每年至少组织一次ADR/MDR相关知识的教育、宣传、培训,具体时间、内容、形式由ADR/MDR 监测室人员制定安排,报医务科及分管领导批准后开展。 (2)、ADR/MDR相关知识考核 医院对ADR/MDR相关知识实行不定期考核,具体考核内容、时间由ADR/MDR监测室人员制定安排,报医务科及分管领导批准后开展。 四、ADR、MDR报告制度 (1)、医院对ADR/MDR遵行可疑即报原则,实行逐级、定期报告制度,必要时可以越级报告; (2)、医院指定专、兼职人员负责本院ADR/MDR的报告和监测工作,发现可能的ADR/MDR应详细记录、调查、分析、评价、处理,并填写“ADR/MDR报告表”,及时完成在线呈报。 (3)、一般的ADR病例应当在30日内报告;新的、严重的ADR必须在15日之内报告,死亡病例须立即报告;出现药品群体不良事件,应立即通过电话或传真等方式向区食品药品监督管理局和区卫生局报告,必要时可疑越级上报。导致死亡的MDR于发现或者知悉之日起5个工作日内,导致严重伤害、可能导致严重伤害或死亡的事件于发现或者知悉之日起15个工作日内报告。突发、群发的MDR,应当立即向省食品药品监督管理部门、卫生主管部门和医疗器械不良事件监测技术机构报告,并在24小时之内填写并报送《可疑医疗器械不良事件报告表》,必要时可越级上报。 五、ADR、MDR监测文件管理 为确保医院ADR、MDR信息完整,为以后ADR/MDR的报告、处理提供参考,要求医院对所有ADR/MDR资料、文件进行统一管理,要求如下: (一)、办公有固定场所;有联网计算机,能实现在线呈报报表;有电话,能及时收集和上报ADR/MDR报表;能提供传真,及时传递信息;能提供复印,留存必要的资料; (二)、建立药品/器械信息档案或数据库,报告表要收集、整理、归档,有固定的位置存放相关资料。
7.医疗器械不良事件分析总结
7.医疗器械不良事件分析总结 2017年医疗器械不良事件报告工作在全院临床及相关科室共同努力下,取得一定成果和进步。今年共计收到临床科室主动上报的医疗器械不良事件5例。2017年医疗器械不良事件的发生数量不多、严重程度不大,说明在不良事件的管理上,科室给予一定程度重视,加强了培训,以及我们医院所选用的医疗器械质量过硬,从而收到了一定效果。 一、不良事件统计: (一)护理类耗材:1、一次性使用无菌导尿包共0例;2、一次性使用无菌注射器(带针)共5例;3、一次性使用2腔无菌导尿管共0例;4、一次性使用3腔乳胶导尿管共0例;5、一次性使用无菌注射器共0例;6静脉留置针0例(二)透析及透析管路:共0例。 (三)其他医用耗材:1一次性使用心电电极共0例。2输液泵使用0例;2高频电刀使用0例;3麻醉机使用0例;4骨科钢板0例;5人工晶体0例;呼吸机使用0例 二、原因分析: 1、分析今年不良事件发生的原因,主要是由医疗器械的质量所造成。 2、临床科室使用时,不完全按照正确的操作流程操作也会造成不良事件的发生。 3、其他个别情况造成不良事件的发生,例如过敏体质的患者使用卫生耗材时发生过敏反应;医疗器械在搬运时发生碰撞,从而影响到使用等。 三、改进方法: 1、继续鼓励不良事件主动上报,发生不良事件后,及时积极与相关部门和人员合作,将患者的损害降到最低,最大限度的保障患者的生命安全。对于经常或者特别严重的医疗器械不良事件,要在医院会议上讨论,将个别经验教训作为教材,在全院引起重视。 2、加强重点人员的管理,加强年轻科室人员能力培训,规范各项操作规程,正确使用医疗器械。工作时做到井然有序,减少因操作不当引起的不良事件。 3、根据发生的问题从源头上、从流程制度上解决不良事件。同时,在选用医疗
医疗器械不良事件监测及报告制度
医疗器械不良事件监测及报告制度 一、医疗器械不良事件是指:获准上市的、合格的医疗器械在正常使用情况下,发生任何与医疗器械预期使用效果无关的有害事件。 二、医疗器械不良事件的监测是指对可疑医疗器械不良事件的发现、报告、评价和控制的过程。医疗器械不良事件监测工作,是预防医疗器械不良事件重复发生和蔓延,保证人民生命安全的重要工作。 三、为加强医疗器械的安全监管,规范医疗器械不良事件报告管理,发现可疑不良事件及时处置,并按规定上报,保障医疗器械临床使用安全,根据《医疗器械监督管理条例》及《昆明市医疗机构医疗器械质量管理规范》的相关规定,制定本制度。 四、医院成立医疗器械不良事件监测领导小组,完善管理制度,组织落实上级有关法律法规的培训工作,指导医院医疗器械不良事件监测工作的开展,监督、检查,确保医疗器械使用安全有效。 五、临床科室健全完善监测体系。科主任、护士长为科室医疗器械不良事件监测的负责人,指定专人做好医疗器械使用的详细登记,并对不良事件的信息进行收集,整理、上报。 六、报告医疗器械不良事件应当遵循可疑即报的原则。 七、医院各临床科室、门诊在诊疗过程活动中如发现医疗器械不良事件时,应立即停止使用,封存,向医疗器械管理科室报告。
八、医疗器械管理科室接到报告后应及时安排相关人员开展工作,对不良事件进行调查、分析、评价,在事件发生24小时内向省市药监局进行网络直报,填写《医疗器械不良事件报告表》交医院及卫生局主管部门,不得擅自处理。 九、根据不良事件的调查情况,医疗器械管理科室应及时向院内各相关科室通报,以引起警惕,避免造成新的伤害。 十、临床科室如对医疗器械不良事件隐瞒不报,经查实后根据情节轻重进行处罚。
医疗器械不良事件报告制度完整版
医疗器械不良事件报告制度 为了加强对医疗器械的监督管理,严格医疗器械的质量跟踪检测工作,保证医疗器械的安全、有效,依据《黑龙江省农垦总局总医院关于规范医疗器械管理使用的实施方案》,特制订制度 一、基本概念 医疗器械不良事件:是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。医疗器械不良事件主要包括医疗器械已知和未知作用引起的副作用、不良反应及过敏反应等。副作用:是治疗使用的医疗器械所产生的某些与防治目的无关的作用。 医疗器械不良事件监测:指对医疗器械不良事件的发现、报告、评价和控制的过程。医疗器械与药品一样具有一定的风险性,特别是那些与人体长时间接触、长期使用、植入人体内的医疗器械,在其对疾病诊治的同时,不可避免地存在着相应风险。只有通过医疗器械上市后,在使用中发生的不良事件的监测和管理,最大限度地控制医疗器械潜在的风险,保证医疗器械安全有效的使用。 二、报告原则 (一)基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所用的医疗器械有关,需要按可疑医疗器械不良事件报告。 严重伤害包括三种情况: 1.危及生命
2.导致机体功能的永久性伤害或者机体结构的永久性损伤。 3.必须采取医疗措施才能避免上诉永久性伤害或者损伤。 (二)濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时,会造成患者、使用者或其他人员死亡或严重伤害,则也需报告。 (三)可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。报告事件可以是与使用医疗器械有关的事件,也可以是不能排除与医疗器械无关的事件。 三、报告时限及流程 (一)报告时限 突发、群发不良事件立即报告,并在24小时内填报《可疑医疗器械不良事件报告表》; 死亡事件:发现或者知悉之日起2个工作日内报告; 严重伤害或可能导致死亡或严重伤害事件:发现或者知悉之日起10个工作日内向市中心报告。 (二)报告流程 1、各临床科室设置医疗器械不良事件报告员,医务科设置医疗器械不良事件联络员,联络员建立于哈尔滨市药品不良反应监测中心联系及《医疗器械不良事件监测系统》网络直报的账号。 2、各临床科室报告员收集本科室不良事件的信息,按报告原则完整、准确、详细填写《可疑医疗器械不良事件报告表》,按时限要求上报医务科联络员。联络员立即进行网络直报,同时打电话通知哈尔滨市药品不良反应监测中心审核。 3、联络员要每月定期与临床相关科室进行沟通,了解医疗器
医疗器械不良反应总结
医疗器械不良反应总结 医疗器械不良反应总结怎么写,以下是XX精心整理的相关内容,希望对大家有所帮助! 医疗器械不良反应总结20XX年上半年,全院共上报药品不良反应43例,医疗器械监测报表零报告。 一、医疗器械不良反应相关情况分析 根据《医疗器械不良反应监测和在评价管理办法(试行)》的工作要点,应坚持“可疑即报”原则,增加报告数量,以推广“医疗器械不良反应事件监测系统”为契机,大力提高报告质量,要求二级及二级以上医疗机构都要突破零报告,而我院医疗器械不良反应事件监测上报为零报告。结合我院实际情况分析,我院医疗器械监测报表为零报告的原因可能为以下几点: 1.医务人员对药品与医疗器械不良反应事件监测概念模糊,不能准确定义不良反应事件,导致漏报; 2. 科室隐瞒不报医疗器械不良反应事件,由于未造成不良后果,未引起科室重视并上报; 3. 没有医疗器械不良反应事件 针对这一情况,应进一步加强度医疗器械不良反应事件监测工作的组织领导,对医疗器械不良事件报告管理职责分别进行梳理和明确,要求各科室发现或知悉医疗器械不良事件后,在规定时限内及时上报,建立并保存医疗器械不良事
件监测记录;不断创新,进一步完善医疗器械不良反应事件监测体系;加强医务人员对药品与医疗器械不良反应事件监测概念的宣传,组织专家对医务人员进行相关医疗器械不良反应事件的培训,提高医务人员对医疗器械不良反应事件监测的上报意识。 二、药品不良反应报告情况分析 20XX年上半年药品不良反应监测报表共有43例,具体分布如下表: 根据医院开放床位数、年住院病人人次,医院每年应上报450例,而医院上半年仅上报43例,大部分科室只有1例,更有部分外科上半年为“零上报”,未能完成了药品不良反应的监测工作。 上报例数过少说明了我院药品不良反应监测工作中存在不少问题,主要是医务人员对“零上报”的理解不足,认为“零上报”就是不上报;然后是医务人员在发生药品不良反应时怕受惩罚,隐瞒不报;还有药品不良反应的上报机制不够完善,间接导致迟报或漏报。医院需进一步完善相关制度,狠抓落实相关措施,努力提高全院药械不良反应监测水平,即以下四个方面: 1、要加强宣传,开展多种形式的教育培训活动。对各科室进行宣传,不断提高他们对做好药品不良反应监测工作重要意义的认识。同时,要积极聘请专家就有关方面知识进
医疗器械不良事件分析模板
事件调查情况: 1.事件调查方案:在接到反馈后,立即通知公司不良事件工作小组,工作小组安排如下: 1.1市场部联系XX医院,获取上报人联系方式,并找到相应医生收集患者资料;同时统计该批次产品销售情况,销售科负责统计XX批次的销售记录并及时与相应经销商联系; 1.2质管科对该批次产品的生产及检验记录进行收集、核对;技术科核对该产品说明书,确认产品质量是否符合产品的技术要求,待院方提供相关资料分析产品使用情况及事件原因; 1.3质管科对以往产品不良事件信息汇总分析,确认是否有相类似不良事件及客户反馈情况; 1.4技术科对同批次的库存产品进行分析,初步分析问题发生的原因; 1.5市场部人员与XX医院联系,确认此次涉及锁定板钉系统在患者二次手术锁定板取出后产品是否可以退回; 1.6销售科销售人员根据此批次的销售记录进行市场调查,确认此批次产品是否有类似的临床情况反馈。 2.调查过程(情况): (1)XX年XX月XX日市场部根据收到的可疑不良事件信息及调查方案(以下简称方案)1.1的要求,立即对XX批次的销售记录进行了分析,从XX年XX月XX日到XX年XX月XX日,批号为XX的锁定板钉系统(锁骨重建YSM27型12孔右)共计销售XX件,目前仓库无库存。
(2)根据“方案”1.5要求,市场部人员与XX医院进行了充分的沟通确认产品。患者发现在右肩部隐痛,于XX年XX月XX日前往该院放射科检查,发现钢板断裂,根据院方反馈情况,院方未提供患者第二次手术的详细资料(院方称对方未在该医院进行二次手术,无法收集到资料),无法了解由于何种原因导致患者钢板断裂。因断裂的锁定板未能获取,我司无法对断板进行试验分析。 (3)根据“方案”1.2要求,质管科结合现场操作对XX批次的产品记录进行了跟踪调查,检查涉及产品实现的全部过程,该批产品在生产过程中严格执行进料检查、过程检验(首检、巡检、完工检)及成品检验,经过记录追溯及现场检查,产品实现过程各项记录及参数无异常,产品性能检测均符合要求。技术科核对该产品说明书,确认产品质量符合产品的技术要求。 (4)根据“方案”1.3要求,质管科对我司以往锁定板钉系统的不良事件信息汇总分析,通过对历年产品使用情况反馈信息(包括产品售后服务记录、顾客满意度调查记录、顾客投诉和抱怨记录、市场用户信息反馈等)可知该产品自注册生产销售以来,用户在以往的产品使用过程中,无因产品质量问题引起的不良事件及客户反馈情况。(5)根据“方案”1.6要求,销售科销售人员根据此批次的销售记录进行市场调查,确认此批次产品无类似的临床情况反馈。 事件原因分析: 发生断裂多为应力集中锁定板疲劳断裂。主要有三方面原因: 1.锁定板质量问题;
医疗器械不良反应报告表
v1.0 可编辑可修改 附件1: 《可疑医疗器械不良事件报告表》及填写要求 可疑医疗器械不良事件报告表 报告日期:年月日编码: 报告来源:生产企业经营企业使用单位单位名称: 联系地址: 邮编:联系电话:A.患者资料 1.姓名:2.年龄: 3.性别男女 4.预期治疗疾病或作用: B.不良事件情况 5.事件主要表现: 6.事件发生日期:年月日 7.发现或者知悉时间:年月日 8. 医疗器械实际使用场所: 医疗机构家庭其他(请注明): 9.事件后果 死亡(时间); 危及生命; 机体功能结构永久性损伤; 可能导致机体功能结构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其他(在事件陈述中说明)。
v1.0 可编辑可修改 报告人:医师技师护士其他16. 操作人:专业人员非专业人员患者其他(请注明): 23.事件报告状态: 已通知使用单位已通知生产企业 已通知经营企业已通知药监部门
报告人签名: 国家食品药品监督管理局制 填写要求 《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。 1.题眉 A.报告日期:是指填报人填报该次不良事件时的确切时间。 B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式: 省(区、市)年份流水号 □□□□□□□□□□□ 注:省(区、市)编码按中华人民共和国行政区划代码填写。在医疗器械不良事件监测系统中,编码由系统自动生成。 C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。 D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。 E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。 2.患者资料 A.患者姓名:是指患者真实全名。若患者姓名无法获知,应填写未知;新生儿无姓名,应填写××子或××女。 B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。若患者年龄小于1岁,应填写具体的月份或天数,如6个月。 C.性别:是指患者的性别,填写时请选择相应的选项,并在“□”中划“√”。 D.预期治疗疾病或作用:是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用,例如血管内支架用于治疗急性心肌梗死。 3.不良事件情况 A.事件主要表现:是指使用医疗器械后引发的、可能与该医疗器械使用有关的有害事件(且与质量、医疗事故无关)。填写不良事
常用医疗器械及其可疑不良事件汇总
常用医疗器械及其可疑不良事件 2013-9-25 1.我国较有代表性的医疗器械不良事件是哪些? 在我国,影响力大、涉及面广、具有代表性的医疗器械不良事件是1998年后出现的角膜塑形镜(OK镜)不良事件和聚丙烯酰胺水凝胶不良事件。 2. 家庭中常用的医疗器械有哪些? 家庭中常用的医疗器械主要有血压计、体温计、血糖仪、隐形眼镜、胰岛素注射笔等。 3.血压计在使用中可能会发生哪些可疑不良事件? 血压计是测量血压的仪器,主要分为水银柱式血压计和电子(无液)血压计两大类。血压计在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为测量结果不准确、间断性黑屏、不显示血压值等。 4.体温计在使用中可能会发生哪些可疑不良事件? 体温计是测量体温的仪器,主要形式有玻璃体温计、电子体温计和红外体温计。体温计在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为测量结果不准确、水银柱不上升/下降、不能计数等。 5.血糖仪在使用中可能会发生哪些可疑不良事件? 血糖仪是糖尿病患者自我血糖监测而使用的仪器,其在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为血糖测量值不准确、血糖值显示不清晰、屏幕不显示等。 6.胰岛素注射笔在使用中可能会发生哪些可疑不良事件? 胰岛素注射笔是糖尿病患者胰岛素治疗中理想的注射用具,其前端是注射针头,后面的套筒则装有胰岛素,套筒容积大小根据胰岛素的种类而不同。胰岛素注射笔在
使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为注射部位疼痛、注射针头漏液、推动困难、笔芯密封不严、笔芯变色等。 7.隐形眼镜在使用中可能会发生哪些可疑不良事件? 隐形眼镜是一种戴在眼球角膜上,用以矫正视力或保护眼睛的镜片,其在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为眼睛干涩、红肿、疼痛、流泪、畏光、视物不清、充血、刺激感等。 8.血管内支架在使用中可能会发生哪些可疑不良事件? 血管内支架主要用于大动脉瘤性血管狭窄、闭塞,外压性动静脉狭窄、闭塞,动脉瘤,动脉夹层、器官移植术后的血管狭窄,动脉粥样硬化性狭窄、闭塞等疾病的治疗。血管内支架在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为支架脱载、无再流、支架内血栓形成、再狭窄等。 9.骨科植入物在使用中可能会发生哪些可疑不良事件? 骨科植入物主要包括骨接合植入物及骨与关节植入物。 骨接合植入物主要包括接骨板、接骨螺钉、髓内针、矫形用棒、矫形用钉、带锁髓内针、脊柱内固定植入物等。 骨与关节植入物主要包括人工髋关节、人工膝关节、人工肘关节等。 骨科植入物在使用过程中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为植入物变形、折弯、断裂、松动、脱落、磨损等。 10.人工心脏瓣膜在使用中可能会发生哪些可疑不良事件? 人工心脏瓣膜用于瓣膜损坏,适用于严重影响循环系统功能的疾病,如风湿性心脏病、先天性畸形、遗传性疾病、外伤等,其在使用中可能会发生导致或者可能导致人体伤害的可疑不良事件,主要表现为开放性卡瓣、瓣叶脱落、碟片被卡、瓣膜狭窄、血栓栓塞等。 11.宫内节育器在使用中可能会发生哪些可疑不良事件? 宫内节育器是置入人体进行妊娠控制的医疗器械,其在使用中可能会发生导致或
医疗器械不良事件处理预案
医疗器械不良事件处理预案 为了有效预防、及时控制和消除医疗器械不良事件的危害,保障公众身体健康与生命安全,根据《医疗器械不良事件监测和再评价管理办法(试行)》及其它有关法律、法规,制订本预案,指导和规范我院医疗器械不良事件处理工作。 一、指导原则 (一)预防为主,常备不懈,提高我院防范医疗器械不良事件的意识,落实各项防范措施,做好人员、技术、物资和设备的应急储备工作。对医疗器械不良事件的情况要及时进行分析,做到早发现、早报告、早处理。 (二)统一领导,分级负责,根据医疗器械不良事件的范围、性质和严重程度,对医疗器械不良事件实行分级管理。我院医疗器械不良事件监测管理小组负责全院医疗器械不良事件的统一领导,各有关部门按照预案规定,在各自的职责范围内做好医疗器械不良事件处理的有关工作。 (三)依法规范,及时反应,完善医疗器械不良事件应急预案体系,为医疗器械不良事件应急处理工作提供系统、科学的制度保障。各有关部门要按照相关规章的规定,对医疗器械不良事件做出快速反应,及时、有效地开展监测、报告和处理工作。 (四)依靠科学,依靠群众,开展医疗器械不良事件防范和处理的培训,为医疗器械不良事件应急处理提供先进、完备的保障。加强
医疗器械不良事件的教育,提高公众的防范意识和能力,组织、动员公众广泛参与医疗器械不良事件的监测及处理。 二、组织机构及职责 (一)医疗器械不良事件监测管理小组 由主管行政领导、相关专业知识的专家组成。其组成、改组和成员的任命由医院医学装备管理委员会负责。协调临床科室、医学工程部、护理部关系,指导我院医疗器械不良事件工作。监督医疗器械不良事件监测日常工作。对严重、特殊或疑难病例进行讨论并给予评价。 监测管理小组的日常具体工作由医学工程部负责,具体组成人员如下:组长;分管副院长 成员:医学工程部主任、质控办主任、医务部主任、护理部主任、医学工程部副主任及相关科室人员 (二)管理小组下设办公室办公室主任:医学工程部主任副主任:医学工程部副主任成员; (三)全院医疗器械不良事件监测网络 各临床科室设立2名兼职监测员(安全管理员)(医生、护士各1人),医学工程部各有关部门指定1名兼职监测员共同组成我院不良事件监测网络系统。 三、医疗器械不良事件的报告、通报与信息发布 (一)医疗器械不良事件的报告:报告医疗器械不良事件应当遵循可疑即报的原则。在我院区域内发生的医疗器械不良事件应逐级、定期报告,必要时可以越级报告。其中,导致死亡的事件于发现或者
医疗器械不良事件分析总结
医疗器械不良事件分析总结 2013年医疗器械不良事件报告工作在全院临床及相关科室共同努力下,取得一定成果和进步。今年共计收到临床科室主动上报的医疗器械不良事件12例。2013年医疗器械不良事件的发生数量不多、严重程度不大,说明在不良事件的管理上,科室给予一定程度重视,加强了培训,以及我们医院所选用的医疗器械质量过硬,从而收到了一定效果。 一、不良事件统计:(一)护理类耗材:1、一次性使用无菌导尿包共4例;2、一次性使用无菌注射器(带针)共2例;3、一次性使用无菌导尿管共2例;4、一次性使用乳胶导尿管共1例;5、一次性使用无菌注射器共1例。(二)透析及透析管路:1、穿刺针(德朗)共1例。(三)其他周边医用耗材:1一次性使用心电电极共1例。 二、原因分析:1、分析今年不良事件发生的原因,主要是由医疗器械的质量所造成。2、临床科室使用时,不完全按照正确的操作流程操作也会造成不良事件的发生。3、其他个别情况造成不良事件的发生,例如过敏体质的患者使用卫生耗材时发生过敏反应;医疗器械在搬运时发生碰撞,从而影响到使用等。 三、改进方法:1、继续鼓励不良事件主动上报,发生不良事件后,及时积极与相关部门和人员合作,将患者的损害降到最低,最大限度的保障患者的生命安全。对于经常或者特别严重的医疗器械不良事件,要在医院会议上讨论,将个别经验教训作为教材,在全院引起重视。2、加强重点人员的管理,加强年轻科室人员能力培训,规范各项操作规程,正确使用医疗器械。工作时做到井然有序,减少因操作不当引起的不良事件。3、根据发生的问题从源头上、从流程制度上解决不良事件。同时,在选用医疗器械时,要提供符合安全标准的器具、材料或耗材。减少或者避免同类的医疗器械不良事件的发生。
医疗器械不良事件监测管理制度
文件名称医疗器械不良事件监测管理制度 文件编号QG/LI8.2.3-01 版次A/0 拟制拟制日期年月日审核审核日期年月日批准批准日期年月日发放号码生效日期年月日发放范围生产部、行政人事部、销售部、质量管理部、采购部、研发部 1、目的 根据《医疗器械不良事件监测和再评价管理办法(试行)》等规定,加强公司医疗器械不良事件的监督管理,特制订本办法。 2、适用范围 适用于医疗器械不良事件的发现、收集、调查、评价、报告、控制、再评价、应急预案。 3、管理机构 医疗器械不良事件监测工作依托质量管理部: 组长:总经理 副组长:管理者代表 联络员:质量管理部经理(负责医疗器械不良事件监测工作) 成员:研发部经理、销售部经理、生产部经理、行政人事部经理 并履行以下主要职责: (1)负责公司医疗器械不良事件监测管理工作的规划和相关制度的制定、修改、监督和落实; (2)负责公司医疗器械不良事件监测管理的宣教工作; (3)研究分析医疗器械不良事件监测管理工作的动态和存在问题; (4)制定突发、群发的医疗器械不良事件,尤其导致死亡或者严重伤害不良事件的应急预案; (5)对于上报的不良事件,组织讨论,制定应对措施; (6)通报传达上级医疗器械不良事件监测技术机构的反馈信息。 4、部门职责 4.1质量管理部为医疗器械不良事件监测工作的管理部门,质量管理部经理具体负责日常
医疗器械不良事件监测工作,总经理为公司医疗器械不良事件监测工作总负责人。质量管理部承担对不良事件进行调查与评价,并对不良事件报告评定处理的过程及结果验证,并监督纠正或预防措施的实施。 4.2销售部负责不良事件信息的发现、收集。 4.3 总经理负责相关审批。 4.4 行政人事部负责医疗器械不良事件的档案管理。 5、相关定义 5.1医疗器械不良事件:是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。 5.2医疗器械不良事件监测:指对医疗器械不良事件的发现、报告、评价和控制的过程。 5.3医疗器械不良事件按照事件后果可分为一般医疗器械不良事件和严重医疗器械不良事件。严重医疗器械不良事件,是指事件后果有下列情况之一者: (一)导致死亡; (二)危及生命; (三)导致机体功能的永久性伤害或者机体结构的永久性损伤; (四)必须采取医疗措施才能避免上述永久性伤害或者损伤; (五)由于医疗器械故障、可用性等问题可能导致上述所列情况的。 上述情形之外的医疗器械不良事件为一般医疗器械不良事件。 6、工作程序 6.1医疗器械不良事件的发现与收集 销售部通过与用户联系,也可通过电话、传真、网络反馈的用户投诉及收集国内外监管部门发布的有关信息等渠道,方便用户提供医疗器械不良事件及时跟踪上市产品所有可疑的不良事件。应详细填写《可疑医疗器械不良事件收集记录表》并将结果及时反馈给质量管理部。 6.2产品的隔离 在正式调查结果没有公布之前,质量管理部应即刻起对该批产品进行封存和隔离,同时向公司总经理汇报。 6.3医疗器械不良事件的调查和评价 质量管理部负责按轻重缓急对不良事件进行分析、调查和评价,以确定是否为不良事件。在正式调查结果没有公布之前,质量管理部应即刻起对该批产品进行封存和隔离,同
医疗器械不良反应事件监测报告管理制度
医疗器械不良反应事件监测报告管理制度 为加强我院医疗器械安全监测和管理,规范我院医疗器械不良反应事件报告和管理制度,根据国家食品药品监督管理司《医疗器械不良反应报告和监测管理办法》及国家相关法规及管理办法,制定制度如下。 1、组织领导 医院成立医疗器械不良反应监测管理小组,领导和组织全院医疗器械不良反应事件的处理。监测管理小组的日常具体工作由医疗器械科负责。 2、报告范围 发生以下医疗器械不良反应事件必须报告监测管理小组: (1)医疗器械不良反应(合格医疗器械正常用法的 意外有害后果)。 (2)医疗器械质量缺陷(假、劣)导致的不良反应 事件。
(3)使用不当导致的不良反应事件。 3、医疗器械不良反应的报告程序 (1)医疗器械不良反应事件实行逐级、定期报告制 度。必要时,可采取越级报告制度。 临床科室发现医疗器械不良反应必须及时报告。 (2)医院建立医疗器械不良反应监控网络,由各临 床科室制定专人负责医疗器械不良 反应联络工作(科室联络员),负责本科室的医疗器械不良反应的搜集、汇总、上报,监督协调医护人员不良反应的报告。 (3)各临床科室医护人员应高度重视医疗器械不 良反应事件的报告和监测工作,密切 关注和发生随时收集本科的医疗器械不良反应,一经发现医疗器械不良反应须及时进行详细记录、调查,及时准确填写《可疑医疗器械不良事件报告》,并按规定将填好表格上交科室联络员或医院医疗器械不良反应监测管理小组。
(4)发现严重、罕见的不良反应病例,应先经医护 人员诊治和处理,并做好医疗器械 的留样、保存和记录工作,在24小时内报告给本科不良反应联络员和医院医疗器械不良反应监测管理小组,其中死亡病例必须在8小时内报告。 (5)发现医疗器械严重不良反应或群体不良事件 或死亡病例须在8小时内报告给本科 不良反应联络员和医院医疗器械不良反应监测管理小组,并及时填写《医疗器械突发性群体不良事件基本信息表》。 (6)医院医疗器械不良反应事件监测管理小组安 排专门人员及时收集、整理,并按规 定日期向国家医疗器械不良反应监测中心报告。一般医疗器械不良反应每月集中上报,新的或严重的医疗器械不良反应于48小时内上报,可疑死亡病例12小时内上报,群体不良反应立即上报。 4、医疗器械不良反应事件的改进管理
医疗器械不良事件控制程序.doc
1 目的 对不良事件的监测、报告、处理和发布忠告性通知进行控制。 2范围 公司产品在临床过程中或销售后发生的技术隐患、问题和各部门通报的不良事件。 3定义 不良事件 发生的或可能发生的任何与产品预期使用效果无关的有害事件。 忠告性通知 产品上市后,由企业发布的通知,旨在以下方面给出补充信息或建议采取的措施:产品使用时应注意的补充事宜; 产品的改动 产品的销毁 不良事件分为一般不良事件、严重不良事件、不良反应、严重不良反应。 一般不良事件 患者或相关接触人员发现有非预期的病状或副作用出现时,但尚未达到严重不良事件的条件。这种症状无论是否与产品相关均属于不良事件(例如操作不当、未按说明规定使用、或与医疗器械不相干的病症等)。 严重不良事件 患者或相关接触人员发现有如下非预期的病状或副作用出现时,这种症状无论是否与产品相关均属于严重不良事件。包括以下几种情况: 死亡;
危及生命; 导致病人住院或延长住院时间; 导致永久或严重残疾 / 功能障碍; 导致先天异常或畸胎;影响工作能力或导致先天畸形; 其他严重症状的。 不良反应和严重不良反应 4职责 市场部负责同不良事件的各相关方(患者、医疗机构相关技术专家、国家 管理当局、公 司各职能部门)进行协调,及时通报或汇报不良事件处理的进展和相关信息。负责整理和保存不良事件处理的一切资料。 市场部负责组织相关部门对产品上市后风险的分析、再评价。 总经理批准忠告性通知和批准上报不良事件,并授权市场部对外发布有关信息。 其他相关部门按总经理和市场部的要求参与调查、处理和改进工作。 5作业流程 不良事件的收集方法及监测 市场部接到客户有异常情况时应及时反馈公司,市场部进一步调查、核 实,如有可疑不良事件应及时报备总经理。 各相关部门应将在生产、检验、过程中发现的问题及时反馈至市场部。 市场部在与客户沟通时收集相关信息,如有异常情况应及时报备总经理。 不良事件报告原则
医疗器械不良反应报告表
附件1: 令狐采学 《可疑医疗器械不良事件报告表》及填写要求 可疑医疗器械不良事件报告表 报告日期:年月日编码: 报告来源:生产企业经营企业使用单位单位名称: 联系地址: 邮编:联系电话: A.患者资料 1.姓名:2.年龄: 3.性别 男 女 4.预期治疗疾病或作用: B.不良事件情况 5.事件主要表现: 6.事件发生日期:年月日 7.发现或者知悉时间:年月日 8. 医疗器械实际使用场所: 医疗机构 家庭 其他(请注明): 9.事件后果 死亡(时间); 危及生命; 机体功能结构永久性损伤; 可能导致机体功能结构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其他(在事件陈述中说明)。 10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
报告人签名: 国家食品药品监督管理局制 填写要求 《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。 1.题眉 A .报告日期:是指填报人填报该次不良事件时的确切时间。 B .编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式: 省 (区、市) 年 份 流水号 □□□□□□□□□□ □ 注:省(区、市)编码按中华人民共和国行政区划代码填写。在医疗器械不良事件监测系统中,编码由系统自动生成。 C .报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。 D .单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。 报告人: 医师 技师 护士 其他
医疗器械不良事件基础知识问答.doc
医疗器械不良事件基础知识考试卷 姓名:得分: 一、填空题(10题,共60分)。 1、医疗器械不良事件报告原则:(1)造成患者、使用者或其他人员死亡、严 重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要报告。 (2)有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为同类事件再次发生时会造成患者、使用者死亡或严重伤害,则也需要报告。 (3)在不清楚是否属于医疗器械不良事件时,按可疑即报原则报告。这些事件可以是与使用的医疗器械有关,也可以是不能排除事件的发生和医疗器械无关。 2、医疗器械生产企业、经营企业和使用单位应当建立并保存医疗器械不良事件监测记录。记录应当保存至医疗器械标明的使用期后年,但是记录保存期限应当不少于 年。 3、医疗安全不良事件报告原则、、。 4、报告医疗器械不良事件应当遵循的原则。 5、医疗器械不良事件后,应当填写。 6、医疗安全不良事件上报形式、、。 7、医疗安全不良事件分为个等级。 8、医疗器械不良事件监测,是指对医疗器械不良事件的、、和的过程。 9、医疗器械不良事件报告的内容和统计资料是加强,指导开展医疗器械再评价工作的依据,不作为医疗纠纷、医疗诉讼和处理医疗器械质量事故的依据。 10、发生医疗器械不良事件的原因非常复杂,有产品固有风险中的设计缺陷,有、,有产品使用说明书上的错误,有上市前研发的局限性等。
二、问答题(3题,共40分) 1.什么是医疗器械不良事件? 2.医疗器械不良事件监测的目的是什么? 3.报告医疗器械不良事件应遵循什么原则?
医疗器械不良事件基础知识答案 一、填空题 1、(1)基本原则(2)濒临事件原则(3)可疑即报原则 2、 2 5 3、自愿性、保密性、非惩罚性 4、可疑即报 5、《可疑医疗器械不良事件报告表》 6、书面报告、网络直报、紧急电话报告 7、4 8、发现、报告、评价控制 9、医疗器械监督管理 10、器械性能功能故障或损坏 二、问答 1.医疗器械不良事件,是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。 2.医疗器械不良事件监测旨在通过对医疗器械使用过程中出现的可疑不良事件进行收集、报告、分析和评价,对存在安全隐患的医疗器械采取有效的控制,防止医疗器械严重不良事件的重复发生和蔓延,保障公众用械安全。 3.报告医疗器械不良事件应当遵循可疑即报的原则。
