全血基因组DNA提取试剂盒使用说明

全血基因组DNA提取试剂盒使用说明
货号:D1800
规格:50T/100T
保存:室温(15℃-25℃)干燥保存,复检期12个月,2℃-8℃保存时间更长。
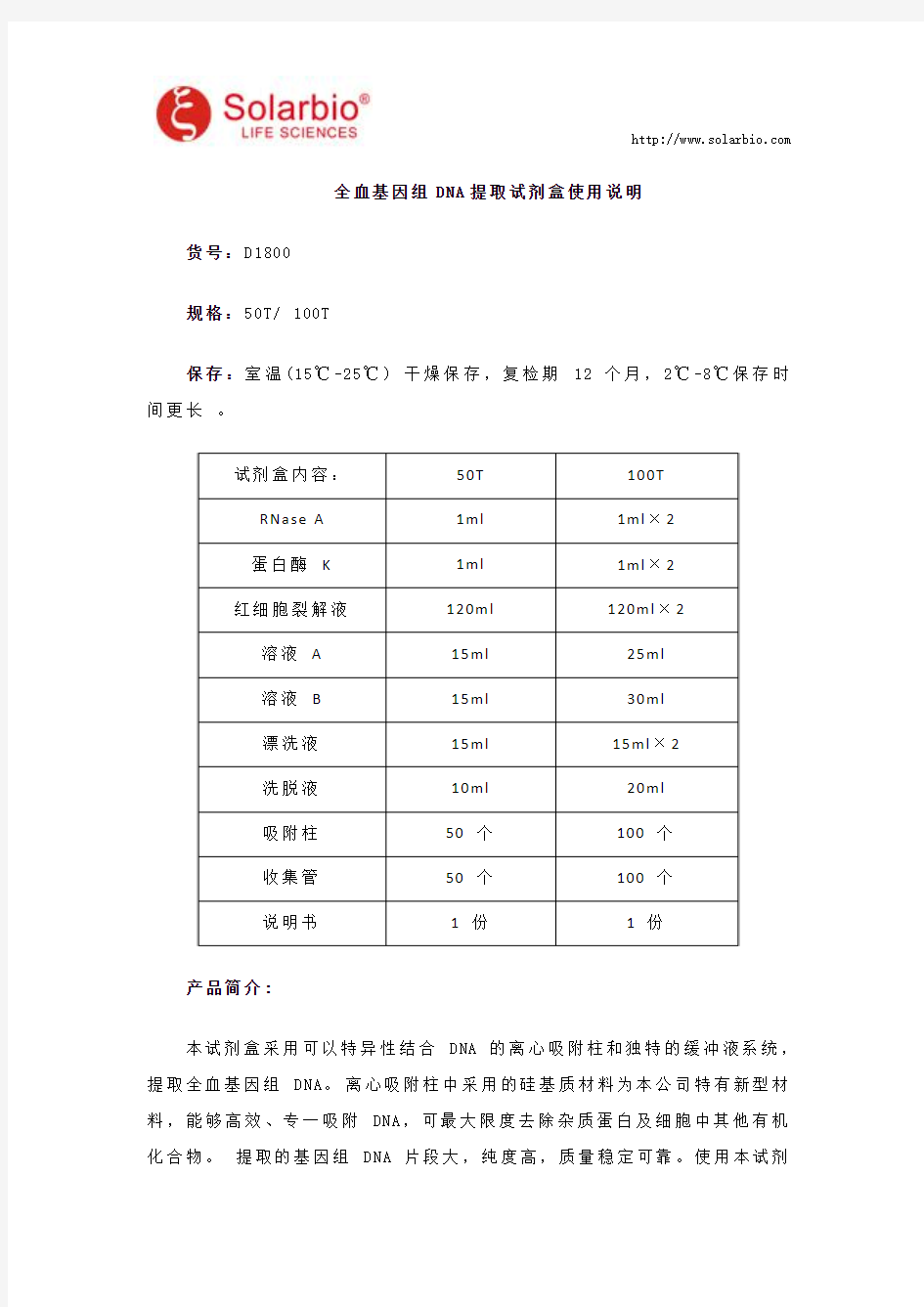
试剂盒内容:50T100T
RNase A1ml1ml×2
蛋白酶K1ml1ml×2
红细胞裂解液120ml120ml×2
溶液A15ml25ml
溶液B15ml30ml
漂洗液15ml15ml×2
洗脱液10ml20ml
吸附柱50个100个
收集管50个100个
说明书1份1份
产品简介:
本试剂盒采用可以特异性结合DNA的离心吸附柱和独特的缓冲液系统,提取全血基因组DNA。离心吸附柱中采用的硅基质材料为本公司特有新型材料,能够高效、专一吸附DNA,可最大限度去除杂质蛋白及细胞中其他有机化合物。提取的基因组DNA片段大,纯度高,质量稳定可靠。使用本试剂
盒提取的基因组DNA可用于各种常规操作,包括酶切、PCR、文库构建、Southern杂交等实验。
操作步骤:
使用前请先在漂洗液和溶液B中加入无水乙醇,加入体积请参照瓶体上的标签。所有离心步骤均为使用台式离心机在室温下离心。
1、样品的处理(本产品适用于处理新鲜的或已经添加抗凝剂的0.lml-1ml血液样品):
a、在血液样品中加入2-3倍体积的红细胞裂解液,充分颠倒混匀,12000rpm离心1min,小心吸去上清,沉淀应为白色或淡红色,如果裂解不彻底,可重复以上述步骤一次。向沉淀中加200ul溶液A,振荡至彻底混匀。
b、如果处理的血样为禽类、鸟类、两栖类或更低级生物的血液,其红细胞为有核细胞,因此处理量为5-20u1,不需要再用红细胞裂解液处理,直接加200ul溶液A,振荡至彻底混匀。
2、向悬浮液中加入20ul(10mg/ml)的RNase A,充分颠倒混匀,室温放置10min。
3、加入20ul(10mg/ml)的蛋白酶K,充分颠倒混匀,65℃水浴消化30-60min,消化期间可颠倒离心管混匀数次,直至样品消化完全为止。
4、加入2倍体积溶液B(使用前请先检查是否己加入无水乙醇),充分颠倒混匀,此时可能会出现絮状沉淀,不影响DNA的提取,可将溶液和絮状沉淀都加入吸附柱中,室温放置2min。
5、12000rpm离心2min,弃废液,将吸附柱放入收集管中。
6、向吸附柱中加入700ul漂洗液(使用前请先检查是否已加入无水乙醇),12000rpm离心1min,弃废液,将吸附柱放入收集管中。
7、向吸附柱中加入500ul漂洗液,12000rpm离心1min,弃废液,将吸附柱放入收集管中。
8、12000rpm离心2min,将吸附柱敞口置于室温或50℃温箱放置数分钟,目的是将吸附柱中残余的漂洗液去除,否则漂洗液中的乙醇会影响后续的实验如酶切、PCR等。
9、将吸附柱放入一个干净的离心管中,向吸附膜中央悬空滴加50-200ul 经65℃水浴预热的洗脱液,室温放置5min,12000rpm离心1min。
10、离心所得洗脱液再加入吸附柱中,12000rpm离心2min,即可得到高质量的基因组DNA。
注意事项:
1、本试剂盒置于室温(15-25℃)干燥条件下可保存12个月,更长时间的保存可置于2-8℃。
2、常用的血液抗凝剂有EDTA、ACD和肝素等,需注意的是,如欲制备大分子量血液基因组DNA,可优先考虑使用ACD抗凝。一般不使用肝素抗凝,因为用肝素抗凝的血液提取的基因组DNA进行PCR扩增时,有PCR扩增抑制现象。
3、样品应避免反复冻融,否则会导致提取的DNA片段较小且提取量也下降。
4、如果试剂盒中的溶液出现沉淀,可在65℃水浴中重新溶解后再使用,不影响效果。
5、绝大多数哺乳动物的全血如入全血中的红细胞无核,故在提取基因组DNA时需去除不含DNA的无核红细胞,以免影响红细胞裂解和DNA释放。如果处理的血样为禽类、鸟类、两栖类或更低级生物的血液,其红细胞为有核细胞,因此处理量减少为5-20ul,不需要再用红细胞裂解液来裂解红细胞。
6、洗脱缓冲液的体积最好不少于50ul,体积过小会影响回收效率:洗脱液的pH值对洗脱效率也有影响,若需要用水做洗脱液应保证其pH值在8.0左右(可用NaOH将水的pH值调至此范围),pH值低于7.0会降低洗脱效率。
相关试剂:
D1850全血基因组DNA提取试剂系统
D10106×DNA Loading Buffer
T106050×TAE缓冲液
T10505×TBE缓冲液
M1060D2000DNA Ladder
M14001kb DNA Ladder
G8142GoldView II型核酸染色剂(5000×)
植物基因组DNA提取试剂盒(北京天根)
植物基因组DNA提取试剂盒 1 取植物新鲜组织约100 mg或干重组织约30 mg,加入液氮充分研磨。 2 将研磨好的粉末迅速转移到预先装有700 μL 65℃预热缓冲液GP1的离心管中(实验前在预热的GP1中加入巯基乙醇,使其终浓度为0.1%),迅速颠倒混匀后,将离心管放在65℃水浴20 min,水浴过程中颠倒离心管以混合样品数次。 3 加入700 μL氯仿,充分混匀,12,000 rpm(~13,400×g)离心5 min。 注:若提取富含多酚或淀粉的植物组织,可在第3步前,用酚:氯仿/1:1进行等体积抽提。 4 小心的将上一步所得水层上相转入一个新的离心管中,加入700 μL缓冲液GP2,充分混匀。 5 将混匀的液体转入吸附柱CB3中,12,000 rpm(~13,400×g)离心30 s,弃掉废液。(吸附柱容积为700μL左右,可分次加入离心。) 6 向吸附柱CB3中加入500 μL缓冲液GD(使用前请先检查是否已加入无水乙醇),12,000 rpm(~13,400×g)离心30 s,倒掉废液,将吸附柱CB3放入收集管中。 7 向吸附柱CB3中加入600 μL漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm(~13,400×g)离心30 s,倒掉废液,将吸附柱CB3放入收集管中。 8 重复操作步骤7。 9 将吸附柱CB3放回收集管中,12,000 rpm(~13,400×g)离心2 min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。 注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中的乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。 10 将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200 μL洗脱缓冲液TE,室温放置2-5 min,12,000 rpm(~13,400×g)离心2 min,将溶液收集到离心管中。 注意:洗脱缓冲液体积不应少于50 μL,体积过小影响回收率。洗脱液的PH值对于洗脱效率有很大影响。若用水做洗脱液应保证其pH值在7.0-8.5范围内(可以用NaOH将水的pH值调到此范围),pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。为增加基因组DNA的得率,可将离心得到的溶液再加入吸附柱CB3中,室温放置 2 min,12,000 rpm (~13,400×g)离心2 min。
高纯度质粒小量快速提取试剂盒操作方法及步骤说明书
杭州昊鑫生物科技股份有限公司 htpp://https://www.360docs.net/doc/8e1014727.html, HighPure Plasmid Mini Kit 高纯质粒小量快速提取试剂盒 目录号:PL03 试剂盒组成、储存、稳定性: 试剂盒组成保存 50次 (PL0301) 100次 (PL0302) 200次 (PL0303) 平衡液室温5ml 10ml 20ml RNaseA(10mg/ml)-20℃150μl 250μl 500μl 溶液P1 4℃15 ml 25 ml 50 ml 溶液P2 室温15 ml 25 ml 50 ml 溶液P3 室温20 ml 35 ml 70 ml 去蛋白液PE 室温16ml 31.5 ml 63 ml 第一次使用前按说明加指定量乙醇 漂洗液WB 室温15 ml 25ml 50ml 第一次使用前按说明加指定量乙醇 洗脱缓冲液EB 室温10ml 15ml 20ml 吸附柱AC 室温50个100个200个 收集管(2ml)室温50个100个200个 本试剂盒在室温储存12个月不影响使用效果。 储存事项: 1.第一次使用时,将试剂盒所带的全部RNase A加入溶液P1后(终浓度100ug/ml) 置于2-8℃保存。如果溶液P1中RNase A失活,提取的质粒可能会有微量RNA 残留,在溶液P1中补加RNase A即可。 2.环境温度低时溶液P2中SDS可能会析出浑浊或者沉淀,可在37℃水浴加热几分 钟,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。 3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时 盖紧盖子。 产品介绍:
本试剂盒采用改进SDS-碱裂解法裂解细胞,离心吸附柱内的硅基质膜在高盐、低pH值状态下选择性地结合溶液中的质粒DNA,再通过去蛋白液和漂洗液将杂质和其它细菌成分去除,最后低盐、高pH值的洗脱缓冲液将纯净质粒DNA从硅基质膜上洗脱。 产品特点: 1.离心吸附柱内硅基质膜全部采用进口世界著名公司特制吸附膜,柱与柱之间吸附 量差异极小,可重复性好。克服了国产试剂盒膜质量不稳定的弊端。 2.独有的去蛋白液配方,可以高效去除残留的核酸酶,即使是核酸酶含量丰富的菌 株如JM系列、HB101也可以轻松去除。有效防止了质粒被核酸酶降解。 3.快速、方便,不需要使用有毒的苯酚、氯仿等试剂,也不需要乙醇沉淀。获得的 质粒产量高、纯度好,可以直接用于酶切、转化、PCR、体外转录、测序等各种分子生物学实验。 注意事项 1. 所有的离心步骤均在室温完成,使用转速可以达到13,000rpm的传统台式离心机, 如Eppendorf 5415C 或者类似离心机。 2. 提取质粒的量与细菌培养浓度、质粒拷贝数等因素有关。一般高拷贝质粒,建议 接种单菌落于1.5-4.5 ml加合适抗生素的LB培养基,过夜培养14-16个小时,可提取出多达20μg的纯净质粒。如果所提质粒为低拷贝质粒或大于10kb的大质粒,应适当加大菌体使用量,使用5-10 ml过夜培养物,同时按比例增加P1、P2、P3的用量,其它步骤相同。 3. 得到的质粒DNA可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。OD260 值为1相当于大约50μg/ml DNA。电泳可能为单一条带,也可能为2条或者多条DNA条带,这主要是不同程度的超螺旋构象质粒泳动位置不一造成,与提取物培养时间长短、提取时操作剧烈程度等有关。本公司产品正常操作情况下基本超螺旋可以超过90%。 4. 质粒DNA确切分子大小,必须酶切线性化后,对比DNA分子量Marker才可以知 道。处于环状或者超螺旋状态的的质粒,泳动位置不确定,无法通过电泳知道其确切大小。 5. 洗脱液EB不含有螯合剂EDTA,不影响下游酶切、连接等反应。也可以使用水洗 脱,但应该确保pH大于7.5,pH过低影响洗脱效率。用水洗脱质粒应该保存在-
基因组DNA提取方法
1 快速微量提取法A.取1.5ml菌体培养物于一灭菌Ep管中,12000rpm离心1min, 丢去上清夜,收集菌体。 B.加入400ul裂解液(40mMTris-醋酸,20mM醋酸钠,1mMEDTA,1%SDS,pH7.8)混匀,置于37oC水浴1hr。C.然后加入200ul5mol/L的氯化钠溶液,混匀后于13000rpm离心15min。D.取上清液,用苯酚抽提2次,氯仿抽提1次。E.加两倍体积无水乙醇,1/10体积醋酸钾(3M ,pH8.0),-20度保存1小时后,13000rpm离心15min,弃上清液,沉淀用70%乙醇洗2次;置于室温干燥后,溶于50ulTE 溶液中,置4oC保存备用。 2 蛋白酶/SDS法制备先用10ml含适当抗生素的GBM过夜培养Delftia sp.,第二天4000rpm离心10min收集菌体,用Washing TE (50mmol/LTris-HCl pH8.0,10mmol/LEDTA pH8.0)洗菌体2次,之后将菌体充分悬浮在5ml 1×TE缓冲液中,先后加入0.5ml 5mg/L的蛋白酶、0.5ml 10% SDS,轻轻混匀后50℃放置3h~5h,接着用等体积的Tris饱和苯酚抽提2次,苯酚/氯仿/异戊醇抽提一次,氯仿抽提一次后,乙醇沉淀DNA,用自动移液器吸管头将絮状DNA沉淀块吸附到Ep管中,70%乙醇洗2次,干燥后溶于适当1×TE或ddH2O中。 3 1) 细菌培养:细菌接种于5ml 液体培养基中,37℃摇床(300rpm)培养过液。2) 细菌收集:取1ml培养物于1.5ml EP 管中,室温8000rpm离心5min,弃上清,沉淀重新悬浮于1ml TE(pH8.0)中(用ddH2O 也行)。3) 菌体裂解:加入6μl 50mg/ml的溶菌酶,37℃作用2h。再加2mol/LNaCl50μl,10%SDS 110μl,20mg/ml的蛋白酶K 3μl,50℃作用3h或37℃过夜。(此时菌液应为透明粘稠液体)4) 抽提:菌液均分到两个1.5ml EP管,加等体积的酚∶氯仿∶异戊醇(25∶24∶1),混匀,室温放置5-10min。12000rpm离心10min。抽提两次。(上清很粘稠,吸取时应小心,最好枪头尖应剪去)5) 沉淀:加0.6倍体积的异丙醇,混匀,室温放置10min。1 2000rpm离心10min。6)洗涤:沉淀用75%的乙醇洗涤。7) 抽(凉)干后,溶于50μl ddH2O中,取2-5μl电泳。作PCR模板用。
质粒提取试剂盒-说明书-翻译
精品文档 。 1欢迎下载 E.Z.N.A.? 质粒小提试剂盒操作规程(英文版译文) (适用于No. D6942, D6943 & D6944) 1. 自新鲜划痕选择培养板中分离单菌落,接种含适当选择性抗生素的1-5ml 的LB 培 养基进行培养。37℃强力摇动(~300rpm )孵育12-16h 。使用10-20ml 培养管或容量至少4倍于培养容积的培养瓶。强烈推荐使用endA 阴性大肠杆菌菌株进行常规质粒分离。此类菌株包括DH5α和JM109。 2. 将1.5-5.0ml 细菌室温10,000 x g 离心1min 。轻轻倒出或吸走培养基并丢弃。 3. 加入250μl 的溶液I/Rnase A 重悬沉淀,涡旋或用移液器反复吹打。充分重悬沉 淀对于获得高质量的DNA 非常重要。 4. 加入250μl 溶液II ,倒置、转动试管数次使之轻轻混匀,得到透明的裂解产物。 可能需要孵育2min 。不要用力混合,以免使染色体DNA 断裂,减低质粒的纯度。该步反应不要超过5min 。溶液II 不用时要拧紧瓶盖,以免试剂被空气中的CO2酸化。 5. 加入350μl 溶液III ,立即倒置试管数次混匀,直至白色絮状沉淀物形成。为避免 形成局部沉淀,加入溶液III 后应立即、充分混匀溶液。 6. 室温≥10,000 x g 离心10分钟。白色沉淀物形成,立即进行下一步操作。 7. 小心翼翼.... 的吸取上清液,加入装配在2ml 收集管中的小量纯化柱I 中。确保离心沉淀未受扰动,确保没有细胞碎片加入到柱子中。室温下10,000 x g 离心1分钟,使裂解液完全通过柱子。 8. 丢弃滤过液,重新使用2ml 收集管;加入500μl HB 缓冲液清洗柱子,室温10,000 x g 离心1分钟,使溶液完成通过柱子。该步操作需确保残余的蛋白质污染被去除,以保证获得高品质的DNA 以适合于下游的应用。 9. 丢弃滤过液,重新使用2ml 收集管;加入700μl 用无水乙醇稀释的DNA 清洗液清 洗柱子,室温10,000 x g 离心1分钟,使溶液完全通过柱子,丢弃滤过液。 注意:DNA 清洗液的浓缩液使用前必须用无水乙醇稀释(5倍稀释),如果DNA 清洗液稀 释液经过冷藏,则使用之前必须置于室温。 10. 可选步骤:重复清洗,加入另外的700μl 用无水乙醇稀释的DNA 清洗液。 11. 将空柱子≥13,000 x g 离心2min ,使柱子的基质干燥。此步骤为关键操作,不可 遗漏。 12. 将柱子放入干净的1.5ml 微量离心管中。将30-50μl (取决于终产物的期望浓度) 洗脱液或无菌去离子水直接加入柱子基质上,使之于室温下静置1-2min 。≥13,000 x g 离心1min 洗脱DNA 。可以进行二次洗脱,以收集残存的DNA 。 13. DNA 的产量和质量:分别在波长260nm 和280nm 处测定样品适当稀释液的吸光度。DNA 的浓度计算如下: DNA 浓度=A 260×50×(稀释倍数)μg/ml A 260/A 280的比率可以反映核酸的纯度。比值大于1.8表明核算的纯度在90%以上。或者,DNA 的产量(及质量)有时可以通过琼脂糖胶/溴乙锭电泳与已知浓度的DNA 样品相比较更好的予以确定。通常情况下洗脱的大部分DNA 是超螺旋单体形式,但也可能存在串联体形式。 张小强 翻译
大量全血基因组DNA提取试剂盒操作方法及步骤说明书
大量全血基因组DNA提取试剂盒 目录号:DN04 DN0401 16次×10ml DN0402 32次×10ml DN0403 96次×10ml 适用范围: 适用于快速提取各种动物全血基因组DNA 试剂盒组成、储存、稳定性: 试剂盒组成保存16次×10ml 32次×10ml 96次×10ml 10x红细胞裂解液室温50 ml 100 ml 300 ml 细胞核裂解液室温180 ml 180×2 ml 250 m l×4 蛋白沉淀液室温55 ml 110 ml 330 ml DNA溶解液室温15 ml 30 ml 90 ml 本试剂盒在室温储存18个月不影响使用效果。 储存事项: 1.环境温度低时细胞核裂解液中某些去污剂成份会析出出现浑浊或者沉淀,可在 37℃水浴加热几分钟,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。 2.蛋白沉淀液可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,如果不 能完全溶解,也不影响使用效果,直接取用上层溶液即可。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时 盖紧盖子。 产品介绍: 本试剂盒根据全血特点采用几个快速步骤提取基因组DNA。首先红细胞裂解液裂解去除不含DNA的红细胞,细胞核裂解液裂解白细胞释放出基因组DNA,然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重溶解于DNA 溶解液。 产品特点: 1.从十几个配方中优选出的红细胞裂解液配方,裂解快速完全。 2.不需要使用有毒的苯酚等试剂。 3.快速,简捷,单个样品操作一般可在1小时内完成。 4.结果稳定,产量高(典型的产量10ml全血可提取出150-500μg),OD260/OD280 典型的比值达 1.7~1.9,长度可达50kb-150kb,可直接用于构建文库、PCR、Southern-blot和各种酶切反应。 注意事项 1.所有的离心步骤均在室温完成,使用转速可以达到2,500 x g,并配备容纳50ml心 管转头的传统台式离心机。 2.用户需自备异丙醇和70%乙醇。 3.典型的产量10ml全血可提取出150-500μg基因组DNA(不同样品尤其疾病样品中 中白细胞数量差异可能非常大,因此产量的个体差异也可能非常大)。 4.本试剂盒为溶液型,可以很容易的按照比例扩大或者缩小每次处理的全血量 (20μl-10ml),请联系我们索取其它处理量的操作手册。
植物基因组DNA提取
植物基因组DNA提取 一、实验目的 1、掌握植物基因组总DNA的抽提方法和基本原理。 2、学习根据不同的植物和实验要求设计和改良植物总DNA抽提方法。 二、实验原理 通常采用机械研磨的方法破碎植物的组织和细胞,由于植物细胞匀浆含有多种酶类(尤其是氧化酶类)对DNA的抽提产生不利的影响,在抽提缓冲液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降低这些酶类的活性。在液氮中研磨,材料易于破碎,并减少研磨过程中各种酶类的作用。 十六烷基三甲基溴化铵(hexadyltrimethyl ammomum bromide,简称为CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate,简称SDS)等离子型表面活性剂,能溶解细胞膜和核膜蛋白,使核蛋白解聚,从而使DNA得以游离出来。加入苯酚和氯仿等有机溶剂,能使蛋白质变性,并使抽提液分相,因核酸(DNA、RNA)水溶性很强,经离心后即可从抽提液中除去细胞碎片和大部分蛋白质。上清液中加入无水乙醇使DNA沉淀,沉淀DNA溶于TE溶液中,即得植物总DNA溶液。 三、实验仪器及试剂 实验仪器:高速离心机;烘箱;冰箱;水浴锅;高压灭菌锅;Nanodrop。 实验试剂:玻璃珠,十二烷基磺酸钠(SDS);三羟甲基氨基甲烷(Tris);乙二胺四乙酸(EDTA);氯化钠;苯酚;氯仿;无水乙醇等。 四、实验步骤 1.SDS提取缓冲液在65℃水浴中预热。 2.将叶片置于1.5ml离心管中,液氮速冻,组织研磨器打样。 3.加入700 l的SDS提取缓冲液,涡旋摇匀。 4.置于65℃的水浴中,每隔10 min轻轻摇动,30 min后取出。
5.加入200 μl KAc溶液,摇匀,放入-20℃冰箱30 min。 6.10000 rpm离心5 min,上清移至新离心管中,12000 rpm离心5 min。 7.上清移至新离心管中,加入700 μl异丙醇,-20℃冰箱30 min。 8.10000 rpm离心5 min,弃上清,加入500 μl 70%乙醇漂洗。 9.弃液体,晾干。 10. DNA纯度与浓度测定(使用nanodrop)。 (1)DNA纯度:DNA的OD260/OD280一般为1.8左右。 OD260/OD280 ≈ 1.8:说明较纯; OD260/OD280 > 1.8:说明可能有RNA污染; OD260/OD280 < 1.8:说明可能有蛋白质污染。 五、注意事项 1. 叶片磨得越细越好。 2. 注意移液器的正确使用。 3. 由于植物细胞中含有大量的DNA酶,因此,除在抽提液中加入EDTA抑制酶的活性外,第一步的操作应迅速,以免组织解冻,导致细胞裂解,释放出DNA酶,使DNA降解。 六、结果与分析 1.植物DNA提取所用试剂的作用? 2.植物DNA提取的关键步骤有哪些? 3.植物DNA提取后的用途有哪些? 4.从化学结构、化学性质、存在场所以及功能等方面比较DNA和RNA的异同。
组织基因组DNA提取试剂盒磁珠法
组织基因组DNA提取试剂盒(磁珠法) 使用说明书(Cat#Yu-TD02-1) 【产品介绍】 组织基因组DNA提取试剂采用国内领先的专利技术合成的纳米磁珠颗粒和多次实验优化的缓冲液体系,能从样品中分离纯化高质量DNA。在一定条件下,磁珠表面修饰的基团高效吸附目的DNA,而当条件改变时,磁珠释放吸附的DNA,达到快速分离纯化DNA的目的。整个过程安全、无毒、便利,提取的DNA质量稳定、纯度高。纯化后的DNA适用于多种后续实验。本试剂盒可以从少量动物组织中分离纯化出高质量、高浓度的DNA。 【产品特点】 1. 效率高:DNA提取得率高,操作简便。 2. 安全、无毒害:整个操作过程无需使用苯酚、氯仿等有毒物质,提取环境更加安全。 3. 高纯度:OD260/230在1.5左右,OD260/280在2.0左右。可直接用于各种分子生物学实验。 【试剂盒组成】 【规格】50T/盒 【自备试剂】无水乙醇,异丙醇 【贮藏与有效期】 裂解吸附液和Buffer AW1必须室温(15-25℃)避光保存;磁珠室温保存;其他所有试剂室温保存,有效期为1年。 【注意事项】
1、Buffer AW1使用前,加入18mL无水乙醇,混匀,使乙醇含量为60%。★ 2、Buffer AW2使用前,加入21mL无水乙醇,混匀,使乙醇含量为70%。★ 3、磁珠使用前必须充分混匀。★ 4、组织最好置于组织核酸(DNA/RNA)保存液(Cat#Yu-TP01)或液氮中保存。【操作步骤】 1、样本的处理 1.1、液氮中保存的组织将组织在液氮中磨成粉末后,使液氮充分挥发。再以50-100mg组织中加入1mL裂解吸附液,充分研磨。以下进入步骤2。 1.2、组织保存液中保存的样本取出在组织保存液中保存的组织,加入1mL无水乙醇洗涤组织两次。再以50-100mg组织中加入1mL裂解吸附液,充分研磨。以下进入步骤2。 2、吸取400μL研磨后的裂解吸附液转入1.5mL的EP管中,加入5μL蛋白酶K,60℃1500rpm10分钟。 3、取出EP管,加入250μL异丙醇和10μL混匀的磁珠,闭盖,充分混匀。室温1500rpm振荡10min。 4、取出EP管,瞬时离心,将EP管放于磁力架上,吸附磁珠4分钟。 5、在磁力架上,打开EP管盖,吸弃液体,保留磁珠。 6、加入600μL Buffer AW1,闭盖。从磁力架上取下EP管,充分混匀使磁珠完全分散至洗液中。 注:可以在漩涡振荡仪上3000rpm振荡20秒,使EP管壁上的磁珠完全分散至洗液中。 7、将EP管放回磁力架,吸附磁珠3分钟至液体清澈(吸附磁珠2分钟后,颠倒磁力架3次,使EP管盖上残留的磁珠被充分回收)。打开EP管盖子,吸弃液体,保留磁珠(需吸干EP管底和管盖中的残留液体)。 注:由于各个实验室磁力架磁力不尽相同,吸附时间可以延长,直至液体清澈。 8、加入600μL Buffer AW2,闭盖。从磁力架上取下EP管,充分混匀使磁珠完全分散至洗液中。 注:可以在漩涡振荡仪上3000rpm振荡20秒,使EP管壁上的磁珠完全分散至洗液中。
基因组DNA提取步骤
基因组DNA提取步骤 1.从无水乙醇中取出少许组织(约50mg)加入干净灭菌的EP管中, 剪碎; 2.加入400ul 1%的SDS,8ul(20mg/ml)的蛋白酶K,充分浸润, 入55℃摇床(100转/分),期间振荡助溶至澄清(5-6h); 3.取出消化液,加入6mol/L的NaCl300ul,氯仿200ul,轻柔正反 颠倒,使其充分乳化,4℃13000转/分离心30min; 4.取出上清(约400ul),加入等体积氯仿抽提一次,轻柔颠倒后, 4℃13000转/分离心10min; 5.上清加入5μl RNaseA(10μg/μl), 37℃10分钟, 除去RNA(RNA对DNA的操作、分析一 般无影响,可省略该步骤)。 6.取上清加入等体积异丙醇,轻柔混匀后-20℃沉淀10min; 7.4℃13000转/分离心15min,弃上清; 8.用75%乙醇洗涤1-2次(1000ul,11000转/分离心2min),弃上 清; 9.冰冻无水乙醇洗涤1-2次(1000ul,11000转/分离心4min)弃上 清,自然晾干或烘干,DDW溶解,30-50ul。 基因组DNA的提取通常用于构建基因组文库、Southern杂交(包括RFLP)及PCR分离基因等。利用基因组DNA较长的特性,可以将其与细胞器或质粒等小分子DNA分离。加入一定量的异丙醇或乙醇,
基因组的大分子DNA即沉淀形成纤维状絮团飘浮其中, 可用玻棒将其取出,而小分子DNA则只形成颗粒状沉淀附于壁上及底部, 从而达到提取的目的。在提取过程中,染色体会发生机械断裂,产生大小不同的片段,因此分离基因组DNA时应尽量在温和的条件下操作,如尽量减少酚/氯仿抽提、混匀过程要轻缓, 以保证得到较长的DNA。一般来说,构建基因组文库, 初始DNA长度必须在100kb以上,否则酶切后两边都带合适末端的有效片段很少。而进行RFLP和PCR分析, DNA长度可短至50kb, 在该长度以上,可保证酶切后产生RFLP片段(20kb以下),并可保证包含PCR所扩增的片段(一般2kb以下)。 不同生物(植物、动物、微生物)的基因组DNA的提取方法有所不同; 不同种类或同一种类的不同组织因其细胞结构及所含的成分不同,分离方法也有差异。在提取某种特殊组织的DNA时必须参照文献和经验建立相应的提取方法, 以获得可用的DNA大分子。尤其是组织中的多糖和酶类物质对随后的酶切、PCR反应等有较强的抑制作用,因此用富含这类物质的材料提取基因组DNA时, 应考虑除去多糖和酚类物质。 本实验以水稻幼苗(禾本科)、李(苹果)叶子、动物肌肉组织和大肠杆菌培养物为材料,学习基因组DNA提取的一般方法。 从植物组织提取基因组DNA 一、材料 水稻幼苗或其它禾本科植物,李(苹果)幼嫩叶子。 二、设备 移液器,冷冻高速离心机,台式高速离心机,水浴锅,陶瓷研钵,50ml离心管(有盖)及5ml和 1.5ml离心管,弯成钩状的小玻棒。 三、试剂 1、提取缓冲液Ⅰ:100mmol/L Tris·Cl, pH8.0, 20mmol/L EDTA, 500mmol/L NaCl, 1.5% SDS。 2、提取缓冲液Ⅱ:18.6g葡萄糖,6.9g二乙基二硫代碳酸钠,6.0gPVP,240ul巯基乙醇,加水至300ml。 3、80:4:16/氯仿:戊醇:乙醇 4、RnaseA母液:配方见第一章。 5、其它试剂:液氮、异丙醇、TE缓冲液,无水乙醇、70%乙醇、3mol/L NaAc。 四、操作步骤: (一)水稻幼苗或其它禾木科植物基因组DNA提取 1. 在50ml离心管中加入20ml提取缓冲液Ⅰ, 60℃水浴预热。 2. 水稻幼苗或叶子5-10g, 剪碎, 在研钵中加液氮磨成粉状后立即倒入预热的离心管中, 剧烈摇动混匀, 60℃水浴保温30-60分钟(时间长,DNA产量高), 不时摇动。 3. 加入20ml氯仿/戊醇/乙醇溶液, 颠倒混匀(需带手套, 防止损伤皮肤),室温下静置5-10分钟, 使水相和有机相分层(必要时可重新混匀)。 4. 室温下5000rpm离心5分钟。 5. 仔细移取上清液至另一50ml离心管,加入1倍体积异丙醇,混匀,室温下放置片刻即出现絮状DNA沉淀。 6. 在1.5ml eppendorf中加入1ml TE。用钩状玻璃棒捞出DNA絮团,在干净吸水纸上吸干,转
高纯度质粒小提试剂盒使用说明书
高纯度质粒小提试剂盒 Pure Mini Plasmid Kit (目录号:HS0103) 产品包装 试剂盒成分 50 preps Buffer P1 15 ml Buffer P2 15 ml Buffer P3 20 ml Buffer PD 30 ml RNase A(10 mg/ml) 150 ul Buffer PW 60 ml Buffer EB 10 ml Spin Columns PA 50个 Collection Tubes (2 ml) 50个 (注意:使用前将全部RNase A 溶液加到Buffer P1中混合均匀,2 ~ 8℃保存) 保存条件 本试剂盒在室温(15 ~ 25℃)干燥条件下,可保存12个月;更长时间的保存可置于2 ~ 8℃。若溶液产生沉淀,应在使用前置于37℃下溶解沉淀。单独包装的RNase A 在室温可稳定保存12个月。加入RNase A 后的Buffer P1应置于2 ~ 8℃保存,可稳定保存6个月。 产品简介 本试剂盒用于高纯度质粒DNA 的小量制备与纯化。菌体经碱裂解、高盐、低pH 处理,质粒可从菌体中释放出来,并特异、高效地被离心柱硅胶膜(Spin Columns PA )吸附。通过去蛋白液(Buffer PD )和漂洗液(Buffer PW )的清洗可去除蛋白及其他杂质,在低盐、高pH 条件下洗脱,最后得到高纯度的质粒DNA 。 北京厚生博泰科技有限公司 Beijing Hooseen Biotech Co., Ltd.
使用本试剂盒可从1 ~ 5 ml过夜培养的菌液中纯化得到高达20 ug的高纯度质粒DNA,可在30 min之内完成提取任务。所得质粒可直接用于酶切、转化、PCR、测序、低敏感细胞株的转染等各种常规分子生物学操作。 产品特点 1. 快速:步骤少,操作简便,节约时间。 2. 简便:离心吸附柱不需要预平衡,漂洗液Buffer PW 和去蛋白液Buffer PD不需要另加乙醇,即开即用。 3. 纯度高:所得质粒可直接用于酶切、转化、PCR、测序、低敏感细胞株的转染等各种常规分子生物学操作。 操作步骤 1. 取1 ~ 5 ml过夜培养的菌液,室温12,000 rpm离心1 min,尽量将上清去除干净。 (注意:根据菌液的浓度决定取液量,浓度高时取1 ml菌液离心即可,浓度低时可多收集一次) 2. 加入250 ul Buffer P1,用枪头充分吹打使菌体重悬均匀。 (注意:是否将RNase A溶液加到Buffer P1中并混合均匀;菌体沉淀是否悬浮充分,如有未彻底悬浮的菌块会影响裂解,导致提取的质粒浓度及纯度降低) 3. 加入250 ul Buffer P2,温和颠倒混匀6 ~ 8次,直到溶液变得清亮粘稠。 (注意:不可剧烈震荡,以免造成基因组DNA片段的污染,所用时间不要超过5 min,以免质粒受到破坏,如未完全变得清亮,可能是菌体太多,可增加Buffer P2的用量,在后续的操作中Buffer P3的用量也要相应增加) 4. 加入350 ul Buffer P3,立即温和颠倒混匀6 ~ 8次,可见白色沉淀物产生,室温静置2 min,然后12,000 rpm离心3 ~ 5 min。 (注意:Buffer P3加入后应立即混合,避免产生局部沉淀,如果上清中还有微小白色沉淀,可再次离心后取上清) 5. 小心将上清液转移到离心吸附柱Spin Columns PA中,静置2 min,让质粒DNA与吸附柱中的硅胶膜充分结合。12,000 rpm离心0.5 ~ 1 min,弃收集管中的废液。 6. 向吸附柱中加入500 ul去蛋白液,12,000 rpm离心1 min,弃收集管中废液。 (注意:如果宿主菌是endA-,如DH5α若TOP10,此步骤可省略。如果宿主菌是endA+,如TG1、BL21、HB101、JM101等,此步骤不可省略,因这些宿主菌含有大量的核酸酶,易降解质粒。如果提取低拷贝质粒
DNAzol基因组DNA快速提取试剂盒操作方法及步骤说明书
DNAzol 基因组DNA快速提取试剂 目录号:DN26 DN2601 50ml DN2602 100ml 产品介绍: DNAzol 是一种完全的、可直接使用的基因组DNA提取试剂,简单高效,结果可靠,可快速提取基因组DNA,适用于多种大量或少量样品。DNAzol 可在一个步骤中裂解细胞并水解RNA,经过乙醇沉淀后即可快速得到基因组DNA。整个过程只需10-30 分钟,DNA 回收率可达70-100%,得到的DNA 不需再纯化,可直接用于Southern 杂交、斑点杂交、分子克隆、PCR 反应和其他分子生物学应用。 产品储存: 室温保存至少一年。 注意事项: DNAzol 有毒害性,应避免直接接触皮肤和眼睛。 操作步骤:(实验前请先阅读注意事项) 1.裂解,匀浆 a.组织:25-50mg 组织加1ml DNAzol ,使用匀浆仪处理5-10 次。少量 (5-10mg)柔软组织,如脾或脑组织,可切成或者捣成小块使用微量取样器吹打
混匀,室温放置5-10 分钟。 b.细胞:单层培养的细胞应直接裂解,倒出培养基,加入DNAzol 用取样器吹 打几次混匀。每10cm2 细胞培养板加0.75-1.0ml DNAzol。 c.细胞沉淀或悬浮液:每1-3×107细胞(体积小于0.1ml)加1ml DNAzol,反复 吹打混匀。 以上均要使用大口径枪头吹打,以免过度剪切断基因组。 2.离心 4 -25℃,10000g 离心10 分钟。将得到的上清转入新管。 此步骤去除组织碎片、部分水解的RNA和多糖。如果所提样品为含较多细胞和细胞外物质的样品,如肝、肌肉和大部分植物组织等,或要提取不含RNA 的DNA 时,可加此步骤。其他样品可省略此步。 3.沉淀 每使用1ml DNAzol 加0.5ml 100%乙醇,颠倒离心管5-8 次,混匀样品至出现DNA 沉淀,室温放置1-3分钟。可以看见DNA 絮状沉淀,让沉淀自然沉降到管底,尽可能吸弃上清。用枪头搅绕DNA贴附在离心管上端壁上,仔细吸弃剩下的在管底和管壁的上清。如果因为剪切太厉害导致形成小片段或者量少的DNA(少于15ug),无法缠绕到枪头上,可在4 -25℃,4000g 离心1-2分钟沉淀DNA,弃上清。 4.漂洗 用0.8-1ml 75%乙醇漂洗DNA 两次。漂洗时,将DNA 悬浮在乙醇中,颠倒离心管3-6 次,然后静置0.5-1 分钟使DNA 沉降到管底,尽可能吸弃上清。 如果需要,可在4 -25℃,1000g 离心1-2 分钟沉淀DNA。从组织中提取DNA 时,如需去除其他内含物,第一次漂洗可用70%DNAzol 和30%乙醇的溶液代替75%乙醇。
质粒提取试剂盒 说明书 翻译
E.Z.N.A.?质粒小提试剂盒操作规程(英文版译文) (适用于No. D6942, D6943 & D6944) 1. 自新鲜划痕选择培养板中分离单菌落,接种含适当选择性抗生素的1-5ml的LB培养基进行培养。37℃强力摇动(~300rpm)孵育12-16h。使用10-20ml培养管或容量至少4倍于培养容积的培养瓶。强烈推荐使用endA阴性大肠杆菌菌株进行常规质粒分离。此类菌株包括DH5α和JM109。 2. 将1.5-5.0ml细菌室温10,000 x g离心1min。轻轻倒出或吸走培养基并丢弃。 3. 加入250μl 的溶液I/Rnase A重悬沉淀,涡旋或用移液器反复吹打。充分重悬沉淀对于获得高质量的DNA非常重要。 4. 加入250μl溶液II,倒置、转动试管数次使之轻轻混匀,得到透明的裂解产物。可能需要孵育2min。不要用力混合,以免使染色体DNA断裂,减低质粒的纯度。该步反应不要超过5min。溶液II不用时要拧紧瓶盖,以免试剂被空气中的CO2酸化。 5. 加入350μl溶液III,立即倒置试管数次混匀,直至白色絮状沉淀物形成。为避免形成局部沉淀,加入溶液III后应立即、充分混匀溶液。 6. 室温≥10,000 x g离心10分钟。白色沉淀物形成,立即进行下一步操作。 7. 小心翼翼 ....的吸取上清液,加入装配在2ml收集管中的小量纯化柱I中。确保离心沉淀未受扰动,确保没有细胞碎片加入到柱子中。室温下10,000 x g离心1分钟,使裂解液完全通过柱子。 8. 丢弃滤过液,重新使用2ml收集管;加入500μl HB缓冲液清洗柱子,室温10,000 x g离心1分钟,使溶液完成通过柱子。该步操作需确保残余的蛋白质污染被去除,以保证获得高品质的DNA以适合于下游的应用。 9. 丢弃滤过液,重新使用2ml收集管;加入700μl用无水乙醇稀释的DNA清洗液清洗柱子,室温10,000 x g离心1分钟,使溶液完全通过柱子,丢弃滤过液。 注意:DNA清洗液的浓缩液使用前必须用无水乙醇稀释(5倍稀释),如果DNA清洗液稀释液经过冷藏,则使用之前必须置于室温。 10. 可选步骤:重复清洗,加入另外的700μl用无水乙醇稀释的DNA清洗液。 11. 将空柱子≥13,000 x g离心2min,使柱子的基质干燥。此步骤为关键操作,不可遗漏。 12. 将柱子放入干净的1.5ml微量离心管中。将30-50μl(取决于终产物的期望浓度)洗脱液或无菌去离子水直接加入柱子基质上,使之于室温下静置1-2min。≥13,000 x g离心1min洗脱DNA。可以进行二次洗脱,以收集残存的DNA。 13. DNA的产量和质量:分别在波长260nm和280nm处测定样品适当稀释液的吸光度。DNA的浓度计算如下: DNA浓度=A260×50×(稀释倍数)μg/ml A260/A280的比率可以反映核酸的纯度。比值大于1.8表明核算的纯度在90%以上。或者,DNA的产量(及质量)有时可以通过琼脂糖胶/溴乙锭电泳与已知浓度的DNA样品相比较更好的予以确定。通常情况下洗脱的大部分DNA是超螺旋单体形式,但也可能存在串联体形式。 张小强翻译
通用基因组DNA提取试剂盒使用说明
通用基因组DNA提取试剂盒使用说明 货号:D2100 规格:50T/100T 保存:室温(15℃-25℃)干燥保存,复检期12个月,2℃-8℃保存时间更长。开封后请将RNase A,蛋白酶K于-20℃保存。 试剂盒内容:D2100-50T D2100-100T RNase A1ml1ml×2 蛋白酶K1ml1ml×2 溶液A25ml50ml 溶液B25ml50ml 漂洗液15ml15ml×2 洗脱液15ml30ml 吸附柱50个100个 收集管50个100个 说明书1份1份 产品简介: 本试剂盒为通用型,适合于从土壤,粪便,昆虫,以及其他样本中提取基因组DNA。对细菌,真菌,昆虫等样本都具有很好的裂解效果,最大限度的保留了生物DNA的多态性。 使用本试剂盒提取的DNA产量大、完整性好,可直接用于各种常规操作,包括酶切、PCR、文库构建、Southern杂交等实验。
操作步骤: 使用前请先在漂洗液中加入无水乙醇,加入体积请参照瓶上的标签。所有离心步骤均为使用台式离心机在室温下离心。 1、样品的处理: 1)土壤:称取0.1-0.3g(根据干湿)土壤,放入研钵中,倒入适量的液氮,立即研磨,重复3次,使土壤颗粒研成粉末,加500ul溶液A,振荡至彻底悬浮。 2)粪便:称取0.1-0.3g(根据干湿)粪便,加500ul溶液A,振荡至彻底悬浮。 3)昆虫:称取0.1-0.3g昆虫,倒入适量的液氮,立即研磨,重复3次,使昆虫研成粉末,加500ul溶液A,振荡至彻底悬浮。 4)未知样品,如为细未状,可直接称取0.1-0.3g(根据干湿)加500ul 溶液A,如为块状,可0.1-0.3g用液氮研磨成粉未,再加500ul溶液A,振荡至彻底悬浮。 2、向悬浮液中加入20ul10mg/ml的RNase A,55℃放置10min。 3、加入20ul10mg/ml的蛋白酶K,充分混匀,55℃水浴消化,30min。消化期间可颠倒离心管混匀数次,12000转离心10min。将上清转移到一个新的离心管中。如有沉淀,可再次离心。 4、加入500ul溶液B,充分混匀。如出现白色沉淀,于55℃放置5min,沉淀即会消失,不影响后续实验。如溶液未变清亮,说明样品消化不彻底,可能导致提取的DNA量少及不纯,还有可能导致上柱后堵柱子,请增加消化时间。
动物基因组DNA的提取
动物基因组DNA的提取 [实验原理] 在EDTA和SDS等去污剂存在下,用蛋白酶K消化细胞,随后用酚抽提,可以得到哺乳动构基因组DNA,用此方法得到的DNA长度为100-150 kb,适用于L嘴菌体构建基因组文库和Southern分析。 通过本实验了解并掌握提取基因组DNA的原理和步骤,以及相对分子质量较大的DNA 的琼脂糖凝胶电泳技术。 [仪器、材料与试剂] (一)仪器 1.台式离心机 2.玻璃匀浆器 3.高压灭菌锅 4.恒温水浴 (二)材料 1.1.5mL微量离心管 2.微量取样器和吸头 3.无菌过滤器(一次性) 4.10 mL注射器 5.鼠肝 6.三羟甲基氨基甲烷(Tris) 7.十二烷基硫酸钠(SDS) 8.乙二胺四乙酸(EDTA)
9.蛋白酶K 10.RNA酶 11.DNA相对分子质量标准物,DNA/EcoRI+HindⅢ相对分子质量标准物 (三)试剂 1、1.5 mol/L NaCl 2、0.5 mol/L Tris·HCI pH8.0 3.0.5 mol/L EDTA pH8.0 4.3 mol/L NaAc pH5.2 以上均高压灭菌。 5.蛋白酶K 10mg/mL配好后用一次性过滤器过滤,-20 保存(教师配制) 6.组织匀浆液100mmol/LNaCI,10mmol/LTris·HCl(pH 8.0),0.25mmol/LEDTA(pH8.0) 7.酶解液200mmol/LNaCI,20mmol/L Tris·HCI(pH 8.O),50mmol/LEDTA(PH 8.0),200~g/mL蛋白酶K,1%SDS 8.无DNA酵的RNA酶:将胰RNA酶溶解于10mmol/L Tris.HCI(pH7.5)、15 mmol /L NaCl溶液中,浓度l0mg/mL,于100℃水浴处理15min,以降解DNA酶,缓慢冷却到室温,-20℃保存 9.TE缓冲液:10mmol/LTris·HCl(pH8.0),25 mmol/LEDTA(pH8.0) 10.平衡酚(pH8.0):氧仿:异戊醇=25:24:1<体积比) 11.氧仿:异戊醇=24:l(体积比) 12.5xTBE 5.4gTris,2.75g硼酸2mL 0.5mol/L EDTA(pH8.0),加水到100mL;13.6x上样缓冲液o.25%溴酚蓝,40%(W/V)蔗糖水溶液
微量临床样品基因组DNA快速提取试剂盒操作方法及步骤说明书
微量临床样品基因组DNA快速提取试剂盒 目录号:DN25 目录编号包装单位 DN2501 50次 适用范围: 适合于从微量血液、法医材料、干血点、药签等微量样品中分离纯化基因组DNA。 试剂盒组成、储存、稳定性: 试剂盒组成保存50次 裂解液ML 室温11 ml 结合液CB 室温15 ml 抑制物去除液IR 室温25 ml 漂洗液WB 室温15ml 第一次使用前按说明加指定量乙醇 Poly Carrier -20℃200 μl 洗脱缓冲液EB 室温10 ml 蛋白酶K粉(可选) 20mg/ml -20℃20 mg 吸附柱AC和收集管室温50套本试剂盒在室温储存12个月不影响使用效果储存事项:
1.结合液CB或者抑制物去除液IR低温时可能出现析出和沉淀,可以在37℃水浴几分 钟帮助重新溶解,恢复澄清透明后冷却到室温即可使用。 2.为避免降低活性,方便运输,提供蛋白酶K为冻干粉状,收到后,可短暂离心后, 加入1毫升灭菌水溶解。因为反复冻融可能会降低酶活性,因此溶解后立即按照每次使用量(20微升)分装冻存,-20℃保存。 3.避免试剂长时间暴露于空气中发生挥发、氧化、pH值变化,各溶液使用后应及时盖 紧盖子。仔细阅读注意事项4。 4. 产品介绍: 本试剂盒采用特制的进口DNA吸附柱和独特的缓冲液系统,特别适合于从微量血液、法医材料、干血点、药签、口香糖、尿液等微量样品中分离纯化基因组DNA。各种来源样品裂解消化处理后DNA在高离序盐状态下选择性吸附于离心柱内硅基质膜(特别配备了Poly Carrier可以从体系中轻松捕获微量核酸),再通过一系列快速的漂洗-离心的步骤,将盐、细胞代谢物、蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净的基因组DNA 从硅基质膜上洗脱。纯化后的DNA无杂质和PCR抑制剂,可直接适用于PCR分析。 产品特点: 1.不需要使用有毒的苯酚等试剂,也不需要乙醇沉淀等步骤。 2.节省时间,简捷,单个样品操作一般可在20分钟内完成。 3.配备了Poly Carrier用于充分收集特别微量DNA。 4.多次柱漂洗确保高纯度,提取的DNA 纯度高,质量稳定可靠,可适用于各种常规 操作,包括PCR、酶切、测序、Southern 杂交等。
mobioDNA提取试剂盒说明书翻译
1.加2g土壤到15mL Bead Tube中 2.加入0.25mLSR1和0.8mLSR2之后,加入2.5mL Bead Solution到Bead Tube 3.加入3.5mL酚:氯仿:异戊醇25:24:1到试管中,加盖后涡旋混合直到分层消失。 4.最大转速涡旋震荡15min 5.室温,2500g离心10min 6.取出后,小心地转移上层水相到干净的15mL收集管中,弃掉下层酚 7.加1.5mL SR3到水相中,然后涡旋混匀,4℃孵育10min 8.室温,2500g离心10min。转移上清到一个新的15mL收集管中 9.加入5mL SR4溶液到装有上清的收集管中,混匀,室温孵育30min 10.室温,2500g离心30min 11.倒掉上清,将收集管倒置在纸上5min 12.震荡SR5混合。加1mL SR5到15mL收集管中,并反复吹打使完全重悬。 13.为每一个RNA样品准备一个RNA Capture Column A.拿去15mL收集管的盖子,将RNA Capture Column放入15mL收集管中。 B.加2mL SR5到RNA Capture Column中,让其完全流尽。 14.从第12步加入RNA样品至RNA Capture Column中,然后让其在重力作用下流尽。收集 液体。 15.用1mLSR5清洗柱子。重力流尽,收集洗脱液。 16.转移柱子到新的收集管,加入SR6震荡混合,然后加入1mL SR6到RNA Capture Column 洗脱RNA到15mL收集管中,重力流尽。 17.转移洗脱的RNA到2.2mL收集管中,并且加入1mL SR4.颠倒至少一次混合,然后-20℃ 孵育最少10min 18.室温13000g离心15min浓缩RNA 19.倒掉上清并倒转收集管在纸上10min晾干 20.用100μL SR7溶液重悬RNA沉淀,去除其中的基因组
