缓控释制剂的工艺和质量研究
缓控释制剂的工艺和质量研究
一、缓控释制剂的分类
(中国药典2005版相关指导原则)
缓释制剂:系指在规定释放介质中,按要求缓慢地非恒速释放药物,与其相应的普通制剂比较,给药频率至少减少一半,或给药频率比普通制剂有所减少,且能显著增加患者的顺应性或疗效的制剂
控释制剂:系指在规定释放介质中,按要求缓慢地恒速或接近恒速释放药物,与其相应的普通制剂比较,给药频率至少减少一半,或给药频率比普通制剂有所减少且能显著增加患者的顺应性或疗效的制剂
迟释制剂:系指在给药后不立即释放的制剂,包括肠溶制剂,结肠定位制剂和脉冲制剂。肠溶制剂和结肠定位制剂同中国药典2000版,增加了脉冲制剂。
脉冲制剂系指口服后不立即释放药物而在某种条件下(如在体液中经过一定时间或一定PH值或某些酶作用下)一次或多次突然释放药物的制剂
各国药典有关缓控释制剂的分类
英国药典(欧洲药典)
肠溶制剂Gastro-Resistant Preparations
调释制剂(改良释放制剂)Modified-Release Preparations
美国药典
延释制剂Delayed-Release Preparations,包括肠溶片、肠溶胶囊、肠溶颗粒(小丸)装入胶囊
控释制剂Extended Release Preparations,包括长效作用(prolonged-action)、重复作用(repeat-action)、缓释作用(sustained release)(收载在包衣片项下)
二、缓、控释制剂的简介(一)
根据药典有关指导原则,缓、控释制剂与普通制剂比较,为药物治疗作用持久,毒副作用低,用药次数减少的制剂,而控释制剂则要求按零级速率规律释放,可以接近恒速释放,它的“峰谷”波动更小。因此在缓、控释制剂开发中对工艺条件的设计上要比普通制剂复杂,要求达到可靠的治疗效果又不致由于单剂量大而可能导致突然释放所带来的危险性。
缓、控释制剂的简介(二)
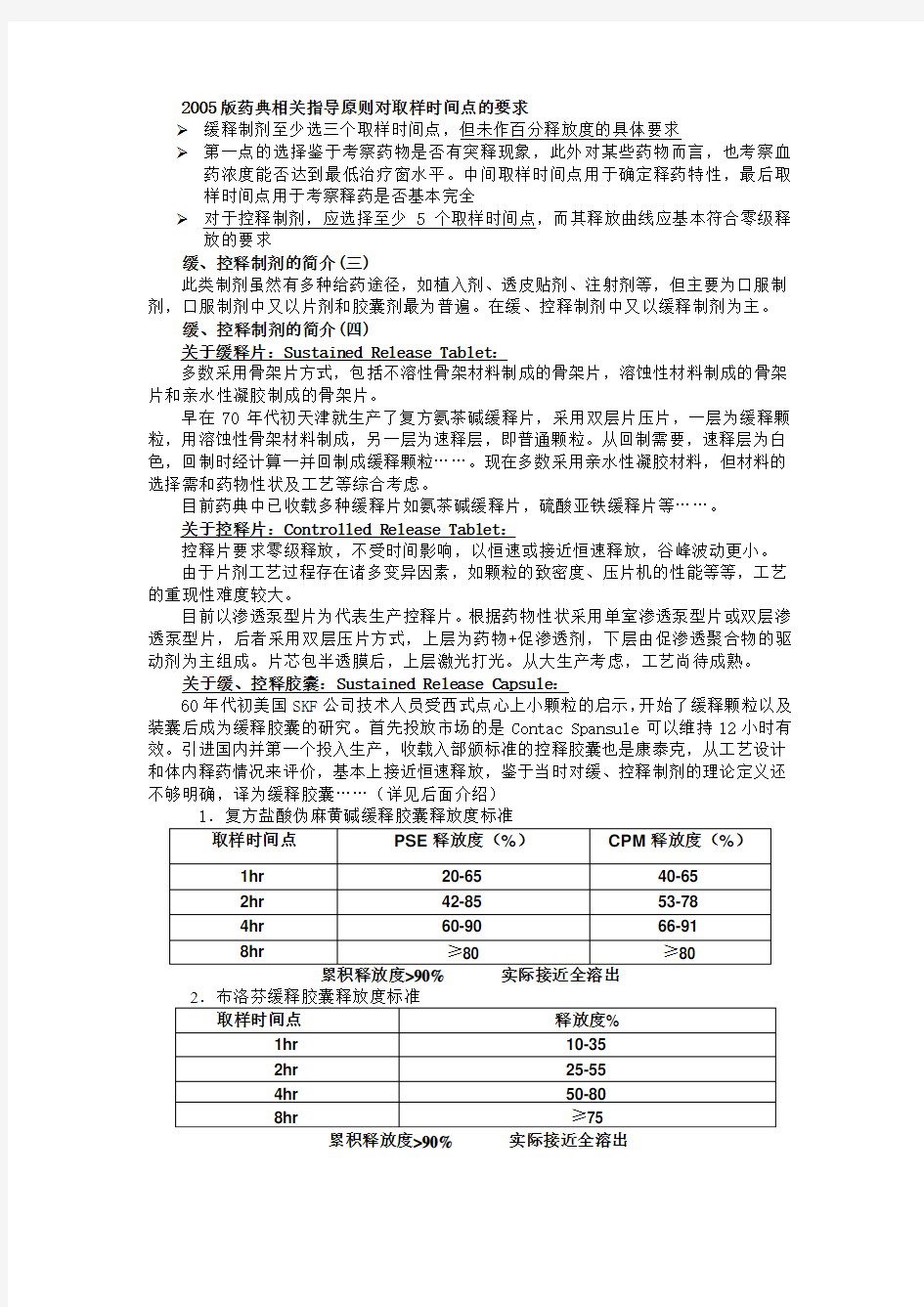
缓、控释制剂的开发主要是解决某些药物半衰期短、用药频繁的问题。避免用药过程由于“谷峰”现象带来的毒副作用较大的缺点,也有为减轻部分药物对胃肠道的刺激而制成缓释制剂如缓释铁制剂……(见附图)
缓速释制剂血药浓度对比示意图
2005版药典相关指导原则对取样时间点的要求
缓释制剂至少选三个取样时间点,但未作百分释放度的具体要求
第一点的选择鉴于考察药物是否有突释现象,此外对某些药物而言,也考察血药浓度能否达到最低治疗窗水平。中间取样时间点用于确定释药特性,最后取样时间点用于考察释药是否基本完全
对于控释制剂,应选择至少5个取样时间点,而其释放曲线应基本符合零级释放的要求
缓、控释制剂的简介(三)
此类制剂虽然有多种给药途径,如植入剂、透皮贴剂、注射剂等,但主要为口服制剂,口服制剂中又以片剂和胶囊剂最为普遍。在缓、控释制剂中又以缓释制剂为主。
缓、控释制剂的简介(四)
关于缓释片:Sustained Release Tablet:
多数采用骨架片方式,包括不溶性骨架材料制成的骨架片,溶蚀性材料制成的骨架片和亲水性凝胶制成的骨架片。
早在70年代初天津就生产了复方氨茶碱缓释片,采用双层片压片,一层为缓释颗粒,用溶蚀性骨架材料制成,另一层为速释层,即普通颗粒。从回制需要,速释层为白色,回制时经计算一并回制成缓释颗粒……。现在多数采用亲水性凝胶材料,但材料的选择需和药物性状及工艺等综合考虑。
目前药典中已收载多种缓释片如氨茶碱缓释片,硫酸亚铁缓释片等……。
关于控释片:Controlled Release Tablet:
控释片要求零级释放,不受时间影响,以恒速或接近恒速释放,谷峰波动更小。
由于片剂工艺过程存在诸多变异因素,如颗粒的致密度、压片机的性能等等,工艺的重现性难度较大。
目前以渗透泵型片为代表生产控释片。根据药物性状采用单室渗透泵型片或双层渗透泵型片,后者采用双层压片方式,上层为药物+促渗透剂,下层由促渗透聚合物的驱动剂为主组成。片芯包半透膜后,上层激光打光。从大生产考虑,工艺尚待成熟。
关于缓、控释胶囊:Sustained Release Capsule:
60年代初美国SKF公司技术人员受西式点心上小颗粒的启示,开始了缓释颗粒以及装囊后成为缓释胶囊的研究。首先投放市场的是Contac Spansule可以维持12小时有效。引进国内并第一个投入生产,收载入部颁标准的控释胶囊也是康泰克,从工艺设计和体内释药情况来评价,基本上接近恒速释放,鉴于当时对缓、控释制剂的理论定义还不够明确,译为缓释胶囊……(详见后面介绍)
三、缓、控释制剂工艺处方的设计要求(一)
重点介绍缓、控释胶囊
药物的理化性状,药代动力学和药效学性质是选择工艺路线的主要依据。
活性成分的溶解度和剂量:
水溶性药物或剂量小的难溶性药物可选用适合的工艺条件,并采用缓、控释材料包衣的工艺。
难溶性或疏水性药物,尤其是主药剂量较大的品种适合采用亲水性的高分子聚合物,选用适宜的工艺条件,使其逐层缓慢溶出,达到缓释效果。
缓、控释制剂工艺处方的设计要点(二)
主药的晶形、粒度和粒度分布
晶形和粒度尤其是对于难溶性药物更加重要,它是工艺设计的关键点,直接影响到释放速率。某些专利结晶,可以直接用于缓释制剂的生产,不须进行加工处理,免除了原料处理过程的静电现象和再聚集的可能性。
粒度的分布状态也是重要因素,它关系到释放度曲线,因此除设定结晶形态控制原料的平均粒度外,还需控制粒度分布范围及百分比,以期在设定的条件下,批与批之间呈现良好的重现性……(例)
缓、控释制剂工艺处方的设计要点(三)
?缓、控释制剂的组成对工艺处方设计的影响:
单方制剂只有一种活性成分,根据工艺的适应性,可以采用工艺手段一次完成,为符合释放度曲线的要求可采用不同释放度的中间体混合组成或/和速释成分一起组合。为固定胶囊囊重,可采用空白组分作为填充(通常经过经设计的计算方法来完成)。应该注意的是凡采用混合各组分的工艺,要特别注意各组分的密度必需接近。空白组分更需注意。
复方制剂工艺设计比较复杂,需考虑:
根据各自的理化性状及剂量大小,以及准备选用的设备确定一次制剂成型或分别制剂后组合而成。
如一次制剂成型要考虑到 主药之间的剂量比例能够自始至终控制在一定幅度的比例中,即保证小剂量成分的均一性和各药物之间的组成比例。 各药物在同一时间取样点的释放度趋势基本平行。
如各活性成分分别制剂后组合从工艺处方设计上比较容易、灵活但是鉴于各成分剂量不同,中间体的密度很难一致,混合装囊方式不易均匀,装囊过程会出现分离现象。目前新型的MG2 MG FUTURA 多轨道装囊机可以进行多组分装囊。
缓、控释制剂工艺处方的设计要点(四)
缓控释制剂的成膜材料的理化性状及释药机制或骨架型释药系统的骨架材料的选择也是工艺处方设计的要点。工艺、处方、使用设备要一体考虑并选用。
包衣材料的溶解系统对释放度的稳定性有较大影响。六、七十年代开发缓、控释制剂选用的是溶蚀性缓释蜡层(MW+GDS/GMS),通常用三氯乙烷或三氯乙烷/二氯甲烷混合物作溶媒,效果比较理想。鉴于含氯有机溶剂对大气臭氧层有破坏作用,1987年蒙特利尔公约(Montreal Protocol)已在全球范围内陆续禁止使用,九十年代后期,多次尝试用乙醇代替,但成品稳定性差。对于EC来说,也是同
样。包衣材料不得不转向水分散体,这就引起工艺,以至设备的变革。
目前多选用EC水分散体,如Aquacoat, Surelease和聚丙烯酸树酯水分散体Eudragit,卡乐康生产的全水性丙烯酸类肠溶包衣系统用于片剂、小丸的肠溶包衣。
缓、控释制剂工艺处方的设计要点(五)
缓、控释制剂多数不能回制,应考虑生产的可操作性,成熟的工艺应具有良好的重现性、稳定性和质量均一性,以严格的经过验证的操作规程及中控手段来实现而不强调操作技巧来控制
供应商的审批制度:定期审计很重要,任何变更要遵循变更控制规定,缓控释材料应有关键控制点,包括有效期、水分散体的固体重量,增塑剂等。
缓释小丸机理
采用先进的Wurster底喷流化包衣工艺
将定量的不同药物活性成份分别喷洒在基丸上,先包以保护性的聚合物外层,然后包以具有缓释功能的水性聚合物缓释包衣材料,最后进行抗潮性的隔离层和色层包衣,形成药物缓释小丸
采用和药物亲和力较低的材料包隔离层,可使药物不宜接触缓、控材料,以防止或减少药物的迁移现象。
进行抗潮性隔离层包衣,以减少温湿度对释药速率的影响。
采用缓控释小丸组成缓控释胶囊的独特优点
采用缓、控释小丸容易组合,尤其是控释胶囊,可根据小丸中间体的释放度、计算组成,使血药浓度平稳
小丸的成膜性好,均匀性好,服用后在胃肠道内分散、吸收也较好
生产工艺操作较易掌握,变异因素少,成品质量的可控制性高,这是片剂所无法比拟的。
目前肠溶胶囊亦倾向于采用肠溶小丸装胶囊的工艺,比采用肠溶空心胶囊的方式质量可靠,安全性好,如奥美拉唑肠溶胶囊……等。
四、缓、控释胶囊的工艺和设备(一)
包衣锅制丸包衣
包衣锅制丸包衣即采用普通糖衣锅按传统方法滚动制丸包衣,选型上应是可调速的浅型荸荠式包衣锅。可以加搅拌桨,也可不加搅拌桨,但搅拌桨的角度比较重要。锅内壁应为光滑的不锈钢锅,最好是316L材料。根据工艺需要有送风、排风系统,必要时有热风系统。空气过滤级别达到1万-10万级,配有喷液装置。此种制丸包衣法适用于主药剂量较大的成丸工艺、粘度较大的水溶性包衣制丸或易挥发的溶剂。
新型正在开发的包衣锅是自动上粉、自动喷液,以解决劳动防护问题。其中自动上粉的难点是分散系统以及相应的防熔装置。分散系统对小丸的质量和收率直接相关。(解释)
流化床包衣法
流化床包衣法即空气悬浮法制丸和包衣,通常以空白小丸为基核采用底喷方式,这种方法可用于可溶解或可分散于上衣材料的药物制丸,这比离心-流化制丸方法方便、圆整,损耗小,利于工业生产。并适用于水溶性或水分散体缓释材料的包衣,如Aquacoat 和Surelease,配方中有适量增塑剂。必要时可加入适量致孔剂。(见附图)
包衣设备属于关键设备在放大生产过程,由于型号改变,工艺参数以至缓释材料的用量必须进行确认和验证……。
供大生产用的MO,MD必须在工艺验证的基础上制订和批准。
缓控释胶囊的工艺和设备(二)
混合设备:V型混合、混合桶混合……
均匀度的验证(两种或两种以上组成):确定时间、转速、设备装量
磨损状况的确认:考察混合前后释放度的变化。
制订混合工序的SOP。
缓控释胶囊的工艺和设备(三)
灌囊设备:
凡采用单一小丸装囊或混合后装囊的方式。可采用普通装囊机,并进行磨损试验和均匀度验证试验。
由于小丸密度差异较大,必须分别装囊的可选用新型双轨或多轨道装囊机,如MG2 FUTURA并选用合适规格的定量器(包括定量盘和定量针),定量盘有不同规格,两个下料斗使用一个规格的定量盘,凭借定量针的位置调节装量,由于
直径固定,装量的调节有一定幅度范围,这就决定了灌装的组成数。(附图)
MG2 FUTURA定量示意图
五、缓、控释制剂的释放度测定(一)
药典相关指导原则对缓释、控释制剂的生物利用度和生物等效性试验以及体内-体外相关性均做了详细阐述。具体要求为:“…系指体内吸收相的吸收曲线与体外释放曲线之间相应的各个时间点的回归,得到直线回归方程的相关系数符合要求…”
在具体设计时先拟定草案,设定采用的测定仪器及测定介质,测定条件及取样点分析方法等,其中非常重要的是释放介质的确定。释放介质通常采用磷酸盐缓冲液或稀的盐酸溶液,对于难溶性药物可加入少量表面活性剂,如0.2%十二烷基硫酸钠,0.1%吐温80等。采用EC水分散体作为缓释材料,通常不受PH 值、缓冲液离子强度的影响。但是不同机理设计的缓、控释制剂,有时对上述因素比较敏感而影响释放速率。为使体外释放曲线能预测体内情况可根据体内
试验结果来调整体外试验方法条件和释放度范围,而释放度限度的最终确定则
根据产品稳定性数据来进行调整。
Relationship between the in vitro dissolution and in vivo bioavailability(AUC)
IVIVC(fit) - for CPM
缓、控释制剂的释放度测定(二)
? 释放度测定仪的选择
? 缓、控释制剂,由于工艺及包衣材料不同,在测定仪器和方法选择上需要考虑
其适应性。通常选用溶出度测定仪(浆法、篮法或采用沉降篮法),因为仪器普及,新产品申报中免去很多困难,此种测定方法存在的问题是胶囊制剂中的空胶囊在释放度测定转速小于50Rpm 时,其粘度对缓释胶囊可能带来的影响。取样点和介质脱气情况也在一定程度上影响释放度%。
? 流室法(Flow-through)释放仪早已收载入USP23版,其优点是对难溶性药物可以定期更换释放介质,避免因溶出介质饱和而不再溶出,可以累积测定,但目前仪器尚不普遍,蠕动泵的仿制有一定难度。对于易降解的药物,其回收试验难于达到理想效果(附图)
AUC(mg/mlh) Dissolution(%)
R=0.9964
?转瓶式溶出仪:早在60年代已应用于缓、控式制剂,但未被各国药典收载,此仪器制作简单,使用方便,尤其适用于缓、控释颗粒和部分密度小的小丸和微丸,但取样量小,宜采用自动释放仪,本释放度结果为相对释放速率?释放度%:
指每片/粒在指定取样点取样后测出的释药量,其百分数是以标示量为基础求得。
相对释放度%:
指每片/粒/每剂量在指定取样点取样后测出的释药量和本品全释放量做比较求算的百分数。即以Total Release 为标准。
长效制剂的释放度测定:
目前没有明确的规则,前面谈及的流室法可适用于药物稳定的长效制剂的测定,但如何控制流速以及确定取样点等要按品种考虑。中国新药杂志2000年刊登了合肥工业大学关于“等距浸出法”的报导,可作为当前“流室法”仪器缺乏的补充。
长效制剂,如避孕药的植入,局部注射抗肿瘤药物……,难于完全用体外试验来证明,在体内试验确定有效的基础上,体外试验仍然只是一种控制产品质量,使产品质量保持一致性的手段。希望能够作为一个课题来探讨。
释放度测定仪(二)
转瓶法释放仪
对缓控释胶囊稳定性的影响因素(一)
空心胶囊的影响:
释放度测定转速<50rpm的品种而言空胶囊的粘度增大,其对应的胶囊溶出度呈下降趋势
空心胶囊的配方和工艺以及贮存期间的稳定性对缓、控释胶囊的释放度影响较大,在某种情况下,缓、控释胶囊的释放度未能通过加速试验条件的考察,而脱囊后的缓、控释小丸在同等条件下,其释放度仍可符合质量标准的幅度要求。
因此,在我们进行质量研究时,应该考虑空心胶囊的影响因素…
胶囊的释放度与空胶囊的冻力强度与粘度的比值(R)趋势一致
空心胶囊(一)
空心胶囊是胶囊的重要组成部分,直接关系到胶囊剂的产品质量。
明胶是空心胶囊的主成分。按来源明胶分骨胶和皮胶两种;按制备方法有酸性明胶(用盐酸水介制成)和碱性明胶之分(用碱水介制成)
明胶重要的指标是溶胶粘度(表示分子链的长短)和凝胶冻力(表示网状结构分子量的大小
早期教科书上介绍明胶冻力不低于240 勃鲁姆克生产空心胶囊为宜,
但目前有冻力200~240(或150-250美国EL-Jay) 勃鲁姆克之间的空心胶囊。
冻力较高的明胶,生产的空心胶囊物理稳定性也较高,鉴于没有充分依据确定对此产品稳定性的影响,以稳定性试验考查结果作为验证的依据。
空心胶囊(二)
粘度和冻力对胶囊的成型质量影响很大,国内生产的空心胶囊以骨胶为主。
皮胶多属猪皮胶,以混合胶(骨胶:皮胶为3:1或4:1)较好。目前植物 胶囊尚在研究和试验中。
胶囊在贮存期间出现崩解度不合格或溶出度降低的原因之一,是空心胶囊的 质量造成的。因此保证产品质量的措施包括:
?固定明胶胶源和生产厂家
?固定空心胶囊配方和工艺条件(固定供应商)
?进行生产工艺验证和稳定性考查
空胶囊冻力强度与粘度的比值R的规律
方法:比值R-时间作图
结论:
空胶囊冻力强度与粘度的比值R随着时间的延长而减小。
注: 以溶出度-比值R作图(略)
空胶囊冻力强度与粘度的比值R越大,其相对应的胶囊溶出度越大。
对缓控释胶囊稳定性的影响因素(二)
基丸质量的影响因素
空白基丸的组成为乳糖或蔗糖,也有加入一定比例的滑石粉、高龄土等,它的粒径大小和圆整性均直接影响缓、控释小丸的释放度。
基丸粒径差异,造成表面积不同,密度不同,含主药比例不同,影响小丸释放度和含量的均匀性。
基丸圆整性,影响缓、控释材料在小丸表面包裹的完整性和厚度差异而药物扩散的数量取决于缓、控释膜的厚度。因此基丸圆整性影响包衣质量和释放度。
鉴于运输、包装等原因,基丸有可能受损,使用前要进行筛目分拆,必要时须进行过筛处理。
对缓控释胶囊稳定性的影响因素(三)
温湿度的影响
对于多数缓、控释胶囊来说,采用PVDC/铝箔包装材料,仍难承受40oC/75%RH 3-6个月加速考察试验。采用缓控释材料包衣的品种。高温高湿可使释放度升高(例)。对于主药随温度升高溶解度增加的产品影响更大,而胶囊水分也影响释放度。
采用高分子聚合物作为隔离层的品种,由于温湿度使其小丸互相粘连,小丸与胶囊壳粘连,在释放度测定转速较低的条件下,由于物理现象,使释放度下降。
因此,选择合理的贮存条件是必要的,销售单位应予以理解。
对缓、控释胶囊稳定性的影响因素(四)
处方和工艺条件的影响:
活性药物和缓、控释材料的理化性状以及它们之间的相互作用决定药物释放和长期稳定性。
采用缓、控释材料包衣的品种,药物释放度的延缓或加速除包衣厚度之外还决定于药物类型和膜的凝聚过程(愈合)即胶粒相互凝聚、融合最终形成完整膜的过程。
采用高分子聚合物作为隔离层的品种,其外层密封层的用量必应适当,避免因其吸湿性影响小丸粘连。凡用乙醇作为溶剂的品种,要充分除去乙醇,防止其残留溶媒导致胶囊的老化现象。
缓释控释制剂制剂习题及答案
缓释、控释制剂和口服定时、定位给药系统练习题: 1.缓释制剂 2.控释制剂 3.迟释制剂 4.脉冲制剂 5.结肠定位制剂 6.肠溶制剂 7.释放度 8.生物粘附 二、选择题 (一)单项选择题 1.渗透泵片控释的基本原理是 A.片剂膜内渗透压大于膜外,将药物从小孔压出 B.药物由控释膜的微孔恒速释放 C.减少药物溶出速率 D.减慢药物扩散速率 E.片外渗透压大于片内,将片内药物压出 2.以下可用于制备亲水凝胶骨架片的材料是 A.海藻酸钠 B.聚氯乙烯 C.脂肪酸 D.硅橡胶 E.蜂蜡 3.以下对渗透泵片的叙述中,错误的是
A.释药不受胃肠道pH的影响 B.当片芯中药物浓度低于饱和溶液浓度时,药物以非零级速率释放 C.当片芯中的药物未被全部溶解时,药物以一级速率释放 D.药物在胃与肠中的释药速率相等 E.药物的释放与半渗透性衣膜的厚度有关 4.下列数学模型中,不是作为拟合缓(控)释制剂的药物释放曲线的是 A.零级速率方程 B.一级速率方程 C. Higuchi方程 D.米氏方程 E. Weibull分布函数 5.下列关于骨架型缓控释片的叙述中,错误的是 A.亲水凝胶骨架片中药物的释放比较完全 B.不溶性骨架片中要求药物的溶解度较小 C.药物从骨架片中的释放速度比普通片剂慢 D.骨架型缓控释片一般有三种类型 E.骨架型缓控释片应进行释放度检查,不进行崩解时限检查 6.可作为渗透泵制剂中渗透促进剂的是 A.氢化植物油 B.脂肪 C.淀粉浆 D.蔗糖 E.邻苯二甲酸醋酸纤维素7.下列不是缓、控释制剂释药原理的为
A.渗透压原理 B.离子交换作用 C.溶出原理 D.扩散原理 E.毛细管作用 8.可作为溶蚀性骨架片的骨架材料是 A.硬脂酸 B.聚丙烯 C.聚硅氧烷 D.聚乙烯 E.乙基纤维素 9.最适合制备缓(控)释制剂的药物半衰期为 A.15h B.24h C.48h D.<1h E.2~8h 10.可作为不溶性骨架片的骨架材料是 A.聚乙烯醇 B.壳多糖 C.果胶 D.海藻酸钠 E.聚氯乙烯 (二)配伍选择题(备选答案在前,试题在后;每组均对应同一组备选答案,每题可能有一个或多个正确答案;每个备选答案可重复选用,也可不选用。) 【1-5】 A.聚乙二醇 B.乙基纤维素 C.羟丙甲纤维素 D.单硬脂酸甘油酯 E.硅橡胶 1.可作为不溶性骨架材料的是 2.可作为控释膜材料的是 3.可作为渗透泵片的推动剂的是 4.可作为生物溶蚀性骨架材料的是
缓控释制剂给药系统的研究进展
缓控释制剂给药系统的研究进展 [ 摘要]技术的不断进展,缓控释制剂作为一种新的制剂技术应运而生。本篇就现存的缓控释给药系统做了综合的概述和评价,总结了近年有关的研究进展,同时对其发展与应用前景做了展望。 [ 关键词]缓释,控释,给药系统 缓释制剂(sustained-release system)亦称长效制剂或延效制剂,是指通过适宜的方法延缓药物在体内的释放、吸收、代谢以及排泄的过程,从而延长药物的作用时间或者减轻其毒副作用的给药系统,动力学为一级释放。控释制剂(controlled-release system)能够控制药物释放速率使其符合药物动力学需要,保持较长时间体内药物治疗浓度的恒定,免除峰谷现象,药物以受控形式恒速(以零级或接近零级速率)释放或者被控制在作用器官等特定吸收部位释放,动力学为零级或接近零级释药【1】。 1 口服缓控释给药系统 1. 1 微囊(球) 用喷雾干燥法制备水溶性药物扑热息痛的控释聚合物微囊,得到微囊的可压性远远相应的扑热息痛物理混合物。虽然粉末不能减慢药物的释放,微囊压片却可在聚合物含量很少时显示出良好的控释性,并且刺激性低。 1. 2 口服缓释生物黏附片 生物黏附片在水介质中表面呈胶凝的屏障可减慢药物释放速率,制剂材料起到黏附和缓释两个作用。 口服缓释生物粘附片,因为不需要经过吸收,没有肝肠循环因此能最大限度的进入血液系统以快速地达到有效血药浓度。而且,可以改善病人粘附药物输送系统(频率)提供一个有希望的办法控制和具体地点传递到胃肠道的附加设备的粘液和粘膜经呼吸道生物粘附的过程中,这些粘附系统也被称为亲密之间的联系的剂型和吸收黏膜,导致较高的药物通量通过吸收组织提高生物利用度【2】。 1. 3胃内滞留型漂浮缓释片 曲莉,王智民等【3】等据流体动力学平衡控制系统( The Hydronamically Balanced controlleddrug delivery System ,HBS) 原理设计制备,是一种不崩解的亲水性凝胶骨架制剂,口服后与胃液接触时,亲水凝胶便开始产生水化作用,膨胀使其密度小于1而漂浮于胃液上,同时制剂表面形成一层水不透性胶体屏障膜,该胶体界面层控制了制剂内的药物与溶剂的扩散速率,从而延长药物在胃内滞留时间及控制了药物的释放速度,直至负载药物释放完全。 1. 4结肠靶向定位给药系统 程刚等【4】依赖型聚丙烯酸树脂EudragitNE 30 D 为膜材,制备茶碱薄膜衣片以γ- 闪烁照相研究该制剂在体内胃肠道的转运情况。结果体外6.5 h 释放的制剂口服8.0 h 后到达升结肠处开始释药,且体内释药与体外释药有一定的相关性。 1. 5固脂纳米粒 口服给药的喜树碱固脂纳米粒中药物的体外释放可达 1 周。对于喜树碱和其他脂溶性药物而言,固脂纳米粒是一个很有希望的口服给药的缓释系统。 2 靶向给药系统 2. 1 肝靶向给药 前体药物是由活性药物衍生而成的药理惰性物质,能在体内经化学反应或酶反应,使活性的母体药物再生而发挥其治疗作用。薛克昌等【5】为提高拉米夫定的肝靶向性,制备了十
缓控释制剂的研究现状
随着药学技术的日新月异,药物研究已进入制剂创新时代,新型的给药系统,如缓释和控释制剂等越来越备受人们的青睐,其巨大的市场潜力,广阔的发展前景,推动着我国医药产业的迅猛发展。 1缓控释制剂的定义与类型 1.1缓释制剂(sustained-releasesystem)有时亦称长效制剂或延效制剂,是指通过适宜的方法延缓药物在体内的释放、吸收、代谢以及排泄的过程,从而延长药物的作用时间或者减轻其毒副作用的给药系统,动力学为一级释药。主要类型有:不溶性骨架制剂、生物溶蚀性骨架制剂、亲水凝胶骨架制剂及缓释包衣制剂等。常见剂型有片剂、胶囊剂、颗粒剂等[1],如阿司匹林缓释胶囊、硫酸吗啡缓释片等。 1.2控释制剂(controlled-releasesystem)能够控制药物释放速率使其符合药物动力学需要,保持较长时间体内药物治疗浓度的恒定,免除峰谷现象,药物以受控形式恒速(以零级或接近零级速率)释放或者被控制在作用器官等特定吸收部位释放,动力学为零级或接近零级释药。主要类型有:定速释放制剂,如骨架型、薄膜包衣型、渗透泵型、离子交换树脂型、包合物型、微球(囊)型等缓控释制剂等[2];定位释放制剂,如胃内滞留漂浮制剂、结肠释药制剂;定时释放制剂,如通过调节聚合物材料的溶蚀度来实现在预定的时间内释放药物,或用生理反馈原理和计算机调节技术来达到定时释药目的脉冲释药制剂[3]、膜控剂等。控释不仅包含缓释作用,而且药物的释放控制在某一定值,其动力学比缓释制剂有预见性和重现性。有时把靶向给药系统、透皮给药系统、黏膜给药系统、植入给药系统等也归属于广义的控释制剂范畴[4]。 2缓控释制剂的优越性 军事医学科学院毒物药物研究所梅兴国教授认为,药物制剂的研究和生产应用形成了四大类释药系统同时蓬勃发展的格局:普通释药系统、缓释给药系统、控释给药系统、也包括“智能化”自调控系统、靶向给药系统等。目前应用广泛、发挥重大作用的是普通释药系统,但其缺点显而易见:①不论口服和注射,血药浓度波动性大,有峰-谷现象,血药浓度达峰时,易超过最佳的治疗浓度,易产生不良反应,甚至中毒;在谷浓度时,低于最小有效浓度,则影响疗效;②给药次数常达3~4次/d,给药不方便;③治疗指数小,消除半衰期短的药物频繁给药可导致蓄积中毒等;④普通制剂受胃肠道生理因素影响较大的药物(如氯化钾)等,血药浓度不稳定。而缓控释制剂可以有效减缓药物“峰-谷现象”,保持平稳持久的有效血浓度,治疗作用持久,给药次数减少,方便用药。同时改善药物在体内的动力学参数,在减少药物剂量的基础上,提高靶位的药物浓度,进而最大限度地提高药物的治疗指数,增加药物的疗效,减少药物的不良反应。如近年在国内上市的盐酸羟考酮控释片,自1995年在美国上市,由于起效迅速,持久高效,被广泛用于治疗癌痛、骨关节炎痛、带状疱疹后神经痛,是全球麻醉药品消耗量增长较快的品种[5];阿司匹林缓释胶囊、布洛芬缓释胶囊等可提高疗效,降低毒性和不良反应;硝苯地平渗透泵,1次/d给药,维持24h平稳血浓度,恒速释放,明显降低不良反应[6];多肽类药物在体内生理条件下,易被破坏,相对分子量大,难以吸收,半衰期又短,无法普通给药,研制成缓控释制剂为临床成功应用提供了方便[7]。3缓控释制剂的局限性 虽然缓控释制剂有其明显的优越性,但并不是所有的药物都能制备。临床上制成缓控释制剂的药物主要有:心血管系统药物、抗消化性溃疡药、解热镇痛药、抗精神失常药等。适于制成缓控释制剂的药物大多为固体药物,与药物的溶解度和稳定性有关,水溶性较大的药物比较适合制成控释制剂,溶解度小于0.01g/ml的药物制成控释制剂时,常需要同时考虑增加溶出及生物利用度等,如地高辛溶解速率低,吸收影响较大。①溶解度与胃肠道生理pH关系密切的药物很难控制释药速率,不宜制成理想的缓控释制剂;②易水解、易被酶代谢的、诱导或抑制酶合成的、经肠壁代谢或具首过效应的、口服吸收不完全或吸收无规律的药物(如季铵盐类),因为药物在血液中浓度变化大,难以控制和维持平稳的血药浓度,不宜制成缓控释制剂;③与血浆蛋白结合率高的药物不宜制成缓释制剂,因为结合作用能延长药物的活性,使药物的作用时间延长,易造成减效或体内蓄积;④半衰期过长和过短的药物也不宜制备缓控释制剂,因为半衰期过长(t1/2>10h)很可能导致药物在体内更多地累积而产生毒副作用,过短(t1/2<1h)所需剂量过高,超出一般剂型所容纳的负荷,且给患者和制备带来困难;一般剂量超过0.5g的药物不宜制成缓控片或胶囊,半衰期为3~6h的药物较为理想。 4缓控释系统的发展 4.1缓控释技术日益完善,药物品种显著增加进入20世纪90年代的缓控释制剂正发展成各具特点、又相互结合的三种类型,即定速、定时、定位释药。缓控释系统是国内外发展最快的新型给药系统,尤其是口服缓控释系统,目前能进入生产的也以口服制剂为主。2000~2005年控释制剂的全球释药系统销售额增长率为87.86%。由于开发周期短,投资少,经济风险低,技术含量增加,附加价值显著提高而被制药企业看重,国外上市的该类制剂品种达200余种,500多个规格,国内也在不断增加,05版药典已达十多种,更多的品 ?综述与讲座? 缓控释制剂的研究现状 王桂梅①魏仁东② (①山东药品食品职业学院,山东淄博255011;②青岛市传染病医院,山东青岛266033) [关键词]缓控释制剂迟效制剂 [中图分类号]R944[文献标识码]A
缓控释制剂介绍
第十六章缓控迟释制剂 教学目的:通过介绍缓控释制剂的定义、特点及应用,学习缓释、控释制剂的类型、释药原理,熟悉缓释、控释制剂的处方设计原理和制备工艺、常用辅料及体内外评价方法。 教学要求: 1、掌握缓释、控释制剂的定义、特点。 2、熟悉缓释、控释制剂的类型和原理。 3、熟悉缓释、控释制剂的处方设计原理和制备工艺、常用辅料。 4、掌握缓(控)释制剂的体内外评价方法。 5、了解口服定时和定位释药系统。 6、掌握靶向制剂的定义、分类、特点、结构及体内作用机制、靶向性评价。 7、了解主动靶向制剂和前体药物;物理化学靶向制剂。 §1概述 背景: 剂型的发展经历四个阶段:第一代为普通制剂;第二代为缓释制剂、肠溶制剂等;第三代为控释制剂,以及靶向制剂;第四代为基于体内反馈情报靶向于细胞水平的给药系统。其中第二代至四代药物制剂,统称为药物传递系统。药物传递系统分为速度控制型给药系统,方向控制型给药系统,应答式给药系统。 对于TI值为2-4的药物以及消除半衰期短的药物在以普通释药系统给药时常出现以下三种情况: ①小剂量频繁给药以维持血药浓度; ②剂量较大,峰浓度达到有效治疗浓度但给药间隔超过药物消除时间,血药浓度长时间低于有效治疗浓度。 ③剂量大,给药次数减少,有效治疗浓度的维持时间长,但峰浓度超出治疗窗,导致副反应。 (1)缓释制剂:指用药后能在较长时间内持续释放药物以达到长效作用的制剂。 控释制剂:指药物能在预定的时间内自动以预定速度释放,使血药浓度长时间恒定维持在有效浓度范围的制剂。广义的讲,控释制剂包括控制药物的速度、方向和时间,靶向之际、透皮吸收制剂均属此列。狭义的控释制剂则一般是指在预定时间内以零级或接近零级速度释
缓释控释药物市场和研究现状
缓释控释药物市场和研究现状 1.概述: 目前新化学结构药物的研究和开发越来越需要更大的投资并且越来越艰难。有关资料表明,近年来国外开发一个新药的周期一般需要八九年时间,资金投入七八亿美元,开发风险越来越大。面对这种情况,业内人士认为对已经上市的药品进行剂型改革,将其开发成服用方便、附加值较高的控缓释制剂,不失为新药开发的一种补充和有效手段。 控缓释制剂的研究始于50年代末,1965年开始有文献发表,70年代被医药界认可,近20多年来受到制药领域的普遍重视,发展较快,上市的药物品种和制剂类型逐渐增多,发展成各具特点又相互结合的三种类型:定时、定速、定位释药。1999年度全球此类产品销售额接近100亿美元,2002年,全球口服控缓释制剂市场销售额为216亿美元,据预测,2005年全球释药技术市场销售额可望达到1000亿美元(中国医药报) 2.研究热潮: ?决策资源(Decision Resources)公司的新报告《新涌现的生物药物释放系统》研究报告,论述了目前采用的主要的新的药物释放系统,认为在以后的10年中,药物释放技术的最新的创新将成为全球医药公司新的增长点之一。 ?强生公司2002年巨资收购了国际最著名的释药技术公司ALZA,很多著名跨国公司也都有缓控释产品上市或临床研究。 ?缓控释给药系统是国内最著名的沈阳药科大学,南京药科大学以及多个医科大学的药学院的重点学科,多年都有多个缓控释药的研究项目 ?在2004年,郑筱萸特别提出希望利用释药技术,对中药原料精加工,提高其附加值,以提高中国在这一领域的地位。 ?中国药典从1990年版开始收载“控释片”,2个品种(即为盐酸地尔硫卓控释片、茶碱控释片。1995年版及其增补本收载了8个缓释制剂、7个肠溶制剂,共计15个品种。由于国内外缓释/控释制剂开发研究的势头正旺,因此,该类制剂的质量控制自然成为不可忽视的环节。2000年版美国药典(USP24)共收载45种缓释/控释制剂。2000年版中国药典将在1995年版的基础上增订4个缓释制剂品种,共计19个品种。该版药典还增订“缓释、控释制剂指导
口服缓控释制剂研发概述
口服固体缓控释制剂的开发概述 缓控释制20世纪60年代开发至今,无论在理论研究还是生产实践等方面都取得了很大的发展。对药物释放机理、控释方法和技术、质量控制以及生物等效性等的研究日趋成熟。据预测2010年整个释药系统的市场份额为1290亿美元,其中口服的将占46%。其中2007年单个品种超过10亿美元有埃索美拉唑、兰索拉唑、泮托拉唑钠、雷贝拉唑钠肠溶制剂,文拉法辛控释胶囊、盐酸羟考酮控释片、混合苯丙胺盐控释片、盐酸哌甲酯控释片等品种。目前在国内市场上销售较好的品种有康泰克缓释胶囊、芬必得缓释胶囊、泰诺缓释片等。我国对缓控释的研究开始于80年代中后期,在开发中主要以仿制为主,研究内容以实验室规模为主,基础研究相对薄弱,在实验室成果向生产的转化方面也存在不少问题,因此,缓控制剂在国内尚有很大的发展空间。 一、基本概念及特点 中国药典2005年版对缓控释制剂的定义做了严格的区分,缓释制剂是指口服药物在规定释放介质中,按要求缓慢的非恒速释放,且每24小时用药次数与相应的普通制剂比较从3~4次减少至1~2次制剂;而控释制剂系指口服药物在规定的释放介质中,按要求缓慢的恒速或接近恒速释放,且且每24小时用药次数与相应的普通制剂比较从3~4次减少至1~2次制剂。而在美国药典中,对缓释和控释制剂未做区分,而是将缓释(sustained release)、控释(controlled release)、长效(prolonged release)等视同为延释(extended release),即比普通制剂的给药次数至少减少1/2或者显著提高病人顺应性或治疗效果的制剂。 因此,缓控释制剂的主要优点有:药物缓慢释放使血药浓度平稳,避免峰谷现象,有利于降低药物的毒副作用。如降糖药或降压药的缓控释制剂与普通制剂相比不易造成低血糖或者低血压。另外,缓控释制剂与普通制剂相比,减少了给药次数,对于需要长期服药病人来说,提高了顺应性。缓控释制剂属于5类新药,可享有3年的市场监测期,并享有定价优势。 二、模型药物的选择 并非所有的药物都适合开发成缓控释制剂,因此,在选择药物时一般需考虑以下几个方面 1、根据临床需要
关于药物缓释控释制剂的研究进展概述-药物制剂工程论文
关于药物缓释控释制剂的研究进展概述 摘要 随着医药制剂技术的持续发展,医药界高度重视新产品、新剂型的开发研究。与新化合物实体开发相比,新的制剂具有成本小、周期短而见效快的优势。近年来,药物缓控释制剂的研究取得了较大的进展,而且具有广阔的研究与发展前景。 关键词:药物;缓释控释制剂;辅料;研究进展 随着社会经济的日益增长,我国制药水平也不断发展。近几年来,为了提高药物的使用率、缩短患者的治疗时间及减轻用药时给患者带来的巨大痛苦,国的许多制药厂都成立了主要以研究药物制剂为主的部门。此类制剂药物因具有给药次数少、对患者的肠胃刺激性小、治疗时间短、使用比较安全等作用,深受患者、医生的信赖。由于缓释、控释药物制剂的应用率不断的上升,现今对缓释、控释药物制剂的要求也越来越严格。药物的一般剂型是片剂和注射剂,但多数药物不适合应用这两种剂型。对治疗糖尿病和心血管疾病的患者,若选择片剂、注射剂治疗时,当药物与血液循环融合后,会产生相对明显的血药浓度波动,出现了峰谷情况,容易产生毒副作用,使之有效治疗浓度较低不能很好的起到治疗的效果。但缓释、控释药物制剂却克服了这一现象。 1、控释缓释制剂的优点 近20 多年来,国外极为重视研究新剂型和新制剂的,其中的控释和缓释口服制剂是热点。相比于普通制剂,缓控释制剂的优点在于: 1.1 对于半衰期短,或者给药频繁的药物,可以减少服药的次数,使病人服药的顺应性得到提高,方便使用。尤其对于需要长期服药的心血管疾病、心绞痛、高血压、哮喘等慢性疾病患者特别适用。 1.2 有利于平稳血药浓度,“减缓峰谷”现象,从而使发生不良药物反应的频率和严重程度得以降低,临床用药更为安全。 1.3 缓慢释放,增强药物的有效性。药物在口服后释放出有效成分的速度缓慢,吸收速度也较恒定,药物作用时间维持较长。
药剂学第十九章缓释、控释制剂和迟释制剂
第十九章缓释、控释制剂和迟释制剂 一、概念与名词解释 1.controlled-release preparations 2.生物利用度 3.生物等效性 4.sustained release formulations 5.靶向制剂 6.主动靶向制剂 7.EPR效应 二、判断题(正确的划√,错误的打×) 1.药物制剂的发展可将制剂分为5代。( ) 2.缓控释制剂以静脉注射剂作标准参比制剂,两者血中药物浓度不呈现明显差别时,即认为生物等效。( ) 3.抗菌素类药物宜于制成缓控释制剂。( ) 4.剂量大于l克的药物不宜制成缓控释制剂。( ) 5.半衰期小于1小时或大于12小时的药物,一般不宜制成缓、控释制剂。( ) 6.半衰期很长的药物不宜制成缓、控释制剂。( ) 7.缓、控释制剂在获得预期疗效的同时,可以减小药物的毒副作用。( ) 8.缓、控释制剂主要有骨架型和贮库型两种类型。( ) 9.减小药物的粒径,降低药物的溶出速度,可使药物缓慢释放,达到长效。( ) 10.缓释制剂可以通过适当的制备手段使得所有药物都可以缓释。( ) 11.邻苯二甲酸酞酸酯(CAP)、Eudragit E、L和S都为肠溶性材料。( ) 12.缓、控释制剂的生物利用度应为普通制剂的譬80%一120%。( ) 13.渗透泵片中药物的释放速率为零级,并与pH无关。( ) 14.某些药物需包肠溶衣,这是为了防止其在胃内分解或对胃有刺激。( ) 15.制成塑料骨架片形式长效制剂,药物必须是易溶于水。( ) 16.在胃肠分解的药物应包肠溶衣。( ) 17.缓控释制剂与普通制剂相比可减少用药的总剂量,因此可用最小剂量达到最 大药效。( ) 18.药物以分子或微晶、微粒的形式均匀分散在各种载体材料中,形成贮库型缓、 控释制剂。( ) 19.青霉素普鲁卡因盐的溶解度比青霉素钾盐的溶解度小,因此有可能延长药效。( ) 20.药物在胃、小肠和结肠都有吸收时,可以考虑设计24小时服用一次的缓释制剂。( ) 21.华法林不适于制成缓释制剂是由于其半衰期很长。( ) 22.核黄素(维生素B2)通过主动转运吸收,可制成缓释制剂,提高在小肠的吸收。( ) 23.作用剧烈的药物为了安全,减少普通制剂给药的峰谷现象,可制成缓、控释制剂。( ) 24.若药物在胃、小肠、大肠均有一定的吸收,可制成12小时服一次的缓释制剂。( ) 25.最适于制备缓、控释制剂的药物半衰期为小于12小时。( ) 26.控释小丸或膜控型片剂的包衣中加入PEG的目的是成膜剂。( ) 27.渗透泵片控释基本原理是片外渗透压大于片内,将片内药物压出。( ) 28.测定缓、控释制剂释放度时,至少应测定5个取样点。( ) 29.药物的靶向从到达的部位可以分为三级。( )
浅述口服缓控释制剂的研究进展
浅述口服缓控释片剂的研究进展 姓名:汪惠专业:12制药工程年级:12级一班学号:12313035 正文: 缓控释制剂系指用药后能在较长时间内持续释放药物以达到长效作用的制剂,与普通制剂相比,通常具有以下优点。首先,对于半衰期短的或者需要频繁给药的药物,可以减少给药次数,从而提高患者的顺应性。其次,血药浓度峰谷波动小,血浓平稳,可避免超过治疗血药浓度范围的毒副作用,保证药物的安全性和有效性。以下简要综述近几年口服缓控释片剂的研究动态和发展现状。 1 骨架型缓控释片剂 骨架型缓控释片剂是依靠其骨架材料作为阻释剂,药物被包藏在不同的骨架中,以减缓药物的溶出速度和扩散速率而达到缓控释的效果。 1.1 亲水性凝胶骨架片 这类骨架片主要材料为羟丙甲纤维素(HPMC),药物的释放速度取决于药物通过凝胶层的扩散速度。 贺周扬等[1]经过正交设计实验优化处方的测定,表明该凝胶骨架片具有良好的缓释效果。高源等[2]筛选出HPMC K100M用量为40%的骨架片剂无突释效应,缓释周期12小时。 中国药科大学的王福坚等[3]利用Box-Behnken效应面法筛选酒石酸美托洛尔聚氧乙烯骨架片的处方,并取得良好的缓释效果。 当前亲水凝胶骨架片的研究基本上是骨架型缓释片研究中最多的一部分,大多数药物均可利用其制成缓释制剂。 1.2 蜡质类骨架片 蜡质骨架片的骨架材料通常为水不溶但可溶蚀的蜡质材料,其释药机制主要为孔道扩散与溶蚀释放。 Bhalekar等[4]比较了蜂蜡和巴西棕榈蜡两种蜡质对缓释效果的影响,结果发现这两种蜡质材料骨架片的释放均达到了缓释效果。方平飞等人[5]经过单因素考察和正交设计优化制备工艺得到该蜡质骨架片最佳工艺条件。 与其他类型缓释材料相比,蜡质骨架材料具有一定的优点。今后研究的重点主要放在制备工艺的选择和优化。 1.3 不溶性骨架片 不溶性骨架片主要以聚乙烯、聚氯乙烯、甲基丙烯酸-丙烯酸甲酯共聚物等为骨架材料。这类骨架片在药物释放以后,不溶性骨架材料整体从粪便排出。 柴佩华等[6]用湿法制粒压片法制得片剂,最后实验测得其累积释放度符合硝苯地平缓释片的释放要求。 因为此类骨架材料不能降解,可能导致药物释放的不完全,从而降低药物的生物利用度。所以此类骨架片的应用不多,相关的文献报道也比较少。 1.4 新型骨架片 在以上传统单一型骨架片的基础上,研究人员不断引入新的设计思想,使骨架释药系统在保持现有的剂型优势的同时更加完善,以下简要介绍几种新型骨架片。 1.4.1 多层骨架片 多层骨架片是通过调节各层排列方式,改变释药面积和各层采用不同骨架及载药量来调节释药速率。能够克服单一骨架系统释药速率随时间逐渐减小的缺陷,有时甚至能达到良好的控释效果。这类骨架片通常可以得到HMH、HML、LML等多种类型的多层骨架片[7]。 H.V. Chavda等[8]研究表明这种三层骨架片可以延缓药物的释放,且调节各层瓜尔胶的
关于药物缓释控释制剂的研究进展概述
科技论坛 关于药物缓释控释制剂的研究进展概述 冯敏 (葵花药业集团佳木斯鹿灵制药有限公司,黑龙江佳木斯154000) 1控释缓释制剂的优点近20多年来,国外极为重视研究新剂型和新制剂的,其中的控释和缓释口服制剂是热点。相比于普通制剂,缓控释制剂的优点在于: 1.1对于半衰期短,或者给药频繁的药物,可以减少服药的次数,使病人服药的顺应性得到提高,方便使用。尤其对于需要长期服药的心血管疾病、心绞痛、高血压、哮喘等慢性疾病患者特别适用。 1.2有利于平稳血药浓度,减缓”峰谷“现象,从而使发生不良药物反应的频率和严重程度得以降低,临床用药更为安全。 1.3缓慢释放,增强药物的有效性。药物在口服后释放出有效成分的速度缓慢,吸收速度也较恒定,药物作用时间维持较长。 1.4使药物化学稳定性得到增强。在贮存期间,某些药物的常规制剂往往容易失效变质,或者被胃酸破坏,而将其制成缓控释制后,可以定时、定位地加以释放,稳定性可以有效提高。 2在缓控释制剂中常用辅料的研究进展2.1在缓控释制剂中多糖水凝胶的应用 水凝胶是一些高聚物或共聚物对大量水分子进行吸收后形成的溶胀交联状态的半固体,其结构呈现三维网状。与其他高分子聚合物不同的是,水凝胶溶胀性能显著,其原因在于水凝胶中有大量的亲水基团存在,所以可以吸收并保持大量的水分,不仅增加重量而且增大体积。对于低分子溶质,水凝胶的透过性也很高,自身具有优良的生物相容性和可降解性而且容易合成。水凝胶的结构可以使用化学修饰的方法进行改变,从而使凝胶的溶胀度得到调控。近年来,医学界越来越关注水凝胶的研究,人们以水凝胶为载体,利用某种特殊手段控制、调节凝胶内药物的扩散和释放速率,研制出新型的脉冲、触发式释放和控释给药系统,从而实现了定位释放化学和蛋白质多肽类药物。 2.2果胶及果胶钙在缓控释制剂中的应用 果胶是由甲酯化半乳糖醛酸聚合物组成、分子量约在1030万之间的酸性多糖。果胶的酯化度或甲氧基含量的高低,可以利用分子中半乳糖醛酸的比例来表征,这样能够将其分为高甲氧基和低甲氧基两种果胶。果胶的溶解度随着增大的甲氧基含量而减小。果胶钙是果胶的中游离羧基与钙离子反应而生成的钙化衍生物,甲氧基在果胶中的含量越低,就会存在越多的游离羧基,也就越容易与钙离子反应生成果胶钙,果胶钙的溶解度随着钙化度的提高而降低。当甲氧基含量或果胶钙的钙化度在果胶中足够高时,在水、酸碱及其他溶剂中都不会溶解,只能由结肠内的果胶酶来进行降解,从而产生一系列可溶性寡聚糖。近年来,一些研究利用果胶和果胶钙的上述特性,通过对于果胶中甲氧基的含量和果胶钙的钙化度进行适当的控制,可以控制果胶和果胶钙的溶解度,利用它来制造缓、控释制剂效果良好。 2.3聚维酮在缓释控释制剂中的应用聚维酮为无定形粉末,颜色为白色或者乳白色,没有味道或几乎没有味道,具有易流动性和吸湿性等稳定的性质,容易在水、甲醇、乙醇、丙二醇、氯仿等中溶解,而不溶于乙醚和丙酮。有实验以聚维酮为载体,用将非诺贝以溶剂法特制成固体分散物,又以海藻酸钠为辅料,蒯成水溶性凝胶骨架片,经体外溶出试验表明,非诺贝特级释片释放机制与一级动力学模型相符,缓释效果良好。 2.4卡波普在口服缓释制剂中的应用20世纪70年代末,国外开始在缓释制剂中应用卡波普作为骨架材料。卡波普的应用在20世纪90年代以来日益广泛。卡波普 (carbop01)是由丙烯酸交联聚合物与聚烷基蔗糖或聚烷基季戊四醇的共聚物。作为缓释材料,卡波普缓控释制剂目前已经在多种药物中加以应用,其相关的产品也已经问世。 其良好的缓释性能,以及特殊的pH 依赖型释药性质,应用前景十分广阔,目前国内多家单位已经开始进行相关的研究与应用。 2.5乙基纤维素在缓控释制剂中的应用 乙基纤维素(EC)是纤维素链中的部分羟基被乙氧基取代的纤维素衍生物,作为一种水不溶性纤维素衍生物,其具有最广泛的应用。近年来,乙基纤维素被广泛地应用在药物制剂中,在固体分散体、包衣制剂、微囊、微丸、及骨架型缓释片方面,制备缓释剂型都可以采用乙基纤维素来进行。与发达国家相比,我国缓控释制剂的研究起步较晚,20世纪60年代开始起步,80年代以后得到迅速发展,但临床投入的品种不多,目前较多地应用于临床的产品多为进口或者合资生产的。作为一类新剂型,有待于进一步提高设备、技术、质量控制。另外,我国在新剂型和新制剂方面的自主开发能力也不是很强,缺乏自主创新意识,虽然已经开发了很多缓控释制剂品种,但是绝大多数都是仿制的。在制剂产品制造的过程中,辅料必不可少。国内辅料存在着较多的问题,其品种和规格也对于研究和生产缓控释制剂带来了困难。近年来,研究缓控释制剂取得了一定的进展,打破一些限制,盐酸普萘洛尔等首过效应强的药物、半衰期很长的卡马西平等已制成缓控释制剂,复方缓控释制剂增加的趋势也日益明显。另外,研究和应用新辅料,发展缓控释制剂也起到了促进作用,开发的新品种、新技术逐渐增多,而且获得了更加稳定的产品质量。例如:壳聚糖的生物和血液的相容性良好,利用壳聚糖微球包封药物,能够使药物释放得到控制,药物的疗效得以延长,而且能够有效地降低药物毒副作用。另外,研制和引进新设备,如高效薄膜包衣机、高速压片机等,也促进了国内缓控释制剂的质量的提高。 3结论综上所述,缓控释制剂因为其具有给药次数少、方便用药、药物的安全有效性高,对胃肠道产生的不良反应小等优点,被广泛地重视,并深入地进行研究和应用。同时,随着研究的深入,缓控释制剂也在不断发展和完善,这类新型给药系统的发展前景和市场潜力是十分广阔的。缓控释制剂的研究对于发展医药科研和制药工业具有极为重要的推动作用。 参考文献 [1]孙黎,王.药物新剂型的进展概况[J].安徽医学,2010,31(11):1387-1388. [2]朱兴年.药物缓释控释制剂的研究进展[J].药学实践杂志,2002,20(3):155-157. [3]白仙娥,白静.援控释制剂的研究进展及其临床应用[J].中国药物与临床,2004,(9):701-703. 摘要:随着医药制剂技术的持续发展,医药界高度重视新产品、新剂型的开发研究。与新化合物实体开发相比,新的制剂具有成本小、周期短而见效快的优势。近年来,药物缓控释制剂的研究取得了较大的进展,而且具有广阔的研究与发展前景。 关键词:药物;缓释控释制剂;研究进展 138··
(完整版)缓释、控释制剂制剂习题及答案
缓释、控释制剂和口服定时、定位给药系统 练习题: 1.缓释制剂 2.控释制剂 3.迟释制剂 4.脉冲制剂 5.结肠定位制剂6.肠溶制剂 7.释放度 8.生物粘附 二、选择题 (一)单项选择题 1.渗透泵片控释的基本原理是 A.片剂膜内渗透压大于膜外,将药物从小孔压出 B.药物由控释膜的微孔恒速释放 C.减少药物溶出速率 D.减慢药物扩散速率 E.片外渗透压大于片内,将片内药物压出 2.以下可用于制备亲水凝胶骨架片的材料是 A.海藻酸钠 B.聚氯乙烯 C.脂肪酸 D.硅橡胶 E.蜂蜡 3.以下对渗透泵片的叙述中,错误的是 A.释药不受胃肠道pH的影响 B.当片芯中药物浓度低于饱和溶液浓度时,药物以非零级速率释放 C.当片芯中的药物未被全部溶解时,药物以一级速率释放 D.药物在胃与肠中的释药速率相等 E.药物的释放与半渗透性衣膜的厚度有关 4.下列数学模型中,不是作为拟合缓(控)释制剂的药物释放曲线的是 A.零级速率方程 B.一级速率方程 C. Higuchi方程 D.米氏方程 E. Weibull分布函数5.下列关于骨架型缓控释片的叙述中,错误的是 A.亲水凝胶骨架片中药物的释放比较完全 B.不溶性骨架片中要求药物的溶解度较小 C.药物从骨架片中的释放速度比普通片剂慢 D.骨架型缓控释片一般有三种类型 E.骨架型缓控释片应进行释放度检查,不进行崩解时限检查 6.可作为渗透泵制剂中渗透促进剂的是 A.氢化植物油 B.脂肪 C.淀粉浆 D.蔗糖 E.邻苯二甲酸醋酸纤维素 7.下列不是缓、控释制剂释药原理的为 A.渗透压原理 B.离子交换作用 C.溶出原理 D.扩散原理 E.毛细管作用 8.可作为溶蚀性骨架片的骨架材料是 A.硬脂酸 B.聚丙烯 C.聚硅氧烷 D.聚乙烯 E.乙基纤维素 9.最适合制备缓(控)释制剂的药物半衰期为 A.15h B.24h C.48h D.<1h E.2~8h 10.可作为不溶性骨架片的骨架材料是 A.聚乙烯醇 B.壳多糖 C.果胶 D.海藻酸钠 E.聚氯乙烯 (二)配伍选择题(备选答案在前,试题在后;每组均对应同一组备选答案,每题可能有一个或多个正确答案;每个备选答案可重复选用,也可不选用。) 【1-5】 A.聚乙二醇 B.乙基纤维素 C.羟丙甲纤维素 D.单硬脂酸甘油酯 E.硅橡胶 1.可作为不溶性骨架材料的是 2.可作为控释膜材料的是 204
缓控释制剂的研究发展
缓控释制剂的研究发展 随着科学的发展,由于普遍制剂的名吸收特性造成血药浓度的峰谷现象,使其在血药浓度较大或生理条件变化时超过药物中毒的剂量,故人们逐渐大目光投到缓控释制剂上来。所谓的缓释制剂系指的是:用药后能在较长时间内持续释放药物以达到延长药效目的德制剂;药物释放主要是一级速度过程。控释制剂系指药物能在设定的时间内自动以设定速度释放,使血药浓度长时间恒定地维持在有效浓度范围内的制剂,其药物释放主要是在预定的时间内以零级或接近零级速率释放。现在我们主要讨论缓控释制剂的研究发展。 缓控释制剂是国外从20世纪50年代末开始研究,70年代以后,国外一些大公司取得一些突破,至今有着40多年的历史了。口服缓释和控释固体剂型的研究和开发已成为当今医药工业发展的一个重要方向。可以用多种技术制备口服缓释和控释制剂。目前的缓控释制剂的分类。 缓释,控释制剂的分类; (一)骨架型缓,控制剂 1)凝胶骨架片这类骨架片主要的材料为羟丙甲纤维素(HPMC),甲基纤维素,羟乙基纤维素,疏甲基纤维素纳,海藻酸钠等。凝胶骨架片中凝胶最后完全溶解,药物全部释放,故生物利用度挺高 (二)蜡质类骨架片这类由不溶解但可以溶蚀的蜡质材料制成 (三)不溶性骨架片这类片剂药物释放后骨架材料整体从粪便排出,在胃肠中不崩解 膜控型缓控释制剂: (一)微孔膜包衣片通常是胃肠道中不溶解的聚合物如醋酸纤维素,乙基纤维素等作为衣膜材料,在包衣中加入少量致孔道剂的物质如PEG类,PVP、PV A 等水溶性物质,也有一些加入水不溶性的粉末如滑石粉,二氧化硅等甚至将药物加在包衣膜内既作致孔剂又作速效部分。 (二)膜控释小片将药物压制成片,外包肠溶衣,再包上含药的糖衣层而得。含药糖衣层在胃液中释药,当肠溶片芯进入肠道后,衣膜溶解、片 芯药物释出,而延长释药时间。 (三)肠溶膜控释片这类控释片是药物片包肠溶衣,当肠溶衣片芯进入肠道后,衣膜溶解,片芯中的药物释出,因而延长释药的时间 (四)膜孔释小丸由丸芯和芯外包裹的控释薄膜衣两部分组成 渗透片泵渗透泵片简称 OROS ,它最大的特点是释药均匀恒定,而且释药速度不受胃肠道可变因素的影响,是迄今为止口服控释制剂中最理 想的一种。 国内开发的缓控释口服制剂主要有:双氯芬酸钠缓释胶囊,扑尔敏控释胶囊,氢溴酸右旋美沙芬缓片,氨茶碱缓释片,复方苯丙醇右旋胺胶囊 国外上市的品种还有心律平缓释片,沙丁胺醇(舒喘灵)渗透泵片,伪麻黄碱渗透泵片,卡马西平缓释片,甲基多巴缓释片,丙戊酸缓释片 发展前景:缓控释制剂无论在国内外的发展前景都是广阔的,因其技术较新,门槛相对见高,因此产品的毛利率相对较高。另外,缓控释制剂以其药物生理上的
药物缓释控释制剂的研究进展
缓控释制剂的研究进展 摘要: 目的介绍缓控释制剂类型及其国内外研究进展 方法以国内外发表的文献为依据,对缓控释制剂类型及研究进展进行分别介绍。 结果与结论目前制备缓控释制剂的技术日益完善,但仍面临一定的问题,需要进一步发展。 关键词:缓控释制剂类型国内外研究进展 1引言 随着高分子材料研究的不断发展进步,我国制药水平也不断发展。近几年来,为了提高药物的使用率、缩短患者的治疗时间及减轻用药时给患者带来的巨大痛苦,国内的许多制药厂都成立了主要以研究药物制剂为主的部门,这从一方面反映了国内药物剂型研发的水平,另一方面也促进了药物制剂的发展[1]。此类制剂药物因具有给药次数少、对患者的肠胃刺激性小、治疗时间短、使用比较安全等作用,深受患者、医生的信赖。由于缓释、控释药物制剂的应用率不断的上升,现今对缓释、控释药物制剂的要求也越来越严格。药物的一般剂型是片剂和注射剂,但多数药物不适合应用这两种剂型。对治疗糖尿病和心血管疾病的患者,若选择片剂、注射剂治疗时,当药物与血液循环融合后,会产生相对明显的血药浓度波动,出现了峰谷情况:药物刚进入体内后,血药浓度很快达到峰值,容易产生毒副作用,之后血药浓度又会快速下降,使之有效治疗浓度较低不能很好的起到治疗的效果[2],但缓释、控释药物制剂却克服了这一现象。
2缓控释药物制剂 2.1缓控释药物制剂简介 缓控释药物是指到达体内后以一定的速度缓慢释放的药物,这样不但能达到平稳的血药浓度,避免血药浓度波动较大而带来的不良反应,而且还能减少给药的次数,增加患者服药的依从性[3]。相比于普通制剂,缓控释制剂的优点在于: 1)减少服药次数,使用方便。 对于半衰期短,或者给药频繁的药物,可以减少服药的次数,使病人服药的顺应性得到提高,方便使用。尤其对于需要长期服药的心血管疾病、心绞痛、高血压、哮喘等慢性疾病患者特别适用。 2)缓慢释放,临床用药更加安全。 有利于平稳血药浓度,“减缓峰谷”现象,从而使发生不良药物反应的频率和严重程度得以降低,临床用药更为安全。 3)缓慢释放,增强药物的有效性。 药物在口服后释放出有效成分的速度缓慢,吸收速度也较恒定,药物作用时间维持较长。 4)药物化学稳定性增强。 在贮存期间,某些药物的常规制剂往往容易失效变质,或者被胃酸破坏,而将其制成缓控释制后,可以定时、定位地加以释放,稳定性可以有效提高。 2.2缓控释制剂分类 目前缓控释制剂发展迅速,种类也多种多样,但较常见的为以下几种类型:口服缓控释给药系统、粘膜给药系统和透皮给药系统。 2.2.1口服缓控释给药系统 口服缓控释给药系统即指经口服延缓、控制药物释放或吸收的一类药物制剂。口服缓控释制剂的发展重点为每日给药一次,适于制备成缓控释制剂的药物范围广泛,而且随着现代制剂技术的发展和临床的需要,一些传统观念上认为不适于制备成缓控释制剂的药物,如抗
缓控释制剂的研究进展
缓控释制剂的研究进展 王武涛 (陕理工生工院(系)生物工程专业072班,陕西汉中 723001) 【摘要】文章介绍近年来国内外缓释控释制剂的研究进展,为缓控释制剂提供参考。近年来缓控释制剂的发展有常用辅料在缓控释制剂中的应用进展、三种缓释控释剂的释药特性、缓控释制剂技术研究进展等。缓释控释制剂发展迅速,其研究发展具有广阔的前景。【关键词】缓控释制剂;释药特性;研究进展 缓释、控释制剂是以药物的疗效仅与体内药物浓度有关而与给药时间无关这一概念为基础发展的第三代剂型。缓(控)释制剂能够降低血药浓度波动,减少给药次数,提高疗效,降低不良反应,而且使用方便,同时相对于其他制剂,因其研究开发周期短、资金投入少、经济风险小、技术含量高、利润丰厚而为制药工业界所看重,是国内外医药工业发展的一个十分重要的方向,因此越来越受到人们的广泛关注。传统的药理学研究表明:心血管疾病、哮喘、胃酸分泌、关节炎、偏头疼等都有昼夜节律性,例如哮喘、心肌梗死等多在凌晨发作,传统的制剂不能在最危险的时刻有效防治这些疾病的发生,而缓控释制剂则可以克服传统制剂的某些缺点。随着科学技术的高速发展,新辅料、新材料、新设备和新工艺的不断涌现及药物载体的修饰等,更为药剂工作者在缓控释制剂领域的探索和发展提供了广阔空间。目前其理论与技术发展日趋成熟,所研究的药物品种和制剂类型都不断增加和扩大,涉及的领域也越来越广泛,现将该制剂的研究进展综述如下。 一、常用辅料在缓控释制剂中的研究进展 1(多糖水凝胶在缓控释制剂中的应用 水凝胶(hydrogel)是一些高聚物或共聚物吸收大量水分子后形成的溶胀交联状态的半固体,其具有三维网状结构。水凝胶与其他高分子聚合物的不同之处在于其
缓、释控释制剂的特点和临床应用注意事项
缓、控释制剂的特点及临床应用注意事项 1、缓释、控释制剂的特点 1.1优点 (1)降低给药频次 普通制剂一般需要每天多次给药,因此常会造成漏服药现象,一些患者甚至会擅自改变给药方案,从而达不到预期的治疗目的。而缓释制剂的载药量高于传统剂型药物的单剂量,且能在较长时间内保持有效的血药浓度,因此为了达到方便用药,提高患者的顺应性,开发每日一次给药的缓释或控释是今后的重要趋势,特别适用于长期服药的慢性病患者,如心血管疾病、哮喘等。地尔硫卓.茶碱.硝苯地平.非洛地平.双氯芬酸钠等均有一天给药一次的产品。 (2)方便给药,提高患者的顺应性 缓控释制剂具有普通制剂不能提供的可以提高病人用药的顺应性的特点。如减少用药次数。随着缓释制剂给药频率的降低,患者漏服的现象很少发生,同时也方便了患者的白天和夜间用药。 (3)吸收完全提高药物疗效 普通制剂的血药浓度处于“波合”时很可能低于有效治疗浓度而不能发挥疗效。而峰浓度时又可能高于最低中毒浓度而产生毒性作用。缓控释制剂在一定程度上避免了“峰合现象”。且与普通制剂相比,药物在吸收部位滞留的时间较长,吸收较为完全。因此具有较高的生物利用度,从而起到增加药物疗效的作用。 (4)降低毒副作用
普通药物制剂血药浓度处于“波峰”时可能会高于“最小中毒浓度”因而容易产生不良反应甚至中毒,缓控释制剂可以克服这一点,降低了药物的毒副作用,提高了用药的安全性。另外,一些缓控释制剂具有局部定位作用,在提高了局部治疗效果的同时,还可以降低全身吸收带来的毒副作用。 (5)降低药物对胃肠道的刺激 普通制剂口服后迅速在胃肠中崩解、溶出,对胃肠产生较大的刺激作用。若制成缓控释制剂可降低药物溶出过快所造成的对胃肠的刺激。如普通的阿司匹林在体内水解生成水杨酸后对胃肠道粘膜有较大的刺激作用,而将其制成缓释片后,药物缓慢释放,在很大程度上可缓冲对胃肠道粘膜的刺激性。 (6)全程治疗费用降低 虽然应用缓控释制剂花费与普通制剂相比较高,但从全程治疗花费看,缓控释制剂具有很大的优越性,这也要基于疗效的提高,毒副作用减少及陪护人员护理时间、疗程缩短,等多方面原因。 1.2缺点 (1)临床应用中对剂量调节的灵活性降低,如果遇到某种特殊情况,往往药物作用不能立刻或较快停止。 (2)缓控释制剂往往是基于健康人群的平均动力学参数而设计。疾病状态时药物动力学参数会有所改变,不能具体情况灵活调整给药方案。 (3)缓控释制剂因设备和技术、工艺高精价格较昂贵。
口服缓控释制剂的研究概述_褚杰
药物生物技术 Pharmaceutical Biotechnology2015,22(3):275 278 口服缓控释制剂的研究概述 褚杰1,刘秀萍2,臧恒昌2* (1.济南护理职业学院,山东,济南250102;2.山东大学药学院,山东济南250012)摘要随着人们对药品发挥药效的准确度与精确度要求的提高,缓控释制剂因其本身具有的剂型优势,成为近年来研究的热点,缓控释制剂是指在水中或某些特殊介质中缓慢释放药物的制剂,可适用于多种给药途径,制作成多种药用剂型。本文对口服缓控释制剂的分类、应用优势、释药机理与处方设计等的研究进展进行了概括,对关键质量控制属性-释放度的测定方法等进行总结及预测,概括了缓控释制剂的应用现状、高分子载体的发展现状及生化药物缓控释剂型等的应用及研究现状。从多方面对影响缓控释制剂发展的因素作了分析,并对缓控释制剂的发展应用前景做了预测。随着科学技术的高速发展,新辅料、新材料、新设备和新工艺的不断涌现及药物载体的修饰等,缓控释制剂会占据大部分医药市场。 关键词缓释制剂;控释制剂;缓控释技术;高分子;生物药物;缓控释材料 中图分类号R9文献标志码A文章编号1005-8915(2015)03-0275-04 早在20世纪70年代初,国外就开始了缓释和控释制剂的研究开发,至今已有40余年的历史。近年来,随着高分子材料的应用及给药系统研究的深入,缓控释制剂日益增多。口服缓控释制剂具有使血药浓度平稳,有利于降低药物的毒副作用,可保证其安全性及有效性,使用更方便等特点[1],越来越受到临床重视。其中,口服缓控释制剂以片剂应用最为广泛,口服缓控释片又以缓控释骨架片居多。需要注意的是,口服缓控释片在临床使用中存在因为不了解其剂型特点导致的服用次数过多、剂量较大及掰开服用等不合理现象[2],需要在医师的指导下服用。 1口服缓控释制剂简介 1.1概念 严格意义上来说,缓控释药物分为控释制剂与缓释制剂两种,它们在释药规律与血药浓度上有所区别。控释制剂侧重于定时、匀速、定位释放药物;缓释制剂侧重于长效浓度。控释剂型更严格、更全面地针对体内诸多影响因素,更符合药物充分利用规律。 1.2应用优势 对生物半衰期短或需要频繁给药的药物,可以减少服用次数,方便患者长期服药,很大提高病人服药的顺应性[3]。通过释药速度的控制,药物以适宜的速度缓慢吸收,使血药浓度平稳,避免或减小峰谷现象,有利于降低药物的毒副作用和提高疗效。对胃肠道刺激性大的药物,通过释药速度的控制,可降低在胃肠道的局部浓度,从而减小刺激性。有时可减少用药的总剂量,因此可用最小剂量达到最大药效。增强药物化学稳定性,某些药物的常规制剂在贮存期间容易变质失效或口服后经胃酸作用而破坏,制成缓控释制剂后,可按要求定时、定位释放,提高稳定性。 1.3口服缓控释制剂的分类 按制备工艺分为: (1)骨架型缓控释制剂:目前的骨架材料主要有不溶性骨架材料、亲水凝胶骨架材料、生物溶蚀性骨架材料以及混合骨架材料4种[4]。 (2)薄膜包衣缓控释制剂[5]:通过包衣膜控制药物扩散到胃肠液的速度,控制和调节制剂中药物的释放速度。药物性质、包衣材料的种类、衣膜的组成、包衣厚度和包衣工艺等是决定制剂缓释效果的主要因素。 (3)固体分散型缓控释制剂[6]:不仅能显著提高药物的溶解度和生物利用度,而且能通过相应辅料的选择达到很好的缓控释效果。 (4)膜控型微丸[7]:按其作用特点可分为普通缓释型、脉冲释放型及定位释放型。 1.4缓控释制剂常见的释药系统 缓控释制剂就释药特点分为3种释药系统:(1)定时释药系统;(2)定位释药系统;(3)定速释药系统。 定速释放制剂包括:骨架型、薄膜包衣、渗透泵型、固体分散体、微囊和微球等缓控释制剂。 572 *收稿日期:2014-09-01修回日期:2014-09-19 作者简介:褚杰,副教授,专业基础部(系)主任,药学方向,山东药理学会理事,E-mail:sdjnchujie@https://www.360docs.net/doc/857921064.html,。 *通讯作者:臧恒昌,教授,硕士生导师,主要从事多糖类药物研究、药品生产工艺优化及在线过程分析与过程控制,Tel:0531-********,E-mail:zanghcw@https://www.360docs.net/doc/857921064.html,。
