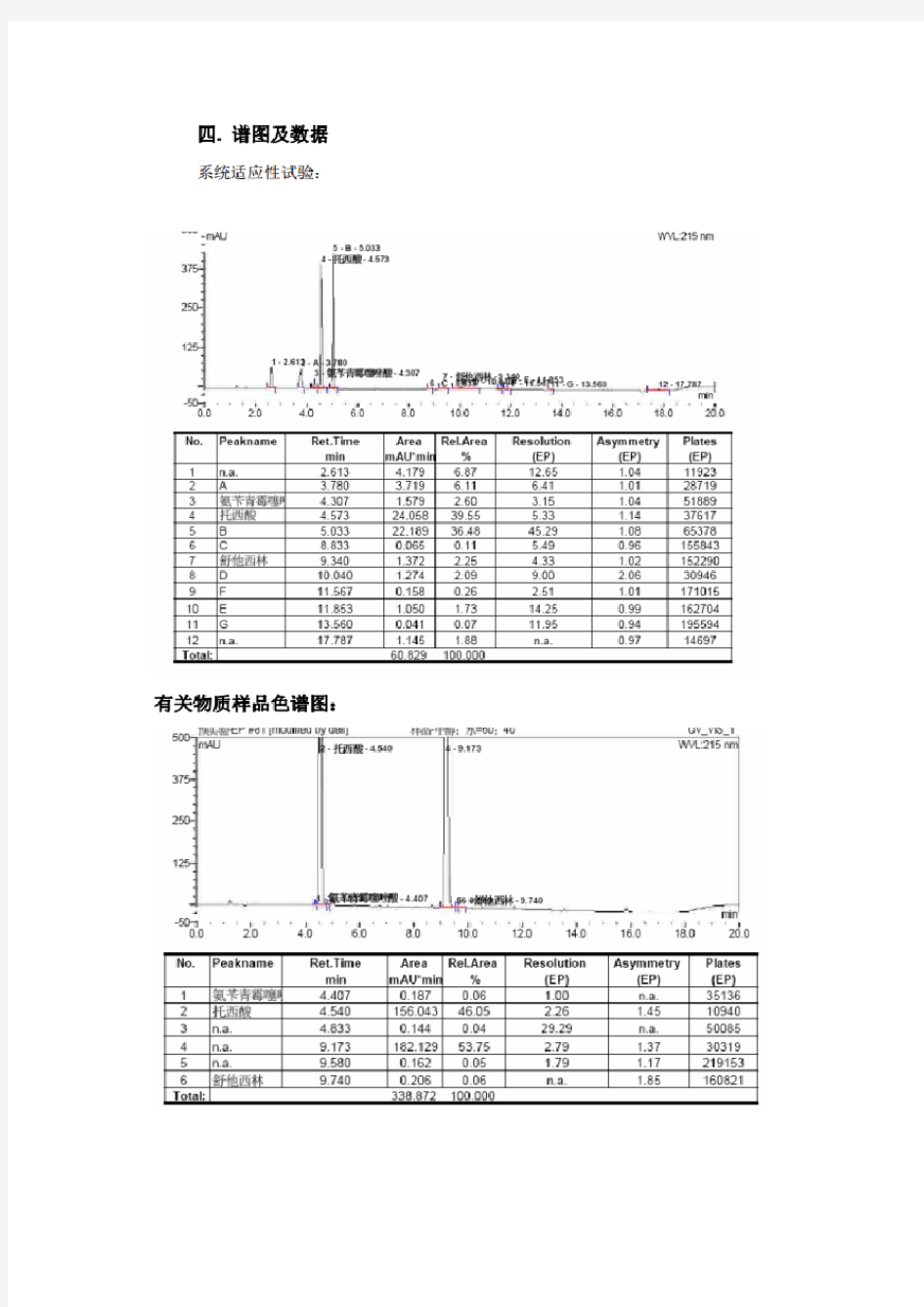
托西酸舒他西林HPLC液相谱图

3.2.P.5.5杂质谱分析模板的整理
3.2.P.5.5杂质谱分析模板的整理 格式模板 首先列出产品的杂志谱列表,比如: ****产品杂质情况分析表
反应过程的描述: 1、 详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。 2、 结合CTD 资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。)。 3、 起始物料说明。起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。比如头孢克洛,要对起始物料7-ACCA 的工艺、杂质控制和质量情况进行详细的说明。 4、 说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料 7-ACCA 的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。第2、3、4内容可以在CTD 的其他部分,比如物料说明部分进行。但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。 5、 关于ICH 的杂质鉴定、报告和质控限度:主要参考ICHQ3A (R2)到ICHQ3D 的相关规定
结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。 第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质) N S OH O O NO 2 O H N O C 22H 19N 3O 7S MW: 469.47 O C 16H 17KN 2O 4S MW: 372.48 Br NO 2 + O 2 MW: 469.51 C 7H 6BrNO 2MW: 216.0322 C 23H 23MW: 485.51 N S N H H OH O O NO 2 O C 22H 19N 3O 6S MW: 453.47 CH 2Cl 2/TEBAC TsCl morpholine N S N H H N O O NO 2O O C 26H 26N 4O 6S MW: 522.57 1) Br 2-pyrindine CH 2Cl 2 2 2C 14H 1235MW: 406.00 HCl 1) (PhO)3P/CH 2Cl 2 22) N,N-dimethyl aniline, PCl 5 i BuOH Na 2S 2O 42H 2C 7H 7ClN 2O 3S MW: 234.66 1、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。比如上述列表中的钯元素控制。 2、 普通有机杂质。 3、 对映异构体(根据品种的情况具体分析);考察不同的对应异构体对最终产品质量的影响情况。 4、 非对映异构体:比如ACCA 的△异构体;还包括非对应异构体自身的各种对映体。
高效液相色谱实验
化学与材料工程学院 环境监测分析实验报告 实验名称:高效液相色谱分析苯-甲苯混合物 专业班级:应化13 学号:150313135 姓名:朱建南 指导教师:翟春 实验地点:敬行楼A210 实验日期:2016年11月28日
高效液相色谱实验 一、实验目的 1.了解HPLC仪器的基本构造和工作原理,掌握HPLC的基本操作; 2.学习苯-甲苯混合物的定性分析方法; 3.评价色谱柱柱效; 4.了解色谱定量操作的主要方法以及各自特点; 5.学习未知样品的定量分析方法。 二、实验原理 不同组分因在互不相溶的流动相与固定相中的分配比不同,当两相做相对运动时,组分在两相之间反复进行多次分配,最终实现不同组分的分离。 色谱仪器的构成:包括高压输液系统、进样系统、分离系统,检测系统等 1.色谱定性分析方法 a保留时间定性 b 峰高增量定性 2.色谱定量分析方法 a 归一化法,要求所有组分必须全部出峰。 b 标准曲线法(外标法)。简单、方便, 结果受到操作技术因素以及具体色谱条件影响较大。 三、仪器与试剂 LC-1602A型高效液相色谱仪、甲醇(色谱纯) 、苯、甲苯、苯-甲苯 四、高效液相色谱仪操作步骤 1. 流动相的预处理 甲醇溶液,用0.45μm 有机滤膜过滤,超声波清洗器脱气10~20 min,装入流动相贮液瓶。 2. 准备苯-甲苯混合试样和苯、甲苯标样 3. 高效液相色谱仪操作 a 依次高压输液泵和检测器电源开关; b 打开色谱工作站,在仪器控制面板中,设置波长,并开灯; c打开三通阀,在仪器控制面板中,设置流速为5ml/min, 启动高压泵,排除流路中的气泡。排气结束后,点击停止按钮,停止高压泵。 d 关闭三通阀,设置最小压力(0.1)和最大压力(20),并设置实验需要的流速(0.5ml/min),启动高压泵。 e用平头微量注射器洗涤进样口后,取试液30 μL,将进样阀柄置于“Load”位置时
怎样分析气相色谱图
在实际工作中,当我们拿到一个样品,我们该怎样定性和定量,建立一套完整的分析方法是关键,下面介绍一些常规的步骤: 1、样品的来源和预处理方法 GC能直接分析的样品通常是气体或液体,固体样品在分析前应当溶解在适当的溶剂中,而且还要保证样品中不含GC不能分析的组分(如无机盐),可能会损坏色谱柱的组分。这样,我们在接到一个未知样品时,就必须了解的来源,从而估计样品可能含有的组分,以及样品的沸点范围。如果样品体系简单,试样组分可汽化则可直接分析。如果样品中有不能用GC直接分析的组分,或样品浓度太低,就必须进行必要的预处理,如采用吸附、解析、萃取、浓缩、稀释、提纯、衍生化等方法处理样品。 2、确定仪器配置 所谓仪器配置就是用于分析样品的方法采用什么进样装置、什么载气、什么色谱柱以及什么检测器。 一般应首先确定检测器类型。碳氢化合物常选择FID检测器,含电负性基团(F、Cl等)较多且碳氢含量较少的物质易选择ECD检测器;对检测灵敏度要求不高,或含有非碳氢化合物组分时,可选择TCD检测器;对于含硫、磷的样品可选择FPD检测器。 对于液体样品可选择隔膜垫进样方式,气体样品可采用六通阀或吸附热解析进样方法,一般色谱仅配置隔膜垫进样方式,所以气体样品可采用吸附-溶剂解析-隔膜垫进样的方式进行分析。 根据待测组分性质选择适合的色谱柱,一般遵循相似相容规律。分离非极性物质时选择非极性色谱柱,分离极性物质时选择极性色谱柱。色谱柱确定后,根据样本中待测组分的分配系数的差值情况,确定色谱柱工作温度,简单体系采用等温方式,分配系数相差较大的复杂体系采用程序升温方式进行分析。 常用的载气有氢气、氮气、氦气等。氢气、氦气的分子量较小常作为填充柱色谱的载气;氮气的分子量较大,常作为毛细管气相色谱的载气;气相色谱质谱用氦气作为载气。 3、确定初始操作条件 当样品准备好,且仪器配置确定之后,就可开始进行尝试性分离。这时要确定初始分离条件,主要包括进样量、进样口温度、检测器温度、色谱柱温度和载气流速。进样量要根据样品浓度、色谱柱容量和检测器灵敏度来确定。样品浓度不超过10mg/mL时填充柱的进样量通常为1-5uL,而对于毛细管柱,若分流比为50:1时,进样量一般不超过2uL。进样口温度主要由样品的沸点范围决定,还要考虑色谱柱的使用温度。原则上讲,进样口温度高一些有利,一般要接近样品中沸点最高的组分的沸点,但要低于易分解温度。
3.2.P.5.5杂质谱分析模板的整理
3.2.P.5.5 杂质谱分析模板的整理 格式模板首先列出产品的杂志谱列表,比如: **** 产品杂质情况分析表
反应过程的描述: 1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。 2、结合CTD 资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性 炭,硅藻土,硅胶等。)。 3、起始物料说明。起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商 提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。 比如头孢克洛,要对起始物料7-ACCA 的工艺、杂质控制和质量情况进行详细的说明。 4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA 的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。第2、3、4 内容可以在CTD 的其他部分,比如物料说明部分进行。但是本部分内容讨论的展开需要物料控制 说明作为基本的理论依据。 5、关于ICH 的杂质鉴定、报告和质控限度:主要参考ICHQ3A (R2)到ICHQ3D 的相关规定 阈值(原料药)
结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂 质等。 第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料 7-ACCA 引入的杂质) 比如上述列表中的钯元素控制。 3 、 对映异构体(根据品种的情况具体分析);考察不同的对应异构体对最终产品 质量的影响情况。 4、 非对映异构体:比如 ACCA 的△异构体;还包括非对应异构体自身的各种对映体。 第二部分:反应的每个步骤引 入的杂质:需要结合实际反应监控( HPLC ,LC-MS 为 主)过程对杂质消除过程以及对后续的影响进行实际说明。这个内容主要在工艺描述 部分进行,本部分引用工艺描述内容。 1、 步骤 1 引入的杂质。 PAA O H N O H N S O OK C 16 H 17 KN 2 O 4 S MW: 372.48 O HN CH 2 Cl CH TsCl Cl /TEBAC n-methylmorpholine morpholine 1) (PhO) 3 P/CH Cl 2 /Pyridine 2) N,N-dimethyl aniline, PCl BuOH Br NO 2 C 7 H 6 BrNO MW: 216.03 H O O N S O O O O C 23 H 23 N 3 O 7 S MW: 485.51 2 Cl 2 DMF/CH 2 Cl 2 TMP toluene NO O N O N O S O 6S NO C 23 H 23 N 3O MW: 469.51 C 22 H 19 N 3 O 7 S MW: 469.47 HCl H 2 N Na 2 S 2 O 4 acetone/H 2O C 14 H 12 ClN 3O 5 S MW: 406.00 7H 7 ClN 2 O 3 S MW: 234.66 1、 无机杂质:说明引入情况和消除渠道; 以及相关的控制方法和标准以及依据。 2、 普通有机杂质。 NO 2 MW: 522.57 H N 2 Cl O
P杂质谱分析的
P杂质谱分析的 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表
1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶 剂,催化剂等。 2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、 其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。)。 3、起始物料说明。起始物料符合广泛、易得、质量稳定,适合保存运 输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况 进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物 料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质 产生来源,分布,控制策略等。第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。 5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2) 到ICHQ3D的相关规定 杂质,降解杂质等。 第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质) 1、无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准 以及依据。比如上述列表中的钯元素控制。 2、普通有机杂质。 3、对映异构体(根据品种的情况具体分析);考察不同的对应异构体 对最终产品质量的影响情况。 4、非对映异构体:比如ACCA的△异构体;还包括非对应异构体自身 的各种对映体。 第二部分:反应的每个步骤引入的杂质:需要结合实际反应监控(HPLC,LC-MS为主)过程对杂质消除过程以及对后续的影响进行实际说明。这个内容主要在工艺描述部分进行,本部分引用工艺描述内容。 1、步骤1引入的杂质。 2、步骤2引入的杂质。 3、步骤3引入的杂质。以及后续的步骤产生的杂质以及消除过程和简 单的控制描述…… 4、精制过程引入的杂质。 第三部分:结合小试中试数据汇总列表、方法适用性、实际检测结果等内容说明各个有机杂质的分布情况。
高效液相色谱之谱图的各种问题
高效液相色谱仪怎样使用? 配好流动相,开工作站,设定流速,设定检测波长,开泵,开检测器,等基线走平后就可以进样了,等着出图后按停止,工作站会自动进行数据处理,生成报告,有不合适的地方自己手工调整. 高效液相色谱之谱图的各种问题 液相色谱系统的许多问题都能在谱图上反映出来。其中有一些问题可以通过改变设备参数得到解决;而其他的问题必须通过修改操作程序来解决。对于色谱柱和流动相的正确选择是得到好的色谱图的关键。 A、峰拖尾 原因解决方法 1、筛板阻塞 1、a、反冲色谱柱 b、更换进口筛板 c、更换色谱柱 2、色谱柱塌陷 2、填充色谱柱 3、干扰峰 3、a、使用更长的色谱柱 b、改变流动相或更换色谱柱 4、流动相PH选择错误 4、调整PH值。对于碱性化合物,低PH 值更有利于得到对称峰
5、样品与填料表面的溶化点发生反应图 5、a、加入离子对试剂或碱性挥发性修饰剂 b、更改色谱柱 B、峰前延 原因解决方法 1、柱温低 1、升高柱温 2、样品溶剂选择不恰当 2、使用流动相作为样品溶剂 3、样品过载 3、降低样品含量 4、色谱柱损坏 4、见A1、A2 C、峰分叉 原因解决方法 1、保护柱或分析柱污染图 1、取下保护柱再进行分析。如果必要更换保护柱。如果分析柱阻塞,拆下来清洗。如果问题仍然存在,可能是柱子被强保留物质污染,运用适当的再生措施。如果问题仍然存在,入口可能被阻塞,更换筛板或更换色谱柱。 2、样品溶剂不溶于流动相 2、改变样品溶剂。如果可能采取流动相作为样品溶剂。 D、峰变形
原因解决方法 1、样品过载 1、减少样品载量 E、早出的峰变形 原因解决方法 1、样品溶剂选择不恰当 1、a、减少进样体积 b、运用低极性样品溶剂 F、早出的峰拖尾程度大于晚出的峰 原因解决方法 1、柱外效应 1、a、调整系统连接(使用更短、内径更小的管路) b、使用小体积的流通池 G、K’增加时,脱尾更严重 原因解决方法 1、二级保留效应,反相模式1、a、加入三乙胺(或碱性样品) b、加入乙酸(或酸性样品)
P.5.5杂质谱分析模板的整理
杂质谱分析模板的整理 格式模板 首先列出产品的杂志谱列表,比如: ****产品杂质情况分析表
反应过程的描述: 1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂 等。 2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、 溶剂、辅料(活性炭,硅藻土,硅胶等。)。 3、起始物料说明。起始物料符合广泛、易得、质量稳定,适合保存运输等的原 则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。比如头孢克洛,要对起始物料7- ACCA的工艺、杂质控制和质量情况进行详细的说明。 4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA 的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。 5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的 相关规定 阈值(原料药) 2 克/天
结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。 第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质) N S OH O O NO 2 O H N O C 22H 19N 3O 7S MW: 469.47 N O N O H S O OK C 16H 17KN 2O 4S MW: 372.48 Br NO 2 + N O N O H S O O NO 2 C H N O S MW: 469.51 C 7H 6BrNO 2MW: 216.03PAA 22 N O H N O H S O O NO 2 O C 23H 23N O S MW: 485.51 TMP toluene N S N H H O O O 23H 21N 3O 5S N S N H H OH O O 2 O C 22H 19N 3O 6S MW: 453.47 CH 2Cl 2/CH 3OH O 3, TMP CH 2Cl 2/TEBAC TsCl morpholine N S N H H N O O 2O O C 26H 26N 4O 6S MW: 522.57 1) Br 2-pyrindine CH 2Cl 2N S Cl O O NO 2 O 2N C 14H 12ClN 3O 5S MW: 406.00 HCl HCl 1) (PhO)3P/CH 2Cl 2 2) N,N-dimethyl aniline, PCl 5 i BuOH Na 2S 2O 4N S OH O Cl O H 2N H C 7H 7ClN 2O 3S MW: 234.66 1、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。比如上述列表中的钯元素控制。 2、 普通有机杂质。
药物杂质研究方法详解
药物杂质研究方法详解 近年来,随着药物研究的不断深入以及杂质研究要求不断提高,杂质的分析技术以及研究方法正发生着重要的改变。在对杂质建立分析方法时,清晰的杂质研究过程是方法建立的基础,而且选择合适的分析技术也至关重要。 杂质的来源分析 药物中的杂质可能来源于药物生产以及销售等各个环节(图1)。根据ICH 指导原则可将药物杂质分为有机杂质、无机杂质、残留溶剂以及其他杂质。本文主要针对有机杂质进行探讨。 对药物杂质研究时引入“质量源于设计( Quality byDesign,QbD)”的理念,可在药物生产之前根据具体工艺的合成机制、起始物料及各中间体的基本结构,初步勾画出产品的杂质谱。 杂质来源分析是制定药物杂质控制策略的基础,尤其是在对毒性杂质来源分析时,应分析所有合成和生产工艺中的试剂、中间体、副产物,推测可能产生的潜在杂质以及分析实际存在的杂质。 在原料药合成结束后,药物的活性化合物虽然经过毒性分析已不含有“警示结构”(alerting structure),但是在生产过程中使用到含有警示结构的化合物则还需考虑其遗传毒性。 杂质的研究方法 在药物研发过程中,药物杂质的分析是关键。因此,在杂质研究中清晰的杂质结构研思路(如图2)以及合适的杂质分析技术可极大地缩短杂质研究时间,推动着药物研究的快速发展。
1、杂质前处理技术 杂质的前处理是伴随着药物活性成分前处理而存在的,然而药物中杂质的含量低且其结构与主成分差异较大,因此常规药物活性成分的前处理和检测方法(如初始流动相溶解后直接进行HPLC-UV 分析)并不一定适用于药物杂质,应针对不同的样品选择不同的前处理技术。 (1)检测灵敏度低的样品 对检测灵敏度低的样品通常使用衍生化的前处理方式,比如引入生色团产生紫外响应,或增加易离子化基团增加离子化效率等。 虽然常规衍生化方式能够满足日常检测的需求,但是为了实现对低浓度的基因杂质进行快速筛选和定量,可对传统的衍生化试剂进行改变以增加其专属性和灵敏度,也可使用气-固衍生化来弥补液-固衍生化的不足。 (2)低浓度的杂质 低浓度杂质前处理方法的选择根据其杂质类型所决定,如降解产物利用强制降解等方法提高降解物的浓度等,但是常规的降解方法往往会引入其他杂质,因而会干扰特殊杂质的杂质谱研究,为了得到单一的杂质研究机制,Ueya-ma 等提出了一种新型的固体药物氧化降解平台,该平台排除了常见氧化方式(例如H2O2 主导)引起的水解、溶剂解或热效应等,可用于氧化降解机制的特异性研究。 (3)易污染仪器的样品 不同仪器有不同的使用条件,因此对复杂样品进行前处理工作能够延长仪器的使用寿命,例如质谱检测器不能使用含有非挥发性盐的流动相,因此在建立液质联用条件时可利用二维液相色谱技术在第一维将各峰进行分离并将样品保留至样品环中,第二维液相使用质谱可接受的流动相以及脱盐柱来洗脱样品环中的样品从而实现了被分析物“脱盐”来保护质谱。 2、杂质分离技术
杂质谱的分析
杂质谱的分析 在药品研发及药品评价的过程中,杂质研究是一项非常重要的内容。因为药物在临床使用过程中所发生的不良反应除了与药品本身的药理活性有关外,有时还与药品中所含有的杂质有很大的关系。众所周知,从事药品研发及药品评价所要遵循的一个基本原则就是要保证上市药品的安全性和有效性,由于药品质量的稳定可控是保证药品安全有效的前提和基础,而杂质研究又是药品质量研究的一项重要内容,所以杂质研究及杂质控制是药品质量保证的关键要素,是确保药品安全有效性的重要体现。 2005年SFDA颁布的《化学药物杂质研究技术指导原则》中明确说明任何影响药物纯度的物质统称为杂质。具体的解释就是指药物中所含有的没有治疗作用、可能影响药物的稳定性和疗效,甚至是对人体健康有害的物质。杂质的来源有工艺杂质和降解产物等,工艺杂质指的是药品在制备工艺过程中引入的杂质,它包括没有反应完全的反应物、反应过程中所生成的中间体及副产物、反应过程中所使用的试剂及催化剂等。降解产物指的是药品在生产和贮藏过程中发生化学变化而产生的杂质,如发生水解、氧化、开环等反应,降解产物主要与药物的结构特征密切相关。 由于杂质研究与药品的质量及安全有效性直接相关,为了提高药品的质量,保障公众的用药安全,因此,在药品研发过程中需规范地进行杂质研究,并将其控制在安全、合理的限度范围内。在杂质研究总体原则的指导下,其中杂质谱的分析应是杂质研究的重要内容之一。 一、杂质研究的总体原则 杂质研究的总体原则就是要结合在研产品具体的工艺以及产品的特点开展研究。首先,要结合具体工艺及产品特点来分析产品中可能产生什么样的杂质,通过杂质谱的分析对产品中杂质的来源及结构情况有较为全面的了解;然后,在杂质谱分析的基础上,有针对性地选择合适的分析方法,以确保杂质的有效检出及控制;最后,需综合药学、药理毒理及临床研究结果确定合理的杂质限度,从而保证药品的质量及安全性。 二、杂质谱的分析 前已提及,对于杂质谱的分析需结合具体的工艺及产品特点展开,下面简要
色谱分析中各种图谱现象的判断
色谱分析中各种图谱现象的判断 色谱分析中各种图谱现象的判断 可能产生的原因及处理办法 一.基线噪音 1 流动池脏,用极性试剂清洗。当有填料进入,拆开流通池。 2 检测器灯有问题,如能量偏低,更换氘灯。 3 周期性的波动,则起源于泵的脉冲,检修泵或更换垫片等。 4 温度对检测器的影响,控制温度。 5 气泡经过检测器,用大流量冲洗。 6 可能难出峰的样品连续不断出来,用强极性流动相冲柱。 7 流动相本底高,如水的纯度不够,换超纯水。或试剂纯度不够,换色谱纯的试剂。 二.基线漂移(上漂和下漂) 1 柱中的流动相没有平衡,延长平衡时间,尤其在流动相中添加了有紫外吸收的添加剂。 2 在梯度洗脱中,基线上漂是正常的,在空白梯度中有可能是柱子中有杂质洗出。其次是流动相中有干扰物,换流动相。 3 温度不稳定(示差检测器),控温。 4 在等度分析中,样品缓慢洗出,改变淋洗液强度或用梯度分析。 5 样品进入检测器,吸附在池中,可能每进样一次,本底一次比一次高,很少见。 三.倒峰的产生和消除 1.柱切换的脉冲效应,一般不是很明显,必要时考虑换阀。
2.在低波长分析时,流动相本底比较高时,而样品用本底低的流动相溶解,肯定出现倒峰,其程度同进样量和本底差有关。解决办法,用流动相溶解样品,减少进样量,消除倒峰的影响。高波长时,影响比较小。 3.如果倒峰不影响峰的分离,对外标法定量不影响。但影响面积归一化法。 4.样品中有比流动相本底低的物质存在,如无机盐等,将出倒峰。这种情况下,倒峰的位置不一定在死体积位置出现(大多数在死体积位置出现)。 四.鬼峰的产生和消除 1.样品分析时峰没出完,在下一针或下下一针出现,判断办法,延长分析时间,计算可能出现的保留时间。然后调整流动相。 2.连续进样,在某个位置出现忽高忽低的峰,最可能是进样针污染,清洗进样针,注意污垢的干扰,有些样品易残留在针管里。可重新取样分析。 3.定量管污染,处理方法同上。 4.在死体积位置出现的小峰,可能是柱切换造成的。 5.流动相与样品溶剂不一致,也会出现鬼峰,尤其在低波长时,出现位置在死体积的地方。 6.气泡,如果有小气泡通过流通池,也出现随机的假峰,大气泡存在,其出现的峰往往直上直下,脱气解决。 7.样品发生变化反应,重新取样快速分析。
杂质谱的分析
发布日期20070628 栏目化药药物评价>>化药质量控制 标题杂质谱的分析 作者于红 部门 正文内容 审评四部审评七室于红 在药品研发及药品评价的过程中,杂质研究是一项非常重要的内容。因为药物在临床使用过程中所发生的不良反应除了与药品本身的药理活性有关 外,有时还与药品中所含有的杂质有很大的关系。众所周知,从事药品研发 及药品评价所要遵循的一个基本原则就是要保证上市药品的安全性和有效 性,由于药品质量的稳定可控是保证药品安全有效的前提和基础,而杂质研 究又是药品质量研究的一项重要内容,所以杂质研究及杂质控制是药品质量 保证的关键要素,是确保药品安全有效性的重要体现。 2005年SFDA颁布的《化学药物杂质研究技术指导原则》中明确说明任何影响药物纯度的物质统称为杂质。具体的解释就是指药物中所含有的没有 治疗作用、可能影响药物的稳定性和疗效,甚至是对人体健康有害的物质。 杂质的来源有工艺杂质和降解产物等,工艺杂质指的是药品在制备工艺过程
中引入的杂质,它包括没有反应完全的反应物、反应过程中所生成的中间体及副产物、反应过程中所使用的试剂及催化剂等。降解产物指的是药品在生产和贮藏过程中发生化学变化而产生的杂质,如发生水解、氧化、开环等反应,降解产物主要与药物的结构特征密切相关。 由于杂质研究与药品的质量及安全有效性直接相关,为了提高药品的质量,保障公众的用药安全,因此,在药品研发过程中需规范地进行杂质研究,并将其控制在安全、合理的限度范围内。在杂质研究总体原则的指导下,其中杂质谱的分析应是杂质研究的重要内容之一。 一、杂质研究的总体原则 杂质研究的总体原则就是要结合在研产品具体的工艺以及产品的特点开 展研究。首先,要结合具体工艺及产品特点来分析产品中可能产生什么样的杂质,通过杂质谱的分析对产品中杂质的来源及结构情况有较为全面的了解;然后,在杂质谱分析的基础上,有针对性地选择合适的分析方法,以确保杂质的有效检出及控制;最后,需综合药学、药理毒理及临床研究结果确定合理的杂质限度,从而保证药品的质量及安全性。 二、杂质谱的分析 前已提及,对于杂质谱的分析需结合具体的工艺及产品特点展开,下面简要介绍关于杂质谱分析的若干途径。 1.对于原料药,需依据所采用的具体合成工艺来分析在研产品中可能产生的杂质。 例如:抗心绞痛药物盐酸曲美他嗪质量标准中哌嗪的检查,曲美他嗪的合
关于仿制药杂质分析方法的几点注意事项
关于仿制药杂质分析方法的几点注意事项 :1、在仿制药杂质谱的对比研究中,需关注该产品是否在ICH成员国药典收载,收载的检测方法与申报方法有无明显差异,是否进行了方法比较研究。如果申报方法与ICH成员国药典方法之间存在较大差异,应进行包括检测能力和样品测定结果的方法对比研究,在此基础上优选专属性好、灵敏度高,能够充分检出相关杂质的检测方法。 需要注意的是:在杂质一致性的研究求证中,分析手段不能等同于日常检测,分离技术(如HPLC法)应与质谱分析(或二极管阵列检测)相结合或使用分析标识物(如杂质对照品),以便从色谱行为、UV特征、分子量及分子碎片特征等信息共同把握其物质一致性。 2、如采用HPLC法的相对保留时间识别某特定未知杂质,需要进行充分的方法耐用性的验证,并在质量标准中规定色谱柱的品牌、规格、粒径、流动相流速等分析条件,以保证检测方法具有足够的重现性,仅仅按照药典标准格式规定色谱填料的类型是不够的。 3、关于杂质分析的定量方式,通常有以下几种: (1)杂质对照品法,即外标法。用于对已知杂质的控制,如采用该法,则应注意对该对照品进行定性和定量研究,需对含量进行准确标定,并提供相关研究信息。 (2)加校正因子的主成分自身对照法,即以主成分作对照的内标法,校正因子可在检测时测定,但需提供杂质对照品,也可在建立方法时将测得的校正因子载入质量标准,供以后常规检验使用,无需长期提供杂质对照品,但也仅适于已知杂质的控制。 (3)不加校正因子的主成分自身对照法,实质上也是以主成分作对照的内标法,但其前提是假定杂质与主成分的响应因子相同,适用于具有与主成分相同或类似发色团的杂质,在有关物质与主成分具有相似的分子结构的情况下,此法不致发生太大误差。 需要关注的是稳定性考察中采用自身对照法考察有关物质变化的相关问题,由于主药本身含量也会降低,因此以主药作为杂质计算的参考标准会影响到
色谱简单流程方框图
色谱简单流程方框图:1..典型流程中的各部件 离开来。 3.色谱操作条件选择 最佳流速的选择: 从速率理论方程式知道,载气流速对柱效有明显的影响。如果从小到大改变载气线速,那么它和理论板高H的关系如图(1)所示: H H μμ 图(1)板高H与载气线速μ关系图 曲线的最低点,即H最小则柱效最高,此点对应的流速即是最佳线速度。对N 来说, 2 则为600~720cm/min。在实际工作中,往往采用稍高于最佳线速为420~600cm/min;而H 2 最佳线速的流速,以缩短分析时间。对于一个内径为4mm的填充柱,载气流速多选用50~80ml/min。 4.固定相的使用温度范围任何一种固定相,都有其使用温度范围。如柱温超过其上限,则固定相会流失或分解,使柱寿命缩短甚至失效,而且污染检测器;如果低于其下限, 加大,而使传质阻力增高,柱效降低。则固定液粘度变大,使组分在液相中的扩散系数D L 往往还会出现异常现象,表现为峰形不正常。如果低于固定液的凝固点时,则其已不是液相了,失去了分配能力。一般说来,提高柱温,各组分的挥发度都增加,分配系统变小而组分靠拢,溶剂效率降低,不利于分开。但操作速度快,分析周期短;降低柱温,有利于分离。但柱温太低,组分蒸气在两相中的扩散传质速率大为减小,分配不能迅速达到平衡,致使峰形变宽、柱效下降,并延长分析时间。甚至组分蒸气会冷凝下来,使分析不能正常进行。 5.汽化温度
对气化温度的要求:应有足够的温度和热容量使被测试样瞬时汽化。一般高于柱温50℃以上,或比样品中组分的最高沸点高出20~40℃;试样在该温度下,不被分解。 汽化温度不足的危害:峰形变宽、峰不对称,降低柱效及分离度;峰形异常,不能重复。 汽化温度过高的危害:样品分解,出现极为复杂的峰图,同样给以假象;汽化室橡皮垫变粘,易漏气; 6.检测温度 应保证样品组分蒸气不被冷凝,一般不低于柱温;要考虑检测器对温度的要求。如火焰离子化检测器,温度不能低于100℃,防止水蒸汽冷凝,否则会破坏离子室的绝缘性,出现异常现象;要考虑温度对检测器灵敏度的影响,如热导检测器的温度高,则灵敏度降低。 注意事项: a.色谱先通载气再开电源,关机时先关电源,在各温度降至室温后再关载气。 b. 使用氢火焰检测器,不点火,为了安全严禁打开氢气气路,换气时先断电源,打开柱箱门,让柱箱内温度下降后再换气瓶, c.热导检测器,以氢气为载气,系统应试漏,尾气必须排到室外,先通载气,后开桥 流电源,换气时应关闭桥流电源。 d.用气瓶应先开总阀,再开减压器阀,关闭时先关减压器阀,后关总阀。 e.使用电脑时应先按显示器电源,后按主机电源,严禁在开机的状态下插拔电缆,不 能随意使用电脑的光驱、软驱,以防电脑感染病毒。 f.用六通阀时要轻开轻闭,不要用力过度,造成六通阀损坏。 g.色谱开机状态下,应经常注意色谱操作条件的变化,出现问题时应尽己所能及时处 理,如不能处理的应向有关技术人员或部门反映,使问题及时得到解决。 SP-2305气相色谱仪操作规程 1、适用范围:SP-2305(1#、6#)适用于酯柱色谱分析。 2、仪器设备:配有热导检测器的色谱、电脑、色谱数据处理工作站。 3、试剂和材料:氢气(纯度≥%),乙醚:AR,6201载体(φ~),5A分子筛。 4、色谱柱:柱长3m,内径4mm不锈钢管。 固定相(酯柱)的配制:按固定液邻苯二甲酸二乙酯/6201载体(φ~)=1:5的比例称取配柱所需的固定液和载体。将称好的固定液用乙醚充分溶解,倒入称好的载体,使载
色谱图
chromatogram 样品流经色谱柱和检测器,所得到的信号-时间曲线,又称色谱流出曲线(elution profile)。 色谱图是指被分离组分的检测信号随时间分布的图象。色谱图形状随色谱方法和检测记录的方式不同而不同,迎头色谱和顶替色谱的色谱图为一系列台阶;在洗脱法色谱中,若采用微分型检测器时,分离组分的检测信号随时间变化的图形为近似于高斯分布的一组色谱峰群,色谱图的纵坐标为检测器的响应信号,横坐标为时间、体积或距离。 [编辑本段] 相关术语 ⊕色谱图(chromatogram)--样品流经色谱柱和检测器,所得到的信号-时间曲线,又称色谱流出曲线(elution profile). ⊕基线(base line)--流动相冲洗,柱与流动相达到平衡后,检测器测出一段时间的流出曲线。一般应平行于时间轴。 ⊕噪音(noise)――基线信号的波动。通常因电源接触不良或瞬时过载、检测器不稳定、流动相含有气泡或色谱柱被污染所致。 ⊕漂移(drift)基线随时间的缓缓变化。主要由于操作条件如电压、温度、流动相及流量的不稳定所引起,柱内的污染物或固定相不断被洗脱下来也会产生漂移。 ⊕色谱峰(peak)--组分流经检测器时相应的连续信号产生的曲线。流出曲线上的突起部分。正常色谱峰近似于对称性正态分布曲线(高斯Gauss曲线)。不对称色谱峰有两种:前延峰(leading peak)和脱尾峰(tailing peak ).前者少见。 ⊕拖尾因子(tailing factor,T)--T=B/A,用以衡量色谱峰的对称性。也称为对称因子(symmetry factor)或不对称因子(asymmetry factor)《中国药典》规定T 应为0.95~1.05。T<0.95为前延峰,T>1.05为拖尾峰。 ⊕峰底――基线上峰的起点至终点的距离。 ⊕峰高(Peak height,h)――峰的最高点至峰底的距离。 ⊕峰宽(peak width,W)--峰两侧拐点处所作两条切线与基线的两个交点间的距离。W=4σ。 ⊕半峰宽(peak width at half-height,Wh/2)--峰高一半处的峰宽。W h/2=2. 355σ。 ⊕标准偏差(standard deviation, σ)--正态分布曲线x=±1时(拐点)的峰宽之半。正常峰宽的拐点在峰高的0.607倍处。标准偏差的大小说明组分在流出色谱柱过程中的分散程度。σ小,分散程度小、极点浓度高、峰形瘦、柱效高;反之,σ大,峰形胖、柱效低。
杂质研究与控制
杂质研究与控制是把控药品质量风险的重要内容之一,基于杂质谱分析的杂质控制是“质量源于设计”基本理念在杂质研究与控制中的具体实践,需要与CMC各项研究乃至药理毒理及临床安全性研究等环节关联思考、综合考虑,而不仅仅拘泥于提供准确的分析数据。本文针对当前CTD申报资料中杂质研究方面存在的问题与不足,结合CTD过程控制和终点控制相结合、研究和验证相结合、全面系统的药品质量控制理念,探讨仿制药杂质研究与控制的基本逻辑思路,提出CTD申报资料中杂质研究与控制方面几个需要关注的问题。 关键词:杂质研究与控制杂质谱CTD格式 杂质研究与控制是一项系统工程,需要以杂质谱分析为主线,安全性为核心,按照风险控制的策略,将杂质研究与CMC各项研究,乃至药理毒理及临床安全性研究等环节关联思考、综合考虑,而不仅仅拘泥于提供准确分析数据的传统思维,不是一项孤立的分析工作。CTD(Common Technical Document)申报格式体现了过程控制和终点控制相结合、研究和验证相结合、全面系统的药品质量控制理念,更加符合杂质研究与控制的基本规律和逻辑思路。自2011年4月起,药审中心陆续发布了多项有关CTD格式及技术审评的相关要求及电子刊物,对于国内研发单位正确理解CTD格式内含的基本精神起到了一定的促进作用,但就目前阶段的申报情况看,有些申报资料在杂质研究方面仍存在一些不足,仅仅是形式上的CTD 格式,尚未实质性贯彻CTD的基本逻辑思路。以下是针对目前CTD申报资料中杂质研究相关问题的一些考虑。 1、CTD格式中杂质控制的考虑要体现在CMC的各个环节,而不是仅仅局限在“质量控制”模块。如制剂的原辅料控制中,原辅料的选择与控制要考虑以符合制剂质量要求(杂质等)为核心,必要时进行精制处理并制定内控标准;关键工艺步骤及参数的确立、工艺开发过程等要考虑以杂质是否得到有效控制为重点关注之一;制剂相关特性中要体现与原研产品杂质谱等的对比情况;包材、贮藏条件以及有效期的确立等也要以杂质是否处于安全合理的可控范围内为核心等等。实际上这正是源头控制、过程控制与终点控制相结合的杂质控制理念的体现,在研发工作及申报资料的整理中都需要针对性的贯彻实施。 问题与案例:有些申报资料在某种程度上未能充分体现杂质研究的整体性,对杂质控制措施仅强调了终点控制措施,尚未充分体现源头控制与过程控制的基本思路,具体表现在如下方面: (1)制剂杂质控制受制于原料药质控水平的约束,以目前国内批准的原料药杂质水平现状为由,未能根据该品当前杂质控制的水平与趋势,对原料药提出较为严格的针对性的杂质控制要求,并进行质量内控,因而难以确保制剂杂质控制水平与目前国际水平相适应; (2)在论述说明制剂相关特性时,未提供与原研产品杂质谱的对比分析情况; (3)关键工艺步骤及参数的确立、工艺开发过程相关内容中未详细说明杂质谱的变化情况,缺失关键质量数据的支持。 2、CTD格式的特点之一是研究内容模块化呈现,但需关注杂质分析与控制的系统性与整体性,不能割裂各项内容的必然联系和有机统一。比如对原料药而言,杂质分析与控制的相关内容会分布在分析方法(3.2.S.4.2)、方法学验证(3.2.S.4.3)、杂质对比研究与杂质谱分析(3.2.S.4.5)、杂质情况分析总结(3.2.S.3.2)、样品检测与数据积累(3.2.S.4.4)、控制限度(2.3.S.4.1)等各模块中,但杂质研究又是一项系统工程,具有统一的整体性,因此,不要因为申报资料格式的模块化而人为割裂各项研究内容的相互联系,甚至遗漏相关研究内容,要高度关注杂质分析与控制的系统性与整体性,将杂质研究与控制的全部内容和信息体现在相应模块中。如详细的杂质研究报告可以体现在3.2.S.4.5中;3.2.S.3.2要报告杂质研究的结果;杂质分析方法的筛选、研究与验证内容要在3.2.S.4.3中体现;对仿制药而言,杂质限度确定的论证与依据需要在与原研产品进行全面的杂质谱对比研究基础上进行论证说明,因此,与原研产品的对比研究及结论要在3.2.S.4.5中体现。
色谱分析谱图
A5000气相色谱工作站分析报告 样品信息: 样品名称: 乙酸乙酯、甲苯盲样样品编号: 样品来源: 省职防院邮寄采样人: 稀释倍数: 0.0 样品量: 0.0 含量单位: 取样时间: 仪器条件: 仪器名称: 气相色谱仪柱子型号: FFAP 检测器: FID 积分参数: 最小值: 10.00 漂移: 0.02 mV/min 噪声: 0.05 mV 最小峰宽: 2.00 S 相对窗宽: 5% 计算方式: 峰面积 色谱条件: 柱箱温度: 50 (℃)程序升温载气流速: 30 (ml/min) 检测器温度: 130 (℃)空气流速: 300 (ml/min) 气化室温度: 200 (℃)氢气流速: 30 (ml/min) 谱图: 分析结果: 定量方法:外标法 序号组分名保留时间峰面积峰高含量峰型 1 二硫化碳 3.91 9726895 366254 9726895 BB 2 乙酸乙酯0.00 0 0 0.000000 BB
3 甲苯0.00 0 0 0.000000 BB 谱图: 分析结果: 定量方法:归一法 序号组分名保留时间峰面积峰高含量峰型 1 二硫化碳 3.87 9287219 363551 9287219 BB 2 乙酸乙酯 5.40 67436 4449 25.265 BB 3 甲苯8.2 4 63476 13403 8.777 B B 谱图:
分析结果: 定量方法:外标法 序号组分名保留时间峰面积峰高含量峰型 1 二硫化碳 3.88 9515607 362744 9515607 BB 2 乙酸乙酯 5.42 68086 4510 25.508 B B 3 甲苯8.25 58293 13600 8.061 BB 谱图: 分析结果: 定量方法:外标法 序号组分名保留时间峰面积峰高含量峰型 1 二硫化碳 3.88 9231735 354067 9231735 BB 2 乙酸乙酯 5.41 67415 4556 25.256 B B 3 甲苯8.25 59548 13601 8.235 BB 谱图:
P杂质谱分析的
格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表
1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶 剂,催化剂等。 2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、 其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。)。 3、起始物料说明。起始物料符合广泛、易得、质量稳定,适合保存运 输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况 进行详细的说明。 4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物 料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质 产生来源,分布,控制策略等。第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。 5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2) 到ICHQ3D的相关规定 杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质) 1、无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准 以及依据。比如上述列表中的钯元素控制。 2、普通有机杂质。 3、对映异构体(根据品种的情况具体分析);考察不同的对应异构体 对最终产品质量的影响情况。 4、非对映异构体:比如ACCA的△异构体;还包括非对应异构体自身 的各种对映体。 第二部分:反应的每个步骤引入的杂质:需要结合实际反应监控(HPLC,LC-MS为主)过程对杂质消除过程以及对后续的影响进行实际说明。这个内容主要在工艺描述部分进行,本部分引用工艺描述内容。 1、步骤1引入的杂质。 2、步骤2引入的杂质。 3、步骤3引入的杂质。以及后续的步骤产生的杂质以及消除过程和简 单的控制描述…… 4、精制过程引入的杂质。 第三部分:结合小试中试数据汇总列表、方法适用性、实际检测结果等 内容说明各个有机杂质的分布情况。 第四部分:潜在杂质在成品中的检测结果
