培养皿和培养板细胞数和加液量
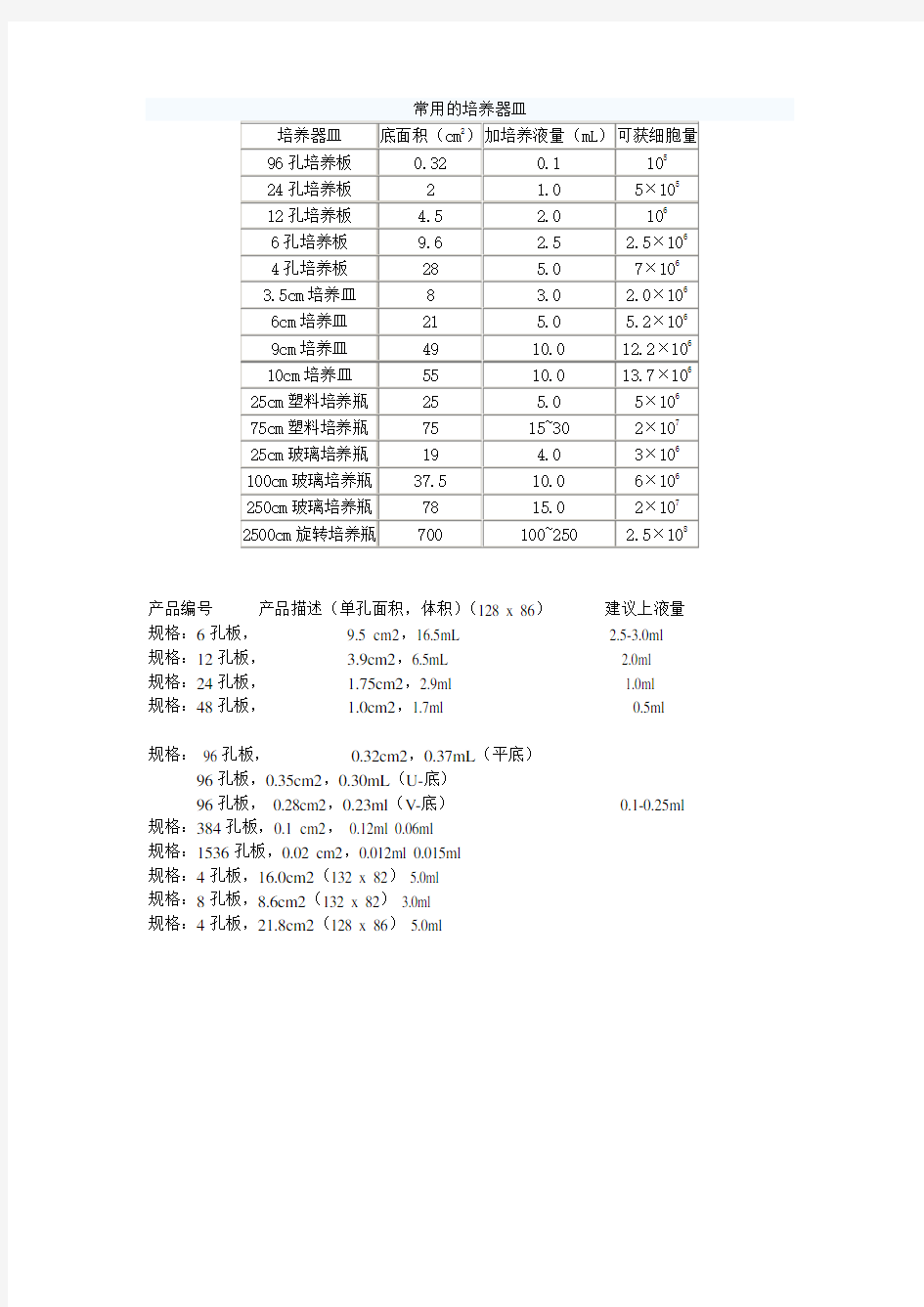
产品编号产品描述(单孔面积,体积)(128 x 86)建议上液量规格:6孔板,9.5 cm2,16.5mL 2.5-3.0ml 规格:12孔板, 3.9cm2,6.5mL 2.0ml
规格:24孔板, 1.75cm2,2.9ml 1.0ml
规格:48孔板, 1.0cm2,1.7ml 0.5ml
规格: 96孔板,0.32cm2,0.37mL(平底)
96孔板,0.35cm2,0.30mL(U-底)
96孔板, 0.28cm2,0.23ml(V-底)0.1-0.25ml 规格:384孔板,0.1 cm2, 0.12ml 0.06ml
规格:1536孔板,0.02 cm2,0.012ml 0.015ml
规格:4孔板,16.0cm2(132 x 82) 5.0ml
规格:8孔板,8.6cm2(132 x 82) 3.0ml
规格:4孔板,21.8cm2(128 x 86) 5.0ml
液体配制及实验方法
(一)液体配制 1.完全培养基 DMEM+10%FBS+1%双抗+(1%HAPS液) 若放置时间长于2周加1%谷氨酰胺 2.PBS 1000ml去离子水中溶解8.0gNaCl、0.2gKCl、2.89gNa2HPO4、0.26gNaH2PO4 3.胰酶 用之前调节PH值至7.6 4.CaCl2 将0.165gCaCl2粉末溶于10ml去离子水中配制成50X的溶液 每5ml胶原酶中加入100μl CaCl2溶液(终浓度3μmol/L)用于激活胶原酶的活性 5.双抗 终浓度:青霉素100万U/100ml 链霉素100万U/100ml 青霉素0.6μg为1个单位链霉素 1.2195μg为一个单位 称取青、链霉素粉末各0.6、1.2195g溶于10mlPBS中再定容至100ml 6.两性霉素B 100mg两性霉素B粉末溶于40mlPBS中,制成浓度为2.5mg/ml(1000X)的浓缩液 每100ml完全培养基中加入100μl 浓缩液,稀释为终浓度2.5μg/ml 7.细胞冻存液 20%DMSO+80%FBS(1mlDMSO+4mlFBS) 8STZ溶液 STZ溶于柠檬酸和柠檬酸三钠的盐溶液中 称取柠檬酸0.105g溶于5mlPBS 称取柠檬酸三钠0.145g溶于5mlPBS中混合两者制成10毫升的溶解液. 再将100mgSTZ粉末溶于该溶解液中制成浓度1%的STZ溶液,调节PH值至4.5,4°避光保存,由于STZ水溶性不稳定,溶液最好在半小时内使用完毕. 9油红O 原液:油红O 0.6g溶于异丙醇(99% )100ml 。 稀释液:油红O 原液20ml ,蒸馏水20ml ,过滤后使用。 10茜素红 称取0.1g茜素红粉溶于100mlPBS,调节PH值到7.2,过滤后使用.
实验三 动物细胞培养用液的配制
实验三动物细胞培养用液配制 一、实验目的 1.了解细胞培养常用培养液和试剂配制的基本方法。 2.初步掌握高压灭菌和抽滤灭菌的方法。. 二、器材与试剂: RPMI-1640干粉型培养基、胰蛋白酶,青霉素、链霉素.蒸馏水、电子天平、PH计、磁力搅拌器、5.6%的NaHCO 3 三、实验原理 动物细胞培养常用液有平衡盐溶液、培养基(天然和合成)及消化液等。配制这些常用液有严格的要求: (1)使用高纯化的三蒸水。 (2)按照用液的配方计算所需各成分的用量,然后准确量取,并按规定顺序溶于三蒸水中。 (3)保证各组分完全溶解。 (4)进行pH值测试和调整。 (5)消毒分装小瓶,抽样做无菌实验,保证用液无菌。 四、具体步骤: 1、酚红(0.1%) 配法:称酚红2g,先用数滴5.6%的NaHCO 3溶液溶解,再加进该5.6% NaHCO 3 溶液使最终体 积为100mL,瓶装保存,备用。 2、Hanks平衡盐溶液。 (Hanks液是常见的平衡盐溶液(BSS)之一。D-Hanks液则是无钙镁离子的Hanks液。) 1.按表称取Hanks、D-Hanks试剂。 表13-2 D-Hanks试剂的配制 成份Hanks D-Hanks CaCl20.140 - KCl 0.400 0.400 KH2PO40.060 - MgCl2·6H2O 0.100 - MgSO4·7H2O 0.100 - NaCl 8.000 8.000 NaHCO30.350 0.350 Na2HPO4·12H2O -0.132 Na2HPO4·7H2O 0.090 - D-葡萄糖 1.000 1.000 酚红(0.1%)1mL 1mL 2.依次加入上述试剂至800mL蒸馏水中,溶解后定容至1000mL。 3.高压灭菌,10磅10min。 注意事项
组织裂解液和细胞裂解液的配制
组织裂解液和细胞裂解液如何配制? 一、细胞裂解液配制 方法一 一、试剂准备 1、新鲜配制冷的 RIPA 裂解缓冲液: 150 mM NaCL 1% NP-40 (去垢剂) 0.1% SDS (去垢剂) 2ug/ml Aprotinin (蛋白酶抑制剂) (使用前加入) 2ug/ml Leupeptin (蛋白酶抑制剂) (使用前加入) 1 mM PMSF (蛋白酶抑制剂) 1.5 mM EDTA (蛋白酶抑制剂) 1mM NaVanadate (磷酸脂酶抑制剂)(任选) 以上所有试剂均按比例溶于150 mM NaCL溶液中。 2、冷的PBS 中加入 1 mM PMSF 1.5 mM EDTA 1mM NaVanadate (钒酸钠)(任选) 3、对数期生长状态佳的细胞,75cm至少3-4瓶(90%以上生长面积)。 二、实验步骤 1、将长满细胞的培养瓶放置在冰上,用吸液管吸出培养液。加入足够的冷的 PBS 在培养瓶中充分洗涤细胞表面,以洗去瓶中残留的培养基,倒掉PBS ,重复以上操作2-3遍。在最后一次洗涤中尽可能吸干残留的PBS,尽量在冰上操作。 2、向培养瓶中加入冷的RIPA 裂解缓冲液 (每75cm2 培养瓶加1ml). 然后用细胞刮子沿着瓶壁开始刮细胞,如果所需要刮的同种细胞有多瓶,则将第一瓶刮下的细胞液吸出转入下一瓶中继续刮 (由于处理后的细胞裂解液较粘稠,所以宜用直径大点的吸液管吸取)。 3、吸出刮好的细胞裂解液置于14ml 离心管中(置于冰上),然后重复步骤2
以刮取剩下的细胞。 4、尽可能将多的细胞裂解液收集到14ml的离心管中,样品插入冰盒进行超声, 超声强度以不产生泡沫为准,超声每次2-3秒,重复3-4次。如仍有细胞碎片或沉淀,应离心10000rpm,10分钟,留取上清。 5、取出小量细胞裂解液测其蛋白浓度(用Biorad Bradford 试剂盒或紫外分 光光度计,在A280测定),分装保存在 -70℃。 4方法二 NP-40 or Triton-100 1% TrisHCl (pH 8.0) 50mmol/L NaCl 150mmol/L PMSF(苯甲基磺酰氟)0.1mmol/L(100μg/ml) Pepstatin(胃蛋白酶抑制剂) 1 μmol/L(0.7μg/ml) Leupeptin(亮抑制肽) 0.5mg/ml Aprotinin(抑蛋白酶肽)0.3μmol/L(1μg/ml) (注:PMSF 贮存液:100mmol/L即17.4mg/ml于异丙醇中; Aprotinin 贮存液:10mg/ml溶于0.01mol/LHEPES(pH8.0); Leupeptin 贮存液:10mg/ml溶于水中; Pepstatin 贮存液 10mg/ml于甲醇液中.均于-20℃保存) 裂解操作程序: * 离心收集1×107个细胞 * 加入4℃预冷1%NP-40裂解液100μl * 剧烈震荡使细胞充分悬浮混匀(如为组织进行匀浆) * 4℃放置15~30min * 4℃离心,15 000rpm,10min,取上清备用。 方法三 ?细胞裂解液的主要目的:1.利用去污剂破坏脂质双分子层,破裂细胞;2. 溶解蛋白;3. 蛋白变性使其稳定;4. 抑制蛋白酶活性 推荐RIPA buffer:
培养皿规格细胞计数
https://www.360docs.net/doc/917388861.html,/item.htm?id=131********&ad_id=&am_id=&cm_id=&pm_id= 培养器皿面积(cm2)培养液量(ml)细胞量 96 孔培养板0.32 0.1 105 24孔培养板 2 1.0 5×105 12孔培养板 4.5 2.0 106 6孔培养板9.6 2.5 2.5×106 3.5 cm 培养皿8 3.0 2×106 6 cm 培养皿21 5.0 5.2×106 10 cm 培养皿55 10.0 13.7×106 25cm2 培养瓶25 5.0 5×106 75cm2 培养瓶75 15~30 2×107 细胞计数(转载) 来源:苌生科的日志 实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。 具体操作: 一、准备工作: 取一瓶传代的细胞,待长成单层后以备使用。 二、细胞悬液制备: 细胞悬液的制备方法是用0.25%的胰蛋白酶液消化、PBS液洗涤后,加入培养液(或Hanks液或PBS等平衡盐溶液),吹打制成待测细胞悬液。 三、细胞计数: 1.盖好盖玻片:取一套血球计数板,将特制的盖玻片盖在血球计数槽上。 2.制备计数用的细胞悬液:用吸管吸5滴细胞悬液到一离心管中,加入5滴台盼蓝染液(0.4%)或苯胺黑,活细胞不会被染色,加入染液后就可以在显微镜下区别活细胞和死细胞。 3.将细胞悬液滴入计数板:将待测细胞悬液吹均匀,然后吸取少量悬液沿盖片边缘缓缓滴入,要保证盖片下充满悬液,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。 4.统计四个大格的细胞数:将血球计数板放于显微镜的低倍镜下观察,并移动计数板,当看到镜中出现计数方格后,数出四角的四个大格(每个大格含有16个中格)中没有被染液染上色的细胞数目。 5.计算原细胞悬液的细胞数L:按照下面公式计算细胞密度: (细胞悬液的细胞数)/ml=(四个大格子细胞数/4)×2×104 说明:公式中除以4因为计数了4个大格的细胞数。 公式中乘以2因为细胞悬液与染液是1:1稀释。 公式中乘以104因为计数板中每一个大格的体积为1.0mm(长)×1.0mm(宽) ×0.1mm(高)=0.1mm3 而 1ml=1000mm3。 四、细胞计数要点: 1.进行细胞计数时,要求悬液中细胞数目不低于104个/ml,如果细胞数目很少要进行离心再悬浮于少量培养液中;
细胞培养与传代注意事项及试剂配制
细胞培养过程中的注意事项及试剂配制 一.常用设备 准备室的设备: 单蒸馏水蒸馏器、双蒸馏水蒸馏器、酸缸、烤箱、高压锅、储品柜(放置未消毒物品)、储品规(放置消毒过的物品)、包装台。 配液室的设备: 扭力天平和电子天平(称量药品)、PH计(测量培养用液PH值)、磁力搅拌器(配置溶液室搅拌溶液)。 培养室的设备: 液氮罐、储品柜(存放杂物)、日光灯和紫外灯、空气净化器系统、低温冰箱(-80℃)、空调、二氧化碳缸瓶、边台(书写实验记录)。必须放在无菌间的设备:离心机(收集细胞)、超净工作台、倒置显微镜、CO2孵箱(孵育培养物)、水浴锅、三氧消毒杀菌机、4℃冰箱(放置serum和培养用液)。 二.无菌操作 无菌室的灭菌: 1.定期打扫无菌室:每周打扫一次,先用自来水拖地、擦桌子、超净工作台等,然后用3‰来苏尔或者新洁尔灭或者0.5%过氧乙酸擦拭。 2.CO2孵箱(培养箱)灭菌:先用3‰新洁尔灭擦拭,然后用75%酒精擦拭或者0.5%过氧乙酸,再用紫外灯照射 3.实验前灭菌:打开紫外灯、三氧杀菌机、空气净化器系统各20-30分钟 4.实验后灭菌:用75%酒精(3‰新洁尔灭)擦拭超净台、边台、倒置显微镜的载物台。 实验人员的无菌准备: 1.肥皂洗手。 2.穿好隔离衣、带好隔离帽、口罩、放好拖鞋 3.用75%酒精棉球擦净双手。 无菌操作的演示: 1.凡是带入超净工作台内的酒精、PBS、培养基、胰蛋白酶的瓶子均要用75%酒精擦拭瓶子的外表面 2.靠近酒精灯火焰操作。 3.器皿使用前必须过火灭菌 4.继续使用的器皿(如瓶盖、滴管)要放在高处,使用时仍要过火。 5.各种操作要靠近酒精灯,动作要轻、准确,不能乱碰。如吸管不能碰到废液缸。 6.吸取两种以上的使用液时要注意更换吸管,防止交叉污染。 三.器械的清洗和消毒 玻璃器械洗消: (1)新的玻璃器皿的洗消: 1.自来水刷洗,除去灰尘。 2.烘干、泡盐酸:烤箱中烘干,然后再浸入5%稀盐酸中12小时以除去脏物、铅、砷等物。 3.刷洗、烘干:12小时后立即用自来水冲洗,再用洗涤剂刷洗,自来水冲干净后用烤箱烘干。 4.泡酸、清洗:用清洁液(重铬酸钾120g:浓硫酸200ml:蒸馏水1000ml)浸泡12小时,然后从酸缸内捞出器皿用自来水冲洗15次,最后蒸馏水冲洗3-5次和用双蒸水过3次。 5.烘干、包装:洗干净后先烘干,然后用牛皮纸(油光纸)包装。 6.高压消毒:包装好的器皿装入高压锅内盖好盖子,打开开关和安全阀,当蒸气成直线上升时,关闭安全阀,当指针指向15磅时,维持20-30分钟。
细胞培养用液的配制与消毒
一、器材与试剂: 干粉型培养基、胰蛋白酶,青霉素、链霉素.纯净水系统、电子天平、PH计、磁力搅拌器。 具体步骤: (1)水的制备: 细胞培养用水必须非常纯净,不含有离子和其他的杂质。需要用新鲜的双蒸水、三蒸水或纯净水. (2)PBS的制备与消毒(也可用于其它BSS,如:Hanks,D-Hanks液的配制): 1.溶解定容:将药品(NaCl8.0g,KCl0.2g,Na2HPO4·H2O1.56g,KH2PO40.2g)倒入盛有双蒸水的烧杯中,玻璃棒搅动,充分溶解,然后把溶液倒入容量瓶中准确定容至1000ml,摇匀即成新配制的PBS溶液。 2.移入溶液瓶内待消毒:将PBS倒入溶液瓶(大的吊针瓶)内,盖上胶帽,并插上针头放入高压锅内8磅消毒20分钟。注意高压消毒后要用灭菌蒸馏水补充蒸发掉的水份。 (3)胰蛋白酶溶液的配制与消毒: 胰蛋白酶的作用是使细胞间的蛋白质水解从而使细胞离散。不同的组织或者细胞对胰酶的作用反应不一样。胰酶分散细胞的活性还与其浓度、温度和作用时间有关,在pH 为8.0、温度为37℃时,胰酶溶液的作用能力最强。使用胰酶时,应把握好浓度、温度和时间,以免消化过度造成细胞损伤。因Ca2+、Mg2+和血清、蛋白质克降低胰酶的活性,所以配制胰酶溶液时应选用不含Ca2+、Mg2+的BSS,如:D-Hanks液。终止消化时,可用含有血清培养液或者胰酶抑制剂终止胰酶对细胞的作用。 1.称取胰蛋白酶:按胰蛋白酶液浓度为0.25%,用电子天平准确称取粉剂溶入小烧杯中的双蒸水(若用双蒸水需要调PH到7.2左右)或PBS(D-hanks)液中。搅拌混匀,置于4℃内过夜。
2.用注射滤器抽滤消毒:配好的胰酶溶液要在超净台内用注射滤器(0.22微米微孔滤膜)抽滤除菌。然后分装成小瓶于-20℃保存以备使用。 (4)青、链霉素溶液的配制于消毒 1.所用纯净水(双蒸水)需要15磅高压20分钟灭菌。 2.具体操作均在超净台内完成。青霉素是80万单位/瓶,用注射器加4ml灭菌双蒸水。链霉素是100万单位/瓶,加5ml灭菌双蒸水,即每毫升各为20万单位。 3.使用时溶入培养液中,使青链霉素的浓度最终为100单位/ml。1单位=1微克 (5)RPMI1640的制备与消毒: 1.溶解、调PH值、定容:先将培养基粉剂加入培养液体积2/3的双蒸水中,并用双蒸水冲洗包装袋2-3次(冲洗液一并加入培养基中),充分搅拌至粉剂全部溶解,并按照包装说明添加一定的药品.然后用注射器向培养基中加入配制好的青链霉素液各0.5ml,使青链霉素的浓度最终各为100单位/ml。然后用一个当量的盐酸和NaOH调PH到7.2左右。最后定容至1000ml,摇匀。 2.安装蔡式滤器:安装时先装好支架,按规定放好滤膜,用螺丝将不锈钢滤器和支架连接好。然后卸下支架腿分别用布包好待消毒。 3.抽滤:配制好的培养液通常用滤器过滤除菌。通常用蔡式滤器在超净工作台内过滤。 4.分装:将过滤好的培养液分装入小瓶内置于4℃冰箱内待用。 5.使用前要向100ml培养液中加入1ml谷氨酰胺溶液(4℃时两周有效)。 (6)血清的灭活: 细胞培养常用的是小牛血清,新买来的血清要在56℃水浴中灭活30分钟后,再经过抽滤方可加入培养基中使用。
细胞培养相关常用液体配制标准SOP操作规程样本
细胞培养相关常用液体配制标准SOP操作规程样本 (一)胰酶的配制:(浓度为1‰,1L) 1、认真清洗配制容器,自来水20遍,去离子水5遍,超纯水润洗3遍。 2、称取牛胰蛋白酶1.0g;EDTA 2 g; 3、用超纯水溶解; 4、磁力搅拌器搅拌至胰酶完全溶解,溶液变得澄清; 5、超纯水定容至1L; 6、不锈钢滤器加0.22um滤纸两张高温灭菌后,在超净工作台过滤; 7、在血清瓶中加入少量滤好的胰酶,置于细胞培养箱中检测是否染菌,其余置于4℃待用; 8、过滤后洗净滤器再次灭菌,避免残留的胰酶降解蛋白。 (二)DMEM配制: 1、所需试剂及材料: 试剂:DMEM干粉(GIBCO 10L)、超纯水(Milli-Q)、Na2CO3 (Sigma)材料:10L玻璃瓶、500ml盐水瓶(灭菌)、0.22um滤膜、滤器(事先放好两层滤膜并高压灭菌)、磁力搅拌器大号搅拌子蠕动泵胶塞2、操作步骤: (1)10L玻璃瓶洗涤,自来水20遍,去离子水5遍,超纯水润洗3遍。 (2)在10L玻璃瓶中加入超纯水9.5L,将DMEM干粉倒入,在磁力
搅拌器上搅拌溶解。 (3)按照3.7g/L 加入Na2CO3 。 (4)调节pH值至7.2~7.4。 (5)过滤分装,并注明名称及配制日期。此过程注意无菌操作! (6)最后用血清瓶取10ml左右置于细胞培养箱中检测是否染菌。 (7)清洗滤器,10L玻璃瓶,软管,将所有实验器具归位。 (三)1640、MEM培养基的配制同上,Na2CO3的用量见包装说明 (四)细胞间100×双抗(青霉素、链霉素)的配制 青霉素及链霉素配制的终浓度为1万单位/毫升。 配制的步骤以400ml为例: 1.认真清洗配制容器,自来水20遍,去离子水5遍,超纯水润洗 3遍。 2.准备5瓶青霉素(80万单位/瓶)、4瓶链霉素(100万单位/瓶)。 3.加入1-2ml细胞间专用PBS进入青霉素、链霉素的瓶子内,浸泡 后吹吸数次至全部溶解,溶解后的液体吸入配制容器内。用PBS 再次润洗装有青霉素及链霉素的小瓶子,将残留的青霉素及链霉素溶解,将液体并入配制容器内,重复润洗2次。 4.用细胞间专用PBS定容至400ml,搅拌均匀。 5.将配制的母液用0.22um的滤膜过滤除菌,分装到灭菌后的4ml EP管内,2ml/ 管,冻存于-20℃。( 4mlEP管需提前一天灭菌,烘干过夜。)
细胞培养常用液体配置
【精华】细胞培养常用液体配置 细胞冻存! https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1075571&sty=1&tpg=1&age=0 求助:1%的胰蛋白酶如何配置成0。25%的?急! https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1601091&sty=1&tpg=1&age=0 求助海马神经元的培养基配方 https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1876036&sty=1&tpg=1&age=0 【求助】活性碳-葡聚糖苷处理过的胎牛血清问题 https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1566352&sty=1&tpg=1&age=0 谁知道加了小牛血清的1640还能过滤吗? https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1936251&sty=1&tpg=1&age=0 求助! https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1730359&sty=1&tpg=1&age=0 小急!乳鼠心肌细胞培养时配胰蛋白酶没调PH值 https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1949765&sty=1&tpg=1&age=0 配DMEM时直接添加粉剂NAHCO3可以吗? https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1949670&sty=1&tpg=1&age=0 冻存液怎么配置? https://www.360docs.net/doc/917388861.html,/bbs/post/view?bid=66&id=1633674&sty=1&tpg=1&age=0求助乳鼠心肌细胞培养的D-HANKS液配方
细胞培养常用水和平衡盐溶液的配制方法
细胞培养常用水和平衡盐溶液的配制方法关键词:细胞培养基ATCC 北纳细胞网 一、水 水是细胞赖以生存的主要环境,营养物质和代谢产物都必须溶解在水中,才能为细胞吸收和排泄。而且,水溶液对维持细胞形态、进行生物化学反应、温度传导、调节渗透压和酸碱度的平衡都有着重要作用。体外培养细胞对水的质量很敏感,要求很高。水的纯度不够,即使混杂有一些含量极微的有害元素,有时也会对细胞产生不利的影响,甚至引起细胞中毒死亡。因此.配制培养液的水必须经过纯化。 细胞培养实验室需要纯净的水,常可分为离子交换水和蒸馏水两种。前者由于仍然带有非离子物质和有机物,在组织培养中很少使用。组织培养必须使用玻璃蒸馏器制备的三次蒸馏水;二次蒸馏水或外购的金属蒸馏器制的蒸馏水只能用于清洗器皿。 蒸馏水的储存对保持水的质量有很大影响;周围环境和空气能使水污染或改变其pH,所以储存水的容器要尽量减少启开的次数,避免和外界过多接触,存放时间不宜太长,一般不要超过两周,最好现制现用。 二、平衡盐溶液(balanced salt solution,BSS) 1.BSS种类:BSS是从Ringer生理盐水发展起来的,主要由无机盐和葡萄糖组成。BSS中的无机离子不仅是细胞生命所需成分,而且在维持渗透压、缓冲
和调节溶液的酸碱度方面,起着重要作用。BSS中含少量的酚红,作为溶液酸碱度变化的指示剂;溶液变酸时呈黄色.变碱时呈紫红色,中性时呈桃红色,借此易于观察到培养液pH的变化。 表2—8是几种常用BSS中的组成成分的比较。Hanks液和Earle 液是配制各种培养液最常用的基础溶液,它们的主要区别在于缓冲系统不同。Hanks液缓冲能力较弱,需利用空气平衡;Earle 液含有高浓度的NaHCO3,缓冲能力较强,需用5%CO2平衡。 钙、镁离子是细胞膜的重要组成成分,它们有促使细胞凝聚作用。因而配制离散细胞用的消化液和细胞洗涤液时.宜采用钙、镁离子含量低的Dulbecco液和无钙镁离子的D-Hanks液或PBS液。 2.BSS 的配制方法:配制BSS 时主要应避免钙、镁离子的沉淀,下面以Hanks 液为例说明其配制方法。 (1)按成分表准确称量试剂。许多试剂是含有水分的水化物,与不含水分试剂的称量不同.应加以换算。
细胞培养溶液配制
1 PBS液 溶解定容:将药品(NaCl 8.0g,KCl 0.2g,Na2HPO4?H2O 1.56g,KH2PO4 0. 2 g )倒入盛有双蒸水的烧杯中,玻璃棒搅动,充分溶解,然后把溶液倒入容量瓶中准确定容至1000ml,摇匀即成新配制的PBS溶液。用HCl或NaOH调PH到7.4。消毒后即可使用 2 胰蛋白酶:按胰蛋白酶液浓度为0.25%,用电子天平准确称取粉剂溶入小烧杯中的双蒸水(若用双蒸水需要调PH到7.2左右)或PBS(D-hanks)液中。搅拌混匀,置于4℃内过夜。 3.青、链霉素溶液: 所用纯净水(双蒸水)需要15磅高压20分钟灭菌。具体操作均在超净台内完成。青霉素是80万单位/瓶,用注射器加4ml灭菌双蒸水。链霉素是100万单位/瓶,加5ml灭菌双蒸水,即每毫升各为20万单位。分装于-20℃保存。使用时溶入培养液中,使青链霉素的浓度最终为100单位/ml。 4 血清的灭活: 细胞培养常用的是小牛血清,新买来的血清要在56℃水浴中灭活30分钟后,再经过抽滤方可加入培养基中使用。 5谷氨酰胺一般培养液中谷氨酰胺的含量为1~4mmol/L。可以配制200mmol/L谷氨酰胺液贮存,用时加入培养液。配制方法为,谷氨酰胺2.922g溶于三蒸水加至100ml即配成200mmol/L的溶液,充分搅拌溶解后,过滤除菌,分装小瓶,-20℃保存,使用时可向100ml培养液中加入1ml谷氨酰胺溶液 6.肝素溶液的配制: 含有肝素的培养液可以使内皮细胞纯度提高,肝素加入全培养液中最终浓度为50ug/ ml。因为现在市售的多为肝素钠,包装为约为0.56克/瓶,配制时,可将其溶于100ml三蒸水中,定容,过夜,然后过滤除菌,分装小瓶,保存温度为??℃。使用时,向100ml培养液中加入1ml(精确可加入0.9ml)即可。 7.Hanks液: 称取KH2PO4 0.06g,Nacl 8.0g,NaHCO3 0.35g,KCl 0.4g,葡萄糖1.0g,Na2H PO4.H2O 0.06g,加H2O至1000ml
细胞培养过程中的注意事项及试剂配制
细胞培养过程中的注意事项及试剂配制 细胞培养过程中的注意事项及试剂配制一.常用设备 准备室的设备: 单蒸馏水蒸馏器、双蒸馏水蒸馏器、酸缸、烤箱、高压锅、储品柜(放置未消毒物品)、储品规(放置消毒过的物品)、包装台。配液室的 设备:扭力天平和电子天平(称量药品)、PH 计(测量培养用液PH 值)、磁力搅拌器(配置溶液室搅拌溶液)。培养室的设备:液氮罐、储品柜(存放杂物)、日光灯和紫外灯、空气净化器系统、低温冰箱(-80℃)、空调、二氧化碳缸瓶、边台(书写实验记录)。必须放在无菌间的设备:离心机(收集细胞)、超净工作台、倒置显微镜、CO2孵箱(孵育培养物)、水浴锅、三氧消毒杀菌机、4℃冰箱(放置serum 和培养用液)。二.无菌操作 无菌室的灭菌: 1.定期打扫无菌室:每周打扫一次,先用自来水拖地、擦桌子、超净工作台等,然后用3‰来苏尔或 者新洁尔灭或者0.5%过氧乙酸擦拭。 2.CO2孵箱(培养箱)灭菌:先用3‰新洁尔灭擦拭,然后用75%酒精 擦拭或者0.5%过氧乙酸,再用紫外灯照射 3.实验前灭菌:打开紫外灯、三氧杀菌机、空气净化器系统各20-30分钟 4.实验后灭菌:用75%酒精(3‰新洁尔灭)擦拭超净台、边台、倒置显微镜的载物台。实验人员的无菌准备: 1.肥皂洗手。 2.穿好隔离衣、带好隔离帽、口罩、放好拖鞋 3.用75%酒精棉球擦净双手。无菌操作的演示: 1.凡是带入超净工作台内的酒精、PBS 、培养基、胰蛋白酶的瓶子均要用75%酒精擦拭瓶子的外表面 2.靠近酒精灯火焰操作。 3.器皿使用前必须过火灭菌 4.继续使用的器皿(如瓶盖、滴管)要放在高处,使用时仍要过火。 5.各种操作要靠近酒精灯,动作要轻、准确,不能乱碰。如吸管不能碰到废液缸。 6.吸取两种以上的使用液时要注意更换吸管,防止交叉污染。三.器械的清洗和消毒 玻璃器械洗消: (1)新的玻璃器皿的洗消: 1.自来水刷洗, 除去灰尘。 2.烘干、泡盐酸:烤箱中烘干,然后再浸入5%稀盐酸中12小时以除去脏物、铅、砷等物。 3.刷洗、烘干:12小时后立即用自来水冲洗,再用洗涤剂刷洗,自来水冲干净后用烤箱烘干。 4.泡酸、清洗:用清洁液(重铬酸钾120g :浓硫酸200ml :蒸馏水1000ml )浸泡12小时,然后从酸缸内捞出器皿用自来水冲洗15次,最后蒸馏水冲洗3-5次和用双蒸水过3次。 5.烘干、包装:洗干净后先烘干,然后用牛皮纸(油光纸)包装。 6.高压消毒:包装好的器皿装入高压锅内盖好盖子,打开开关和安全阀,当蒸气成直线上升时,关闭安全阀,当指针指向15磅时,维持20-30分钟。 7.高压消毒后烘干(2)旧的玻璃器皿的洗消: 1.刷洗、烘干:使用过的玻璃器皿可直接泡入来苏尔液或洗涤剂溶液中,泡过来苏尔溶液(洗涤剂)的器皿要用清水刷洗干净,然后烘干。 2.泡酸、清洗:烘干后泡入清洁液(酸液),12小时后从酸缸内捞出器皿立即用自来水冲洗(避免蛋白质干涸后粘附于玻璃上难以清洗),再用蒸馏水冲洗3次。 3.烘干、包装:洗干净的器皿烘干后取出用牛皮纸(油光纸)等包装,以便于消毒储存及防止灰尘和再次被污染。 4.高压消毒:包装好的器皿装入高压锅内,盖好盖子,打开开关和安全阀,随着温度的上升安全阀冒出蒸气,当蒸气成直线冒出3-5分钟后,关闭安全阀,气压表指数随之上升,当指针指向15磅时,调节电开关维持20-30分钟即可。(玻璃培养瓶消毒前可将胶帽轻轻盖上) 5.烘干备用:因为高压消毒后器皿会被蒸气打湿,所以要放入烤箱内烘干备用。金属器械洗消: 金属器皿不能泡酸,洗消时可先用洗涤剂刷洗,后用自来水冲干净,然后用75%酒精擦拭,再用自来水,然后用蒸馏水冲洗,再烘干或空气中晾干。放入铝制盒内包装好在高压锅内15磅高压(30分钟)消毒,再烘干备用。橡胶和塑料: 橡胶和制品通常处理方法是:先用洗涤剂洗刷干 净,再分别用自来水和蒸馏水冲干净,再用烤箱烘干,然后根据不同品质进行如下的处理程序: 1 . 针式滤器帽不能泡酸液,用NaOH 泡6-12小时,或者煮沸20分钟,在包装之前要装好滤膜两张,安装滤膜时注意光面朝上(凹向上),然后将螺旋稍微拧松一些,放入铝盒中在高压锅内15磅30分钟消毒,再烘干备用。注意在超净台内取出使用时应该立即将螺旋旋紧。 2. 胶塞烘干后用2%氢氧化钠溶液煮沸30分钟(用过的胶塞只要用沸水处理30分钟),自来
细胞培养皿规格
细胞培养皿规格 订货信息: 货号品名规格包装备注售价(元)是否现货订购10188细胞培养板6孔,孔直径 34.8mm,生长面积 9.5cm2 5只/包. 97.00现货10192细胞培养板12孔,孔直径 22.1mm,生长面积 3.8cm2 50只/箱. 1000.00现货10194细胞培养板24孔,孔直径 15.6mm,生长面积 1.9cm2 5只组. 110.00现货10196细胞培养板48孔,孔直径 10.2mm,生长面积 0.8cm2 100只/箱. 2400.00现货10198细胞培养板96平底,孔直径 6.4mm,生长面积 0.32cm2 5只组. 110.00现货10200细胞培养板96U底,孔直径 6.4mm,生长面积n/acm2 5只组. 132.00现货110202细胞培养板96V底,孔直径
6.4mm,生长面积 0.38 cm2 50只/箱. 1650.00现货10204细胞培养板96半孔板,孔直径 4.5mm,生长面积 0.16 cm2 5只组. 182.00现货10206细胞培养板384孔,125μl 20只/包. 968.00现货10208细胞培养板1536孔, 2.3μl 20只/箱. 4500.00现货10209细胞培养板1536孔, 2.3μl 1只/包. 248.00现货培养器皿96孔培养板24孔培养板12孔培养板6孔培养板 3.5 cm培养皿6 cm培养皿10 cm培养皿25cm2培养瓶75cm2培养瓶面积(cm2) 0.3 224.5 9.75培养液量(ml) 0.1 1.0 2.0 2.5 3.0
5.0 10.0 5.015~30细胞量1055× .5×1062× 1065.2× 10613.7×1065×1062×107
细胞培养用液的配制具体步骤与消毒方法
细胞培养用液的配制具体步骤与消毒方法实验器材与生物试剂 干粉型培养基、胰蛋白酶,青霉素、链霉素. 纯净水系统、电子天平、PH计、磁力搅拌器。 具体步骤 一.水的制备 细胞培养用水必须非常纯净,不含有离子和其他的杂质。需要用新鲜的双蒸水、三蒸水或纯净水 二.PBS的制备与消毒(也可用于其它BSS,如:Hanks,D-Hanks液的配制) 1.溶解定容:将药品(NaCl 8.0g,KCl 0.2g,Na2HPO4?H2O 1.56g,KH2PO4 0. 2g )倒入盛有双蒸水的烧杯中,玻璃棒搅动,充分溶解,然后把溶液倒入容量瓶中准确定容至1000ml,摇匀即成新配制的PBS溶液。 2.移入溶液瓶内待消毒:将PBS倒入溶液瓶(大的吊针瓶)内,盖上胶,并插上针头放入高压锅内120℃消毒20分钟。注意高压消毒后要用灭菌蒸馏水补充蒸发掉的水份。 三.胰蛋白酶溶液的配制与消毒 胰蛋白酶的作用是使细胞间的蛋白质水解从而使细胞离散。不同的组织或者细胞对胰酶的作用反应不一样。胰酶分散细胞的活性还与其浓度、温度和作用时间有关,在pH为8.0、温度为37℃时,胰酶溶液的作用能力最强。使用胰酶时,应把握好浓度、温度和时间,以免消化过度造成细胞损伤。因Ca2+、Mg2+和血清、蛋白质克降低胰酶的活性,所以配制胰酶溶液时应选用不含Ca2+、Mg2+的 BSS,如:D-Hanks液。终止消化时,可用含有血清培养液或者胰酶抑制剂终止胰酶对细胞的作用。 1.称取胰蛋白酶:按胰蛋白酶液浓度为0.25%,用电子天平准确称取粉剂溶入小烧杯中的双蒸水(若用双蒸水需要调PH到 7.2左右)或PBS(D-hanks)液中。搅拌混匀,置于4℃内过夜。 2.用注射滤器抽滤消毒:配好的胰酶溶液要在超净台内用注射滤器(0.22微米微孔滤膜)抽滤除菌。然后分装成小瓶于-20℃保存以备使用。 四.青、链霉素溶液的配制与消毒
细胞培养液配方
一PBS配方: 方法一 1×PBS(Phosphate-Buffered Sallines) Na 2HPO 4、 Na 2 HPO 4 ?7H2O 、 Na 2 HPO 4 ?12H2O中任选其一。 方法二母液的配制: 0.2M Na2HPO4:称取71.6g Na2HPO4-12H2O,溶于1000ml 水 0.2M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml 水 各种浓度PBS(pH=7.4)的配制: 先配0.2M PB S(pH=7.4,100ml):取19ml 0.2mol/L的NaH2PO4,81ml 0.2mol/L 的Na2HPO4, 即可。 然后只需将0.2M PB (pH=7.4)按相应比例适当稀释即可,如: 0.1M PBS(PH=7.4):取500ml 0.2M PB,加水稀释至1000ml 即可。 0.01M PBS(PH=7.4):取50ml 0.2M PB,加水稀释至1000ml 即可。 0.02M PBS(PH=7.4):取100ml 0.2 M PB,加水稀释至1000ml 即可。 若需要NaCl的话,加入NaCl 至0.9%(g/100ml)即可。
二细胞培养液配方:(200ml) RPMI-1640培养基 (180ml) 胎牛血清 (20ml) 双抗(2ml) 溶液各组分终浓度为90%RPMI-1640培养基 +10%胎牛血清+1%双抗(200mM L-谷氨酰胺、10mg/ml链霉素和10000U青霉素) 三细胞冻存液配方:(20ml) RPMI-1640培养基 (14ml) 胎牛血清 (4ml) DMSO (2ml) 双抗(0.2ml)
细胞培养用液的配制
实验3 、细胞培养用液的配制 【实验目的】 1. 掌握DMEM培养基、胰酶的配制 2. 学习针头滤器的使用方法 【实验原理】 一.细胞培养的基本条件 1. 气体环境 气体是细胞生存的必需条件之一,所需气体主要有氧气和二氧化碳。氧气参与三羧酸循环,产生能量和合成各种成分。二氧化碳主要维持培养基的pH,并作为碳源。一般用5%的空气和5%CO2来提供动物细胞的气体生长环境。氧分压过大,不利于细胞生长。植物组织或细胞一般不需要额外提供CO2。 2. pH环境 细胞生长的pH环境为:7.2-7.4,不同细胞有所差异。一般细胞耐酸性比耐碱性大些。CO2对培养基pH的影响: CO2是细胞的代谢产物, CO2的释放必然会影响培养基的pH。 CO2 + H2O H2CO3 H+ + HCO3- 所以,培养基中要加一些缓冲剂,以保持 pH的稳定,如 NaHCO3 、HEPES等 3. 糖类 葡萄糖------细胞的主要营养物质,为生命活动提供能量 糖类在生物体内的功能不仅仅是提供能量,与蛋白质和脂类共同构过程结构材料和生物活性物质。 体外培养动物细胞时,几乎所有的培养基中都以葡萄糖作为能源材料,根据不同细胞的代谢特点,所加葡萄糖浓度有所不同。植物细胞培养一般以蔗糖作为能源物质。 4.氨基酸 所有细胞多需要以下12种氨基酸:精氨酸、胱氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苏氨酸、色氨酸、组氨酸、酪氨酸、苯丙氨酸和缬氨酸另外所有细胞都需要谷氨酰胺,其具有特殊作用—促进氨基酸进入细胞膜,参与核酸合成,也是能源和碳源。5.维生素 在细胞代谢中起调节作用,虽然所需甚微,但为机体正常代谢不可缺少。 6.促生长因子 培养基中除上述营养成分外,还需要促细胞生长因子,已知有许多激素具有促细胞增殖作用。 血清是提供促细胞生长因子和其他细胞所需物质的来源。 二.天然培养基与合成培养基 1.天然培养基
培养细胞所需的几种主要液体的配制方法
培养细胞所需的几种主要液体的配制方法:1.DMEM维持培养基 DMEM基础培养基95ml 95ml 胎牛血清5ml 谷氨酰胺液2ml 含有DMEM基础培养基95ml,胎牛血清5ml,谷氨酰胺液2ml。混合均匀,密封后与4摄氏度保存。 2.D-hank’s D-hank’s干粉9.5g(1袋) NaHCO3 0.35g 超纯水1000ml 取D-hank’s干粉9.5g加入超纯水500ml搅拌均匀,加入0.35g的NaHCO3搅拌至完全溶解,倒入1000ml容量瓶中,用1mol/l的HCL或者NaOH 溶液调整溶液的PH值为7.2,最后经过∮0.22微升的滤膜过滤除菌,分装后4摄氏度保存. 3. DMEM完全培养基 85ml, DMEM基础培养液85ml, , l-谷氨酰胺溶液, 2ml 1000u/ml双抗液1ml 胎牛血清15ml 取DMEM基础培养基85ml, 胎牛血清15ml,l -谷氨酰胺溶
液2ml,混合均匀,密封于4摄氏度保存. 4. DMEM细胞基础培养基 DMEM干粉13.4g(1袋) Na2HCO3 3.7g 超纯水1000 ml 取DMEM干粉1袋(13.4g)倒入烧杯中,取800ml 超纯水溶解培养基干粉,搅拌均匀,然后向溶液中加入3.7g的Na2HCO3,搅拌至完全溶解后倾入1000 ml容量瓶中,再用1mol/l 的HCL 或者1mol/l的NaOH溶液调整溶液的PH值为7.2,混合均匀后,定容,∮0.22微升的滤膜过滤除菌,分装4摄氏度保存. 5. l-谷氨酰胺溶液 l-谷氨酰胺 2.92g DMEM基础培养基100ml 称取l-谷氨酰胺干粉2.92g于烧杯中,加80 ml超纯水于烧杯中搅拌溶解,用100ml容量瓶定容,∮0.22微升的滤膜过滤除菌,分装于小瓶中于-20摄氏度保存.使用添加量是1ml/50ml,使用浓度是2mmol/l. 6.1000u/ml的双抗液 青霉素(注射用) 80万单位(1瓶) 链霉素(注射用) 0.8 g 0.9%生理盐水80ml
实验2 细胞培养液的配制
实验二细胞培养用液的配制 一、D-MEM细胞培养液 1. 实验用水的选择配制培养溶液最好使用新制备的三蒸水。一般在试验前当天或前一天制备为好。调节pH值的酸碱溶液也应该使用这种水配制。(本实验用新买的怡宝纯净水) 2. 实验器材的准备所用的器材清洗要绝对干净,烤干后备用(滤器、滤膜、量筒、吸液管及盛放培养液的小瓶等存放和转移培养液的器材都应进行灭菌)。(小的东西放在饭盒内) 3. 溶解培养基干粉:将D-MEM培养基干粉溶于总量1/3(约300 ml)的水中,再用水洗包装袋内面两次,合并三次溶液。用磁力搅拌器或玻璃棒人工搅拌助溶。 4. 补加试剂:根据D-MEM培养基包装袋说明和试验需要加入NaHCO3 5. 加抗生素:一般抗生素终浓度为――青霉素100U/ml,链霉素100U/ml。(本实验最终体积按1000 ml加入现有的100mg链霉素,62.5mg青霉素) 6. 调pH值:将上述溶液加水至850ml,然后用1N盐酸或1N氢氧化钠或 5%NaHCO3调pH值最终为7.2-7.4。(不用调p H) 7. 过滤除菌:用不锈钢过滤器过滤上述溶液,分装于100 ml盐水瓶中,一瓶85 ml,余下装于盐水瓶中备用,即得基本培养液,标记,4℃冰箱保存,备用。8. 加小牛血清:取一瓶基本培养液,用针头过滤器过滤加入小牛血清15ml,摇匀,即得完全培养液(用于细胞培养),标记,4℃冰箱保存,备用。(小牛血清需预先从冰箱中取出解冻) 第7和第8的工作一定要在超净工作台上进行! 二、D-hanks 配方: NaCl 8g KCl 0.4g Na2HPO40.06g KH2PO40.06g NaHCO30.35 g 取约500ml水,分别依次加入上述药品,每加入一种药品先搅拌溶解后,再加入另外一种药品,最后加水至1000ml,摇匀,分装至100 ml、250 ml或500 ml 盐水瓶,高压灭菌,标记,4℃冰箱保存,备用。
细胞计数及铺板
用于侵袭、迁移等试验的细胞计数及铺板 [实验步骤] 1、准备工作用75% 的酒精擦拭双手,同时用酒精棉球擦拭超净台。2)将培养液、实验所需材料也放入超净台进行灭菌(血清、培养基除外)3)倒置显微镜下,观察细胞的状态,是否已经长满培养瓶,需要进行分瓶。 2、弃去培养基,用枪尽量去培养基。贴壁加入5mlPBS液清洗一遍,四个方向晃动倒掉。 3、将0.25%胰酶600ul加入培养皿内,拍皿,上下左右铺匀,37°消化30分钟左右,随时观察,见到细胞泥沙状留下时,即消化完全. 4、加入4ml的含5%血清的新鲜培养基,反复吹打消化好的细胞使其脱壁并分散,制成细胞悬液,然后装到15ml离心管中。1000rpm,3min. 5、弃上清。用PBS 3ml 洗细胞,吹打或涡旋混匀,洗2次,离心1000rpm,3min.弃上清。 6、配细胞稀释液(BSA 终浓度为0.1%).每种细胞需3ml稀释液,共6个样品,所以配20ml稀释液(无血培20ml+10%BSA 200ul.) 7、细胞沉淀中加3ml细胞稀释液,吹打混匀,即得稀释过的细胞悬液。 8、细胞计数板每孔加15ul悬液。每个样品计数2次,算均值。(8个大格总数/8=数值*104) 9、根据铺板密度,计算稀释过的细胞悬液用量,剩余体积用细胞稀释液补。 普通的细胞计数及铺板(免疫荧光,WB等不需定量) [实验步骤] 1、准备工作用75% 的酒精擦拭双手,同时用酒精棉球擦拭超净台。2)将培养液、实验所需材料也放入超净台进行灭菌(血清、培养基除外)3)倒置显微镜下,观察细胞的状态,是否已经长满培养瓶,需要进行分瓶。 2、弃去培养基,用枪尽量去培养基。贴壁加入5mlPBS液清洗一遍,四个方向晃动倒掉。 3、将0.25%胰酶600ul加入培养皿内,拍皿,上下左右铺匀,37°消化30分钟左右,随时观察,见到细胞泥沙状留下时,即消化完全.
细胞培养常用器材与试剂课稿
器材与试剂 干粉型培养基、胰蛋白酶,青霉素、链霉素. 纯净水系统、电子天平、PH计、磁力搅拌 器等 具体步骤 1. 水: 细胞培养用水必须非常纯净,不含有离子和其他的杂质。需要用新鲜的双蒸水、三蒸水或纯净水. 2. PBS (也可用于其它BSS,如:Hanks,D-Hanks液的配制): 主要用于免疫组化染色时组织或细胞的漂洗 溶解定容:将药品(NaCl 8.0g,KCl 0.2g,Na2HPO4·H2O 1.56g,KH2PO4 0. 2g )倒入盛有双蒸水的烧杯中,玻璃棒搅动,充分溶解,然后把溶液倒入容量瓶中准确定容至1000ml,摇匀即成新配制的PBS溶液。用HCl或NaOH调PH到7.4。 移入溶液瓶内待消毒:将PBS倒入溶液瓶(大的吊针瓶)内,盖上胶帽,并插上针头放入高压锅内8磅消毒20分钟。注意高压消毒后要用灭菌蒸馏水补充蒸发掉的水份。 3. 胰蛋白酶溶液: 胰蛋白酶的作用是使细胞间的蛋白质水解从而使细胞离散。不同的组织或者细胞对胰酶的作用反应不一样。胰酶分散细胞的活性还与其浓度、温度和作用时间有关,在pH为8.0、温度为37℃时,胰酶溶液的作用能力最强。使用胰酶时,应把握好浓度、温度和时间,以免消化过度造成细胞损伤。因Ca2+、Mg2+和血清、蛋白质克降低胰酶的活性,所以配制胰酶溶液时应选用不含Ca2+、Mg2+的BSS,如:D-Hanks液。终止消化时,可用含有血清培养液或者胰酶抑制剂终止胰酶对细胞的作用。 称取胰蛋白酶:按胰蛋白酶液浓度为0.25%,用电子天平准确称取粉剂溶入小烧杯中的双蒸水(若用双蒸水需要调PH到7.2左右)或PBS(D-hanks)液中。搅拌混匀,置于4℃内过夜。 用注射滤器抽滤消毒:配好的胰酶溶液要在超净台内用注射滤器(0.22微米微孔滤膜)抽滤除菌。然后分装成小瓶于-20℃保存以备使用。 4. 0.05%胰蛋白酶-0.02%EDTA溶液 称取胰蛋白酶粉末(1:250)0.05g,EDTA 0.02g,加入PBSA 100ml,0.22um微孔滤膜过滤除菌,分装,于-20℃保存。 5. 青、链霉素溶液: 所用纯净水(双蒸水)需要15磅高压20分钟灭菌。具体操作均在超净台内完成。青霉素是80万单位/瓶,用注射器加4ml灭菌双蒸水。链霉素是100万单位/瓶,加5ml灭菌双蒸水,即每毫升各为20万单位。分装于-20℃保存。使用时溶入培养液中,使青链霉素的浓度最终为100单位/ml。 6. RPMI1640: 溶解、调PH值、定容:先将培养基粉剂加入培养液体积2/3的双蒸水中,并用双蒸水冲洗包装袋2-3次(冲洗液一并加入培养基中),充分搅拌至粉剂全部溶解,并按照包装说明添加一定的药品.然后用注射器向培养基中加入配制好的青链霉素液各0.5ml, 使青链霉素的浓度最终各为100单位/ml。然后用二氧化碳或碳酸氢钠调PH到7.2左右。最后定容至1000ml,摇匀。 安装蔡式滤器:安装时先装好支架,按规定放好滤膜,用螺丝将不锈钢滤器和支架连接好。然后卸下支架腿分别用布包好待消毒。 抽滤:配制好的培养液通常用滤器过滤除菌。通常用蔡式滤器在超净工作台内过滤。
