用超声波_盐析法提取仙人掌果胶的研究2003

中图分类号:TS255;文献标识码:A ;文章篇号:1007-2764(2003)04-0050-17
用超声波、盐析法提取仙人掌果胶的研究
林曼斌黄传香
(韩山师范学院化生系潮州521041)
摘要: 主要研究了用超声波辅助盐析法从仙人掌中提取果胶,通过正交实验,对其工艺条件进行探讨,得出最佳的条件及产率。对于间接超声波作用,其最佳提取条件是提取功率40%,提取时间15min,提取温度75 ,提取液为15mL,即1倍的提取液;对于直接超声波作用,其最佳提取条件是提取功率60,提取时间15min,间歇比60%,提取液37.5mL,即2.5倍的提取液,此时果胶沉析的最佳条件是PH值为4.5,温度60 ,铝盐量9mL,得出的果胶产率是9.15%。
关键词: 超声波;盐析法; 仙人掌; 果胶; 提取
仙人掌中果胶含量丰富。果胶是一种淡黄色至白色、味微酸的粉末状固体,是一种以á-1.4 甙键连结的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。果胶在食品工业中作为食品添加剂有着十分广泛的用途:制造、果冻、果酱、果汁饮料、速溶饮料、巧克力和果糖等,分别在其中用作胶凝剂、混合剂、稳定剂、增稠剂等,其作用基本可取代琼脂但比琼脂便宜;医药上,其可用于防止血液凝固、肠出血和治疗便秘等症以及作为金属中毒的解毒剂;实验表明,其在纺织工业也是一种良好的乳化剂。此外,在化妆品及其它领域中也有广泛的应用。
目前,国内果胶生产由于多种原因停滞于中试水平,未能工业化生产,主要原因是工艺不太成熟,成本太高。而从仙人掌中提取果胶物质,传统方法是用水提法,沉析则用乙醇沉析法。水提法的缺点是耗时,而乙醇沉析法的缺点是原辅料消耗大,能耗大,工艺条件不易控制。本文采用超声波破碎浸提果胶,并对其最佳工艺条件进行探讨。超声波是频率高于20KMz 的机械波,它在媒质中传播时可产生空化现象,空化中产生的极大压力造成被破碎物在瞬间破碎,同时,超声波产生的振动作用加强了被破碎物的扩散及溶解。因此,在提取仙人掌果胶的过程中可用超声波进行细胞破壁。同时,本文用盐析法对从仙人掌中提取果胶进行了初步探讨,认为该方法基本克服了乙醇沉淀法的缺点,是一种可行的方法。
1 实验
收稿日期:2003-8-11
作者简介:林曼斌,男,韩山师范学院化生系讲师1.1 原料和试剂
新鲜仙人掌:采于潮州
试剂:结晶硫酸铝(C.P.,简称铝盐),盐酸(C.P.),氢氧化钠(C.P.),95%乙醇(C.P.),硝酸银(C.P.)1.2 主要仪器设备
PHS-3C型酸度计(萧山市分析仪器厂);
TG328电光分析天平(上海第二天平仪器厂);
SHZ-D( )循环水式真空泵(巩义峪予华仪器厂)
XMT温度数显调节仪(上海实验仪器总厂);
KQ-300DE型医用数控超声波清洗器(昆山市超声仪器有限公司);
JY96- 超声波细胞粉碎机(上海新芝生物技术研究所宁波新芝科器研究所);
KA-1000离心机;
小刀、纱布、托盘天平及玻璃仪器如烧杯等1.3 工艺流程
新鲜仙人掌 切碎 加水 调PH值 超声波浸提 抽滤 加铝盐 调PH值 沉析 离心过滤 水洗 乙醇沉淀 多次醇洗 过滤 烘干
1.4 实验方法
称取15g新鲜仙人掌,用小刀切成3~5mm3的小颗粒,置于80ml小烧杯中,加水,用10%盐酸调PH 值至2.1左右,超声波处理,趁热抽滤。滤液加入一定量的铝盐饱和溶液,搅拌并加入10%氢氧化钠溶液调至一定PH值,沉析1.5h后过滤,洗涤沉淀。再将所得的果胶铝沉淀用预先配制好的60%的乙醇与10%盐酸混合液(体积比为7:1)洗涤,以置换出铝离子。最后,用中性60%乙醇反复洗涤沉淀,直至洗液中不出现氯离子为止,烘干即得产品。
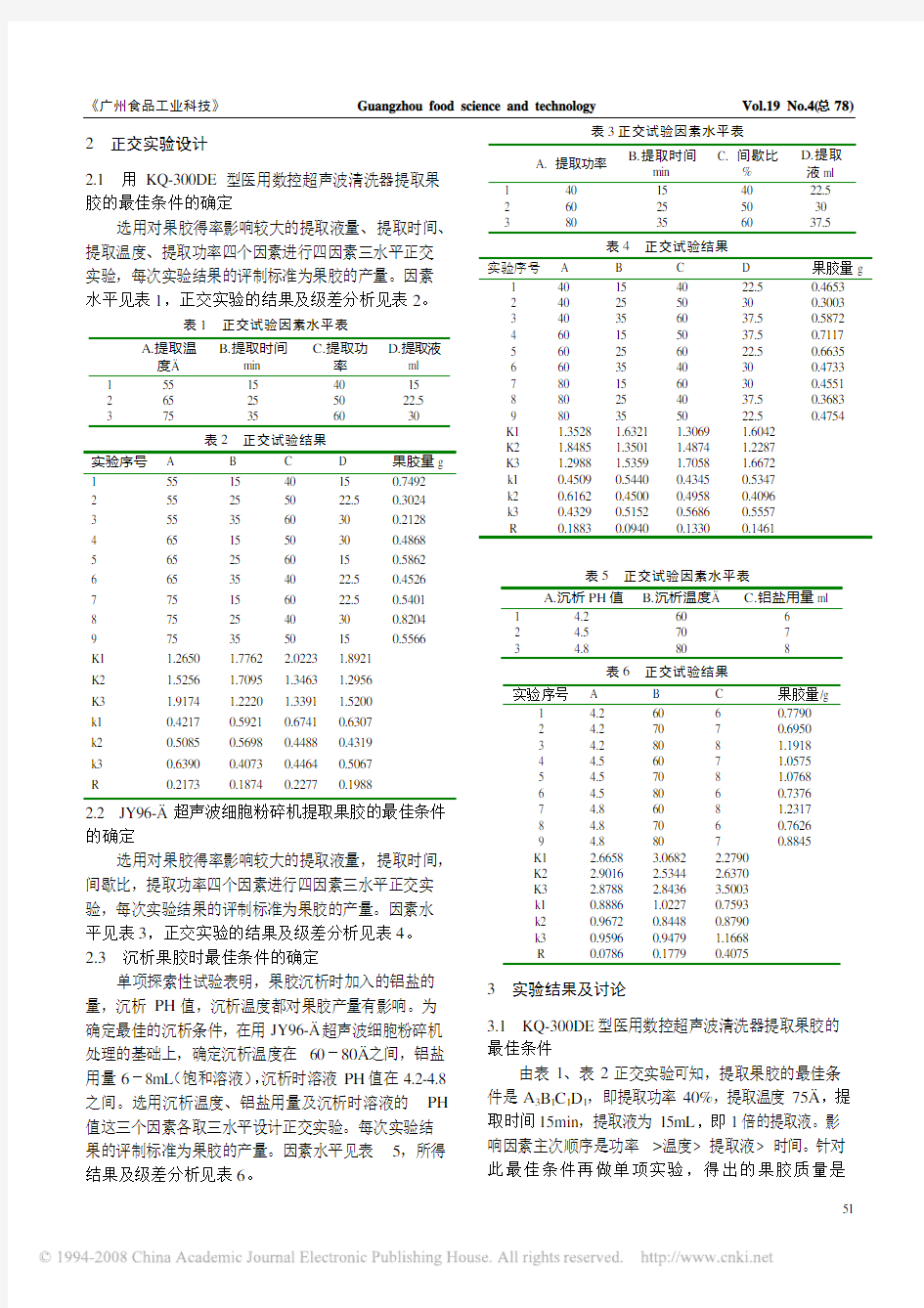
2 正交实验设计
2.1 用KQ-300DE型医用数控超声波清洗器提取果胶的最佳条件的确定
选用对果胶得率影响较大的提取液量、提取时间、提取温度、提取功率四个因素进行四因素三水平正交实验,每次实验结果的评制标准为果胶的产量。因素水平见表1,正交实验的结果及级差分析见表2。
表1 正交试验因素水平表
A.提取温
度 B.提取时间
min
C.提取功
率
D.提取液
ml
1 55 15 40 15
2 65 25 50 22.5
3 75 35 60 30
表2 正交试验结果
实验序号 A B C D 果胶量g
1 55 15 40 15 0.7492
2 55 25 50 22.5 0.3024
3 55 35 60 30 0.2128
4 6
5 15 50 30 0.4868
5 65 25 60 15 0.5862
6 65 35 40 22.5 0.4526
7 75 15 60 22.5 0.5401
8 75 25 40 30 0.8204
9 75 35 50 15 0.5566
K1 1.2650 1.7762 2.0223 1.8921
K2 1.5256 1.7095 1.3463 1.2956
K3 1.9174 1.2220 1.3391 1.5200
k1 0.4217 0.5921 0.6741 0.6307
k2 0.5085 0.5698 0.4488 0.4319
k3 0.6390 0.4073 0.4464 0.5067
R 0.2173 0.1874 0.2277 0.1988
2.2 JY96- 超声波细胞粉碎机提取果胶的最佳条件的确定
选用对果胶得率影响较大的提取液量,提取时间,间歇比,提取功率四个因素进行四因素三水平正交实验,每次实验结果的评制标准为果胶的产量。因素水平见表3,正交实验的结果及级差分析见表4。
2.3 沉析果胶时最佳条件的确定
单项探索性试验表明,果胶沉析时加入的铝盐的量,沉析PH值,沉析温度都对果胶产量有影响。为确定最佳的沉析条件,在用JY96- 超声波细胞粉碎机处理的基础上,确定沉析温度在60-80 之间,铝盐用量6-8mL(饱和溶液),沉析时溶液PH值在4.2-4.8之间。选用沉析温度、铝盐用量及沉析时溶液的PH 值这三个因素各取三水平设计正交实验。每次实验结果的评制标准为果胶的产量。因素水平见表5,所得结果及级差分析见表6。
表3正交试验因素水平表
A. 提取功率
B.提取时间
min
C. 间歇比
%
D.提取
液ml
1 40 15 40 22.5
2 60 25 50 30
3 80 35 60 37.5
表4 正交试验结果
实验序号 A B C D 果胶量g
1 40 15 40 22.5 0.4653
2 40 25 50 30 0.3003
3 40 35 60 37.5 0.5872
4 60 1
5 50 37.5 0.7117
5 60 25 60 22.5 0.6635
6 60 35 40 30 0.4733
7 80 15 60 30 0.4551
8 80 25 40 37.5 0.3683
9 80 35 50 22.5 0.4754
K1 1.3528 1.6321 1.3069 1.6042
K2 1.8485 1.3501 1.4874 1.2287
K3 1.2988 1.5359 1.7058 1.6672
k1 0.4509 0.5440 0.4345 0.5347
k2 0.6162 0.4500 0.4958 0.4096
k3 0.4329 0.5152 0.5686 0.5557
R 0.1883 0.0940 0.1330 0.1461
表5 正交试验因素水平表
A.沉析PH值
B.沉析温度
C.铝盐用量ml
1 4.
2 60 6
2 4.5 70 7
3 4.8 80 8
表6 正交试验结果
实验序号 A B C 果胶量/g
1 4.
2 60 6 0.7790
2 4.2 70 7 0.6950
3 4.2 80 8 1.1918
4 4.
5 60 7 1.0575
5 4.5 70 8 1.0768
6 4.5 80 6 0.7376
7 4.8 60 8 1.2317
8 4.8 70 6 0.7626
9 4.8 80 7 0.8845
K1 2.6658 3.0682 2.2790
K2 2.9016 2.5344 2.6370
K3 2.8788 2.8436 3.5003
k1 0.8886 1.0227 0.7593
k2 0.9672 0.8448 0.8790
k3 0.9596 0.9479 1.1668
R 0.0786 0.1779 0.4075
3 实验结果及讨论
3.1 KQ-300DE型医用数控超声波清洗器提取果胶的
最佳条件
由表1、表2正交实验可知,提取果胶的最佳条件是A3B1C1D1,即提取功率40%,提取温度75 ,提取时间15min,提取液为15mL,即1倍的提取液。影
响因素主次顺序是功率>温度> 提取液> 时间。针对此最佳条件再做单项实验,得出的果胶质量是
0.9052g,比正交实验中任何一组都高,证明上述条件确是用KQ-300DE型医用数控超声波清洗器(间接法)提取仙人掌果胶的最佳条件。
3.2 JY96- 超声波细胞粉碎机提取果胶的最佳条件
由表3、表4正交实验可知,提取果胶的最佳条件是A2B1C3D3, 即提取功率60,提取时间15min,间歇比60%,提取液37.5mL,即2.5倍的提取液。影响因素主次顺序是功率> 提取液> 间歇比> 时间。针对此最佳条件再做单项实验,得出的果胶质量是0.7790g,比正交实验中任何一组都高,证明上述条件确实是用JY96- 超声波细胞粉碎机(直接法)提取仙人掌果胶的最佳条件。
3.3 沉析果胶的最佳条件
由表5、表6正交实验可以看出,沉析果胶的最佳条件是A2B1C3, 即PH值为4.5,温度60 ,铝盐量8mL。因此在PH值为4.5,温度为60 条件下再以铝盐用量做单项试验,结果见表7。由表7知沉析的最佳铝盐量是9mL,此时果胶产量是 1.372g,产率为9.15%。因此,PH值为4.5,温度60 ,铝盐量9mL 就是仙人掌果胶沉析的最佳条件。
表7 单项试验
铝盐用量(ml)8 9 10
产量(g) 1.2883 1.372 1.3416 由表6可看出:沉析温度对果胶产量的影响相对来说不是很大。但若沉析温度偏低,则果胶铝沉淀的速度较慢以致沉析反应在短时间内不完全,若此情况下延长沉析时间,则易发生诸如未沉析的果胶降解的副反应;沉析温度过高,则果胶或果胶铝可能发生分解或降解从而导致产量偏低,故而,果胶的沉析温度不宜偏低或偏高。由表6可知,沉析温度取60 较好。
正交实验表明,沉析PH值对果胶产量的影响相对较大。单项探索性实验也显示沉析PH值对产品的性状和颜色有影响。这可能因为溶液的酸度太大,则果胶将出现氧化、分解及果胶铝脱铝等现象从而影响产量和质量;若酸度太小,则发生果胶分子在溶液中电离、溶解以致过滤时损失较大,同时,溶液颜色加深,同样必然影响产品的产量和质量。由表6可以得知PH值以4.5为最佳。
3.4 超声波提取法与传统浸提法的比较
在相同的条件下,分别用传统方法和超声波法提取仙人掌果胶,结果表明用超声波法提取仙人掌果胶可明显加快提取速度。但用传统方法浸提较长时间后可达到与超声波处理同样的破碎效果。
3.5 两种超声波提取法的比较
对于KQ-300DE型医用数控超声波清洗器(间接法)而言,由于是用1倍的提取液,所以提取物黏度较大,在加铝盐及调PH 值时必须大力、充分搅拌,果胶才能沉析完全。而对于JY96- 超声波细胞粉碎机(直接法)来说,由于是用2.5倍的提取液,所以提取物黏度较小,果胶容易沉析完全。在相同的沉析条件下,前者的提取率比后者高。但两者的共同点是提取时间少、超声功率都不大,而且都是超声功率影响最大,提取时间影响最小。
3.6 醇沉淀法与盐析法的比较
同样15g仙人掌,提取条件一样,只是滤液处理过程不同:一用乙醇沉淀法,即将所得滤液浓缩后用乙醇沉淀,然后过滤、洗涤、干燥;另一用盐析法,即本文上述处理过程。结果发现:乙醇沉淀法所得的果胶量较少,产品性状和色泽都不好且乙醇消耗大、滤液收集时损失大;而用盐析法所得果胶量比乙醇沉淀法多得多,产品质量较好且醇耗量少,明显能缩短工时,节约能源,因而大大降低成本,所以,用盐析法提取仙人掌中的果胶较传统的乙醇沉淀法优越。
4 结论
4.1 用 KQ-300DE型医用数控超声波清洗器提取果胶(间接法),其最佳提取条件是:提取功率40%,提取时间15min,提取温度75 ,提取液为15mL,即1倍的提取液。
4.2用 JY96- 超声波细胞粉碎机提取果胶(直接法),其最佳提取条件是:提取功率60,提取时间15min,间歇比60%,提取液37.5mL,即2.5倍的提取液。
4.3 在用JY96- 超声波细胞粉碎机处理的条件下,果胶沉析的最佳条件是PH值为4.5,温度60 ,铝盐量9mL,在此条件下,仙人掌果胶产量是1.372g,产率为9.15%。所得果胶为淡黄色、略有特臭的粉末,经红外光谱分析证明其与MW5800的多糖极相似。
4.4 相对于传统的水浸提法提取果胶,用超声波法提取果胶可缩短时间,但用传统方法浸提较长时间后可达到与超声波处理同样的破碎效果。相对于传统的乙醇沉淀法,盐析法提取果胶的优越之处在于:工艺较简单,工时可缩短1/3,乙醇消耗量可降低30%-35%,因而可大大降低生产成本。
参考文献
1 王钊等.我国海南仙人掌的成分分析及开发[]].天然产品研
究与开发,2001(1):44~48
2 Trejo. Gomzalez A, etal. A purified extract from prickly pear
cactus (Opunite fuliginosa) controls experimentally induced diabetes in rat. Journal of Ethnopharmacology,1996,55
(1) :27~33
3 Sierakowski M R,etal.Some structural features of heteropoly
saccharide from the leaves of the cactus Pereskia aculeate.
Phytochemistry,1987,26(6):1709~1713
4 吴广枫等. 超声波用于芦荟多糖提取的研究[J].食品科
技,2001(6):23~24
5 东北师范大学等校.物理化学实验[M]. 高等教育出版社,
1989.(5):26~31
6 肖志剑等.从仙人掌中分离提取果胶的研究[J].广州食品工
业科技,2001(3):4~6
7 林曼斌等.用盐析法从香黄瓜中提取果胶及其工艺条件的
研究[J].广州食品工业科技,2000(2):33~37
8 王建龙等. 盐析法从鲜西瓜皮中提取果胶的工艺[J]. 太原
工业大学学报,97.28(3):99~103
9 王凤阁等.用盐析法从苹果批皮中提取果胶[J] .烟台师范
学院学报,98.14(3):206~208
Study of the Extracting Pectin from Cactus by Ultrasonic Wave and Salt
LinManBin, HuangChuanXiang
(Department of Chemistry and Biology, HanShan Teachers’ college, ChaoZhou 521041) Abstract: This paper mainly study the method of extracting pectin from cactus by ultrasonic wave supporting the salting-out way. After orthogonal design and many times of approaches its technical conditions, we conclude the best environments for extracting and the rate of production. For the indirect ultrasonic wave function, its best extracting environments are the power 40%,the time 15 min, the temperature 75 , the liquid 15 ml. , namely 1 withdrawing of times liquid; For the direct ultrasonic wave function, its best extracting environments are the power 60, withdrawing time 15 min, intermittent ratio 60%, withdrawing the liquid 37.5 ml., namely 2.5 withdrawing of times liquid; And in the conditions, the best withdrawing environments of pectin are pH 4.5 ,temperature 60 , aluminum salt measure 9 ml. .The rate of production is 9.15%.
Key words: ultrasonic wave; salting-out way; cactus; pectin; extract
(上接第100页)
16 S. M.Clegg, G. O. Phillips and P. A. Williams, In G. O.
Phillips, D. J. Wedlock and P. A. Williams (eds) (1990).
Gums and Stebilisers for the Food Industry 5, IRL Press at Oxford University Press, Oxford, 459
17 H. Torigata, H. Inagaki and H. Litano (1952). Nippon Kagaku
Zasshi. 73,186
18 N. Sugiyama, H. Shimahara, T. Andoh, M. Takemoto and T.
Kamata (1972). Agr. Biol. Chem. 36,1381
19 N. Kishida, S. Okimasu and T. Kamata (1978). Agr. Biol.
Chem. 42, 1645
20 N. Kishida (1979). Agr. Biol. Chem. 43(11), 2391
21 K. Nishinari, K. Y. Kim and K. Kohyama (1987). 2nd
International Workshop on Plant Polysaccharides, Grenoble 22 E. R. Morris, A. N. Cutler, S. B. Ross-Murphy, D. A. Rees
and J. Price (1981). Carbohydr. Polym. 1,5
23 G. J. Shelso (1990). Gums and Stebilisers for the Food
Industry 5, IRL Press at Oxford University Press, Oxford, 563
24 H. D. Chanzy, A. Grosrenaud, J. P. Joseleau, M. Dube and R.
H. Marchessault (1982). Biopolymers. 21,301
25 A. D. French and V. G. Murphy (1977). Cereal Foods World.
22, 61
26 A. Jeanes, N. C. Schieltz and C. A. Wilham (1948). J. Biol.
Chem. 176, 617
27 H. J. Welland (1954). J. Poly. Sci. 13, 471
28 K. Ogawa, T. Yui and T. Mizuno (1991). Agri. Biol. Chem.
176, 617
29 M. Yoshimura, T. Takaya and K. Nishinari (1996). J. Agric.
Food Chem. 44,2970
Summarized the Researches of Oversea on Structure and Solution Properties of Konjac Glucomannan
Li Bin, Wang Chao
(Dept. of food science and Technology, Huazhong Agricultural University, Wuhan 430070) Abstract: Summarized the researches of oversea on structure and solution properties of konjac glucomannan.
Keywords: Konjac Glucomannan; Structure; Solution Property; Review.
果胶提取工艺讲解学习
果胶提取工艺
果皮中提取果胶方法探讨综述 摘要:由于时间不允许,没做到实验,不过先从理论探讨一下各方法从果皮中提取果胶, 对酸解法工艺进行初步探讨。 关键词:果胶、提取方法、工艺 Abstract: due to the time did not permit, didn't do the experiment, but first discuss the method from the theory from the extraction of the peel pectin, the acid solution process for a preliminary discussion. Keywords: pectin and extraction method, process 果胶广泛存在于植物组织之中, 主要形成细胞壁的中层, 起组织硬化和保持水分的作用。由于酸和果胶酶的存在, 它的含量随果实的成熟度的增加而降低, 果胶是以α一1,4糖苷键键合的D一半乳糖醛酸为基本结构的多糖类物质, 分子量为10000到400000。一般地, 一个果胶分子由几百到1000 多个半乳糖醛酸残基组成, 平均分子量在50000到220000之间[1]。 作为膳食纤维的主要成分之一, 果胶具有抗腹泻、抗癌、治疗糖尿病等功效, 在医药工业中用于制造轻泻剂、止血剂、毒性金属解毒剂、血浆代用品等, 另外, 果胶具有良好的胶凝性和乳化稳定作用, 被广泛地用于果冻、果酱、婴儿食品、冰淇淋及果汁的生产中。FAO/WHO 规定, 果胶作为食品添加剂, 其添加量不受限制。 果胶提取方法: 酸萃取法传统的无机酸提取法是将洗净、除杂预处理后的果皮用无机酸(如盐酸、硫酸、亚硫酸、硝酸、磷酸等)调节一定pH值,加热90~ 95℃并不断搅拌, 恒温50~ 60min,然后将果胶提取液离心、分离、过滤除杂(提取用水最
果胶的提取与果胶含量的测定
果胶的提取与果胶含量 的测定 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
果胶的提取与果胶含量的测定 一、引言 果胶广泛存在于水果和蔬菜中,如苹果中含量为—%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。 二、实验材料、试剂与仪器 材料:桔皮,苹果等; 试剂:%HCL,95%乙醇(AR),精制乙醇,乙醚,LHCl,%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯) 仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等三、实验步骤 (一)果胶的提取 1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。 2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约%HCL溶液,以浸没果皮为宜,调pH至~,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。 3、脱色:在滤液中加入~%的活性炭,于80℃加热20min,进行脱色和除异味,趁热抽滤(如抽滤困难可加入2%~4%的硅藻土作为助滤剂)。如果柑橘皮漂洗干净萃取液为清澈透明则不用脱色。
果胶提取实验报告1
桔皮中果胶提取技术的试验分析 【摘要】酸浸提法提取果胶具有快速、简便、易于控制、提取率较高等特点,用盐酸浸提、乙醇沉淀法进行了从桔皮中提取果胶的工艺试验。用单因素试验进行工艺参数的优化,其适合的工艺条件是:液料质量比为20;浸提液pH值为2;浸提温度为90℃。 关键词:桔皮果胶提取工艺工艺参 引言:果胶是一种亲水性植物胶,属于多糖类物质,广泛存在于高等植物的根、茎、叶、果的细胞壁中。通常人们所说的果胶系指原果胶、果胶和果胶酸的总称,是一种高分子聚合物,分子量介于20 000-400 000之间。其基本结构是D一吡喃半乳糖醛酸,以1,4甙链连接成的长链,其中部分半乳糖醛酸被甲醇酯化 [1]。 胶凝剂、增稠剂、稳定剂和乳化剂,随着功能性多糖的开发研究,果胶作为水溶性膳食纤维,越来越受到重视。应用必定会越来越广泛[2-4]。我国是柑桔的主要产地,柑桔皮中果胶含量可达10%~30%。从桔皮中提取果胶不仅有极大的工业价值,而且对综合开发、利用柑桔资源,提高原材料利用率,减少环境污染,有重要的实际意义[2,4,6]。果胶的提取一般有酸提取法、离子交换法、微生物法和微波加热处理法等方法[5-9],由于酸提取法具有快速、简便且提取率高的优点,国内外大多采用此法。果胶分离沉淀主要有乙醇沉淀法和盐析法。国内主要采用乙醇沉淀法,而国外多用盐析法或不经沉淀直接喷雾干燥。针对我国情况而言,对乙醇沉淀法已有大量研究,而本实验也是在总结
别人成果的基础上进行对比以及提取工艺条件的优化。 1材料与方法 1.1 材料 桔皮采用成熟新鲜、无病虫果害的晚熟蜜桔,人工取皮,在40℃下干燥,粉碎至1~3 mm,待用。 盐酸、乙醇、氢氧化钠、无水氯化钙、冰醋酸和甲基红,均为化学纯。1.2 果胶提取方法 果胶提取工艺为:原料→洗涤→失活→干燥→粉碎→酸提取→过滤→浓缩→冷却→乙醇沉淀→离心分离→干燥→称量→粉碎→果胶。 剔除腐烂变质、发黑的桔皮,用清水洗净后,放入烧杯中,加水,加热至90 ℃保温5~10 min,使酶失活,捞出桔皮,将桔皮在40 ℃下干燥,切碎。将20 g原料加入用HC1预先配制的、具有一定pH值和温度的酸溶液中,维持所需的温度达到一定的提取时间,并不断搅拌。趁热用布氏漏斗过滤得果胶提取液。将滤液用旋转蒸发仪在60-70 ℃下浓缩至原体积的1/3时为止。果胶浸提液冷却至常温后加入1倍体积的95 乙醇,搅拌、静置2 h,使果胶沉淀析出。用布氏漏斗过滤得粗果胶。在60-70 ℃干燥,粉碎即得果胶粉。随后进行提取物中果胶含量的测定和提取率的计算。 1.3 试验方法 单因素试验,分别研究不同液料质量比对果胶提取率的影响(浸 提液pH值3、温度80℃、浸提时间45 min);不同浸提液pH值对果胶提取率的影响(浸提液温度80℃、液料质量比10、浸提时间45 min);不
果胶的提取
实验果胶的提取 一、目的要求 1.掌握从柚子皮中提取果胶的方法。 2. 了解果胶的性质和提取原理。 3. 了解果胶在食品工业中的用途。 二、实验原理 果胶物质广泛存在于植物中,主要分布于细胞壁之间的中胶层,尤其以果蔬中含量为多。不同的果蔬含果胶物质的量不同,山楂约为6.6%,柑橘约为0.7~1.5%,南瓜含量较多,约为7%~17%。在果蔬中,尤其是在未成熟的水果和果皮中,果胶多数以原果胶存在,原果胶不溶于水,用酸水解,生成可溶性果胶,再进行脱色、沉淀、干燥即得商品果胶。从柚子皮中提取的果胶是高酯化度的果胶,在食品工业中常用来制作果酱、果冻等食品。 果胶是一种分子中含有几百到几千个结构单元的线性多糖,平均分子量大约在50000~180000之间,其基本结构是以α-1,4苷键结合而成的聚半乳糖醛酸,在聚半乳糖醛酸中,部分羧基被甲醇酯化,剩余部分与钾、钠或铵等离子结合。 在果蔬中果胶多以原果胶存在。在原果胶中,聚半乳糖醛酸可被甲醇部分酯化,并以金属桥(特别是钙离子)与多聚半乳糖醛酸分子残基上的游离羧基相连接。原果胶不溶于水,用酸水解时这种金属离子桥(离子键)被破坏,即可得可溶性果胶。再进行纯化和干燥即为商品果胶。 三、实验器材 恒温水浴、布氏漏斗、抽滤瓶、玻棒、尼龙布、表面皿、精密pH试纸、烧杯、电子天平、小刀、真空泵、柚子皮(新鲜)。 四、实验试剂 1.95%乙醇。 2.浓盐酸 3.2mol/L氨水 4.活性炭 五、操作步骤 1.称取新鲜柚子皮5g,用水冲洗后切成3~5 mm大小的颗粒,放入100 mL烧杯中,加20 mL水,加热至90 ℃保温5~10 min,使酶失活。把果皮粒用尼龙布挤干,用50 ℃左右的热水漂洗,直至水为无色,果皮无异味为止。每次漂洗都要把果皮用尼龙布挤干,再进行下一次漂洗[注1]。 2.将处理过的果皮粒放入烧杯中,加入45 mL水,滴加浓盐酸调溶液的pH 2.0~2.5之间。加热至90 ℃,在恒温水浴中保温30 min,保温期间要不断地搅动,趁热用垫有100目尼龙布(或四层纱布)的布氏漏斗抽滤,收集滤液。 3.在滤液中加入0.5—1%的活性炭于80℃加热10 分钟进行脱色和除异味,趁热抽滤[注2]。 4.滤液冷却后,滴加2mol/L氨水调至pH 3~4,在不断搅拌下缓缓地加入95%酒精溶液,加入乙醇的量为原滤液体积的1.5倍(使其中酒精的质量分数达50%~60%)。酒精加入过程中即可看到絮状果胶物质析出,静置10 min后,用尼龙布过滤、挤压。将脱水的果胶放入表面皿中摊开,在60~70 ℃烘干。将烘干的果胶磨碎过筛,制得干果胶。 5.滤液可用蒸馏法收回乙醇。 六、问题与思考 1.从柚子皮中提取果胶时,为什么要加热使酶失活? 2.沉淀果胶除用乙醇外,还可用什么试剂? 3.在工业上,可用什么果蔬原料提取果胶? [注1]:处理的主要目的是灭酶,以防果胶酶解。同时也是对果皮进行清洗,以除去泥土、杂质、色素等。 这种处理的好坏直接影响果胶的色泽和质量。 [注2]:如果柚子皮漂洗干净,滤液清沏,则可不脱色。因为胶状物容易堵塞滤纸,这时可加入占滤液2~4%的硅藻土用助滤剂。
实验二 离子交换法提取谷氨酸
实验二离子交换法提取谷氨酸 一、实验目的 掌握离子交换装置的结构和使用方法。 掌握离子交换法提取谷氨酸的工艺流程。 掌握等电点沉淀法提取谷氨酸。 了解认识离子交换树脂的处理和再生。 二、实验原理 谷氨酸是两性电解质,是一种酸性氨基酸,等电点为pH3.22,当pH>3.22时,羧基离解而带负电荷,能被阴离子交换树脂交换吸附;当pH<3.22时,氨基离解带正电荷,能被阳离子交换树脂交换吸附。也就是说,谷氨酸可被阴离子交换树脂吸附也可以被阳离子交换树脂吸附。由于谷氨酸是酸性氨基酸,被阴离子交换树脂的吸附能力强而被阳离子交换树脂的吸附能力弱,因此可选用弱碱性阴离子交换树脂或强酸性阳离子交换树脂来吸附氨基酸。但是由于弱碱性阴离子交换树脂的机械强度和稳定性都比强酸性阳离子交换树脂差,价格又较贵,因此就都选强酸性阳离子交换树脂而不选用弱碱性阴离子交换树脂。目前各味精厂均采用732#强酸性阳离子交换树脂,本实验就是采用732#树脂。 谷氨酸溶液中既含有谷氨酸也含有其他如蛋白质、残糖、色素等妨碍谷氨酸结晶的杂质存在,通过控制合适的交换条件,在根据树脂对谷氨酸以及对杂质吸附能力的差异,选择合适的洗脱剂和控制合适的洗脱条件,使谷氨酸和其他杂质分离,以达到浓缩提纯谷氨酸的目的。 三、实验装置 1、离子交换装置 本实验采用动态法固定床的单床式离子交换装置。离子交换柱是有机玻璃柱,柱底用玻璃珠及玻璃碎片装填,以防树脂漏出。 2、树脂 本实验用苯乙烯型强酸性阳离子交换树脂,编号为732#,其性能如下表:
732#树脂的主要性能常数 3、树脂的处理 对市售干树脂,先经水充分溶胀后,经浮选得到颗粒大小合适的树脂,然后加3倍量的2mol/L HCL溶液,在水浴中不断搅拌加热到80℃,30min后自水溶液中取出,倾去酸液,用蒸馏水洗至中性,然后用2mol/L NaOH溶液,同上洗树脂30min后,用蒸馏水洗至中性,这样用酸碱反复轮洗,直到溶液无黄色为止。用6%(W/W)盐酸溶液转树脂为氢型,蒸馏水洗至中性备用。过剩的树脂浸入1mol/L NaOH溶液中保存,以防细菌生长。 四、试剂配制 1、上柱交换液 谷氨酸发酵液或等电点母液,含谷氨酸2%左右。 配制方法;取工厂购回的谷氨酸干粉20g溶于200ml自来水中,再加进约8ml浓盐酸使谷氨酸粉全部溶解,此时pH值约为1.5,最后稀释至1.0L。 2、洗脱用碱 4%NaOH溶液。其配制方法有两种: ①40gNaOH溶于1000ml自来水中; ②工业用碱配成4%浓度(W/W),(约9°Bx,相对密度1.04) 3、再生用酸 6%(W/W)盐酸溶液。把大约80ml浓盐酸(36%含量)用自来水稀释至500ml。配成约4°Be,相对密度1.027的溶液。 4、0.5%茚三酮溶液 0.5g茚三酮溶于100mL丙酮溶液中配制成。
果胶提取的现状及发展前景研究综述
果胶的提取现状和发展前景研究 摘要:果胶是一种天然高分子,随着对其研究的深入发展,涉及的内容和应用范围越来越广泛。本文综合概述了果胶的结构、性质、作用、提取的方法和发展前景,简单介绍了它们的应用领域。 关键词:果胶;提取;前景 引言: 果胶是植物中的一种酸性多糖物质,它通常为白色至淡黄色粉末,稍带酸味,具有水溶性,工业上即可分离,其分子量约5万一30万,主要存在于植物的细胞壁和细胞内层,为内部细胞的支撑物质。在食品上作胶凝剂,增稠剂,稳定剂,悬浮剂,乳化剂,增香增效剂,并可用于化妆品,对保护皮肤,防止紫外线辐射,冶疗创口,美容养颜都存一定的作用。因而果胶有着广泛的应用。 一、果胶的性质及来源 果胶(Pectin)是一组聚半乳糖醛酸。在适宜条件下其溶液能形成凝胶和部分发生甲氧基化(甲酯化,也就是形成甲醇酯),其主要成分是部分甲酯化的a(l,4)一D一聚半乳糖醛酸。残留的羧基单元以游离酸的形式存在或形成铵、钾钠和钙等盐。 不同的蔬菜,水果口感有区别,主要是由它们含有的果胶含量以及果胶分子的差异决定的。柑橘、柠檬、柚子等果皮中约含30%果胶,是果胶的最丰富来源。 二、果胶在我国的发展现状 果胶作为胶凝剂广泛用于生产果酱、果冻、果脯、蜜饯、软糖、焙烤食品与饮料中,还可作为增稠剂和稳定剂添加于果汁、乳制品中。随着现代工业的发展,果胶在各领域的需求量越来越多,我国每年消耗果胶3000 吨以上,进口果胶约占80%,由于进口果胶的价格高于国产果胶,国产果胶成了国内众多企业的期盼,因此大力开发果胶生产新工艺,利用我国丰富的果胶资源,生产出优质果胶,满足国内外市场需求已显得极为迫切。
果胶生产工艺主要分预处理、提取、浓缩、沉淀、干燥等5 个步骤,其关键步骤为提取和沉淀。目前国内果胶生产多采用传统方法。提取过程主要采用酸提取法,辅之于微波、超声波处理等辅助手段提取。沉淀方法主要是醇沉法和盐析法。整个工艺方法的缺点是乙醇使用量大,其中醇沉法工艺生产1 吨果胶需消耗7 吨乙醇;盐析法可使乙醇用量下降至4 吨,但生产成本仍较高,且产品产量低,沉淀性状不好, 灰分含量高,溶解性差,工艺条件也较难控制。 三、果胶提取新型方法的研究 (一)甘薯果胶酸提取工艺的研究 目前,我国甘薯加工主要集中在提取淀粉,制作粉丝、粉条等粗加工领域,在生产过程中,每天都要产生大量的废渣。鲜薯渣中含水量高达80%,不易贮存、运输,腐败变质后产生恶臭,如果直接排放将会造成严重的环境污染。 国外多以柑橘皮、柠檬皮渣、苹果皮渣等为原料生产果胶,目前我国食品行业主要从柑橘皮渣、苹果渣中提取和生产果胶,但尚未有从具有高果胶含量的甘薯渣中提取和生产果胶的报道。资料表明,甘薯渣中至少有20%~30% 的果胶物质。本研究立足于当前我国果胶生产的实际情况,以及丰富甘薯渣资源的现状,以简化果胶生产工艺、降低生产成本为目的,对甘薯果胶[1]的提取工艺进行优化分析和讨论,以期确定最佳提取工艺。 (二)酶法制备低甲氧基果胶的工艺研究 果胶是一种植物多糖, 其基本组成是部分甲酯化的半乳糖醛酸, 通常按甲氧基含量分为两大类: 甲氧基含量高于7%的高甲氧基果胶和低于7%的低甲氧基果胶。 工业化高甲氧基果胶[1]生产原料主要是柑桔和苹果的皮渣, 低甲氧基果胶[1]的生产是由高甲氧基果胶在一定条件下脱酯得到。果胶的用途很广, 70%用作食品添加剂, 两类果胶的最大区别在于胶凝机理不同。 高甲氧基果胶只能在可溶性固形物高于55%和狭小的pH 范围( 3.0 左右) 才能胶凝, 主要用于高糖食品的生产。低甲氧基果胶只需较低的糖浓度甚至无糖条件下, 就能在Ca2+或其它二价阳离子体系中形成凝胶。为满足肥胖和糖尿病人等的需要, 可制成低热量的食品, 这使低甲氧基果胶的需求量越来越大。 目前国内只有高甲氧基果胶的生产技术,低甲氧基果胶加工技术尚不成熟,
果胶的提取
果胶的提取 一、目的要求 1.学习从柑橘皮中提取果胶的方法。 2.进一步了解果胶质的有关知识。 二、实验原理 果胶物质广泛存在于植物中,主要分布于细胞壁之间的中胶层,尤其以果蔬中含量为多。不同的果蔬含果胶物质的量不同,山楂约为6.6%,柑橘约为0.7~1.5%,南瓜含量较多,约为7%~17%。在果蔬中,尤其是在未成熟的水果和果皮中,果胶多数以原果胶存在,原果胶不溶于水,用酸水解,生成可溶性果胶,再进行脱色、沉淀、干燥即得商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶,在食品工业中常用来制作果酱、果冻等食品。 三、实验器材 恒温水浴、布氏漏斗、抽滤瓶、玻棒、尼龙布、表面皿、精密pH试纸、烧杯、电子天平、小刀、真空泵。 柑橘皮(新鲜)。 四、实验试剂 1.95%乙醇、无水乙醇。 2.0.2 mol/L盐酸溶液 3.6 mol/L氨水 4.活性炭 五、操作步骤 1.称取新鲜柑橘皮20 g(干品为8 g),用清水洗净后,放入250 mL 烧杯中,加120 mL水,加热至90 ℃保温5~10 min,使酶失活。用水冲洗后切成3~5 mm大小的颗粒,用50 ℃左右的热水漂洗,直至水为无色,果皮无异味为止。每次漂洗都要把果皮用尼龙布挤干,再进行下一次漂洗。 2.将处理过的果皮粒放入烧杯中,加入0.2 mol/L的盐酸以浸没果皮为度,调溶液的pH 2.0~2.5之间。加热至90 ℃,在恒温水浴中保温40 min,保温期间要不断地搅动,趁热用垫有尼龙布(100目)的布氏漏斗抽滤,收集滤液。 3.在滤液中加入0.5%~1%的活性炭,加热至80 ℃,脱色20 min,趁热抽滤(如橘皮漂洗干净,滤液清沏,则可不脱色)。 4.滤液冷却后,用6 mol/L氨水调至pH 3~4,在不断搅拌下缓缓地加入95%酒精溶液,加入乙醇的量为原滤液体积的1.5倍(使其中酒精的质量分数达50%~60%)。酒精加入过程中即可看到絮状果胶物质析出,静置20 min 后,用尼龙布(100目)过滤制得湿果胶。 5.将湿果胶转移于100 mL烧杯中,加入30 mL无水乙醇洗涤湿果胶,
从果皮中提取果胶
从果皮中提取果胶 一、实验目的 1、学习从从果皮中提取果胶的基本原理和方法, 了解果胶的一般性质。 2、掌握提取有机物的原理和方法。 3、进一步熟悉萃取、蒸馏、升华等基本操作。 二、实验原理 果胶是一种高分子聚合物,存在于植物组织内,一般以原果胶、果胶酯酸和果胶酸3种形式存在于各种植物的果实、果皮以及根、茎、叶的组织之中。果胶为白色、浅黄色到黄色的粉末,有非常好的特殊水果香味,无异味,无固定熔点和溶解度,不溶于乙醇、甲醇等有机溶剂中。粉末果胶溶于20倍水中形成粘稠状透明胶体,胶体的等电点pH值为3.5。果胶的主要成分为多聚D—半乳糖醛酸,各醛酸单位间经a—1,4糖甙键联结,具体结构式如图1。 图1 果胶的结构式 在植物体中,果胶一般以不溶于水的原果胶形式存在。在果实成熟过程中,原果胶在果胶酶的作用下逐渐分解为可溶性果胶,最后分解成不溶于水的果胶酸。在生产果胶时,原料经酸、碱或果胶酶处理,在一定条件下分解,形成可溶性果胶,然后在果胶液中加入乙醇或多价金属盐类,使果胶沉淀析出,经漂洗、干燥、精制而形成产品。 三、主要仪器和药品 仪器:恒温水浴锅、真空干燥箱、布氏漏斗、抽滤瓶、玻棒、纱布、表面皿、精密pH试纸、烧杯、电子天平、小刀、小剪刀、真空泵、。 药品:干柑桔皮、稀盐酸、95%乙醇(分析纯)等。 四、实验内容 1、柑桔皮的预处理 称取干柑桔皮20g,将其浸泡在温水中(60~70℃)约30min,使其充分吸水软化,并除掉可溶性糖、有机酸、苦味和色素等;把柑桔皮沥干浸入沸水5min进行灭酶,防止果胶分解;然后用小剪刀将柑皮剪成2~3mm的颗粒;再将剪碎后的柑桔皮置于流水中漂洗,进一步除去色素、苦味和糖分等,漂洗至沥液近无色为止,最后甩干。 2、酸提取
离子交换法提取谷氨酸
离子交换法回收提取谷氨酸 一、实验目的 通过实验掌握新树脂的预处理方法及动态离子交换的基本操作;了解谷氨酸提取的原理和方法。 二、实验原理 树脂的选择,选择离子交换树脂的主要依据是被分离物的性质和分离目的。包括被分离物和主要杂质的解离特性、分子量、浓度、稳定性、所处介质的性质以及分离的具体条件和要求。然后从性质各异的多种树脂中选择出最适宜的品种进行分离操作。 其中最重要的一条是根据分离要求和分离环境保证分离目的物与主要杂质对树脂的吸附力有足够的差异。当目的物具有较强的碱性和酸性时,宜选用弱酸性弱碱性的树脂。这样有利于提高选择性,并便于洗脱。如目的物是弱酸性或弱碱性的小分子物质时,往往选用强碱、强酸树脂。如氨基酸的分离多用强酸树脂,以保证有足够的结合力,便于分步洗脱。对于大多数蛋白质,酶和其它生物大分子的分离多采用弱碱或弱酸性树脂,以减少生物大分子的变性,有利于洗脱,并提高选择性。 就树脂而言,要求有适宜的孔径,孔径太小交换速度慢,有效交换量下降(尤对生物大分子),若孔径太大也会导致选择性下降。此外树脂的化学稳定性及机械性能也需考虑.在既定的操作条件下有足够的化学耐受性和良好的物理性能以利操作。一般树脂都有较高的化学稳定性,能经受酸、碱和有机溶剂的处理。但含苯酚的磺酸型树脂及胺型阴离子树脂不宜与强碱长时间接触,尤其是在加热的情况下。对树脂的特殊结合力也要给予足够的注意,如树脂对某些金属离子的结合以及辅助力的作用。 氨基酸为两性电解质,等电点较低的谷氨酸在pH小于pI 3.2时,主要以GA+型式存在,故可用强酸性阳离子交换树脂提取。当发酵液流过交换柱时,发酵液中各成分依亲和力的不同进行交换。吸附GA的树脂再用洗脱液(5%NaOH)洗脱,收集富含GA的流分(高流液)。从而实现与杂质的分离及GA的富集,高流液调等电点pH 3.2,GA结晶析出。用过的树脂用稀酸再生以用于下轮交换(图1)。主要化学反应有: 交换: RSO3H + NH4+ = RSO3NH4+ RSO3H + GA+ = RSO3GA + H+ 洗脱: RSO3-GA+ + NaOH = RSO3Na+ + GA+ + H2O RSO3-GA+ + NH4OH = RSO3HN4+ + GA+ + H2O 再生: RSO3Na+ + HCl = RSO3H + NaCl
橘皮中橙皮苷和果胶的提取
橘皮中橙皮苷和果胶的提取 一、实验目的 1.掌握果胶和橙皮苷的提取基本原理和提取方法,了解橙皮苷的鉴定方法。2.熟悉过滤、干燥、重结晶等基本操作。 二、实验原理 1.性质和用途 橙皮苷、果胶是糖类物质,在柑橘里含量丰富,广泛应用于食品和医药。果胶为淡黄色粉末,溶于水,酸性条件下稳定,在碱性中易分解,在食品工业中作为增稠剂或胶凝剂。结构式如下: O O O COOCH3 HO OH H O H OH OH H H COOCH3 O H OH O 橙皮苷为灰白色粉末,难溶于水,能维持血管正常渗透压,降低血管脆性,缩短出血时间,是合成新型甜味剂二氢查耳酮的主要原料。结构式如下: O O H OH H OH CH2 OH H O O OCH3 OH OH O OH H O H OH H OH 2.原理 用热水浸泡方法提取果胶,用乙醇析出。提取过果胶的橘皮残渣经水浸泡、碱溶液处理、酸化等提取橙皮苷。 三、主要仪器与试剂 仪器:烧杯(100mL)、量筒、圆底烧瓶(100mL,250mL)、磁力搅拌器、抽滤瓶(250mL)、布氏漏斗(60mm)、熔点仪、红外光谱仪。 试剂:干橘皮粉末、95%乙醇、浓盐酸(分析纯)、氯化钙、饱和石灰水、亚硫酸氢钠、氢氧化钠、稀盐酸、精密pH试纸。
四、实验内容 1.果胶的提取 ①原料预处理 称取新鲜柑橘皮20 g(干品为8 g),用清水洗净后,放入250 mL烧杯中,加120 mL水,加热至90 ℃保温5~10 min,使酶失活。用水冲洗后切成3~5 mm 大小的颗粒,用50 ℃左右的热水漂洗,直至水为无色,果皮无异味为止。每次漂洗都要把果皮用尼龙布挤干,再进行下一次漂洗。 ②酸法提取 将处理过的果皮粒放入烧杯中,加入0.2 mol/L的盐酸以浸没果皮为度,调溶液的pH 2.0~2.5之间。加热至90 ℃,在恒温水浴中保温40 min,保温期间要不断地搅动,趁热用垫有尼龙布(100目)的布氏漏斗抽滤,收集滤液。 ③脱色 在滤液中加入0.5%~1%的活性炭,加热至80 ℃,脱色20 min,趁热抽滤(如橘皮漂洗干净,滤液清沏,则可不脱色)。 ④乙醇沉淀果胶 滤液冷却后,用6 mol/L氨水调至pH 3~4,在不断搅拌下缓缓地加入95%酒精溶液,加入乙醇的量为原滤液体积的1.5倍(使其中酒精的质量分数达50%~60%)。酒精加入过程中即可看到絮状果胶物质析出,静置20 min后,用尼龙布(100目)过滤制得湿果胶。 ⑤将湿果胶转移于100 mL烧杯中,加入30 mL无水乙醇洗涤湿果胶,再用尼龙布过滤、挤压。将脱水的果胶放入表面皿中摊开,在60~70 ℃烘干。将烘干的果胶磨碎过筛,制得干果胶。 2.橙皮苷的提取 称取提取过果胶的橘皮残渣5g,放到250mL圆底烧瓶中,加入50mL水浸泡1h,然后加入2mL1.0mol/LCaCl2溶液,60mL饱和石灰水、0.07g亚硫酸氢钠、2.4mL2.0mol/LNaOH溶液,加热至40~50℃,搅拌2h滤去残渣,滤液用稀盐酸调节pH为6~7,冰浴冷却,析出灰白色沉淀物。过滤并用水洗涤沉淀,用乙醇重结晶得橙皮苷。 3.产品检测
果胶的提取制备现状与展望
摘要: 果胶是一种亲水性植物胶, 由α- 1, 4糖苷键联接的半乳糖醛酸与鼠李糖、阿拉伯糖、半乳糖等中性糖聚合而成, 是重要的食品添加剂之一。果胶需求量与世界平均水平相比呈高速增长趋势【4】。大力开展果胶的研究与开发, 探索提高果胶产量和质量的新方法和新资源, 不仅能为我国食品加工领域广泛地应用优质果胶提供理论依据, 而且将推动国产果胶生产的发展。本文介绍了果胶的化学结构及提取用原料,并结合国内外近年来的研究成果, 系统综述了果胶的提取、脱色、沉淀和干燥的方法【1-7】。 关键词: 果胶;提取;脱色;沉淀;干燥;展望 1 前言 果胶(Pectin)是一组聚半乳糖醛酸。它具有水溶性,工业上即可分离,其分子量约5万一30万。在适宜条件下其溶液能形成凝胶和部分发生甲氧基化(甲酯化,也就是形成甲醇酯),其主要成分是部分甲酯化的a(l,4)一D一聚半乳糖醛酸。残留的羧基单元以游离酸的形式存在或形成铵、钾钠和钙等盐。我国果胶资源丰富,柑桔皮甜菜压粕、苹果皮渣,柠檬皮渣、向日葵盘等均含有大量果胶【4】。已成为具有工业化生产价值的主要原料。目前国内以柑桔皮为主要原料生产果胶。果胶具有良好的乳化、增稠、稳定和胶凝作用, 在食品、纺织、印染、烟草、冶金等领域得到了广泛的应用。同时, 由于果胶具有抗菌、止血、消肿、解毒、降血脂、抗辐射等作用, 还是一种优良的药物制剂基质。近年来, 其在医药领域的应用较为广泛。 2 目前果胶的制备的现状 2.1果胶的提取 果胶分为水溶性和非水溶性2种, 非水溶性果胶可溶于六偏磷酸钠溶液或无机酸溶液。天然果胶中的原果胶不溶于水, 但可在酸、碱、盐等化学试剂作用下水解成水溶性果胶。目前, 国内外常用的提取主要方法有如下几种【1-7】。 2.1.1酸提取法 水解酸的种类很多,生产中多用盐酸。传统的无机酸提取法是:将洗净、除杂预处理好的果皮用无机酸(如盐酸、硫酸、亚硫酸、硝酸、磷酸等) 调节一定pH值,加热90~95 ℃并不断搅拌,恒温50~60 min ,然后将果胶提取液离心,分离,过滤除杂(提取用水最好经过软化处理) ,得到果胶澄清液。该法的缺点是果胶分子在提取过程中会局部水解,反应条件也复杂,过滤时速度较慢, 生产周期长, 效率低【1】。据文献报导,在上述无机酸中亚硫酸的效果最好。目前酸提取法正在朝着混和酸提取法的方向发展 2.1.2离子交换树脂法 果胶类物质与细胞壁半纤维素等共价键结合, 通过次级键与细胞壁其他多聚体通过次级键结合。多价阳离子特别是钙离子存在时, 阳离子键合引起低酯果胶类物质的不溶性, 降低了高酯果胶的浸胀性。所以单纯酸法提取不能完全解除 果皮中多价阳离子及其他杂质对果胶的束缚。该法的工艺流程是:将处理过的柑桔皮脱水后粉碎,再与离子交换树脂和水制成浓浆液(原料一般先与30~50 倍左右水混和,加入一定的离
西瓜皮中叶绿素提取工艺的研究
第36卷第6期 2018年11月 食品科学技术学报 Journal of Food Science and Technology Vol.36No.6 Nov.2018 doi:10.3969/j.issn.2095?6002.2018.06.012文章编号:2095?6002(2018)06?0082?06 引用格式:时月,王宇滨,李武,等.西瓜皮中叶绿素提取工艺的研究[J].食品科学技术学报,2018,36(6):82-87. SHI Yue,WANG Yubin,LI Wu,et al.Extraction of chlorophyll from watermelon peel[J].Journal of Food Science and Technology,2018,36(6):82-87. 西瓜皮中叶绿素提取工艺的研究 时 月, 王宇滨, 李 武, 马 越, 赵晓燕, 张 超* (北京市农林科学院蔬菜研究中心/果蔬农产品保鲜与加工北京市重点实验室/农业部蔬菜产后 处理重点实验室/农业部华北地区园艺作物生物学与种质创制重点实验室,北京 100097)摘 要:西瓜皮约占果实总重量30%,属于西瓜深加工的副产物三研究以西瓜皮为原料,优化溶剂提取法和超高压辅助溶剂提取法提取西瓜皮中叶绿素的工艺参数三结果显示溶剂提取法的较佳条件为以φ=80%的丙酮溶液为溶剂,按照料液比1∶7g/mL在50℃提取1.5h,获得叶绿素提取率为3.92mg/g;超高压辅助溶剂提取法的较佳条件为以φ=80%的丙酮溶液为溶剂,按照料液比1∶7 g/mL,在常温条件下40MPa保压10min,获得叶绿素提取率为4.46mg/g三因此,使用超高压辅助溶剂提取法提取西瓜皮叶绿素比传统溶剂提取法缩短时间90%以上,提高叶绿素提取率11.7%,为西瓜副产物的综合利用提供新的技术手段三 关键词:西瓜皮;叶绿素;超高压辅助;溶剂提取法 中图分类号:TS255.8 文献标志码:A 收稿日期:20171221 基金项目:现代农业产业技术体系资助项目(CARS25);北京市自然科学基金资助项目(6172013);果蔬农产品保鲜与加工北京市重点实验室资助项目(Z141105004414037)三 作者简介:时 月,女,硕士研究生,研究方向为农产品加工; *张 超,男,副研究员,博士,主要从事农产品深加工方面的研究,通信作者三 西瓜(Citrullus lanatus)是我国重要的经济作 物,近十年来,我国西瓜生产总量一直居世界首位, 2015年全国西瓜播种面积186.07万公顷,总产量 7714.0万t,占全球总产量的66.2%,经济效益显 著[1-2]三目前,西瓜主要被鲜食,小部分被加工成为 鲜切西瓜二西瓜汁二西瓜粉或西瓜酒等三在加工过程 中,约占西瓜质量30%的西瓜皮作为副产物被抛 弃三研究显示西瓜皮具有很高的利用价值,其已经 在提取果胶二加工果酱果脯二饲料以及药用等方面得 到应用[3-4]三 叶绿素是天然的绿色色素来源,具有纯天然和 色价高等优点,广泛应用于食品二化工和医药领域三 目前,叶绿素的生产原料主要是蚕沙和菠菜,其中蚕 沙中叶绿素含量在5~10mg/(g干重)[5],菠菜中叶 绿素含量在0.524mg/(g干重)[6]三叶绿素的提取 方法包括溶剂提取法[7]二超声波辅助溶剂提取 法[8]二微波辅助溶剂提取法[9]二酶处理辅助溶剂提 取法等[10],这些方法各有优缺点三近年来,超高压 辅助溶剂提取法已经应用于蓝莓渣花色苷[11]二橙皮 果胶[12]二人参的人参皂甙[13]二绿茶茶多酚[14]二龙眼 和赤松根抗氧化物质[15-16]的提取,有效地提高了目 标组分的产率三但是,使用超高压辅助溶剂提取法 提取西瓜皮中叶绿素的研究还鲜有报道三 因此,本文分别采用溶剂提取法和超高压辅助 溶剂提取法两种方法对西瓜皮中叶绿素进行提取, 优化其工艺参数,比较其叶绿素提取率,以期为西瓜 副产物综合利用提供理论依据三 1 材料与方法 1.1 材料与仪器 西瓜,京欣3号,购于北京果香四溢蔬菜水果超28
实验四 果胶的提取
实验四果胶的提取 一、引言 果胶广泛存在于水果和蔬菜中,如苹果中含量为0.7—1.5%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。 在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。 二、实验材料、试剂与仪器 材料:桔皮,苹果等; 试剂:0.25% HCL,95%乙醇(AR),精制乙醇,乙醚,0.05mol/L HCl,0.15%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯) 仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等 三、实验步骤 (一)果胶的提取 1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。 2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约60mL 0.25% HCL 溶液,以浸没果皮为宜,调pH至2.0~2.5,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。 3、脱色:在滤液中加入0.5~1.0%的活性炭,于80℃加热20min,进行脱色和除异味,趁热抽滤(如抽滤困难可加入2%~4%的硅藻土作为助滤剂)。如果柑橘皮漂洗干净萃取液为清澈透明则不用脱色。 4、沉淀:待提取液冷却后,用稀氨水调pH至3~4。在不断搅拌下加入95%乙醇溶液,加入乙醇的量约为原体积的1.3倍,使酒精浓度达到50%~65%。 5、过滤、洗涤、烘干:用尼龙布过滤(滤液可用蒸馏法回收酒精),收集果胶,并用95%乙醇洗涤果胶2~3次,再于60~70℃干燥果胶,即为果胶产品。
果胶的提取
从果皮中提取果胶 一、目的要求 1.学习从柑橘皮中提取果胶的方法。 2.进一步了解果胶质的有关知识。 二、实验原理 果胶物质广泛存在于植物中,主要分布于细胞壁之间的中胶层,尤其以果蔬中含量为多。不同的果蔬含果胶物质的量不同,山楂约为6.6%,柑橘约为0.7~1.5%,南瓜含量较多,约为7%~17%。在果蔬中,尤其是在未成熟的水果和果皮中,果胶多数以原果胶存在,原果胶不溶于水,用酸水解,生成可溶性果胶,再进行脱色、沉淀、干燥即得商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶,在食品工业中常用来制作果酱、果冻等食品。 三、实验药品、仪器、装置 仪器:恒温水浴、布氏漏斗、抽滤瓶、玻棒、尼龙布、表面皿、精密pH试纸、烧杯、电子天平、小刀、真空泵、柑橘皮(新鲜)。 试剂:1.95%乙醇、无水乙醇。 2.0.2 mol/L盐酸溶液 3.6 mol/L氨水 4.活性炭 四、操作步骤 1.称取新鲜柑橘皮20 g(干品为8 g),用清水洗净后,放入250 mL烧杯中,加120 mL水,加热至90 ℃保温5~10 min,使酶失活。用水冲洗后切成3~5 mm大小的颗粒,用50 ℃左右的热水漂洗,直至水为无色,果皮无异味为止。每次漂洗都要把果皮用尼龙布挤干,再进行下一次漂洗。 2.将处理过的果皮粒放入烧杯中,加入0.2 mol/L的盐酸以浸没果皮为度,调溶液的pH 2.0~2.5之间。加热至90 ℃,在恒温水浴中保温40 min,保温期间要不断地搅动,趁热用垫有尼龙布(100目)的布氏漏斗抽滤,收集滤液。 3.在滤液中加入0.5%~1%的活性炭,加热至80 ℃,脱色20 min,趁热抽滤(如橘皮漂洗干净,滤液清沏,则可不脱色)。 4.滤液冷却后,用6 mol/L氨水调至pH 3~4,在不断搅拌下缓缓地加入95%酒精溶液,加入乙醇的量为原滤液体积的1.5倍(使其中酒精的质量分数达50%~60%)。酒精加入过程中即可看到絮状果胶物质析出,静置20 min后,用尼龙布(100目)过滤制得湿果胶。 5.将湿果胶转移于100 mL烧杯中,加入30 mL无水乙醇洗涤湿果胶,再用尼龙布过滤、挤压。将脱水的果胶放入表面皿中摊开,在60~70 ℃烘干。将烘干的果胶磨碎过筛,制得干果胶。 五、注意事项 1.脱色中如抽滤困难可加入2%~4%的硅藻土作助滤剂。 2.湿果胶用无水乙醇洗涤,可进行2次。 3.滤液可用分馏法回收酒精。 六、实验现象及结论记录表
离子交换法提取柠檬酸概述
离子交换法提取柠檬酸概述 应富祥 (安徽省皖东化工厂,天长 239300) 柠檬酸生产工艺,目前均采用钙盐法,劳动强度大,所产生的硫酸钙废渣,污染环境,而且提取收率低,能耗大,往往由于水解和分离不彻底,使柠檬酸混杂于废渣中废弃,严重影响收率。离子交换法是提取柠檬酸的新工艺,值得推广。过去曾有人用离子交换膜、电渗析法生产柠檬酸,由于种种原因,没能成功,以后有人采用离子交换法,但因当时国产离子交换树脂品种少,价格高,物化性能也满足不了工艺要求,造成提取收率低,成本高,母液中残留其它有机杂酸和色素,结果仍需采用“钙盐法”进行净化,故无明显优势,没有得到发展。离子交换法新工艺,工艺简单,容易操作,连续化管道化生产,自动化操作,大大减轻劳动强度,不产生硫酸钙废渣,提取收率可由旧工艺的70%提高到90%以上。新工艺简单易行。将发酵液过滤后用颗粒活性炭脱色除杂,经特制的高强度高交换容量的弱碱性阴离子交换树脂交换吸附,饱和后用氢氧化钠或氢氧化铵进行洗脱,洗脱液再经特制的大孔强酸性阳离子交换树脂除杂,用氢离子交换使柠檬酸钠(铵)转化为柠檬酸,经浓缩结晶可获得质量优良的柠檬酸产品。结晶母液再经阴离子交换树脂除杂,再浓缩结晶,也获得合格产品。 离子交换法提取柠檬酸工艺流程如下 : 1 离子交换法提取柠檬酸交换洗脱原理 1.1 吸附 阴离子交换树脂以OH 型进行交换与吸 附 3R OH+C 6H 8O 7→R CHO+3H 2O 1.2 洗脱 采用氢氧化钠或氢氧化铵为洗脱剂 R 3C 6H 5O 7+3NaOH →Na 3C 6H 5O 7+3R OH 如用氨水洗脱: R 3C 6H 5O 7+3NH 3?H 2O →(NH 4)3C 6H 5O 7+3R OH 1.3 利用大孔阳离子交换树脂 以氢离子交换除阳离子,使柠檬酸盐成为柠檬酸,阳离子交换树脂经酸再生后仍成为氢型。 Na 3C 6H 5O 7+3RSO 3H →3RSO 3N a +C 6H 8O 7(NH 4)3C 6H 5O 7+3RSO 3H →3RSO 3(NH 4)3+C 6H 8O 7 再生: RSO 3Na +HCl →RSO 3H+NaCl RSO 3(NH 4)3+HCl →RSO 3H+NH 4Cl 注:R 为阳树脂骨架,R 为阴树脂骨架。 2 离子交换树脂型号的选择 2.1 专用阴树脂与一般的201×7比较其体积交换量m mol/ml 为2.7,而201×7为1.4,所用专用的阴树脂比较优越,体积几乎高出一倍。 2.2 专用的大孔强酸阳树脂与一般的001×7比较 其体积交换量(mmol/ml)为1.57,0.01×7为1.8,但大孔强酸树脂不易破碎寿命 24总第95期1998年第5期 安 徽 化 工
橘皮果胶的不同提取
橘皮果胶的不同提取 工艺研究 指导老师:王晓玲 学生姓名:王虹霞 学生学号:120703032515 学院单位:化学与环境保护工程学院 时间:2012.12.20
橘皮果胶的不同提取工艺研究 王虹霞 (西南民族大学化学与环境保护工程学院,成都) 摘要:果胶在柑橘皮中的含量约为20%,其用途越来越广,而我省是生产柑橘的大省,因此本文主要利用本土资源,首先概述了果胶的应用及其主要成分和存在形式,然后重点介绍从柑橘中提取果胶的不同方法。 关键字:橘皮果胶、性质、提取方法。 1.前言 1.1果胶的性质 果胶广泛存在于绿色陆生植物的细胞壁和细胞内层,通常以部分甲酯化状态存在,一般有原果胶、果胶及果胶酸三种形式。以分子中半乳糖醛酸的比例所表征果胶的酯化度或甲氧基含量的高低,可将其分为高甲氧基果胶(甲氧基含量7%或酯化度>50%)或低甲氧基果胶(甲氧基含量<7%或酯化度< 50%)[1]天然存在的果胶都是高甲氧基果胶,经酸或碱处理降低酯化度后得到低甲氧基果胶。果胶物质在化学分类上应属于碳水化合物的衍生物,是一种高分子聚合物,分子量在1~40万之间,其基本组成单位是D-吡喃半乳糖醛酸,并以α-1,4-苷键连接起来而成高分子化合物(即多聚半乳糖醛酸),其主链上还有其他糖,包括L-阿拉伯糖、D-半乳糖、D-山梨糖、L-鼠李糖[2]。 O O O O O O O OH OH OH OH OH OH OH OH O OH O O O HO OH HO 图1 果胶的结构式 从柑橘皮中提取出的果胶具有良好的乳化、增稠、稳定和胶凝作用,在食品、纺织、印染、烟草、冶金等领域得到了广泛的应用。同时,由于果胶具有抗菌、止血、消肿、解毒、降血脂、抗辐射等作用,还是一种优良的药物制剂基质[3]。近年来,其在医药领域的应用较为广泛。目前全世界的年需求果胶量高达近2.0×108kg,并预计每年将以5%的速度增长。 果胶的结构特征,使果胶主要表现出以下三点的性能特性: (1)溶解性:纯品果胶物质为白色或淡黄色粉末,略有特异气味。在20倍的水中几乎完全溶解,形成一种带负电荷的粘性胶体溶液,但不溶于 乙醚、丙酮等有机溶剂。如果用蔗糖糖浆或与3倍以上砂糖混合则更易溶于水。一般来说,果胶在水中的溶解度与自身的分子结构有关,其多聚半乳糖醛酸链越长在水中溶解度越小。 (2)酸碱性:在不加任何试剂的条件下,果胶物质水溶液呈酸性,主要是果胶酸和半乳糖醛酸。因此,在适度的酸性条件下,果胶稳定。但在强酸强碱条件下,果胶分子会降解。
谷氨酸的发酵和提取工艺综述
综述:谷氨酸的发酵与提取工艺 第一部分谷氨酸概述 谷氨酸非人体所必需氨基酸,但它参与许多代谢过程,因而具有较高的营养价值,在人体内,谷氨酸能与血氨结合生成谷氨酰胺,解除组织代谢过程中所产生的氨毒害作用,可作为治疗肝病的辅助药物,谷氨酸还参与脑蛋白代谢和糖代谢,对改进和维持脑功能有益。另外,众所周知的谷氨酸钠盐即味精有很强烈的鲜味,是重要的调味品。 1996、1997、1998年味精年产量分别为55.0万吨、56.64万吨、59.03万吨。尽管如此,我国人均年消耗味精量还只有400g左右,而台湾省已达2000g。因此,中国将是世界上最大的潜在味精消费市场,也就是说,味精生产会稳步发展。这也意味着谷氨酸的生产不断在扩大[1]。 谷氨酸生产走到今天就生产技术而言已有了长足进步,无论是规模还是产能都今非昔比,与此同时各厂家还在追求完美, 这是行业进步的动力,也是生存之所需。实际上生产工艺是与时俱进的,没有瑕疵的工艺是不存在的。如:配方及提取方法现在是多种多样,有单一用纯生物素的,也有用甘蔗糖蜜加纯生物素的, 还有加玉米浆干粉或麸皮水解液及豆粕水解液等等;提取方法有:等电-离交、等电-离交-转晶、连续等点-转晶等等[2]。 本综述简述谷氨酸生产的流程及发酵机制,着重介绍谷氨酸的提取工艺。 第二部分谷氨酸生产原料及其处理 谷氨酸发酵的主要原料有淀粉、甘蔗糖蜜、甜菜糖蜜、醋酸、乙醇、正烷烃(液体石蜡)等。国内多数谷氨酸生产厂家是以淀粉为原料生产谷氨酸的,少数厂家是以糖蜜为原料进行谷氨酸生产的,这些原料在使用前一般需进行预处理。 (一)糖蜜的预处理 谷氨酸生产糖蜜预处理的目的是为了降低生物素的含量。因为糖蜜中特别是甘蔗糖蜜中含有过量的生物素,会影响谷氨酸积累。故在以糖蜜为原料进行谷氨酸发酵时,常常采用一定的措施来降低生物素的含量,常用的方法有以下几种:(1)活性炭处理法; (2)水解活性炭处理法;(3)树脂处理法。 (二)淀粉的糖化 绝大多数的谷氨酸生产菌都不能直接利用淀粉,因此,以淀粉为原料进行谷氨酸生产时,必须将淀粉质原料水解成葡萄糖后才能供使用。可用来制成淀粉水解糖的原料很多,主要有薯类、玉米、小麦、大米等,我国主要以甘薯淀粉或大米制备水解糖。 淀粉水解的方法有三种:①酸解法;②酶解法;③酸酶(或酶酸)结合法。 1.酸解法用酸解法生产水解糖,其工艺流程如下: 原料(淀粉、水、盐酸)调浆→糖化→冷却→中和→脱色→过滤除杂→糖液2.酶解法先用α-淀粉酶将淀粉水解成糊精和低聚糖,然后再用糖化酶将糊精和低聚糖进一步水解成葡萄糖的方法,称为酶解法。 与淀粉的酸解相比,酶解法具有以下一些优点:①酶解反应条件比较温和。细菌α-淀粉酶是在pH6.0~7.0、温度85~90℃条件下,将淀粉液化成能溶解于水的糊精和低聚糖;而糖化酶是在pH4.0~4.5、温度58—60℃条件下,完成糖化反应的。②由于酶的作用专一性强,因此水解过程中很少有副反应发生。③淀粉乳
