蛋白质的理化性质
第三节蛋白质理化性质
一、教学内容分析:
本节课是这一章里最重要的一节课,在本模块中,学生将通过实例学习蛋白质的理化性质,体会在解决实际的问题中如何更好应用这些理论知识。
二、学生学习情况分析:
我们的课堂教学常用“高起点、大容量、快推进”的做法,忽略了知识的发生发展过程,无形增加了学生的负担,泯灭了很多学生学习的兴趣。
三、设计思想
本节课让学生充分感受到知识应用于生活,激发同学们学习的乐趣。努力改变课程实施过程死记硬背,机械训练的现状,倡导学生主动参与,乐于探究,培养学生学生收集和处理信息的能力,获得新知识的能力。
四、重点难点突破
以生活为源泉,善于创设情景
五、教学过程设计
(三)蛋白质的理化性质探求过程
1、蛋白质的两性解离和等电点
思考:电泳法分离蛋白质机理?
动画演示:氨基酸两性解离及等电点
教学
程序
教学内容教师活动学生活动
导入新课电泳法分离蛋白质机理[讲解]醋膜电泳法将血浆蛋白
质分成5条带
蛋白质为什么带电荷?
倾听
思考
学习新知识(一)蛋白质的两性解离和等
电点
[讲解]
1.两性基团(羧基和氨基)。
2.两性解离
酸性解离:-COOH
-COO- + H+
碱性解离:-NH2+ H+
-NH3+
3.等电点
[讨论]兼性离子是否“不带电”
聆听、理解、记忆
讨论发言
巩固和提高蛋白质的两性解离和等
电点
[探讨]如何判断蛋白质的带电
情况。
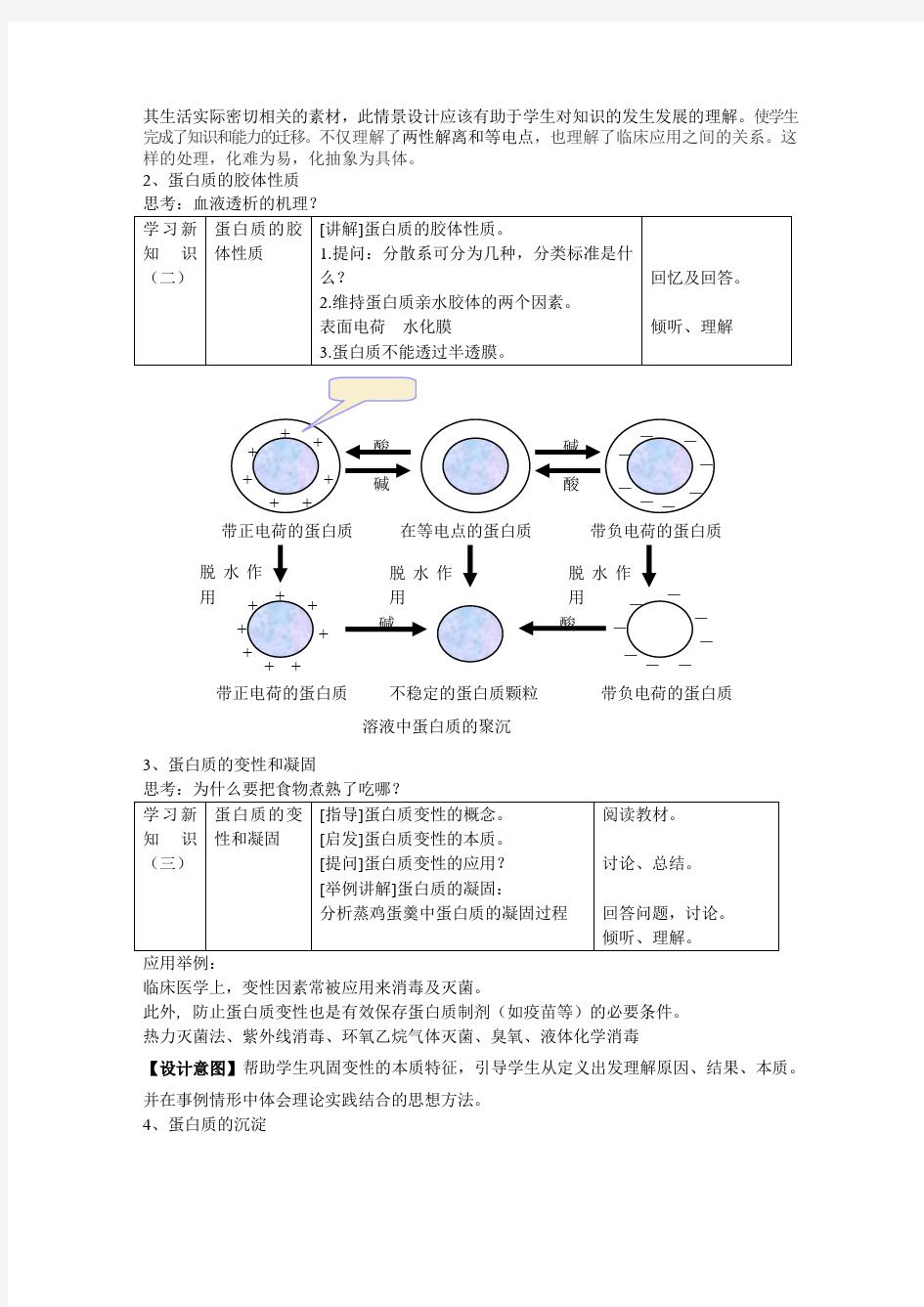
1. 绘图解释蛋白质pH pH=pI,pH>pI时蛋白质的带电 情况。 2.总结带电情况如何判断 3.[示例]血清蛋白醋膜电泳时 蛋白质的带电情况。 观察、分析、讨论 分析、判断、发言 【设计意图】:学生已经具有丰富的生活经验和一定的科学知识,因此选择感兴趣的、与 其生活实际密切相关的素材,此情景设计应该有助于学生对知识的发生发展的理解。使学生完成了知识和能力的迁移。不仅理解了两性解离和等电点,也理解了临床应用之间的关系。这样的处理,化难为易,化抽象为具体。 2、蛋白质的胶体性质 思考:血液透析的机理? 学习新知识(二) 蛋白质的胶体性质 [讲解]蛋白质的胶体性质。 1.提问:分散系可分为几种,分类标准是什么? 2.维持蛋白质亲水胶体的两个因素。 表面电荷 水化膜 3.蛋白质不能透过半透膜。 回忆及回答。 倾听、理解 3、蛋白质的变性和凝固 思考:为什么要把食物煮熟了吃哪? 学习新知识(三) 蛋白质的变性和凝固 [指导]蛋白质变性的概念。 [启发]蛋白质变性的本质。 [提问]蛋白质变性的应用? [举例讲解]蛋白质的凝固: 分析蒸鸡蛋羹中蛋白质的凝固过程 阅读教材。 讨论、总结。 回答问题,讨论。 倾听、理解。 应用举例: 临床医学上,变性因素常被应用来消毒及灭菌。 此外, 防止蛋白质变性也是有效保存蛋白质制剂(如疫苗等)的必要条件。 热力灭菌法、紫外线消毒、环氧乙烷气体灭菌、臭氧、液体化学消毒 【设计意图】帮助学生巩固变性的本质特征,引导学生从定义出发理解原因、结果、本质。并在事例情形中体会理论实践结合的思想方法。 4、蛋白质的沉淀 + + + + + + + 带正电荷的蛋白质 - - - - - - - - 带负电荷的蛋白质 在等电点的蛋白质 水化+ + + + + + + + 带正电荷的蛋白质 - - - - - - - - 带负电荷的蛋白质 不稳定的蛋白质颗粒 酸 碱 酸 碱 酸 碱 脱水作用 脱水作用 脱水作用 溶液中蛋白质的聚沉 学习新知识(四)蛋白质的沉淀[讲解]蛋白质的沉淀。 1.沉淀方法。 2.沉淀机理。 3.沉淀与变性。 理解,记忆 六、教学内容重点难点提示及板书设计 第三节蛋白质的理化性质 一、蛋白质的理化性质 (一)蛋白质的两性解离与等电点: 由于蛋白质分子中氨基酸残基的侧链上存在游离的氨基和游离的羧基,因此蛋白质与氨基酸一样具有两性解离的性质,因而也具有特定的等电点(pI)。 ☆同样,当溶液pH=pI时,蛋白质所带正、负电荷相等;当溶液pH>pI时,蛋白质带净负电荷;当溶液pH<pI时,蛋白质带净正电荷。 (二)蛋白质的胶体性质: 蛋白质分子的颗粒直径已达1~100nm,处于胶体颗粒的范围。因此,蛋白质具有亲水溶胶的性质。 ☆蛋白质分子表面的水化膜和表面电荷是稳定蛋白质亲水溶胶的两个重要因素。 (三)蛋白质的变性、沉淀和凝固: ☆在某些物理或化学因素的作用下,蛋白质严格的空间结构被破坏(不包括肽键的断裂),从而引起蛋白质若干理化性质和生物学性质的改变,称为蛋白质的变性(denaturation)。 蛋白质分子相互聚集而从溶液中析出的现象称为沉淀(precipitation)。 变性后的蛋白质由于疏水基团的暴露而易于沉淀,但沉淀的蛋白质不一定都是变性后的蛋白质。 加热使蛋白质变性并凝聚成块状称为凝固(coagulation)。 因此,凝固的蛋白质一定发生变性。 (一)盐析与有机溶剂沉淀: ☆——重点 ★——难点 图片展示重点强调、 ☆1. 盐析:在蛋白质溶液中加入大量中性盐,以破坏蛋白质的胶体性质,使蛋白质从溶液中沉淀析出,称为盐析(salt precipitation)。 常用的中性盐有:硫酸铵、氯化钠、硫酸钠等。 盐析时,溶液的pH在蛋白质的等电点处效果最好。 盐析沉淀蛋白质时,通常不会引起蛋白质的变性。 有机溶剂沉淀蛋白质:凡能与水以任意比例混合的有机溶剂,如乙醇、甲醇、丙酮等,均可用于沉淀蛋白质。 沉淀原理是:①脱水作用;②使水的介电常数降低,蛋白质溶解度降低。 重金属盐与生物碱试剂沉淀: 布置作业 1.名词:蛋白质的变性等电点 2.某蛋白质的等电点pI=5.0,电泳缓冲溶液pH=7.4,问蛋白质带何种电荷?电泳时向那个电极移动? 2.维持蛋白质溶液稳定的两个因素是什么? 3.沉淀蛋白质的方法和条件? 4.蛋白质变性的实质及应用? 七、教学反思 虽然强调了学生的探究能力的培养,但不意味着每个知识点都需要人为创设情景加以探究,现实的教学由于受教学时数限制,总是希望课堂教学效率高些,否一定要创设情景让学生探究? 知识十六主要蛋白质的理化性质、功能、临床意义 教学目的: 1、熟悉血浆蛋白质的理化性质、功能与临床意义; 2、掌握个别血浆蛋白质特别是血浆中的白蛋白、前白蛋白的临床意义; 3、了解疾病时血浆蛋白质的变化等。 重点:个别血浆蛋白质特别是血浆中的白蛋白、前白蛋白的临床意义。 难点:血浆蛋白质测定的临床意义;疾病时血浆蛋白质的变化。 教学方法和手段:课堂讲授为主,多媒体教学为辅,课堂提问突出重点。 授课时数:1学时 教学内容及组织: 一、血浆蛋白质的组成及功能 血浆蛋白质是血浆固体成份中含量最多、组成复杂、功能广泛的一类化合物。占血浆固体成份90%左右,目前已经研究的血浆蛋白质有300多种,分离出的纯品约100来种,除免疫球蛋白外,主要由肝细胞合成,主要功能。 1. 维持血浆胶体渗透压;清蛋白。 2. 作为某些物质的载体,起运输作用;如清蛋白能与多种物质结合(FA、胆红素),某些球蛋白具特异地运输某些物质的功能,运铁蛋白、运皮质醇蛋白。 3. 维持体液pH恒定;血浆蛋白pI一般都小于7.4是弱酸,一部分以弱酸盐形式存在,构成缓冲对。 4. 免疫功能;血浆中许多具有免疫功能的球蛋白,主要由浆细胞合成,电泳时位于γ区带,如IgG、IgA、IgM、IgD、IgE,此外,还有具有免疫作用的非特异球蛋白,如补体。 5. 凝血与纤溶作用;凝血与纤溶是一对矛盾的统一、凝血因子与纤溶因子绝大部分是血浆蛋白质,它们促进血液凝固,防止血液流失和溶解血栓,防止重要脏器的动脉栓塞。 6. 营养作用;血浆蛋白质可分解成AA,用于合成组织蛋白或氧化供能。 7. 催化作用;血浆中有许多酶类,其中部分在血浆中发挥作用,称血浆功能性酶,如凝血酶原、纤溶酶原、铜蓝蛋白、LPL、LCAT、肾素等。 二、个别血浆蛋白质 (一)前白蛋白(prealbumin,PA)分子量5.4万,由肝细胞合成,电泳时移动速度较白蛋白快,位于其前方面得名,半寿期短12h,PA是一类运载蛋白,一种能与甲状腺素结合,称为甲状腺结合蛋白,一种能与VitA结合,称为VitA 结合蛋白,常用测定方法是免疫学方法,正常参与范围0.2~0.4g /L,急性炎症, 蛋白质凭借游离的氨基和羧基而具有两性特征,在等电点易生成沉淀。不同的蛋白质等电点不同,该特性常用作蛋白质的分离提纯。生成的沉淀按其有机结构和化学性质,通过pH的细微变化可复溶。蛋白质的两性特征使其成为很好的缓冲剂,并且由于其分子量大和离解度低,在维持蛋白质溶液形成的渗透压中也起着重要作用。这种缓冲和渗透作用对于维持内环境的稳定和平衡具有非常重要的意义。 在紫外线照射、加热煮沸以及用强酸、强碱、重金属盐或有机溶剂处理蛋白质时,可使其若干理化和生物学性质发生改变,这种现象称为蛋白质的变性。酶的灭活,食物蛋白经烹调加工有助于消化等,就是利用了这一特性。 (二)蛋白质的分类 简单的化学方法难于区分数量庞杂、特性各异的这类大分子化合物。通常按照其结构、形态和物理特性进行分类。不同分类间往往也有交错重迭的情况。一般可分为纤维蛋白、球状蛋白和结合蛋白三大类。 1.纤维蛋白包括胶原蛋白、弹性蛋白和角蛋白。 (1) 胶原蛋白胶原蛋白是软骨和结缔组织的主要蛋白质,一般占哺乳动物体蛋白总量的30%左右。胶原蛋白不溶于水,对动物消化酶有抗性,但在水或稀酸、稀碱中煮沸,易变成可溶的、易消化的白明胶。胶原蛋白含有大量的羟脯氨酸和少量羟赖氨酸,缺乏半胱氨酸、胱氨酸和色氨酸。 (2) 弹性蛋白弹性蛋白是弹性组织,如腱和动脉的蛋白质。弹性蛋白不能转变成白明胶。 (3) 角蛋白角蛋白是羽毛、毛发、爪、喙、蹄、角以及脑灰质、脊髓和视网膜神经的蛋白质。它们不易溶解和消化,含较多的胱氨酸(14-15%)。粉碎的羽毛和猪毛,在15-20磅蒸气压力下加热处理一小时,其消化率可提高到70-80%,胱氨酸含量则减少5-6%。 2.球状蛋白 (1) 清蛋白主要有卵清蛋白、血清清蛋白、豆清蛋白、乳清蛋白等,溶于水,加热凝固。 (2) 球蛋白球蛋白可用5-10%的NaCl溶液从动、植物组织中提取;其不溶或微溶于水,可溶于中性盐的稀溶液中,加热凝固。血清球蛋白、血浆纤维蛋白原、肌浆蛋白、豌豆的豆球蛋白等都属于此类蛋白。 (3) 谷蛋白麦谷蛋白、玉米谷蛋白、大米的米精蛋白属此类蛋白。不溶于水或中性溶液,而溶于稀酸或稀碱。 (4) 醇溶蛋白玉米醇溶蛋白、小麦和黑麦的麦醇溶蛋白、大麦的大麦醇溶蛋白属此类蛋白。不溶于水、无水乙醇或中性溶液,而溶于70-80%的乙醇。 (5) 组蛋白属碱性蛋白,溶于水。组蛋白含碱性氨基酸特别多。大多数组蛋白在活细胞中与核酸结合,如血红蛋白的珠蛋白和鲭鱼精子中的鲭组蛋白。 (6) 鱼精蛋白鱼精蛋白是低分子蛋白,含碱性氨基酸多,溶于水。例如鲑鱼精子中的鲑精蛋白、鲟鱼的鲟精蛋白、鲱鱼的鲱精蛋白等。鱼精蛋白在鱼的精子细胞中与核酸结合。 球蛋白比纤维蛋白易于消化,从营养学的角度看,氨基酸含量和比例也较纤维蛋白更理想。 3. 结合蛋白 结合蛋白是蛋白部分再结合一个非氨基酸的基团(辅基)。如核蛋白(脱氧核糖核蛋白、核糖体),磷蛋白(酪蛋白、胃蛋白酶),金属蛋白(细胞色素氧化酶、铜蓝蛋白、黄嘌呤氧化酶),脂蛋白(卵黄球蛋白、血中β1-脂蛋白),色蛋白(血红蛋白、细胞色素C、黄素蛋白、视网膜中与视紫质结合的水溶性蛋白)及糖蛋白(γ球蛋白、半乳糖蛋白、甘露糖蛋白、氨基糖蛋白)。 蛋白质的理化性质 第四节蛋白质的理化性质 一、两性离解和等电点 蛋白质是由氨基酸组成的,在其分子表面带有很多可解离基团,如羧基、氨基、酚羟基、咪唑基、胍基等。此外,在肽链两端还有游离的α-氨基和α-羧基,因此蛋白质是两性电解质,可以与酸或碱相互作用。溶液中蛋白质的带电状况与其所处环境的pH 有关。当溶液在某一特定的pH 条件下,蛋白质分子所带的正电荷数与负电荷数相等,即净电荷数为零,此时蛋白质分子在电场中不移动,这时溶液的pH 称为该蛋白质的等电点,此时蛋白质的溶解度最小。由于不同蛋白质的氨基酸组成不同,所以蛋白质都有其特定的等电点,在同一pH 条件下所带净电荷数不同。如果蛋白质中碱性氨基酸较多,则等电点偏碱,如果酸性氨基酸较多,等电点偏酸。酸碱氨基酸比例相近的蛋白质其等电点大多为中性偏酸,约在5.0 左右。 1、两性解离 蛋白质可以在酸性环境中与酸中和成盐,而游离成正离子,即蛋白质分子带正电,在电场中向阴极移动;在碱性环境中与碱中和成盐而游离成负离子,即蛋白质分子带负电,在电场中向阳极移动。以“P”代表 收集于网络,如有侵权请联系管理员删除 收集于网络,如有侵权请联系管理员删除 蛋白质分子,以―NH 2 和―COOH 分别代表其碱性和酸性解离基团,随 pH 变化,蛋白质的解离反应可简示如下: (pH>pI ) (pH=pI ) (pH 蛋白质的理化性质(一) 关键词:蛋白质蛋白质是由氨基酸组成的大分子化合物,其理化性质一部分与氨基酸相似,如两性电离、等电点、呈色反应、成盐反应等,也有一部分又不同于氨基酸,如高分子量、胶体性、变性等。 一、蛋白质的胶体性质 蛋白质分子量颇大,介于一万到百万之间,故其分子的大小已达到胶粒1~100nm范围之内。球状蛋白质的表面多亲水基团,具有强烈地吸引水分子作用,使蛋白质分子表面常为多层水分子所包围,称水化膜,从而阻止蛋白质颗粒的相互聚集。 与低分子物质比较,蛋白质分子扩散速度慢,不易透过半透膜,粘度大,在分离提纯蛋白质过程中,我们可利用蛋白质的这一性质,将混有小分子杂质的蛋白质溶液放于半透膜制成的囊内,置于流动水或适宜的缓冲液中,小分子杂质皆易从囊中透出,保留了比较纯化的囊内蛋白质,这种方法称为透析(dialysis)。 蛋白质大分子溶液在一定溶剂中超速离心时可发生沉降。沉降速度与向心加速度之比值即为蛋白质的沉降系数S。校正溶剂为水,温度20℃时的沉降系数S20·w可按下式计算:式中X 为沉降界面至转轴中心的距离,W为转子角速度,W2X为向心加速度,dX/dt为沉降速度。单位用S,即Svedberg单位,为1×1013秒,分子愈大,沉降系数愈高,故可根据沉降系数来分离和检定蛋白质。 二、蛋白质的两性电离和等电点 蛋白质是由氨基酸组成的,其分子中除两端的游离氨基和羧基外,侧链中尚有一些解离基,如谷氨酸、天门冬氨酸残基中的γ和β-羧基,赖氨酸残基中的ε-氨基,精氨酸残基的胍基和组氨酸的咪唑基。作为带电颗粒它可以在电场中移动,移动方向取决于蛋白质分子所带的电荷。蛋白质颗粒在溶液中所带的电荷,既取决于其分子组成中碱性和酸性氨基酸的含量,又受所处溶液的pH影响。当蛋白质溶液处于某一pH时,蛋白质游离成正、负离子的趋势相等,即成为兼性离子(zwitterion,净电荷为O),此时溶液的pH值称为蛋白质的等电点(isoelectricpoint,简写pI)。处于等电点的蛋白质颗粒,在电场中并不移动。蛋白质溶液的pH 大于等电点,该蛋白质颗粒带负电荷,反之则带正电荷。各种蛋白质分子由于所含的碱性氨基酸和酸性氨基酸的数目不同,因而有各自的等电点。 凡碱性氨基酸含量较多的蛋白质,等电点就偏碱性,如组蛋白、精蛋白等。反之,凡酸性氨基酸含量较多的蛋白质,等电点就偏酸性,人体体液中许多蛋白质的等电点在pH5.0左右,所以在体液中以负离子形式存在。 三、蛋白质的变性 天然蛋白质的严密结构在某些物理或化学因素作用下,其特定的空间结构被破坏,从而导致理化性质改变和生物学活性的丧失,如酶失去催化活力,激素丧失活性称之为蛋白质的变性作用(denaturation)。变性蛋白质只有空间构象的破坏,一般认为蛋白质变性本质是次级键,二硫键的破坏,并不涉及一级结构的变化。 变性蛋白质和天然蛋白质最明显的区别是溶解度降低,同时蛋白质的粘度增加,结晶性破坏,生物学活性丧失,易被蛋白酶分解。 引起蛋白质变性的原因可分为物理和化学因素两类。物理因素可以是加热、加压、脱水、搅拌、振荡、紫外线照射、超声波的作用等;化学因素有强酸、强碱、尿素、重金属盐、十二烷基磺酸钠(SDS)等。在临床医学上,变性因素常被应用于消毒及灭菌。反之,注意防止蛋白质变性就能有效地保存蛋白质制剂。 变性并非是不可逆的变化,当变性程度较轻时,如去除变性因素,有的蛋白质仍能恢复或部分恢复其原来的构象及功能,变性的可逆变化称为复性。例如,前述的核糖核酸酶中四对二硫键及其氢键。在巯基乙醇和8M尿素作用下,发生变性,失去生物学活性,变性后如 第三节蛋白质的理化性质 一、蛋白质的两性解离和等电点 蛋白质分子除两端的氨基和羧基可解离外,氨基酸残基侧链中某些基团,如谷氨酸、天冬氨酸残基中的γ-羧基和β-羧基,赖氨酸残基中的ε-氨基、精氨酸残基中的胍基和组氨酸残基中的咪唑基,在一定pH的溶液中可解离成带负电荷或正电荷的基团。由于蛋白质分子中既含有能解离出H+的酸性基团,又含有能结合H+的碱性基团,故蛋白质具有两性解离性质。 当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子净电荷为零,此时溶液的pH称为蛋白质的等电点(pI)。当蛋白质溶液的pH>pI时,蛋白质解离为阴离子,带负电荷;当蛋白质溶液的pH<pI时,蛋白质解离为阳离子,带正电荷。 体内各种蛋白质的等电点不同,但大多数接近于5.0,所以在人体体液pH在7.4的环境下,大多数蛋白质解离成阴离子。少数蛋白质含碱性氨基酸较多,其等电点偏于碱性,被称为碱性 蛋白质,如鱼精蛋白、组蛋白等。也有少量蛋白质含酸性氨基酸较多,其等电点偏于酸性,被称为酸性蛋白质,如胃蛋白酶和丝蛋白等。 由于组成蛋白质的氨基酸种类和数量不同,其蛋白质的等电点也各不相同。在同一pH条件下,不同蛋白质所带净电荷的性质及电荷量不同。因此,利用蛋白质两性解离性质,可通过电泳、层析等方法将不同蛋白质分离、纯化。 二、蛋白质的高分子性质 蛋白质属于生物大分子,分子量在104-106D,其分子的直径可达1-100nm,在胶粒范围之内。在蛋白质颗粒中,疏水基团大多位于分子内部,而亲水基团多分布于分子表面,在溶液中与水发生水合作用,颗粒表面形成一层水化膜,相互不会聚集。此外,在非等电点的溶液中,同种性质的蛋白质颗粒表面都带有同种的电荷,相互排斥,使蛋白质颗粒相互隔开,不易聚集沉淀。因此,蛋白质分子表面的水化膜和同种电荷是蛋白质胶体溶液稳定的两个重要因素。 蛋白质是高分子化合物,蛋白质溶液具有胶体溶液的性质,不能透过半透膜,是某些蛋白质分离纯化方法的基础。最简单的纯化蛋白质的方法是将含有小分子杂质的蛋白质溶液放在半透膜内,置于蒸馏水或适宜的缓冲液中,杂质即可透过半透膜渗出而与蛋白质分离,这种方法称为透析。 三、蛋白质的变性 第四节蛋白质的理化性质 Ⅰ复习题问: ⒈什么是分子病?试举例。 ⒉何为变构效应? ⒊什么是蛋白质的构象病?试举例。 Ⅱ新授 一、蛋白质的紫外吸收 述:蛋白质的紫外吸收特征: 蛋白质溶液能吸收一定波长的紫外线,主要是由带芳香环的氨基酸决定的。由于这些分子中含有共轭双键使蛋白质在紫外光280nm波长处有特征性吸收波,其对紫外光吸收能力的强弱顺序为:色(Trp)>酪(Tyr)>苯丙(Phe)。 二、蛋白质的等电点与电泳 ㈠两性电离与等电点 述:蛋白质分子除两端的氨基和羧基可解离外,氨基酸残基侧链中某些基团,在一定的溶液pH条件下都可解离成带负电荷或 正电荷的基团。 蛋白质的等电点(pI):(课本P11) 当蛋白质溶液处于某一pH时,蛋白质解离成阴、阳离子的趋势相等,净电荷为零,蛋白质为兼性离子,此时溶液的 pH称为该蛋白质的等电点。 (P课本11图1-13)蛋白质阴、阳离子、兼性离子转换图 述:体内各蛋白质的等电点不同,但大多接近于pH5.0,所以人体液pH为7.4的环境,大多蛋白质解离成阴离子。 过渡:蛋白质两性电离的性质非常重要,可以依此进行蛋白质的分离纯化。 ㈡电泳 ⒈概念 电泳:指带电颗粒在电场中向电性相反的电极移动的现象。述:蛋白质在高于或低于等电点的pH溶液中为带电颗粒,能发生电泳。在同一pH溶液中,由于各蛋白质所带电荷性 质和数量不一,分子大小和形状不同,因此它们在同一电 场中移动的速度也有差异。根据这一原理可以用电泳法进 行蛋白质的分离与鉴定。 ⒉几种重要的蛋白质电泳 ⑴种类:纤维膜电泳,粉末电泳,凝胶电泳等 ⑵举例:双向凝胶电泳 述:双向凝胶电泳是蛋白质组学研究的重要技术,它利用各蛋白质等电点和相对分子质量的差异,将复杂的蛋白质 混合物分离,后利用质谱等技术对蛋白质逐一鉴定。 蛋白质组学:研究一个生物体系(生物群体、生物个体、 器官、组织或细胞)蛋白质的结构、功能和 蛋白质群体的相互作用。 三、蛋白质的胶体性质 述:蛋白质是生物大分子,其溶液有许多高分子溶液的性质,如:扩散慢、易沉降、粘度大、不能透过半透膜等。另 外,蛋白质的分子直径为1~100nm,在胶粒范围之内, 所以又是亲水胶体溶液。 第三节蛋白质理化性质 一、教学内容分析: 本节课是这一章里最重要的一节课,在本模块中,学生将通过实例学习蛋白质的理化性质,体会在解决实际的问题中如何更好应用这些理论知识。 二、学生学习情况分析: 我们的课堂教学常用“高起点、大容量、快推进”的做法,忽略了知识的发生发展过程,无形增加了学生的负担,泯灭了很多学生学习的兴趣。 三、设计思想 本节课让学生充分感受到知识应用于生活,激发同学们学习的乐趣。努力改变课程实施过程死记硬背,机械训练的现状,倡导学生主动参与,乐于探究,培养学生学生收集和处理信息的能力,获得新知识的能力。 四、重点难点突破 以生活为源泉,善于创设情景 五、教学过程设计 (三)蛋白质的理化性质探求过程 1、蛋白质的两性解离和等电点 思考:电泳法分离蛋白质机理? 动画演示:氨基酸两性解离及等电点 教学 程序 教学内容教师活动学生活动 导入新课电泳法分离蛋白质机理[讲解]醋膜电泳法将血浆蛋白 质分成5条带 蛋白质为什么带电荷? 倾听 思考 学习新知识(一)蛋白质的两性解离和等 电点 [讲解] 1.两性基团(羧基和氨基)。 2.两性解离 酸性解离:-COOH -COO- + H+ 碱性解离:-NH2+ H+ -NH3+ 3.等电点 [讨论]兼性离子是否“不带电” 聆听、理解、记忆 讨论发言 巩固和提高蛋白质的两性解离和等 电点 [探讨]如何判断蛋白质的带电 情况。 1. 绘图解释蛋白质pH知识十六 主要蛋白质的理化性质、功能、临床意义.
蛋白质的性质和分类
蛋白质的理化性质教学内容
蛋白质的理化性质(一)
蛋白质理化性质
.蛋白质的理化性质及分类
蛋白质的理化性质
