标准电极电势表
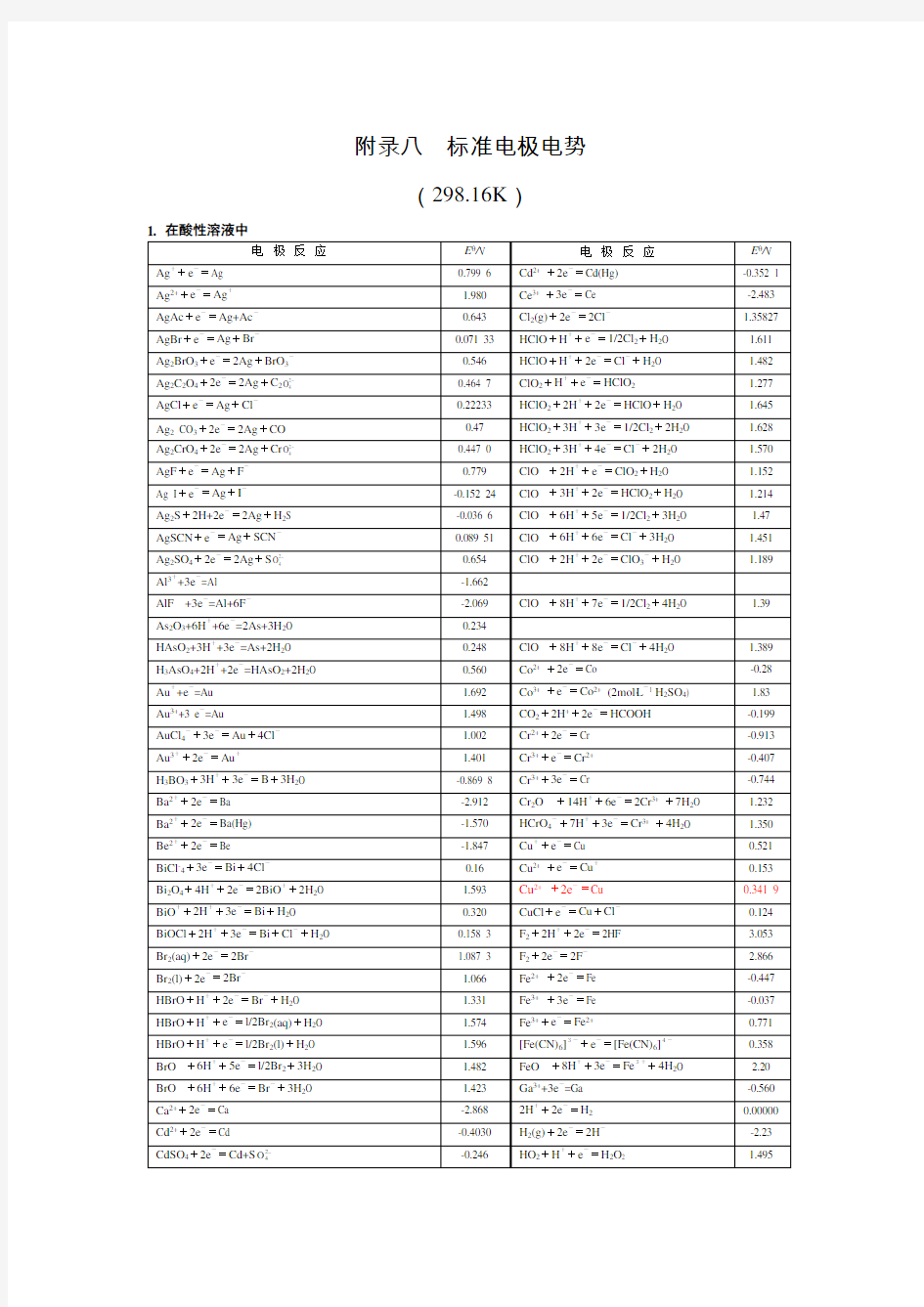
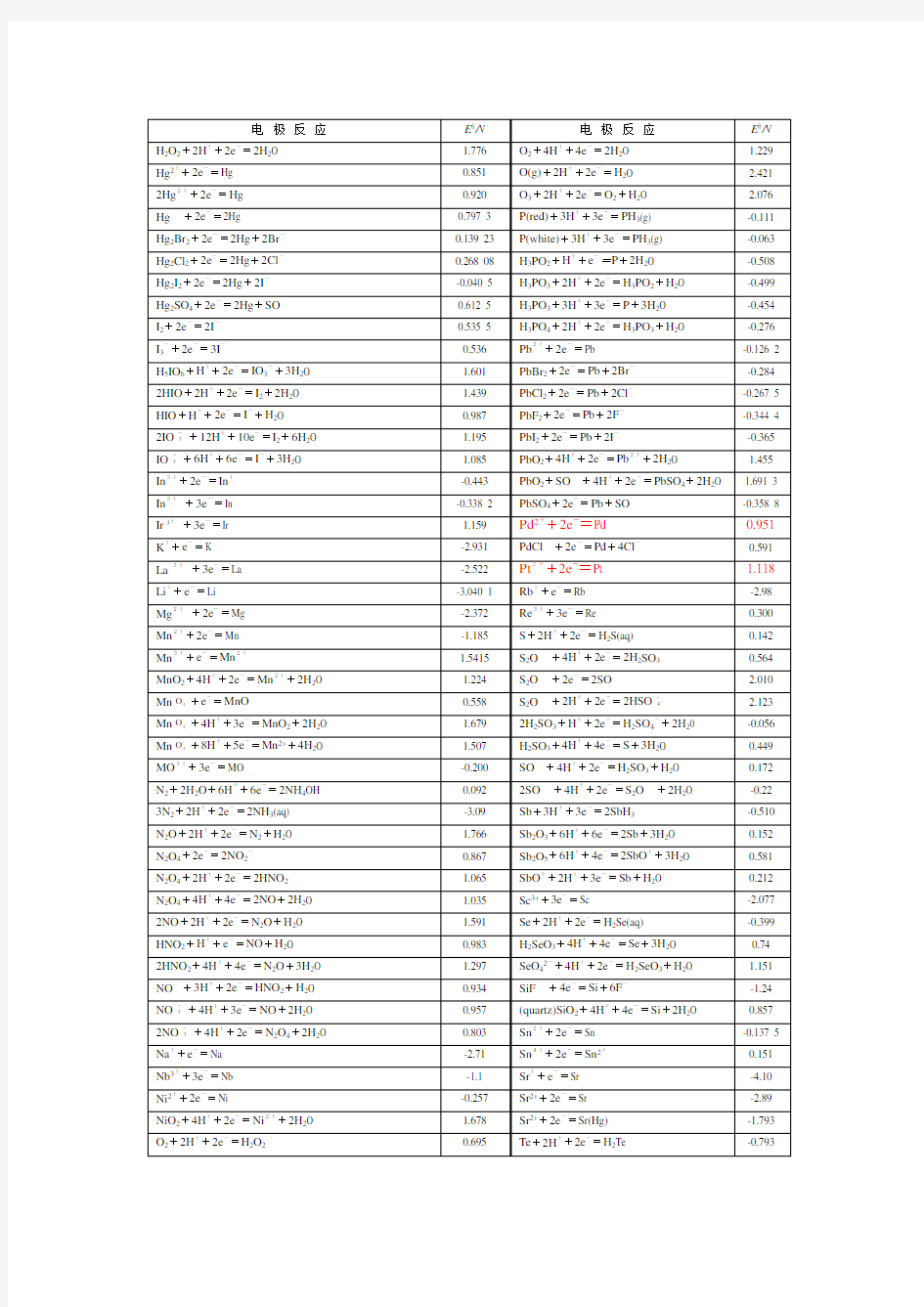
附录八标准电极电势
(298.16K)
1. 在酸性溶液中
1. 在碱性溶液中
摘自R.C.Weast.Handbook of Chemistry and Physics,D-151.70th ed.1989-1990 。饱和甘汞电极(SCE)相对标准氢电极电势:+0.2415V
电位差计的原理和使用
实验八 电位差计的原理和使用 【实验目的】 1.掌握电位差计的工作原理和正确使用方法,加深对补偿法测量原理的理解和运用。 2.训练简单测量电路的设计和测量条件的选择。 【实验仪器】 UJ31型直流电位差计、SS1791双路输出直流稳压电源、标准电池、标准电阻、AC15/5灵敏电流计、FJ31型直流分压箱、滑线变阻器、直流电阻箱、待校验电表、待测干电池、待测电阻、开关和导线等。 【实验原理】 如图5.8.1所示,电位差计的工作原理是根据电 压补偿法,先使标准电池E n 与测量电路中的精密电阻R n 的两端电势差U st 相比较,再使被测电势差(或电压)E x 与准确可变的电势差U x 相比较,通过检流计G 两次指零来获得测量结果。电压补偿原理也可从电势差计的“校准”和“测量”两个步骤中理解。 校准:将K 2打向“标准”位置,检流计和校准电路联接,R n 取一预定值,其大小由标准电池E S 的电动势确定;把K 1合上,调节R P ,使检流计G 指零,即E n = IR n ,此时测量电路的工作电流已调好为 I = E n /R n 。校准工作电流的目的:使测量电路中的R x 流过一个已知的标准电流I o ,以保证R x 电阻盘上的电压示值(刻度值)与其(精密电阻R x 上的)实际电压值相一致。 测量:将K 2打向“未知”位置,检流计和被测电路联接,保持I o 不变(即R P 不变),K 1合上,调节R x ,使检流计G 指零,即有E x = U x = I o R x 。 由此可得x n n x R R E E = 。由于箱式电位差计面板上的测量盘是根据R x 电阻值标出其对应的电压刻度值,因此只要读出R x 电阻盘刻度的电压读数,即为被测电动势E x 的测量值。 所以,电位差计使用时,一定要先“校准”,后“测量”,两者不能倒置。 【实验装置】 1. UJ31型电位差计 UJ31型箱式电位差计是一种测量低电势的电位差计,其测量范围为 mV .V 1171-μ(1K 置1?档)或mV V 17110-μ(1K 置10?档)。使用 图5.8.1 电位差计的工作原理 图5.8.2 UJ31型电位差计面板图 + - -++- + -标准 检流计 5.7-6.4V 未知1 未知2 K 1 R P2 R P3 R P1 R n K 2 I II III 1.01×10 ×1 未知1 未知2 标准断断粗 中 细 ×1 ×0.1 ×0.001 粗细短路
标准电极电势表
标准电极电势表 标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L ,气体分压为100kPa ,温度为298K ,所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。 注:(s ) – 固体;(l ) – 液体;(g ) – 气体;(aq ) – 水溶液;(Hg ) – 汞齐。 半反应 E° (V)[注 1] 来源 Ba + + e ? Ba(s ) ?4.38 [10][1][3] Sr + + e ? Sr(s ) ?4.10 [11][1][3] Ca + + e ? Ca(s ) ?3.8 [11][1][3] Pr 3+ + e ? Pr 2+ ?3.1 [11] ?N 2(g ) + H + + e ? HN 3(aq ) ?3.09 [6] Li + + e ? Li(s ) ?3.0401 [5] N 2(g ) + 4?H 2O + 2?e ? 2?NH 2OH (aq ) + 2?OH ? ?3.04 [6] Cs + + e ? Cs(s ) ?3.026 [5] Ca(OH) 2(s ) + 2?e ? Ca(s ) + 2 OH ? ?3.02 [11] Rb + + e ? Rb(s ) ?2.98 [4] K + + e ? K(s ) ?2.931 [5]
半反应E° (V)[注 1]来源Mg+ + e? Mg(s) ?2.93 [10] Ba2+ + 2?e? Ba(s) ?2.912 [5] ? La(s) + 3OH??2.90 [5] La(OH) Fr+ + e? Fr(s) ?2.9 [11] Sr2+ + 2?e? Sr(s) ?2.899 [5] ? Sr(s) + 2?OH??2.88 [11] Sr(OH) Ca2+ + 2?e? Ca(s) ?2.868 [5] Eu2+ + 2?e? Eu(s) ?2.812 [5] Ra2+ + 2?e? Ra(s) ?2.8 [5] Yb2+ + 2?e? Yb(s) ?2.76 [11][1] Na+ + e? Na(s) ?2.71 [5][9] Sm2+ + 2?e? Sm(s) ?2.68 [11][1] No2+ + 2?e? No(s) ?2.50 [11] ?Hf(s) + 4?OH??2.50 [11] HfO(OH)
电动势的测定及其应用(实验报告)
实验报告 电动势的测定及其应用 一.实验目的 1.掌握对消法测定电动势的原理及电位差计,检流计及标准电池使用注意事项及简单原理。 2.学会制备银电极,银~氯化银电极,盐桥的方法。 3.了解可逆电池电动势的应用。 二.实验原理 原电池由正、负两极和电解质组成。电池在放电过程中,正极上发生还原反应,负极则发生氧化反应,电池反应是电池中所有反应的总和。 电池除可用作电源外,还可用它来研究构成此电池的化学反应的热力学性质,从化学热力学得知,在恒温、恒压、可逆条件下,电池反应有以下关系: △r G m =-nFE 式中△r G m 是电池反应的吉布斯自由能增量;n 为电极反应中电子得失数;F 为法拉第常数;E 为电池的电动势。从式中可知,测得电池的电动势E 后,便可求得△r G m ,进而又可求得其他热力学参数。但须注意,首先要求被测电池反应本身是可逆的,即要求电池的电极反应是可逆的,并且不存在不可逆的液接界。同时要求电池必须在可逆情况下工作,即放电和充电过程都必须在准平衡状态下进行,此时只允许有无限小的电流通过电池。因此,在用电化学方法研究化学反应的热力学性质时,所设计的电池应尽量避免出现液接界,在精确度要求不高的测量中,常用“盐桥”来减小液接界电势。 为了使电池反应在接近热力学可逆条件下进行,一般均采用电位差计测量电池的电动势。原电池电动势主要是两个电极的电极电势的代数和,如能分别测定出两个电极的电势,就可计算得到由它们组成的电池电动势。 附【实验装置】(阅读了解) UJ25型电位差计 UJ25型箱式电位差计是一种测量低电势的电位差计,其测量范围为 mV .V 1171-μ(1K 置1?档)或 mV V 17110-μ(1K 置10?档) 。使用V V 4.6~7.5外接工作电源,标准电池和 灵敏电流计均外接,其面板图如图5.8.2 所示。调节工作电流(即校准)时分别调节1p R (粗调)、2p R (中调)和3p R (细 调)三个电阻转盘,以保证迅速准确地调 节工作电流。n R 是为了适应温度不同时标准电池电动势的变化而设置的,当温 图5.8.2 UJ31型电位差计面板图 + - -++- + -标准 检流计 5.7-6.4V 未知1 未知2 K 1 R P2 R P3 R P1 R n K 2 I II III 1.01×10 ×1 未知1 未知2 标准断断粗 中 细 ×1 ×0.1 ×0.001 粗细短路
标准电极电势表(全)
在酸性溶液中(298K) 电对方程式E/V Li(I)-(0)Li++e-=Li-Cs(I)-(0)Cs++e-=Cs-Rb(I)-(0)Rb++e-=Rb- K(I)-(0)K++e-=K-Ba(II)-(0)Ba2++2e-=Ba-Sr(II)-(0)Sr2++2e-=Sr-Ca(II)-(0)Ca2++2e-=Ca-Na(I)-(0)Na++e-=Na-La(III)-(0)La3++3e-=La-Mg(II)-(0)Mg2++2e-=Mg-Ce(III)-(0)Ce3++3e-=Ce- H(0)-(-I)H2(g)+2e-=2H--Al(III)-(0)AlF63-+3e-=Al+6F--Th(IV)-(0)Th4++4e-=Th-Be(II)-(0)Be2++2e-=Be- U(III)-(0)U3++3e-=U-Hf(IV)-(0)HfO2++2H++4e-=Hf+H2O-Al(III)-(0)Al3++3e-=Al-Ti(II)-(0)Ti2++2e-=Ti-Zr(IV)-(0)ZrO2+4H++4e-=Zr+2H2O-Si(IV)-(0)[SiF6]2-+4e-=Si+6F--Mn(II)-(0)Mn2++2e-=Mn-Cr(II)-(0)Cr2++2e-=Cr-Ti(III)-(II)Ti3++e-=Ti2+- B(III)-(0)H3BO3+3H++3e-=B+3H2O-*Ti(IV)-(0)TiO2+4H++4e-=Ti+2H2O-Te(0)-(-II)Te+2H++2e-=H2Te-Zn(II)-(0)Zn2++2e-=Zn-Ta(V)-(0)Ta2O5+10H++10e-=2Ta+5H2O-Cr(III)-(0)Cr3++3e-=Cr-Nb(V)-(0)Nb2O5+l0H++10e-=2Nb+5H2O-As(0)-(-III)As+3H++3e-=AsH3- U(IV)-(III)U4++e-=U3+-Ga(III)-(0)Ga3++3e-=Ga-
标准氢电极
标准氢电极 品名:氢标准电极 拼音:qingbiaozhundianji 英文名称:standard hydrogen electrode 说明:由于单个电极的电势无法确定,故规定任何温度下标准状态的氢电极的电势为零,任何电极的电势就是该电极与标准氢电极所组成的电池的电势,这样就得到了“氢标”的电极势。标准状态是指氢电极的电解液中的氢离子活度为1,氢气的压强为0.1兆帕(约1大气压)的状态,温度为298.15K。 这只是一种假定的理想状态,通常是将镀有一层海绵状铂黑的铂片,浸入到H+浓度为1.0mol/L的酸溶液中,在298.15K时不断通入压力为100kPa的纯氢气,使铂黑吸附H2气至饱和,这是铂片就好像是用氢制成的电极一样。 实际测量时需用电势已知的参比电极替代标准氢电极,如甘汞电极、氯化银电极等。它们的电极势是通过与氢电极组成无液体接界的电池,通过精确测量用外推去求得的。 电极电势 一,电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double l ayer theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 2.标准电极电势 为了获得各种电极的电极电势数值,通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势, 而确定各种不同电极的相对电极电 势E值。1953年国际纯粹化学与应用化学联合会(IUPAC)的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零。 (1)标准氢电极电极符号: Pt|H2(101.3kPa)|H+(1mol.L-1) 电极反应: 2H+ + 2e = H2(g)
标准电极电势表
标准电极电势表 目录[隐藏] 电极电势的产生—双电层理论 定义 公式 电极电势内容 标准电极电势表 [编辑本段] 电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double lay er theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 [编辑本段] 定义 标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势. 标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向. [编辑本段] 公式
电极电势的应用
?无机及分析化学?课程单元教学设计 ──?电极电势的应用? 一、教案头: 本次课题:电极电势的应用 二、教学设计 第一部分:组织教学和复习上次课主要内容(时间:5分钟) ①考勤 ②标准电极电势的测定及利用Nernst方程计算电极电势 第二部分:学习新内容(时间:38分钟) 步骤一告知,宣布本次课的教学内容、目标(时间:3分钟)
课件演示本次课的标题:电极电势的应用 教师讲述引入:我们在上次课中学习了电极电势的知识,电极电势除了可以计算原电池电动势以外,还有其它的一些应用,这节课我们就要一起学习电极电势的这些应用。 教学内容: 一、氧化剂、还原剂的相对强弱 二、氧化还原反应进行的方向 三、氧化还原反应进行的程度 四、元素电势图及其应用 教学目的:通过学习能能根据标准电极电势大小判断氧化剂、还原剂的相对性强弱:判断反应进行的方向,能利用元素电势图判断能否发生歧化反应或逆歧化反应、掌握E?与K?的互算。 步骤二讲授新课(时间:30分钟) 一、判断氧化剂、还原剂的相对强弱 教师讲述:E?小的电对对应的还原型物质还原性强 E?大的电对对应的氧化型物质氧化性强 深化对上述知识点的理解:讲解例题9-11 巩固练习:P127简答题第四题 二、判断氧化还原反应进行的方向 教师讲述:E?值大的的氧化态(O)氧化E?值小的还原态(R) 深化对上述知识点的理解:讲解例题9-12、例题9-12 巩固练习:P127简答题第四题 三、氧化还原反应进行的程度
教师指出:氧化还原反应的平衡常数K Θ与标准电极电势E Θ 的关系 ) -E (E 0.0592 0.0592¨ ¨lg -+==Z ZE K E ?越大,电势差越大,K ?也越大,所以K ?能判断氧化还原反应程度 深化理解:K Θ与E Θ关系之互算 例题9-14、 例题9-15已知298K 时下列电极反应的E ?值: 试求AgCl 的溶度积常数。 能力训练:有关K Θ与E Θ关系之互算的计算 (1) 0.2222V )aq (Cl Ag(s) e (s) AgCl 0.7991V Ag(s) e )aq (Ag =++=+---+E E g(s)A )L 1.0mol (g A )L 1.0mol (Cl AgCl(s) g(s)A 11-+--??解:设计一个原电池: 1 (s) AgCl )aq (Cl )aq (Ag )aq (Cl Ag(s) e (s) AgCl Ag(s) e )aq (Ag sp K K = ++++-+---+10-sp sp ¨101.80 7449.90.0592V 0.5769V 0.0592V ¨ lg - 0.0592V ¨ lg 0.5769V 0.222V 0.7991V ) Ag /AgCl ()Ag /Ag ( ¨ ?======+=-=+K ZE K ZE K E E E 24224)aq (6H )aq (O C 5H )aq (2MnO ++++-例:求反应
中科院电化学问答答案
2005年电化学和电分析化学 1、标准电极电位和条件电位 各种标准状态下的被测电极与标准氢电极组成原电池,标准氢电极作为阳极(发生那氧化反应)用实验的方法测得的该电池电动势的数值,就是被测电极的标准电极电位。 对于实际体系,在某一特定条件下,该电对的氧化型的总浓度和还原型的总浓度均为1mol/L时的实际电位,就叫条件电位。 2、双电层 当电极插入溶液中后,在电极和溶液之间便有一个界面。如果导体电荷带正电荷,会对溶液中的负离子产生吸引作用,同时对正离子也有一定的排斥作用。结果在电极附近就会聚集很多负离子,叫做吸附层,在吸附层外一微小区域,由于静电引力的存在,也有电荷过剩现象存在,称为扩散层,这种结构就叫做双电层。3、极限电流和扩散电流 在电化学反应中,电解开始后,随着外加电压的继续增大,电流急剧上升,最后当外加电压增加到一定数值时,电流不再增加,达到一个极限值。此时的电流称为极限电流。极限电流与残余电流之差称为扩散电流。 4、半电池的形式电势 5、交流伏安法 在电路里负载两端并联一电压表,电路里串联电流表,通过电压和电流计算出阻抗,包括电容的容抗和电感的感抗。 二简答题 1、何谓循环伏安法?主要用于研究什么?从可逆性角度简述循环伏安曲线有几 类?具体依据及特点? 循环伏安法是以快速线性扫描的形式施加以三角波电压于工作电极上,得到循环伏安曲线的一种方法。 一般用于研究电极过程的可逆性、吸附性以及测定可逆体系标准电极电位,鉴别电极反应产物和研究化学反应控制的各个电极过程。 从可逆性的角度可有三类循环伏安曲线:(1)可逆过程ΔEp= 2.2RT/nF = 56.5/n mv,一般说来,ΔEp与实验条件有关,其数值在55/n ~65/n mv 时,可判断为
电化学原理思考题答案解析
第三章 1.自发形成的双电层和强制形成的双电层在性质和结构上有无不同为什么2.理想极化电极和不极化电极有什么区别它们在电化学中有什么重要用途答:当电极反应速率为0,电流全部用于改变双电层的电极体系的电极称为理想极化电极,可用于界面结构和性质的研究。理想不极化电极是指当电极反应速率和电子反应速率相等时,极化作用和去极化作用平衡,无极化现象,通向界面的电流全部用于电化学反应,可用作参比电极。 3.什么是电毛细现象为什么电毛细曲线是具有极大值的抛物线形状 答:电毛细现象是指界面张力随电极电位变化的现象。溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。 4.标准氢电极的表面剩余电荷是否为零用什么办法能确定其表面带电状况答:不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外,还有吸附双电层\ 偶极子双电层\金属表面电位。可通过零电荷电位判断电极表面带电状况,测定氢标电极的零电荷电位,若小于0则电极带正电,反之带负电。 5.你能根据电毛细曲线的基本规律分析气泡在电极上的附着力与电极电位有什么关系吗为什么有这种关系(提示:液体对电极表面的润湿性越高,气体在电极表面的附着力就越小。)6.为什么在微分电容曲线中,当电极电位绝对值较大时,会出现“平台”7.双电层的电容为什么会随电极电位变化试根据双电层结构的物理模型和数学模型型以解释。 8.双电层的积分电容和微分电容有什么区别和联系9.试述交流电桥法测量微分电容曲线的原理。10.影响双电层结构的主要因素是什么为什么 答:静电作用和热运动。静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。11.什么叫ψ1电位能否说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关ψ1电位的符号是否总是与双电层总电位的符号一致为什么 答:距离电极表面d处的电位叫ψ1电位。不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关。当发生超载吸附时ψ1电位的符号与双电层总电位的符号不一致。 12.试述双电层方程式的推导思路。推导的结果说明了什么问题 13.如何通过微分电容曲线和电毛细曲线的分析来判断不同电位下的双电层结构答:14.比较用微分电容法和电毛细曲线法求解电极表面剩余电荷密度的优缺点。15.什么是特性吸附哪些类型的物质具有特性吸附的能力答:溶液中的各种粒子还可能因非静电作用力而发生吸附称为特性吸附。大部分无机阴离子,部分无机阳离子以及表面活性有机分子可发生特性吸附。
等电位
等电位联结:将建筑物内部和建筑物本身的所有的大金属构件全部用母排或导线进行电气连接,使整个建筑物的正常非带电导体处于电气连通状态。等电位联结分为总等电位联结(MEB)、辅助等电位联结(SEB)、局部等电位联结(LEB)。 什么是等电位联结?就是将建筑物内部和建筑物本身的所有的大金属构件全部用母排或导线进行电气连接,使整个建筑物的正常非带电导体处于电气连通状态。 怎样做等电位联结?等电位联结分为:总等电位联结(MEB)和局部等电位联结(LEB) 。国家建筑标准设计图集《等电位联结安装》(02D501-2)对建筑物的等电位联结具体做法作了详细介绍。 总等电位联结做法是通过每一进线配电箱近旁的总等电位联结母排将下列导电部分互相连通:进线配电箱的PE(PEN)母排、公用设施的上、下水、热力、煤气等金属管道、建筑物金属结构和接地引出线。它的作用在于降低建筑物内间接接触电压和不同金属部件间的电位差,并消除自建筑物外经电气线路和各种金属管道引入的危险故障电压的危害。 局部等电位联结做法是在一局部范围内通过局部等电位联结端子板将下列部分用 6mm2黄绿双色塑料铜芯线互相连通:柱内墙面侧钢筋、壁内和楼板中的钢筋网、金属结构件、公用设施的金属管道、用电设备外壳(可不包括地漏、扶手、浴巾架、肥皂盒等孤立小物件)等。一般是在浴室、游泳池、喷水池、医院手术室、农牧场等场所采用。要求等电位联结端子板与等电位联结范围内的金属管道等金属末端之间的电阻不超过3Ω。 等电位联结有什么作用?主要是各种保护作用: 1.雷击保护IEC标准中指出,等电位连接是内部防雷措施的一部分。当雷击建筑物时,雷电传输有梯度,垂直相邻层金属构架节点上的电位差可能达到10kV量级,危险极大。但等电位联结将本层柱内主筋、建筑物的金属构架、金属装置、电气装置、电信装置等连接起来,形成一个等电位连接网络,可防止直击雷、感应雷、或其他形式的雷,避免火灾、爆炸、生命危险和设备损坏。 2.静电防护静电是指分布在电介质表面或体积内,以及在绝缘导体表面处于静止状态的电荷。传送或分离固体绝缘物料、输送或搅拌粉体物料、流动或冲刷绝缘液体、高速喷射蒸汽或气体,都会产生和积累危险的静电。静电电量虽然不大,但电压很高,容易产生火花放电,引起火灾、爆炸或电击。等电位联结可以将静电电荷收集并传送到接地网,从而消除和防止静电危害。 3.电磁干扰防护在供电系统故障或直击雷放电过程中,强大的脉冲电流对周围的导线或金属物形成电磁感应,敏感电子设备处于其中,可以造成数据丢失、系统崩溃等。通常,屏蔽是减少电磁波破坏的基本措施,在机房系统分界面做的等电位连接,由于保证所有屏蔽和设备外壳之间实现良好的电气连接,最大限度减小了电位差,外部电流不能侵入系统,得以有效防护了电磁干扰。 4.触电保护1999年6月开始实行的新的建设部《住宅设计规范》中,有一项不太引人瞩目的条款:城镇新建住宅中的卫生间宜做等电位连接。专家通俗的解释是:浴室等电位连接就是保护你不会在洗澡的时候被电着。电热水器、坐浴盆、电热墙,浴霸以及传统的电灯……都有漏电的危险,电气设备外壳虽然与PE线联结,当仍可能会出现足以引起伤害的
电极电势的应用
5.4电极电势的应用 电极电势具有多方面的应用,比如可以结合热力学公式判断氧化还原反应方向、计算氧化还原反应进行的程度、比较氧化剂或还原剂的相对强弱、设计各种原电池、测定配合物的额不稳定常数等等。下面例题就体现了在实际金属离子回收中如何利用电极电势指导路线设计过程。 为了从钴镍铁合金边角废料中提取钴和镍,先将合金边角废料溶于硫酸和硝酸混合酸中,所的溶液主要含Ni 2+、Co 2+和 Fe 2+,其中Fe 2+是大量的,如何使它与Ni 2+、Co 2+分离而除去呢?一般是把Fe 2+氧化为Fe 3+,并使其以钠铁矾沉淀从溶液中分离出去,因此需要选择一种只能将Fe 2+氧化为Fe 3+,而不能氧化Ni 2+和Co 2+的氧化剂,试分析酸性溶液中的氯酸钠NaClO 3或次氯酸纳NaClO 是符合要求? 解 为了便于比较氧化还原能力强弱,下面从标准电极电势表中把有关电对的标准电极电势代数值从小到大排列起来: Fe 3++e -?Fe 2+ φΘ(Fe 3+/Fe 2+)=0.77V - 3 ClO +6H+6e -?Cl -+3H2O φΘ(/Cl -)=1.45V HClO+H++2e -?Cl -+H2O φΘ(HClO/Cl -)=1.49V Co 3++e -?Co 2+ φΘ(Co 3+/Co 2+)=1.80V NiO 2+4H ++2e -?Ni 2++2H2O φΘ(NiO2/Ni 2+)=2.0V 显然,在酸性溶液中,无论氯酸钠或者次氯酸钠都符合要求,只能氧化Fe 2+而不能氧化Co 2+和Ni 2+。这两种氧化剂在实际过程中选用哪一种更合适呢?从它们与Fe 2+反应方程式: O H 3Cl Fe 6H 6Fe 6ClO 2-32-3++=+++++ O H Cl Fe 2H Fe 2HClO 2-32++=+++++ 可以看出1 mol NaClO 3可以氧化6 mol FeSO 4,而1 mol NaClO 只能氧化2 mol FeSO 4,显然,选用NaClO 3作氧化剂可以节省许多原料。
等电位联结安装标准图的编制说明
等电位联结安装标准图的编制说明作者:徐华 摘要作者结合对《等电位联结安装》(97SD567)国标图的修编,谈了对等电位联结的一些新认识,同时对实施过程中出现的问题作简要探讨。 关键词等电位联结接地故障防雷等电位电涌防护器IEC 目前,我国许多新修订的规范、标准逐步同国际电工标准(IEC标准)接轨。等电位联结在电气设计中,是一种行之有效的安全措施,早已为国际上许多国家所采用。我国对等电位联结的作用在认识上也有了长足的进步,1997年编制的《等电位联结安装》提出了一些基本做法,自试用以来收到了施工过程中对许多实际问题的反映,特别是信息技术的迅猛发展,对防雷、接地、等电位有了更高的要求,因此我们参考国际、国内的新标准、新做法对原标准图97SD567作了修编,新的图集号是02D501-2,下面主要对新图册做一些说明 1 等电位联结的分类
笔者在编制97SD567时,曾对"等电位联结"和"等电位连接"分析比较,决定本图册采用"等电位联结"这一名称,但现实工作中,这两个词往往还混淆不清,在此想强调一下,任何标准、规范要想正确的贯彻执行,必须要有规范的名称,具体分析见"浅谈《等电位联结安装》标准图的编制"(《现代建筑电气设计技术文集》第233页。在总说明中,把等电位联结分为三个层次,即总等电位联结,辅助等电位联结,局部等电位联结分别作了详细说明。 总等电位联结作用于全建筑物,由等电位联结端子板放射连接或链接进出建筑物的金属管道、金属结构构件等。辅助等电位联结是在导电部分间,用导线直接连通,使其电位相等或接近,一般是在电气装置的某部分接地故障保护不能满足切断回路的时间要求时,作辅助等电位联结。 局部等电位联结是在一局部场所范围内通过局部等电位联结端子板把各可导电 部分连通,一般是在浴室、游泳池、医院手术室、农牧业等特别危险场所,发生电击事故的危险性较大,要求更低的接触电压,或为满足信息系统抗干扰的要求,一般局部等电位联结也都有一个端子板或者连成环形。简单地说,局部等电位联结可以看成是在这局部范围内的总等电位联结。其区别可借助图集第6页图理解。
(完整版)电化学分析习题答案
电化学分析习题 一、选择题 1.不属于电化学分析法的是C A.电位分析法 B. 极谱分析法 C. 电子能谱法 D. 库仑滴定 2. Ag-AgCl参比电极的电极电位取决于电极内部溶液中的 B A.Ag+活度 B. Cl-活度 C. AgCl活度 D.Ag+和Cl-活度之和 3.正确的饱和甘汞电极半电池组成为B A. Hg/Hg2Cl2(1mol/L)/KCl(饱和) B.Hg/Hg2Cl2(固)/KCl(饱和) C.Hg/Hg2Cl2(固)/KCl(1mol/L) D.Hg/HgCl2(固)/KCl(饱和) 4.pH玻璃电极的膜电位产生是由于测定时,溶液中的 D A.H+离子穿过了玻璃膜 B.电子穿过了玻璃膜 C.Na+与水化玻璃膜上的Na +交换作用 D.H+与水化玻璃膜上的H+交换作用 5.玻璃电极使用前,需要C A.在酸性溶液中浸泡1h B.在碱性溶液中浸泡1h C.在水溶液中浸泡24h D.测量的pH不同,浸泡溶液不同 6.氟离子选择电极对氟离子具有较高的选择性是由于 B A.只有F-能透过晶体膜 B.F-能与晶体膜进行离子交换 C.由于F-体积比较小 D.只有F-能被吸附在晶体膜上 7. 在电位法中离子选择性电极的电位应与待测离子的浓度 D A. 成正比 B. 的对数成正比 C. 符合扩散电流公式的关系 D. 符合能斯特方程式 8. 当金属插入其金属盐溶液时,金属表面和溶液界面会形成双电层,所以产生了电位差。此电位差为B A.液接电位B.电极电位C.电动势D.膜电位 9. 用pH玻璃电极测定pH为13的试液,pH的测定值与实际值的关系为 B A.测定值大于实际值B.测定值小于实际值C.二者相等D.不确定10.直接电位中,加入TISAB的目的是为了 C A.提高溶液酸度 B.恒定指示电极电位 C.固定溶液中离子强度和消除共存离子干扰 D.与待测离子形成配合物 11.测量pH时,需要用标准pH溶液定位,这是为了 D A.避免产生酸差 B.避免产生碱差 C.消除温度的影响 D.消除不对称电位和液接电位的影响 12.玻璃电极不包括 C A.Ag-AgCl内参比电极B.一定浓度的HCl溶液 C.饱和KCl溶液D.玻璃膜 13.电位测定水中F-含量时,加入TISAB溶液,其中NaCl的作用是 B A.控制溶液的pH在一定范围内B.使溶液的离子强度保持一定值
最新最全最实用电极电势表
标准电极电势表 环境:摄氏25度,1标准大气压,离子浓度1摩尔/升,采用氢电极最全最实用电极电势表由xsm18倾情制作,转载请注明来源:https://www.360docs.net/doc/a48136518.html,/xsm18/home
PbSO4(+2)/Pb PbSO4+2e-=Pb+SO42--0.3588 PbBr2(+2)/Pb PbBr2+2e-=Pb+2Br--0.284 Co2+/Co Co2++2e-=Co-0.28 H3PO4/H3PO3H3PO4+2H++2e-=H3PO3+H2O-0.276 PbCl2(+2)/Pb PbI2+2e-=Pb+2I--0.2675 Ni2+/Ni Ni2++2e-=Ni-0.257 CO2/HCOOH(甲酸)CO2(g)+2H++2e-=HCOOH(aq)-0.199 CuI(+1)/Cu CuI+e-=Cu+I-0.1852 AgI(+1)/Ag AgI+e-=Ag+I-0.15224 Sn2+/Sn Sn2++2e-=Sn-0.1375 Pb2+/Pb Pb2++2e-=Pb-0.1262 C4+/C2+CO2(g)+2H++2e-=CO+H2O-0.12 P/PH3P(白磷)+3H++3e-=PH3(g)-0.063气体(g) Hg2I2(+1)/Hg Hg2I2+2e-=2Hg+2I--0.0405 Fe3+/Fe Fe3++3e-=Fe-0.037 Ag2S(+1)/Ag Ag2S+2H++2e-=2Ag+H2S-0.0366 H+/H22H++2e-=H20.00 CuBr(+1)/Cu CuBr+e-=Cu+Br-0.033 AgBr(+1)/Ag AgBr+e-=Ag+Br-0.07133 Si/SiH4Si+4H++4e-=SiH40.102 C(石墨)/CH4C+4H++4e-=CH40.1316 CuCl(+1)/Cu CuCl+e-=Cu+Cl-0.137 Hg2Br2(+1)/Hg Hg2Br2+2e-=2Hg+2Br-0.13923 S/H2S(aq)S+2H++2e-=H2S(aq)0.142水溶液 Sn4+/Sn2+Sn4++2e-=Sn2+0.151 Cu2+/Cu+Cu2++e-=Cu+0.153 S6+/S4+SO42-+4H++2e-=H2SO3+H2O0.172 AgCl(+1)/Ag AgCl+e-=Ag+Cl-0.2223 As3+/As(亚砷酸)HAsO2(aq)+3H++3e-=As+2H2O0.2476HAsO2.H2O Hg2Cl2/Hg Hg2Cl2+2e-=2Hg+2Cl-0.268 Bi3+/Bi Bi3++3e-=Bi0.308 Cu2+/Cu Cu2++2e-=Cu0.337 AgIO3/Ag AgIO3+e-=Ag+IO3-0.354 S6+/S SO42-+8H++6e-=S+4H2O0.3572 Ag2CrO4/Ag Ag2CrO4+2e-=2Ag+CrO42-0.447铬酸银 S4+/S H2SO3+4H++4e-=S+3H2O0.449 Ag2C2O4/Ag Ag2C2O4+2e-=2Ag+C2O42-0.4647草酸银 Cu+/Cu Cu++e-=Cu0.521 I2/I-I2+2e-=2I-0.5355 AgBrO3/Ag AgBrO3+e-=Ag+BrO3-0.546 As5+/As3+H3AsO4(aq)+2H++2e-=HAsO2+2H2O0.56水溶液AgNO2/Ag AgNO2+e-=Ag+NO2-0.564 Te4+/Te TeO2+4H++4e-=Te+2H2O0.593
电动势的测定及其应用
实验五电动势的测定及其应用 【实验目的】 1. 学会几种金属电极的制备方法。 2. 掌握几种金属电极的电极电势的测定方法。 【实验原理】 可逆电池的电动势可看作正、负两个电极的电势之差。设正极电势为φ+,负极电势为φ-,则: E=φ+-φ- 电极电势的绝对值无法测定,手册上所列的电极电势均为相对电极电势,即以标准氢电极(其电极电势规定为零)作为标准,与待测电极组成一电池,所测电池电动势就是待测电极的电极电势。由于氢电极使用不便,常用另外一些易制备、电极电势稳定的电极作为参比电极,如:甘汞电极、银-氯化银电极等。 本实验是测定几种金属电极的电极势。将待测电极与饱和甘汞电极组成如下电池: Hg(l)-Hg2Cl2(S)|KCl(饱和溶液)∥M n+(a±)|M(S)金属电极的反应为: M n+ +n e → M 甘汞电极的反应为: 2Hg+2Cl-→Hg2Cl2+2e 电池电动势为: (1) 式中,φ(饱和甘汞)=0.24240-7.6×10-4(t-25) (t为℃),a=γ±m 【仪器试剂】 原电池测量装置1套;银电极1支;铜电极1支;锌电极1支;饱和甘汞电极1支。 AgNO3(0.1000mol·kg-1);CuSO4(0.1000mol·kg-1); ZnSO4(0.1000mol·kg-1);KNO3饱和溶液;KCl饱和溶液 【实验步骤】 1. 铜、锌等金属电极的制备见本实验的讨论部分。 2. 测定以下三个原电池的电动势。
(1) Hg(l)-Hg2Cl2(S)|饱和KCl溶液∥CuSO4(0.1000mol·kg-1)|Cu(S) (2) Zn(S)|Zn SO4(0.1000mol·kg-1)∥CuSO4(0.1000mol·kg-1)|Cu(S) (3) Zn(S)|Zn SO4 (0.1000mol·kg-1)∥KCl(饱和)|Hg2Cl2(S) -Hg(l) 3. 测量步骤 (1) 连接线路,依次将工作电源、检流计、标准电池以及被测电池接在电位差计相应端钮上。 (2) 调节工作电压(标准化)。将室温时标准电池电动势算出,调节温度补偿旋钮至计算值。20℃时,。将转化开关打到N上,调节粗、中、细、微四个旋钮,依次按下电计旋钮“粗”、“细”,直至检流计指零,在测量过程中,经常检查是否发生偏离,加以调正。 (3) 测量未知电池电动势。将转换开关打在X1或X2上,从大到小调节6个测量旋钮,依次按下电计旋钮“粗”、“细”,直至检流计指零,6个小窗口读书即为E x。 【数据处理】 由测定的电池电动势数据,利用公式(1)计算铜、锌的标准电极电势。 其中离子平均活度系数γ± (25℃)
标准电极电势表样本
标准电极电势表 标准电极电势能够用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极, 溶液中离子有效浓度为1mol/L, 气体分压为100kPa, 温度为298K, 所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。 注: (s) –固体; (l) –液体; (g) –气体; (aq) –水溶液; (Hg) –汞齐。 半反应E°(V)[注 1]来源 Ba++ e?Ba(s) ?4.38 [10][1][3] Sr++ e?Sr(s) ?4.10 [11][1][3] Ca++ e?Ca(s) ?3.8 [11][1][3] Pr3++ e?Pr2+?3.1 [11] ?N2(g) + H++ e?HN3(aq) ?3.09 [6] Li++ e?Li(s) ?3.0401 [5] N2(g) + 4?H2O + 2?e?2?NH2OH(aq) + 2?OH??3.04 [6] Cs++ e?Cs(s) ?3.026 [5]
半反应E°(V)[注 1]来源Ca(OH)2(s) + 2?e?Ca(s) + 2 OH??3.02 [11] Rb++ e?Rb(s) ?2.98 [4] K++ e?K(s) ?2.931 [5] Mg++ e?Mg(s) ?2.93 [10] Ba2++ 2?e?Ba(s) ?2.912 [5] La(OH)3(s) + 3?e?La(s) + 3OH??2.90 [5] Fr++ e?Fr(s) ?2.9 [11] Sr2++ 2?e?Sr(s) ?2.899 [5] Sr(OH)2(s) + 2?e?Sr(s) + 2?OH??2.88 [11] Ca2++ 2?e?Ca(s) ?2.868 [5] Eu2++ 2?e?Eu(s) ?2.812 [5] Ra2++ 2?e?Ra(s) ?2.8 [5] Yb2++ 2?e?Yb(s) ?2.76 [11][1] Na++ e?Na(s) ?2.71 [5][9]
修改版——浅谈电极电势的理解和应用
编号: 119060141011 内蒙古民族大学化学化工学院 本科生学年论文 题目:浅谈对电极电势的理解和应用 专业:化学 年级: 2011级 姓名:郭学良 指导教师:赵玉英导师 完成日期: 2013 年 6 月 1 日
浅谈对电极电势的理解和应用 郭学良 摘要 化学反应可以分为两大类:氧化还原反应和非氧化还原反应,因此可以说氧化还原反应是无机化学学习中最重要的一类反应;而标准电极电势是氧化还原反应很好的定量标度,因此我们就有必要对标准电极电势进行必要的解析和研究。而对于初入门的化学学习者来说,深入的了解电极电势可以从电极电势与电动势的关系、电极电势的能特斯方程、影响电极电势的因素、电极电势的图示法……这几方面入手,接下来我们就从这几方面展开讨论。 关键词:标准电极电势氧化还原反应拉提莫图能特斯方程
引言 标准电极电势是氧化还原反应很好的定量标度,氧化还原反应是无机化学学习中最重要的一类反应,对了解各种元素及其物质的性质及其联系有着重要的意义。因此我们就有必要对标准电极电势进行必要的解析和研究。而对于初入门的化学学习者来说,深入的了解电极电势可以从电极电势与电动势的关系、电极电势的能特斯方程、影响电极电势的因素、电极电势的图示法……这几方面入手,接下来我们就从这几方面展开讨论。
浅谈对电极电势的理解和应用 一、电极电势与电动势的关系 要想了解电极电势与电动势的关系,首先需要明白这两者的概念; 1)电动势:大小等于非静电力把单位正电荷从电源的负极,经过电源内部 移到电源正极所作的功。如设W为电源中非静电力(电源力)把正电荷量 q从负极经过电源内部移送到电源正极所作的功,则电动势大小为 E=W/q。 2)电极电势:当金属放入盐溶液中,溶液中的金属离子受到金属表面电子 的吸引而在金属表面面积形成双电层,双电层之间的电势差就是相应电 极的电极电势。 3)标准电极电势:单个电极的的电极电势是无法测定的,根据IUPAC建议 采用标准氢作为标准电极,给定电极电势与标准电极电势所组成的原电 池的电动势即为该电极的标准电极电势。 从定义可以看出电动势与电极电势是有联系的,即当指定的电极与标准氢电极构成原电池时,指定电极电势大小的绝对值与原电池的电动势的大小相等。但这两者是不同的概念: 1)电动势大小等于原电池两电极电势之差;而单个电极的电势是无法求得 的,标准电极电势大小等于指定电极的电势与标准氢电极E○一(H+/H2)电 势的差值。 2)电动势只有正值;而标准电极电势可以有负值。 3)电动势的对象是原电池;标准电极电势的对象时单个电极。 电动势是我们熟悉的定义,通过电极电势与电动势的对比,可以增进我们对电极电势概念的理解,对于初学者来说只有熟悉了电极电势的概念,下一步的讨论才有意义。 二、电极电势的能特斯方程 1. 首先我们看一下电动势的能特斯方程 对于电池反应 aA+bB=cC+dD,有化学等温式
电极电势在无机化学中的应用(共2篇)
电极电势在无机化学中的应用(共2篇)本文从网络收集而来,上传到平台为了帮到更多的人,如果您需要使用本文档,请点击下载按钮下载本文档(有偿下载),另外祝您生活愉快,工作顺利,万事如意! 第1篇:电极电势在无机化学中的应用 氧化还原反应是化学中的重要反应。原电池中,两个电极用导线连接,并用盐桥将电解液连接,导线中就有电流通过,这说明两个电极上具有电势存在,并且两极之间具有电势差,这种电极上所具有的电势就称电极电势,用渍厮表示。电极电势可用来衡量金属在水溶液中失去电子能力的大小,金属电极电势的高低主要决定于金属的种类、金属离子的浓度和溶液的温度。当外界条件一定时,对金属电极,其电势高低决定于金属活泼性的大小,金属越活泼,达到平衡时,电极的金属片单位面积上积累的负电荷就越多,电极相对于溶液的电势就越负,电极电势就越低;相反,金属越不活泼,溶解倾向则越小,电极电势就越高。 一、电极电势在氧化还原反应中的应用 1.判断氧化剂和还原剂的相对强弱 由金属电极电势的产生可知,标准电极电势数值
越小,表明还原态越易失去电子,即其还原态的还原性越强,氧化态的氧化性越弱;渍厮值越大,表明氧化态越易得电子,即氧化剂是越强的氧化剂,还原剂就是越弱的还原剂。 例如,渍■■=-,渍■■= ∵>- ∴Cu2+的氧化性大于Zn2+. ∵-Cu 2.判断氧化还原反应进行的方向[1] 例1.试用标准电极电势判断Zn+Cu2+=Zn2++Cu反应能否自发向右进行。 已知渍■■=-渍■■= 解:要使反应能自发向右进行,必须其标准电动势E厮>0,否则E厮0 ∴反应能自发向右进行。 或按氧化剂和还原剂的相对强弱判断。氧化还原反应发生在较强的氧化剂和较强的还原剂之间。 例2.试用标准电极电势判断 I2+2Fe2+=2Fe3++2I-反应进行的方向。 已知:渍■■=,渍■■= 解:E厮=渍■■-渍■■= =<0,
