化学实验报告 实验__EDTA标准溶液的配制与标定

实验报告
姓名:班级:同组人:自评成绩:
项目:EDTA标准溶液的配制与标定课程:学号:
一、实验目的
1. 掌握氢氧化钠溶液的配制和标定方法。
2. 熟悉滴定操作和滴定终点的判断。
3. 学习固定量称量法。
二、实验原理
乙二胺四乙酸(H4Y)是一种有机氨羧配合剂,简称EDTA,能与大多数金属离子形成1︰1的螯合物,化学计量简单,故常作为配位滴定中的标准溶液。EDTA难溶于水,通常使用其二钠盐EDTA?2Na?2H2O配制其标准溶液。
配制EDTA标准溶液时,一般是用分析纯的EDTA?2Na?2H2O先配制成近似浓度的溶液,然后以Zn、ZnO、Cu、CaCO3等为基准物标定其浓度。当用Zn或ZnO标定时,滴定是在pH约为10的条件下,以铬黑T为指示剂进行的。终点时,溶液由紫红色变为纯蓝色。滴定过程中的反应为:
滴定前Zn2+ + HIn2-(纯蓝色)══ZnIn-(紫红色)+ H+
终点前Zn2+ + H2Y2- ══ZnY2- + 2H+
终点时ZnIn- + H2Y2-(酒红色)══ ZnY2- + HIn2-(纯蓝色)+ H+
注意事项:
EDTA溶液应贮存在聚乙烯塑料瓶或硬质玻璃中,以防EDTA与玻璃中的金属离子作用。
三、仪器和药品
仪器:分析天平,托盘天平,酸式滴定管(50mL,棕色),锥形瓶(250mL),称量瓶,量筒(5mL、10mL、25mL),烧杯(500mL),硬质玻璃瓶或聚乙烯塑料瓶(500mL)。
试剂:乙二胺四乙酸二钠盐(A.R),ZnO(G.R),铬黑T指示剂,HCl溶液(6mol/L),甲基红指示剂(1%),氨试液(6mol/L),NH3?H2O-NH4Cl缓冲液(pH=10)。
四、内容及步骤
1. EDTA标准溶液(0.05mol/L)的配制
取EDTA?2Na?2H2O 3.8g~4.0g,置于500mL烧杯中,加蒸馏水约100mL使溶解,稀释至200mL,摇匀,移入硬质玻璃瓶或聚乙烯塑料瓶中。
2. EDTA标准溶液(0.05mo1/L)的标定
准确称取在800℃灼烧至恒重的基准物ZnO三份,每份在0.080~0.100g之间,分别置于3个250mL锥形瓶中,加6mol/L盐酸3mL使溶解,加蒸馏水25mL与甲基红指示液1滴,滴加氨试液至溶液呈微黄色。再加蒸馏水25mL,NH3?H2O-NH4Cl缓冲液(pH=10)10mL和铬黑T指示剂3滴,用EDTA标准溶液滴定至溶液由紫红色转变为纯蓝色,即为终点。记录所消耗的EDTA标准溶液的体积。
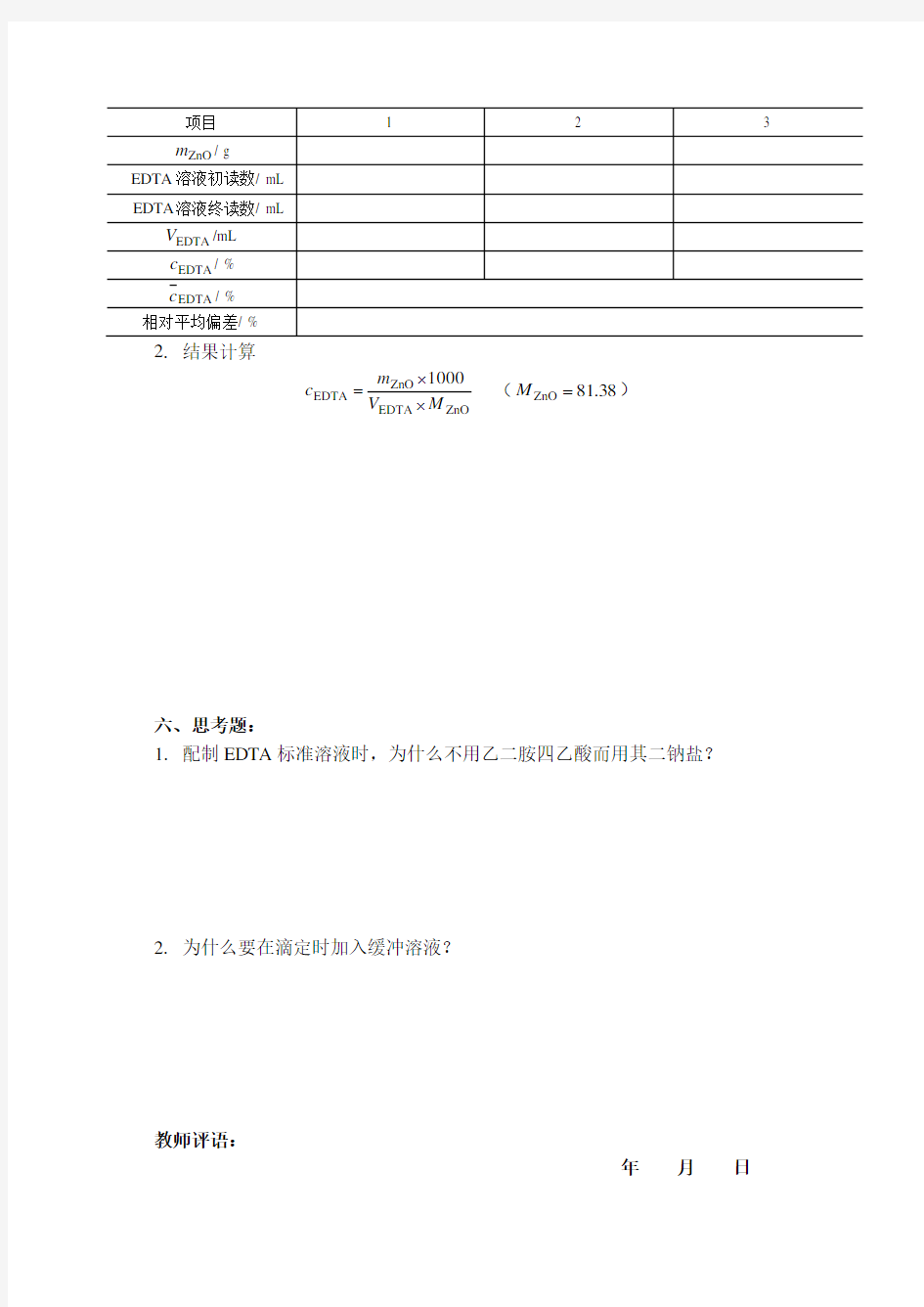
五、实验结果记录与计算
1. 数据记录
ZnO
EDTA ZnO EDTA 1000
M V m c ??=
(8.381ZnO =M )
六、思考题:
1. 配制EDTA 标准溶液时,为什么不用乙二胺四乙酸而用其二钠盐?
2. 为什么要在滴定时加入缓冲溶液?
教师评语:
年 月 日
标准溶液‘配制’及‘标定’原始记录
标准溶液‘配制’及‘标定’原始记录 配制人:标定:复标:审核:
标准物质配制(标定)记录 编号: CHEC/QBG-075 名称:、配制方法: 使用天平型号编号室温℃、湿度%RH 配制:取定溶mL 标定:取份: ⑴⑵⑶⑷ 用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。 标准溶液浓度计算公式:C= 计算结果():C1= C2= C3= C4= C = 相对偏差(%):S1= S2= S3= S4= 备注: 。 配制人:复核人: 配制日期:年月日有效期年月日
标准溶液配制记录 编号: CHEC/QBG-147 标准溶液名称:规格: 配制方法: 仪器名称: 溯源标准: 温度:℃、湿度:%RH 标准溶液拟配浓度: 配制或稀释过程: 配制日期:年月日有效期:年月日配制人:复核人:
0.1mol/L盐酸标准滴定溶液的标定 编号:JL/LJ-001-01 一、标定方法:GB/T5009.1-2003 二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号: JYC009) 三、操作 1、量取9ml盐酸,加适量水并稀释至1000ml。混匀,待标定。 2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸 钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶 液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定 至溶液由绿色变为暗紫色。 四、记录和结果 1、计算公式:c(HCl)=m/[(V1-V2)×0.0530] 0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基 准无水碳酸钠的质量,g 配制人:复核人: 配制日期:复核日期:
乙二胺四乙酸二钠(EDTA)标准溶液配制标定
乙二胺四乙酸二钠(EDTA)标准溶液配制标定各浓度EDTA标准滴定溶液的配制 按表1所示,称取乙二胺四乙酸二钠二水物(C 10H 14 N 2 O 8 Na 2 · 2H 2 O)溶于足够量 的水中,稀释至1L,贮存在聚乙烯容器内。 表 1 称取EDTA质量
氧化锌基准溶液 按表2所示,称取已于800℃灼烧1h的基准氧化锌置于100mL烧杯中,用少量水湿润,滴加盐酸溶液(1+1)至氧化锌溶解,移入250mL量瓶中,稀释至刻度,混匀。 表 2标定所需氧化锌质量
标定 氨-氯化铵缓冲溶液(pH≈10) 1、称取54g氯化铵溶于水,加350mL氨水,稀释至1L。 2、称取氯化铵溶于水,加36mL氨水,稀释至1L 铬黑T指示液(5g/L) 称取铬黑T和氯化羟胺,溶于乙醇中,用乙醇稀释至100mL,贮存于棕色瓶中。可保持数月不变质。标定时,用单标线吸管吸取25mL氧化锌基准溶液于250mL锥形瓶中,加75mL水,用氨水(1+1)中和至溶液pH7~8(溶液出现微混浊),加10mL氨-氯化铵缓冲溶液,5滴铬黑T指示液,用EDTA溶液滴定至溶液由紫红色变成纯蓝色为终点。 计算 乙二胺四乙酸二钠标准滴定溶液浓度按式(1)计算: c(EDTA)=m/×V (1) 式中: 乙二胺四乙酸二钠标准滴定溶液之物质的量浓度,mol/L ; c(EDTA)── m──氧化锌基准溶液中所含氧化锌的质量,g; V──滴定用去乙二胺四乙酸二钠溶液的实际体积,mL; ──与乙二胺四乙酸二钠标准滴定溶液〔 c( EDTA) = L〕相当的以克表示的氧化锌的质量。 精密度 做五次平行测定,取平行测定的算术平均值为测定结果。
化学实验报告单模板
( 实验报告) 姓名:____________________ 单位:____________________ 日期:____________________ 编号:YB-BH-053853 化学实验报告单模板Template of chemical experiment report
化学实验报告单模板 xx中学化学实验报告 高xxxx届x班 固体酒精的制取 指导教师:xxx 实验小组成员:xxxx 实验日期:xxxx-xx-xx 一、实验题目:固态酒精的制取 二、实验目的:通过化学方法实现酒精的固化,便于携带使用 三、实验原理:固体酒精即让酒精从液体变成固体,是一个物理变化过程,其主要成分仍是酒精,化学性质不变.其原理为:用一种可凝固的物质来承载酒精,包容其中,使其具有一定形状和硬度.硬脂酸与氢氧化钠混合后将发生下列反应: CHCOOH+NaOH →1735 CHCOONa+HO 17352 四、实验仪器试剂:250ml烧杯三个1000ml烧杯一个蒸馏水热水硬脂酸氢氧化钠乙醇模版 五、实验操作:1.在一个容器中先装入75g水,加热至60℃至80℃,加入125g酒精,再加入90g硬脂酸,搅拌均匀。 2.在另一个容器中加入75g水,加入20g氢氧化钠溶解,将配置的氢氧化
钠溶液倒入盛有酒精、硬脂酸和石蜡混合物的容器,再加入125g酒精,搅拌,趁热灌入成形的模具中,冷却后即可得固体酒精燃料。 六、讨论: 1、不同固化剂制得的固体霜精的比较: 以醋酸钙为固化剂操作温度较低,在40~50 C即可.但制得的固体酒精放置后易软化变形,最终变成糊状物.因此储存性能较差.不宜久置。 以硝化纤维为固化剂操作温度也在4O~50 c,但尚需用乙酸乙酯和丙酮 溶解硝化纤维.致使成本提高.制得的固体酒精燃烧时可能发生爆炸,故安全性较差。 以乙基羧基乙基纤维素为固化剂虽制备工艺并不复杂,但该固化剂来源困难,价格较高,不易推广使用。 使用硬脂酸和氢氧化钠作固化剂原料来源丰富,成本较低,且产品性能优良。 2 加料方式的影晌: (1)将氢氧化钠同时加入酒精中.然后加热搅拌.这种加料方式较为简单,但由于固化的酒精包在固体硬脂酸和固体氢氧化钠的周围,阻止了两种固体的溶解的反应的进一步进行,因而延长了反应时间和增加了能耗。 (2)将硬脂酸在酒精中加热溶解,再加入固体氢氧化钠,因先后两次加热溶解,较为复杂耗时,且反应完全,生产周期较长。 (3)将硬脂酸和氢氧化钠分别在两份酒精中加热溶解,然后趁热混合,这样反应所用的时间较短,而且产品的质量也较好.3 、温度的影响:见下表:可见在温度很低时由于硬脂酸不能完全溶解,因此无法制得固体酒精;在30 度时硬脂酸可以溶解,但需要较长的时间.且两液混合后立刻生成固体酒精,
实验十一0.02M EDTA标准溶液的配制与标定
实验十一乙二胺四乙酸二钠(EDTA)标准溶液的配制与标定 [C EDTA=0.02mol/L] 一、配制: 称取乙二胺四乙酸二钠8g,加1000毫升水,加热溶解,冷却,摇匀,备用。 二、标定: (一)以基准氧化锌(ZnO)标定(指示剂:0.5%铬黑T指示剂)标定流程:准称于800±500C度高温炉中灼烧至恒重的工作基准试剂氧化锌(0.3~0.4g)于100mL烧杯中 ↓←少量水湿润,盖上表面皿 滴加盐酸溶液(20%)使之刚好完全溶解 ↓ 转移入250毫升容量瓶中,加水至刻度,混匀 ↓ 准确移取25.00毫升(含Zn2+溶液)于锥形瓶 ↓←加甲基红指示剂一滴 滴加氨水(10%)至微黄色(此时PH=7~8) ↓←加蒸溜水25mL 加10毫升氨~氯化铵缓冲溶液(PH≈10) ↓←加5滴铬黑T指示液(0.5%)用EDTA溶液滴定至溶液由紫红色变为纯蓝色,即为终点。 ↓
记录EDTA溶液消耗的体积 ↓ 同时做空白实验 计算:C EDTA=[m X(V1/250)X1000]/[(V2-V0)X M ZnO] 式中: m--------氧化锌的质量,g V1---------含Zn2+标准溶液所取的体积 V2----------------滴定时,EDTA标准溶液所消耗的体积,mL V0-----------------空白滴定时,EDTA标准溶液所消耗的体积,mL M------------------氧化锌的摩尔质量,g/mol, 即M ZnO=81.39g/mol (二)以基准碳酸钙(CaCO3)标定(指示剂:钙指示剂) 标定流程:准称工作基准试剂碳酸钙(0.35~0.4g)于100mL烧杯中 ↓←少量水湿润,盖上表面皿 滴加盐酸溶液(20%)使之刚好完全溶解(可加热助溶) ↓冷却 转移入250毫升容量瓶中,加水至刻度,混匀 ↓ 准确移取25.00毫升(含Ca2+溶液)于锥形瓶 ↓←加甲基红指示剂一滴 滴加氨水(10%)至微黄色 ↓
大学化学实验报告
大学化学实验报告 大学化学实验报告格式1):实验目的,专门写实验达到的要求和任务来实现。(例如,为了研究添加硫酸铜条件的溶液中的氢氧化钠溶液反应) 2):实验原理,该实验是对写的操作是什么通常是实验室书世外桃源基础上做在那里,你总结就行了。(您可以使用上述反应式) 3):实验用品,包括在实验中,液体和固体药品使用的设备。(如酒精灯,滤纸,以及玻璃棒,后两者用于过滤,这应该是在右侧。) 4):实验步骤:实验书籍有(即上面的话,氢氧化钠硫酸铜溶液加到生成蓝色沉淀,再加热蓝色沉淀,观察的现象 5)的反应):实验数据记录和处理。 6):分析与讨论 大学化学实验报告范文实验题目:溴乙烷的合成实验目的:1. 学习从醇制备溴乙烷的原理和方法 2. 巩固蒸馏的操作技术和学习分液漏斗的使用。 实验原理: 主要的副反应: 反应装置示意图: (注:在此画上合成的装置图) 实验步骤及现象记录: 实验步骤现象记录
1. 加料: 将9.0ml水加入100ml圆底烧瓶,在冷却和不断振荡下,慢慢地加入19.0ml浓硫酸。冷至室温后,再加入10ml95%乙醇,然后在搅拌下加入13.0g研细的溴化钠,再投入2-3粒沸石。 放热,烧瓶烫手。 2. 装配装置,反应: 装配好蒸馏装置。为防止产品挥发损失,在接受器中加入5ml 40%nahso3溶液,放在冰水浴中冷却,并使接受管(具小咀)的末端刚好浸没在接受器的水溶液中。用小火加热石棉网上的烧瓶,瓶中物质开始冒泡,控制火焰大小,使油状物质逐渐蒸馏出去,约30分钟后慢慢加大火焰,直到无油滴蒸出为止。 加热开始,瓶中出现白雾状hbr。稍后,瓶中白雾状hbr 增多。瓶中原来不溶的固体逐渐溶解,因溴的生成,溶液呈橙黄色。 3. 产物粗分: 将接受器中的液体倒入分液漏斗中。静置分层后,将下层的粗制溴乙烷放入干燥的小锥形瓶中。将锥形瓶浸于冰水浴中冷却,逐滴往瓶中加入浓硫酸,同时振荡,直到溴乙烷变得澄清透明,而且瓶底有液层分出(约需4ml浓硫酸)。用干燥的分液漏斗仔细地分去下面的硫酸层,将溴乙烷层从分液漏斗的上口倒入30ml蒸馏瓶中。 接受器中液体为浑浊液。分离后的溴乙烷层为澄清液。
标准溶液配制
溶液配制 标准溶液的配置与标定 一、1N、0.5N、0.1N硫酸标准溶液 1、配制 1N硫酸标准溶液 量取98%的浓硫酸280ml,慢慢倒入装有10L水瓶中,摇匀待标 0.5N硫酸标准溶液 量取98%的浓硫酸140ml,慢慢倒入装有10L水瓶中,摇匀待标 0.1N硫酸标准溶液 量取98%的浓硫酸28ml,慢慢倒入装有10L水瓶中,摇匀待标 2、标定 1)标定方法 1N硫酸标准溶液 吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 0.5N硫酸标准溶液 吸取10ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 0.1N硫酸标准溶液 吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%
甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 2)计算 N=N1*V1/V 式中:V1-碳酸钠基准液用量 ml N1-碳酸钠基准液当量浓度 V-消耗硫酸标准溶液的用量 ml 二、10%、25% 10%硫酸溶液 量取98%的浓硫酸600ml,慢慢倒入装有10L水瓶中,摇匀待标25%硫酸溶液 量取98%的浓硫酸1600ml,慢慢倒入装有10L水瓶中,摇匀待标 2、标定 1)标定方法 10%硫酸溶液 吸取配制好的10%的硫酸溶液5ml于250ml三角烧瓶中,加入3D 甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙色即为终点。(消耗的氢氧化钠标准溶液应在10.85ml以上,方可达到10%浓度) 25%硫酸溶液 吸取配制好的25%的硫酸溶液5ml于250ml三角烧瓶中,加入3D 甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定 一、实验目的 (1)、掌握EDTA标准溶液的配制与标定方法。 (2)、掌握铬黑T指示剂的应用条件和终点颜色变化。二、实验原理 EDTA(Na 2H 2 Y)标准溶液可用直接法配制,也可以先配制粗略浓度,再用金属Zn、 ZnO、CaCO 3或MgSO 4 · 7H 2 O等标准物质来标定。当用金属锌标定时,用铬黑T(H 3 In) 做指示剂,在pH=10的款冲溶液中进行,滴定到溶液呈蓝色时为止。滴定反应式: 指示剂反应 Hln2- + Zn2+ = Znln- + H+ ) 滴定反应 H2Y2- + Zn2+ = ZnY2- + 2H+ 终点反应 Znln- + H2Y2-? ZnY2- + Hln2- + H+ 二、实验注意事项 (1)、称取EDTA和金属时,保留四位有效数; (2)、控制好滴定速度; (3)、加热锌溶解时,用表面皿盖住以免蒸发掉。 ? 三、主要仪器与药品 仪器:酸式滴定管、25ml移液管、250ml容量瓶、250ml锥形瓶、250ml烧杯、表面皿。 药品:EDTA二钠盐、金属锌、1:1的氨水、1:1的HCl 、铬黑T指示剂、氨水—NH4Cl缓冲液(PH=10) 四、实验过程及原始数据记录 (1)、称取分析纯EDTA二钠盐左右,配制成500ml溶液。 (2)、称取~金属Zn,加入1:1 HCl 5ml,盖好表面皿,使锌完全溶解,用水冲洗表面皿及烧杯内壁,然后将溶液移入250ml容量瓶中,再加水至刻度摇均,用25ml移液管吸此溶液置于250ml锥形瓶中,滴加1:1 氨水至开始出现Zn(OH) 2白色沉淀,再加PH=10的缓冲溶液10ml ,加水稀释至100ml ,加入少许(约)铬黑T指示剂,用待标定的EDTA溶液滴定至溶液由酒红色变为纯蓝色,即为滴定终点。 ( EDTA的标定[ m(Zn) = ]
EDTA标准溶液的配制与标定(铬黑T)
实验八EDTA溶液的配制与标定 (铬黑T法) 一、实验目的 1、学习配制Zn2+标准溶液,EDTA标准溶液; 2、学会以Zn为工作基准试剂,铬黑T为指示剂标定EDTA标准溶液; 3、巩固直接称量、准确配制溶液、准确移取溶液、滴定等基本操作。 二、实验原理 1、用EDTA二钠盐配制EDTA标准溶液的原因; EDTA是四元酸,常用H4Y表示,是一种白色晶体粉末,在水中的溶解度很小,室温溶解度为0.02g/100g H2O。因此,实际工作中常用它的二钠盐Na2H2Y·2H2O, Na2H2Y·2H2O 的溶解度稍大,在22℃(295K)时,每100g水中可溶解11.1g. 2、标定EDTA标准溶液的工作基准试剂,基准试剂的预处理; 实验中以纯金属Zn为工作基准试剂。预处理:称量前一般应先用稀盐酸洗去氧化层,然后用水洗净,烘干。 3、滴定用的指示剂,指示剂的作用原理; 实验中以铬黑T作为指示剂。 作用原理:在pH=l0的条件下,滴定前,Zn2+与指示剂反应: HIn2- + Zn2+ ZnIn- + In3- 纯蓝色酒红色 滴定至终点时,反应为: ZnIn- + H2Y2- HIn2- + ZnY2- + H+ 酒红色纯蓝色 此时,溶液从酒红色变为纯蓝色,变色敏锐。 4、用何种缓冲溶液及其原因; 实验是以NH3·H2O-NH4Cl为缓冲溶液。原因:实验中所用的指示剂是铬黑T, p K a2=6.3 p K a3=11.55 H2In-HIn2-In3-
紫红蓝橙 若pH<6.3或pH>11.5,由于指示剂本身接近于红色而不能使用。根据实验结果,使用铬黑T的最适宜酸度是pH=9~10.5,pH=10的缓冲液符合要求。 5、计算式。 C EDTA=mV Zn/0.25M Zn V EDTA 三、实验步骤
化学实验报告格式模板.doc
化学实验报告格式模板 (以草酸中h2c2o4含量的测定为例) 实验题目:草酸中h2c2o4含量的测定 实验目的: 学习naoh标准溶液的配制、标定及有关仪器的使用; 学习碱式滴定管的使用,练习滴定操作。 实验原理: h2c2o4为有机弱酸,其ka1=5.9×10-2,ka2=6.4×10-5。常量组分分析时cka1>10-8,cka2>10-8,ka1/ka2<105,可在水溶液中一次性滴定其两步离解的h+: h2c2o4+2naoh===na2c2o4+2h2o 计量点ph值8.4左右,可用酚酞为指示剂。 naoh标准溶液采用间接配制法获得,以邻苯二甲酸氢钾标定: -cook -cooh +naoh=== -cook
-coona +h2o 此反应计量点ph值9.1左右,同样可用酚酞为指示剂。 实验方法: 一、naoh标准溶液的配制与标定 用台式天平称取naoh1g于100ml烧杯中,加50ml蒸馏水,搅拌使其溶解。移入500ml试剂瓶中,再加200ml蒸馏水,摇匀。 准确称取0.4~0.5g邻苯二甲酸氢钾三份,分别置于250ml 锥形瓶中,加20~30ml蒸馏水溶解,再加1~2滴0.2%酚酞指示剂,用naoh标准溶液滴定至溶液呈微红色,半分钟不褪色即为终点。 二、h2c2o4含量测定 准确称取0.5g左右草酸试样,置于小烧杯中,加20ml蒸馏水溶解,然后定量地转入100ml容量瓶中,用蒸馏水稀释至刻度,摇匀。 用20ml移液管移取试样溶液于锥形瓶中,加酚酞指示剂1~2滴,用naoh标准溶液滴定至溶液呈微红色,半分钟不褪色即为终点。平行做三次。 实验数据记录与处理: 一、naoh标准溶液的标定
标准溶液的配制
标准溶液的配制 二氧化硅标准贮存溶液:称取0.5000g预先在100℃灼烧2h并冷至室温的二氧化硅(99.99%)置于铂坩埚中,加5g无水碳酸钠,盖上坩埚盖并稍留缝隙,置于1000℃高温炉中熔融5-10min,取出,冷却。置于盛有300ml 沸水聚四氟乙烯烧杯中,低温加热浸出熔块至溶液清亮,用热水洗出坩埚及盖,冷却运载室温。移入500ml容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中,此溶液1ml含1mg二氧化硅。 二氧化硅标准溶液:移取50.00ml二氧化硅标准贮存溶液,置于500ml 容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中。此溶液1ml含1μg二氧化硅。 三氧化二铁标准贮存溶液:称取1.0000g预先在110℃烘2小时的三氧化二铁(99.99%),置于烧杯中,用少许水湿润,加入40ml盐酸(1+1),低温加热溶解至溶液清亮,冷至室温,移入1000ml容量瓶中,用水稀释至刻度,摇匀。此溶液1ml含1mg三氧化二铁。 三氧化二铁标准溶液:移取50.00ml三氧化二铁标准贮存溶液,置于500ml容量瓶中用水稀释至刻度,摇匀。此溶液1ml含100μg三氧化二铁。 氧化铝标准溶液:称取0.5293g金属铝(99.99%)于聚四氟乙烯烧杯中,加20ml水、10~15ml氢氧化钾溶液(40%),低温溶解,以盐酸(1+1)中和至沉淀出现,并过量20ml,加热煮沸1~2min至溶液清亮,冷却,移入1000ml容量瓶中,以水稀释至刻度,摇匀,此溶液1ml含1mg氧化铝。 二氧化钛标准贮存溶液:称取0.1000g预先在1000℃灼烧1小时的二氧化钛(光谱纯),置于铂坩埚中,加入5~8g焦硫酸钾熔融,熔融物用200ml 硫酸(1+9)加热溶解,溶液冷至室外温后,移入1000ml容量瓶中,用硫酸(5+95)稀释至刻度摇匀。此溶液1ml含100μg二氧化钛。 二氧化钛标准溶液:称取50.00ml二氧化钛标准贮存溶液,置于500ml 容量瓶中,用水稀释至刻度,摇匀。此溶液1ml含10μg二氧化钛。 氧化钙标准溶液:称取0.8923g预先在110℃烘1小时的碳酸钙(基准试剂)置于400ml烧杯中,加少量水盖上表面皿,沿杯嘴慢慢加入盐酸(1+1),加热溶解并煮沸冷至室温,移入1000ml容量瓶中用水稀释至刻度摇匀。此溶液1ml含0.5mg氧化钙。当取样量为1.7848g时溶液含氧化钙1mg/ml。
高中化学实验报告(完整版)
报告编号:YT-FS-1072-24 高中化学实验报告(完整 版) After Completing The T ask According To The Original Plan, A Report Will Be Formed T o Reflect The Basic Situation Encountered, Reveal The Existing Problems And Put Forward Future Ideas. 互惠互利共同繁荣 Mutual Benefit And Common Prosperity
高中化学实验报告(完整版) 备注:该报告书文本主要按照原定计划完成任务后形成报告,并反映遇到的基本情况、实际取得的成功和过程中取得的经验教训、揭露存在的问题以及提出今后设想。文档可根据实际情况进行修改和使用。 1 (1)称取4gNaOH,5.85gNaCl (2)用量筒量取适量蒸馏水 (3)置于烧杯中搅拌溶解冷却 (4)用玻璃棒将液体引流到1L的容量瓶中 (5)再用蒸馏水洗烧杯,再引流到容量瓶中 (6)用胶头滴管定容 (7)盖上容量瓶盖子,上下摇晃,混合均匀即可 2 (1)验漏 (2)用标准液和待测液润洗滴定管 (3)取高锰酸钾溶液于酸式滴定管中,取草酸于酸式滴定管中,并读出初始刻度 (4)将草酸流入锥形瓶中,在锥形瓶下方垫上白纸
(5)用正确方法将高锰酸钾溶液滴入锥形瓶中 (6)直到溶液微呈淡紫色,滴定结束 (7)读出末刻度,计算 物理实验报告·化学实验报告·生物实验报告·实验报告格式·实验报告模板 3 加入少量NaOH固体生成白色沉淀的是AlCl3 加少量Ba(OH)2固体,有无色的可使湿润的红色石蕊试纸变蓝的气体 的再加入HCl,白色沉淀不溶解的是(NH4)2SO4,沉淀溶解的是(NH4)2CO3 4 将新制的氯水分别加入,振荡,再加入CCl4,振荡静置分层 若下层为棕黄色则为NaBr,若下层为紫红色则为NaI 在分液,取下层液,蒸馏得Br2,I2 5 向废铜屑中加浓硫酸 这里填写您企业或者单位的信息 Fill In The Information Of Your Enterprise Or Unit Here
常用标准溶液的配制和标定
标准溶液的配制与标定 实训一氢氧化钠标准溶液的配制和标定 一、目的要求 1.掌握NaOH标准溶液的配制和标定。 2.掌握碱式滴定管的使用,掌握酚酞指示剂的滴定终点的判断。 二、方法原理 NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。 反应方程式:2NaOH + CO2→ Na2CO3+ H2O 由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。 除去Na2CO3最通常的方法是将NaOH先配成饱和溶液(约52%,W/W),由于Na2CO3在饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。待Na2CO3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。此外,用来配制NaOH溶液的蒸馏水,也应加热煮沸放冷,除去其中的CO2。 标定碱溶液的基准物质很多,常用的有草酸(H2C2O4?2H2O)、苯甲酸(C6H5COOH)和邻苯二甲酸氢钾(C6H4COOHCOOK)等。最常用的是邻苯二甲酸氢钾,滴定反应如下: C6H4COOHCOOK + NaOH →C6H4COONaCOOK + H2O 计量点时由于弱酸盐的水解,溶液呈弱碱性,应采用酚酞作为指示剂。 三、仪器和试剂 仪器:碱式滴定管(50ml)、容量瓶、锥形瓶、分析天平、台秤。 试剂:邻苯二甲酸氢钾(基准试剂)、氢氧化钠固体(A.R)、10g/L酚酞指示剂:1g酚酞溶于适量乙醇中,再稀释至100mL。 四、操作步骤 1.0.1mol/L NaOH标准溶液的配制 用小烧杯在台秤上称取120g固体NaOH,加100mL水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。 准确吸取上述溶液的上层清液5.6mL到1000毫升无二氧化碳的蒸馏水中,摇匀,贴上标签。
化学实验报告标准范本
报告编号:LX-FS-A83751 化学实验报告标准范本 The Stage T asks Completed According T o The Plan Reflect The Basic Situation In The Work And The Lessons Learned In The Work, So As T o Obtain Further Guidance From The Superior. 编写:_________________________ 审批:_________________________ 时间:________年_____月_____日 A4打印/ 新修订/ 完整/ 内容可编辑
化学实验报告标准范本 使用说明:本报告资料适用于按计划完成的阶段任务而进行的,反映工作中的基本情况、工作中取得的经验教训、存在的问题以及今后工作设想的汇报,以取得上级的进一步指导作用。资料内容可按真实状况进行条款调整,套用时请仔细阅读。 实验题目:溴乙烷的合成 实验目的:1. 学习从醇制备溴乙烷的原理和方法 2. 巩固蒸馏的操作技术和学习分液漏斗的使用。 实验原理: 主要的副反应: 反应装置示意图: (注:在此画上合成的装置图) 实验步骤及现象记录: 1. 加料: 将9.0ml水加入100ml圆底烧瓶,在冷却和
不断振荡下,慢慢地加入19.0ml浓硫酸。冷至室温后,再加入10ml95%乙醇,然后在搅拌下加入13.0g研细的溴化钠,再投入2-3粒沸石。 放热,烧瓶烫手。 2. 装配装置,反应: 装配好蒸馏装置。为防止产品挥发损失,在接受器中加入5ml 40%nahso3溶液,放在冰水浴中冷却,并使接受管(具小咀)的末端刚好浸没在接受器的水溶液中。用小火加热石棉网上的烧瓶,瓶中物质开始冒泡,控制火焰大小,使油状物质逐渐蒸馏出去,约30分钟后慢慢加大火焰,直到无油滴蒸出为止。 加热开始,瓶中出现白雾状hbr。稍后,瓶中白雾状hbr增多。瓶中原来不溶的固体逐渐溶解,因溴的生成,溶液呈橙黄色。 3. 产物粗分:
EDTA标准溶液的配制和标定(氧化锌标液)
EDTA标准溶液的配制和标定(氧化锌标液) 一、目的:1、学习EDTA标准溶液的配制和标定方法。 2、学习配位滴定法的原理,了解该滴定法的特点。 二、原理: 标定EDTA的基准物质有Zn、CaCO 3、Bi、Cu、MgSO 4 ·7H 2 O等。 (M EDTA =372.2g/mol) 指示剂:EBT 1%(称取1克EBT加入三乙醇胺75ml、无水乙醇25ml)。 在PH=10.0的缓冲溶液中:Zn2++In3- ZnIn- (酒红色) ZnIn-+HY3-←→ ZnY2-+HIn2- (蓝色) 三、用ZnO作为基准物质时所需试剂: EDTA ZnO(烘干) NH 3—NH 4 Cl缓冲液(PH=10.0) 1+1 氨水EBT 1% 6mol·L-1的HCl (M ZnO =81.37) 四、实验步骤: 1、配制0.02mol·L-1EDTA500mL 在台称上称取EDTA二钠盐3.5—3.8g溶入150—200mL温水中,稀释至500mL,装入试剂瓶中、待标定。 2、配制ZnO标准溶液250mL 在分析天平上准确称取ZnO 0.3—0.4g于小烧杯中。滴加6mol·L-1的HCl至全部溶解(约5~10mL),转移至250mL的容量瓶中。 3、准确取三份各25.00mL+25mL蒸馏水入三角锥瓶中。 慢慢滴加NH 3 水,至刚好出现白色浑浊,加入10mL缓冲液,滴加3—4
滴铬黑T。 4、0.02mol·L-1EDTA滴定,由酒红色→蓝色为终点。 五、数据及计算: 公式:C EDTA =(m ZnO /M ZnO ×25/250)/ (V EDTA /1000) 样品号 1 2 3 ZnO的质量(g) ZnO基准溶液用量 (mL) EDTA终读数 (mL) EDTA初读数 (mL) V EDTA (mL) C EDTA (mol·L-1) C EDTA 平均值 (mol·L-1) 绝对偏差 相对平均偏差 (%) 二、思考题: 1、配位滴定中为什么需要采用缓冲溶液? 2、为什么在ZnO中加入HCl? 3、通过计算说明为什么称取0.32—0.4g ZnO? 怎么标定0.05mol/L的EDTA标准溶液基准物是氧化锌指示剂是铬黑T固体?
工厂化学实验报告表格
工厂化学实验报告表格 篇一:综合实验预习报告 实验目的 通过陶瓷工艺设计性综合实验,达到以下目的: (1)了解常用陶瓷原料在陶瓷坯料中的作用;(2)掌握坯料配方设计和实验研究方法;(3)掌握实验技能,提高动手能力;(4)提高分析问题和解决问题的能力; (5)为毕业论文实验、进一步深造或从事专业技术工作奠定良好的基础。 2、实验安排 查找相关资料,进行长石质日用陶瓷坯料的配方设计,完成实验预习报告。实验过程性能测试 泥浆的流动性性能测试瓷坯的抗弯强度测试 完成实验总结报告 3.实验方案设计 长石质日用瓷使用的各种原料 各原料的化学组成(1)实验室原材料的化学组成 表1实验原料的化学组成(wt%) 原料石英长石生砂石碱矸滑石粉洪江土苏州土SiO2 Al2O3Fe2O3TiO2
---- CaO- MgO- K2O--- Na2O--- 烧失量 3,各原料的作用及适宜范围(1)粘土 软质:硬度低,可塑性、结合性好,杂质较多,成泥后干燥收缩率大,烧后白度低。苏州土、洪江土、碱矸(实验室提供)等。 硬质:硬度较高,可塑性、结合性较差,杂质少,干燥收缩率小,烧后白度高。实验室提供大同土(生砂石)。粘土在陶瓷坯料中的作用: a、赋予坯料以可塑性或结合性。保证成型性能及泥浆稳定性。强可塑性粘土一般小于15% b、赋予以一定的干燥强度。保证后续工序顺利进行 c、构成坯体的主体,总量一般50%左右。 d、烧成过程中转化为莫来石等铝硅化合物,构成坯体和材料的骨架。长石 钾、钠长石,K2O(Na2O)?Al2O3?6SiO2硬度莫氏
5~6级;无可塑性,瘠性原料。钾长石:肉红色透明感岩石;熔融温度1200~1220℃,高温黏度较大,对黏土和石 英的溶解能力较低。 钠长石:淡肉红色略白色透明感岩石;熔融温度1180~1200℃,高温黏度较小,对黏土和石英的溶解能力 较高。长石在坯料中的作用: a、约1000℃长石开始熔融,液相填充于固相颗粒之间,提高坯体的致密度,冷却后转化为玻璃相与固相颗粒牢固 结合,提高产品的强度、透明度等性能。 b、溶解黏土和长石,在液相中析出晶须状莫来石晶体,提高产品的强度、热稳定性等。 C、降低干燥收缩,提高干燥速度。 d、降低烧成温度,实验室提供山西闻喜长石引入量20%~40%。(3)石英 理论组成:SiO2;熔点:1713℃;硬度:莫氏7级;白色块状或砂状,瘠性原料。晶型转变:β-石英?α-石英(573℃)ΔV=%,实验室提供河南石英砂引入量 20%~40%。 石英在陶瓷坯料中的作用: a、高温下部分溶解于液相,提高液相的高温黏度,未 熔石英颗粒与黏土转化物一起构成坯体骨架,防止产品变形。
EDTA标准溶液的标定
EDTA标准溶液的标定 1.实验目的 (1)掌握络合滴定的原理,了解络合滴定的特点; (2)学习EDTA标准溶液的配制和标定方法; (3)了解金属指示剂的特点,熟悉二甲酚橙、钙黄绿素指示剂的使用及终点颜色的变化。 2.实验原理 乙二胺四乙酸(简称EDTA),难溶于水,通常用EDTA二钠盐,并采用间接法配 制标准溶液。标定EDTA溶液的基准物有Zn、ZnO、CaCO 3、Cu 、MgSO 4 ·7 H 2 O等。 用于测定Pb2+、 Bi3+含量的EDTA溶液可用ZnO或金属Zn作为基准物进行标定。 以二甲酚橙作指示剂,在pH=5~6的溶液中,二甲酚橙指示剂(XO)本身显黄色,而与Zn2+的络合物呈紫红色。EDTA与Zn2+形成更稳定的络合物,当用EDTA溶液滴至近终点时。EDTA会把与二甲酚橙络合的Zn2+置换出来而使二甲酚橙游离,因此溶液由紫红色变为黄色。其变色原理可表达如下: XO(黄色)+ Zn2+__ZnXO(紫红色) ZnXO(紫红色)+EDTA__ZnEDTA(无色)+XO(黄色) EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量及测定水的硬度,最好选用CaCO 3 做基准物标定。这样基准物和被测组分含有相同的组分,使得测定条 件一致,可以减少误差。首先将CaCO 3 用盐酸溶解后,制成Ca2+标准溶液,调节酸度至pH>12.5时,以钙黄绿素-百里酚酞作混合指示剂,用EDTA标准溶液滴至由绿色荧光色消失。 3.仪器和药品 仪器:电子天平、酸式滴定管、移液管、锥形瓶、容量瓶、烧杯、试剂瓶。 药品: (1)以ZnO为基准物时所用试剂:ZnO(A.R)、乙二胺四乙酸二钠(A.R)、六次甲基四胺:20%(m/v)、二甲酚橙指示剂(0.2%)、盐酸(1+1)。 (2)以CaCO 3 为基准物时所用试剂:碳酸钙:固体,一级试剂(G.R);盐酸(1+1);钙黄绿素-百里酚酞混合指示剂(1g钙黄绿素和1g百里酚酞与50g固体硝酸钾(A..R)磨细,混匀后,贮于小广口瓶中);氢氧化钾溶液:20%(m/v);乙二胺
化学实验报告格式示例
化学实验报告格式示例 化学实验报告格式示例例一定量分析实验报告格式(以草酸中H2C2O4含量的测定为例) 实验题目:草酸中H2C2O4含量的测定 实验目的: 学习NaOH标准溶液的配制、标定及有关仪器的使用; 学习碱式滴定管的使用,练习滴定操作。 实验原理: H2C2O4为有机弱酸,其Ka1=5.9×10-2,Ka2=6.4×10-5。常量组分分析时cKa1>10-8,cKa2>10-8,Ka1/Ka2<105,可在水溶液中一次性滴定其两步离解的H+: H2C2O4+2NaOH===Na2C2O4+2H2O 计量点pH值8.4左右,可用酚酞为指示剂。 NaOH标准溶液采用间接配制法获得,以邻苯二甲酸氢钾标定: -COOK -COOH +NaOH=== -COOK -COONa
+H2O 此反应计量点pH值9.1左右,同样可用酚酞为指示剂。实验方法: 一、NaOH标准溶液的配制与标定 用台式天平称取NaOH1g于100mL烧杯中,加50mL蒸馏水,搅拌使其溶解。移入500mL试剂瓶中,再加200mL蒸馏水,摇匀。 准确称取0.4~0.5g邻苯二甲酸氢钾三份,分别置于250mL锥形瓶中,加20~30mL蒸馏水溶解,再加1~2滴0.2%酚酞指示剂,用NaOH标准溶液滴定至溶液呈微红色,半分钟不褪色即为终点。 二、H2C2O4含量测定 准确称取0.5g左右草酸试样,置于小烧杯中,加20mL蒸馏水溶解,然后定量地转入100mL容量瓶中,用蒸馏水稀释至刻度,摇匀。 用20mL移液管移取试样溶液于锥形瓶中,加酚酞指示剂1~2滴,用NaOH标准溶液滴定至溶液呈微红色,半分钟不褪色即为终点。平行做三次。 实验数据记录与处理: 一、NaOH标准溶液的标定 实验编号123备注
标准溶液配制作业指导书-1
标准溶液的配制作业指导书 1.目的: 规范标准溶液配制活动、保证标准溶液(标准物质)准确、可靠,量值溯源稳定。 2.适用范围: 适用于技术中心检验测试用标准溶液(标准物质)的制备、标定、验证、有效期限的规定和标识等活动。 3.职责: 3.1配制人员:记录配制、稀释过程和数据;加贴标签; 3.2审核(复核)人员:检查配制过程符合性,计算有效性和结果准确性。 4.工作过程及要求 4.1基本要求 4.1.1方法选择:按照检验、测试、分析标准(方法)规定执行或按照国家标准(如GB/T601、GB/T602等)规定执行。 4.1.2制备标准溶液用水,应符合GB/T6682-92中二级水的规定,特殊项目、微量测定用元素标准溶液配制用水应符合GB/T6682-92中一级水的规定。 4.1.3配制标准溶液所用试剂的纯度应为基准剂试、高纯试剂、光谱纯试剂。 4.1.4所用分析天平的砝码需定期校正,滴定管、容量瓶及移液管使用已校正的。 4.1.5标定标准溶液所用的基准试剂应为容量分析工作基准试剂。 4.1.6制备标准溶液的浓度系指20℃时的浓度,在标定和使用时,如温度有差异,应按附表1进行补正。 4.1.7“标定”或比“较较”标准溶液浓度时,平行试验不得少于4次,平行测定结果的极差(即最大值和最小值之差)与平均值之比不得大于0.1%,结果取平均值。浓度值取四位有效数字。 4.1.8对规定用“标定”和“比较”两种方法测定浓度时不得略去其中任何一种,且两种方法测得的浓度值之差不得大于0.2%,以标定结果为准。 4.1.9制备的标准溶液浓度与规定浓度相对误差不得大于5%。 4.1.10配制浓度等于或低于0.02mol/L的标准溶液时,应现用现配。 4.1.11碘量法反应时,溶液的温度不能过高,一般在15-20℃之间进行。 4.1.12标准贮备液有效期为两个月。滴定分析用标准溶液在常温(15-25℃)下,保存时间一般不超过2个月。 4.1.13微量测定用工作液应用标准溶液逐级冲稀成所需工作液,每次吸取体积不得小于5ml。4.1.14微量测定所用标准溶液在常温(15-25℃)下保存期一般为2个月,有效期内出现混浊、沉淀或颜色有变化时,应重新制备。 4.2 配制方法 4.2.1滴定分析(容量分析)用标准溶液的制备按照检验、测试、分析标准(方法)规定执行或按GB/T601-2002执行 4.2.1.1直接配制法 用分子量求出欲配制的浓度质量。 在分析天平上准确称取一定量已干燥的基准物放入洁净的烧杯中溶于水,转入已校正的容量瓶中用水稀释至刻度,摇匀。 根据物质的重量,溶液的体积计算出其准确浓度。 配制标准溶液校核登记。
分析化学实验报告标准范本
报告编号:LX-FS-A91137 分析化学实验报告标准范本 The Stage T asks Completed According T o The Plan Reflect The Basic Situation In The Work And The Lessons Learned In The Work, So As T o Obtain Further Guidance From The Superior. 编写:_________________________ 审批:_________________________ 时间:________年_____月_____日 A4打印/ 新修订/ 完整/ 内容可编辑
分析化学实验报告标准范本 使用说明:本报告资料适用于按计划完成的阶段任务而进行的,反映工作中的基本情况、工作中取得的经验教训、存在的问题以及今后工作设想的汇报,以取得上级的进一步指导作用。资料内容可按真实状况进行条款调整,套用时请仔细阅读。 实验题目:草酸中h2c2o4含量的测定 实验目的: 学习naoh标准溶液的配制、标定及有关仪器的使用; 学习碱式滴定管的使用,练习滴定操作。 实验原理: h2c2o4为有机弱酸,其ka1=5、9×10-2,ka2=6、4×10-5、常量组分分析时cka1>10-8,cka2>10-8,ka1/ka2<105,可在水溶液中一次性滴定其两步离解的h+: h2c2o4+2naoh===na2c2o4+2h2o
计量点ph值8、4左右,可用酚酞为指示剂。 naoh标准溶液采用间接配制法获得,以邻苯二甲酸氢钾标定: -cook -cooh +naoh=== -cook -coona +h2o 此反应计量点ph值9、1左右,同样可用酚酞为指示剂。 实验方法: 一、naoh标准溶液的配制与标定 用台式天平称取naoh1g于100ml烧杯中,加50ml蒸馏水,搅拌使其溶解。移入500ml试剂瓶
EDTA标准溶液的配置和标定
姓名:舒睿 学号:5603111040 试验时间:第八周,星期3 ,14点 实验九 EDTA 标准溶液的配制和标定 一、 实验目的: 1.进一步掌握分析天平的正确使用; 2.掌握正确的滴定操作方法。 3学习EDTA 标准溶液的配制和标定方法; 4.掌握配位滴定指示剂的指示原理、终点的判断。 5. 掌握定量分析实验报告的正确表示(格式、内容、有效数字等) 二、原理 乙二胺四乙酸二钠简称EDTA ,由于EDTA 与大多数金属离子形成稳定的1:1型螯合物,故常用作配合滴定的标准溶液。 标定EDTA 溶液的基准物有:Zn ,ZnO ,CaCO3,Cu ,Bi ,Ni ,Pb MgSO4·7H2O ,等。通常选用的标定条件应尽可能与测定条件一致,以免引起系统误差,如果用被测元素的纯金属或化合物作基准物质,就更为理想。 如果EDTA 溶液用于测定pb2+,Bi3+,则宜用纯金属锌作基准物标定EDTA ,用铬黑T 作指示剂,用氨缓冲溶液,在pH=10进行标定。也可用二甲酚橙作指示剂,用六次甲基四胺调节酸度,在pH=5~6进行标定。 本实验用CaCO3作基准物,在pH ≧12的NaOH 缓冲液中,以钙指示剂, 标定EDTA 。溶液由酒红色变为纯蓝色为终点。反应如下: 滴定前 : Ca2++ HInd2-(纯蓝) CaInd-(酒红)+ H+ 滴定开始至终点: Ca2+ + H2Y2- CaY2- + H+ pH ≧12 终点: CaInd-(酒红)+H2Y2- CaY2- + HInd2-(纯蓝) pH ≧12 计算EDTA 浓度 三、试剂 1、乙二胺四乙酸二钠(Na2H2Y ·2H2O ) 摩尔质量为372.2。1g/2人。 2、 CaCO3 (A·R ) 3、NH3-NH4Cl 缓冲溶液 EDTA CaCO EDTA V m C 100000.25000.2509.1003
化学实验报告的格式
篇一:化学实验报告 班级同组人指导教师史老师日期:实验题目:观察和描述一对蜡烛及期燃烧的探究实验目的: 1、培养观察和描述的能力。 2、学习科学探究的方法。 实验器材: 蜡烛、小木条、烧杯2个、澄清石灰水 实验步骤: 1、点燃前,观察蜡烛的颜色、状态、形状和硬度;观察把蜡烛投入水中的情况。 2、燃着时,火焰分几层,用小木条比较火焰不同部分温度的高低,用烧杯推测燃烧后的生成物。 3、燃灭后,用火柴去点白烟,蜡烛能否重新燃烧。 现象: 1、蜡烛是乳白色,柱状固体、无味,能被轻易切成处,放于水中飘浮于水面上。 2、火焰分为三层。小木条上外焰接触的部分被烧焦得最厉害,干燥的烧杯内壁有水珠,涂有石灰水的烧杯变浑浊。 3、白烟能被点燃。 分析及结论: 1、蜡烛难溶于水、质软。
2、外焰温度最高,蜡烛燃烧有水和CO2生成。 3、吹灭蜡烛后的白烟是可燃物。 班级姓名同组人指导教师史老师日期:实验题目:对人体吸入的空气和呼出的气体的探究实验目的: 探究人体吸入的空气和呼出的气体有何不同 实验器材: 水槽、集气瓶4个、玻璃片4块、滴管、石灰水、饮料管、小木条实验步骤: 1、用吹气排水法收集两瓶呼出的气体。 2、收集两瓶空气。 3、在1瓶空气和1瓶呼出气中滴入石灰水、振荡。 4、将燃着的木条分别插入空气和呼出气中。 5、对着干燥的玻璃片呼气。 现象: 1、滴入石灰水后,充满呼出气的集气瓶更浑浊一些; 2、插入呼出气中的木条立即熄灭,插入空气中的木条正常燃烧过了一会儿才熄灭; 3、呼气后干燥的玻璃片上有较多的水珠。 分析及结论: 人体呼出的气体中有CO2含量较高,吸入的空气中O2含量较高,呼出气中H2O含量较高。 班级姓名同组人指导教师史老师日期:实验题目:化学
