总胆固醇(TC)检测试剂盒(COD-PAP双试剂微板法)

总胆固醇(TC)检测试剂盒(COD-PAP 双试剂微板法)
简介:
胆固醇(Cholesterol)又称胆甾醇,是一种环戊烷多氢菲的衍生物,分子式C 27H 46O ,分子量为3860.65。胆固醇广泛存在于动物体内,其中脑、神经组织最丰富,在肾、脾、皮肤、肝和胆汁中含量也较高。
Leagene 总胆固醇(TC)检测试剂盒(COD-PAP 双试剂微板法)又称胆固醇氧化酶法或胆固醇氧化酶-过氧化物酶偶联法等,血液中的胆固醇约1/3为游离胆固醇,2/3为与脂肪酸结合的胆固醇酯,后者被CEH 水解为游离胆固醇,使4-氨基安替比林与酚(三者合称PAP)反应,生成红色醌亚胺色素(Trinder 反应)。分光光度计在500~520nm 处进行比色测定。本试剂盒用于人或动物的血清、血浆、脑脊液、细胞、组织等样本中的总胆固醇含量定量测定。本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
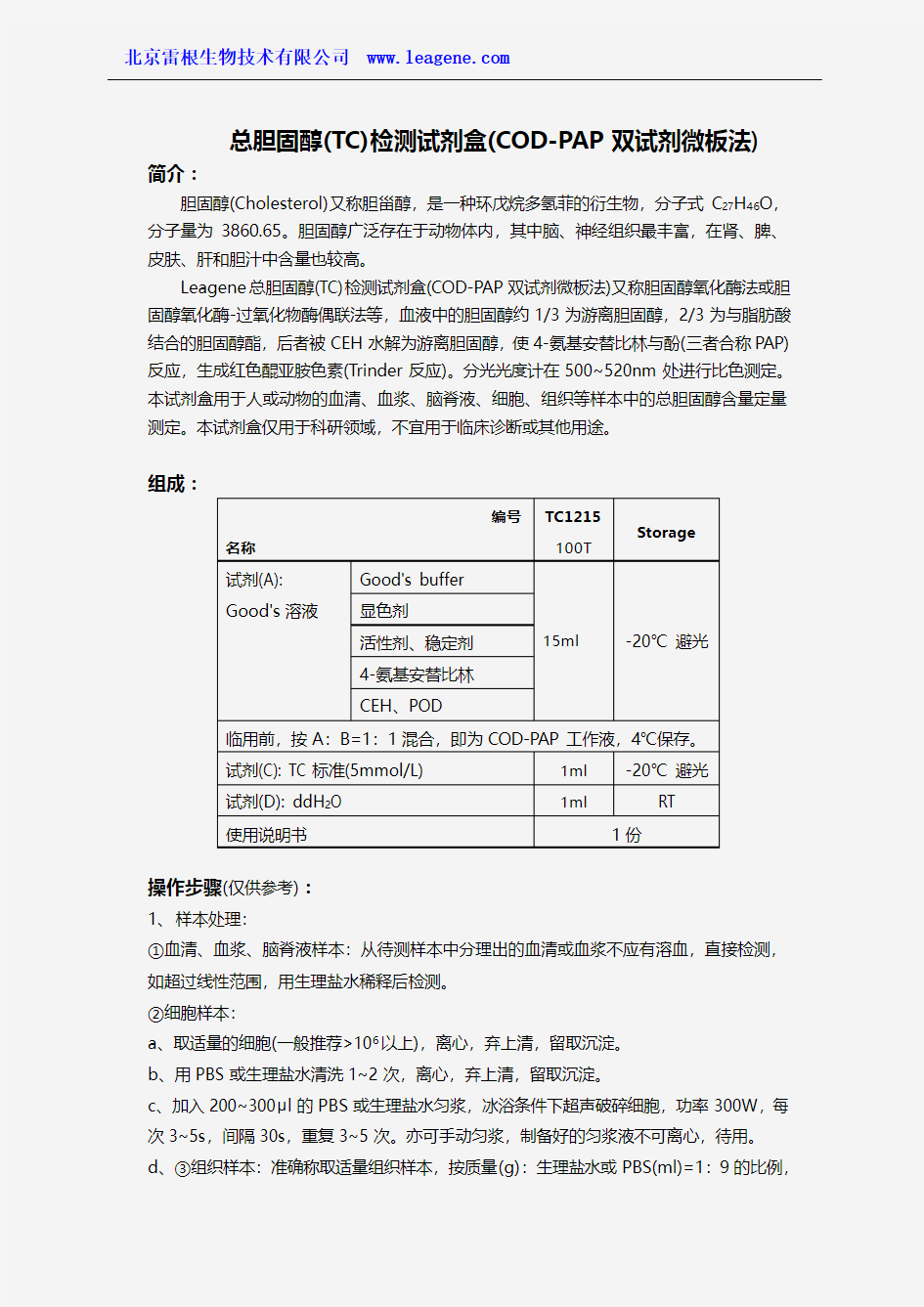
组成:
操作步骤(仅供参考):
1、 样本处理:
①血清、血浆、脑脊液样本:从待测样本中分理出的血清或血浆不应有溶血,直接检测,如超过线性范围,用生理盐水稀释后检测。 ②细胞样本:
a 、取适量的细胞(一般推荐>106以上),离心,弃上清,留取沉淀。
b 、用PBS 或生理盐水清洗1~2次,离心,弃上清,留取沉淀。
c 、加入200~300μl 的PBS 或生理盐水匀浆,冰浴条件下超声破碎细胞,功率300W ,每次3~5s ,间隔30s ,重复3~5次。亦可手动匀浆,制备好的匀浆液不可离心,待用。
d 、③组织样本:准确称取适量组织样本,按质量(g):生理盐水或PBS(ml)=1:9的比例,
编号 名称
TC1215100T
Storage
试剂(A): Good's 溶液
Good's buffer 15ml
-20℃ 避光
显色剂
活性剂、稳定剂 4-氨基安替比林 CEH 、POD
临用前,按A :B=1:1混合,即为COD-PAP 工作液,4℃保存。 试剂(C): TC 标准(5mmol/L) 1ml -20℃ 避光
试剂(D): ddH 2O 1ml
RT 使用说明书
1份
加入生理盐水或PBS,冰浴条件下手动或机械匀浆。离心,取上清待用。
2、酶标仪TC测定操作:
①按下表依次加入试剂:
空白孔标准孔待测孔ddH2O(μl) 3
TC标准(5mmol/L)(μl) 3
待测样本(μl) 3
COD-PAP工作液(μl) 300 300 300
②充分混匀,水浴中孵育。
③酶标仪测定500~520nm吸光度。以空白管调零,读取标准管和各待测管的吸光度。
3、分光光度计(1ml比色杯)、半自动生化分析仪TC测定操作:
①按下表依次加入试剂:
空白管标准管待测管ddH2O(μl) 10
TC标准(5mmol/L)(μl) 10
待测样本(μl) 10
COD-PAP工作液(ml) 1.0 1.0 1.0
②充分混匀, 水浴中孵育。
③分光光度计测定500~520nm吸光度。以空白管调零,读取标准管和各待测管的吸光度。
4、普通分光光度计(2ml比色杯)TC测定操作:
①按下表依次加入试剂:
空白管标准管待测管ddH2O(μl) 20
TC标准(5mmol/L)(μl) 20
待测样本(μl) 20
COD-PAP工作液(ml) 2.0 2.0 2.0
②充分混匀,水浴中孵育。
③分光光度计测定500~520nm吸光度。以空白管调零,读取标准管和各待测管的吸光度。
5、全自动生化分析仪TC测定操作:
①按下表依次加入试剂:
空白管标准管待测管ddH2O(μl) 3
TC标准(5mmol/L)(μl) 3
待测样本(μl) 3
COD-PAP工作液(μl) 300 300 300
②充分混匀,水浴中孵育。
③全自动生化分析仪测定500~520nm波长处吸光度。以空白管调零,读取标准管和各待测管的吸光度。
机器参数:
主波长/次波长500/600nm
反应类型终点法
反应方向升反应(+)
计算公式:
血清、血浆等液体样本(空白调零):
TC(mmol/L)={(待测管吸光度-空白吸光度)/(标准管吸光度-空白吸光度)}×5mmol/L 血清、血浆等液体样本(全自动生化分析仪):
TC(mmol/L)=(待测管吸光度/(标准管吸光度)×5mmol/L
细胞、组织等样本(空白调零):
TC(mmol/L)={(待测管吸光度-空白吸光度)/(标准管吸光度-空白吸光度)}×5mmol/L÷待测样本浓度(mg/ml)
细胞、组织等样本(全自动生化分析仪):
TC(mmol/L)=(待测管吸光度/(标准管吸光度)×5mmol/L÷待测样本浓度(mg/ml)
参考区间:
健康成年人理想范围:<5.2mmol/L(<200mg/dl)
边缘升高:<5.23~5.69mmol/L(201~219mg/dl)
升高:≥5.72mmol/L(≥220mg/dl)
备注:TC标准(5mmol/L)=442.48mg/dl
性能指标:
外观无色至淡黄色澄清液体
线性范围0.1~13mmol/L(3.6~500mg/dl),R2>0.95
灵敏度检测下限0.1mmol/L(3.6mg/dl)
变异系数批内<3%,批间<5%
空白吸光值<0.1(1cm光径)
干扰因素胆红素<410μmol/L;血红蛋白<7g/L;甘油
三脂<28.5mmol/L时,对结果无明细影响。
稳定性密闭,12个月
注意事项:
1、上述低温试剂避免反复冻融,以免失效或效率下降。
2、本法可直接用于检测脑脊液中的TC含量,但不能直接检测尿液中的TC含量,因为未
经处理的尿液中含有还原性物质,影响过氧化物酶反应。
3、待测样本如不能及时测定,应置于2~8℃保存,3天内稳定。
乳酸检测试剂盒(乳酸脱氢酶微板法)
乳酸检测试剂盒(乳酸脱氢酶微板法) 简介: 乳酸(Lactic acid ,LD)又称2-羟基丙酸是一种化合物,是一种含有羟基的羧酸,分子式是C 3H 6O 3,参与生物化学很多反应过程。 乳酸检测试剂盒(乳酸脱氢酶微板法)其检测原理是在NAD 存在条件下,乳酸脱氢酶(LDH)催化乳酸生成丙酮酸,同时生成NADH 。在碱性条件下显色剂与丙酮酸生成复合物,并使平衡偏向乳酸氧化为丙酮酸的方向,驱动反应完成,生成的NADH 与乳酸为等量摩尔。通过分光光度比色法(酶标仪)测定340nm 处吸光度,据此通过比色分析就可以计算出LD 水平。该试剂盒可用于检测细胞或组织的裂解液或匀浆液、血浆、血清等样品中内源性的乳酸含量。该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 操作步骤(仅供参考): 1、 准备样品: ①_x0001_ 血浆、血清、尿液及其他体液样品:血浆、血清按照常规方法制备后可以直接用于本试剂盒的测定,尿液通常也可以直接用于测定,-20℃冻存。 ②_x0001_ 细胞或组织样品:取恰当细胞或组织裂解液,如果有必要需进行适当匀浆,低速离心取上清,-20℃冻存,用于LD 的检测。 ③_x0001_ 高浓度样品:如果样品中含有较高浓度的LD ,可以使用原有的裂解液或 PBS 等进行稀释,如鸡血清、血浆可稀释5~10倍后检测。 2、 配制标准品工作液:取乳酸标准(20mmol/L) 0.1ml 溶解于0.3ml 乳酸标准稀释液,使 浓度达到5mmol/L ,即为标准品工作液-乳酸标准(5mmol/L)。4℃避光保存2个月有效。 编号 名称 TC0731 110T Storage 试剂(A): 乳酸标准(20mmol/L) 1ml -20℃ 避光 试剂(B): 乳酸标准稀释液 1ml RT 试剂(C): LD 显色液 C1: LD Assay buffer 5ml 4℃ 避光 C2: NAD 2支 -20℃ 避光 C3: LDH solution 15μl -20℃ 避光 试剂(D): LD 终止液 30ml RT 使用说明书 1份
生产过程防止污染、交叉污染、混淆和差错的管理规范流程
生产过程防止污染、交叉污染、混淆和差错的管理规程目的:建立防止污染、交叉污染、混淆和差错管理规程,规定了在药品生产活动过程中防止污染、交叉污染、混淆和差错管理容和要求 适用围:适用于药品生产活动过程中防止污染、交叉污染、混淆和差错的管理 职责:生产技术部、质保部、车间对实施本规程负责 容: 1.定义 1.1污染:在生产、取样、包装或重新包装、贮存或运输等操作过程中,原辅料、中间产品、待包装产品、成品受到具有化学或微生物特性的杂质或异物的不利影响。 1.2 交叉污染:不同原料、辅料及产品之间发生的相互污染。 1.3混淆:在生产或包装的过程中,误将一种或一批物料当成了另一种或另一批物料进行使用、操作。 1.4 差错:在生产过程中,因为计量器具未调试到位、或计量方式不正确、或计数不准确而造成的错误 2. 产生污染、交叉污染、混淆和差错的原因 2.1 人员:操作人员患有传染病、皮肤病等,或未接受卫生方面的培训,未按要求穿戴工作服,行为不规、人员带来外部污染,生产人员未按工艺规程和SOP要求操作,工作责任心不强,工作量过大,操作中随意性大等。 2.2 设备:表面不光洁、平整,材质不稳定,不易清洁,设备选型不合理,维修、保养不及时,没有定期验证或没有保持验证状态。生产中使用的设备、容器无状态标志,清场不彻底等造成混淆。 2.3 物料:购进的原辅料本身质量不好,或在运输、贮存、检验取样、配料过程中造成污染。原辅料微生物指标超限。原辅料、包装材料、半成品、中间体等无明显标志,放置混乱,散装或放在易破损的包装中,印刷性包装材料管理不善等。 2.4 文件:文件管理制度不健全,或执行不力,无复核、监控,发现问题未及时查找原因等,特别是配料、包装等重要部门管理不严格。 2.5 环境:厂房设计不合理,生产环境如空气中粒子过多,车间地面、墙壁、天花板等不平整、易脱落、长霉、消毒不严格等造成污染。 2.6 清洁:清洁效果不能保证微生物除去水平及残留限度,清洁剂残留、消毒剂效果不能保证;生产结束后不及时清洁清场等造成污染。
碱性磷酸酶检测试剂盒(PNP微板法)
碱性磷酸酶检测试剂盒(PNP 微板法) 产品简介: 碱性磷酸酶(Alkaline phosphatase ,简称ALP 或AKP)为一类磷酸酯酶,广泛分布于哺乳动物组织内,其活性所需最适pH 9.2~9.8。此酶主要存在于物质交换活跃之处(细胞膜),如肠上皮和肾近曲小管的刷状缘、附睾上皮之静纤毛、肝的毛细胆管膜以及微动脉和毛细血管动脉部之内皮,还见于内质网、高尔基复合体、吞饮小泡、肠上皮之溶酶体、中性粒细胞之中性颗粒以及平滑肌的细胞膜。 Leagene 碱性磷酸酶检测试剂盒(PNP 微板法)(Alkaline Phosphatase Colorimetric Assay Kit)采用PNP 比色法,其检测原理是Para-nitrophenyl phosphate (pNPP)为一种常用的磷酸酶显色底物,在酸性条件下,可在碱性磷酸酶的作用下生成p -nitrophenol 。在碱性条件下p -nitrophenol 转变成醌式结构,呈较深的黄色,产物黄色越深,说明碱性磷酸酶活性越高,反之则酶活性越低,通过分光光度比色法测定处吸光度,据此通过比色分析就可以计算出碱性磷酸酶活性水平。该试剂盒可用于检测细胞或组织的裂解液或匀浆液、血浆、血清、尿液等样品中内源性的碱性磷酸酶活性。该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 产品组成: 自备材料: 1、 水浴锅或恒温箱 2、 96孔板 3、 酶标仪 操作步骤(仅供参考): 1、 配制显色工作液: 取出1支pNPP ,恢复至室温后溶解于ALP Assay buffer ,混匀, 冰上预冷备用。新配制的显色工作液应在6h 内用完。 2、 配制标准品工作液:取出p -nitrophenol(10mM)恢复至室温后,取10μl 溶解于190μ 编号 名称 TE0002 100T Storage 试剂(A): ALP Assay buffer 15ml 4℃ 试剂(B): pNPP 2支 -20℃ 避光 试剂(C): p -nitrophenol(10mM) 0.1ml -20℃ 避光 使用说明书 1份
GMP生产过程中防止污染与交叉污染措施评估
*****制药有限公司系统风险评估报告 生产过程中污染 与交叉污染控制措施评估报告 编号:
一、概述 我公司自2004年通过GMP 认证至今已近十年,各项措施已不断完善。做为GMP 的宗旨之一的防止污染和交叉污染措施,是生产过程中需要不断改进的主要工作之一。现行的生产过程中的防止污染与交叉污染的措施是以前按照一种自发的风险降低的理念进行设计的,按照新版GMP 引入的风险管理的原则,这些措施的有效性需要进行评估,另外,按照风险管理的理论,还需要对生产过程中可能存在的其他能引起污染和交叉污染的环节进行评估和控制。 二、风险评估的流程与依据 按照药品生产质量管理规范和我公司《风险管理规程》MZ-ZL-SMP-003规定,按以下程序进行控制。 三、风险评估工具选择 由于该项目的系统性较强,包含了较多个子项目和诸多影响因素,且各子项目的风险程度可通过其失败后的影响进行评价,故选择使用失效模式与影响分析(FMEA )来进行评价。
该评价方式包括以下几个方面: 1.风险严重性(S):风险对环境、产品的污染、危害的严重程度。可分为四个等级,描述如下: 2.发生的可能性(P):评估风险产生的可能性。根据积累的经验、硬件软件保障水平或其他可能的评价来确定。可分为四个等级,描述如下: 3.可检测性(D):潜在风险发生或造成危害前,检测、发生的可能性。分为四个等级,描述如下: 4.RPN(风险优先系数)计算,即将严重性、可能性和可检测性的等级分值相乘的积:RPN=S×P×D 高风险定义:当RPN系数大于16时为高风险,此风险为不可接受风险,必须尽快采取措施降低风险水平。 中等风险定义:当RPN系数介于9-16时(含16)为中等风险,此风险需控制的等级,应在生产过程中予以注意并予以改进。 低风险定义:当RPN系数不大于8时为低风险,此风险为可接受风险。
丙氨酸氨基转移酶(ALT)检测试剂盒(赖氏微板法)
丙氨酸氨基转移酶(ALT)检测试剂盒(赖氏微板法) 简介: Leagene 丙氨酸氨基转移酶(ALT)检测试剂盒(赖氏微板法)其检测原理是丙氨酸氨基转移酶催化丙氨酸与α-酮戊二酸之间的氨基转移反应,在ALT 催化下,其反应公式如下: L-丙氨酸+α-酮戊二酸→丙酮酸+L-谷氨酸。 二硝基苯肼与α-酮酸反应,生成相应的二硝基苯腙,在碱性条件下,二硝基苯腙的吸收光谱有差异,通过酶标仪检测在500-520nm 处差异最大,以等摩尔浓度计算出丙酮酸的生成量,进而计算酶的活性。 组成: 操作步骤(仅供参考): 1、 准备样品: ①_x0001_ 血浆、血清样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的 测定,-20℃保存1个月有效,用于ALT/GPT 的检测。 ②_x0001_ 细胞或组织样品:取恰当细胞或组织进行匀浆,低速离心取上清,-20℃保存 1个月有效,用于ALT/GPT 的检测。 ③_x0001_ (选做)样品准备完毕后可以用BCA 蛋白浓度测定试剂盒测定蛋白浓度,以便 于后续计算单位蛋白重量组织或细胞内的ALT/GPT 含量。 2、 制作ALT 标准曲线:取适量的丙酮酸标准(100mmol/L),按丙酮酸标准(100mmol/L): 丙酮酸标准稀释液=1:49的比例混合,即为丙酮酸标准工作液-丙酮酸标准(2mmol/L),按下表制备标准曲线。最好设定平行检测管,求平均值。 编号 名称 TE0121 100T Storage 试剂(A): 丙酮酸标准(100mmol/L) 1ml 4℃ 避光 试剂(B): 丙酮酸标准稀释液 2ml RT 试剂(C): 标准对照液 2ml 4℃ 试剂(D): ALT assay buffer 3ml -20℃ 避光 试剂(E): 二硝基苯肼显色液 3ml 4℃ 避光 试剂(F): ALT 显色基液 25ml RT 使用说明书 1份 加入物 0 1 2 3 4 丙酮酸标准(2mmol/L)(μl) 2 4 6 8
实验七__胆固醇氧化酶法测定血清总胆固醇
生物化学与分子生物学设计实验 (胆固醇氧化酶法测定血清总胆固醇及二乙酰一肟 法测定血清尿素) 小组成员: 班级:麻醉11-2班 日期:2012年12月19 胆固醇氧化酶法测定血清总胆固醇及二乙酰一肟法 测定血清尿素
实验目的 1、掌握酶法测定总胆固醇的原理和方法。 2、学习用比色法测定血清尿素。 3、巩固有关胆固醇和尿素的知识。 4、进一步熟练UV2100型分光光度计的 重点、难点: 重点:1、氧化酶法测定总胆固醇的原理 2、二乙酰一肟法测定血清尿素的注意事项 难点:氧化酶法测定总胆固醇的原理 一、实验原理 (一)氧化酶法测定血清总胆固醇 血清总胆固醇(TC)包括:游离胆固醇(FC)和胆固醇酯(CE)两部分。本实验是胆固醇酯酶、胆固醇氧化酶和过氧化物酶相偶联发生的偶联反应。 第一步:血清胆固醇酯可被胆固醇酯酶水解为游离胆固醇和游离脂肪酸(FFA) 。 第二步:胆固醇在胆固醇氧化酶的氧化作用下生成△4-胆甾烯酮和H2O2。 第三步:H2O2在4-氨基安替比林和酚存在时,经过氧化物酶催化,反应生成苯醌亚胺非那腙的红色醌类化合物,其颜色深浅与标本中TC含 量成正比。 (二)二乙酰一肟法测定血清尿素 二乙酰在强酸条件下与尿素缩合成红色的4,5-二甲基-2-氧咪唑化合物,颜色深浅与尿素含量成正比。因二乙酰不稳定,故由试剂中二乙酰一肟与强酸作用产生二乙酰。 二、操作步骤 (一)氧化酶法测定血清总胆固醇
终点法检测TC,取试管3支按下表依次加样。 酶法测定TC操作步骤 加入物(μl) 空白管标准管测定管血清--20 标准液或定值血清-20 -蒸馏水20 -- 酶试剂 1 000 1 000 1 000 混匀后,37℃保温10 min,每管加3ml水混匀,用分光光度计比色,于500 nm波长处以空白管调零,读出各管吸光度。 (二)二乙酰一肟法测定血清尿素 取试管3支,按下表依次加样。 二乙酰一肟法操作步骤 加入物(ml) 空白管标准管测定管 血清--0.02 尿素标准应用液-0.02 - 蒸馏水0.02 -- 二乙酰一肟溶液0.5 0.5 0.5 酸性试剂 5.0 5.0 5.0 混匀,置沸水浴加热12min,取出置冷水中冷却5min,以空白管调零,在540nm处读取各管吸光度。 三、注意事项 (一)氧化酶法测定血清总胆固醇 1、最后加酶试剂,各管反应时间应一致; 2、比色应在30min内完成; 3、试管在操作前尽量保持干燥; 4、试剂中酶的质量影响测定结果;
总胆固醇(TC)检测试剂盒(COD-PAP单试剂比色法)
总胆固醇(TC)检测试剂盒(COD-PAP 单试剂比色法) 简介: 胆固醇(Cholesterol)又称胆甾醇,是一种环戊烷多氢菲的衍生物,分子式C 27H 46O ,分子量为3860.65。胆固醇广泛存在于动物体内,其中脑、神经组织最丰富,在肾、脾、皮肤、肝和胆汁中含量也较高。 Leagene 总胆固醇(TC)检测试剂盒(COD-PAP 单试剂比色法)又称胆固醇氧化酶法或胆固醇氧化酶-过氧化物酶偶联法等,血液中的胆固醇约1/3为游离胆固醇,2/3为与脂肪酸结合的胆固醇酯,后者被CEH 水解为游离胆固醇,使4-氨基安替比林与酚(三者合称PAP)反应,生成红色醌亚胺色素(Trinder 反应)。分光光度计在500~520nm 处进行比色测定。本试剂盒用于人或动物的血清、血浆、脑脊液、细胞、组织等样本中的总胆固醇含量定量测定。本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 操作步骤(仅供参考): 1、 样本处理: ①血清、血浆、脑脊液样本:从待测样本中分理出的血清或血浆不应有溶血,直接检测,如超过线性范围,用生理盐水稀释后检测。 ②细胞样本: a 、取适量的细胞(一般推荐>106以上),离心,弃上清,留取沉淀。 b 、用PBS 或生理盐水清洗1~2次,离心,弃上清,留取沉淀。 c 、加入200~300μl 的PBS 或生理盐水匀浆,冰浴条件下超声破碎细胞,功率300W ,每次3~5s ,间隔30s ,重复3~5次。亦可手动匀浆,制备好的匀浆液不可离心,待用。 ③组织样本:准确称取适量组织样本,按质量(g):生理盐水或PBS(ml)=1:9的比例,加入生理盐水或PBS ,冰浴条件下手动或机械匀浆。离心,取上清待用。 2、 分光光度计(1ml 比色杯)、半自动生化分析仪TC 测定操作: 编号 名称 TC1213100T Storage 试剂(A): COD-PAP 工作液 Good's buffer 2×50ml -20℃ 避光 胆固醇氧化酶 胆固醇激酶 稳定剂 试剂(B): TC 标准(5mmol/L) 1ml -20℃ 避光 试剂(C): ddH 2O 1ml RT 使用说明书 1份
防止洁净室交叉污染的重要措施
防止洁净室交叉污染的重要措施 防止差错、污染与交叉污染的发生是GMP的核心之一。交叉污染是指通过人员往返、工具运输、物料传递、空气流动、设备清洗与消毒、岗位清场等途径,将不同品种的成分混入导致污染,或因人为、工器具、物料、空气等不恰当的流向,使洁净度低的区域的污染物传入洁净度高的区域,而造成交叉污染。那么,如何防止交叉污染呢?2002年实施的《洁净厂房设计规范》明确指出,洁净厂房“工艺平面布置应合理、紧凑。洁净室或洁净区内只布置必要的工艺设备以及有空气洁净度要求的工序和工作室”。 ■合理布置空间面积 合理布局首先要理顺工艺流程,避免迂回往返。工作室的平面空间应合理,既有利于操作,又便于维修,不应预留闲置面积和空间。合理的空间与面积,也有利于合理的分区,防止混杂事故。 应该引起注意的是:洁净室并非越大越好,面积和空间的大小关系着送风量的多少,决定着空调能耗的大小,影响工程的投资。但洁净室的空间面积也不可太小,太小可能不便于操作、维修。所以,设计合理的空间面积应考虑到设备操作、维修的需要。生产区和储存区应有与生产规模相适应的空间面积,用以安置设备、物料,便于操作和维修。一般洁净室高度控制在2.60米,对个别较高的设备可在局部加高,而不宜全面提高洁净区的高度。车间内部应设有物料的中间站,其面积足以存放物料、中间产品、待验品和成品,且便于明确分区,以最大限度地减少差错和交叉污染。 ■提高设备水平 设备的材质、加工精度、密闭程度以及管理制度都与交叉污染有关。所以除了合理布局外,提高设备的自动化水平和组成联动的生产线,以减少操作人员,降低人员的活动频率,是防止交叉污染的必要措施。
苹果酸脱氢酶检测试剂盒(OAA微板法)
苹果酸脱氢酶(MDH)检测试剂盒(OAA微板法) 简介: 苹果酸脱氢酶(Malate Dehydrogenase, MDH)是合成苹果酸的关键酶之一,催化苹果酸和草酰乙酸(OAA)的相互转化,参与众多生理代谢途径如TCA循环C4循环脂肪酸的氧化呼吸作用氮同化等,因此MDH在植物的生长发育中发挥着重要作用,广泛存在于线粒体、细菌细胞膜上,为三羧酸循环中的一种酶,由于酶的来源不同,其某些性质也不尽相同。MDH在细胞多种生理活动中扮演着重要的角色,包括线粒体的能量代谢、苹果酸-天冬氨酸穿梭系统、活性氧代谢和抗病性等。根据不同的辅酶特异性,MDH分为NAD-依赖的MDH和NADP-依赖的MDH,细菌中通常只含有NAD-MDH,在真核细胞中,NAD-MDH 分布于细胞质和线粒体中。 Leagene苹果酸脱氢酶(MDH)检测试剂盒(OAA微板法)检测原理是在弱碱条件下,以草酰乙酸(OAA)作为显色底物,OAA在MDH催化下被NADH还原为苹果酸(Mal),每催化1分子OAA消耗1分子NADH,通过分光光度比色法(酶标仪)测定处吸光度的变化,计算出NADH的消耗速率进一步推算出苹果酸脱氢酶活性水平。该试剂盒主要用于检测植物样本、血清等中苹果酸脱氢酶活性。该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 自备材料: 1、研钵或匀浆器 2、离心管或试管 3、低温离心机 4、96孔板 5、酶标仪 操作步骤(仅供参考):编号 名称TE0461 100T Storage 试剂(A): MDH Lysis buffer 250ml 4℃避光试剂(B): PMSF 1ml -20℃ 试剂(C): MDH Assay buffer20ml RT 试剂(D): NADH 1支-20℃ 试剂(E): ddH2O 10ml RT 使用说明书1份
实验三血清总胆固醇的测定
实验三血清总胆固醇的测定 目的要求 了解并掌握胆固醇测定的原理和方法。 实验原理 血清胆固醇(chol)测定是动脉粥样硬化性疾病防治、临床诊断和营养研究的重要指标。正常人血清胆固醇含量范围为100 ~ 250mg/mL。 胆固醇是环戊烷多氢菲的衍生物,它不仅参与血浆蛋白的组成,而且也是细胞的必要结构成分,还可以转化成胆汁酸盐、肾上腺皮质激素和维生素D等。胆固醇在体内以游离胆固醇及胆固醇酯两种形式存在,统称总胆固醇。总胆固醇的测定有化学比色法和酶学方法两类。本实验采用前一种方法。 胆固醇及其酯在硫酸作用下与邻苯二甲醛产生紫红色物质,此物质在550nm波长处有最大吸收。因此,可用比色法作总胆固醇的定量测定。胆固醇含量在400mg/100mL以内时,与光吸收值呈良好线性关系。 本法不必离心,颜色产物也比较稳定。 试剂和器材 一、试剂 邻苯二甲醛试剂:称取邻苯二甲醛50mg,以无水乙醇溶至50mL冷藏,有效期为一个半月。 混合酸:冰乙酸100mL与浓硫酸100mL混合。 标准胆固醇贮存液(1mg/mL):准确称取胆固醇100mg,溶于冰乙酸中,定溶至100mL。 标准胆固醇工作液(0.1mg/mL):将上述贮存液以冰乙酸稀释10倍,即取10mL用冰乙酸稀释至100mL。 二、测试样品 0.1mL人血清以冰乙酸稀释至4.00mL。 三、器材 试管1.5×15cm(×11);移液枪,量筒50mL分光光度计。 操作方法 一、制作标准曲线 取9支试管编号后,按下表顺序加入试剂:
加毕,温和混匀,20~37℃下静置10分钟,在550nm波长处测定光吸收值。以总胆固醇量(mg%)为横坐标,光吸收值为纵坐标做出标准曲线。 二、样品测定 取3支试管编号后,分别加入试剂,与标准曲线同时作比色测定: 加毕,温和混匀,20~37℃下静置10分钟,在550nm下测定光吸收值。然后,从标准曲线上可查出样品中总胆固醇的含量。 注意事项 1.本法在20~37℃条件下显色。 2.混合酸粘度比较大,颜色容易分层,比色前一定要混匀。 思考题 1. 本实验操作中特别需要注意些什么?为什么? 2. 酯类难溶于水,将它们均匀分散在水中则形成乳浊液,为什么正常人血浆和血清中含有酯类虽多,但却清澈透明?
防止污染与交叉污染措施评估
郑州民众制药有限公司系统风险评估报告 生产过程中污染 与交叉污染控制措施评估报告 编号:
一、概述 我公司自2004年通过GMP 认证至今已近十年,各项措施已不断完善。做为GMP 的宗旨之一的防止污染和交叉污染措施,是生产过程中需要不断改进的主要工作之一。现行的生产过程中的防止污染与交叉污染的措施是以前按照一种自发的风险降低的理念进行设计的,按照新版GMP 引入的风险管理的原则,这些措施的有效性需要进行评估,另外,按照风险管理的理论,还需要对生产过程中可能存在的其他能引起污染和交叉污染的环节进行评估和控制。 二、风险评估的流程与依据 按照药品生产质量管理规范和我公司《风险管理规程》MZ-ZL-SMP-003规定,按以下程序进行控制。 三、风险评估工具选择 由于该项目的系统性较强,包含了较多个子项目和诸多影响因素,且各子项目的风险程度可通过其失败后的影响进行评价,故选择使用失效模式与影响分析(FMEA )来进行评价。
该评价方式包括以下几个方面: 1.风险严重性(S):风险对环境、产品的污染、危害的严重程度。可分为四个等级,描述如下: 2.发生的可能性(P):评估风险产生的可能性。根据积累的经验、硬件软件保障水平或其他可能的评价来确定。可分为四个等级,描述如下: 3.可检测性(D):潜在风险发生或造成危害前,检测、发生的可能性。分为四个等级,描述如下: 4.RPN(风险优先系数)计算,即将严重性、可能性和可检测性的等级分值相乘的积:RPN=S×P×D 高风险定义:当RPN系数大于16时为高风险,此风险为不可接受风险,必须尽快采取措施降低风险水平。 中等风险定义:当RPN系数介于9-16时(含16)为中等风险,此风险需控制的等级,应在生产过程中予以注意并予以改进。 低风险定义:当RPN系数不大于8时为低风险,此风险为可接受风险。
总胆固醇测定试剂注册技术审查指导原则
总胆固醇测定试剂注册技术审查指导原则 本指导原则旨在指导注册申请人对总胆固醇(Total cholesterol,TC)测定试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对总胆固醇测定试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。 本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。 本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。 一、适用范围 本指导原则所指的总胆固醇测定试剂是指利用CHOD-PAP法对人血清、血浆等样本中总胆固醇含量进行体外定量测定的试剂。 目前,总胆固醇测定已有完整的参考系统:其决定性方法为同位素稀释质谱法,参考方法为正己烷抽提L-B反应显色法(ALBK法)或色谱法,常规测定方法为酶法。酶法主要包括胆固醇氧化酶法和胆固醇脱氢酶法,其中胆固醇氧化酶-PAP法是目前应用最为广泛的常规测定方法。依据YY/T 1227-2014《临床化学体外诊断试剂(盒)命名》的要求,将
胆固醇氧化酶-PAP法规范表述为CHOD-PAP法。本指导原则适用于采用CHOD-PAP法测定的试剂,不适用于脱氢酶法和干化学法测定的试剂,但适用处可参照执行。 依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),总胆固醇测定试剂属于酯类检测试剂,管理类别为Ⅱ类,分类编码为6840。本指导原则适用于进行产品注册和相关许可事项变更的产品。 二、注册申报资料要求 (一)综述资料 综述资料主要包括产品预期用途、产品描述、有关生物安全性说明、产品主要研究结果的总结和评价以及同类产品上市情况等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。 1.产品预期用途 总胆固醇是指血液中各脂蛋白所含胆固醇之总和,分为酯化型胆固醇(又称胆固醇酯,CE)和游离型胆固醇(FC),其中CE占60%~70%,FC占30%~40%,健康个体之间两种类型的比例保持稳定。胆固醇是合成肾上腺皮质激素、性激素、胆汁酸以及维生素D等生理活性物质的重要原料,也是构成细胞膜的主要成分,其浓度可作为脂代谢的指标。 定量测定人体样本中总胆固醇含量,临床主要用于心血管疾病的危险分析,高TC血症是冠心病的主要危险因素之一。病理状态下,高TC有原发与继发两类,原发的如家族性高胆固醇血症(低密度脂蛋白受体缺陷)、家族性apoB缺陷症、多源性高TC、混合性高脂蛋白血症。继发的多见于
防止生产过程污染和交叉污染的管理规程
防止生产过程污染和交叉污染的管理规程 2011-07-28 18:12:56| 分类:工作【GMP知识】| 标签:|字号大中小订阅 1 目的:建立防止生产过程污染和交叉污染的管理规程,最大限度地降低药品生产过程中污 染、交叉污染的风险。 2 范围:适用于防止生产区、化验区与仓贮区在生产过程污染和交叉污染的管理。 3 职责:生产区、化验区与仓贮区人员负责实施,QA检查员及各部门负责人负责监督执行。 4 内容 4.1 定义 4.1.1 污染:在生产、取样、包装或重新包装、贮存或运输等操作过程中,原辅料、中间产品、 待包装产品、成品受到具有化学或微生物特性的杂质或异物的不利影响。 4.1.2 交叉污染:不同原料、辅料及产品之间发生的相互污染。 4.2 防止人员污染和交叉污染: 4.2.1 所有人员都应当接受卫生要求的培训,人员操作严格执行《人员卫生操作规程》,最大 限度地降低人员对药品生产造成污染的风险。 4.2.2 各级管理人员严格监控防止体表有伤口、患有传染病或其他可能污染药品疾病的人员 从事直接接触药品的生产。可能患有污染药品疾病的人员必须积极主动地配合主管部门的管理要求。 4.2.3 控制进入洁净区的人和物的数量。执行《参观人员进出生产区的管理规程》。 4.2.4 进入洁净区的人和物严格执行《人员进出洁净区的净化程序》和《物料、容器、工具 进出洁净区的净化程序》。 4.2.5 进入洁净区的操作人员不得随意离开自己的工作区域(需对岗位培训)而进入其它操 作间,确需进入时,应再次执行《人员进出洁净区净化程序》后方可进入。 4.2.6 工作人员在需要进出公共区时,不能同时进出,防止交叉污染。 4.3 防尘措施:生产中对洁净区产尘操作区域进行控制,采取以下方法防止粉尘扩散、避免 交叉污染的,并在此基础上不断改进防止尘埃产生和扩散的有效措施。 4.3.1 工艺过程产生粉尘的工序的操作应在负压称量室进行,负压称量室设置独立的除尘系 统。 4.3.2 洁净室密闭,不使外界未经净化的空气进入洁净厂房,必须定期检查送风口、灯罩、安全 门等是否有泄漏点。 4.3.3 洁净室的地面,墙壁和顶棚等要保持无尘、光滑、无静电,并能经得起清洁、消毒,一旦发 生涂层脱落应及时修补。 4.3.4 洁净室内的设备安装在近送风口处,产尘设备有吸尘装置。 4.3.5 按不同生产需要,房间与走廊必须保持正常的压差,工作间房门必须经常关闭,以保持压 差梯度。 4.3.6 员工操作时对于易产尘的物料要轻拿轻放,尽量避免产生粉尘。 4.3.7 洁净级别较高的A、B级设置专门的房间或区域并采用单向气流保护操作面。 4.4 防止厂房设施的污染和交叉污染 4.4.1 厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大 限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。厂房地理需要控制的原则性要求,进行风险防范,避免周围环境的影响,远离污染源。例如:铁路、码头、机场、火电厂、垃圾处理场等等。另外,需要考虑其厂区地理位置的常年主导风向,是否处于污染源的上风向侧,避免受到污染的风险发生。 4.4.2 厂房建筑布局应考虑风向的影响,动物房、锅炉房、产尘车间等潜在污染源应位于下风
单胺氧化酶(MAO)检测试剂盒(醛苯腙微板法)
单胺氧化酶(MAO)检测试剂盒(醛苯腙比色法) 简介: 单胺氧化酶(Monoamine Oxidase ,MAO)是一组催化多种单胺类化合物氧化脱氨的酶,属于细胞外酶,含有铜离子,分布于肝脏、肾脏等组织的线粒体内,其含量分布为肝脏>心脏>肾脏>脑>肺>骨骼肌。血小板、胎盘中也含有MAO 。线粒体中的MAO 与膜紧密结合,仅少量为可溶性的,存在于细胞质中,血液和结缔组织中的MAO 为水溶性。 Leagene 单胺氧化酶(MAO)检测试剂盒(醛苯腙比色法)其检测原理是待测样品在MAO 作用下,氧化底物苄胺生成苄醛,后者经催化反应生成醛苯腙,呈棕红色,通过酶标仪检测吸光度,根据标准曲线即可测出MAO 活力。该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 自备材料: 1、 蒸馏水 2、 离心管或小试管 3、 比色杯 4、 分光光度计 操作步骤(仅供参考): 1、 准备样品: ①血浆、血清和尿液样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的测定,尿液通常也可以直接用于测定,冻存,用于MAO 的检测。 ②细胞或组织样品:取恰当细胞或组织进行匀浆,低速离心取上清,冻存,用于MAO 的检测。 高活性样品:如果样品中含有较高活性的MAO ,可以使用MAO Assay buffer 稀释。 编号 名称 TE0251 100T Storage 试剂(A): 苄醛标准(5mmol/L) 1ml 4℃ 避光 试剂(B): MAO Assay buffer 50ml RT 试剂(C): 苄胺缓冲液 5ml 4℃ 避光 试剂(D): 苄醛显色液 2.5ml 4℃ 避光 试剂(E): 苄醛显色缓冲液 5ml RT 使用说明书 1份
总胆固醇测定试剂盒标准操作程序.
总胆固醇测定试剂盒标准操作程序 1. 摘要 本试剂盒供医疗机构用于体外定量测定人血清或血浆样本中总胆固醇的含量。 2. 适用范围 程序适用于AU5811自动生化分析仪检测血清样本中总胆固醇的含量。 3. 职责 使用AU5811自动生化分析仪进行测定总胆固醇浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。 4. 检测方法 上海科华生物工程股份有限公司生产的总胆固醇测定试剂盒采用的是氧化酶法。 5. 原理 O H ESPAS O H O H O O H 222222244+???→?+-+-?+????→?++???→?+醌亚胺氨基安替比林胆甾烯酮 游离胆固醇脂肪酸 游离胆固醇总胆固醇过氧化物酶胆固醇氧化酶胆固醇酯酶 ESPAS:N-乙基-N-(3-磺丙基)-间-茴香胺 血清中的总胆固醇在胆固醇酯酶的作用下水解成游离胆固醇和脂肪酸,游离胆固醇在胆固醇氧化酶的催化下,氧化成Δ4-胆甾烯酮和双氧水,最后双氧水在过氧化物酶的催化下与色原底物4-氨基安替比林和ESPAS 反应生成红色化合物醌亚胺。 由于醌亚胺在波长550nm 处有吸收峰,所以在一定底物浓度范围内,550nm 处吸光度的变化值与样本中总胆固醇的含量成正比 6. 仪器 AU5811自动生化分析仪 7. 试剂 7.1 试剂来源: 上海科华生物工程股份有限公司提供 7.2 试剂瓶内主要成分: R1:胆固醇酯酶、抗坏血酸氧化酶、过氧化物酶、ESPAS (ADPS ); R2:胆固醇氧化酶、4-氨基安替比林; 校准品:胆固醇 7.3 试剂稳定性:
生产过程中防止污染和交叉污染的管理规程
生产过程中防止污染和交叉污染的管理规程?? 1?目的:建立防止生产过程污染和交叉污染的管理规程,最大限度地降低药品生产过程中污染、交叉污染的风险。 2?范围:适用于防止生产区、化验区与仓贮区在生产过程污染和交叉污染的管理。 3?职责:生产区、化验区与仓贮区人员负责实施,QA检查员及各部门负责人负责监督执行。4?内容 4.1?定义 4.1.1?污染:在生产、取样、包装或重新包装、贮存或运输等操作过程中,原辅料、中间产 品、待包装产品、成品受到具有化学或微生物特性的杂质或异物的不利影响。 4.1.2?交叉污染:不同原料、辅料及产品之间发生的相互污染。 4.2?防止人员污染和交叉污染: 4.2.1?所有人员都应当接受卫生要求的培训,人员操作严格执行《人员卫生操作规程》,最 大限度地降低人员对药品生产造成污染的风险。 4.2.2?各级管理人员严格监控防止体表有伤口、患有传染病或其他可能污染药品疾病的人 员从事直接接触药品的生产。可能患有污染药品疾病的人员必须积极主动地配合主管部门的管理要求。 4.2.3?控制进入洁净区的人和物的数量。执行《参观人员进出生产区的管理规程》?。 4.2.4?进入洁净区的人和物严格执行?《人员进出洁净区的净化程序》和《物料、容器、工
具进出洁净区的净化程序》?。 4.2.5?进入洁净区的操作人员不得随意离开自己的工作区域(需对岗位培训)而进入其它 操作间,确需进入时,应再次执行《人员进出洁净区净化程序》后方可进入。 4.2.6?工作人员在需要进出公共区时,不能同时进出,防止交叉污染。 4.3?防尘措施:生产中对洁净区产尘操作区域进行控制,采取以下方法防止粉尘扩散、避 免交叉污染的,并在此基础上不断改进防止尘埃产生和扩散的有效措施。 4.3.1?工艺过程产生粉尘的工序的操作应在负压称量室进行,负压称量室设置独立的除尘 系统。 4.3.2?洁净室密闭,不使外界未经净化的空气进入洁净厂房,必须定期检查送风口、灯罩、 安全门等是否有泄漏点。 4.3.3?洁净室的地面,墙壁和顶棚等要保持无尘、光滑、无静电,并能经得起清洁、消毒, 一旦发生涂层脱落应及时修补。 4.3.4?洁净室内的设备安装在近送风口处,产尘设备有吸尘装置。? 4.3.5?按不同生产需要,房间与走廊必须保持正常的压差,工作间房门必须经常关闭,以保 持压差梯度。 4.3.6?员工操作时对于易产尘的物料要轻拿轻放,尽量避免产生粉尘。 4.3.7?洁净级别较高的A、B级设置专门的房间或区域并采用单向气流保护操作面。 4.4?防止厂房设施的污染和交叉污染
5-核苷酸酶检测试剂盒(钼蓝微板法)
简介: 5′-核苷酸酶(5′-NT 或NTP)广泛分布于肝脏、胆道及其他各种组织中,该酶活性变化常与ALP 活性相平行。但在骨骼系统的疾病中,如肿瘤骨转移、畸形性骨炎、甲亢、佝偻病等,ALP 活力增高,但是5′-NT 活力正常。 Leagene 5′-核苷酸酶(5′-NT)检测试剂盒(钼蓝微板法)先检测ALP 和5′-NT 总的活性,利用镍离子能选择性的抑制5′-NT 的特性,用总活性减去ALP 活性即获得5′-NT 活性。通过酶标仪检测680nm 处吸光度。该酶的检测对于研究自由基代谢平衡,抗衰老和肿瘤发病机制具有一定的价值。该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 操作步骤(仅供参考): 1、 准备样品: ① 血浆、血清和尿液样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的 测定,尿液通常也可以直接用于测定,-70℃冻存,用于5′-NT 的检测。 ② 细胞或组织样品:取恰当细胞或组织进行裂解,可以采用Leagene Western 及IP 细胞裂解液,如果有必要需进行适当匀浆,低速离心取上清,-70℃冻存,用于5′-NT 的检测。 ③ 高活性样品:如果样品中含有较高活性的5′-NT ,可以使用AMP 酸性缓冲液稀释。 ④ (选做)样品准备完毕后可以用BCA 蛋白浓度测定试剂盒测定蛋白浓度,以便于后续 计算单位蛋白重量组织或细胞内的5′-NT 含量。 2、 配制对照NT Assay 工作液:取适量的NT Assay buffer Ⅰ、Ⅱ、Ⅲ,配制对照NT Assay 工作液,4℃保存备用。 3、 配制测定NT Assay 工作液:取适量的NT Assay buffer Ⅰ、Ⅱ,配制测定NT Assay 工 作液,4℃保存备用。 编号 名称 TE0261 100T Storage 试剂(A): NT Assay buffer Ⅰ 15ml RT 试剂(B): NT Assay buffer Ⅱ 2ml RT 试剂(C): NT Assay buffer Ⅲ 1ml RT 避光 试剂(D): 5′-AMP buffer 2ml 4℃ 试剂(F): 磷标准(6mmol/L) 1ml 4℃ 试剂(H): 定磷还原液 3ml 4℃ 避光 使用说明书 1份
防止交叉污染控制
防止交叉污染控制 This manuscript was revised on November 28, 2020
防止交叉污染措施 1 目的 搞好生产过程中的卫生管理,防止因交叉污染而造成产品质量问题。 2 范围 适用于产品生产全过程。 3 职责 3.1质量技术部负责车间的布局工艺流程图的制定。 3.2生产部负责对员工进行规范操作及卫生培训,负责加工过程中的卫生控制,负责对生产设备进行常规维护与清洗消毒以及维修改造。 3.3 品控室负责生产过程中交叉污染的监督检查。 4 工作程序 4.1 防止车间布局不合理造成的污染 4.1.1 控制要求 a)保证车间建筑设施的完好。 b)根据产品加工工艺流程,按照车间布局图、设备布局图做好车间设备 c)按照人流物流图保证人流物流分开,按照车间分区图保证清洁区与其他次清洁区严格分开;保证加工工序相互隔离;保证原、料辅料、半成品、成品在加工储运过程中严格分开。 d)产品发生改变时,生产系统必须碱水煮罐、蒸汽消毒等处理 4.1.2 监视要求 a)每班开工前/生产、储存过程中随时监视。 b)班组日常监控,品控室不定期抽查。 4.1.3. 纠正措施 检查中发现问题,由抽查员跟踪解决。存在交叉污染隐患的车间布局或加工流程由质量技术部重新调整或改造。 4.2 防止新员工培训不合格造成的交叉污染 4.2.1 控制要求 办公室安排各部门对新进员工进行岗位的饲料安全卫生知识和安全生产操作培训,考核合格方可上岗。 4.2.2监视要求 生产车间和部门对新人上岗时检查其有无上岗证。 4.2.3 纠正措施 没有经过饲料安全卫生知识和安全生产操作培训的员工不得上岗。需接受培训,考核合格后才可上岗。 4.3防止员工行为不当导致的交叉污染 4.3.1 控制要求 a)进入生产现场的人员必须穿戴洁净的工作服、鞋、帽,清洁区生产人员不得佩带首饰、手表及化装,不得留长指甲和擦指甲油,不得喷香水,不得在生产场地晾衣服。 b)清洁区生产人员进入和每离开从属区域后必须洗手、更衣、消毒。 c)个人物品和生产无关的物品不得带入车间。
甘油三脂(TG)检测试剂盒(GPO-PAP单试剂微板法)
甘油三脂(TG)检测试剂盒(GPO-PAP 单试剂微板法) 简介: 甘油三酯(Triglyceride ,TG )又称三酰甘油,是3分子长链脂肪酸和甘油形成的脂肪分子,是人体内含量最多的脂类,大部分组织均可以利用甘油三酯分解产物供给能量,同时肝脏、脂肪等组织还可以进行甘油三酯的合成。 Leagene 甘油三脂(TG)检测试剂盒(GPO-PAP 单试剂微板法)又称磷酸甘油氧化酶法或磷酸甘油氧化酶-过氧化物酶偶联法等,甘油三脂被LPL 水解为甘油和脂肪酸,再经过氧化物酶(POD)催化,使4-氨基安替比林与酚(三者合称PAP)反应,生成红色苯醌亚胺(Trinder 反应)。酶标仪在500~520nm 处进行比色测定。本试剂盒用于人或动物的血清、血浆、脑脊液、细胞、组织等样本中的甘油三脂含量定量测定。本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 操作步骤(仅供参考): 1、 样本处理: ①血清、血浆、脑脊液样本:从待测样本中分理出的血清或血浆不应有溶血,直接检测,如超过线性范围,用生理盐水稀释后检测。 ②细胞样本: a 、取适量的细胞(一般推荐>106以上),弃上清,留取沉淀。 b 、用PBS 或生理盐水清洗1~2次,弃上清,留取沉淀。 c 、加入200~300μl 的PBS 或生理盐水匀浆,冰浴条件下超声破碎细胞,功率300W ,每次3~5s ,间隔30s ,重复3~5次。亦可手动匀浆,制备好的匀浆液不可离心,待用。 d 、③组织样本:准确称取适量组织样本,按质量(g):生理盐水或PBS(ml)=1:9的比例, 编号 名称 TC1241100T Storage 试剂(A): GPO-PAP 工作液 Tris-HCl buffer 30ml -20℃ 避光 LPL 、GK 4-氨基安替比林 对氯酚 试剂(B): Glycerol 标准(1.7mmol/L) 1ml RT 试剂(C): ddH 2O 1ml RT 使用说明书 1份
总胆固醇(TC)检测试剂盒(COD-PAP双试剂比色法)
总胆固醇(TC)检测试剂盒(COD-PAP双试剂比色法) 简介: 胆固醇(Cholesterol)又称胆甾醇,是一种环戊烷多氢菲的衍生物,分子式C27H46O,分子量为3860.65。胆固醇广泛存在于动物体内,其中脑、神经组织最丰富,在肾、脾、皮肤、肝和胆汁中含量也较高。用酶学方法测定总胆固醇(Total Cholesterol,TC)葡萄糖是生化检测中的常用方法,其特点是:1、灵敏度、准确度、精密度均高;2、使用温和的反应条件;3、操作简便;4、适用于自动分析仪。 Leagene总胆固醇(TC)检测试剂盒(COD-PAP双试剂比色法)又称胆固醇氧化酶法或胆固醇氧化酶-过氧化物酶偶联法等,血液中的胆固醇约1/3为游离胆固醇,2/3为与脂肪酸结合的胆固醇酯,后者被CEH水解为游离胆固醇,后者被胆固醇氧化酶(COD)氧化成胆甾烯酮,并产生过氧化氢,再经过氧化物酶(POD)催化,使4-氨基安替比林与酚(三者合称PAP)反应,生成红色醌亚胺色素(Trinder反应)。分光光度计在处进行比色测定。本试剂盒用于人或动物的血清、血浆、脑脊液、细胞、组织等样本中的总胆固醇含量定量测定。本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 自备材料: 1、生理盐水或PBS 2、离心管、小试管或96孔板 3、水浴锅或恒温箱 4、分光光度计或酶标仪 5、全自动或半自动生化分析仪编号 名称TC1217 100T Storage 试剂(A): Good's溶液Good's buffer 2×25ml-20℃避光显色剂 活性剂、稳定剂 试剂(B): COD-POD溶液胆固醇氧化酶、激酶 2×25ml -20℃避光4-氨基安替比林 CEH、POD 临用前,按A:B混合,即为COD-PAP工作液,4℃保存。 试剂(C): TC标准(5mmol/L) 1ml-20℃避光试剂(D): ddH2O 1ml RT 使用说明书1份
