等效平衡原理及规律

等效平衡原理及规律
1、等效平衡原理
相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,起始时加入物质的物质的量不同(只要初始浓度相同),而达到化学平衡时,同种物质的百分含量(质量分数或物质的量分数或体积分数)相同。
2、等效平衡规律
(1)恒温恒容时
对于反应前气体分子数改变的可逆反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算成同一半边的物质,若各物质的物质的量,与原平衡相同,则两平衡等效。
对于反应前气体分子数不变的可逆反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算成同一半边的物质,若各物质的物质的量的比值与原平衡相同,则两平衡等效。
(2)恒温恒压时
改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算成同一半边的物质,若各物质的物质的量的比值与原平衡相同,则两平衡等效。
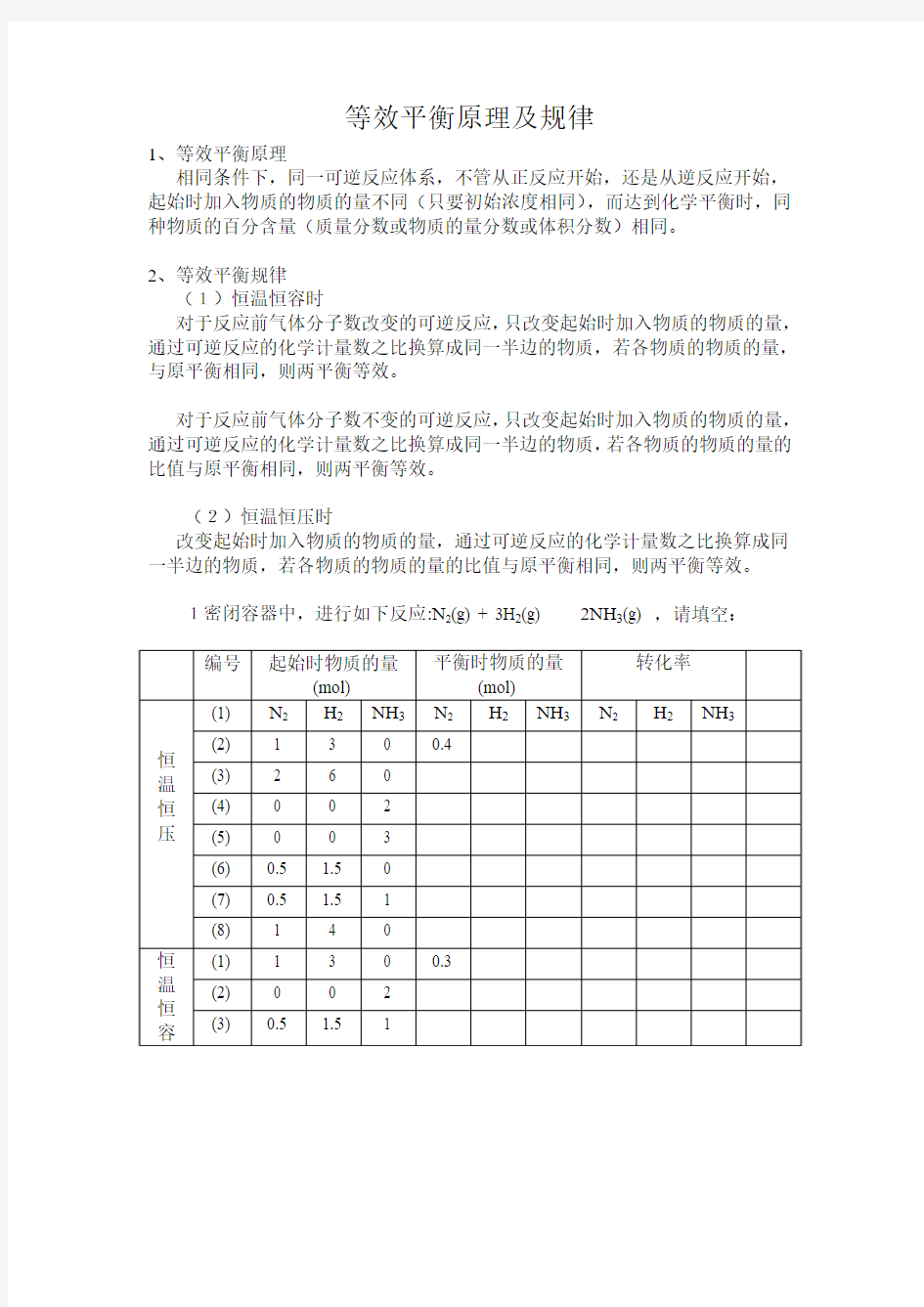
1密闭容器中,进行如下反应:N2(g) + 3H2(g) 2NH3(g) ,请填空:
密闭容器中,对于H2(g)+H2(g) == 2HI(g)反应:
1、密闭容器中,保持一定温度,进行如下反应:N2(g) + 3H2(g) 2NH3(g) 已知加入1molN2和3molH2,在恒压条件下,达到平衡时生成a molNH3[见下表编号(1)的一行];在恒容条件下,达到平衡时生成b molNH3[见下表编号(4)的一行]。
2、某温度下,在1L密闭容器中加入1molN2和3molH2,,使反应:
N2(g) + 3H2(g) 2NH3(g)达平衡,测得平衡混合气体中N2、H2、NH3的浓度分别为Mmol/L、Nmol/L、Gmol/L。如果温度不变,只改变初始物质的加入量,而要求M、N、G总保持不变,则N2、H2、NH的加入量用x、y、z表示时,应满足的条件是:
(1)若x=0,y=0,则z= 。
(2)若x=0.75mol,则y= ,z= 。
高中化学等效平衡原理(习题练习)
等效平衡原理及练习 一、等效平衡概念 等效平衡是指在一定条件(恒温恒容或恒温恒压)下,只是起始加入情况不同的同一可逆反应达平衡后,任何相同组分的体积分数或物质的量分数均相等的平衡。 在等效平衡中,有一类特殊的平衡,不仅任何相同组分X的含量(体积分数、物质的量分数)均相同,而且相同组分的物质的量均相同,这类等效平衡又称为同一平衡。同一平衡是等效平衡的特例。 如,常温常压下,可逆反应: 2SO2 + O2 2SO2 ①2mol 1mol 0mol ②0mol 0mol 2mol ③0.5mol 0.25mol 1.5mol ①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡 二、等效平衡规律 判断是否建立等效平衡,根据不同的特点和外部条件,有以下几种情况: ①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,若保持其数值相等,则两平衡等效。此时,各组分的浓度、反应速率等分别与原平衡相同,亦称为同一平衡。 ②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,只要物质的量的比值与原平衡相同则两平衡等效。此时,各配料量不同,只导致其各组分的浓度反应速率等分别不同于原平衡,而各组分的百分含量相同。 ③在恒温、恒压下,不论反应前后气体分子数是否发生改变,改变起始时加入物质的物质的量,根据化学方程式的化学计量数换算
平衡结构理论(六)五大规则
平衡结构理论(六)五大规则 一、平衡规则 1.平衡规则主要用于测定和确认趋势平衡状态的技术规则,通过趋势运行过程中所呈现出的不同平衡状态来确定价格 运行的规律。 2.平衡规则来源于平衡法则、趋势惯性定律、趋势均衡定律、趋势相邻定律、趋势重演定律、时间周期定律,这里就不重复了。 3.均衡节奏平衡主要用时空矩形来确定其运行规律,非均衡节奏主要用趋势线和趋势通道来确定其运行规律。 举例:均衡节奏:华新水泥600801 非均衡节奏:华业地产600240 4.平衡被打破就是原有的平衡失衡,失衡主要是由于时间失衡和价格失衡引起的。同样的涨跌幅度,运行时间短呈加速状态,上涨初期宜买入,下跌初期宜卖出。同样的涨跌幅度,运行时间长呈减速速状态,上涨末期宜卖出,下跌末期宜观望。同样的运行时间,涨跌幅度大呈加速状态,上涨初期宜买入,下跌初期宜卖出。同样的运行时间,涨跌幅度小呈减速速状态,上涨末期宜卖出,下跌末期宜观望。 加速举例:精工科技002006 减速举例:包钢股份600010 ? 二、顶底规则
1.多头顶底规则。多头的顶底是依次抬高的,以此作为判断多头趋势成立的标准。若当前的底高于先前的顶称之为强势多头。若当前的底低于先前的顶称之为弱势多头。 举例:ST康达尔000048 2.空头顶底规则。空头的顶底是依次降低的,以此作为判断空头趋势成立的标准。若当前的顶低于先前的底称之为强势空头。若当前的顶高于先前的底称之为弱势空头。 举例:科新机电300092 3.水平顶底规则。当前的顶或底与先前的顶或底相等或相似,趋势暂不明确,若水平顶处于高位有转势可能,若水平底处于低位也有随时转势可能。 水平顶举例:天龙光电300029 水平底举例:新黄浦600638 4.整理行情的顶底很不规则,用顶底规则无法判断趋势,用支撑阻挡定律判断更加准确。三、双波规则 1.双波规则就是通过推进波和调整波的变化来判断趋势是否延续和转势的规则。2.当前推进波大于先前的推进波或当前调整波小于先前调整波,表示原有趋势将会延续。上涨趋势延续推进波举例:福建水泥600802 上涨趋势延续调整波举例:福建水泥600802 下跌趋势延续推进波举例:康芝药业300086 下跌趋势延续调整波举例:康芝药业
等效平衡原理及规律
等效平衡原理及规律 一、等效平衡原理 在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。 如,常温常压下,可逆反应: 2SO2 + O2 2SO2 ①2mol 1mol 0mol ②0mol 0mol 2mol ③ ①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡 二、等效平衡规律 根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类: I.在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。 例1.在一固定体积的密闭容器中,加入2 mol A和1 mol B发生反应 2A(g)+B(g)3C(g)+D(g),达到平衡,c的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c的浓度仍为w mol/L的是 A. 4 mol A +2 mol B B. 1 mol A+ mol B+ mol C+ mol D C. 3 mol C+1 mol D +1 mol B D. 3 mol C+1 mol D 解析:根据题意: 2A(g)+B(g)==3C(g)+D(g) (反应1)<==> 2A(g)+B(g)==3C(g)+ D(g)(反应2) 2mol 1mol 0 0 0 0 3mol 1mol
股市剑客-平衡结构理论
平衡结构理论(一)平衡法则 平衡结构理论(二)多头平衡法则平衡结构理论(一)平衡法则 《平衡结构理论》系列简介:平衡结构理论是以平衡法则为基础,以结构型技术为主导,形成独特的技术分析体系和交易决策体系,是一门崭新的技术分析方法,该理论完全脱离成交量分析和指标分析,分析研判和买卖决策也无须成交量和指标的相互验证,是一个完整的独立体系。该理论把传统繁杂的技术分析高度简单化,无需预测市场,也不必去做比市场更聪明的预测,只要承认和尊重市场并顺势而为即可。该理论避免主观判断并尽可能回避传统技术分析的缺陷,在实战中经常有出色的表现。 一、平衡法则的概述 1、世界万事万物都处于不停的运动之中,绝对静止的物体是不存在的,所有运动的物体都处在相对的平衡和不平衡之中,平衡被打破就是不平衡,不平衡又会酝酿新的平衡,永恒的平衡和不平衡是不存在的,任何事物总是处于平衡与不平衡的混沌状态。在一定的时间内保持原有的特性称之为平衡,否则就是不平衡。 2、自然界中的一切无不处于动态平衡之中,从生物界的产生、成长、消亡、延续的反复循环到昼夜交换、日月更替、寒来暑往等自然现象,总是在有序和无序、和谐与不和谐之中得到统一。 3、人类社会中,商品价格总是在供过于求和供不应求的矛盾中得到相对平衡,科技总是在不断更新之中得到领先与淘汰。人类本身也在不停的生生死死中获得相对平衡。 二、市场平衡属性 1、市场每时每刻都处于动态变化之中,这种动态的变化构成了市场行为的全部内容,动态的变化构成一种趋势,每一种趋势都会延续一段时间(市场一旦某一种趋势形成以后,都会延续一段时间),(通过延续一段时间的这个过程,就称之为一种动态的平衡)趋势的延续构成一种动态的平衡,而这种动态平衡状态不是永恒的,当这种平衡受到外界环境变化或市场反作用力的影响时,原有的趋势或平衡被打破,新的平衡就会产出。所以市场总是在平衡——短暂的不平衡——新的平衡中永不停息的运动。 2、涨多必跌,跌多必涨,阴阳交替,涨跌循环。这是市场的本性,只有这样市场才能保持动态的平衡,也只有这样,原有的平衡才会被打破,新的平衡才会产生,市场的趋势才能在循环往复中得到延续。(一直涨会导致泡沫,一直跌会导致崩盘) 举例:维科精华2008年11月7日
等效平衡知识点总结
等效平衡知识总结 一、等效平衡原理的建立 化学平衡理论指出:同一可逆反应,当外界条件相同时,反应不论是从正方应开始,还是从逆反应开始,或者从正、逆反应同时开始,最后都能达到平衡状态。化学平衡状态与条件有关,而与建立平衡的途径无关。因此,我们把: 在一定条件(恒温、恒压或怛温、恒容)下,只是起始物质加入情况不同的同一可逆反应达到平衡后,反应混合物中各组分的百分数(体积、物质的量、质量)均对应相等,这样的化学平衡互称等效平衡。 切记的是:组分的百分数相同,包括体积分数、物质的量分数或质量百分数,而不仅仅是指浓度相同,因为同一组分百分数相同时其浓度不一定相等。 概念的理解: (1)外界条件相同:通常可以是①恒温、恒容; ②恒温、恒压。 (2)“等效平衡”与“完全相同的平衡状态”不同:“完全相同的平衡状态”是指在达到平衡状态时,任何组分的物质的量分数(或体积分数)对应相等,并且反应的速率等也相同,但各组分的物质的量、浓度可能不同。而“等效平衡”只要求平衡混合物中各组分的物质的量分数(或体积分数)对应相同,反应的速率、压强等可以不同。 (3)平衡状态只与终态有关,而与途径无关,(如:①无论反应从正反应方向开始,还是从逆反应方向开始②投料是一次还是分成几次③反应容器经过扩大—缩小或缩小—扩大的过程,)只要起始浓度相当,就达到相同的平衡状态。 判断“等效平衡”的方法 (1)使用极限转化的方法将体系转化成同一方向的反应物或生成物。 (2)观察有关物质的量是否相等或成比例。 等温等容:A、m+n≠p+q 相同起始物质的物质的量相等 B、m+n = p+q 相同起始物质的物质的量之比相等 等温等压:相同起始物质的物质的量之比相等。等压比相等,等容量相等。但若系不变,可为比相等。 a.气态物质反应前后体积变化的可逆反应 Ⅰ:恒温恒容时 1.建立等效平衡的条件是:反应物的投料相当即“等量”加入 2.判断方法:“一边倒”的极限转换法 即将不同的投料方式根据化学方程式中计量系数比换算到同一边时,如果反应物(或生成物)中同一组分的物质的量完全相同,则互为等效平衡。 2、恒温恒容时,对于反应前后气体分子数不变的可逆反应,若一边倒后的比例关系与原平衡相同,则二平衡等效(平衡时相同物质的含量相同,n、C都成倍数关系) a.气态物质反应前后体积变化的可逆反应 Ⅱ:恒温恒压时 1.建立等效平衡的条件是:反应物的投料比相等即“等比”加入 2.判断方法:“一边倒”的极限转换法 即将不同的投料方式根据化学方程式中计量系数比换算到同一边时,只要反应物(或生成物)中各组分的物质的量的比例相同,则互为等效平衡。 二、化学反应速率化学平衡图像 图像题是化学平衡中的常见题型,这类题目是考查自变量(如时间、温度、压强等)与因变量(如物质的量、浓度、百分含量、转化率)之间的定量或定性关系。
(完整word版)等效平衡原理及规律
1 等效平衡原理及规律 一、等效平衡原理 在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物 质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同, 这样的平衡称为等效平衡。 如,常温常压下,可逆反应:2SO 2 + O 2 2SO 3 SO 2、O 2、SO 2的物质的量分别为①2mol 1mol 0mol②0mol 0mol 2mol ③0.5mol 0.25mol 1.5mol ①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况 如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将 ②、③折算为①),因此三者为等效平衡 二、等效平衡规律 根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否 相等),可将等效平衡问题分成三类: I.在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物 质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原 平衡相同,则两平衡等效。 例1.在一固定体积的密闭容器中,加入2 mol A 和1 mol B 发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡,c 的浓度为w mol/L 。若维持容器体积和温度不变,下列四种配 比作为起始物质,达平衡后,c 的浓度仍为w mol/L 的是 A. 4 mol A +2 mol B B. 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D C. 3 mol C+1 mol D +1 mol B D. 3 mol C+1 mol D 解析:根据题意: 2A(g)+B(g)==3C(g)+D(g) (反应1)<==> 2A(g)+B(g)==3C(g)+ D(g)(反应2) 2mol 1mol 0 0 0 0 3mol 1mol 2A(g)+B(g)==3C(g)+D(g) (反应3)<==> 2A(g)+B(g)== 3C(g) + D(g)(反应4) 1mol 0.5mol 0 0 0 0 1.5mol 0.5mol 所以,以3 mol C+1 mol D 或以1mol A+0.5 mol B+1.5mol C+0.5 mol D 作为起始物质 均可形成与反应(1)等效的平衡。答案:BD 解题规律:此种条件下,只要改变起始加入物质的物质的量,若通过可逆反应的 化学计量数之比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效(此种情 况下又称等同平衡,此法又称极限法)。 II.在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生 成物)的物质的量之比与原平衡相同,则两平衡等效。 例2.恒温恒容下,可逆反应2HI H 2+I 2(气)达平衡。下列四种投料量均能达到同一 平衡,请填写:
平衡化理论
前言 在电力系统中,存在着种种不平衡因素,可以归结为事故性和正常性两大类。事故性的不平衡是由于系统故障引起的,这种运行工况在系统中是不允许的,一般要通过保护装置切除故障元件,经处理后再恢复系统运行。正常性不平衡是由于三相元件参数或负荷不对称引起的,象电气化铁道中的牵引负荷、冶炼系统中的电弧炉等。系统三相不平衡度如果超过一定范围,将会影响系统的安全运行。因此,针对正常性不平衡运行工况,制定了“三相电压允许不平衡度”的电能质量指标。 本文着重分析三相平衡化原理,并以电气化铁道为例,探讨负序补偿问题。对于不对称工业负荷,要求补偿装置具有快速响应特性和分相调整功能。三相平衡原理及实时平衡化公式的建立,是实现上述功能的基础。目前能实现上述功能的补偿装置以SVC为典型代表。国外一些发达国家如日本、澳大利亚等国已成功地将SVC技术应用在电气化铁道的无功和负序补偿中。在国内,SVC技术在上述领域的应用尚属空白,因此有必要在建立较优的技术经济指标的前提下,开发适用于电气化铁道负荷补偿的SVC装置,这对提高电网的运行质量无疑是有益的。 2三相平衡化的基本原理 因平衡的三相系统总功率是恒定的且与时间无关,而不平衡的三相系统的总功率是在其平衡值上下波动的,因此将不平衡三相系统变换成平衡的三相系统时,在平衡装置中应该设有能够暂时存储电磁能量的电磁元件,如:电抗器和电容器,以单相电阻性负荷为例,如图1所示,它是不平衡的三相系统。 在不改变电源和负荷之间的有功功率交换的前提下,分别在U-W和W-V相间装设电抗器和电容器,如图2所示。 根据三相平衡关系确定容抗XC和感抗XL的数值,假定系统三相电源是对称的,即系统三相电压满足下述关系: 由于只是单相电阻负荷,图1所示电路为一典型的负荷不对称三相电路,在U-W相和
化学平衡知识归纳总结(总)
化学平衡知识归纳总结 一、化学平衡 化学平衡的涵义 1、可逆反应:在同一条件下同时向正方向又向逆反应方向进行的反应。 注意:“同一条件”“同时进行”。同一体系中不能进行到底。 2、化学平衡状态 在一定条件下的可逆反应里,正反应速率和逆反应速率相同时,反应混合物中各组分的浓度保持不变的状态叫化学平衡状态。要注意理解以下几方面的问题:(1)研究对象:一定条件下的可逆反应 (2)平衡实质:V 正=V 逆 ≠0 (动态平衡) (3)平衡标志:反应混合物各组分的含量保持不变,可用六个字概括——逆、等、定、动、变、同。 3、化学平衡状态的特征: (1)逆:化学平衡状态只对可逆反应而言。 (2)等:正反应速率和逆反应速率相等,即同一物质的消耗速率与生成速率相等。 (3)定:在平衡混合物中,各组分的浓度保持一定,不在随时间的变化而变化。(4)动:化学平衡从表面上、宏观上看好像是反应停止了,但从本质上、微观 上看反应并非停止,只不过正反应速率于逆反应速率相等罢了,即V 正=V 逆 ≠0, 所以化学平衡是一种动态平衡。 (5)变:化学平衡实在一定条件下建立的平衡。是相对的,当影响化学平衡的外界条件发生变化时,化学平衡就会发生移动。
(6)同:化学平衡状态可以从正逆两个方向达到,如果外界条件不变时,不论采取何种途径,即反应是由反应物开始或由生成物开始,是一次投料或多次投料,最后所处的化学平衡是相同的。即化学平衡状态只与条件有关而与反应途径无关。可逆反应达到平衡的标志 1、同一种物质V 正=V 逆 ≠0 2、各组分的物质的量、浓度(包括物质的量的浓度、质量分数等)、含量保持不变。
等效平衡规律及练习
等效平衡规律: (1)在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,只改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式中同一半边的物质,其物质的量与对应组分的起始加入量相同,则建立的化学平衡是等效的 恒温、恒容时,I、Ⅱ、Ⅲ这三种情况下达到的平衡完全等效。IV与I、Ⅱ、Ⅲ不等效。(2)在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式同一半边的物质,其物质的量比与对成组分的起始加入量比相同,则建立的化学平衡是等效的。 I、Ⅱ、Ⅲ形成等效平衡,此处等效的含义是各物质的体积分数相同,同时,混合气体的平 均摩尔质量也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。 (3)在恒温、恒压条件下,改变起始时加入物质的物质的量,如果按化学计量数换算成化学方程式同一半边的物质,其物质的量之比与对应组分的起始加入量之比相同,则建立的化学平衡等效。
I、Ⅱ、Ⅲ、Ⅳ形成等效平衡。说明等效平衡分析方法:“一边倒”——按化学计量关系将生成(反应)物全部转化为反应(生成) 物后再看是否相同或成比例。
随堂练习 A组基础巩固型 i.恒压下,在-个可变容积的密闭容器中发生如下反应: 2NH3(g)+CO2(g)CO(NH2)2(g)+H2O(g) 若开始时放入2mol NH3和1mol CO2,达平衡后,生成amol H2 O;若开始时放入xmol NH3、2mol CO2和1mol H2O(g),达平衡后,H2O的物质的量是3a mol,则x为 A 1mol B 2mol C 3mol D 4mol ii.(双选)在密闭容器中,加入3mol A和1mol B,一定条件下发生反应3A(g)+B(g)2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持容器中压强和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是 A 6mol A+2mol B B 1.5mol A+0.5mol B+1mol C+0.5mol D C 3mol A+1mol B+2mol C+1mol D D 2mol C+1mol D iii.一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g)2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是 A 保持温度和容器体积不变,充入1mol SO2(g) B 保持温度和容器内压强不变,充入1mol SO3(g) C 保持温度和容器内压强不变,充入1mol O2(g) D 保持温度和容器内压强不变,充入1mol Ar(g) iv.(双选)在一个固定容积的密闭容器中,加入mmol A、nmol B,发生下列反应:mA(g)+nB(g)pC(g)平衡时C的浓度是wmol/L,若容器体积和温度不变,起始时放入amol A、bmol B、cmol C,若要平衡后C的浓度仍为wmol/L,则a、b、c应满足的关系是 A a︰b︰c=m︰n︰p B a︰b=m︰n (ap/m)+c=p C (mc/p)+a=m,(nc/p)+b=n D a=m/3,b=n/3,c=2p/3 v.(双选)在VL密闭容器中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2+O22SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是 A 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol B 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol C 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4mol D 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol vi.(双选)一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
等效平衡原理及规律
等效平衡原理及规律 Prepared on 22 November 2020
等效平衡原理及规律 一、等效平衡原理 在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。 如,常温常压下,可逆反应:2SO2 + O2 2SO3 SO2、O2、SO2的物质的量分别为①2mol 1mol 0mol②0mol 0mol 2mol③ ①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡 二、等效平衡规律 根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类: I.在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。 例1.在一固定体积的密闭容器中,加入2 mol A和1 mol B发生反应 2A(g)+B(g)3C(g)+D(g),达到平衡,c的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c的浓度仍为w mol/L的是 A. 4 mol A +2 mol B B. 1 mol A+ mol B+ mol C+ mol D C. 3 mol C+1 mol D +1 mol B D. 3 mol C+1 mol D 解析:根据题意:
平衡结构理论全集(股市剑客)
股市不相信眼泪系列(29)——平衡结构理论(一)平衡法则 《平衡结构理论》系列简介:平衡结构理论是以平衡法则为基础,以结构型技术为主导,形成独特的技术分析体系和交易决策体系,是一门崭新的技术分析方法,该理论完全脱离成交量分析和指标分析,分析研判和买卖决策也无须成交量和指标的相互验证,是一个完整的独立体系。该理论把传统繁杂的技术分析高度简单化,无需预测市场,也不必去做比市场更聪明的预测,只要承认和尊重市场并顺势而为即可。该理论避免主观判断并尽可能回避传统技术分析的缺陷,在实战中经常有出色的表现。本系列分为:平衡法则4集,18大定律6集,五大规则2集,一共12集。每周五晚上7:30—9:30在呱呱视频聊天室股市剑客梦工厂(专区)讲一集。 一、平衡法则的概述 1、世界万事万物都处于不停的运动之中,绝对静止的物体是不存在的,所有运动的物体都处在相对的平衡和不平衡之中,平衡被打破就是不平衡,不平衡又会酝酿新的平衡,永恒的平衡和不平衡是不存在的,任何事物总是处于平衡与不平衡的混沌状态。在一定的时间内保持原有的特性称之为平衡,否则就是不平衡。 2、自然界中的一切无不处于动态平衡之中,从生物界的产生、成长、消亡、延续的反复循环到昼夜交换、日月更替、寒来暑往等自然现象,总是在有序和无序、和谐与不和谐之中得到统一。 3、人类社会中,商品价格总是在供过于求和供不应求的矛盾中得到相对平衡,科技总是在不断更新之中得到领先与淘汰。人类本身也在不停的生生死死中获得相对平衡。 二、市场平衡属性 1、市场每时每刻都处于动态变化之中,这种动态的变化构成了市场行为的全部内容,动态的变化构成一种趋势,趋势的延续构成一种动态的平衡,而这种动态平衡状态不是永恒的,当这种平衡受到外界环境变化或市场反作用力的影响时,原有的趋势或平衡被打破,新的平衡就会产出。所以市场总是在平衡——短暂的不平衡——新的平衡中永不停息的运动。 2、涨多必跌,跌多必涨,阴阳交替,涨跌循环。这是市场的本性,只有这样市场才能保持动态的平衡,也只有这样,原因的平衡才会被打破,新的平衡才会产生,市场的趋势才能在循环往复中得到延续。 举例:维科精华 三、市场平衡本质 1、市场平衡的本质就是趋势运行呈匀速状态,就是趋势运行以相同的节奏或不同的节奏匀速运动。比如布鲁斯、华尔兹、维也纳华尔兹、探戈、伦巴、恰恰,虽然节奏不同,但单位时间和节奏的重复就形成了一个完整的平衡状态。股票市场也是一样。趋势总是在单位时间内以不同的节奏做匀速运动,从而在这段时间内保持一种动态平衡。 举例:中色股份2009年1月22日——7月15日 2、由于市场运行节奏的不同,所以趋势运行可分为:均衡趋势运行和非均衡趋势运行。均衡趋势运行就是在同一个趋势方向上,相等的时间内涨跌幅度相同或相似。非均衡趋势运行就是在同一个趋势方向上,相等或不想等的时间内涨跌幅度不相同。但是不管是价格运行如何,趋势都会维持在一个相对平衡的匀速运行状态,直到原有的平衡被打破产生新的平衡位置。 中色股份2010年7月22日——8月31日 四、市场平衡状态 1、市场平衡状态分为平衡状态和非平衡状态。平衡状态是延续的,非平衡状态是短暂的,原有平衡被打破就是非平衡,非平衡之后又会建立新的平衡。 2、平衡状态又可分为均衡节奏和非均衡节奏。均衡节奏是相同的时间涨跌幅度相同。非均衡节奏就是相同或不相同的时间涨跌幅度相等或不相等,但都在同一通道内或趋势线内运行。无论是均衡节奏的平衡还是非均衡节奏的平衡,都是因为没有受到干扰,所以能够延续下去。 举例:景兴纸业(均衡节奏)万力达(非均衡节奏) 3、非平衡状态是原有的平衡状态由于受到外力的干扰,改变了其原有的运行速度,具有短暂性和突发性,也就是我们经常所说的市场拐点。非平衡状态可分为加速运行和减速运行。加速运动就是单位时间内股价涨跌幅度加大,减速运动就是单位时间内涨跌幅度减弱。 举例:美欣达(加速)浙大网新(减速) 四、市场平衡结构。 1、市场平衡的方向。市场平衡的方向可以分为横向市场平衡、纵向市场平衡(上涨市场平衡和下跌市场平衡),就是我们经常所说的横盘趋势、上涨趋势、下跌趋势。 1
等效平衡规律
等效平衡规律 高二学生学习等效平衡时,常常因为没有认识清楚三大等效平衡的条件差异、结论差异,在解决一些等效平衡问题时出现困难。现将三者分析比较如下: 一、完全等效平衡条件 1.条件:恒温、恒容; 2.方程式特点:前后气体系数和不一定相等; 3.将起始投料等同地转化为反应物(或生成物),与原始投料相比,若量完全相同,则反 应达到平衡后与原平衡互为等效平衡。 平衡时状态:各组分的物质的量、质量、各组分的浓度、物质的量分数(或气体体积分数)、反应物转化率均对应完全相等。 例:在恒温、恒容时,反应N2(g)+3H2(g)==2NH3(g),转化前,N2、H2、NH3的物 质的量分别为1mol、3mol、0,或为0、0、2mol,0.5mol、1.5mol、1mol,最终达到同一平衡,即全等平衡。 二、气体系数和相等等效 1.条件:恒温、恒容; 2.方程式特点:前后气体系数和相等; 3.将起始投料等同地转化为反应物(或生成物),各物质间的量比若与原始投料相应物质 间的量比相等,则反应建立平衡后与原平衡互为等效平衡。 平衡状态:气体的物质的量不等,质量不等,浓度不等,但百分含量(体积分数)相等,反 应物转化率相等。 例:在恒温、恒容时,反应H2(g)+Br2(g)==2HBr(g),转化前H2、Br2、HBr的物质 的量分别为1mol、2mol、0,或0.5mol、1mol、0,平衡后虽然体系压强不一样,浓度不一样,物质的量不一样,但平衡时各组分的百分含量、反应物转化率对应相同。 三、气体不压等效 1.条件:恒温、恒压; 2.方程式特点:前后气体系数和不一定相等; 3.将起始投料等同地转化为反应物(或生成物),与原始投料相比,若比例相等,则反应 达到平衡后两平衡互为等效平衡。 平衡状态:物质的量不等,质量不等,但各对应组分的浓度、物质的量分数(或气体体积分数)、反应物转化率均对应相等。 例:一定温度下,向一容积可变的容器中充入1.0molN2和3.0molH2,反应达到平衡时测得
等效平衡原理及规律技巧归纳
等效平衡原理及规律技巧 归纳 Prepared on 22 November 2020
等效平衡原理及规律技巧归纳 人教版教材对等效平衡概念是这样表述的:“实验证明,如果不是从CO和 H2O(g)开始反应,而是各取和,以相同的条件进行反应,生成CO和H2O(g),当达到化学平衡状态时,反应混合物里CO、H2O(g)、CO2、H2各为,其组成与前者完全相同(人教版教材第二册(必修加选修)第38页第四段)。”这段文字说明了,化学平衡状态的达到与化学反应途径无关。即在相同的条件下,可逆反应无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,也就是等效平衡。(其实这个例子属于等效平衡中的特例,也称完全等效) 等效平衡的内涵是,在一定条件下(等温等容或等温等压),只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的质量分数(或体积分数)都相同,这样的平衡互为等效平衡。 等效平衡的外延是它的分类,即不同类型的等效平衡以及其前提条件,类型大致可分为三种.面对繁多的等效平衡类型,我们要掌握一定的方法,方法指导:解等效平衡的题,有一种基本的解题方法——极限转换法(也称一边倒)。由于等效平衡的建立与途径无关,不论反应时如何投料,都可以考虑成只加入反应物的“等效”情况。所以在解题时,可以将所加的物质“一边倒”为起始物质时,只要满足其浓度与开始时起始物质时的浓度相同或成比例,即为等效平衡。但是,要区分“浓度相同”或“浓度成比例”的情况,必须事先判断等效平衡的类型。分类如下: ①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,若保持其数值相等,则两平衡等效。此时,各组分的浓度、反应速率等分别与原平衡相同,亦称为同一平衡。
等效平衡专题教案
一、复习预习 1、化学平衡移动原理的内容是什么 2、影响平衡移动的外界因素有哪些 二、知识讲解 考点1等效平衡定义 对同一可逆反应,在一定条件下(常见的为恒温恒容或恒温恒压),起始投料方式不同(从正、逆或中间等方向开始),若达到的化学平衡同种物质的百分含量均相同,这样的平衡状态互称为等效平衡。 考点2等效平衡的常见分类和状态 以如下反应为例:mA(g)+nB(g)pC(g)+qD(g) (1)如果m+n≠p+q ①恒温恒容:使用极限转化分析法,一边倒后相同起始物质的物质的量相等。达到平衡后各物质浓度相等,百分含量相等,体积没变化,压强没有变化,达到平衡后正逆反应速率相同。唯一不同的是根据投料方式的不同会导致反应热不同。
②恒温恒压:一边倒后相同起始物质的物质的量之比相等。达到平衡后各物质浓度相等,百分含量相等,体积可有变化,压强没有变化,达到平衡后正逆反应速率相同。根据投料的量和方式的不同会导致反应热不同。 (2)如果m+n = p+q ③一边倒后相同起始物质的物质的量之比相等。恒温恒压的话,达到平衡后体积未必相等;恒温恒容的话,除了体积相等,达到平衡后各物质浓度、压强、正逆反应速率都可能不同。两种情况下反应热根据投料的量和方式的不同而不同。比较见下表1. 等效平衡解题建模过程 对于反应N 2(g)+3H 2(g) 2NH 3(g),按照①、②、③的投料方式进行反应, (1)恒温恒容下,则所能达到等效平衡的状态为:①=②≠③。 ③为①或②、④进行加压后的情况,对于这种△vg<0的情况,压强增大,平衡向正方向 移动, N 2转化率升高。 (2③。 2(g) (3基于上面几种类型的建模过程,对照表1 三、例题精析 【例题1】 3和2PCl 1.0molP Cl 3和0.4mol 【答案】C 【解析】此题属于恒温恒容,△Vg ﹤0。移走后,相当于一开始就是1.0mol PCl 3和0.5mol Cl 2在反应。若平衡不移动,PCl 5为0.2 mol 。若用虚拟隔板将体积压缩为一半,则移走前后互
相平衡理论及其应用
离子液体的应用综述 摘要:离子液体作为环境友好、“可设计性”溶剂正越来越多地受到关注。已有的研究表明,离子液体具有独特的性能并有着十分广阔的应用前景。该文在介绍离子液体特性的基础上,综述了其在有机合成、聚合反应、电化学、分离过程、新材料制备、生物技术等方面的应用。 关键词:离子液体;绿色溶剂;有机合成;聚合反应;电化学;分离过程离子液体是在室温或室温附近呈液态的由离子构成的物质,具有呈液态的温度区间大、溶解范围广、没有显著的蒸气压、良好的稳定性、极性较强且酸性可调、电化学窗口宽等许多优点,因此,它是继超临界CO2后的又一种极具吸引力的绿色溶剂,是传统挥发性溶剂的理想替代品。 离子液体的阳离子和阴离子可以有多种形式,可设计成为带有特定末端或具有一系列特定性质的基团。因此,离子液体也被称为“designer solvents”,这就意味着它的性质可以通过对阳离子修饰或改变阴离子来进行调节,像熔点、黏性、密度、疏水性等性质,均可以通过改变离子的结构而予以改变[1]。因此,它不仅作为绿色溶剂在分离过程、电化学、有机合成、聚合反应等方面有着十分广阔的应用前景,而且由于其独特的物理化学性质及性能,有望作为新型功能材料使用,是近年来国内外精细化工研究开发的热点领域。 1、在化学反应中的应用 以离子液体作为化学反应的介质,为化学反应提供了不同于传统分子溶剂的环境,有可能通过改变反应机理而使催化剂活性、稳定性更好,转化率、选择性更高。离子液体种类多,选择范围宽,将催化剂溶于离子液体中,与离子液体一起循环利用,催化剂兼有均相催化效率高、多相催化易分离的优点。同时离子液体无蒸气压,液相温度范围宽,产物可通过倾析、萃取、蒸馏等简单的方法分离出来。 1.1在有机合成中的应用 离子液体[EtNH3] [NO3]最先应用于环戊二烯与丙烯酸甲酯和甲基酮的
汽车平衡悬架的设计要点
汽车平衡悬架的设计要点 东风汽车工程研究院 陈耀明 二00四年十一月
目录 前言 1.四连杆机构的布置 1)推力杆外端头的位置 2)推力杆的高度 3)推力杆的斜度 4)推力杆的长度 5)推力杆在横向平面的布置 (1)上推力杆的布置 (2)下推力杆的布置 6)关于通用件的处理方法 2.推力杆铰接头 1)以橡胶体的变形来满足扭转和斜摆运动要求的铰接头(1)硫化粘结式 (2)组装压入式 ①径向压缩型 ②轴向压缩型 (3)粘结压缩式 2)橡胶体与滑动衬套并用的铰接头 (1)粘接复合衬套 (2)聚胺脂衬套 3.平衡轴总成 1)平衡轴 (1)整体式平衡轴 (2)断开式平衡轴 ①左、右支架连接 ②左、右支架不连接 2)平衡轴承 (1)轴承 (2)止推垫片与锁紧螺母 (3)润滑与密封
4.钢板弹簧的紧固与定位 1)钢板弹簧根部的紧固 2)平衡轴承毂 3)钢板弹簧端部支承座 (1)端座侧板的不对称布置 (2)滑板设计 (3)端座侧板设计 (4)反向限位
前言 采用倒置半椭圆钢板弹簧做为弹性元件、纵置四连杆机构做为导向杆系的平衡悬架,因其结构简单、可靠,性能良好,长期以来成为6×6越野汽车、6×4自卸汽车和牵引汽车后悬架的传统结构。尽管近年来为了提高平顺性和解决门对门运输中保持车高不变的问题,一些重型牵引汽车采用了空气悬架,但使用在路面条件苛刻的军用车辆和自卸汽车,这种平衡悬架仍有明显的优势和强大生命力。 我国从上世纪60年代就自主研发了具有独立自主产权的板簧平衡悬架,并且生产了三十几年。与国外车型对比,我们也有许多独有的设计经验和优势。撰写本文的目的就是为了总结这些设计经验,供有关的悬架设计师参考借鉴。
平衡结构理论合集
平衡结构理论(一)平衡法则 《平衡结构理论》系列简介:平衡结构理论就是以平衡法则为基础,以结构型技术为主导,形成独特得技术分析体系与交易决策体系,就是一门崭新得技术分析方法,该理论完全脱离成交量分析与指标分析,分析研判与买卖决策也无须成交量与指标得相互验证,就是一个完整得独立体系。该理论把传统繁杂得技术分析高度简单化,无需预测市场,也不必去做比市场更聪明得预测,只要承认与尊重市场并顺势而为即可。该理论避免主观判断并尽可能回避传统技术分析得缺陷,在实战中经常有出色得表现。 一、平衡法则得概述 1.世界万事万物都处于不停得运动之中,绝对静止得物体就是不存在得,所有运动得物体都处在相对得平衡与不平衡之中,平衡被打破就就是不平衡,不平衡又会酝酿新得平衡,永恒得平衡与不平衡就是不存在得,任何事物总就是处于平衡与不平衡得混沌状态。在一定得时间内保持原有得特性称之为平衡,否则就就是不平衡。 2、自然界中得一切无不处于动态平衡之中,从生物界得产生、成长、消亡、延续得反复循环到昼夜交换、日月更替、寒来暑往等自然现象,总就是在有序与无序、与谐与不与谐之中得到统一。 3、人类社会中,商品价格总就是在供过于求与供不应求得矛盾中得到相对平衡,科技总就是在不断更新之中得到领先与淘汰。人类本身也在不停得生生死死中获得相对平衡。 二、市场平衡属性 1.市场每时每刻都处于动态变化之中,这种动态得变化构成了市场行为得全部内容,动态得变化构成一种趋势,每一种趋势都会延续一段时间(市场一旦某一种趋势形成以后,都会延续一段时间),(通过延续一段时间得这个过程,就称之为一种动态得平衡)趋势得延续构成一种动态得平衡,而这种动态平衡状态不就是永恒得,当这种平衡受到外界环境变化或市场反作用力得影响时,原有得趋势或平衡被打破,新得平衡就会产出。所以市场总就是在平衡——短暂得不平衡——新得平衡中永不停息得运动。 2.涨多必跌,跌多必涨,阴阳交替,涨跌循环。这就是市场得本性,只有这样市场才能保持动态得平衡,也只有这样,原有得平衡才会被打破,新得平衡才会产生,市场得趋势才能在循环往复中得到延续。(一直涨会导致泡沫,一直跌会导致崩盘) 举例:维科精华2008年11月7日 三、市场平衡本质 1.市场平衡得本质就就是趋势运行呈匀速状态,就就是趋势运行以相同得节奏或不同得节奏匀速运动。比如布鲁斯、华尔兹、维也纳华尔兹、探戈、伦巴、恰恰,虽然节奏不同,但单位时间与节奏得重复就形成了一个完整得平衡状态。股票市场也就是一样。趋势总就是在单位时间内以不同得节奏做匀速运动,从而在这段时间内保持一种动态平衡。
高中化学等效平衡原理(习题练习)含答案
等效平衡原理 一、等效平衡概念 等效平衡是指在一定条件(恒温恒容或恒温恒压)下,只是起始加入情况不同的同一可逆反应达平衡后,任何相同组分的体积分数或物质的量分数均相等的平衡。 在等效平衡中,有一类特殊的平衡,不仅任何相同组分X的含量(体积分数、物质的量分数)均相同,而且相同组分的物质的量均相同,这类等效平衡又称为同一平衡。同一平衡是等效平衡的特例。 如,常温常压下,可逆反应: 2SO 2 + O 2 2SO 2 ①2mol 1mol 0mol ②0mol 0mol 2mol ③0.5mol 0.25mol 1.5mol ①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡 二、等效平衡规律 判断是否建立等效平衡,根据不同的特点和外部条件,有以下几种情况: ①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,若保持其数值相等,则两平衡等效。此时,各组分的浓度、反应速率等分别与原平衡相同,亦称为同一平衡。 ②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,只要物质的量的比值与原平衡相同则两平衡等效。此时,各配料量不同,只导致其各组分的浓度反应速率等分别不同于原平衡,而各组分的百分含量相同。 ③在恒温、恒压下,不论反应前后气体分子数是否发生改变,改变起始时加入物质的物质的量,根据化学方程式的化学计量数换算成同一则物质的物质的量只要物质的量之比与原平衡相同,则两平衡等效。此时的情形与(2)相似。 例题、【2003年江苏高考试题】恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g) C(g) (1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol。 (2)若开始时放入3 mol A和3mol B ,到达平衡后,生成C的物质的量 为 mol。 (3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x= mol,y= mol。 平衡时,B的物质的量(选填一个编号) (A)大于2 mol (B)等于2 mol
选修4 等效平衡与转化率
第四讲等效平衡与转化率 一、等效平衡原理 在一定条件下(恒温恒容或恒温恒压),对于同一可逆反应,起始时投料方式不同,不管从正反应开始,还是从逆反应开始,只要达到平衡状态时,各组分在混合物中的百分含量相同,这样的化学平衡就互称为等效平衡。 如:恒温恒压下,对可逆反应:2SO2+ O22SO3 ① 2mol 1mol 0mol ② 0mol 0mol 2mol ③ 0.5mol 0.25mol 1.5mol ①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系换算成同边的物质,对应各组分的百分含量均相等,因此三者互为等效平衡。 二、等效平衡规律 根据反应条件(恒温恒容或恒温恒压)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类: ①恒温恒容时,对于反应前后气体分子数改变的可逆反应,用“一边倒”的方法将各种投料方式换算为同一边的物质,若各物质的物质的量相等,则两平衡等效。 此种情况下,两等效平衡状态中,各组分的百分含量,物质的量,物质的量浓度。 【例1】恒温恒容时,判断哪些是等效平衡?() N2 + 3H2 2NH3 (A) 2mol 6mol 0mol (B) 0mol 0mol 4mol (C) 0.5mol 1.5mol 1mol (D) 1mol 3mol 2mol 【例2】将2molSO2 (g)和2molSO3 (g)混合于某固定体积的容器中,在一定条件下达平衡,平衡时SO3(g)为w mol,同温下,分别按下列配比在相同体积的容器中反应,达平衡时SO3 (g)的物质的量仍为w mol 的是() A.2molSO2(g)+1mol O2(g) B.4mol SO2(g)+ 1mol O2(g) C.2mol SO2(g)+ 1mol O2(g)+ 2mol SO3(g) D.3mol SO2(g)+1.5mol O2(g)+ 1mol SO3(g) 【例3】在一个固定容积的密闭容器中加入2 mol A和1 mol B,发生反应2A(g)+B(g) ?3C(g)+D(g),达到平衡时,C的浓度为w mol/L。若维持容器的容积和温度不变,按下列情况配比为开始浓度,达到平衡后C的浓度仍为w mol/L的是() A.4molA+2molB B.2molA+1molB+3molC+1molD C.3molC+1molD+1molB D.3molC+1molD E.1molA+0.5molB+1.5molC+0.5molD 【例4】在一定温度下,把2 mol SO2和1 mol O2通入固定容积的密闭容器里,发生如下反应: 2SO2+O2?2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白: (1)若a=0,b=0,则c = ___________。(2)若a=0.5,则b=_________,c= _________。
