化学需氧量的测定 重铬酸盐法(GB11914—89)

化学需氧量的测定(重铬酸盐法)
(GB11914—89)
1.内容与应用范围:本标准规定了水中化学需氧量的测定方法。本标准适用于各种类型的含COD大于30mg/L的水样,对未经稀释的水样的测定上限为700mg/L,不适用于氯化物浓度大于1000mg/L(稀释后)的含盐水。
2.定义:在一定条件下,经重铬酸钾氧化处理时,水样中的溶解性物质和悬浮物所消耗的重铬酸钾盐相对应的氧的质量浓度。
3.原理:在水样中加入已知量的K2Cr2O7溶液,并在强酸介质下银盐做催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。在酸性K2Cr2O7条件下,芳烃及吡啶难以被氧化,其氧化率较底。在Ag2SO4的催化作用下,直链脂肪族化合物可有效的被氧化。
4.试剂
4.1.硫酸银(Ag2SO4)
4.2.硫酸汞(HgSO4)
4.3.硫酸(H2SO4)(ρ=1.84g/L)
4.4.Ag2SO4—H2SO4向1LH2SO4中加入10gAg2SO4放置1—2天使之溶解,并混匀,使用前小心摇动。
4.5.K2Cr2O7标准溶液
4.5.1.浓度为(1/6 K2Cr2O7)=0.2500mol/L的K2Cr2O7:将12.2580G在105o C干燥2h后的K2Cr2O7溶于水中,稀释至1L。
4.5.2.浓度为C(1/6 K2Cr2O7)=0.02500mol/L 的K2Cr2O7:将250mol/L的K2Cr2O7:将4.5.1的溶液稀释10倍而成。
4.6硫酸亚铁铵标准滴定溶液
4.6.1.C[(NH4)2Fe(SO4)2]=0.10mol/L标准滴定溶液:溶解39g[(NH4)2Fe(SO4)26H2O]于水中,加入20mlH2SO4,待其溶液冷却后稀释至1L。
4.6.2.每日临用前,必须用K2Cr2O7标准溶液标定:取10.00mlK2Cr2O7标准溶液置于锥型瓶中,用水稀释至100ml,加入30mlH2SO4,混匀,冷却后,加3滴(约015ml)试亚铁灵为指示剂,用硫酸亚铁铵标准滴定溶液滴定溶液的颜色由黄经蓝绿色变为红褐色,即为终点。记录用量。
4.6.3.硫酸亚铁铵标准滴定溶液浓度的计算:C[(NH4)2Fe(SO4)2·6H2O]= (10.00×0.2500)/V=2.50/V。(V—滴定所消耗的硫酸亚铁铵标准滴定溶液的体积)
4.6.4.1,10—菲罗啉(1,10phenanathroline monohy)指示剂:溶解0.7g七水合硫酸亚铁(FeSO4·7H2O)于50ml水中,加入1.5g1,10—菲罗啉,搅动至溶解,加水稀释至100ml。
5.仪器
回流装置:带有24号标准磨口的250ml锥型瓶的全玻璃回流装置,回流冷凝管长度为300—500mm。若取样量30ml以上,可采用带500ml锥型瓶的全玻璃回流装置。
6.采样和样品:水样要采集于玻璃瓶或聚乙烯瓶中,应尽快分析,如不能立即分析,应加入H2SO4(4.3)至PH<2,置4℃下保存,但保存时间不多于5天,
采集水样的体积不得少于100ml。试样摇匀,取20.00ml备用。
7.实验步骤:
7.1.对于COD值小于50的水样应采用低浓度重铬酸钾标准溶液氧化,加热回流以后,采用低浓度的硫酸亚铁铵标准溶液回滴。
7.2.该法对未经稀释的水样,其测定上限为700,超过此限时必须经稀释后测定。
7.3.对于污染严重的水样,可选取所需体积1/10的试料和1/10的试剂,放入10×150mm硬质玻璃管中,摇匀后,用酒精灯加热至沸数分钟,观察溶液是否变成蓝绿色,如成蓝绿色,应再适当少取试样,重复以上实验,直至溶液不变为蓝绿色为止,从而确定待测水样适当的稀释倍数。
7.4.取试样(6.1)于锥型瓶中,或取适量试样加水至20.00。
7.5.空白实验:按相同步骤以20.00纯水代替试样进行空白实验,所耗硫酸亚铁铵体积记为V1
7.6.去干扰试验:无机还原性物质如硝酸盐、硫化物及二价铁盐将使结果增加,将其需氧K2Cr2O7量作为水样COD值的一部分是可以接受的。该试验的主要干扰物是氯化物,可加入硫酸汞部分去除,经回流后,氯离子可与硫酸汞结合成可溶性的氯汞结合物。当氯离子含量超过1000mg/L时,COD最低允许为250mg/L,低于此值,结果的准确度就不可靠。
7.7.水样的测定:于试样中加入10.00ml K2Cr2O7标准溶液(4.5.1)和防爆沸玻璃珠,摇匀。将锥型瓶接到回流装置冷凝管下端,接通冷凝水。从冷凝管上端缓慢加入30ml Ag2SO4—H2SO4以防止低沸点有机物的逸出,不断旋转锥型瓶使之混匀,自溶液开始沸腾起回流2小时,冷却后,用20—30ml纯水自冷凝管上端冲洗冷凝管后,取下瓶子,再用水稀释至140ml左右。溶液冷至室温后,加入3滴试亚铁灵指示剂,用硫酸亚铁铵标准溶液滴定,溶液颜色由黄经蓝绿色变为红褐色即为终点,记录所耗体积,记为V2
COD(mg/L)=[C(V1-V2)*8000]/V0
C——(NH4)2Fe(SO)2标准溶液的浓度
V1——空白试验所耗(NH4)2Fe(SO)2标准溶液的体积
V2——滴定水样所耗(NH4)2Fe(SO)2标准溶液的体积
V0——所取水样的体积
8000——1/4的摩尔质量以mg/L为单位的换算值
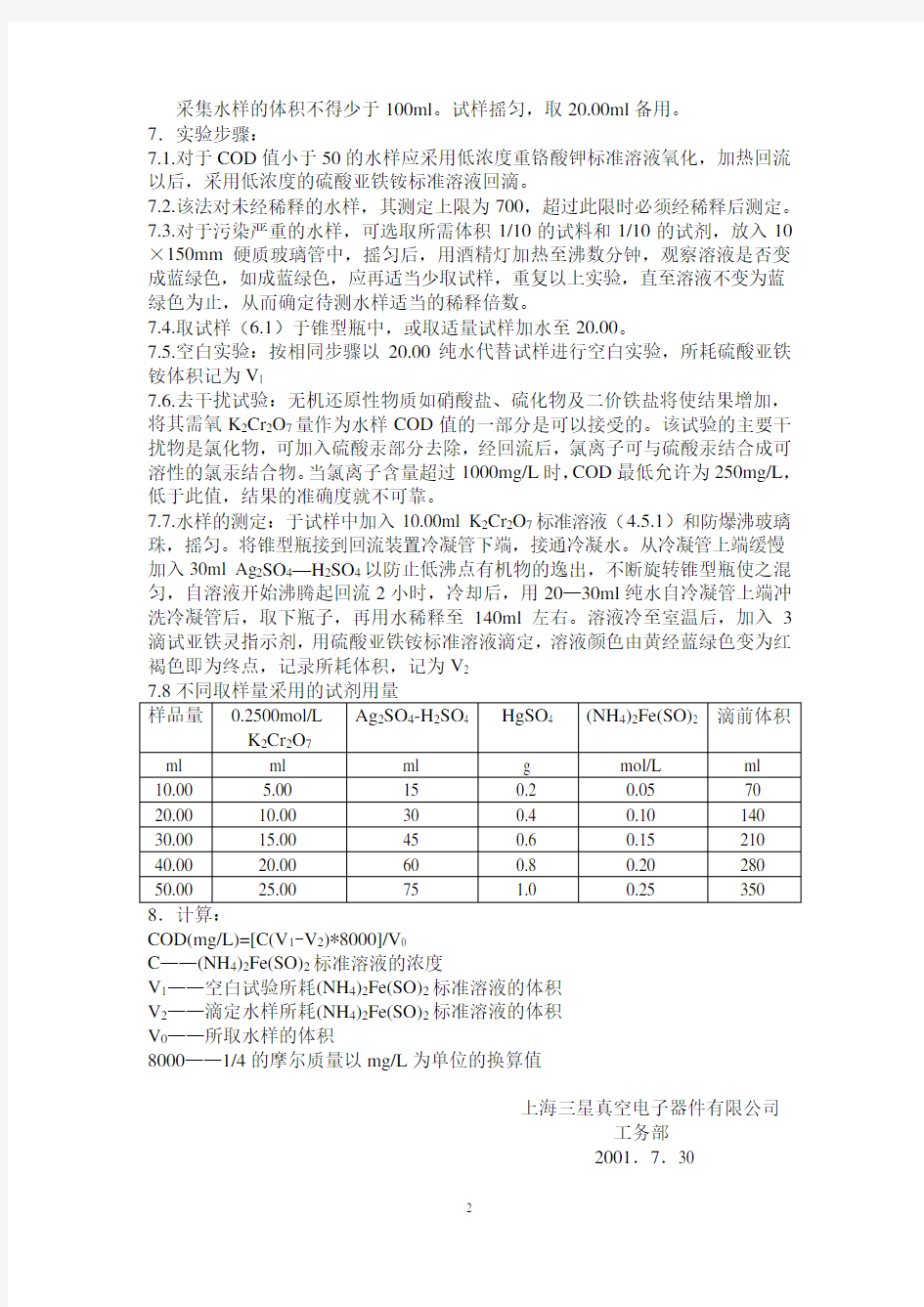
上海三星真空电子器件有限公司
工务部
2001.7.30
差量法化学计算题
差量法化学计算题https://www.360docs.net/doc/ef16646988.html,work Information Technology Company.2020YEAR
化学计算突破---差量法 例1.用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克? 例2.将CO和CO2的混合气体2.4克,通过足量的灼热的CuO 后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比? 例3.将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量? 例4.已知同一状态下,气体分子间的分子个数比等于气体间的体积比。把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比? 例5.给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数?练习1.将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数? 练习2.已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比? 练习3.把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。求⑴原混合气体中CO的质量?⑵反应后生成的CO2与原混合气体中CO2的质量比? 练习4.CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数? 练习5.在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是()写出解题思路 A Fe B Al C Ba(OH)2 D Na2CO3
初中化学计算题解题方法汇编_第1讲:差量法
第一讲差量法 例1、用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克? 例2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比? 例3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量? 例4、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比? 例5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数? 答案:1、8克 2、 7∶ 5 3、 11.2克 4、 8∶7 7∶23 5、 28.89% 练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数? 练习2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比? 练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。 求⑴原混合气体中CO的质量? ⑵反应后生成的CO2与原混合气体中CO2的质量比? 练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数? 练习5、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是( ) A Fe B Al C Ba(OH)2 D Na2CO3 练习6、在CuCl2和FeCl3溶液中加入足量的铁屑m克,反应完全后,过滤称量剩余固体为m克,则原混合溶液中CuCl2与FeCl3物质的量之比为( )(高一试题) A 1∶1 B 3∶2 C 7∶ D 2∶7 练习7 P克结晶水合物A?nH20,受热失去全部结晶水后,质量为q克,由此可得知该结晶水合物的分子量为( ) A18Pn/(P—q) B 18Pn/q C 18qn/P D 18qn/(P—q) 答案:1 、96% 5、 A 6 、C 7、 A
地下水—化学需氧量的测定—重铬酸盐氧化法
FHZDZDXS0088 地下水 化学需氧量的测定 重铬酸盐氧化法 F-HZ-DZ-DXS-0088 地下水—化学需氧量的测定—重铬酸盐氧化法 1 范围 本方法适用于污染严重的地下水中化学需氧量的测定。测定结果以氧的质量浓度表示。 测定范围:40mg/L ~500mg/L 。 2 原理 在煮沸的硫酸溶液中,大多数有机物能被重铬酸钾所氧化。用二氮杂菲-硫酸亚铁混合溶液作指示剂。以硫酸亚铁铵溶液回滴剩余的重铬酸钾。重铬酸钾在煮沸的强酸溶液中,对有机物的氧化虽比高锰酸钾法完全,但对某些有机物仍难以完全氧化,因此须加入银盐(硫酸银)作催化剂,以增强重铬酸钾的氧化作用。水样中的氯离子因能和硫酸银形成不溶性的氯化银沉淀,使硫酸银失去其作用,可先加入硫酸汞,使氯离子与高汞离子形成难以电离的氯化高汞而消除氯离子对测定的影响。 3 试剂 除非另有说明,本法所用试剂均为分析纯,水为蒸馏水,二次去离子水或等效纯水。 3.1 硫酸汞(HgSO 4)。 3.2 硫酸银溶液:在500mL 硫酸(H 2SO 4,ρ1.848/mL )中加入5g 硫酸银(Ag 2SO 4),放置1天~2天,待硫酸银溶解后摇匀使用。 3.3 重铬酸钾标准溶液[c (6 1K 2Cr 2O 7)=0.25mol/L]:称取12.2576g 预先在150℃烘2h 并在干燥器中冷却的重铬酸钾(K 2Cr 2O 7,光谱纯),溶于蒸馏水,移入1000mL 容量瓶中,再用蒸馏水稀释至刻度,摇匀。 3.4 硫酸亚铁铵标准溶液[c (FeSO 4(NH 4)2SO 4)=0.1mol/L] 3.4.1 配制:称取39.21g 硫酸亚铁铵[(FeSO 4(NH 4)2SO 4·6H 2O ,优级纯)]溶于硫酸溶液(3+97)中,并用硫酸溶液(3+97)稀释至1000mL ,摇匀。 3.4.2 标定:吸取三份10.0mL 重铬酸钾标准溶液[c (6 1K 2Cr 2O 7)=0.25mol/L]于三个三角瓶中,加100mL 蒸馏水,加10mL 硫酸(ρ1.84g/mL ),摇匀。待试液冷却后,加入邻二氮杂菲-硫酸亚铁混合溶液2滴,用硫酸亚铁铵溶液[c (FeSO 4(NH 4)2SO 4)=0.1mol/L]滴定到试液颜色由绿色突变为红褐色,即为滴定终点。记录硫酸亚铁铵溶液所用去的毫升数(V )。 3.4.3 按公式(1)计算硫酸亚铁铵溶液的浓度 c[FeSO 4(NH 4)2SO 4]= V 10250×.…………………………(1) 式(1)中: c[FeSO 4(NH 4)2SO 4]——硫酸亚铁铵标准溶液的浓度,mol/L ;
初中化学差量法计算题
一、差量法 1.用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克? 2.将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为 3.2克,求原混合气体中CO和CO2的质量比? 3.将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量? 4.已知同一状态下,气体分子间的分子个数比等于气体间的体积比。把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比? 5.给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数? 答案:1、8克 2 、7∶5 3 、11.2克4、8∶7 、7∶23 5 、28.89% 练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数? 练习2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比? 练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。 求⑴原混合气体中CO的质量? ⑵反应后生成的CO2与原混合气体中CO2的质量比? 练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数? 练习5、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是() A Fe B Al C Ba(OH)2 D Na2CO3 练习6、在CuCl2和FeCl3溶液中加入足量的铁屑m克,反应完全后,过滤称量剩余固体为m克,则原混合溶液中CuCl2与FeCl3物质的量之比为()
水质 COD的测定方法和注意事项(重铬酸盐法)
水质COD的测定(重铬酸钾法) 一、原理: 在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的重铬酸钾的量计算出消耗氧的质量浓度。 氧化反应: 15Cr2O72- + 3C8H5O4-(邻苯二甲酸氢钾) + 123H+→30Cr3+ + 24CO2 + 69H2O 二、测试流程
三、注意事项: 1.水样保存:应加入浓硫酸至pH<2,置于4°C下保存,保存时间不超过 5d。 2.水样前处理: ①氯离子浓度测试:硝酸银滴定,根据氯离子浓度,确定加入硫酸汞体积。氯离子浓度>1000mg/L时,水样需稀释。 3.试验条件: ①背景值控制:保证实验用水和试剂的纯度,实验用具使用前酸洗,锥形瓶可用马弗炉灼烧或铬酸清洗。 ②加热:从沸腾开始保持2小时,但要防止爆沸(造成测试误差)。 ③冷却:加热结束后,在电炉上冷却30mins,从冷凝管中加水,取下锥形瓶冷却至室温(不能有明显的温感)。 ④滴定终点:当溶液的颜色先变为蓝绿色再变到红褐色即达到终点(30s内不褪色),几分钟后可能还会重现蓝绿色(指示剂暴露在空气中被氧化)。 4.影响因素: ①氯离子干扰:氯离子被重铬酸钾氧化而影响测试结果。 消除方法:<1000mg/L时,用HgSO 4进行掩蔽,生成[HgCl 4 ]2- 稳定配合物。 >1000mg/L时,水样先稀释,再用HgSO 4 进行掩蔽。 ②还原性物质干扰:硫化物、亚铁离子和亚硝酸盐等还原性物质干扰。HJ 828-2017测试的COD不仅包含有机物耗氧量,也包含还原性无机物的耗氧量。 ③催化剂:硫酸银作用是使由有机物氧化形成的有机酸(R-COOH),进一 步被催化氧化形成水和CO 2 ,即。 ④氧化能力:酸性重铬酸钾溶液对于大部分有机化合物的氧化率为95-100%(反应中条件氧化还原电位E可以达到1.55V-1.42V)。但是苯、嘧啶等结构稳定的有机物,其氧化率不到20%。 参考标准:HJ 828-2017 水质化学需氧量的测定重铬酸盐法
初中化学差量法计算题
差量法 例1、用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克? 例2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比? 例3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量? 例4、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比? 例5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数? 答案:1、8克 2 、7∶5 3 、11.2克4、8∶7 、7∶23 5 、28.89% 练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这1 0克残渣中铜元素的质量分数? 练习2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比? 练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。 求⑴原混合气体中CO的质量? ⑵反应后生成的CO2与原混合气体中CO2的质量比?
练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数? 练习5、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是() A Fe B Al C Ba(OH)2 D Na2CO3 练习6、在CuCl2和FeCl3溶液中加入足量的铁屑m克,反应完全后,过滤称量剩余固体为m克,则原混合溶液中CuCl2与FeCl3物质的量之比为()(高一试题) A 1∶1B3∶2 C 7∶ D 2∶7 练习7 P克结晶水合物AnH20,受热失去全部结晶水后,质量为q克,由此可得知该结晶水合物的分子量为() A18Pn/(P—q) B 18Pn/q C18qn/P D18qn/(P—q) 答案:1 、96% 5、A 6 、C7、 A 二、平均值法 三、离子守恒法 例题:1、一块质量为4克的合金,与足量的盐酸反应,产生0.2克氢气。则该合金的组成可能为() A Fe Mg B Fe Al C Fe Zn D Mg Al 2、测知CO和M的混合体气体中,氧的质量分数为50% 。则M气体可能是() A CO2 B N2O C SO2 D SO3 3、某硝酸铵(NH4NO3)样品,测知含氮量为37%,则该样品中含有的杂质可能是() A (NH4)2SO4 B CO(NH2)2 C NH4HCO3 D NH4Cl 4、有Zn和另一种金属组成的混合物4。5克,与足量的盐酸反应,放出所氢气
COD的测定-重铬酸盐法
水质化学需氧量的测定重铬酸盐法GB 11914-89 批准日期1989-09-01实施日期1989-09-01 水质化学需氧量的测定 重铬酸盐法 GB 11914-89 Water quality—Determinotion of the chemical oxygen demand— Dichromate method 1 主题内容与应用范围 本标准规定了水中化学需氧量的测定方法。 本标准适用于各种类型的含COD值大于30mg/L的水样,对未经稀释的水样的测定上限为700mg/L。 本标准不适用于含氯化物浓度大于1000mg/L(稀释后)的含盐水。 2 定义 在一定条件下,经重铬酸钾氧化处理时,水样中的溶解性物质和悬浮物所消耗的重铬酸盐相对应的氧的质量浓度。 3 原理 在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。 在酸性重铬酸钾条件下,芳烃及吡啶难以被氧化,其氧化率较低。在硫酸银催化作用下,直链脂肪族化合物可有效地被氧化。 4 试剂 除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。 4.1 硫酸银(Ag2SO4),化学纯。 4.2 硫酸汞(HgS04),化学纯。 4.3 硫酸(H2SO4),p=1.84g/mL。
4.4 硫酸银-硫酸试剂:向1L硫酸(4.3)中加入10g硫酸银(4.1).放置1—2天使之溶解,并混匀,使用前小心摇动。 4.5 重铬酸钾标准溶液: 4.5.1 浓度为C(1/6K2Cr2O7)=0.250mol/L的重铬酸钾标准溶液:将12.258g在105℃干燥2h后的重铬酸钾溶于水中,稀释至1000mL。 4.5.2 浓度为C(1/6K2Cr2O7)=0.0250mo1/L的重铬酸钾标准溶液:将4.5.1条的溶液稀释10倍而成。 4.6硫酸亚铁铵标准滴定溶液 4.6.1 浓度为C[(NH4)2Fe(SO4)2·6H2O]≈0.10mo1/L的硫酸亚铁铵标准滴定溶液;溶解39g硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]于水中,加入20mL硫酸(4.3),待其溶液冷却后稀释至1000mL。 4.6.2 每日临用前,必须用重铬酸钾标准溶液(4. 5.1)准确标定此溶液(4. 6.1)的浓度。 取10.00mL重铬酸钾标准溶液(4.5.1)置于锥形瓶中,用水稀释至约100mL,加入30mL硫酸(4.3),混匀,冷却后,加3滴(约0.15mL)试亚铁灵指示剂(4.7),用硫酸亚铁铵(4.6.1)滴定溶液的颜色由黄色经蓝绿色变为红褐色,即为终点。记录下硫酸亚铁铵的消耗量(mL)。 4.6.3 硫酸亚铁铵标准滴定溶液浓度的计算: 式中:V--滴定时消耗硫酸亚铁铵溶液的毫升数。 4.6.4 浓度为C[(NH4)2Fe(SO4)2·6H2O)≈0.010mo1/L的硫酸亚铁铵标准滴定溶液:将4.6.1条的溶液稀释10倍,用重铬酸钾标准溶液(4. 5.2)标定,其滴定步骤及浓度计算分别与4. 6.2及4.6.3类同。 4.7 邻苯二甲酸氢钾标准溶液,C(KC6H5O4)=2.0824mmo1/L:称取105℃时干燥2h的邻苯二甲酸氢钾(HOOCC6H4COOK)0.4251g溶于水,并稀释至1000mL,混匀。以重铬酸钾为氧化剂,将邻苯二甲酸氢钾完全氧化的COD值为1.1768氧/克(指1g邻苯二甲酸氢钾耗氧1.176g)故该标准溶液的理论COD值为500mg/L。 4.8 1,10-菲绕啉(1,10-phenanathroline monohy drate)指示剂溶液:溶解0.7g七水合硫酸亚铁(FeSO4·7H2O)于50mL的水中,加入1.5g1,10-菲统啉,搅动至溶解,加水稀释至100mL。 4.9 防爆沸玻璃珠。 5 仪器 常用实验室仪器和下列仪器。 5.1 回流装置:带有24号标准磨口的250mL锥形瓶的全玻璃回流装置。回流冷凝管长度为300—500mm。若取样量在30mL以上,可采用带500 mL锥形瓶的全玻璃回流装置。
初中化学差量法计算
一:课堂引入(差量法的应用条件) 1.差量法是根据反应前后物质的量发生的变化(即差量)列比例式计算的。 2.差量可以是固态、液态物质的质量,也可以是气态物质的体积等。 3.差量的大小与参加反应的反应物量或生成物量有一定的比例关系。 4.差量也是质量守恒定律的一种表现形式。 5.仔细分析题意,选定相关化学量的差量。质量差均取正值。 6.差量必须是同一物理量及其单位,同种物态。 二:课堂例题讲解 : 1、金属与盐溶液反应,根据差量求参加反应的金属质量或生成物的质量。 例题:将质量为8g的铁片浸入硫酸铜溶液中一会,取出干燥后称得铁片质量为8.4g,问参加反应的铁的质量为多少克? 解:设参加反应的铁的质量为x Fe + CuSO4 = Fe SO4 + Cu △m 56 64 8 X (8.4-8)g 56/8=x/0.4g x =2.8g — 答:参加反应的铁的质量为2.8 g。 注意:本题出现的质量差是固体质量差。 2、金属与酸发生反应,根据差量求天平平衡问题。 例题:在天平两托盘行分别放置盛有等质量且足量稀盐酸的烧杯,调至天平平衡。现往左盘烧杯中加入 2.8 g铁,问向右盘烧杯中加入多少克碳酸钙才能天平平衡? 解:设左盘加入铁后增重的质量为x 设右盘加入碳酸钙的质量为y 】 Fe + 2HC1 = FeC12 +H2↑ △m CaCO3 + 2HC1 = Ca C12 + H2O + CO2↑ △m 56 2 54 100 44 56 2.8 x y x 56/54=2.8 g/ x x = 2.7 g 100/56= y/2.7 g y=4.8g 答:向右盘烧杯中加入4.8 g碳酸钙才能使天平平衡。 $ 3、根据反应前后物质质量差求反应物或生成物质量。 例题:将一定量氢气通过8g灼热的氧化铜,反应一段时间后冷却后称量剩余固体质量为7.2g,问有多少克氧化铜参加了反应? 解:设参加反应的氧化铜的质量为x CuO + H2Cu + H2O △m 80 64 16 x (8-7.2) g 80/16= x/0.8 g x = 4g /
九年级化学计算差量法
“差量法”巧解化学计算题2015年遂平县第一次摸底考试最后一道题四、23(5)某碳酸钠样品中含有少量的氯化钠。现称量11克该样品放入烧杯中,然后加入一定量的溶质质量分数为14.6%的稀盐酸至恰好完全反应,去除溶液中的水分,最终得到12.1ɡ氯化钠固体。计算:1.碳酸钠样品中碳酸钠的质量;2.反应后所得溶液中溶质的质量分数。(结果精确到0.1%)此题运用差量法解题特别是第一问应用最简便容易。今年我县化学计算得分最低。“差量法”是在化学计算题中常采用一些计算技巧,这样可以大大简化运算量,提高运算准确度。差量法是根据在化学反应中反应物与生成物的差量和造成这种差量的实质及二者关系,列出比例式求解的解题方法。差量的大小与参与反应的物质的有关量成正比。我们学过的化学反应前后有固体质量差、气体质量差、气体体积差等都可用差量法求解。解题的关键是做到明察秋毫,抓住造成差量的实质,即根据题意确定“理论差值”,再根据题目提供的“实际差量”,列出正确的比例式,求出答案。 例1.将12克和2的混合气体通过足量灼热的氧化铜后,得到气体的总质量为18克,求原混合气体中的质量分数。 【解析】2 28 44 由化学方程式可知,气体质量增加的原因是夺取了氧化铜中的氧元素。每28份质量的参加反应,可生成44份质量的2,使气体质量增加44-28=16(份)。现已知气体质量增加18克-12克=6克,据此可列比例求解。
解:设原混合气体中的质量分数为x m(气体质量增加) 2△ 28 44 44-28=16 12x 18126克 可求出87.5% 答:原混合气体中的质量分数为87.5%。 差量法是依据化学反应前后的莫些“差量”(固体质量差、溶液质量差、气体体积差、气体物质的量之差等)与反应物或生成物的变化量成正比而建立的一种解题法。 此法将“差量”看作化学方程式右端的一项,将已知差量(实际差量)与化学方程式中的对应差量(理论差量)列成比例,其他解题步骤与化学方程式列比例式解题完全一致。 用差量法解题的关键是正确找出理论差量。 [差量法在化学计算中有广泛的用途,其中较为常见的是“质量差法”和“体积差法”] 差量法的适用条件: 1.差量法是根据反应前后物质的量发生的变化(即差量)列比例式计算的。 2.差量可以是因态、液态物质的质量,也可以是气态物质的体积等。 3.差量的大小与参加反应的反应物量或生成物量有一定的比例关系。 4.差量也是质量守恒定律的一种表现形式。 5.仔细分析题意,选定相关化学量的差量。质量差均取正值。 6.差量必须是同一物理量及其单位,同种物态。
山东省地方标准3737 高氯水质 化学需氧量的测定 重铬酸盐法
ICS13.060 Z 16 DB37 山东省地方标准 DB 37/T 3737—2019 高氯水质化学需氧量的测定重铬酸盐 法 High chlorinated water quality—Determination of chemical oxygen demand—Dichromate method 2019- 12 -05发布2020-01-05实施
目次 前言................................................................................ II 1 范围 (1) 2 规范性引用文件 (1) 3 术语和定义 (1) 4 方法原理 (1) 5 干扰和消除 (2) 6 试剂和材料 (2) 7 仪器和设备 (4) 8 样品采集 (5) 9 分析步骤 (5) 10 计算结果与表示 (7) 11 精密度和准确度 (7) 12 质量保证和质量控制 (8) 13 废物处理 (8) 14 注意事项 (8)
前言 本标准按照GB/T 1.1—2009给出的规则起草。 本标准由山东省生态环境厅提出并组织实施。 本标准由山东省环保标准化技术委员会归口。 本标准起草单位:山东省环境监测中心。 本标准主要起草人:王德明、王文雷、宋永超、魏征、许艳芳、刘金芝、金玲仁。
高氯水质化学需氧量的测定重铬酸盐法警告:本方法所用试剂硫酸汞剧毒,实验人员应避免直接接触。样品前处理过程应在通风橱中进行。 1 范围 本标准规定了测定高氯水质中化学需氧量的重铬酸盐法。 本标准适用于氯离子质量浓度1 000 mg/L~30 000 mg/L的地表水、生活污水及工业废水等水质化学需氧量(COD)的测定。 取样量为20.0 ml时,方法的检出限为4 mg/L,方法的测定下限为16 mg/L。 2 规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 GB 11896 水质氯化物的测定硝酸银滴定法 HJ/T 91 地表水和污水监测技术规范 HJ/T 195 水质氨氮的测定气相分子吸收光谱法 HJ 535 水质氨氮的测定纳氏试剂分光光度法 3 术语和定义 下列术语和定义适用于本文件。 高氯水high chlorinated water 指氯离子含量大于1 000 mg/L的水。 表观COD apparent COD 指在一定条件下,由水样所消耗的重铬酸钾的量,换算成相应的氧的质量浓度。 氯离子校正值chlorine ion correction value 指水样中被氧化的氯离子生成的氯气所对应氧的质量浓度。 4 方法原理
表面钝化处理工艺
钝化是将金属置于亚硝酸盐、硝酸盐、铬酸盐或重铬酸盐溶液中处理,使金属表面生成一层铬酸盐钝化膜的过程。常作为锌、镉镀层的后处理,提高镀层的耐蚀性;有色金属的防护;提高漆膜的附着力等。 铁、铝在稀HNO3或稀H2SO4中能很快溶解,但在浓HNO3或浓H2SO4中溶解现象几乎完全停止了,碳钢通常很容易生锈,若在钢中加入适量的Ni、Cr,就成为不锈钢了。金属或合金受一些因素影响,化学稳定性明显增强的现象,称为钝化。由某些钝化剂(化学药品)所引起的金属钝化现象,称为化学钝化。如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4等氧化剂都可使金属钝化。金属钝化后,其电极电势向正方向移动,使其失去了原有的特性,如钝化了的铁在铜盐中不能将铜置换出。此外,用电化学方法也可使金属钝化,如将Fe置于H2SO4溶液中作为阳极,用外加电流使阳极极化,采用一定仪器使铁电位升高一定程度,Fe就钝化了。由阳极极化引起的金属钝化现象,叫阳极钝化或电化学钝化。 金属处于钝化状态能保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如电镀和化学电源等。 金属是如何钝化的呢?其钝化机理是怎样的?首先要清楚,钝化现象是金属相和溶液相所引起的,还是由界面现象所引起的。有人曾研究过机械性刮磨对处在钝化状态的金属的影响。实验表明,测量时不断刮磨金属表面,则金属的电势剧烈向负方向移动,也就是修整金属表面可引起处在钝态金属的活化。即证明钝化现象是一种界面现象。它是在一定条件下,金属与介质相互接触的界面上发生变化的。电化学钝化是阳极极化时,金属的电位发生变化而在电极表面上形成金属氧化物或盐类。这些物质紧密地覆盖在金属表面上成为钝化膜而导致金属钝化,化学钝化则是像浓HNO3等氧化剂直接对金属的作用而在表面形成氧化膜,或加入易钝化的金属如Cr、Ni等而引起的。化学钝化时,加入的氧化剂浓度还不应小于某一临界值,不然不但不会导致钝态,反将引起金属更快的溶解。 金属表面的钝化膜是什么结构,是独立相膜还是吸附性膜呢?目前主要有两种学说,即成相膜理论和吸附理论。成相膜理论认为,当金属溶解时,处在钝化条件下,在表面生成紧密的、复盖性良好的固态物质,这种物质形成独立的相,称为钝化膜或称成相膜,此膜将金属表面和溶液机械地隔离开,使金属的溶解速度大大降低,而呈钝态。实验证据是在某些钝化的金属表面上,可看到成相膜的存在,并能测其厚度和组成。如采用某种能够溶解金属而与氧化膜不起作用的试剂,小心地溶解除去膜下的金属,就可分离出能看见的钝化膜,钝化膜是怎样形成的?当金属阳极溶解时,其周围附近的溶液层成分发生了变化。一方面,溶解下来的金属离子因扩散速度不够快(溶解速度快)而有所积累。另一方面,界面层中的氢离子也要向阴极迁移,溶液中的负离子(包括OH-)向阳极迁移。结果,阳极附近有OH-离子和其他负离子富集。随着电解反应的延续,处于紧邻阳极界面的溶液层中,电解质浓度有可能发展到饱和或过饱和状态。于是,溶度积较小的金属氢氧化物或某种盐类就要沉积在金属表面并形成一层不溶性膜,这膜往往很疏松,它还不足以直接导致金属的钝化,而只能阻碍金属的溶解,但电极表面被它覆盖了,溶液和金属的接触面积大为缩小。于是,就要增大电极的电流密度,电极的电位会变得更正。这就有可能引起OH-离子在电极上放电,其产物(如OH-)又和电极表面上的金属原子反应而生成钝化膜。分析得知大多数钝化膜由金属氧化物组成(如铁之Fe2O3),但少数也有由氢氧化物、铬酸盐、磷酸盐、硅酸盐及难溶硫酸盐和氯化物等组成。 吸附理论认为,金属表面并不需要形成固态产物膜才钝化,而只要表面或部分表面形成一层氧或含氧粒子(如O2-或OH-)的吸附层也就足以引起钝化了。这吸附层虽只有单分子层厚薄,但由于氧在金属表
化学需氧量的测定-重铬酸盐法(GB11914—89)
化学需氧量的测定(重铬酸盐法) (GB11914—89) 1.内容与应用范围:本标准规定了水中化学需氧量的测定方法。本标准适用于各种类型的含COD大于30mg/L的水样,对未经稀释的水样的测定上限为700mg/L,不适用于氯化物浓度大于1000mg/L(稀释后)的含盐水。 2.定义:在一定条件下,经重铬酸钾氧化处理时,水样中的溶解性物质和悬浮物所消耗的重铬酸钾盐相对应的氧的质量浓度。 3.原理:在水样中加入已知量的K2Cr2O7溶液,并在强酸介质下银盐做催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。在酸性K2Cr2O7条件下,芳烃及吡啶难以被氧化,其氧化率较底。在Ag2SO4的催化作用下,直链脂肪族化合物可有效的被氧化。 4.试剂 4.1.硫酸银(Ag2SO4) 4.2.硫酸汞(HgSO4) 4.3.硫酸(H2SO4)(ρ=1.84g/L) 4.4.Ag2SO4—H2SO4向1LH2SO4中加入10gAg2SO4放置1—2天使之溶解,并混匀,使用前小心摇动。 4.5.K2Cr2O7标准溶液 4.5.1.浓度为(1/6 K2Cr2O7)=0.2500mol/L的K2Cr2O7:将12.2580G在105o C干燥2h后的K2Cr2O7溶于水中,稀释至1L。 4.5.2.浓度为C(1/6 K2Cr2O7)=0.02500mol/L 的K2Cr2O7:将250mol/L的K2Cr2O7:将4.5.1的溶液稀释10倍而成。 4.6硫酸亚铁铵标准滴定溶液 4.6.1.C[(NH4)2Fe(SO4)2]=0.10mol/L标准滴定溶液:溶解39g[(NH4)2Fe(SO4)26H2O]于水中,加入20mlH2SO4,待其溶液冷却后稀释至1L。 4.6.2.每日临用前,必须用K2Cr2O7标准溶液标定:取10.00mlK2Cr2O7标准溶液置于锥型瓶中,用水稀释至100ml,加入30mlH2SO4,混匀,冷却后,加3滴(约015ml)试亚铁灵为指示剂,用硫酸亚铁铵标准滴定溶液滴定溶液的颜色由黄经蓝绿色变为红褐色,即为终点。记录用量。 4.6.3.硫酸亚铁铵标准滴定溶液浓度的计算:C[(NH4)2Fe(SO4)2·6H2O]= (10.00×0.2500)/V=2.50/V。(V—滴定所消耗的硫酸亚铁铵标准滴定溶液的体积) 4.6.4.1,10—菲罗啉(1,10phenanathroline monohy)指示剂:溶解0.7g七水合硫酸亚铁(FeSO4·7H2O)于50ml水中,加入1.5g1,10—菲罗啉,搅动至溶解,加水稀释至100ml。 5.仪器 回流装置:带有24号标准磨口的250ml锥型瓶的全玻璃回流装置,回流冷凝管长度为300—500mm。若取样量30ml以上,可采用带500ml锥型瓶的全玻璃回流装置。 6.采样和样品:水样要采集于玻璃瓶或聚乙烯瓶中,应尽快分析,如不能立即分析,应加入H2SO4(4.3)至PH<2,置4℃下保存,但保存时间不多于5天,
初中化学差量法计算题讲课稿
初中化学差量法计算 题
差量法 例1、用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克? 例2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比? 例3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量? 例4、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比? 例5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数? 答案:1、 8克 2 、7∶ 5 3 、11.2克 4、 8∶7 、7∶23 5 、28.89% 练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数? 练习2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、O 2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比? 练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。 求⑴原混合气体中CO的质量? ⑵反应后生成的CO2与原混合气体中CO2的质量比?
练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数? 练习5、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是() A Fe B Al C Ba(OH)2 D Na2CO3 练习6、在CuCl2和FeCl3溶液中加入足量的铁屑m克,反应完全后,过滤称量剩余固体为m克,则原混合溶液中CuCl2与FeCl3物质的量之比为()(高一试题) A 1∶1 B 3∶2 C 7∶ D 2∶7 练习7 P克结晶水合物AnH20,受热失去全部结晶水后,质量为q克,由此可得知该结晶水合物的分子量为() A18Pn/(P—q) B 18Pn/q C 18qn/P D 18qn/(P—q) 答案:1 、96% 5、 A 6 、C 7、 A 二、平均值法 三、离子守恒法 例题:1、一块质量为4克的合金,与足量的盐酸反应,产生0.2克氢气。则该合金的组成可能为() A Fe Mg B Fe Al C Fe Zn D Mg Al 2、测知CO和M的混合体气体中,氧的质量分数为50% 。则M气体可能是() A CO2 B N2O C SO2 D SO3 3、某硝酸铵(NH4NO3)样品,测知含氮量为37%,则该样品中含有的杂质可能是() A (NH4)2SO4 B CO(NH2)2 C NH4HCO3 D NH4Cl
水质化学需氧量的测定重铬酸盐法
水质化学需氧量的测定 重铬酸盐法 Pleasure Group Office【T985AB-B866SYT-B182C-BS682T-STT18】
水质化学需氧量的测定重铬酸盐法 Water quality—Determinotion of the chemical oxygen demand— Dichromate method GB 11914-89 批准日期1989-09-01 实施日期1989-09-01 1 主题内容与应用范围 本标准规定了水中化学需氧量的测定方法。 本标准适用于各种类型的含COD值大于30mg/L的水样,对未经稀释的水样的测定上限为 700mg/L。 本标准不适用于含氯化物浓度大于1000mg/L(稀释后)的含盐水。 2 定义 在一定条件下,经重铬酸钾氧化处理时,水样中的溶解性物质和悬浮物所消耗的重铬酸盐相对应的氧的质量浓度。 3 原理 在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。 在酸性重铬酸钾条件下,芳烃及吡啶难以被氧化,其氧化率较低。在硫酸银催化作用下,直链脂肪族化合物可有效地被氧化。 4 试剂 除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。 硫酸银(Ag 2SO 4 ),化学纯。 硫酸汞(HgS0 4 ),化学纯。 硫酸(H 2SO 4 ),p=mL。
硫酸银-硫酸试剂:向1L硫酸中加入10g硫酸银.放置1~2天使之溶解,并混匀,使用前小心摇动。 重铬酸钾标准溶液: 浓度为C(1/6K 2Cr 2 O 7 )=L的重铬酸钾标准溶液:将在105℃干燥2h后的重铬酸钾溶于水中,稀释至 1000mL。 浓度为C(1/6K 2Cr 2 O 7 )=L的重铬酸钾标准溶液:将条的溶液稀释10倍而成。 硫酸亚铁铵标准滴定溶液 浓度为C[(NH 4) 2 Fe(SO 4 ) 2 ·6H 2 O]≈L的硫酸亚铁铵标准滴定溶液;溶解39g硫酸亚铁铵 [(NH 4) 2 Fe(SO 4 ) 2 ·6H 2 O]于水中,加入20mL硫酸,待其溶液冷却后稀释至1000mL。 每日临用前,必须用重铬酸钾标准溶液准确标定此溶液的浓度。 取重铬酸钾标准溶液置于锥形瓶中,用水稀释至约100mL,加入30mL硫酸,混匀,冷却后,加3滴(约试亚铁灵指示剂,用硫酸亚铁铵滴定溶液的颜色由黄色经蓝绿色变为红褐色,即为终点。记录下硫酸亚铁铵的消耗量(mL)。 硫酸亚铁铵标准滴定溶液浓度的计算: 式中:V--滴定时消耗硫酸亚铁铵溶液的毫升数。 浓度为C[(NH 4) 2 Fe(SO 4 ) 2 ·6H 2 O)≈L的硫酸亚铁铵标准滴定溶液:将条的溶液稀释10倍,用重铬酸 钾标准溶液标定,其滴定步骤及浓度计算分别与及类同。 邻苯二甲酸氢钾标准溶液,C(KC 6H 5 O 4 )=L:称取105℃时干燥2h的邻苯二甲酸氢钾(HOOCC 6 H 4 COOK) 溶于水,并稀释至1000mL,混匀。以重铬酸钾为氧化剂,将邻苯二甲酸氢钾完全氧化的COD值为氧/克(指1g邻苯二甲酸氢钾耗氧故该标准溶液的理论COD值为500mg/L。 1,10-菲绕啉(1,10-phenanathroline monohy drate)指示剂溶液:溶解七水合硫酸亚铁 (FeSO 4·7H 2 O)于50mL的水中,加入 l,10-菲统啉,搅动至溶解,加水稀释至100mL。 防爆沸玻璃珠。
化学转化处理
化学转化处理 由金属或其腐蚀产物与环境中的组分发生反应而形成保护性膜的表面防护方法。化学转化处理通常分为电化学法和化学法两种。电化学法即阳极氧化,系外加电流通过电化学反应形成阳极氧化膜的方法。化学法则利用浸液或喷液法,通过金属与介质界面的纯化学反应形成化合物膜。化学法有化学氧化、草酸盐处理、磷酸盐处理(磷化)和铬酸盐处理(铬化)等,分别形成氧化物膜、草酸盐膜、磷酸盐膜和铬酸盐膜。化学法中以磷化和铬化最为普遍。 阳极氧化在铝上应用最为普遍,也应用于铜、钛、锆、钽以及硅和锗上。化学氧化用于钢、铝和铜上;磷化可用在钢、铝、锌和镁等金属上;铬化应用也很广泛,可用于钢、锌、镉、镁、铝、铜、锡和银上。铝合金的铬-磷化复盐处理可以得到耐蚀好的膜,也是目前采用广泛的铝表面处理方法之一。 化学转化膜广泛应用于机械、电子、兵器、航空和仪器仪表等工业部门以及日用品生产上,作为防腐蚀、耐磨、减摩和其他功能性的表面覆盖层。化学转化膜还凭借本身色彩起装饰作用,也利用其多孔性吸收物质而着色,常应用于建材和日用品装饰上。化学转化膜也可作为金属镀层的底层而提高镀层与基体的结合力。化学转化膜在金属冷作加工中,可以起润滑和减摩双重作用,而有利于在高负荷下进行加工。 化学转化膜的防护功效常取决于以下因素:(1)基体金属本性。(2)转化膜类型、组成和结构。 (3)膜的性能(包括结合力、孔隙率等)和环境条件。化学转化膜与其他防护层相比较,其防护功效并非是最有效的。因此,金属在进行化学转化处理后,通常还需要补加其他防护措施。 字数:680 参考文献 吴纯素.化学转化膜.北京:化学工业出版社,1988 作者:朱祖芳 知识来源:中国冶金百科全书总编辑委员会《金属材料卷》编辑委员会编.中国冶金百科全书·金属材料.北京:冶金工业出版社.2001.第427-428页. 收录词条数:1083
(完整版)初中化学差量法计算
初中化学差量法计算 差量法 例1、用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克? 例2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比? 例3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量? 例4、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比? 例5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数?答案:1、8克 2 、7∶5 3 、11.2克4、8∶7 、7∶23 5 、28.89% 练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数? 练习2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比? 练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。 求⑴原混合气体中CO的质量? ⑵反应后生成的CO2与原混合气体中CO2的质量比? 练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数? 练习5、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是() A Fe B Al C Ba(OH)2 D Na2CO3 练习6、在CuCl2和FeCl3溶液中加入足量的铁屑m克,反应完全后,过滤称量剩余固体为m克,则原混合溶液中CuCl2与FeCl3物质的量之比为()(高一试题) A 1∶1 B 3∶2 C 7∶ D 2∶7 练习7 P克结晶水合物AnH20,受热失去全部结晶水后,质量为q克,由此可得知该结晶水合物的分子量为() A18Pn/(P—q) B 18Pn/q C 18qn/P D 18qn/(P—q) 答案:1 、96% 5、A 6 、C 7、A 二、平均值法 三、离子守恒法 例题:1、一块质量为4克的合金,与足量的盐酸反应,产生0.2克氢气。则该合金的组成可能为() A Fe Mg B Fe Al C Fe Zn D Mg Al 2、测知CO和M的混合体气体中,氧的质量分数为50% 。则M气体可能是() A CO2 B N2O C SO2 D SO3 3、某硝酸铵(NH4NO3)样品,测知含氮量为37%,则该样品中含有的杂质可能是() A (NH4)2SO4 B CO(NH2)2 C NH4HCO3 D NH4Cl 4、有Zn和另一种金属组成的混合物4。5克,与足量的盐酸反应,放出所氢气 0.2克,则另一种种种金属可能是() A Al B Mg C Zn D Cu 分反应,得到14·4克氯化银沉淀,则可能混有的盐(山西省中考)() A CaCl2 B KCl C BaCl2 D MgCl2 6、今取12·7克氯化亚铁样品,完全溶于水制成溶液然后加入足量的硝酸银溶液,使其充分反应,得氯化银沉淀,经干燥后称量质量为30克,已知,样品内杂质为氯化物,则该杂质可能是() A KCl B NaCl C ZnCl2 D BaCl2 答案:1:A B 2:B 3:B 4:A B 5 、A D 6 、B
