NaOH水溶液的比重与浓度对照表
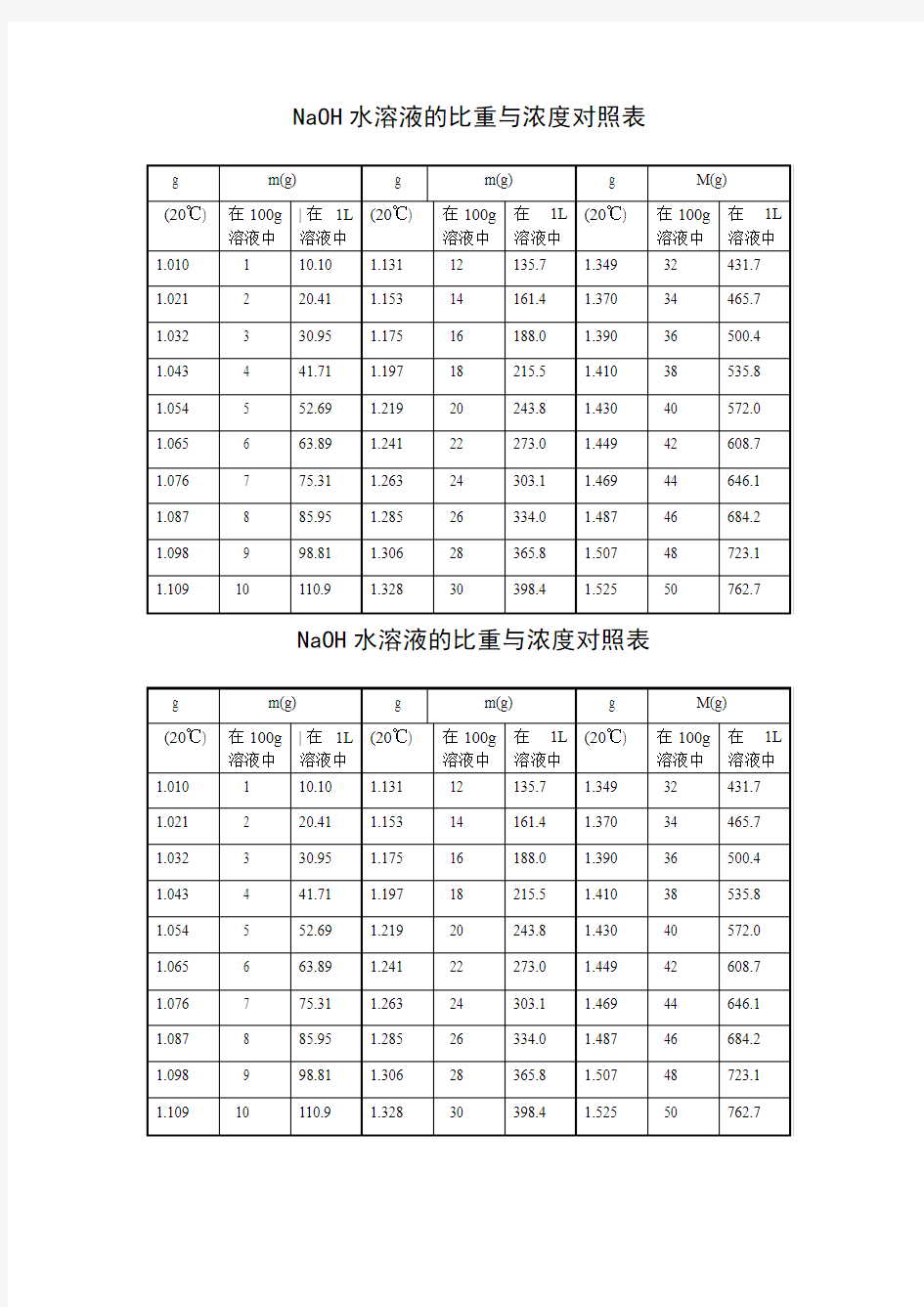
NaOH水溶液的比重与浓度对照表
NaOH水溶液的比重与浓度对照表
及其甲烷二氧化碳重整反应的性能
doi:10.6043/j.issn.0438-0479.201811009 氨辅助浸渍法制备抗烧结Ni/SiO 2催化剂 及其甲烷二氧化碳重整反应的性能 万吉纯,朱孔涛,翁维正*,楚沙沙,郑燕萍,黄传敬,万惠霖 (厦门大学化学化工学院,固体表面物理化学国家重点实验室,醇醚酯化工清洁生产国家 工程实验室,福建 厦门 361005) 摘要:以硝酸镍为前驱盐,商品SiO 2为载体,采用氨水辅助浸渍法通过改变n (NH 3)/n (Ni)制备了系列Ni/SiO 2催化剂,并将其应用于甲烷二氧化碳重整(DRM )制合成气反应,实验结果表明:在浸渍过程中加入氨水可显著改善Ni/SiO 2的DRM 反应活性、稳定性和抗积碳性。进一步的表征结果表明,随着氨水添加量的增加,催化剂活性相分散度提高,当n (NH 3)/n (Ni) ≥ 6 后,经800 ℃焙烧后催化剂上NiO 物种的平均粒径小于5 nm 。通过改变氨水,SiO 2,前驱盐的浸渍顺序发现只有用硝酸镍与一定浓度的氨水配成的混合溶液浸渍SiO 2才能获得具有良好分散度的Ni/SiO 2催化剂。氨水与Ni 形成镍氨络合物能够避免在浸渍过程中生成Ni(OH)2沉淀,进而有利于Ni 物种在SiO 2表面的均匀分散。氨水所形成的碱性环境还可使载体表面Si-O 物种部分溶解或“软化”,进而促进Ni 物种与载体表面Si-O 物种的相互作用,在后续的焙烧过程中生成与SiO 2具有较强相互作用的镍物种以及表面镍硅酸盐物种。这些物种具有良好的抗烧结性能,可防止Ni 物种在高温下团聚并在600 ℃以上通H 2还原后得到分散性良好且具有较强抗烧结性能的的金属Ni 颗粒。 关键词: Ni/SiO 2;氨水辅助浸渍;抗烧结;镍硅酸盐;甲烷二氧化碳重整 中图分类号:O 643.36+1 文献标志码: A 甲烷二氧化碳重整(DRM )制合成气反应是利用甲烷和二氧化碳这两种重要的含碳资源的一个有效途径,对缓解能源危机,减轻温室气体排放等具有重要意义[1-2]。目前用于DRM 反应的催化剂主要有3类,其中,负载型贵金属催化剂虽然催化活性高,稳定性好但是价格昂贵[3-6];金属硫化物或氧化物等虽然价格低廉但是常压下相比于Ni 基催化剂反应速率更慢且易于失活[7-8],需要在高压下反应;负载型非贵金属催化剂,尤其是Ni 基催化剂价格便宜,催化活性高,但在反应条件下容易发生烧结和积碳,导致催化剂失活[9-10]。如果能够解决厦门大学学报(自然科学版)
过氧化氢浓度密度对照表
过氧化氢浓度密度对照 表 标准化工作室编码[XX968T-XX89628-XJ668-XT689N]
浓度0% 浓度0.5% 浓度1% 浓度1.5% 浓度2% 浓度2.5% 浓度3% 浓度3.5% 浓度4%6 浓度4.5% 浓度5% 浓度5.5% 浓度6% 浓度6.5% 浓度7% 浓度7.5% 浓度8% 浓度8.5% 浓度9% 浓度9.5% 浓度10% 浓度10.5% 浓度11% 浓度11.5% 浓度12% 浓度12.5% 浓度13% 浓度13.5% 浓度14% 浓度14.5% 浓度15% 浓度15.5% 浓度16% 浓度16.5% 浓度17% 浓度17.5%8 浓度18% 浓度18.5% 浓度19% 浓度19.5% 浓度20% 浓度20.5% 浓度21% 浓度21.5% 浓度22%3987 浓度22.5% 浓度23% 浓度23.5% 浓度24% 浓度24.5% 浓度25% 浓度25.5% 浓度26% 浓度26.5%时密度=1.09661 浓度27% 浓度27.5% 浓度28% 浓度28.5% 浓度29% 浓度29.5% 浓度30% 浓度30.5% 浓度31%时密度=1.1 浓度31.5% 浓度32% 浓度32.5% 浓度33% 浓度33.5% 浓度34% 浓度34.5% 浓度35% 浓度35.5%时密度=1. 浓度36% 浓度36.5% 浓度37% 浓度37.5% 浓度38% 浓度38.5% 浓度39% 浓度39.5% 浓度40% 浓度40.5% 浓度41% 浓度41.5% 浓度42% 浓度42.5% 浓度43% 浓度43.5% 浓度44% 浓度44.5% 浓度45% 浓度45.5% 浓度46% 浓度46.5% 浓度47% 浓度47.5% 浓度48% 浓度48.5% 浓度49% 浓度49.5% 浓度50% 浓度50.5% 浓度51% 浓度51.5% 浓度52% 浓度52.5% 浓度53%94 浓度53.5% 浓度54% 浓度54.5% 浓度55% 浓度55.5% 浓度56% 浓度56.5% 浓度57% 浓度57.5% 浓度58% 浓度58.5% 浓度59% 浓度59.5% 浓度60% 浓度60.5% 浓度61% 浓度61.5% 浓度62% 浓度62.5% 浓度63% 浓度63.5% 浓度64% 浓度64.5% 浓度65% 浓度65.5% 浓度66% 浓度66.5% 浓度67% 浓度67.5% 浓度68% 浓度68.5% 浓度69% 浓度69.5% 浓度70% 浓度70.5% 浓度71% 浓度71.5% 浓度72% 浓度72.5% 浓度73% 浓度73.5% 浓度74% 浓度74.5% 浓度75% 浓度75.5% 浓度76% 浓度76.5% 浓度77% 浓度77.5% 浓度78% 浓度78.5% 浓度79% 浓度79.5% 浓度80% 浓度80.5% 浓度81% 浓度81.5% 浓度82% 浓度82.5% 浓度83% 浓度83.5% 浓度84% 浓度84.5% 浓度85% 浓度85.5% 浓度86% 浓度86.5% 浓度87% 浓度87.5% 浓度88% 浓度88.5% 浓度89% 浓度89.5% 浓度90% 浓度90.5% 浓度91% 浓度91.5% 浓度92% 浓度92.5% 浓度93% 浓度93.5% 浓度94% 浓度94.5% 浓度95% 浓度95.5% 浓度96% 浓度96.5%
石灰石石膏法和氨法比较(zjh)教学教材
石灰石石膏法和氨法比较(z j h)
石灰石/石膏法和氨法比较 一、概述 工业锅炉脱硫方法多种多样,有已在火电厂、工业锅炉中得到普遗应用的石灰石/石膏法烟气脱硫技术,也有国内刚刚兴起氨法脱硫技术。现已本工程脱硫项目为例,从方案可行、技术可靠、经济可比的原则进行论证。 二、技术方案介绍 1.石灰石/石膏法工艺流程 石灰石/石膏法烟气脱硫技术是一种发展最成熟、在全球范围内广泛应用(市场占有率90%)的烟气脱硫技术。该工艺以石灰石浆液作为吸收剂,通过石灰石浆液在吸收塔内对烟气进行洗涤, 发生反应,去除烟气中的SO2,反应产生的亚硫酸钙通过强制氧化生成含2 个结晶水的硫酸钙(石膏),脱硫后的烟气从烟囱排放。脱硫装置工艺系统主要包括:烟气系统、SO2 吸收系统、石灰石破碎及浆液制备系统、石膏脱水系统、工艺水及废水处理系统。主要设备包括:烟气挡板门、吸收塔、氧化风机、循环浆泵、真空皮带脱水机等。 2.湿式氨/硫铵法工艺流程 氨法脱硫技术,除用氨水作洗涤剂以外,其运行方式与石灰石/石膏法相似。从引风机来的烟气,进入脱硫塔浓缩结晶段,经过洗涤、降温、增湿后进入上部吸收段;在吸收段,烟气经氨水吸收液循环吸收SO2 生成亚硫酸铵;脱硫后的烟气经除雾,使烟气中水雾小于75 mg/m3,净化、除雾后的烟气经热空气及烟气加热器升温至75℃左右送入烟囱排放。吸收剂氨与吸收液混合后进入吸收塔。吸收烟气中SO2形成的亚硫酸铵在吸收塔底部被鼓入的空气氧化成硫酸铵溶液,硫酸铵在塔内结晶,含固浆液经过滤离心机分离得到固体硫酸
铵,固体硫酸铵进入干燥器干燥后,进入料仓和包装机,即可得到商品硫酸铵。母液回塔。氨法脱硫系统包括脱硫装置和硫酸铵后续处理装置。其中:脱硫装置的主要设备有吸收塔、 烟道、挡板门、循环泵、氧化风机、氨水槽及氨水泵、工艺水箱及水泵,附属管道、阀门及控制仪表等。硫酸铵处理装置的主要设备有旋流器、离心机、干燥机、包装机、附属的管道、阀门及控制仪表等。 三、方案技术比较 1、方案比较的原则 方案技术比较按照处理烟气量40万Nm3/h,燃料含硫量1%,烟气SO2含量1600 mg/Nm3,脱硫效率90%,机组年运行6800 h计算。经济比较按照工艺水1.5元/t,电0.25元/kWh,蒸汽100元/t,石灰石80元/t,液氨2500元/t,脱硫副产品硫酸铵化肥600元/t.二水石膏50元/t计算。 2、方案技术参数汇总(见表1) 3、方案经济比较(见表2) 4、两种脱硫技术综合评价 (见表3)
硫酸的密度与浓度对照表
硫酸的密度与浓度对照表(20℃时) 密度 H2SO4 密度H2SO4 密度 H2SO4 密度H2SO4 g/cm3 % g/cm3 % g/cm3 % g/cm3 % 1.000 0.3 1.115 16.7 1.230 31.4 1.345 44.7 1.005 1.0 1.120 17.4 1.235 3 2.0 1.350 45.3 1.010 1.7 1.125 18.1 1.240 3 2.6 1.355 45.8 1.015 2.5 1.130 18.8 1.245 3 3.2 1.360 46.3 1.020 3.2 1.135 19.4 1.250 33.8 1.365 46.9 1.025 4.0 1.140 20.1 1.255 34.4 1.370 47.4 1.030 4.7 1.145 20.7 1.260 35.0 1.375 47.9 1.035 5.5 1.150 21.4 1.265 35.6 1.380 48.4 1.040 6.2 1.155 2 2.0 1.270 36.2 1.385 49.0 1.045 7.0 1.160 2 2.7 1.275 36.8 1.390 49.5 1.050 7.7 1.165 23.3 1.280 37.4 1.395 50.0 1.055 8.4 1.170 23.9 1.285 37.9 1.400 50.5 1.060 9.1 1.175 24.6 1.290 38.5 1.405 51.0 1.065 9.8 1.180 25.2 1.295 39.1 1.410 51.5 1.070 10.6 1.185 25.8 1.300 39.7 1.415 5 2.0 1.075 11.3 1.190 26.5 1.305 40.2 1.420 52.5 1.080 12.0 1.195 27.1 1.310 40.8 1.425 5 3.0 1.085 12.7 1.200 27.7 1.315 41.4 1.430 53.5 1.090 13.4 1.205 28.3 1.320 41.9 1.435 5 4.0 1.095 14.0 1.210 28.9 1.325 42.5 1.440 54.5 1.100 14.7 1.215 29.6 1.330 43.1 1.445 5 5.0 1.105 15.4 1.220 30.2 1.335 43.6 1.450 55.4 1.110 1 6.1 1.225 30.8 1.340 44.2 1.455 55.9 密度 H2SO4 密度 H2SO4 密度 H2SO4 密度 H2SO4 g/cm3 % g/cm3 % g/cm3 % g/cm3 % 1.460 56.4 1.585 67.8 1.710 78.5 1.835 95.7 1.465 56.9 1.590 68.2 1.715 78.9 1.836 97.0 1.470 57.4 1.595 68.7 1.720 79.4 1.475 57.8 1.600 69.1 1.725 79.8 1.480 58.3 1.605 69.5 1.730 80.2 1.485 58.8 1.610 70.0 1.735 80.7 1.490 59.2 1.615 70.4 1.740 81.2 1.495 59.7 1.620 70.8 1.745 81.6 1.500 60.2 1.625 71.2 1.750 8 2.1 1.505 60.6 1.630 71.7 1.755 8 2.6 1.510 61.1 1.635 7 2.1 1.760 8 3.1 1.515 61.5 1.640 7 2.5 1.765 8 3.6 1.520 6 2.0 1.645 72.9 1.770 84.1 1.525 6 2.4 1.650 7 3.4 1.775 8 4.6 1.530 6 2.9 1.655 7 3.8 1.780 85.2
氢氧化钠密度浓度对照表
密度g/m3 质量分数%摩尔浓度mol/L密度g/m3质量分数,%摩尔浓度mol/L 1.005 0.602 0.151 1.095 8.74 2.391 1.01 1.045` 0.264 1.1 9.19 2.527 1.015 1.49 0.378 1.105 9.645 2.664 1.02 1.94 0.494 1.11 10.1 2.802 1.025 2.39 0.611 1.115 10.555 2.942 1.03 2.84 0.731 1.12 11.01 3.082 1.035 3.29 0.851 1.125 11.46 3.224 1.04 3.745 0.971 1.13 11.92 3.367 1.045 4.2 1.097 1.135 1 2.37 3.51 1.05 4.655 1.222 1.14 1 2.83 3.655 1.055 5.11 1.347 1.145 13.28 3.801 1.06 5.56 1.474 1.15 13.73 3.947 1.065 6.02 1.602 1.155 14.18 4.095 1.07 6.47 1.731 1.16 14.64 4.244 1.075 6.93 1.862 1.165 15.09 4.395 1.08 7.38 1.992 1.17 15.54 4.545 1.085 7.83 2.123 1.175 15.99 4.697 1.09 8.28 2.257 1.18 16.44 4.85 NaOH密度,质量分数与摩尔浓度对应(二) 密度g/m3 质量分数%摩尔浓度mol/L 密度g/m3 质量分数%摩尔浓度mol/L 1.185 16.89 5.004 1.37 34.03 11.65 1.19 17.345 5.16 1.375 34.52 11.86 1.195 17.8 5.317 1.38 35.01 1 2.08 1.2 18.255 5.476 1.385 35.5 1 2.29 1.275 25.1 8 1.39 36 1 2.51 1.28 25.56 8.178 1.395 36.495 1 2.73 1.285 26.02 8.357 1.4 36.99 1 2.95 1.29 26.48 8.0539 1.405 37.49 13.17 1.295 26.94 8.722 1.41 37.99 13.3 1.3 27.41 8.906 1.415 38.49 13.61 1.305 27.87 9.092 1.42 38.99 13.84 1.31 28.33 9.278 1.425 39.495 14.07 1.315 28.8 9.466 1.43 40 14.3
硫酸浓度与比重对照表
硫酸浓度与比重对照表
硝酸的百分比浓度、当量浓度及比重对照表 1.0036 1.1609 1.0152 1.1733 1.0543 1.2213 1.0661 1.2335 盐酸浓度与比重对照表 HCL含量( 克 ) 比重20/4℃HCL含量( 克 ) 比重 20/4℃ 100g中含 量 1升中含量100g中含量1升中含量
1 10.03 1.003 2 2 243.8 1.108 2 20.16 1.008 24 268.5 1.119 4 40.72 1.018 26 293. 5 1.129 6 61.6 7 1. 02 8 28 319.0 1.139 8 83.01 1.038 30 344.8 1.149 10 104.7 1.047 32 371.0 1.159 12 126.9 1.057 34 397.5 1.169 14 149.5 1.068 36 424.4 1.179 16 172.4 1.078 38 451.6 1.189 18 195.8 1.088 40 479.2 1.198 20 219.6 1.098 磷酸浓度与比重对照表 H3PO含量( 克 ) 比重 20/4 ℃H3PO含量( 克 ) 比重 20/4 ℃ 100g中含量1升中含量100g中含量1升中含量 1 10.04 1.004 55 758.5 1.379 3 30.49 1.01 4 60 855.6 1.426 5 51.37 1.025 65 958.8 1.475 8 83.36 1.042 70 1068 1.526 10 105.3 1.053 75 1184 1.579 15 162.4 1.082 80 1306 1.633 20 222.7 1.113 85 1436 1.689 25 286.6 1.146 90 1571 1.746 30 354.2 1.180 96 1746 1.819 35 425.6 1.216 98 1807 1.844
硫酸浓度与密度对照表
硫酸浓度/密度对照表(20℃) 密度H2SO4密度H2SO4密度H2SO4密度H2SO4 g/cm3%g/cm3%g/cm3%g/cm3% 1.00000.3 1.115016.7 1.230031.4 1.345044.7 1.0050 1.0 1.120017.4 1.235032.0 1.350045.3 1.0100 1.7 1.125018.1 1.240032.6 1.355045.8 1.0150 2.5 1.130018.8 1.245033.2 1.360046.3 1.0200 3.2 1.135019.4 1.250033.8 1.365046.9 1.0250 4.0 1.140020.1 1.255034.4 1.370047.4 1.0300 4.7 1.145020.7 1.260035.0 1.375047.9 1.0350 5.5 1.150021.4 1.265035.6 1.380048.4 1.0400 6.2 1.155022.0 1.270036.2 1.385049.0 1.04507.0 1.160022.7 1.275036.8 1.390049.5 1.05007.7 1.165023.3 1.280037.4 1.395050.0 1.05508.4 1.170023.9 1.285037.9 1.400050.5 1.06009.1 1.175024.6 1.290038.5 1.405051.0 1.06509.8 1.180025.2 1.295039.1 1.410051.5 1.070010.6 1.185025.8 1.300039.7 1.415052.0 1.075011.3 1.190026.5 1.305040.2 1.420052.5 1.080012.0 1.195027.1 1.310040.8 1.425053.0 1.085012.7 1.200027.7 1.315041.4 1.430053.5 1.090013.4 1.205028.3 1.320041.9 1.435054.0 1.095014.0 1.210028.9 1.325042.5 1.440054.5 1.100014.7 1.215029.6 1.330043.1 1.445055.0 1.105015.4 1.220030.2 1.335043.6 1.450055.4 1.110016.1 1.225030.8 1.340044.2 1.455055.9 1.460056.4 1.585067.8 1.710078.5 1.835095.7 1.465056.9 1.590068.2 1.715078.9 1.836097.0 1.470057.4 1.595068.7 1.720079.4 1.475057.8 1.600069.1 1.725079.8 1.480058.3 1.605069.5 1.730080.2 1.485058.8 1.610070.0 1.735080.7 1.490059.2 1.615070.4 1.740081.2 1.495059.7 1.620070.8 1.745081.6 1.500060.2 1.625071.2 1.75008 2.1
氨水浓度密度对照表
0.001000 3.48987.5 6.96973.7 0.12999.6 3.60987.17.08973.2 0.24999.2 3.72986.67.20972.7 0.36998.8 3.84986.17.32972.2 0.48998.4 3.96985.77.44971.7 0.60998.0 4.08985.27.56971.2 0.72997.6 4.20984.77.68970.7 0.84997.2 4.32984.37.80970.3 0.96996.8 4.44983.87.92969.8 1.08996.3 4.56983.38.04969.3 1.20995.9 4.6898 2.98.16968.8 1.32995.5 4.80982.48.28968.3 1.44995.1 4.92981.98.40967.8 1.56994.7 5.04981.48.52967.3 1.68994.2 5.16981.08.64966.8 1.8099 3.8 5.28980.58.76966.3 1.92993.4 5.40980.08.88965.8 2.04992.9 5.52979.59.00965.3 2.16992.5 5.64979.09.12964.8 2.28992.0 5.76978.69.24964.3 2.40991.6 5.88978.19.3696 3.9 2.52991.2 6.00977.69.48963.4 2.64990.7 6.12977.19.60962.9 2.76990.3 6.24976.69.72962.4 2.88989.8 6.36976.19.84961.9 3.00989.4 6.48975.69.96961.4 3.12988.9 6.60975.210.08960.9 3.24988.4 6.7297 4.710.20960.4 3.36988.0 6.84974.210.32959.9
测定硫酸磷酸混合酸中各组分的浓度
测定硫酸磷酸混合酸中各组分的浓度 一.实验目的 1.学会用双指示剂法测定混合酸中各组分含量的分析方法 2.测定混合酸中硫酸和磷酸的含量 二.实验用品及试剂 1.仪器、用品:锥形瓶,胶头滴管,250ml容量瓶,量筒,烧杯,细口瓶,移液管,洗耳球,台秤,分析天平 2.化学试剂:混合酸,甲基红指示剂,酚酞试液,氢氧化钠固体,邻苯二甲酸氢钾 三.实验原理 硫酸与磷酸混合溶液,用NaOH标准溶液滴定。 取稀释好的混合酸液25.00ml到锥形瓶中,加入甲基红指示剂,当反应液颜色变为橙色时,停止滴定。记此时消耗的NaOH 标准溶液的体积为V1,此时的反应式为:H2SO4 + 2NaOH =Na2SO4 + H2O , NaOH + H3PO4 = NaH2PO4 + H2O ,此时溶液的PH为4.7,所以选用甲基红指示剂。 另取稀释好的混合酸液25.00ml到锥形瓶中,加入酚酞试液,滴定至反应液变色时停止滴定,记此时消耗的NaOH标准溶液的体积为V2.此时的反应式为:NaOH + NaH2PO4 =Na2HPO4 + H2O 。 四.实验步骤
1.NaOH溶液的标定 用表面皿在台秤上称取2.0g氢氧化钠固体于烧杯中,加入蒸馏水稀释至500ml,摇匀,转移到细口瓶中。 用分析天平称取0.35~0.45g的邻苯二甲酸氢钾于锥形瓶中,加蒸馏水稀释至25ml,滴加2~3滴酚酞试液,用所配制的氢氧化钠溶液滴定,待锥形瓶中溶液由无色变为浅粉红色时停止滴定,记录碱式滴定管的读数。平行测定3次。 2.混合酸的测定 取混合酸样25.00ml(V),转移到容量瓶中,加入蒸馏水稀释至250.00ml。用移液管移取稀释液25.00ml至锥形瓶中,加入甲基红指示剂2~3滴,用已标定的氢氧化钠标准溶液滴定,待反应液颜色变为橙色时停止滴加,记此时消耗的氢氧化钠标准溶液体积为V1. 另取混合酸样25.00ml,用移液管转移到锥形瓶中,加入酚酞试液2~3滴,用氢氧化钠溶液标定,待反应液颜色由无色变为浅粉色时停止滴加,记此时消耗的氢氧化钠溶液体积为V2. 硫酸的浓度为:(C(NaOH)*(2V1-V2))/(2V*(25/250)) 磷酸的浓度为:(C(NaOH)*(V1-V2))/(V*(25/250))
磷酸含量的测定
、磷酸含量的测定(容量法) 1、原理 根据磷酸性质,以百里香酚酞为指示剂,用氢氧化钠标准滴定溶液直接滴定,以确定磷酸含量。 2、仪器 250ml具塞锥形玻璃烧瓶3个,滴定管(碱式)一支。 3、试剂和材料 ①氢氧化钠标准滴定溶液:c (Na OH)~0.5mol/L ; ②百里香酚酞指示剂:1g/L. ③超纯水(25 T在线电阻率不小于18.2M Q .cm) 4、测定步骤 ①称取约1g试样,精确至0.0002g。移入250ml具塞锥形玻璃烧瓶中,用80ml的超纯水稀释,加入0.5ml百里香酚酞指示剂。 ②用0.5mol/L的氢氧化钠标准溶液滴定至溶液刚呈浅蓝色即为终点。 ③用同样方法同时做一空白和一平行样。 5、计算: 磷酸(H3PO4)质量分数(x i)按下式计算 V.c M9.0 x i= 100% x 式中:c----氢氧化钠标准滴定溶液的实0际浓度,单位为摩尔每升
(mol/L); V--- 消耗氢氧化钠标准滴定溶液的体积,单位为毫升(ml);m--- 试样的质量,单位为克(g); 49.00--- 磷酸的摩尔质量[M(1/2H 3PO4)], 单位为克每摩尔 (g/mol )。 取平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不 大于0.2% 。
、磷酸含量的测定(重量法或仲裁法) 1、方法原理 在盐酸介质中试样与加人的喹钼柠酮沉淀剂生成磷钼酸喹啉沉淀,经过滤,洗涤,烘干及称重后,确定磷酸含量 2、仪器 玻璃砂坩埚:滤板孔径5 Km-15 pm; 电烘箱:温度能控制在180C士5C或250C士100C; 100ml烧杯2个; 500ml容量瓶1个。 3、试剂 (1)盐酸; (2)喹钼柠酮溶液配置: a)称取70g钼酸钠溶解于150ml纯水中,此溶液为溶液A; b)称取60g柠檬酸溶解于150ml纯水和85ml硝酸的混合溶液中,此溶液为溶液B。 c)在搅拌下将溶液A倒入溶液B中,此溶液为溶液C。 d)在100ml水中加入35ml硝酸,再加入5ml喹啉,此溶液为溶液D; e)将溶液D倒入溶液C中,混匀。放置12h后,用玻璃砂坩埚过滤,再加入280ml丙酮,用水稀释至1000ml,混匀,贮存于聚乙烯瓶中
工业磷酸标准
工业湿法磷酸浓磷酸 Wet-process phosphoric acid for industrial use (草案) (征求意见稿) 请将你们发现的有关专利的内容和支持性文件随意见一并返回. 200×-××-×× 发布200×-××-×× 实施 中华人民共和国国家发展和改革委员会发布 前言 本标准由中国石油和化学工业协会提出. 本标准由全国化学标准化技术委员会无机化工分会归口(SAC/TC63/SC1). 本标准主要起草单位:天津化工研究设计院,贵州宏福实业开发有限总公司. 本标准主要起草人: 工业湿法磷酸 1 范围 本标准规定了工业湿法磷酸的要求,试验方法,检验规则及标志,包装,运输,贮存. 本标准适用于溶剂萃取法生产的工业湿法磷酸.主要用于工业磷酸盐的生产. 分子式:H3PO4. 相对分子量:97.99(按2005年国际相对原子质量). 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款.凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版本均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本.凡是不注日期的引用文件,其最新版本适用于本标准. GB/T 605 化学试剂色度测定通用方法 GB/T610.1—1988 化学试剂砷测定通用方法(砷斑法) GB/T1250 极限数值的表示方法和判定方法 GB/T3049—1986化工产品中铁含量测定通用用方法(邻菲啰啉分光光度法) GB/T6678 化工产品采样总则 GB/T 6682 实验室用水规格 GB7686 化工产品中砷含量测定的通用方法 HG/T3696.1 无机化工产品化学分析用标准滴定溶液的制备 HG/T3696.2 无机化工产品化学分析用杂质标准溶液的制备 HG/T3696.3 无机化工产品化学分析用制剂及制品的制备 3 技术要求 3.1 外观:无色透明或略带浅色,稠状液体. 3.2 工业湿法磷酸应符合表1要求. 表1 要求 项目 指标
氢氧化钠密度浓度对照表[1]
NaOH密度,质量分数与摩尔浓度对应(一) 密度g/m3 质量分数%摩尔浓度mol/L密度g/m3质量分数,%摩尔浓度mol/L 1.005 0.602 0.151 1.095 8.74 2.391 1.01 1.045` 0.264 1.1 9.19 2.527 1.015 1.49 0.378 1.105 9.645 2.664 1.02 1.94 0.494 1.11 10.1 2.802 1.025 2.39 0.611 1.115 10.555 2.942 1.03 2.84 0.731 1.12 11.01 3.082 1.035 3.29 0.851 1.125 11.46 3.224 1.04 3.745 0.971 1.13 11.92 3.367 1.045 4.2 1.097 1.135 1 2.37 3.51 1.05 4.655 1.222 1.14 1 2.83 3.655 1.055 5.11 1.347 1.145 13.28 3.801 1.06 5.56 1.474 1.15 13.73 3.947 1.065 6.02 1.602 1.155 14.18 4.095 1.07 6.47 1.731 1.16 14.64 4.244 1.075 6.93 1.862 1.165 15.09 4.395 1.08 7.38 1.992 1.17 15.54 4.545 1.085 7.83 2.123 1.175 15.99 4.697 1.09 8.28 2.257 1.18 16.44 4.85 NaOH密度,质量分数与摩尔浓度对应(二) 密度g/m3 质量分数%摩尔浓度mol/L 密度g/m3 质量分数%摩尔浓度mol/L 1.185 16.89 5.004 1.37 34.03 11.65 1.19 17.345 5.16 1.375 34.52 11.86 1.195 17.8 5.317 1.38 35.01 1 2.08 1.2 18.255 5.476 1.385 35.5 1 2.29 1.275 25.1 8 1.39 36 1 2.51 1.28 25.56 8.178 1.395 36.495 1 2.73 1.285 26.02 8.357 1.4 36.99 1 2.95 1.29 26.48 8.0539 1.405 37.49 13.17 1.295 26.94 8.722 1.41 37.99 13.3 1.3 27.41 8.906 1.415 38.49 13.61 1.305 27.87 9.092 1.42 38.99 13.84 1.31 28.33 9.278 1.425 39.495 14.07 1.315 28.8 9.466 1.43 40 14.3 NaOH密度,质量分数与摩尔浓度对应(三)
浓缩磷酸含水率的推算
浓缩磷酸含水率的推算 宜兴申利化工周金花 关键词:浓缩磷酸含水率小样电子表格推算 摘要:浓酸直接通气氨做小样,分析小样及所用磷酸养分,利用电子表格快速推算磷酸中的含水量,取代磷酸全分析推算磷酸中的含水量。 浓缩磷酸的主要用途是生产磷酸二铵、磷酸一铵、重过磷酸钙,不同品位的磷酸生产的磷酸二铵(磷酸一铵或重过磷酸钙)品位也不同。为了使生产的二铵(一铵或重钙)养分与包装袋标识养分一致,就需预知库存磷酸的品位,也就是需分析磷酸的含水率。 由于磷酸酸性混合物,采用烘干法直接分析较为困难,所以一般都采用对磷酸中P2O5和各种杂质如:镁、铝、铁、钙、氟、硅、含固率等进行全分析,扣除杂质及H3PO4含量,剩余部分为水含量。 浓缩磷酸的全分析是一个较费时的复杂过程,分析项目有十多个,不仅需要准确度高的分析设备,而且整个分析过程也很长。全分析对于浓缩磷酸库容量受限制且分析设备不齐全的厂家来说并不适用。 利用做小样来推算浓缩磷酸的含水率的过程要比全分析推磷酸水分要简单的多,且准确度也有保障。小样来推算浓缩磷酸含水率的具体步骤如下: 1、取500ml具有代表性的浓缩磷酸进行分样,其中200ml分析P2O5含量; 2、另外300ml通气氨做小样。取一根碱式滴定管用的皮管约1米,一头套在长30厘米的空心玻璃管上,另一头套在气氨管道上的取样阀上,将磷酸倒入研钵中(注意:氨化时放热量大,用玻璃容器
容易爆裂),将玻璃管放入研钵,略开取样阀,使气氨呈连续鼓泡,边通氨边搅动玻璃管,待研钵内物料氨化至PH=6.5-7.0停止通氨,小样完成。再将小样进行分析N、P2O5、H2O。 附图: 气氨管道 气氨取样阀 3、含水率的理论推算。 H3PO4+NH3= NH4 H2PO4+Q NH4 H2PO4+NH3=( NH4) 2 HPO4+Q 上述两反应式合起来可以看作: H3PO4+xNH3= (NH4) x H3-x PO4+Q 在磷酸与氨反应过程中水不参与反应,反应也不放出水,磷酸及磷酸中各项杂质的络合反应基本遵循等式:磷酸-磷酸中含水-氟的气相挥发+氨=磷铵干基。无论是大生产还是做小样,氟的气相挥发总是存在的,所以可以把氟的气相挥发当作磷酸中的水分,所以以上等式可看成:磷酸干基+氨=磷铵干基。当氨化度大于1时,小样中就没有
氨水浓度的测定
氨水浓度的测定 氨水又称阿摩尼亚水,主要成分为NH3·H2O,是氨气的水溶液,无色透明且具有刺激性气味。熔点-77℃,沸点36℃,密度0.91g/cm^3。易溶于水、乙醇。易挥发,具有部分碱的通性,由氨气通入水中制得。有毒,对眼、鼻、皮肤有刺激性和腐蚀性,能使人窒息,空气中最高容许浓度30mg/m^3。主要用作化肥。 工业氨水是含氨25%~28%的水溶液,氨水中仅有一小部分氨分子与水反应形成铵离子和氢氧根离子,即氢氧化铵,是仅存在于氨水中的弱碱。氨水凝固点与氨水浓度有关,常用的(wt)20%浓度凝固点约为-35℃。与酸中和反应产生热。有燃烧爆炸危险。比热容为4.3×10^3J/kg·℃﹙10%的氨水)。 化验室常用的浓氨水的浓度为28%,氨水浓度直接决定其用途,那么对于氨水的浓度该怎么测定呢? 氨水浓度测定方法: 利用酸碱滴定法进行测定,取适量样品注入事先盛有100毫升蒸馏水的250毫升锥形瓶中,加入甲基橙指示剂两滴,用硫酸标准溶液滴定至溶液由橙黄色变为红色即可。计算公式: 氨水的百分浓度:cxVx0.017/V1x氨水溶液密度ρx100 c为1/2H2SO4的物质的量浓度摩尔/升 V为滴定消耗1/2H2SO4标准溶液的体积毫升 V1为取样体积毫升 ρ为样品密度克/毫升
0.017为NH3的毫摩尔质量克/毫摩尔 氨水浓度测定还有两种情况: 1.稀氨水中氨浓度测定:方法一,酸碱滴定法。本方法适用于氨浓度<30%的氨水浓度的测定,方法是吸取一定体积氨水,以甲基红为指示剂,用硫酸标准滴定溶液滴定,至红色为终点,同时,测定试样密度;方法二,密度计法。取试样100毫升于量筒中,用密度计测量试样密度同时测其温度,由测得的密度查附录表三《氨溶液质量百分浓度,密度<20℃和物质的量浓度对照表》,当温度在T℃时换算为20℃时密度。 2.浓氨水中氨浓度的测定:方法一,安瓿球法。本方法适用于浓氨小30~80%中氨含量的测定。测量原理是由于高浓度氨水极量挥发,取样体积无法准确计量,所以先称取一定量的试样于吸收液(硫酸标液)中,然后用氢氧化钠标准溶液滴定,以甲基红为指示剂;方法二,快速称重法。用移液管将试样直接移入加有一定量的1.0mol/L硫酸标准溶液的带塞三角瓶中,称三角瓶前后重量,其差即为试样重量。然后用氢氧化钠标准滴定溶液滴定;方法三,球胆称量法。宏昌工贸建议当液氨喷溅较重,不易取样时可用本法。
液碱密度和浓度对照表
液碱密度和浓度对照表密度浓度% 1 0.159 1.005 0.602 1.01 1.04 1.02 1.94 1.03 2.84 1.04 3.74 1.05 4.65 1.06 5.56 1.07 6.47 1.08 7.38 1.09 8.28 1.1 9.19 1.11 10.1 1.12 11.01 1.13 11.92 1.14 1 2.83 1.15 13.73 1.16 14.64 1.17 15.54 1.18 16.44 1.19 17.34 1.2 18.25 1.21 19.16 1.22 20.07 1.23 20.98 1.24 21.9 1.25 2 2.82 1.26 23.73 1.27 24.64 1.28 25.56 1.29 26.48 1.3 27.41 1.31 28.33 1.32 29.26
1.33 30.2 1.34 31.14 1.35 3 2.1 1.36 3 3.06 1.37 3 4.03 1.38 3 5.01 1.39 36 1.4 3 6.99 1.41 3 7.99 1.42 3 8.99 1.43 40 1.44 41.03 1.45 42.07 1.46 43.12 1.47 44.17 1.48 45.22 1.49 46.27 1.5 47.33 1.51 48.38 1.52 4 9.44 1.53 50.5
液碱温度密度对照表 温度分别是0℃10℃15℃18℃20℃30℃40℃50℃60℃70℃80℃90℃100℃时在不同比例下的密度分别如下 1% 1.01240 1.01150 1.01065 1.01003 1.00950 1.00690 1.00330 0.99900 0.99410 0.98840 0.98240 0.97600 0.96930 5% 1.05980 1.05710 1.05554 1.05454 1.05380 1.05010 1.04580 1.04120 1.03590 1.03020 1.02430 1.01790 1.01150 10% 1.11710 1.11320 1.11107 1.10977 1.10890 1.10430 1.09950 1.09420 1.08890 1.08310 1.07710 1.07080 1.06430 12% 1.13990 1.13550 1.13327 1.13188 1.13090 1.12610 1.12100 1.11570 1.11010 1.10430 1.09830 1.09200 1.08550 14% 1.16240 1.15780 1.15545 1.15400 1.15300 1.14800 1.14280 1.13730 1.13160 1.12570 1.11950 1.11320 1.10660 16% 1.18490 1.18010 1.17761 1.17610 1.17510 1.16990 1.16450 1.15880 1.15310 1.14710 1.14080 1.13430 1.12770 18% 1.20730 1.20230 1.19973 1.19810 1.19720 1.19180 1.18630 1.18050 1.17460 1.16850 1.16210 1.15560 1.14890 20% 1.22960 1.22440 1.22183 1.22022 1.21910 1.21360 1.20790 1.20200 1.19600 1.18980 1.18330 1.17680 1.17000 22% 1.25190 1.24650 1.24386 1.24220 1.24110 1.23540 1.22960 1.22360 1.21740 1.21110 1.20460 1.19800 1.19120 24% 1.27410 1.26860 1.26582 1.26412 1.26290 1.25710 1.25120 1.24510 1.23880 1.23240 1.22590 1.21920 1.21240 26% 1.29630 1.29060 1.28770 1.28600 1.28480 1.27890 1.27280 1.26660 1.26030
二氧化硫优化减排项目改造方案选择和比较
低浓度二氧化硫优化减排技术方案选择和比较 摘要:我国对二氧化硫的排放标准日益严格,根据我厂环集烟气的情况,对低浓度二氧化硫优化减排技术方案的选择进行比较分析,提出方案的选择建议,为脱硫改造项目提供决策参考。 关键词:二氧化硫优化减排;方案的选择;比较 前言 有色金属多与硫伴生成为硫化矿,它们是冶金工业的重要原料,从矿产资源中提取有色金 属过程中,从各冶金炉的加料口、排放口和工作门处外溢出的环集烟气,SO 2 含量浓度较低难以 制酸,SO 2 随烟气排出,不仅浪费硫资源,而且对我们的生态环境造成极大的破坏。我国是严重缺硫的国家,每年需进口数百万吨的硫产品,而在有色金属生产中数百万吨的硫又以烟 气SO 2、SO 3 的形式被排放到大气中,即浪费硫资源,又给生态与农业带来了巨大损失。据统 计, 每吨SO2排放造成的损失达5000元之巨。 我国是农业大国,也是化肥大国。中国政府在《国民经济和社会发展“九五”计划和2010年远景目标纲要》中,明确提出了加快发展以化肥为重点的农用工业,而硫酸是化肥生产的重要基本原料。SO2是生产硫酸和一系列重要化肥的必要原料。针对国家发展农业对化肥产量和品种的需求这一特点,烟气脱硫工艺的副产物能产硫酸及化肥,替代进口,增加国家高浓度复合肥的国际竞争力并降低环境污染,完全符合国家行业发展的规划“友好”地将其回收,变废为宝,对我国具有十分明显意义。 一、选题背景 国家环保部于2010年10月1执行了新的《铜、镍、钴工业企业污染物排放标准》GB25467-2010,该标准大幅度提高了对大气污染物排放的标准要求,SO2从原来的1430 mg/Nm3将降低到400 mg/Nm3,尘从原来的200 mg/Nm3降低到80mg/Nm3。2010年11月18日发布的信息,国家环保部“十二五”减排目标:“二氧化硫减少10%”,也就是说,国家对SO2排放指标及排放量的要求越来越严格。 二、我厂的烟气现状及脱硫的必要性 我厂所处地理位置现已在昆明市三环路以内,作为冶炼企业,排放废气中都有一定的污染物,会影响到本厂员工和周边居民健康,关系到当地人民健康和城市发展。目前,我厂高浓度SO2烟气用来生产硫酸,环集烟气SO2浓度略低于排放标准值,但存在波动情况,偶尔会出现高于排放指标,因此必须通过对环集烟气实施脱硫后完全满足达标排放,进一步削减SO2污染物的排放量,这既是企业的义务,更是一个企业应尽的职责。 三、脱硫技术概述 目前,国内外脱硫方法100多种,工业成熟应用的有20多种,按脱硫的方式、产物的处理形式来划分,烟气脱硫技术总体上可分为干法、半干法和湿法三大类。我国烟气脱硫技术研究从20世纪70年代起步,最初开发的技术有:石灰石或石灰湿式、洗涤法、双碱法、钠盐循环吸收法、氨吸收法、活性炭吸附法等。“六五”和“七五”期间开发了旋转喷雾法、碱式硫酸铝法和炉内喷钙法等。“八五”期间,我国对S02污染控制技术的研究取得了一系列成果。工业化应用以湿法为主,而湿法中石灰石一石膏法应用最为广泛。从九十年代开始,为促进烟气脱硫技术的研究发展,我国有计划、有目的引进一批国外的先进技术和装置。湿法脱硫以日本技术为主,半干法和干法脱硫技术则以欧美技术为主。虽然国外技术设备先进、运行稳定,但投资和运行费用较高。 四、SO 2 烟气治理及资源化利用脱硫技术 在有色冶炼过程进行烟气脱硫是解决污染、综合回收硫资源的的最佳途径,通过烟气脱
