化学平衡高考题(含答案)

化学平衡
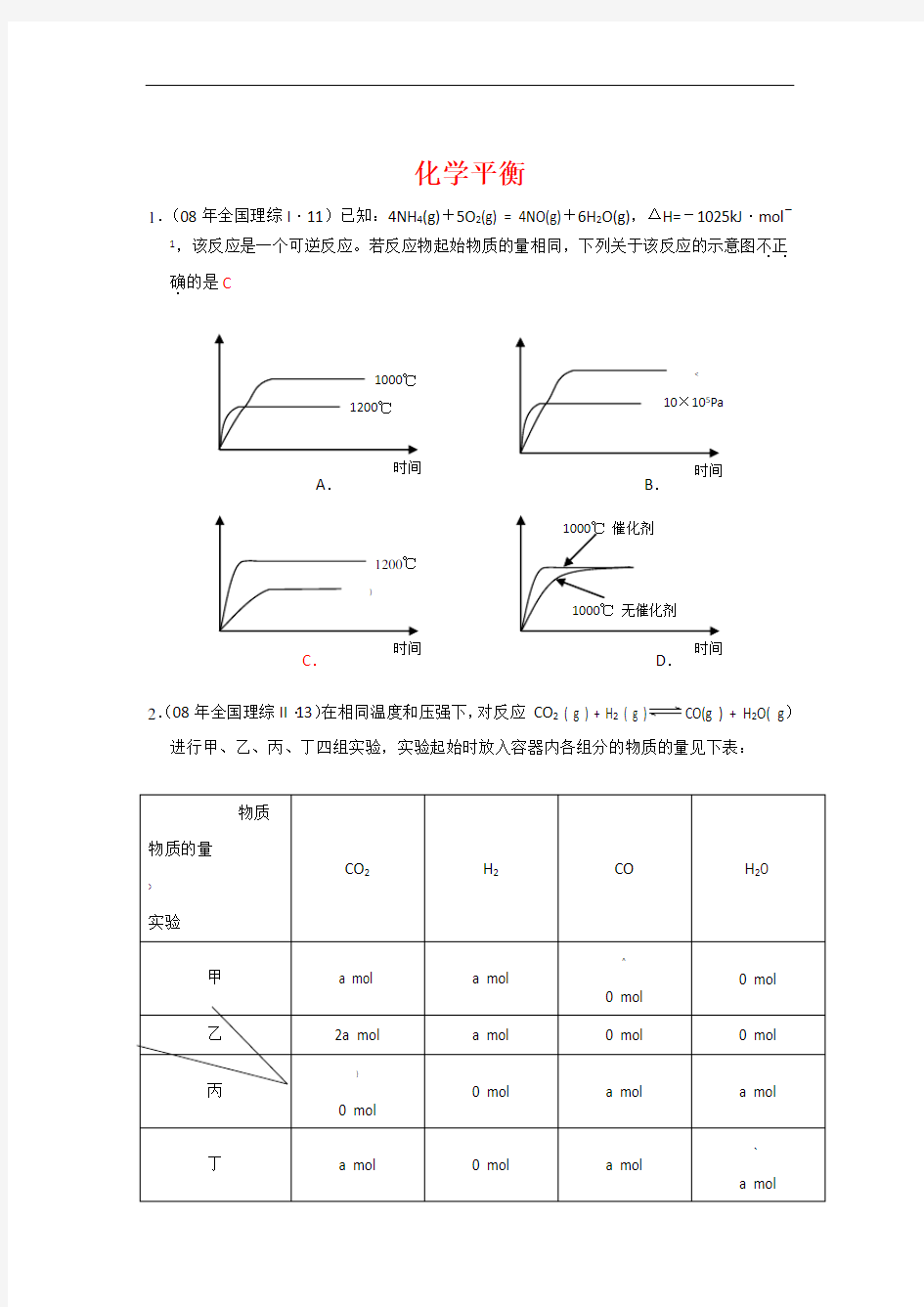
1.(08年全国理综I ·11)已知:4NH 4(g)+5O 2(g) = 4NO(g)+6H 2O(g),ΔH=-1025kJ ·mol
-
1
,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正..
确.
的是C
2.(08年全国理综II ·13)在相同温度和压强下,对反应 CO 2 ( g ) + H 2 ( g )
CO(g ) + H 2O( g )
进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
物质
物质的量
)
实验
CO 2 H 2 CO H 2O
甲 a mol a mol
^
0 mol
0 mol
乙 2a mol
a mol 0 mol 0 mol 丙
}
0 mol
0 mol
a mol
a mol 丁 a mol 0 mol a mol
、
a mol
C .
D .
1200℃
N O 含量
时间
)
N O 含量
时间
1000℃ 催化剂
1000℃ 无催化剂
N O 含量
时间
10×105Pa
<
A .
B .
N O 含量
时间
1000℃ 1200℃
上述四种情况达到平衡后, n ( CO )的大小顺序是 A A .乙=丁>丙=甲 B .乙>丁>甲>丙 C .丁>乙>丙=甲
D .丁>丙>乙>甲
3.(08年天津理综·8)对平衡CO 2(g )CO 2(aq ) .△H =·mol -
1,为增大二氧化碳
气体在水中的溶解度,应采用的方法是D A .升温增压 B .降温减压 C .升温减压
D .降温增压
'
4.(08年山东理综·14)高温下,某反应达到平衡,平衡常数)
H ()CO ()
O H ()CO (222c c c c K ??=。恒容
时,温度升高,H 2浓度减小。下列说法正确的是A A .该反应的焓变为正值
B .恒温恒容下,增大压强,H 2浓度一定减小
C .升高温度,逆反应速率减小
D .该反应的化学方程式为CO +H 2O CO 2+H 2
5.(08年宁夏理综·12)将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应:
}
①NH 4I(s)
NH 3(g)+HI(g);②2HI(g)
H 2(g)+I 2(g)
达到平衡时,c (H 2)=·L -1,c (H I )=4mol ·L -1,则此温度下反应①的平衡常数为C A .9
B .16
C .20
D .25
6.(08年四川理综·8)在密闭容器中进行如下反应:H 2(g) +I 2(g)
2HI(g),在温度T 1和T 2时,产物的量与反应时间
的关系如下图所示.符合图示的正确判断是D
<
A .T 1>T 2,ΔH >0
B .T 1>T 2,ΔH <0
C .T 1<T 2,ΔH >0
D .T 1<T 2,ΔH <0
7.(08年广东理基·36)对于反应2SO 2(g)+O 2(g)
2SO 3(g)能增大正反应速率的措施是
催化剂
高温 T 1碘化氢的量
时 间
T 2
A .通入大量O 2
B .增大容器容积
C .移去部分SO 3
D .降低体系温度
8.(08年广东化学·8)将H 2(g)和Br 2(g)充入恒容密闭容器,恒温下发生反应H 2(g )+Br 2(g)
2HBr (g )△H <0,平衡时Br 2(g)的转化率为a ;若初始条件相同,绝热下进行上述反应,平衡时Br 2(g)的转化率为b 。a 与b 的关系是A
#
A .a >b
B .a =b
C .a <b
D .无法确定
9.(08年广东化学·15)碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中
沉积在管壁上的钨可以发生反应:W (s )+I 2(g )WI 2(g ) ΔH <0(温度T 1<T 2)。下列说法正确的是AD
A .灯管工作时,扩散到灯丝附近高温区的WI 2(g )会分解出W 1W 重新沉积到灯丝上
B .灯丝附近温度越高,WI 2(g )的转化率越低
C .该反应的平衡常数表达式是)
WI ()
I ()W (22c c c K ?=
D .利用该反应原理可以提纯钨
[
10.(08年海南化学·10)X 、Y 、Z 三种气体,取X 和Y 按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y
2Z ,达到平衡后,测得混合气体中反应物的总
物质的量与生成物的总物质的量之比为3︰2,则Y 的转化率最接近于D A .33%
B .40%
C .50%
D .66%
11.(08年上海化学·21)等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积V 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是AC
T 1
T 2 组别
c (HCl)(mol·L -
1)
温度(℃)
状态 `
1
25 块状 2
30 块状 —
50
块状
A .4—3—2—1
B .1—2—3—4
C .3—4—2—1
D .1—2—4—3
12.(07年高考广东理基·26)把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是D
A .盐酸的浓度
B .铝条的表面积
C .溶液的温度
D .加少量Na 2SO 4
13.(07年理综北京卷·10)一定条件下,在体积为10 L 的密闭容器中,1 mol X 和1 mol Y 进行反应:2X(g)+Y(g)
Z(g),经60 s 达到平衡,生成 mol Z ,下列说法正确的是A
A .以X 浓度变化表示的反应速率为 mol/(L·s)
B .将容器体积变为20 L ,Z 的平衡浓度变为原来的1/2
)
C .若增大压强,则物质Y 的转化率减小
D .若升高温度,X 的体积分数增大,则该反应的H >0
14.(07年高考全国理综卷I·13)如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合....
的是C 0
反应速率
平衡态Ⅰv (正)
v (逆)
平衡态Ⅱv (正)′v (逆)
′
A .反应达平衡时,正反应速率和逆反应速率相等
B .该反应达到平衡态I 后,增大反应物浓度,平衡发生移动,达到平衡态II
C .该反应达到平衡态I 后,减小反应物浓度,平衡发生移动,达到平衡态II
D .同一种反应物在平衡态I 和平衡态II 时浓度不相等
·
15.(07年高考全国理综卷II·6)已知:C(s)+CO 2(g)2CO(g);H >0。该反应达到平衡后,
下列条件有利于反应向正方向进行的是A A .升高温度和减小压强 B .降低温度和减小压强 C .降低温度和增大压强
D .升高温度和增大压强
16.(07年高考理综四川卷·13)向某密闭容器中充入1 mol CO 和2 mol H 2O(g),发生反应:CO +H 2O(g)
催化剂CO 2+H 2。当反应达到平衡时,CO 的体积分数为x 。若维持容器的体积
和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO 的体积分数大于x 的是B
A .0.5 mol CO +2 mol H 2O(g)+1 mol CO 2+1 mol H 2
B .1 mol CO +1 mol H 2O(g)+1 mol CO 2+1 mol H 2
C .0.5 mol CO + mol H 2O(g)+ mol CO 2+ mol H 2
D .0.5 mol CO + mol H 2O(g)+ mol CO 2+ mol H 2
【
17.(07年高考理综天津卷·12)下列有关工业生产的叙述正确的是D
A .合成氨生产过程中将NH 3液化分离,可加快正反应速率,提高N 2、H 2的转化率
B .硫酸工业中,在接触室安装热交换器是为了利用SO 3转化为H 2SO 4时放出的热量
C .电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl 2进入阳极室
D .电解精炼铜时,同一时间内阳极溶液铜的质量比阴极析出铜的质量小
18.(07年高考理综宁夏卷·13)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为%,与反应前...的体积相比,反应后体积缩小的百分率是A A .%
B .%
C .%
D .%
19.(07年高考江苏卷·13)一定温度下可逆反应:A(s)+2B(g)
2C(g)+D(g);H <0。现将
1 mol A 和
2 mol B 加入甲容器中,将4 mol C 和2 mol D 加入乙容器中,此时控制活塞P ,使乙的容积为甲的2倍,t 1时两容器内均达到平衡状态(如图1所示,隔板K 不能移动)。下列说法正确的是BD
、
0t
速率v
v (正)v (逆)v (逆)′v
(正)′t 1
t 2甲容器
==0t
速率v (正)
v (逆)′′v (正)v (逆)
=v
(逆)′v (正)′=t
1
t 2
乙容器
′′′′
图1 图2 图3
A .保持温度和活塞位置不变,在甲中再加入1 mol A 和2 mol
B ,达到新的平衡后,甲
中C 的浓度是乙中C 的浓度的2倍
B .保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B 的体积分数均增大
C .保持温度不变,移动活塞P ,使乙的容积和甲相等,达到新的平衡后,乙中C 的体
积分数是甲中C 的体积分数的2倍
D .保持温度和乙中的压强不变,t 2时分别向甲、乙中加入等质量的氦气后,甲、乙中
反应速率变化情况分别如图2和图3所示(t 1前的反应速率变化已省略)
甲
乙
P 活塞
K
/
20.(15分)(08年全国理综II·26)红磷P (s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。
反应过程和能量关系如图所示(图中的△H表示生成l mol 产物的数据)。
【
根据上图回答下列问题:
(1)P和CI2反应生成PC13的热化学方程式是。
(2)PC15分解成PC13和Cl2的热化学方程式是;上述分解反应是一个可逆反应。温度T l时,在密闭容器中加人nol PC15,反应达平衡时PC15还剩mol ,其分解率a l等于;若反应温度由T l升高到T2,平衡时PC15的分解率为a2,a2a l(填“大于”、“小于”或“等于”)。
(3)工业上制备PC15通常分两步进行,先将P和C12反应生成中间产物PC13,然后降温,再和Cl2反应生成PCl5。原因是。
(4)P和C12分两步反应生成1 mol PC15的△H3== ,一步反应生成1 molPC15的△H4____________△H3(填“大于”、“小于”或“等于”)。
(5)PC15与足量水充分反应,最终生成两种酸,其化学方程式是:
。
@
【答案】(15分)
(1)2P(s) + 3Cl2(g)===2PCl3(g);△H == -612 kJ·mol-1
(2)PCl5(g)===PCl3(g) + Cl2(g);△H== +93kJ·mol-125% 大于
(3)两步反应都是放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ·mol-1等于
(5)PCl5 + 4H2O===H3PO4 + 5HCl
21.(14分)(08年宁夏理综·25)
已知可逆反应:M(g)+N(g)P(g)+Q(g),△H>0
·
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)= mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为;
(2)若反应温度升高,M的转化率(填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol·L-1,
c(N)= mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(4)若反应温度不变,反应物的起始浓度为:c(M)= 1 mol·L-1,达到平衡后,M的转化率为。
【答案】(14分)
(1)25%(2)增大(3)6 (4)41%
.
22.(14分)(08年重庆理综·26)N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是___________________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将______(填“增大”、“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s0{
1000
500
c(N2O5)/mol·L—1
则500s内N2O5的分解速率为______________。
③在T2温度下,反应1000s时测得NO2的浓度为L,则T2________T1。
—
(3)题26图所示装置可用于制备N2O5,则N2O5在电解池的___________区生成,其电极反应式为_________________________________________。
【答案】(14分)(1)
(2)①不变② mol·L—1·s—1③<或小于
(3)阳极N2O4+2HNO3—2e—=2N2O5+2H+
23.(11分)(08年广东化学·20)
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为mol·L-1、mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为mL、大理石用量为g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
>
实验编号
T/K大理石规格HNO3浓度/mol·L-1实验目的
①298粗颗粒
| (Ⅰ)实验①和②探究HNO3浓
度对该反应速率的影响;
(Ⅱ)实验①和探究温度
对该反应速率的影响;
(Ⅲ)实验①和探究大理
石规格(粗、细)对该反应速率
的影响;)
②
③
④
]
(2)实验①中CO2质量随时间变化的关系见下图:
依据反应方程式
21CaCO 3+HNO 3=21Ca(NO 3)2+21CO 2↑+2
1
H 2O ,计算实验①在70-90 s 范围内HNO 3的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中CO 2质量随时间变化关系的预期结果示意图。
【答案】(11分)(1)
、
实验编号
T/K
大理石规格 HNO 3浓度/mol -
1·L -
1
实验目的
① 298 粗颗粒
'
(Ⅱ)③
(Ⅲ)④
②
298 粗颗粒
]
③
308
粗颗粒
④ 298 细颗粒
)
(2)
70至90s 内,CO 2生成的质量为:m (CO 2)= g=,其物质的量为n (CO 2)=÷44g·mol -
1=, 根据方程式比例,可知消耗HNO 3的物质的量为:n (HNO 3)=×2==, 溶液体积为25mL=,所以HNO 3减少的浓度△c (HNO 3)=
L
mol 025.0005.0=·L -
1,
所以HNO 3在70-90S 范围内的平均反应速率为v (HNO 3)=
△c (HNO 3)
t
=s
s L mol 70902.01-?-=·L -1·s -1。 (3)
·
24.(12分)(08年广东化学·24)
科学家一直致力研究常温、常压下“人工围氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N 2在催化剂(掺有少量Fe 2O 3的TiO 2)表面与水发生反应,生成的主要产物为NH 3。进一步研究NH 3生成量与温度的关系,部分实验数据见下表(光照、N 2压力×105Pa 、反应时间3 h ):
T/K
303 313 323 353 .
NH 3生成量/(10-6 mol )
4.8
5.9
6.0
2.0
相应的热化学方程式如下:
N 2(g)+3H 2O(1)=2NH 3(g)+2
3
O 2(g) ΔH =+ kJ ·mol -1 回答下列问题:
@
(1)请在答题卡的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程
中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH 3生成量的建议: 。
(3)工业合成氨的反应为N 2(g)+3H 2(g)
2NH 3(g)。设在容积为 L 的密闭容器中充
入 mol N 2(g)和 mol H 2(g),反应在一定条件下达到平衡时,NH 3的物质的量分数(NH 3的物
质的量与反应体系中总的物质的量之比)为
7
4
。计算 ①该条件下N 2的平衡转化率; ②该条件下反应2NH 3(g)N 2(g)+3H 2(g)的平衡常数。
【答案】(12分)(1)
(2)研制新型高效催化剂(升高温度,增大反应物N 2的浓度,不断移出生成物脱离反应体系)
…
(3)①% ②
25.(10分)(08年江苏化学·18)“温室效应”是全球关注的环境问题之一。CO 2是目前大气中含量最高的一种温室气体。因此,控制和治理CO 2是解决温室效应的有效途径。 (1)下列措施中,有利于降低大气中CO 2浓度的有: 。(填字母) a .减少化石燃料的使用 b .植树造林,增大植被面积
c .采用节能技术
d .利用太阳能、风能
(2)将CO 2转化成有机物可有效实现碳循环。CO 2转化成有机物的例子很多,如: a .6CO 2 + 6H 2O 光合作用
C 6H 12O 6+6O 2 b .CO 2 + 3H 2
催化剂
△CH 3OH +H 2O c .CO 2 + CH 4
催化剂△
CH 3COOH d .2CO 2 + 6H 2
催化剂△
CH 2==CH 2 + 4H 2O
"
以上反应中,最节能的是 ,原子利用率最高的是 。 (3)文献报道某课题组利用CO 2催化氢化制甲烷的研究过程如下:
CO2
H2O
铁粉
镍粉
300℃
6h冷却
气体
收集
过滤
固体
滤液
检测
检测
检测
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。
CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即:CO2ⅠHCOOH
Ⅱ
CH4
①写出产生H2的反应方程式。
(
②由图可知,镍粉是。(填字母)
a.反应Ⅰ的催化剂b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂d.不是催化剂
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
<
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f .反应Ⅰ的速率减小,反应Ⅱ的速率增加 【答案】(10分)(1)abcd (2)a c
(3)①3Fe+4H 2O
300℃
Fe 3O 4+2H 2 ②c ③e
26.(10分)(08年江苏化学·20)将一定量的SO 和含 mol 氧气的空气(忽略CO 2)放入一定体积的密闭容器中,550 ℃时,在催化剂作用下发生反应:2SO 2+O 2
催化剂 加热
2SO 3
(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH 溶液,气体体积减少了 L ;再将剩余气体通过焦性没食子酸的碱性溶液吸收O 2,气体的体积又减少了 L (以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母) a .SO 2和SO 3浓度相等 b .SO 2百分含量保持不变
)
c .容器中气体的压强不变
d .SO 3的生成速率与SO 2的消耗速率相等
e .容器中混合气体的密度保持不变
(2)欲提高SO 2的转化率,下列措施可行的是 。(填字母) a .向装置中再充入N 2 b .向装置中再充入O 2 c .改变反应的催化剂 d .生高温度 (3)求该反应达到平衡时SO 3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl 2溶液,生成沉淀多少克 【答案】(10分)
,
(1)bc (2)b
(3)消耗的O 2物质的量:mol mol
L L
mol 45.0/4.226.57.0=-
生成的SO 3物质的量:mol mol 9.0245.0=? SO 2和SO 3的物质的量和:
mol mol
L L
95.0/4.2228.21=
反应前的SO 2物质的量:
mol mol
L L 95.0/4.2228.21= SO 2的转化率:
%7.94%10095.09.0=?mol mol
(4)在给定的条件下,溶液呈强酸性,BaSO 3不会沉淀。因此BaSO 4的质量
g
mol
g
mol5.
10
/
233
05
.0
9.0≈
?
?
27.(8分)(08年海南化学·15)反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
,
(1)该反应是____________________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),原因是____________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响_______________,原因是_________.
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。
【答案】(8分)(1)放热(2)减小该反应正反应为放热反应,升高温度使平衡向逆反应方向移动(3)不影响催化剂不改变平衡的移动(4)减小减小28.(08年上海化学·25)在2L密闭容器内,800℃时反应:2NO(g)+O 2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
~
12345
n(NO)(mol)-.
(1)写出该反应的平衡常数表达式:K= 。
已知:300C K ?>350C K ?,则改反应是 热反应。
(2)右图中表示NO 2的变化的曲线是 。
》
用O 2表示从0~2 s 内该反应的平均速率v = 。
(3)能说明该反应已达到平衡状态的是 。 a .v (NO 2)=2v (O 2) b .容器内压强保持不变 c .v 逆(NO)=2v 正(O 2) d .容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。 a .及时分离除NO 2气体 b .适当升高温度 c .增大O 2的浓度 d .选择高效催化剂
【答案】(1)K =[NO 2]2[NO]2
·[O 2]
放热 (2)b ×10-3mol·L -1·s -
1 (3)bc (4)c
;
29.(07年高考
广东化学卷·2
实验编号 ①
② ③ ④ ⑤ c (I -
)/ mol·L -1
\
c (-
28
2O S )/mol·L -1
(
t /s
、
t 1
回答下列问题:
(1)该实验的目的是___________________________________________________。 (2)显色时间t 1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t 2的范围为______(填字母)。
(A)< s (B) s ~ s (C)> s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是______________________________________。
[答案](1)研究反应物I -
与
282O S 的浓度对反应速率的影响。 (2) s 。 (3)A 。
;
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
30.(07年高考海南化学卷,反应速率)(9分)下表是稀硫酸与某金属反应的实验数据:
~
分析上述数
据,回答下列问
题: (1)实验
4和5表明
,
______________
__________ 对
反应速率有影
响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号); (2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:_________________________________________________________________________。 [答案](1)固体反应物的表面积; 表面积越大; 1和2(或4和5)。 (2)1、3、4、6、8;或2和5。 (3)反应温度; 6和7,8和9。 (4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近。
31.(07年高考广东化学卷·25)(10分)黄铁矿(主要成分为FeS 2)是工业制取硫酸的重要原料,其煅烧产物为SO 2和Fe 3O 4。
(1)将 mol SO 2(g)和 mol O 2(g)放入容积为1 L 的密闭容器中,反应2SO 2(g)+O 2(g)
2SO 3(g)
在一定条件下达到平衡,测得c (SO 3)= mol/L 。计算该条件下反应的平衡常数K 和SO 2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO 2平衡转化率的有 (填字母) A .升高温度 B .降低温度 C .增大压强 D .减小压强 E .加入催化剂 G .移出氧气
(3)SO 2尾气用饱和Na 2SO 3溶液吸收可得到重要的化工原料,反应的化学方程式为________________________________________________________________________。 (4)将黄铁矿的煅烧产物Fe 3O 4溶于H 2SO 4后,加入铁粉,可制备FeSO 4。酸溶过程中需保持溶液足够酸性,其原因是__________________________________________________。 [答案](1)解: 2SO 2(g) + O 2(g) 2SO 3(g)
起始浓度/ mol·L -
1 0 平衡浓度/ mol·L -1 - -2) = =
所以,K =)
(O )}(SO {)}SO ({2222
3c c c ?= 1
2121L mol 0.010 )L mol (0.010)L mol 040.0(---????= ×103 mol·L -1。(不带单位计算也得分)
(SO 2) =
1
1
L mol 050.0L mol )010.0050.0(--??-×100% = 80% 。
(2)B 、C 。 (3)SO 2+H 2O +Na 2SO 3=2NaHSO 3。 (4)抑制Fe 2+
、Fe 3+
的水解,防止Fe 2+
被氧化成Fe 3+
。
32.(07年高考海南化学卷·16) (6分)PCl 5的热分解反应为:PCl 5(g)PCl 3(g)+Cl 2(g)
(1) 写出反应的平衡常数表达式:
(2) 已知某温度下,在容积为 L 的密闭容器中充入 mol PCl 5,达到平衡后,测得容器内PCl 3的浓度为 mol/L 。计算该温度下的平衡常数。
[答案](1)K =
)
PCl ()
Cl ()PCl (523c c c ?。 (2)K = 。
33.(07年高考上海化学卷·25)一定条件下,在体积为3 L 的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu 2O/ZnO):CO(g)+2H 2(g)
CH 3OH(g)
t /min
n (甲醇)/mol n n t t 曲线A 300 ℃
曲线B 500 ℃
E
C D
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K = ,升高温度,K 值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H 2)= 。 (3)在其他条件不变的情况下,对处于E 点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少
b .正反应速率加快,逆反应速率也加快
c .甲醇的物质的量增加
d .重新平衡时n (H 2)/n (CH 3OH)增大
(4)据研究,反应过程中起催化作用的为Cu 2O ,反应体系中含少量CO 2有利于维持催化剂Cu 2O 的量不变,原因是:_______________________________________(用化学方程式表示)。
[答案](1)K =223)}H ({)CO ()
OH CH (c c c ?; 减小。 (2))B (3)
B (2t n mol·
(L·min)-1。 (3)b ; c 。 (4)Cu 2O +CO
2Cu +CO 2。
34.(07年高考理综宁夏卷·27)(14分)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:□SiO 2+□C +□N 2
高温
□Si 3N 4+□CO
(1) 配平上述反应的化学方程式(将化学计量数填在方框内); (2)该反应中的氧化剂是__________,其还原产物是_____________。 (3)该反应的平衡常数表达式为K =_______________________;
(4)将知上述反应为放热反应,则其反应热H________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”); (5)若使压强增大,则上述平衡向_______反应方向移动(填“正”或“逆”);
(6)若已知CO 生成速率为v (CO) =18 mol/(L·min),则N 2消耗速率为v (N 2) =__________mol/(L·min)。
[答案](1)3,6,2,1,6 。 (2)N 2; Si 3N 4。 (3)K =2
26)}N ({)}CO ({c c 。 (4)小于;减小。
(5)逆。 (6)6。
35.(07年高考理综山东卷·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。 (1)硫酸生产中,SO 2催化氧化生成SO 3: 2SO 2(g)+O 2(g)△
催化剂2SO 3(g)。某温度下,SO 2
的平衡转化率(
)与体系总压强(p )的关系如图所示。根据图示回答下列问题:
α
p /MPa
0.100.500.80
0.85A
B
①将 mol SO 2和 mol O 2置于10 L 密闭容器中,反应达平衡后,体系总压强为 MPa 。该反应的平衡常数等于____________。
②平衡状态由A 变到B 时,平衡常数K (A)_______K (B)(填“>”、“<”或“=”)。 (2)用CH 4催化还原NO x 可以消除氮氧化物的污染。例如: CH 4(g)+4NO 2(g) = 4NO(g)+CO 2(g)+2H 2O(g);H =-574 kJ/mol CH 4(g)+4NO(g) = 2N 2(g)+CO 2(g)+2H 2O(g);H =-1160 kJ/mol
若用标准状况下 L CH 4还原NO 2至N 2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用N A 表示),放出的热量为_________kJ 。
(3)新型纳米材料氧缺位铁酸盐(MFe 2O x ,3<x <4,M = Mn 、Co 、Zn 或Ni)由铁酸盐(MFe 2O 4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
2O x
H 2
常温分解CO 2、SO 2、NO 2等
请写出MFe 2O x 分解SO 2的化学方程式______________________________________(不必配平)。
[答案](1)①800 L·mol -
1。② =。 (2)(或;。 (3)MFe 2O x +SO 2MFe 2O 4+S 。
