络合滴定法授课课件
合集下载
分析化学络合滴定法.ppt

感谢你的阅读
6
一、络合滴定中的滴的稳定性不高,而且还存在分步络
合等缺点。在分析化学中,主要用于干扰物质的掩蔽剂和 防止金属离子水解的辅助络合剂等。
有机络合剂:
应用有机络合剂(多基配位体)的络合滴定方法,已成
为广泛应用的滴定分析方法之一。目前应用最为广泛的有
2019-10-19
感谢你的阅读
12
图6-1 EDTA各型体的分布曲线
2019-10-19
感谢你的阅读
13
从图6—1可以看出,在不同pH值时,EDTA的主要存在型 体如下:
2019-10-19
pH
主要存在型体
<0.9 0.9~1.6 1.6~2.16 2.16~2.67 2.67~6.16 6.16~10.2
︰
[MLn]= βn[M][L]n
2019-10-19
感谢你的阅读
25
3.总形成常数和总离解常数
总形成常数:最后一级累积形成常数又叫总形成常数; 总离解常数:最后一级累积离解常数又叫总离解常数。
对上述1:4型如Cu(NH3)2+的络合物 K形=β4;
总形成常数与总离解常数互为倒数关系,即
2019-10-19
感谢你的阅读
21
1. 络合物的逐级形成常数与逐级离解常数
络合物形成常数(对ML4型来讲)的一般规律是: K1>K2>K3>K4
原因: 随着络合体数目的增多,配体间的排斥作用增强,稳定
性下降。
2019-10-19
感谢你的阅读
22
络合物的离解常数
离解常数:如果从络合物的离解来考虑,其平衡常数称为 “离解常数”。
第一级形成常数: Cu2++NH3= Cu(NH3)2+ K1=[Cu(NH3)2+]/[Cu2+][NH3]=1.4×104
第三章络合滴定法课件

MY
H+
OH -
MHY
M(OH)Y
MLn 辅助配 位效应
2024/8/2
M(OH)n H6Y
羟基配 酸效应 位效应
干扰离 子效应
混合配位效应
25
配合物MY的副反应及副反应系数MY
主反应:
M
+
Y
MY
副反应: L
OH - H +
N
H+
OH -
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MHY
M(OH)Y
主反应和副反应
H6Y
羟基配位效应 辅助配位效应 酸效应 共存离子效应
混合配位效应
M(OH)
数
2024/8/2
M(L)
Y(H)
Y(N)
MY(H) MY(OH) 副反应系
20
主反应:
M
+
Y
副反应:
L
OH - H +
N
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MY
H+
OH -
MHY
M(OH)Y
MLn
MLn
辅助配 位效应
M(OH)n H6Y
羟基配 酸效应 位效应
干扰离 子效应
2024/8/2
混合配位效应
26
EDTA的酸效应Y(H):由于H+存在使
EDTA与金属离子配位反应能力降低的现
象。
M+Y
MY
主反应
H+ HY
H+
H+
H2Y
【课件】第四章络合滴定PPT

判断络合物的稳定性
判断络合反应的完全程度,判定条件:
当 CSP 0.01mol / L
lg
K
' 稳
≥8
由 lgY (H ) ≤ lg K稳 8 绘制酸效应曲线
参见p132 图4.4
第二节 络合滴定基本原理
1、滴定曲线
配位滴定通常用于测定金属离子,当溶液中金属离子浓度较小时, 通常用金属离子浓度的负对数pM来表示。
K(MY) = [MY] [M][Y]
sp时:[M]= [Y]; [M]+[MY]= cSP(M)
M'sp = Y'sp =
csp M K ' MY
或:
pM'sp
=
(pY)sp
=
1 2
lgK'MY + pcsp M
滴定突跃范围
sp前,-0.1%, 按剩余M浓度计
以被测金属离子浓度的pM对应滴定剂加入体积作图,可得配 位滴定曲线。
在配位滴定中,随着滴定剂的加入,金属离子浓度逐渐减小,在化学计 量点附近,pM发生急剧变化,可画出滴定曲线。 有了条件稳定常数,曲线不难作出。滴定曲线对于选择适当的滴定条件 和指示剂重要的指导意义。
(1) 滴定曲线
M + Y = MY
MY M Y
(1:1)
[MY ] K 稳 [M ][Y ]
(逆反应)
K 不稳
[M ][Y ] [MY ]
稳定常数用途:判断一个络合物的稳定性
EDTA的酸效应 条件稳定常数
EDTA的酸效应
M Y MY (主反应)
Y H HY H H 2Y H 6Y 副反应
《络合滴定法》课件

《络合滴定法》PPT 课件
目录
• 络合滴定法概述 • 络合滴定法的基本概念 • 络合滴定法的实验技术 • 络合滴定法的应用实例 • 络合滴定法的注意事项与展望
01
络合滴定法概述
定义与原理
定义
络合滴定法是一种通过络合反应来滴定溶液中金属离子浓度的分析方法。
原理
络合反应是可逆的,通过加入过量的络合剂与待测金属离子形成稳定的络合物 ,再利用滴定剂滴定剩余的络合剂,从而计算出金属离子的浓度。
络合滴定法的实验设备与试剂
实验设备
滴定管、容量瓶、烧杯、搅拌器等。
实验试剂
络合剂、指示剂、标准溶液、待测样品等。
络合滴定法的实验步骤与操作
实验步骤
准备实验设备与试剂、配制标准溶液、进行滴定操作、记录 实验数据。
操作要点
准确称量样品、控制滴定速度、选择合适的指示剂、观察颜 色变化等。
络合滴定法的实验数据处理与分析
络合滴定法的应用领域
环境保护
用于测定水体、土壤等 环境样品中的重金属离
子浓度。
食品检测
用于检测食品中的微量 元素,确保食品安全。
医药分析
用于药物成分分析,以 及生物样品中金属离子
的测定。
地质勘探
用于分析矿石和岩石中 的金属元素。
络合滴定法与其他滴定法的比较
与酸碱滴定法相比,络合滴定法具有 更高的选择性,能够测定一些酸碱滴 定法难以测定的金属离子。
01
误差控制
02
选择合适的络合剂和指示剂,确保反应速 度适中且变色点与化学计量点一致。
03
严格控制溶液的酸度、温度等条件,以减 小副反应的发生。
04
采用标准曲线法、内标法等手段进行校正 ,提高测量的准确性。
目录
• 络合滴定法概述 • 络合滴定法的基本概念 • 络合滴定法的实验技术 • 络合滴定法的应用实例 • 络合滴定法的注意事项与展望
01
络合滴定法概述
定义与原理
定义
络合滴定法是一种通过络合反应来滴定溶液中金属离子浓度的分析方法。
原理
络合反应是可逆的,通过加入过量的络合剂与待测金属离子形成稳定的络合物 ,再利用滴定剂滴定剩余的络合剂,从而计算出金属离子的浓度。
络合滴定法的实验设备与试剂
实验设备
滴定管、容量瓶、烧杯、搅拌器等。
实验试剂
络合剂、指示剂、标准溶液、待测样品等。
络合滴定法的实验步骤与操作
实验步骤
准备实验设备与试剂、配制标准溶液、进行滴定操作、记录 实验数据。
操作要点
准确称量样品、控制滴定速度、选择合适的指示剂、观察颜 色变化等。
络合滴定法的实验数据处理与分析
络合滴定法的应用领域
环境保护
用于测定水体、土壤等 环境样品中的重金属离
子浓度。
食品检测
用于检测食品中的微量 元素,确保食品安全。
医药分析
用于药物成分分析,以 及生物样品中金属离子
的测定。
地质勘探
用于分析矿石和岩石中 的金属元素。
络合滴定法与其他滴定法的比较
与酸碱滴定法相比,络合滴定法具有 更高的选择性,能够测定一些酸碱滴 定法难以测定的金属离子。
01
误差控制
02
选择合适的络合剂和指示剂,确保反应速 度适中且变色点与化学计量点一致。
03
严格控制溶液的酸度、温度等条件,以减 小副反应的发生。
04
采用标准曲线法、内标法等手段进行校正 ,提高测量的准确性。
第6章络合滴定法PPT课件
4
第4页/共32页
自学要求: 了解 ①螯合剂主要有那些类型?②它们各与那类
物质反应形成螯合物?(参考书:武大第五版教材 P167~P168 )
5
第5页/共32页
6.1.2 氨羧络合剂 Complexan
是一类含有氨基二乙酸基团的螯合剂
CH3COOH
N
CH3COOH
:N
易与Co2+,Ni2+,Cd2+,Cu2+,Zn2+, Hg2+等金属离子络合。
15
第15页/共32页
2、MLn型(多元络合物)
M + L ⇌ ML
K1
[ML] [M][L
]
累积稳定常数
β1
[ML] [M][L]
k1
ML + L ⇌ ML2
K
2
[ ML2 [ M L] [
] L]
2
[ML2 ] [M][L] 2
k1k2
… … …
MLn-1 + L ⇌ MLn
K
n
[
[ MLn ] MLn-1] [
[H2Y] [Y][H]2
K1HK
H 2
1 K K a5 a6
… …
H5Y+H
H6Y
β6
[ H6 Y ] [ Y ] [ H ]6
K1H
K
H 2
K
H 6
[ Hi Y] βi[ Y] [ H ]i
1 Ka1 Ka2 ...Ka6
18
第18页/共32页
δ M L
n
[MLn]
CM
β n[ L ]n
]
k
1k
第三章-络合滴定法PPT课件

§3.1 分析化学中的络合物 §3.2 络合物的平衡常数
第三章 §3.3 副反应系数和条件稳定常数 络合滴定法 §3.4 金属离子指示剂
§3.5 络合滴定法的基本原理
§3.6 提高络合滴定选择性的途径 §3.7 络合滴定方式及应用示例
8/2/2024
.
1
§3.1 分析化学中的络合物
一、简单络合物:由中心离子和单基配位体组成
1 β2[L]2
βn [L]n
δML
···
[ML] cM
1
β1[L]
β1[L] β2[L]2
β1[L]n
δMLn
8/2/2024
[MLn ] cM
1
β1[L]
β1[L] n β. 2[L] 2
β1[L]n
8
例2 使100mL 0.010mol·L-1Zn2+降至10-9mol·L-1,问应加入多
逐级稳定常数
Cu2+ + NH3 [Cu(NH3)]2+ + NH3 [Cu(NH3)]22+ + NH3
[Cu(NH3)]32+ + NH3
[Cu(NH3)]2+ [Cu(NH3)]22+ [Cu(NH3)]3 2+
[Cu(NH3)]4 2+
lgK1 =4.31 lgK2 =3.67 lgK3 =3.04 lgK4 =2.30
一、络合物的稳定常数:
M+ L ML + L
ML2
+L
···
MLn-1 + L
ML K1 ML2 K2 M···L3 K3 MLn Kn
M+ L M + 2L M + 3L
第三章 §3.3 副反应系数和条件稳定常数 络合滴定法 §3.4 金属离子指示剂
§3.5 络合滴定法的基本原理
§3.6 提高络合滴定选择性的途径 §3.7 络合滴定方式及应用示例
8/2/2024
.
1
§3.1 分析化学中的络合物
一、简单络合物:由中心离子和单基配位体组成
1 β2[L]2
βn [L]n
δML
···
[ML] cM
1
β1[L]
β1[L] β2[L]2
β1[L]n
δMLn
8/2/2024
[MLn ] cM
1
β1[L]
β1[L] n β. 2[L] 2
β1[L]n
8
例2 使100mL 0.010mol·L-1Zn2+降至10-9mol·L-1,问应加入多
逐级稳定常数
Cu2+ + NH3 [Cu(NH3)]2+ + NH3 [Cu(NH3)]22+ + NH3
[Cu(NH3)]32+ + NH3
[Cu(NH3)]2+ [Cu(NH3)]22+ [Cu(NH3)]3 2+
[Cu(NH3)]4 2+
lgK1 =4.31 lgK2 =3.67 lgK3 =3.04 lgK4 =2.30
一、络合物的稳定常数:
M+ L ML + L
ML2
+L
···
MLn-1 + L
ML K1 ML2 K2 M···L3 K3 MLn Kn
M+ L M + 2L M + 3L
《络合滴定法》课件

应用领域
环境监测
络合滴定法可用于检测水 体中重金属离子的含量, 例如铜、铅和镍等。
医药研究
该方法可应用于药物中金 属离子含量的测定,以确 保药物的质量和安全性。
食品分析
络合滴定法可用于确定食 品中微量金属元素的含量, 保证食品的质量和安全。
发展历程
1
1 9世纪
络合滴定法首次被提出,并用于测定金属离子的含量。
2
2 0世纪
随着化学分析的发展,络合滴定法得到了进一步完善和应用。
3
现代
络合滴定法已成为常用的分析方法之一,在各个领域得到广泛的应用。
实验步骤
1 样品处理
选择合适的样品,并进 行必要的预处理,如稀 释或加热等。
2 滴定操作
选择适当的滴定剂,并 按照一定的操作步骤进 行滴定。
3 数据处理
整理和分析实验数据, 得出准确的结果。
实验结果分析
通过典型实例的介绍和讨论,深入分析实验结果的意义和相关化学知识,帮 助学员全面理解络合滴定法的应用。
实验注意事项
安全注意事项
进行实验时,必须注意实 验室安全,佩戴适当的防 护装备。
操作注意事项
操作滴定仪器时要非常仔 细,避免滴定液和样品的 误差。
设备注意事项
检查和校准实验设备的准 确性和完整性,确保实验 结果的准确性。
《络合滴定法》PPT课件
此PPT课件介绍了Байду номын сангаас合滴定法的基本原理、应用领域和实验步骤。通过详细 的讲解和实例,帮助大家深入理解该分析方法的重要性和实际应用。
什么是络合滴定法?
络合滴定法是一种化学分析方法,用于测定金属离子或其他化学物质中配位 化合物的含量。通过滴定剂与待测物质之间的络合反应,来确定待测物质的 含量。
第4章 络合滴定法PPT课件

上一页 下一页 返回 退出
如:
严格书写时,根据溶 液pH值,写出EDTA的 主要存在形成。
Mg2+ + HY3- ⇌ MgY2- + H+ pH9~10
Al3+ + H2Y2- ⇌ AlY- + 2H+ pH4~6
不标明pH时,一般通式为:
略去电荷
Mn+ + H2Y2- ⇌ MYn-4 + 2H+ 或 Mn+ + Y4- ⇌ MYn-4
上一页 下一页 返回 退出
§4-1 概 述
络合滴定法—以络合反应为基础的分析方法。 满足条件: ➢ 反应必须完全,稳定常数足够大 ➢ 有严格的计量关系,组成恒定,无逐级络合 现象 反应速度快,有适当的方法指示滴定终点
上一页 下一页 返回 退出
络合剂:提供配位原子 ➢ 无机络合剂 ➢ 有机络合剂
分析化学
§4 络合滴定法 Complexometric Titration
下一页 返回 退出
基本内容和重点要求
掌握络合反应的特点和稳定常数 理解EDTA与金属离子络合平衡的基本概念 理解副反应系数和条件稳定常数 理解滴定Mn+的允许最低pH的含义、酸效应曲线 掌握常用金属指示剂的使用条件及颜色变化 学习络合滴定的基本原理 掌握提高络合滴定选择性途径 掌握络合滴定法的实际应用
Mn+ Na+ Li+ Ba2+ Sr2+ Mg2+ Ca2+ Mn2+ Fe2+
lgKMY 1.66 2.76 7.76 8.63 8.69 10.69 14.04 14.33
Mn+ lgKMY
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MLn-1 L Kn MLn
Kn
[MLn ] [MLn-1 ][L]
n
=
K1K2 Kn
[ML n ] [M][L] n
最后一级累积形成常数又称络合物的总 形成常数。
计算溶液中各级络合物型体的平衡浓度:
ML 1M L
ML2 2 M L2
MLn n M Ln
3.络合剂的质子化常数
络合剂可以与金属离子络合,也可以与H+结 合,称之为络合剂的酸效应。
Mg(H 2O)62+ + 2
N OH
H O
H
N
O
Mg
O
N
H
O H
+ 2 H+ + 4 H2O
掩蔽剂:例如,用KCN掩蔽Zn2+,消除其对EDTA滴 定Pb2+的干扰。
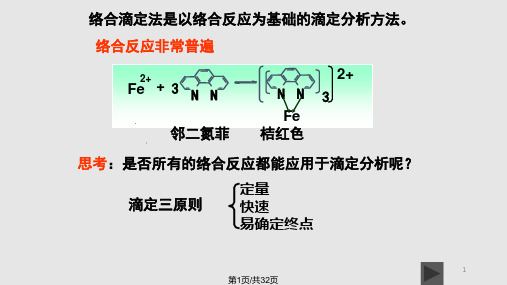
Zn2 4CN Zn(CN)24
显色剂:例如,邻二氮菲显色分光光度法测定 铁:
Fe2+ + 3
NN
邻二氮菲橘红色
NN Fe
滴定剂,例如:EDTA络合滴定法测定水的硬 度所形成的Ca2+-EDTA络合物。
酸性
EDTA性质
配位性质 溶解度
EDTA的性质
酸性
HOOCH2C -OOCH2C
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
1.0pKa1=0.9
pKa2=1.6
pKa3=2.07
H6Y02.+8
H6YH2+5Y+H2Y2-
H4Y
HY3-
Y4-H3Y-
分布系数
分布pK0a.46=2.75
分 数
0.4
H5Y+
H2Y2-
pKa5=6.24
pKa6=10.34
HY3-
Y4-
H3Y-
0.2
H4Y
0.0 /通用格/通式用格/通式用格/通式用格/通式用格/通式用格/通式用格/通式用格式 EDTA各种型体分布图 pH
配位性质
EDTA有6个配位基
HOOCH 2C -OOCH 2C
H N CH2 CH2 +
H6Y
K6H
H6Y H5Y H
1 Ka1
6H
K1H
K
H 2
K6H
EDTA各型体的浓度亦可通过Y与H+的平衡 浓度计算:
HY 1H Y H
H2Y 2H Y H 2
H6Y
H 6
Y
H
6
二、溶液中各级络合物型体的分布 设溶液中金属离子的分析浓度为cM,当络合反 应达到平衡时,溶液中游离络合剂的平衡浓度 为[L],根据物料平衡关系:
用EDTA滴定金属离子时,络合剂Y也能与 溶液中的H+结合,形成HY, H2Y,…H6Y等产物
Y + H+
KH1
Ka6
HY + H+ KH2 Ka5
HY
K1H
HY Y H
1
Ka6
H2Y
K
H 2
H2Y HY H
1
Ka5
1H K1H
H 2
K1H
K
H 2
H5Y + H+
KH6 Ka1
络合物。
NiY2-CuY2-CoY2-MnY2-CrY-FeY蓝深蓝紫红紫红深紫黄
络合滴定中的主要矛盾 应用的广泛性与选择性的矛盾; 滴定过程中酸度的控制。
第二节溶液中各级络合物型体的分布
一、络合物的形成常数
(一)ML(1:1)型络合物
M+Y⇌MY
平衡常数
KMY
MY M Y
K离
M Y MY
+ N
H
CH2COOCH2COOH
2个氨氮配位原子
4个羧氧配位原子
..
N
O ..
CO
溶解度
型体 H4Y Na2H2Y
溶解度(22ºC) 0.2g/L
111g/L,0.3mol/L
◦ 三、金属离子-EDTA络合物的特点 广泛,几乎能与所有的金属离子形成络合物 稳定,多数金属离子lgK>15; 络合比简单,一般为1:1; 络合反应速度快,水溶性好; EDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜色更深的
以Cu
2与NH
的络合反应为例,计算出游离氨的浓度
3
NH3 不同时,溶液中铜氨络合物各型体的i值,然后
作出i pNH3 曲线
铜氨络合物各种型体的分布
分布系数
Cu2+
Cu(NH3)42+
分
Cu(NH3)22+
布
分
数
Cu(NH3)2+
Cu(NH3)32+
6543210
lgK1-4 4.13.52.92.1
pNH3
例6-1已知Zn2+NH3溶液中,
CZn2+=0.020mol/L,[NH3]=0.10mol/L,计算 溶液中锌氨络合物各型体的浓度,并指出其 主要型体。
解:已知锌氨络合物的各级累积形成常数
lg 1 ~ lg 4分别为
2.27,4.61,7.01和9.06,NH3 101.00 mol L1,
(二)MLn(1:n)型络合物 1.络合物的逐级形成(解离)常数
K1
M L ML
Kn′
第一级形成常数 第n级解离常数
K1
ML M L
K
n
M L ML
2.络合物的累积形成常数和总形成常数
逐级络合
M L K1 ML
形成常数
[M L] K1 [M][L]
累积形成常数
1
=
K1
[ML] [M][L]
cZn2 101.70 mol L1。
1 2
1 102.27
101.00
104.61
1 102.00 107.01
103.00
109.06
104.00
0 Zn 1 i NH3 i 105.10
Zn2 c0 Zn2 106.80 mol L1
Zn(NH3 )2 01[NH3 ] 103.83
络合滴定法
本章要点 分析化学中的络合物 络合平衡 络合滴定原理 混合离子的选择性滴定 络合滴定方式及其应用
第一节概述 一、络合滴定中的滴定剂
以络合反应为基础的滴定分析方法称为 络合滴定法。
在络合反应中,提供配位原子的物质 称为配位体,即络合剂。
分析化学中广泛使用各种类型的络合物
沉淀剂:例如,8-羟基喹啉与镁离子生成螯合 物沉淀:
O
C H2C O CH2
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
乙二胺四乙酸 (EthyleneDiami neTetraaceticA cid), 简称EDTA。
二、EDTA及其二钠盐的性质
水溶液中的结构
HOOCH 2C -OOCH 2C
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
cM M ML ML2 MLn
M 1ML 2ML2 nMLn
M (1 iLi )
又根据分布分数的定义可以得到:
0
M
M
cM
1
1
i
Li
1
ML
ML
cM 1
1L i Ln
01L
n
MLn
MLn
cM
1
n
Ln i Li
0nLn
如果cM和[L]已知,则M离子各型体MLi的平 衡浓度均可由下式求出:[MLi]=icM
