必修二有机知识点汇编
第三章有机化合物知识点
绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
一、烃
1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:
饱和烃→烷烃(如:甲烷)
脂肪烃(链状)
烃不饱和烃→烯烃(如:乙烯)
芳香烃(含有苯环)(如:苯)
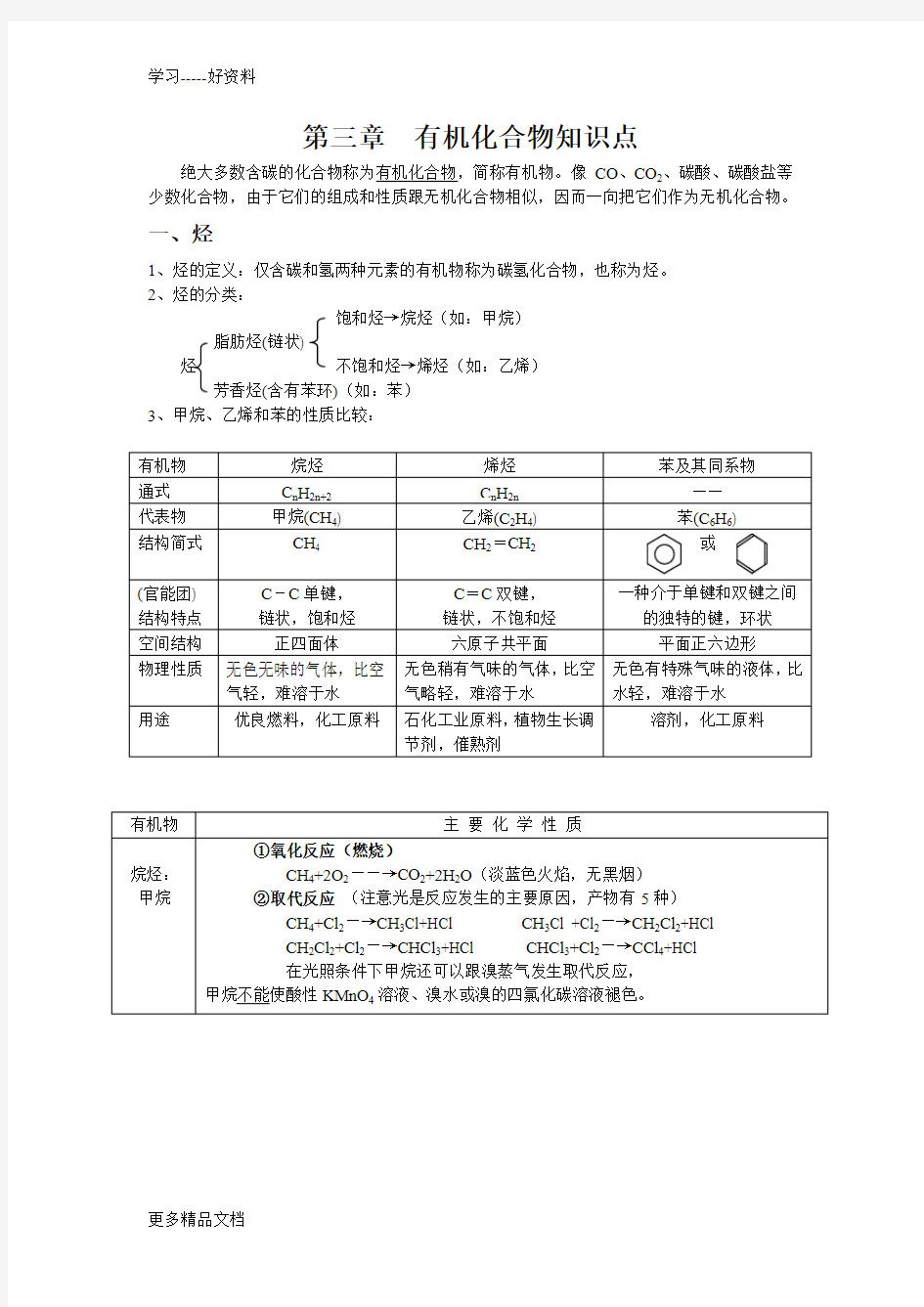
3、甲烷、乙烯和苯的性质比较:
有机物烷烃烯烃苯及其同系物
通式C n H2n+2C n H2n——
代表物甲烷(CH4) 乙烯(C2H4) 苯(C6H6)
结构简式CH4 CH2=CH2或
(官能团) 结构特点C-C单键,
链状,饱和烃
C=C双键,
链状,不饱和烃
一种介于单键和双键之间
的独特的键,环状
空间结构正四面体六原子共平面平面正六边形
物理性质无色无味的气体,比空
气轻,难溶于水无色稍有气味的气体,比空
气略轻,难溶于水
无色有特殊气味的液体,比
水轻,难溶于水
用途优良燃料,化工原料石化工业原料,植物生长调
节剂,催熟剂
溶剂,化工原料有机物主要化学性质
烷烃:甲烷
①氧化反应(燃烧)
CH4+2O2――→CO2+2H2O(淡蓝色火焰,无黑烟)
②取代反应(注意光是反应发生的主要原因,产物有5种)
CH4+Cl2―→CH3Cl+HCl CH3Cl +Cl2―→CH2Cl2+HCl
CH2Cl2+Cl2―→CHCl3+HCl CHCl3+Cl2―→CCl4+HCl
在光照条件下甲烷还可以跟溴蒸气发生取代反应,
甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。
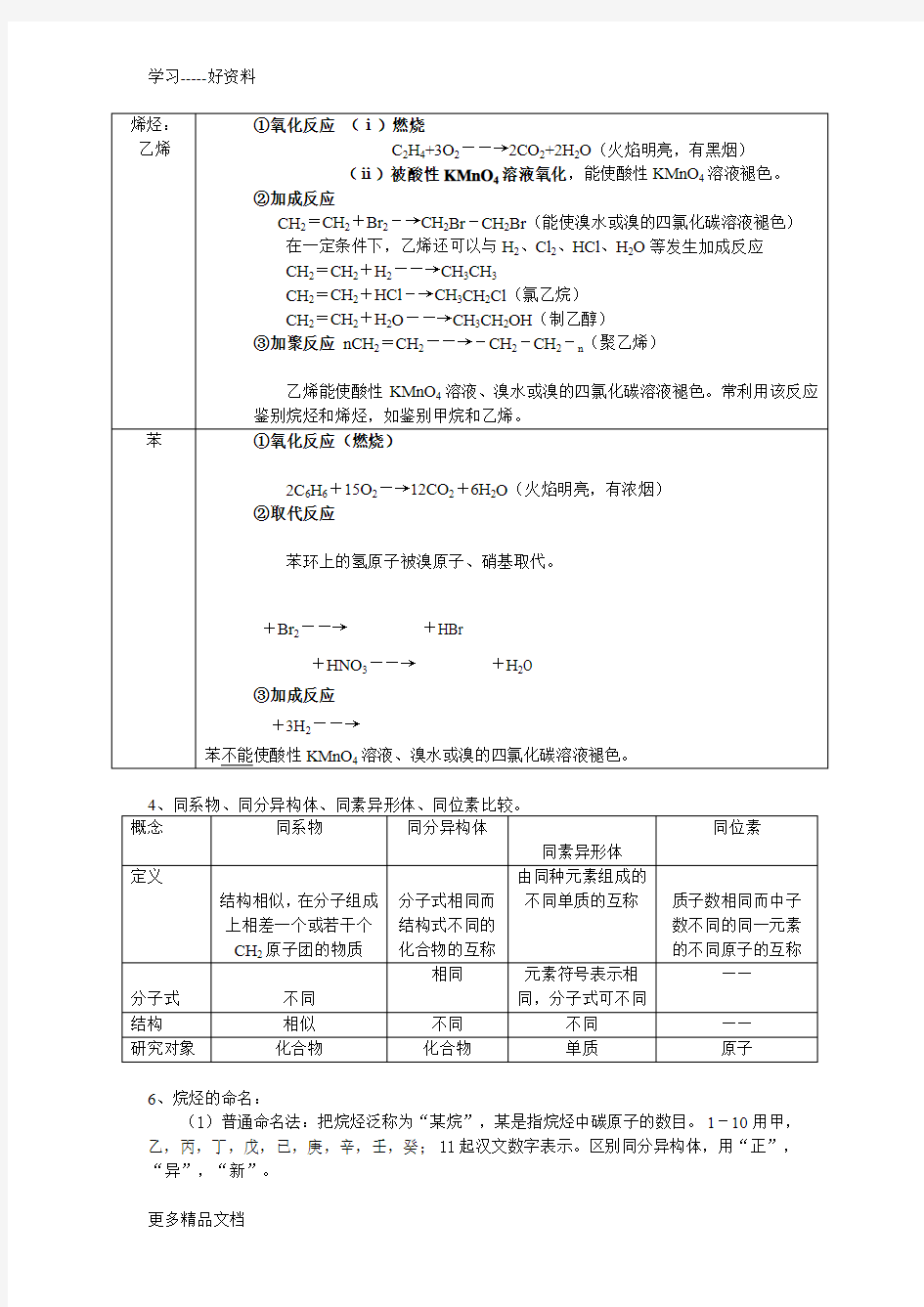
烯烃:乙烯①氧化反应(ⅰ)燃烧
C2H4+3O2――→2CO2+2H2O(火焰明亮,有黑烟)
(ⅱ)被酸性KMnO4溶液氧化,能使酸性KMnO4溶液褪色。
②加成反应
CH2=CH2+Br2-→CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H2、Cl2、HCl、H2O等发生加成反应
CH2=CH2+H2――→CH3CH3
CH2=CH2+HCl-→CH3CH2Cl(氯乙烷)
CH2=CH2+H2O――→CH3CH2OH(制乙醇)
③加聚反应nCH2=CH2――→-CH2-CH2-n(聚乙烯)
乙烯能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。常利用该反应鉴别烷烃和烯烃,如鉴别甲烷和乙烯。
苯①氧化反应(燃烧)
2C6H6+15O2―→12CO2+6H2O(火焰明亮,有浓烟)
②取代反应
苯环上的氢原子被溴原子、硝基取代。
+Br2――→+HBr
+HNO3――→+H2O
③加成反应
+3H2――→
苯不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。
4、同系物、同分异构体、同素异形体、同位素比较。
概念同系物同分异构体
同素异形体
同位素定义
结构相似,在分子组成上相差一个或若干个CH2原子团的物质分子式相同而
结构式不同的
化合物的互称
由同种元素组成的
不同单质的互称质子数相同而中子
数不同的同一元素
的不同原子的互称
分子式不同相同元素符号表示相
同,分子式可不同
——
结构相似不同不同——
研究对象化合物化合物单质原子
6、烷烃的命名:
(1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。1-10用甲,乙,丙,丁,戊,已,庚,辛,壬,癸;11起汉文数字表示。区别同分异构体,用“正”,“异”,“新”。
正丁烷,异丁烷;正戊烷,异戊烷,新戊烷。
(2)系统命名法:
①命名步骤:(1)找主链-最长的碳链(确定母体名称);(2)编号-靠近支链(小、多)的一端;
(3)写名称-先简后繁,相同基请合并.
②名称组成:取代基位置-取代基名称母体名称
③阿拉伯数字表示取代基位置,汉字数字表示相同取代基的个数
CH3-CH-CH2-CH3CH3-CH-CH-CH3
2-甲基丁烷2,3-二甲基丁烷
7、比较同类烃的沸点:
①一看:碳原子数多沸点高。
②碳原子数相同,二看:支链多沸点低。
常温下,碳原子数1-4的烃都为气体。
二、烃的衍生物
1、乙醇和乙酸的性质比较
有机物饱和一元醇饱和一元醛饱和一元羧酸
通式C n H2n+1OH ——C n H2n+1COOH
代表物乙醇乙醛乙酸
结构简式CH3CH2OH
或C2H5OH
CH3CHO CH3COOH
官能团羟基:-OH 醛基:-CHO 羧基:-COOH
物理性质无色、有特殊香味的液体,俗
名酒精,与水互溶,易挥发
(非电解质)——有强烈刺激性气味的无色液
体,俗称醋酸,易溶于水和乙
醇,无水醋酸又称冰醋酸。
用途作燃料、饮料、化工原料;用
于医疗消毒,乙醇溶液的质量
分数为75%——有机化工原料,可制得醋酸纤
维、合成纤维、香料、燃料等,
是食醋的主要成分
有机物主要化学性质
乙醇
①与Na的反应
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
乙醇与Na的反应(与水比较):①相同点:都生成氢气,反应都放热
②不同点:比钠与水的反应要缓慢
结论:乙醇分子羟基中的氢原子比烷烃分子中的氢原子活泼,但没有水分子中的氢原子活泼。
②氧化反应(ⅰ)燃烧
CH3CH2OH+3O2―→2CO2+3H2O
(ⅱ)在铜或银催化条件下:可以被O2氧化成乙醛(CH3CHO)
2CH3CH2OH+O2――→2CH3CHO+2H2O
③消去反应
CH3CH2OH――→CH2=CH2↑+H2O
乙醛氧化反应:醛基(-CHO)的性质-与银氨溶液,新制Cu(OH)2反应CH3CHO+2Ag(NH3)2OH――→CH3COONH4+H2O +2Ag↓+3NH3↑
(银氨溶液)
CH3CHO + 2Cu(OH)2――→CH3COOH+Cu2O↓+2H2O
(砖红色)
醛基的检验:方法1:加银氨溶液水浴加热有银镜生成。
方法2:加新制的Cu(OH)2碱性悬浊液加热至沸有砖红色沉淀乙酸①具有酸的通性:CH3COOH≒CH3COO-+H+
使紫色石蕊试液变红;
与活泼金属,碱,弱酸盐反应,如CaCO3、Na2CO3
酸性比较:CH3COOH > H2CO3
2CH3COOH+CaCO3=2(CH3COO)2Ca+CO2↑+H2O(强制弱)
②酯化反应
CH3COOH+C2H5OH CH3COOC2H5+H2O
酸脱羟基醇脱氢
人教版数学必修二知识点总结
第一章立体几何初步 1、柱、锥、台、球的结构特征 (1)棱柱:定义:两个面互相平行,其余各面都是四边形,且每相邻两个四边形的公共边都互相平行的几何体。 分类:以底面多边形的边数作为分类的标准分为三棱柱、四棱柱、五棱柱等。 表示:用各顶点字母,如五棱柱' ' ' ' 'E D C B A ABCDE-或用对角线的端点字母,如五棱柱' AD。 几何特征:两底面是对应边平行的全等多边形;侧面、对角面都是平行四边形;侧棱平行且相等;平行于底面的截面是与底面全等的多边形。 (2)棱锥:定义:有一个面是多边形,其余各面都是有一个公共顶点的三角形,由这些面所围成的几何体。 分类:以底面多边形的边数作为分类的标准分为三棱锥、四棱锥、五棱锥等 表示:用各顶点字母,如五棱锥' ' ' ' 'E D C B A P- 几何特征:侧面、对角面是三角形;平行于底面的截面与底面相似,其相似比等于顶点到截面距离与高的比。(3)棱台:定义:用一个平行于棱锥底面的平面去截棱锥,截面和底面之间的部分 分类:以底面多边形的边数作为分类的标准分为三棱态、四棱台、五棱台等 表示:用各顶点字母,如五棱台' ' ' ' 'E D C B A P- 几何特征:①上下底面是相似平行多边形②侧面是梯形③侧棱交于原棱锥的顶点。 (4)圆柱:定义:以矩形一边所在直线为轴旋转,其余三边旋转所成的曲面所围成的几何体。 几何特征:①底面是全等的圆;②母线与轴平行;③轴与底面圆的半径垂直;④侧面展开图是一个矩形。(5)圆锥:定义:以直角三角形一条直角边为旋转轴,旋转一周所成的曲面所围成的几何体。 几何特征:①底面是一个圆;②母线交于圆锥的顶点;③侧面展开图是一个扇形。 (6)圆台:定义:用一个平行于圆锥底面的平面去截圆锥,截面和底面之间的部分 几何特征:①上下底面是两个圆;②侧面母线交于原圆锥顶点;③侧面展开图是一弓形。 (7)球体:定义:以半圆的直径所在直线为旋转轴,半圆面旋转一周形成的几何体 几何特征:①球的截面是圆;②球面上任意一点到球心的距离等于半径。 2、空间几何体的三视图 定义三视图:正视图(光线从几何体的前面向后面正投影);侧视图(从左向右)、俯视图(从上向下) 注:正视图反映了物体上下、左右的位置关系,即反映了物体的高度和长度; 俯视图反映了物体左右、前后的位置关系,即反映了物体的长度和宽度; 侧视图反映了物体上下、前后的位置关系,即反映了物体的高度和宽度。 3、空间几何体的直观图——斜二测画法 斜二测画法特点:①原来与x轴平行的线段与'x轴平行且长度不变; ②原来与y轴平行的线段与'y轴平行,长度减为原来的一半。 4、柱体、锥体、台体的表面积与体积 (1)几何体的表面积为几何体各个面的面积的和。 (2)特殊几何体表面积公式(c为底面周长,h为高,'h为斜高,l为母线) ch S= 直棱柱侧面积 rh Sπ 2 = 圆柱侧 ' 2 1 ch S= 正棱锥侧面积 rl Sπ = 圆锥侧面积 ') ( 2 1 2 1 h c c S+ = 正棱台侧面积 l R r Sπ) (+ = 圆台侧面积 ()l r r S+ =π2 圆柱表 ()l r r S+ =π 圆锥表 ()2 2R Rl rl r S+ + + =π 圆台表 (3)柱体、锥体、台体的体积公式
物理必修二 知识点归纳
2017—2018学年度下学期高一物理组 主备教师:夏春青 第五章曲线运动 一、教学目标 使学生在理解曲线运动的基础上,进一步学习曲线运动中的两种特殊运动,抛体运动以及圆周运动,进而学习向心加速度并在牛顿第二定律的基础上推导出向心力,结合生活中的实际问题对曲线运动进一步加深理解。 二、教学内容 1.曲线运动及速度的方向; 2.合运动、分运动的概念; 3.知道合运动和分运动是同时发生的,并且互不影响; 4.运动的合成和分解; 5.理解运动的合成和分解遵循平行四边形定则; 6.知道平抛运动的特点,理解平抛运动是匀变速运动,会用平抛运动的规律解答有关问题; 7.知道什么是匀速圆周运动; 8.理解什么是线速度、角速度和周期; 9.理解各参量之间的关系;10.能够用匀速圆周运动的有关公式分析和解决有关问题;11.知道匀速圆周运动是变速运动,存在加速度。12.理解匀速圆周运动的加速度指向圆心,所以叫做向心加速度;13.知道向心加速度和线速度、角速度的关系;14.能够运用向心加速度公式求解有关问题;15.理解向心力的概念,知道向心力大小与哪些因素有关.理解公式的确切含义,并能用来计算;会根据向心力和牛顿第二定律的知识分析和讨论与圆周运动相关的物理现象; 16.培养学生的分析能力、综合能力和推理能力,明确解决实际问题的思路和方法。 三、知识要点
涉及的公式: §5-1 曲线运动 & 运动的合成与分解 一、曲线运动 1.定义:物体运动轨迹是曲线的运动。 2.条件:运动物体所受合力的方向跟它的速度方向不在同一直线上。 3.特点:①方向:某点瞬时速度方向就是通过这一点的曲线的切线方向。 ②运动类型:变速运动(速度方向不断变化)。 ③F 合≠0,一定有加速度a 。 ④F 合方向一定指向曲线凹侧。 ⑤F 合可以分解成水平和竖直的两个力。 4.运动描述——蜡块运动 二、运动的合成与分解 1.合运动 与分运动的关系: 等时性、独立性、等效性、矢量性。 2.互成角度的两个分运动的合运动的判断: ①两个匀速直线运动的合运动仍然是匀速直线运动。 ②速度方向不在同一直线上的两个分运动,一个是匀速直线运动,一个是匀变速直线运动,其合运动是匀变速曲线运动,a 合为分运动的加速度。 ③两初速度为0的匀加速直线运动的合运动仍然是匀加速直线运动。 ④两个初速度不为0的匀加速直线运动的合运动可能是直线运动也可能是曲线运动。当两个分运动的初速度的和速度方向与这两个分运动的和加速度在同一直线上时,合运动是匀变速直线运动,否则即为曲线运动。
高一化学必修二知识点总结
高一化学必修二知识点总结 化学是一门很有魅力的学科,许多学生学习高中化学感到困难,因此我们要学会去总结每个章节的重要知识点,下面就让小编给大家分享一些高一化学必修二知识点总结吧,希望能对你有帮助! 高一化学必修二知识点总结篇一1、最简单的有机化合物甲烷 氧化反应CH4(g)+2O2(g)CO2(g)+2H2O(l) 取代反应CH4+Cl2(g)CH3Cl+HCl 烷烃的通式:CnH2n+2n4为气体、所有1-4个碳内的烃为气体,都难溶于水,比水轻 碳原子数在十以下的,依次用甲、乙、丙、丁、戊、己、庚、辛、壬、癸 同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物 同分异构体:具有同分异构现象的化合物互称为同分异构 同素异形体:同种元素形成不同的单质 同位素:相同的质子数不同的中子数的同一类元素的原子 2、来自石油和煤的两种重要化工原料 乙烯C2H4(含不饱和的C=C双键,能使KMnO4溶液和溴的溶液褪色)
氧化反应2C2H4+3O22CO2+2H2O 加成反应CH2=CH2+Br2CH2Br-CH2Br(先断后接,变内接为外接) 加聚反应nCH2=CH2[CH2-CH2]n(高分子化合物,难降解,白色污染) 石油化工最重要的基本原料,植物生长调节剂和果实的催熟剂,乙烯的产量是衡量国家石油化工发展水平的标志 苯是一种无色、有特殊气味的液体,有毒,不溶于水,良好的有机溶剂 苯的结构特点:苯分子中的碳碳键是介于单键和双键之间的一种独特的键 氧化反应2C6H6+15O212CO2+6H2O 取代反应溴代反应+Br2-Br+HBr 硝化反应+HNO3-NO2+H2O 加成反应+3H2 3、生活中两种常见的有机物 乙醇 物理性质:无色、透明,具有特殊香味的液体,密度小于水沸点低于水,易挥发。 良好的有机溶剂,溶解多种有机物和无机物,与水以任意比互溶,醇官能团为羟基-OH 与金属钠的反应2CH3CH2OH+Na2CH3CHONa+H2
高一化学必修二知识点总结
高一化学必修二知识点概括总结 1 原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 2 元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+ 7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外); (2)同一主族的元素的最高正价、负价均相同 (3) 所有单质都显零价 3元素的金属性与非金属性 (1)同一周期的元素电子层数相同。因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增; (2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。 4最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 这些有的是第一节有的是本章后面几节的不管怎么说记下来有好处,以后都用的上 有机化合物主要由氧元素、氢元素、碳元素组成。有机物是生命产生的物质基础。其特点主要有: 多数有机化合物主要含有碳、氢两种元素,此外也常含有氧、氮、硫、卤素、磷等。部分有机物来自植物界,但绝大多数是以石油、天然气、煤等作为原料,通过人工合成的方法制得。和无机物相比,有机物数目众多,可达几百万种。有机化合物的碳原子的结合能力非常强,互相可以结合成碳链或碳环。碳原子数量可以是1、2个,也可以是几千、几万个,许多有机高分子化合物甚至可以有几十万个碳原子。此外,有机化合物中同分异构现象非常普遍,这也是造成有机化合物众多的原因之一。有机化合物除少数以外,一般都能燃烧。和无机物相
高中地理必修二知识点汇总
第一章人口的变化 第一节人口的数量变化 一、人口的自然增长 1、世界人口规模 (1)“世界60亿人口日”——1999年10月12日,世界人口已经相当庞大。(2)2008年,世界人口达到67亿。 2、人口的自然增长:人口自然增长率=出生率—死亡率 3、人口自然增长数量=人口基数×人口自然增长率 4、世界人口增长的差异 二、人口增长模式及其转变 1、构成:出生率、死亡率、自然增长率 2、类型: (1)原始型:高出生率、高死亡率、低自然增长率 (2)传统型:高出生率、低死亡率、高自然增长率 (3)现代型:低出生率、低死亡率、低自然增长率 3、转变:从原始型——传统型——现代型逐步过渡。
4、转变的因素:生产力水平、国家政策、社会福利、自然环境、文化观念、宗教信仰 5、分布:发达国家——现代型;发展中国家——传统型 强调:南非、冰岛——传统型;中国、韩国、古巴、新加坡、乌拉圭——现代型 第二节人口的空间变化 一、人口的迁移 1、人口迁移:人的居住地在国际或本国范围内发生改变。 2、人口迁移的判断:是否发生了地域上的移动(行政区位的改变);是否有居住地的改变;时间的改变(通常为一年) 3、人口迁移的类型:国际迁移、国内迁移 二、影响人口迁移的因素 1、主要因素 (1)自然环境因素:气候、土壤、水、矿产资源、自然灾害 (2)经济因素:经济发展、交通、通信 (3)政治因素:政策、社会变革、战争 (4)文化因素:宗教、民族、文化教育 2、对影响因素的评价: (1)经济因素往往起着重要作用 (2)某种特定的时空条件下,任何因素都可能成为决定性因素。
第三节人口的合理容量 一、地球最多能养活多少人——环境人口容量 1、环境承载力 2、环境人口容量 3、影响因素:资源、科技发展水平、开放程度、消费水平 4、世界环境人口容量:乐观无限、悲观已过、客观百亿 二、地球上适合养活多少人——人口合理容量 1、人口合理容量<环境人口容量 2、保持合理人口容量的紧迫性表现: 日益严峻的人口过快增长问题、人口城市化问题、城市人口老龄化问题3、保持合理人口容量的措施: (1)国际社会倡导尽最大可能把人口控制在合理规模内 (2)建立公平秩序保证大多数人拥有不断追求高水平生活质量的平等权利 第二章城市与城市化 第一节城市内部空间结构 一、城市形态类型——团块状条带状组团状 二、城市土地利用和功能分区 1、城市土地利用类型 2、城市功能区的形成:同类活动的空间集聚效应形成功能区 3、城市功能区的特点: (1)无明显界线 (2)某种功能为主,可能兼有其他功能 5、其他功能区:行政区、文化区、中心商务区 三、城市内部空间结构的形成和变化 1、城市内部空间结构的定义 2、城市内部空间结构的模式:同心圆模式、扇形模式、多核心模式
高一化学必修二第三章有机化合物知识点总结
第三章有机化合物知识点总结绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。 一、烃 1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。 2、甲烷、乙烯和苯的性质比较:
乙烯 1.氧化反应 I .燃烧 C 2H 4+3O 2??→ ?点燃 2CO 2+2H 2O (火焰明亮,伴有黑烟) II .能被酸性KMnO 4溶液氧化为CO 2,使酸性KMnO 4溶液褪色。 2.加成反应 CH 2=CH 2+Br 2?→?CH 2Br -CH 2Br (能使溴水或溴的四氯化碳溶液褪色) 在一定条件下,乙烯还可以与H 2、Cl 2、HCl 、H 2O 等发生加成反应 CH 2=CH 2+H 2 催化剂 △ CH 3CH 3 CH 2=CH 2+HCl 催化剂 △ CH 3CH 2Cl (氯乙烷:一氯乙烷的简称) CH 2=CH 2+H 2O 高温高压 催化剂 CH 3CH 2OH (工业制乙醇) 3.加聚反应 nCH 2=CH 2 催化剂 △ (聚乙烯) 注意:①乙烯能使酸性KMnO 4溶液、溴水或溴的四氯化碳溶液褪色。常利用该反应鉴 别烷烃和烯烃,如鉴别甲烷和乙烯。②常用溴水或溴的四氯化碳溶液来除去烷烃中的烯烃,但是不能用酸性KMnO 4溶液,因为会有二氧化碳生成引入新的杂质。 苯 难氧化 易取代 难加成 1.不能使酸性高锰酸钾褪色,也不能是溴水发生化学反应褪色,说明苯的化学性质比较稳定。但可以通过萃取作用使溴水颜色变浅,液体分层,上层呈橙红色。 2.氧化反应(燃烧) 2C 6H 6+15O 2??→ ?点燃 12CO 2+6H 2O (现象:火焰明亮,伴有浓烟,说明含碳量高) 3.取代反应 (1)苯的溴代: (溴苯)+ Br 2 FeBr 3 +HBr (只发生单取代反应,取代一个H ) ①反应条件:液溴(纯溴);FeBr 3、FeCl 3或铁单质做催化剂 ②反应物必须是液溴,不能是溴水。(溴水则萃取,不发生化学反应) ③溴苯是一种 无 色 油 状液体,密度比水 大 , 难 溶于水 ④溴苯中溶解了溴时显褐色,用氢氧化钠溶液除去溴,操作方法为分液。 (2)苯的硝化: + HO -NO 2 浓H 2SO 455℃~60℃ -NO 2 + H 2O ①反应条件:加热(水浴加热)、浓硫酸(作用:催化剂、吸水剂) ②浓硫酸和浓硝酸的混合:将浓硫酸沿烧杯内壁慢慢倒入浓硝酸中,边加边搅拌 ③硝基苯是一种 无 色 油 状液体,有 苦杏仁 气味, 有 毒,密度比水 大 ,难 溶于水。 ④硝基苯中溶解了硝酸时显黄色,用氢氧化钠溶液除去硝酸,操作方法为分液。 (3)加成反应(苯具有不饱和性,在一定条件下能和氢气发生加成反应) + 3H 2 Ni (一个苯环,加成消耗3个H 2,生成环己烷) 4概念 同系物 同分异构体 同素异形体 同位素 定义 结构相似,在分子组成 上相差一个或若干个CH 2原子团的物质 分子式相同而结构式不同的化合物的互称 由同种元素组成的不同单质的互称 质子数相同而中子数不同的同一元素的不同原子的互称 分子式 不同 相同 元素符号表示相同,分子式可不同 ——
高中数学必修二知识点整理
高中数学 必修2知识点 第一章 空间几何体 1.1柱、锥、台、球的结构特征 1.2空间几何体的三视图和直观图 1 三视图: 正视图:从前往后 侧视图:从左往右 俯视图:从上往下 2 画三视图的原则: 长对齐、高对齐、宽相等 3直观图:斜二测画法 4斜二测画法的步骤: (1).平行于坐标轴的线依然平行于坐标轴; (2).平行于y 轴的线长度变半,平行于x ,z 轴的线长度不变; (3).画法要写好。 5 用斜二测画法画出长方体的步骤:(1)画轴(2)画底面(3)画侧棱(4)成图 1.3 空间几何体的表面积与体积 (一 )空间几何体的表面积 1棱柱、棱锥的表面积: 各个面面积之和 2 圆柱的表面积 3 圆锥的表面积2 r rl S ππ+= 4 圆台的表面积2 2 R Rl r rl S ππππ+++= 5 球的表面积2 4R S π= (二)空间几何体的体积 1柱体的体积 h S V ?=底 2锥体的体积 h S V ?=底31 3台体的体积 h S S S S V ?++ =)3 1 下下 上上( 4球体的体积 33 4 R V π= 第二章 直线与平面的位置关系 2.1空间点、直线、平面之间的位置关系 2.1.1 1 平面含义:平面是无限延展的 2 平面的画法及表示 (1)平面的画法:水平放置的平面通常画成一个平行四边形,锐角画成450 ,且横边画成邻边的2倍长(如图) (2)平面通常用希腊字母α、β、γ等表示,如平面α、平面β等,也可以用表示平面的平行四边形的四个顶点或者相对的两个顶点的大写字母来表示,如平面AC 、平面ABCD 等。 3 三个公理: (1)公理1:如果一条直线上的两点在一个平面内,那么这条直线在此平面内 符号表示为 A ∈L B ∈L => L α A ∈α B ∈α 公理1作用:判断直线是否在平面内 D C B A α L A · α 222r rl S ππ+=
高中化学必修二有机化合物知识点总结
高中化学必修二有机化合物知识点总结
绝大多数含碳的化合物称为有机化合物,简称有机物。像 CO、CO2、碳酸、碳酸盐等少数 化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
有机物
主要化学性质 ①氧化反应(燃烧) CH4+2O2――→CO2+2H2O(淡蓝色火焰,无黑烟) ②取代反应 (注意光是反应发生的主要原因,产物有 5 种)
烷烃: 甲烷
CH4+Cl2―→CH3Cl+HCl CH2Cl2+Cl2―→CHCl3+HCl
CH3Cl +Cl2―→CH2Cl2+HCl CHCl3+Cl2―→CCl4+HCl
在光照条件下甲烷还可以跟溴蒸气发生取代反应, 甲烷不能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色。 ①氧化反应 (ⅰ)燃烧 烯烃: 乙烯 C2H4+3O2――→2CO2+2H2O(火焰明亮,有黑烟) (ⅱ)被酸性 KMnO4 溶液氧化,能使酸性 KMnO4 溶液褪色。 ②加成反应
CH2=CH2+Br2-→CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色) 在一定条件下,乙烯还可以与 H2、Cl2、HCl、H2O 等发生加成反应 CH2=CH2+H2――→CH3CH3 CH2=CH2+HCl-→CH3CH2Cl(氯乙烷) CH2=CH2+H2O――→CH3CH2OH(制乙醇) ③加聚反应 nCH2=CH2――→-CH2-CH2-n(聚乙烯) 乙烯能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色。常利用该反应鉴别烷烃和烯烃, 如鉴别甲烷和乙烯。 ①氧化反应(燃烧) 2C6H6+15O2―→12CO2+6H2O(火焰明亮,有浓烟) ②取代反应 苯环上的氢原子被溴原子、硝基取代。 苯 +Br2――→ +HNO3――→ ③加成反应 +3H2――→ 苯不能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色。 +HBr +H2O
、同系物、同分异构体、同素异形体、同位素比较。
概念 同系物 同分异构体 同素异形体 由同种元素组成的不 同单质的互称 元素符号表示相同, 分 子式可不同 不同 单质 同位素 质子数相同而中子数不 同的同一元素的不同原 子的互称 —— —— 原子 结构相似,在分子组成上 分子式相同而结 定义 相差一个或若干个 CH2 原 构式不同的化合 子团的物质 分子式 结构 研究对象 不同 相似 化合物 物的互称 相同 不同 化合物
6、烷烃的命名: (1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。1-10 用甲,乙, 丙,丁,戊,已,庚,辛,壬,癸;11 起汉文数字表示。区别同分异构体,用“正”,“异”, “新”。 正丁烷,异丁烷;正戊烷,异戊烷,新戊烷。 (2)系统命名法: ①命名步骤: (1)找主链-最长的碳链(确定母体名称); (2)编号-靠近支链 (小、 多) 的一端; (3)写名称-先简后繁,相同基请合并. ②名称组成:取代基位置-取代基名称母体名称 ③阿拉伯数字表示取代基位置,汉字数字表示相同取代基的个数 CH3-CH-CH2-CH3 CH3-CH-CH-CH3
必修二知识点梳理
7.(36分)读下图,回答下列问题。 (1)说明在地形影响下,该区域城镇和交通线路的分布特征。(6分) (2)简述图中滦河三角洲的成因。(6分) (3)比较图中(a)与(b),分析滦河河道的变化及其人为原因。(8分) 2010年,曹妃甸新建的首钢京唐钢铁厂已全面投入生产。 (4)说明钢铁厂建设对曹妃甸地区经济发展的带动作用。(8分) (5)概述制约华北平原农业生产的自然因素,并提出应对措施。(8分) 【答案】 (1)平原:城镇数量多,密度大,交通线路密集; 山地和高原:城镇数量少,密度小,交通线路稀疏。 (2)在滦河河口附近,流速减缓,泥沙堆积,形成三角洲。 (3)河道变窄,分叉减少。 主要由于上游沿线修建水库拦水,自滦河向流域外引水,滦河流域生产生活用水量增加,河流流量减少,沼泽湿地被开发为盐田、鱼塘。 (4)拉动基础设施建设;带动相关产业集聚;促进当地商业、服务业的发展;增加当地就业岗位和经济收入。 (5)制约因素:降水偏少,水资源短缺,多旱涝、寒潮、冰雹、风沙、病虫害、土壤盐碱化等;应对措施:完善农田水利设施和防护林体系;增加农业技术投入,发展节水农业;加强对灾害的监测和
第一章人口的变化 1.1 人口的数量变化 1、一个地区人口的自然增长,是由出生率和死亡率共同决定的。 2、几个重要的人口日:“世界60亿人口日”(1999/10/12);中国13亿人口(2005/1/6)。 3、人口增长的历史阶段 4、20世纪以来特别过去100多年人口增长迅速的原因: 过去100多年,伴随着生产工具和社会生产力等方面的进步,人类对自然环境开发利用和改造的范围不断扩大,对各种灾害和疾病的防御能力也不断提高,使人类对自然环境的利用和适应性不断增强,死亡率进一步降低。 5、某个地区人口自然增长的数量受人口自然增长率和人口基数大小共同影响。 6、发达国家和发展中国家人口变化比: 7、人口增长模式由出生率、死亡率、自然增长率三个指标构成。 公式:自然增长率=出生率-死亡率 8、三种人口增长模式特点 9、人口增长模式的转变: 人口增长模式是由原始型向传统型,继而向现代型转变。 转变的因素:生产力水平、国家政策、社会福利、自然环境、文化观念 10、大部分发达国家(欧洲、北美为代表)为现代型,大多数发展中国家为传统型,中国为
高一数学必修二基础知识点总结
高一数学必修二基础知识点总结 【一】 1、柱、锥、台、球的结构特征 (1)棱柱: 定义:有两个面互相平行,其余各面都是四边形,且每相邻两个 四边形的公共边都互相平行,由这些面所围成的几何体。 分类:以底面多边形的边数作为分类的标准分为三棱柱、四棱柱、五棱柱等。 表示:用各顶点字母,如五棱柱或用对角线的端点字母,如五棱 柱 几何特征:两底面是对应边平行的全等多边形;侧面、对角面都 是平行四边形;侧棱平行且相等;平行于底面的截面是与底面全等的多 边形。 (2)棱锥 定义:有一个面是多边形,其余各面都是有一个公共顶点的三角形,由这些面所围成的几何体 分类:以底面多边形的边数作为分类的标准分为三棱锥、四棱锥、五棱锥等 表示:用各顶点字母,如五棱锥 几何特征:侧面、对角面都是三角形;平行于底面的截面与底面 相似,其相似比等于顶点到截面距离与高的比的平方。 (3)棱台:
定义:用一个平行于棱锥底面的平面去截棱锥,截面和底面之间 的部分 分类:以底面多边形的边数作为分类的标准分为三棱态、四棱台、五棱台等 表示:用各顶点字母,如五棱台 几何特征:①上下底面是相似的平行多边形②侧面是梯形③侧棱 交于原棱锥的顶点 (4)圆柱: 定义:以矩形的一边所在的直线为轴旋转,其余三边旋转所成的 曲面所围成的几何体 几何特征:①底面是全等的圆;②母线与轴平行;③轴与底面圆的 半径垂直;④侧面展开图是一个矩形。 (5)圆锥: 定义:以直角三角形的一条直角边为旋转轴,旋转一周所成的曲 面所围成的几何体 几何特征:①底面是一个圆;②母线交于圆锥的顶点;③侧面展开 图是一个扇形。 (6)圆台: 定义:用一个平行于圆锥底面的平面去截圆锥,截面和底面之间 的部分 几何特征:①上下底面是两个圆;②侧面母线交于原圆锥的顶 点;③侧面展开图是一个弓形。 (7)球体:
高一化学必修二有机知识点归纳
高一化学必修二有机知识点归纳【篇一】高一化学必修二有机知识点归纳 一、物质的分类 金属:Na、Mg、Al 单质 非金属:S、O、N 酸性氧化物:SO3、SO2、P2O5等 氧化物碱性氧化物:Na2O、CaO、Fe2O3 氧化物:Al2O3等 纯盐氧化物:CO、NO等 净含氧酸:HNO3、H2SO4等 物按酸根分 无氧酸:HCl 强酸:HNO3、H2SO4、HCl 酸按强弱分 弱酸:H2CO3、HClO、CH3COOH 化一元酸:HCl、HNO3 合按电离出的H+数分二元酸:H2SO4、H2SO3 物多元酸:H3PO4 强碱:NaOH、Ba(OH)2 物按强弱分 质弱碱:NH3•H2O、Fe(OH)3 碱 一元碱:NaOH、
按电离出的HO-数分二元碱:Ba(OH)2 多元碱:Fe(OH)3 正盐:Na2CO3 盐酸式盐:NaHCO3 碱式盐:Cu2(OH)2CO3 溶液:NaCl溶液、稀H2SO4等 混悬浊液:泥水混合物等 合乳浊液:油水混合物 物胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等 二、分散系相关概念 1.分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。 2.分散质:分散系中分散成粒子的物质。 3.分散剂:分散质分散在其中的物质。 4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。分散质粒子直径小于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液。 下面比较几种分散系的不同: 分散系溶液胶体浊液 分散质的直径100nm(粒子直径大于10-7m) 分散质粒子单个小分子或离子许多小分子集合体或高
(完整word版)必修二有机化学知识点整理
必修二中有机化学知识整理 最简单的有机化合物——甲烷 一、组成与结构 分子式:电子式:结构式:结构简式:空间构型:甲烷的二氯代物有几种? 二、性质 (一)物理性质:常温常压下为色味体,密度于空气密度,溶于水。 (二)化学性质: 1、燃烧 ①写出甲烷燃烧的化学方程式: ②现象: ③如何检验燃烧的产物? ④在常温常压下,甲烷的燃烧热为890KJ/mol,写出甲烷的燃烧热的热化学方程式: 2、取代反应:有机物分子里某些原子或原子团被其它原子或原子团所替代的反应。 反应条件:甲烷与纯净的气态卤素单质在光照条件下反应。 写出甲烷与氯气在光照下的取代反应方程式: 其中有机产物有,在常温常压下,其中为气体,其余均为液体;其中为正四面体构型,其余均为构型。 来自石油的一种基本化工原料——乙烯 一、组成与结构 分子式:电子式:结构式:结构简式:官能团:最简式(或比例式、实验式):空间构型:构型,个原子共平面。 二、性质 (一)物理性质:常温常压下为色味体,密度于空气密度,溶于水。 (二)化学性质: 1、氧化反应 ①燃烧 a,写出乙烯燃烧的化学方程式: b,现象: ②与酸性KMnO4溶液反应:酸性KMnO4溶液将乙烯氧化为CO2 现象: 2、加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 完成下列乙烯与H2、X2、HX、H2O的加成反应方程式,注意反应条件! ①与H2 ②与Br2,将乙烯通入溴水中 ③与HX ④与H2O
3、加聚反应:由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物分子,这样的聚合反应同时也是加成反应。 写出乙烯的加聚反应方程式,并指出单体、链节、聚合度: 【思考】 1、鉴别甲烷与乙烯的方法有: 2、如何除去混在甲烷中的乙烯?能否用酸性KMnO4溶液?为什么? 来自煤的一种基本化工原料——苯 一、组成与结构 分子式:结构式:结构简式:最简式(或比例式、实验式):空间构型:构型,个原子共平面。 【思考】1、苯的一氯代物有几种? 2、苯的邻位二氯代物有几种? 二、性质 (一)物理性质:常温常压下为色味体,密度于水的密度,溶于水。 (二)化学性质: 1、燃烧 ①写出燃烧的化学方程式: ②现象: 2、加成反应:(与H2、X2) 写出苯与H2的加成反应方程式: 3、取代反应: ①卤代反应:苯与液溴(纯净的卤素单质)在FeBr3的催化下反应 写出反应方程式: 有机产物的名称为,常温常压下为色体,密度于水的密度,溶于水。【思考】 a,加入药品的顺序为: b,此反应的催化剂为: c,长导管的作用为: d,反应开始时可观察到哪些现象? e,尾气处理装置如图,为何如此设计?还有哪些尾气处理装置可达到此目的? f,如何检验产物中的无机物? g,如何提纯产物中的有机物? h,什么现象说明发生了取代反应而不是加成反应?
高中必修二数学知识点全面总结
第1章 空间几何体1 1 .1柱、锥、台、球的结构特征 1. 2空间几何体的三视图和直观图 11 三视图: 正视图:从前往后 侧视图:从左往右 俯视图:从上往下 22 画三视图的原则: 长对齐、高对齐、宽相等 33直观图:斜二测画法 44斜二测画法的步骤: (1).平行于坐标轴的线依然平行于坐标轴; (2).平行于y 轴的线长度变半,平行于x ,z 轴的线长度不变; (3).画法要写好。 5 用斜二测画法画出长方体的步骤:(1)画轴(2)画底面(3)画侧棱(4)成图 1.3 空间几何体的表面积与体积 (一 )空间几何体的表面积 1棱柱、棱锥的表面积: 各个面面积之和 2 圆柱的表面积 3 圆锥的表面积2 r rl S ππ+= 4 圆台的表面积22R Rl r rl S ππππ+++= 5 球的表面积2 4R S π= (二)空间几何体的体积 1柱体的体积 h S V ?=底 2锥体的体积 h S V ?=底31 3台体的体积 h S S S S V ?++=)31 下下上上( 4球体的体积 33 4 R V π= 第二章 直线与平面的位置关系 2.1空间点、直线、平面之间的位置关系 222r rl S ππ+=
2.1.1 1 平面含义:平面是无限延展的 2 平面的画法及表示 (1)平面的画法:水平放置的平面通常画成一个平行四边形, 锐角画成450,且横边画成邻边的2倍长(如图) (2)平面通常用希腊字母α、β、γ等表示,如平面α、平面β等,也可以用表示平面的平行四边形的四个顶点或者相对的两个顶点的大写字母来表示,如平面AC 、平面ABCD 等。 3 三个公理: (1)公理1:如果一条直线上的两点在一个平面内,那么这条直线在此平面内 符号表示为 A ∈L B ∈L => L α A ∈α B ∈α 公理1作用:判断直线是否在平面内 (2)公理2:过不在一条直线上的三点,有且只有一个平面。 符号表示为:A 、B 、C 三点不共线 => 有且只有一个平面α, 使A ∈α、B ∈α、C ∈α。 公理2 作用:确定一个平面的依据。 (3)公理3:如果两个不重合的平面有一个公共点,那么它们有且只有一条过该点的公共直线。 符号表示为:P ∈α∩β =>α∩β=L ,且P ∈L 公理3作用:判定两个平面是否相交的依据 2.1.2 空间中直线与直线之间的位置关系 1 空间的两条直线有如下三种关系: 相交直线:同一平面内,有且只有一个公共点; 平行直线:同一平面内,没有公共点; 异面直线: 不同在任何一个平面内,没有公共点。 2 公理4:平行于同一条直线的两条直线互相平行。 符号表示为:设a 、b 、c 是三条直线 a ∥ b c ∥b 强调:公理4实质上是说平行具有传递性,在平面、空间这个性质都适用。 公理4作用:判断空间两条直线平行的依据。 3 等角定理:空间中如果两个角的两边分别对应平行,那么这两个角相等或互补 4 注意点: ① a'与b'所成的角的大小只由a 、b 的相互位置来确定,与O 的选择无关,为了简便,点O 一般取在两直线中的一条上; ② 两条异面直线所成的角θ∈(0, ); ③ 当两条异面直线所成的角是直角时,我们就说这两条异面直线互相垂直,记作a ⊥b ; ④ 两条直线互相垂直,有共面垂直与异面垂直两种情形; ⑤ 计算中,通常把两条异面直线所成的角转化为两条相交直线所成的角。 2.1.3 — 2.1.4 空间中直线与平面、平面与平面之间的位置关系 1、直线与平面有三种位置关系: D C B A α L A · α C · B · A · α P · α L β 共面直线 =>a ∥c 2
必修二基础知识
必修2.遗传与进化 1. 4 细胞的增殖 (1)细胞的生长和增殖的周期性。 细胞不能无限长大:细胞表面积与体积的关系限制了细胞的长大(相对表面积);细胞的核质比。 细胞以分裂的方式进行增殖:意义:生物体生长、发育、繁殖和遗传的基础;真核细胞分裂的方式:有丝分裂、无丝分裂、减数分裂 (2)细胞周期: 概念:指连续分裂(前提)的细胞,从一次分裂完成时开始,到下一次分裂完成时为止。 ①分裂间期:分裂间期为分裂期进行活跃的物质准备,完成DNA分子的复制和有关蛋白质的合成(即染色体的复制)。分裂间期所占时间长。 ②分裂期:分为前期、中期、后期、末期 与有丝分裂有关的细胞器:中心体、线粒体(供能)、核糖体(合成蛋白质)、高尔基体(形成细胞壁) (3)细胞的有丝分裂 分裂间期 特点:完成DNA的复制(加倍)和有关蛋白质的合成 结果:每个染色体都形成两个姐妹染色单体,呈染色质形态(染色体数目没有变化)分裂期 ①前期 特点:出现染色体、出现纺锤体;核膜、核仁消失 染色体特点:1、染色体散乱地分布在细胞中心附近。2、每个染色体都有两条姐妹染色单体 ②中期 特点:所有染色体的着丝点都排列在赤道板上(与纺锤体的中轴垂直的平面,无此结构)染色体的形态和数目最清晰,故中期是进行染色体观察及计数的最佳时机。 ③后期
特点:着丝点分裂,姐妹染色单体分开,成为两条子染色体。并分别向两极移动。 纺锤丝牵引着子染色体分别向细胞的两极移动。这时细胞核内的全部染色体就平均分配到了细胞两极 染色体特点:染色单体消失,染色体数目加倍。(DNA分子数目没有变化) ④末期 特点:染色体变成染色质,纺锤体消失;核膜、核仁重现;在赤道板位置出现细胞板,并扩展成分隔两个子细胞的细胞壁 植物与动物细胞的有丝分裂的比较 相同点:1、都有间期和分裂期。分裂期都有前、中、后、末四个阶段。 2、分裂产生的两个子细胞的染色体数目和组成完全相同且与母细胞完全相同。染色体在各期的变化也完全相同。 3、有丝分裂过程中染色体、DNA分子数目的变化规律。动物细胞和植物细胞完全相同。不同点: 有丝分裂的意义:将亲代细胞的染色体经过复制以后,精确地平均分配到两个子细胞中去。因而在细胞的亲代和子代之间保持了遗传性状的稳定性。 规律总结 ①染色体数目是根据着丝点数目来计数的 ②无染色单体时,染色体:DNA=1:1,有染色单体存在时,染色体:染色单体:DNA=1:2:2 ③染色体数目在有丝分裂后期加倍,末期恢复(减半) ④DNA数目在有丝分裂间期加倍,末期恢复(减半)
高中生物必修二知识点总结(精华版)
生物必修2复习知识点 第二章基因和染色体的关系 第一节减数分裂 一、减数分裂的概念 减数分裂(meiosis)是进行有性生殖的生物形成生殖细胞过程中所特有的细胞分裂方式。在减数分裂过程中,染色体只复制一次,而细胞连续分裂两次,新产生的生殖细胞中的染色体数目比体细胞减少一半。 (注:体细胞主要通过有丝分裂产生,有丝分裂过程中,染色体复制一次,细胞分裂一次,新产生的细胞中的染色体数目与体细胞相同。) 二、减数分裂的过程 1、精子的形成过程:精巢(哺乳动物称睾丸) ●减数第一次分裂1、精子的形成过程:精巢(哺乳动物称睾丸)间期:染色体复制(包括DNA复制和蛋白质的合成)。 前期:同源染色体两两配对(称联会), 形成四分体。四分体中的非姐妹染色单 体之间常常交叉互换。 中期:同源染色体成对排列在赤道板上 (两侧)。 后期:同源染色体分离;非同源染色体 自由组合。 末期:细胞质分裂,形成2个子细胞。 ●减数第二次分裂(无同源染色体 ......) 前期:染色体排列散乱。 中期:每条染色体的着丝粒都排列在细胞中央的赤道板上。 后期:姐妹染色单体分开,成为两条子染色体。并分别移向细胞两极。 末期:细胞质分裂,每个细胞形成2个子细胞,最终共形成4个子细胞。
2、卵细胞的形成过程:卵巢 附:减数分裂过程中染色体和DNA 的变化规律 三、精子与卵细胞的形成过程的比较 精子的形成 卵细胞的形成 不 同点 形成部位 精巢(哺乳动物称睾丸) 卵巢 过 程 有变形期 无变形期 子细胞数 一个精原细胞形成4个精子 一个卵原细胞形成1个卵细胞+3个极体 相同点 精子和卵细胞中染色体数目都是体细胞的一半
生物必修二基础知识点背诵版讲解
生物必修二基础知识点背诵版 1、遗传的基本规律 (1)基因的分离定律 ①豌豆做材料的优点:(1)豌豆能够严格进行自花授粉,而且是闭花授粉,自然条件下能保持纯种。(2)品种之间具有易区分的性状。 ②人工杂交试验过程:去雄(留下雌蕊)→套袋(防干扰)→人工传粉 ③一对相对性状的遗传现象:具有一对相对性状的纯合亲本杂交,后代表现为一种表现型,F1代自交,F2代中出现性状分离,分离比为3:1。 ④基因分离定律的实质:在杂合子的细胞中,位于一对同源染色体上的等位基因,具有一定的独立性,生物体在进行减数分裂时,等位基因会随同源染色体的分开而分离,分别进入到两个配子中,独立地随配子遗传给后代。 (2)基因的自由组合定律 ①两对等位基因控制的两对相对性状的遗传现象:具有两对相对性状的纯合子亲本杂交后,产生的F1自交,后代出现四种表现型,比例为9:3:3:1。四种表现型中各有一种纯合子,分别在子二代占1/16,共占4/16;双显性个体比例占9/16;双隐性个体比例占1/16;单杂合子占2/16×4=8/16;双杂合子占4/16;亲本类型比例各占9/16、1/16;重组类型比例各占3/16、3/16 ②基因的自由组合定律的实质:位于非同源染色体上的非等位基因的分离或组合是互不干扰的。在进行减数分裂形成配子的过程中,同源染色体上的等位基因彼此分离,同时非同源染色体上的非等位基因自由组合。 ③运用基因的自由组合定律的原理培育新品种的方法:优良性状分别在不同的品种中,先进行杂交,从中选择出符合需要的,再进行连续自交即可获得纯合的优良品种。 记忆点: 1.基因分离定律:具有一对相对性状的两个生物纯本杂交时,子一代只表现出显性性状;子二代出现了性状分离现象,并且显性性状与隐性性状的数量比接近于3:1。 2.基因分离定律的实质是:在杂合子的细胞中,位于一对同源染色体,具有一定的独立性,生物体在进行减数分裂形成配子时,等位基因会随着的分开而分离,分别进入到两个配子中,独立地随配子遗传给后代。 3.基因型是性状表现的内存因素,而表现型则是基因型的表现形式。表现型=基因型+环境条件。 4.基因自由组合定律的实质是:位于非同源染色体上的非等位基因的分离或组合是互不干扰的。在进行减数分裂形成配子的过程中,同源染色体上的等位基因彼此分离,同时非同源染色体上的非等位基因自由组合。在基因的自由组合定律的范围内,有n对等位基因的个体产生的配子最多可能有2n种。 2、细胞增殖 (1) 细胞周期:指连续分裂的细胞,从一次分裂完成时开始,到下一次分裂完成时为止。 (2)有丝分裂: 分裂间期的最大特点:完成DNA分子的复制和有关蛋白质的合成
语文必修二基础知识总结
人教版语文必修二基础知识总结 荷塘月色 一、词语 蓊蓊郁郁弥望袅娜羞涩渺茫 霎时宛然脉脉酣眠参差斑驳 峭楞楞倩影梵婀玲妖童媛女 消受独处琐屑踱步 二、文学常识 朱自清:原名自华,字佩弦,诗人、散文家、学者,又是民主战士、爱国知识分子,毛泽东称颂他“表现了我们民族的英雄气概”。作品有诗文集《踪迹》,散文集《背影》、《欧游杂记》、《伦敦杂记》,收在《朱自清文集》里。散文名篇有《背影》、《绿》、《匆匆》、《荷塘月色》、《桨声灯影里的秦淮河》等。 故都的秋 一、词语 混沌混水摸鱼潭柘寺皇城人海 一椽驯鸽落蕊落寞啼唱 嘶叫歧韵颓废散文钞 廿四桥普陀山鲈鱼 二、文学常识 郁达夫:(1896-1945),1921年第一部小说集《沉沦》问世,1923年《春风沉醉的晚上》、《薄奠》。作品风格清新,抒情浓烈,有感伤情调,有时流露出颓废色彩;文学观和审美观方面,他提倡“静的文学”,写的也是“静如止水似的文学”。 囚绿记 一、词语 猗郁蕈菌葱茏婆娑淅沥 瞥见移徙陆蠡 二、成语 涸辙之鲋:比喻处在困境中急待救援的人。 揠苗助长:比喻违反事物的发展规律,急于求成,反而坏事。 急不暇择:因过于急切而来不及选择。 三、文学常识 陆蠡,现代散文家、翻译家,著有散文集《囚绿记》、《海星》、《竹刀》,译著有《罗亭》、《鲁宾逊漂流记》。 《诗经》两首 一、词语 氓蚩蚩愆期将子无怒垝垣 尔卜尔筮咎言载笑载言于嗟鸠兮 桑葚犹可说也其黄而陨自我徂尔 淇水汤汤渐车帷裳罔极靡有朝矣 咥笑夙兴夜寐隰则有泮玁狁 不遑靡盬孔疚骙骙小人所腓
象弭鱼服雨雪霏霏信誓旦旦 二、成语 夙兴夜寐:早起晚睡,形容勤劳。 信誓旦旦:誓言诚恳可信。 三、文学常识: 1、《诗经》是我国最早的诗歌总集。它收集了从西周初期到春秋中叶约500年间的诗歌305篇。先秦称为《诗》或《诗三百》,西汉时被尊为儒家经典,始称《诗经》。 2、《诗经》按乐曲分为风、雅、颂三部分。“风”指十五国风,绝绝大部分是民间歌谣;“雅”分大雅小雅,诗宫廷乐歌;“颂”有“周颂”“鲁颂”“商颂”,是宗庙祭祀的乐歌。《诗经》的表现手法有:赋、比、兴。 3、《诗经》六义:风、雅、颂、赋、比、兴。 4、《诗经》开创了中国诗歌的优秀传统,是我国现实主义文学的光辉起点。现实主义的《诗经》与屈原浪漫主义的骚体作品交相辉映,并称“风骚”。 离骚 1、文学常识 屈原(约公元前340—约前278),战国时期楚国人,伟大的爱国诗人、政治家,“楚辞”的创立者和代表作者。《离骚》是屈原的代表作,370多句,2400多字,为中国古代最长的政治抒情诗。《离骚》又常被举作屈原全部作品的总称。在文学史上,还常以“风”、“骚”并称,用“风”来概括《诗经》,用“骚”来概括《楚辞》,分别是现实主义和浪漫主义的源头。 2、词语读音 修姱嫉妒謇忳郁悒侘傺 溘死鸷鸟方圜攘诟谣诼 延伫芰荷偭兰皋椒丘 岌岌杂糅昭质可惩 孔雀东南飞 1、文学常识 《孔雀东南飞》是我国古代最优秀的民间叙事诗。沈归愚称为“古今第一首长诗”,所以它也被称为我国古代文学史上最早的一首长篇叙事诗。原名《古诗为焦仲卿妻作》,最早见于南朝徐陵所编的《玉台新咏》。它是继《诗经》《楚辞》以后较早的一部古诗总集。后人把《孔雀东南飞》与北朝的《木兰辞》及唐代韦庄的《秦妇吟》并称为“乐府三绝”,并且前两者又被称为“乐府双璧”。 乐府诗是一种合乐的古诗,因传自乐府官署而得名,乐府原为汉武帝刘彻设置的音乐机关,专事制作乐章并采集整理各地民间俗乐和歌辞,分别用于朝廷典礼和宴会时演唱。这些乐章、歌辞,后来就叫“乐府”,成为继《诗经》、《楚辞》而起的一种新诗体。 2、词语读音 箜篌怀忿槌床哽咽绣腰襦 葳蕤卑鄙蹑丝履玳瑁流纨 明月珰磐石拊掌郡丞思量 量体裁衣否极泰来白鹄婀娜 踯躅金镂鞍赍钱蟠龙琉璃 晻晻日暝摧藏蹑履怅然
