金属晶体+离子晶体+分子晶体与原子晶体

第三节金属晶体
【教学目标】
1.理解金属键的概念和电子气理论
2.初步学会用电子气理论解释金属的物理性质
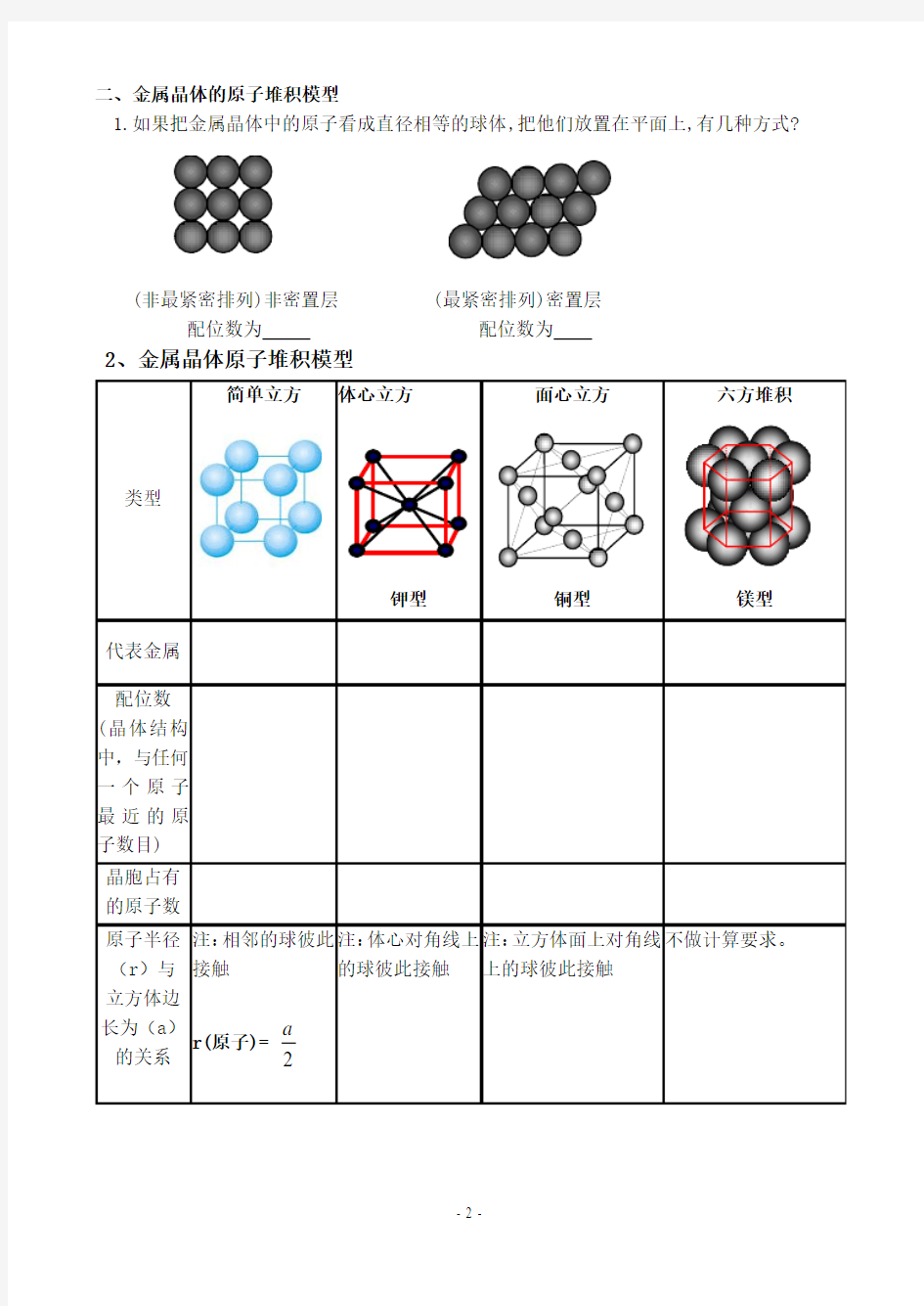
3.了解金属晶体内原子的几种常见排列方式
【教学难点】金属键和电子气理论;金属晶体内原子的空间排列方式
【教学重点】金属具有共同物理性质的解释;金属晶体内原子的空间排列方式
【教学方法】对比、诱导、分析、观察、推理、归纳相结合、讲授法、探究法、实验法【教学过程】
一、金属键
1、金属晶体定义:由和通过键形成的具有一定几何外形的晶体。
2、构成微粒:和。
3、微粒间的作用力:键。
4、金属的物理通性(用电子气理论解释)
“电子气理论”:金属原子脱落下来的形成遍布整块晶体的“”,被所有原子共用,金属键就是将所有原子维系在一起的这种金属脱落价电子后形成的离子与“价电子气”之间的强烈的相互作用。
比较电解质溶液、金属晶体导电的区别
导电性:在外加电场作用下定向移动,所以能导电。
②导热性:与碰撞传递热量。
温度升高金属的导热率。
③延展性:相对滑动,金属离子与自由电子仍保持相互作用。
④ 硬度和熔沸点:与金属键的强弱有关。
一般规律:原子半径越小、金属键就越
价电子数(即阳离子的的电荷)越,金属键就越。
金属键的强弱影响金属晶体的物理性质。
金属键越强,硬度就越,熔沸点就越。
- 1 -
相关主题
