CODATA物理常数(物理化学常数部分)
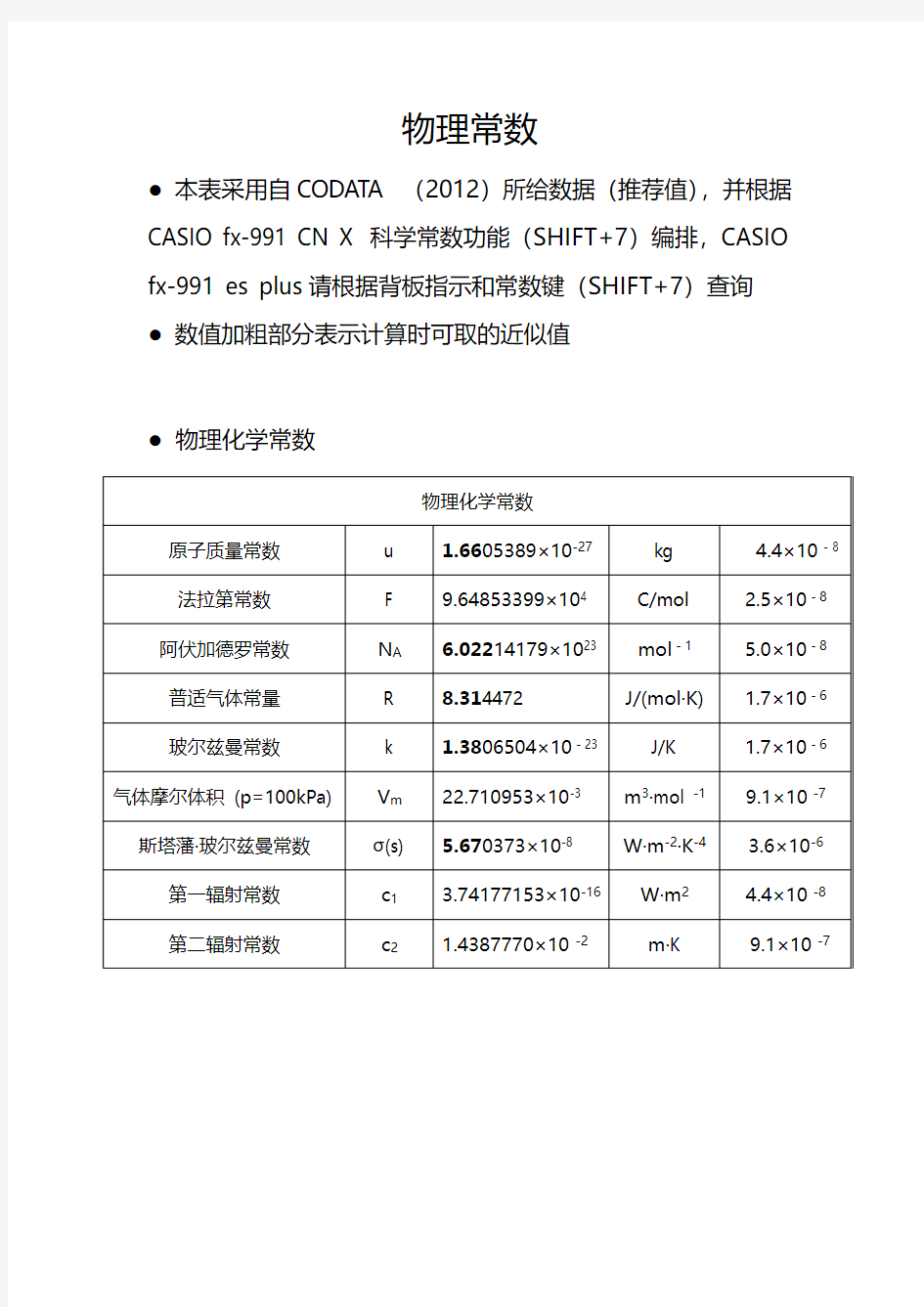
物理常数
●本表采用自CODATA (2012)所给数据(推荐值),并根据CASIO fx-991 CN X 科学常数功能(SHIFT+7)编排,CASIO fx-991 es plus请根据背板指示和常数键(SHIFT+7)查询
●数值加粗部分表示计算时可取的近似值
●物理化学常数
大学物理化学实验报告---液体饱和蒸汽压的测定
纯液体饱和蒸汽压的测量 目的要求 一、 明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱 和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。 二、 用数字式真空计测量不同温度下环己烷的饱和蒸气压。初步掌握真空实验 技术。 三、 学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸 点。 实验原理 通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol 液体所吸收的热量称为该温度下液体的摩尔气化热。 液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm (101.325kPa )时,液体的沸点称为该液体的正常沸点。 液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示: 2 m vap d ln d RT H T p ?= (1) 式中,R 为摩尔气体常数;T 为热力学温度;Δvap H m 为在温度T 时纯液体的摩尔 气化热。 假定Δvap H m 与温度无关,或因温度范围较小,Δvap H m 可以近似作为常数,积分上式,得: C T R H p +??-=1 ln m vap (2) 其中C 为积分常数。由此式可以看出,以ln p 对1/T 作图,应为一直线,直线的斜率为 R H m vap ?- ,由斜率可求算液体的Δvap H m 。 静态法测定液体饱和蒸气压,是指在某一温度下,直接测量饱和蒸气压,此 法一般适用于蒸气压比较大的液体。静态法测量不同温度下纯液体饱和蒸气压,有升温法和降温法二种。本次实验采用升温法测定不同温度下纯液体的饱和蒸气压,所用仪器是纯液体饱和蒸气压测定装置,如图1所示: 平衡管由A 球和U 型管B 、C 组成。平衡管上接一冷凝管,以橡皮管与压
大学物理化学实验全集
实验六.二组分固-液体系相图的绘制 一、实验目的 (1)热分析法测绘Sn-Bi二元合金相图 (2)掌握热分析法的测量技术 (3)掌握热电偶测量温度的基本原理以及数字控温仪和升降温电炉的使用方法 二、实验原理 用几何图形来表示多相平衡体系中有哪些相,各相的成分如何,不同相的相对量是多少,以及它们随浓度、温度、压力等变量变化的关系图叫相图。以体系所含物质的组成为自变量,温度为应变量所得到的T-x图就是常见的一种相图。 绘制相图的方法很多,热分析法就是常用的一种实验方法。即按一定比例配成一两组分体系,将体系加热到熔点以上成为液态,然后使其逐渐冷却,每隔一定时间记录一次温度,以体系的温度对时间的关系曲线称为步冷曲线。熔融体系在均匀冷却过程中无相变时,其温度将连续均匀下降,得到一条平滑的冷却曲线,当冷却过程中发生相变时,放出相变热,使热损失有所抵偿,冷却曲线就会出现转折。当两组分同时析出时,冷却速度甚至变为零,冷却曲线出现水平段。转折点或平台所对应的温度,即为该组成合金的相变温度。 取一系列组成不同的二元合金,测得冷却曲线,再将相应的转折点连接起来即得到二元合金相图(如下图所示) 三、实验所用仪器、试剂 1.KWL-09可控升降温电炉,SWKY-1数字控温仪 2.编号为1-6的六个金属硬质试管依次分装:纯铋、含锡20%,42%,60%,80%的合金、纯锡。8号试管为空管。 四、实验步骤 1.安装并调整SWKY-1数字控温仪与KWL-09可控升降温电炉,将控温仪与电炉用电缆连接。2号炉膛(右侧)放8号空管,将与控温仪相连的温度传感器(传感器2)插入其中 2.1.将装有试剂的试管1放入1号炉膛(注意安全,始终用铁夹小心夹住试管),并将与电炉连接的温度传感器(传感器1)插入炉膛旁边的另一小孔中(注:不要将传感器1插入试管中)。将2号传感器插入放有8号空管的炉膛2 2.2.调节控温仪(工作/量数按钮),将电炉温度设定为350℃,再调为工作状态,此时1号炉膛开始加热。调节定时按钮,是时间显示为30s。将电炉“冷风量调节”电压调到零,“加热量调节”调到180V(电压过低加热太慢,电压过高有损仪器使用寿命),给2号炉膛预热到200度左右(避免温度下降过快,减小试管冷却时发生过冷现象的可能) 2.3.当温度显示1号炉膛温度达到350℃时,再等10min左右。待温度稳定后将预热后的8号空管用铁夹移出去,并将1号试管夹入2号炉膛。换入2号试管加热,熔融。关闭“加热量调节”,此时控温仪显示温度上升,当温度上升到310℃以上时,打开“冷风量调节”,电压调为1.5V。此时温度开始下降,当温度降到接近300℃时,开始记录温度。每隔30s,控温仪会响一声,依次记下此时的仪表读数即可。
基本物理常数
基本物理常数 是物理领域的一些普适常数,主要是指原子物理学中常用的一些常数。最基本的有真空中光速с,普朗克常数h、基本电荷e、电子静止质量m e和阿伏伽德罗常数N A 等。基本物理常数共有30多个,加上其组合量则有40~50个,它们之间有着深刻的联系,并不是彼此独立的。 基本物理常数的发现和测量,在物理学的发展中起了很大的作用。纵观近代物理学史可以看到,一些重大的物理现象的发现和物理理论的创立,常常同基本物理常数的发现或准确测定有着密切的联系。例如,电子的发现是通过对电子的荷质比e/m的测定获得的;M.普朗克建立量子论的同时,发现了普朗克常数;狭义相对论的出 发点之一就是真空中的光速不变;等等。由此可见,基本物理常数出现于许多不同的物理现象之中,每一种物理现象的规律都同一种确定的常数有关。 物理学发展到今天,形成了许多分支,如固体物理学、原子物理学、原子核物理学、粒子物理学、天体物理学等等,包括大至宇宙、小至基本粒子的广阔领域。但是物理学的这些分支都是用统一的物理理论结合在一起的,这些基本理论有经典电动力学、相对论(见狭义相对论、广义相对论)、统计力学(见统计物理学)、量子力学等。这些理论的定量预言的准确程度,依赖于在理论中出现的基本物理常数值的准确性。特别重要的是,仔细研究由物理学不同领域的实验所确定的这些常数值,能逐个考察物理学一些基本理论的一致性和正确性。由于应用了高稳定激光、约瑟夫森效应、X射线干涉术、量子霍耳效应等许多新方法,使基本物理常数测量的准确度有所提高,很多常数的测量准确度已达10-6量级,更高的可达10-8~10-10量级。常数的准确值增加一位,就会有可能发现物理学中前所未知的矛盾,或获得解决目前所存在的某个矛盾的线索。 基本物理常数的重要性还表现在定义计量单位从而建立计量基准的工作上。普朗克早在1906年就建议用基本常数来定义计量基本单位,由于当时常数的测量准确度还很低,这个愿望不能实现。60年代以来,随着常数值的准确度不断提高,上述建议就有了现实意义。如由于可同时准确测量高稳定激光波长λ和频率v,就能够通
物理化学实验报告.
《大学化学基础实验2》实验报告 课程:物理化学实验 专业:环境科学 班级: 学号: 学生姓名:邓丁 指导教师:谭蕾 实验日期:5月24日
实验一、溶解焓的测定 一、实验名称:溶解焓的测定。 二、目的要求:(1)学会用量热法测定盐类的积分溶解焓。 (2)掌握作图外推法求真实温差的方法。 三、基本原理: 盐类的溶解通常包含两个同时进行的过程:一是晶格的破坏,为吸热过程;二是离子的溶剂化,即离子的水合作用,为放热过程。溶解焓则是这两个过程热效应的总和,因此,盐类的溶解过程最终是吸热还是放热,是由这两个热效应的相应大小所决定的。影响溶解焓的主要因素有温度、压力、溶质的性质以及用量等。热平衡式: △sol H m=-[(m1C1+m2C2)+C]△TM/m2 式中, sol H m 为盐在溶液温度及浓度下的积分溶解焓, J·mol , m1 , m2 分别为水和溶质的质量, M 为溶质的摩尔质量,kg·mol -1 ;C1 ,C 2 分别为溶剂水, kg; 溶质的比热容,J·kg -1;T 为溶解过程中的真实温差,K;C 为量热计的热容, J·K- 1 ,也称热量计常数.本实验通过测定已知积分溶解焓的标准物质 KCl 的 T ,标定出量热计热容 C 的值. 四、实验主要仪器名称: NDRH-2S型溶解焓测定实验装置1套(包括数字式温度温差测量仪1台、300mL简单量热计1只、电磁搅拌器1台);250mL容量瓶1个;秒表1快;电子 ;蒸馏水 天平1台;KCl;KNO 3 五、实验步骤: (1)量热计热容 C 的测定 ( 1 ) 将仪器打开 , 预热 . 准确称量 5.147g 研磨好的 KCl , 待用 . n KCl : n水 = 1: 200 (2)在干净并干燥的量热计中准确放入 250mL 温室下的蒸馏水,然后将温度传感器的探头插入量热计的液体中.打开搅拌器开关,保持一定的搅拌速度,待温差变化基本稳定后,读取水的温度 T1 ,作为基温. (3)同时, 每隔30s就记录一次温差值,连续记录8 次后, 将称量好的 5.174g KCl 经漏斗全部迅速倒入量热计中,盖好.10s记录一次温度值,至温度基本稳定不变,再每隔 30s记录一次温度的数值,记录 8 次即可停止. (4)测出量热计中溶液的温度,记作 T2 .计算 T1 , T2 平均值,作为体系的温度.倒出溶液,取出搅拌子,用蒸馏水洗净量热计. KNO3 熔解热的测定:标准称量 3.513g KNO3 ,代替 KCl 重复上述操作.
物理化学公式大全
物理化学公式集 热力学第一定律 功:δW=δW e+δW f (1)膨胀功δW e=p外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f=xdy 非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。热Q:体系吸热为正,放热为负。 热力学第一定律:△U=Q—W 焓H=U+pV 理想气体的内能和焓只是温度的单值函数。 热容C=δQ/dT (1)等压热容:C p=δQ p/dT=(?H/?T)p (2)等容热容:C v=δQ v/dT=(?U/?T)v 常温下单原子分子:C v,m=C v,m t=3R/2 常温下双原子分子:C v,m=C v,m t+C v,m r=5R/2 等压热容与等容热容之差: (1)任意体系C p—C v=[p+(?U/?V)T](?V/?T)p (2)理想气体C p—C v=nR 理想气体绝热可逆过程方程: pVγ=常数TVγ-1=常数p1-γTγ=常数γ=C p/ C v 理想气体绝热功:W=C v(T1—T2)=(p1V1—p2V2) 理想气体多方可逆过程:W=(T1—T2) 热机效率:η=冷冻系数:β=-Q1/W 可逆制冷机冷冻系数:β=
焦汤系数:μJ-T==- 实际气体的ΔH和ΔU: ΔU=+ΔH=+ 化学反应的等压热效应与等容热效应的关系:Q p=Q V+ΔnRT 当反应进度ξ=1mol时,Δr H m=Δr U m+RT 化学反应热效应与温度的关系: 热力学第二定律 Clausius不等式: 熵函数的定义:dS=δQ R/T Boltzman熵定理:S=klnΩ Helmbolz自由能定义:F=U—TS Gibbs自由能定义:G=H-TS 热力学基本公式: (1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程: dU=TdS-pdV dH=TdS+Vdp dF=-SdT-pdV dG=-SdT+Vdp (2)Maxwell关系: ==- (3)热容与T、S、p、V的关系: C V=T C p=T Gibbs自由能与温度的关系:Gibbs-Helmholtz公式=- 单组分体系的两相平衡: (1)Clapeyron方程式:=式中x代表vap,fus,sub。 (2)Clausius-Clapeyron方程式(两相平衡中一相为气相):= (3)外压对蒸汽压的影响:p g是在惰性气体存在总压为p e时的饱和蒸汽压。
大学物理化学实验报告-络合物的磁化率的测定
物理化学实验报告 院系化学化工学院 班级化学 061 学号 13 姓名沈建明
实验名称 络合物的磁化率的测定 日期 同组者姓名 史黄亮 室温 ℃ 气压 kPa 成绩 一、目的和要求 1、掌握古埃(Gouy )法磁天平测定物质磁化率的基本原理和实验方法; 2、通过对一些络合物的磁化率测定,推算其不成对电子数,判断这些分子的配键类型 二、基本原理 物质的磁性一般可分为三种: 顺磁性, 反磁性和铁磁性。 a .反磁性是指磁化方向和外磁场方向相反时所产生的磁效应。反磁物质的χD < 0(电子的拉摩进动产生一个与外磁场方向相反的诱导磁矩,导致物质具有反磁性)。 b. 顺磁性是指磁化方向和外磁场方向相同时所产生的磁效应,顺磁物质的 Xp > 0。(外磁场作用下,粒子如原子、分子、离子,中固有磁矩产生的磁效应)。 c. 铁磁性是指在低外磁场中就能达到饱和磁化,去掉外磁场时,磁性并不消失,呈现出滞后现象等一些特殊的磁效应。 d. 摩尔磁化率: 古埃法测定物质的摩尔磁化率( )的原理 通过测定物质在不均匀磁场中受到的力,求出物质的磁化率 。 把样品装于园形样品管中,悬于两磁极中间,一端位于磁极间磁场强度最大区域 H ,而另一端位于磁场强度很弱的区域 H 0,则样品在沿样品管方向所受的力F 可表示为: M χH F mH Z χ?=?P P D M χχχχ≈+=
其中:m 为样品质量,H 为磁场强度, 为沿样品管方向的磁场梯度。 本实验用摩尔氏盐(六水合硫酸亚铁铵)标定外磁场强度H 。测定亚铁氰化钾 和硫酸亚铁的摩尔磁化率,求金属离子的磁矩并考察电子配对状况。 三、仪器、试剂 MB-1A 磁天平(包括电磁铁,电光天平,励磁电源) 1套 软质玻璃样品管 1只 角匙 1只 漏斗 1只 莫尔氏盐(NH 4)2SO 4·FeSO 4·6H 2O (分析纯) FeSO 4·7H 2O (分析纯) K 4Fe(CN)6·3H 2O (分析纯) 四、实验步骤 1. 磁场强度(H )的测定 : 用已知摩尔磁化率的莫尔氏盐标定某一固定励磁电流时的磁场强度(H ).励磁电流变化0A →3A →→4A →→3A →0A ,分别测定励磁电流在各值下的天平的读数(4A 的值可以不读,持续2分钟左右,消磁),用同一仪器在同等条件下进行后续的测定。 具体操作如下: (1)把样品管悬于磁场的中心位置,测定空管在加励磁电流前,后磁场中的重 量。求出空管在加磁场前,后的重量变化管 ,重复测定三次读数,取平均值。 (2)把已经研细的莫尔氏盐通过小漏斗装入样品管,样品高度约为8m (此时样 品另一端位于磁场强度H=0处)。读出样品的高度,要注意样品研磨细小,装样均匀不能有断层。测定莫尔氏盐在加励磁电流前,后磁场中的重量。求出在加磁场前后的重量变化样品+管,重复测定三次读数,取平均值。 2.样品的莫尔磁化率测定: 把测定过莫尔氏盐的试管擦洗干净,把待测样品 ,分别装在样品管中,按着上述步骤(1) ,(2)分别测定在加磁场前,后的重量。求出重量的变化(管和样品+管),重复测定三次读数,取 H Z ??[]462()3K Fe CN H O ?4 2 7FeSO H O ?
物理化学试验-华南理工大学
物理化学实验Ⅰ 课程名称:物理化学实验Ⅰ 英文名称:Experiments in Physical Chemistry 课程代码:147012 学分:0.5 课程总学时:16 实验学时:16 (其中,上机学时:0) 课程性质:?必修□选修 是否独立设课:?是□否 课程类别:?基础实验□专业基础实验□专业领域实验 含有综合性、设计性实验:?是□否 面向专业:高分子材料科学与工程、材料科学与工程(无机非金属材料科学与工程、材料化学) 先修课程:物理、物理化学、无机化学实验、有机化学实验、分析化学实验等课程。 大纲编制人:课程负责人张震实验室负责人刘仕文 一、教学信息 教学的目标与任务: 该课程是本专业的一门重要的基础课程,物理化学实验的特点是利用物理方法来研究化学系统变化规律,是从事本专业相关工作必须掌握的基本技术课程。其任务是通过本课程的学习,使学生达到以下三方面的训练: (1)通过实验加深学生对物理化学原理的认识,培养学生理论联系实际的能力; (2)使学生学会常用的物理化学实验方法和测试技术,提高学生的实验操作能力和独立工作能力; (3)培养学生查阅手册、处理实验数据和撰写实验报告的能力,使学生受到初步的物理性质研究方法的训练。 教学基本要求: 物理化学实验的特点是利用物理方法来研究化学系统变化规律,实验中常用多种物理测量仪器。因此在物理化学实验教学中,应注意基本测量技术的训练及初步培养学生选择和配套仪器进行实验研究工作的能力。 物理化学实验包括下列内容: (1)热力学部分量热、相平衡和化学平衡实验是这部分的基本内容。还可以选择稀溶液的依数性、溶液组分的活度系数或热分析等方面的实验。
基本物理常数与计量基本单位
收稿日期:2002-12-27. 基金项目:湖北省教育厅2002年度重点项目(B 类). 作者简介:杨建平(1964-),女,副教授,主要从事物理学史的研究. 基本物理常数与计量基本单位 杨建平 (湖北民族学院物理系,湖北恩施445000) 摘要:基本物理常数的发现和测量,不仅在物理学的发展中起到了很大的作用,而且在计量学的发展上也起到 了重要的作用.设法把计量单位的定义与基本物理常数相联系,详细分析了长度单位、电压单位、电阻单位以 及质量单位与基本物理常数的关系.由于基本物理常数是不会变化的,因此这样定义的计量单位极为稳定,不 会随着时间而发生漂移. 关键词:基本物理常数;计量基准;单位制 中图分类号:04-34文献标识:A 文章编号:1008-8423(2003)02-0069-03 基本物理常数是指那些在物理学中起着基本而广泛作用的普适常数.如真空中的光速c 、普朗克常数1、基本电荷量e 、阿伏伽德罗常数N A 以及许多有关微观粒子的常数等等.基本物理常数的发现和测量,不仅在物理学的发展中起到了很大的作用,而且在计量学的发展上也起到了重要的作用.普朗克早在20世纪初就 建议用基本物理常数来定义物理量的基本单位,也就是计量基本单位.但由于当时的测量准确度还很低, 这个愿望未能实现.20世纪50年代以前,计量基准的量值一般是由实物基准所保存及复现的.这种实物基准一般是根据经典物理学的原理,用某种特别稳定的实物来实现,而且总是用工业界所能提供的最好的材料及工艺制成,以保证其稳定性. 实物基准及相应的计量量值传递检定系统给产业界提供了计量服务,确实在帮助产业界提升产品品质的工作中作出了贡献.但是,随着科技及工农业的发展,这样的传统计量量值传递检定系统开始反映出一些不足:实物基准一旦做成,总会有一些不易控制的物理、化学过程使它的特性发生缓慢的变化,因而它所保存的量值也会有所改变;最高等级的实物计量基准全世界只有一个或一套,一旦因为某种意外原因而损坏,就无法完全一模一样地复制出来,原来连续保存的单位量值也会因之中断;量值传递检定系统庞大复杂,从最高等级的实物基准到具体应用场所,量值要经过多次传递,准确度也必然会有所下降.为了解决这些问题,人们就要寻找那些不依赖于某一具体实物具体特性的计量基准,从而诞生了量子计量基准.量子计量基准基于量子物理学中阐明的微观粒子的运动规律,特别是微观粒子的态和能级的概念.按照量子物理学,宏观物体中的微观粒子如果处于相同的微观态,其能量有相同的确定值,也就是处于同一能级上.当粒子在不同能级之间发生量子跃迁时,将伴随着吸收或发射能量等于能级差!E 的电磁波能量子,即光子.而且,电磁波频率 !与!E 之间满足普朗克公式, 而比例系数为普朗克常数1.也就是说,电磁波的频率反映了能级差的数量.另一方面,宏观物体中基本粒子的能级结构与物体的宏观参数,如形状、体积、质量等并无明显关系.因此,即使物体的宏观参数随时间发生了缓慢变化,也不会影响物体中微观粒子的量子跃迁过程.这样,利用量子跃迁现象来复现计量单位,就可以从原则上消除各种宏观参数不稳定产生的影响,所复现的计量单位不再发生缓慢漂移,计量基准的稳定性和准确度可以达到空前的提高.而且量子跃迁复现计量单位不受时间、地点的限制.现在,把此类用量子现象复现量值的计量基准统称为量子计量基准,而量子计量基准中,又依赖于一些基本物理常数.20世纪80年代开始,随着基本物理常数准确度的不断提高,长度单位、电学量电压和电阻单第21卷第2期 2003年6月湖北民族学院学报(自然科学版)JournaI of Hubei Institute for NationaIities (NaturaI Science Edition )VoI.21No.2Jun.2003
物理化学主要公式
物理化学主要公式 第一章 气体的pVT 关系 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 / y B m,B B * =V ?∑* A V y A m,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩尔体积。∑*A A m,A V y 为 在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上述各式适用于任意的 气体混合物。 (3) V V p p n n y ///B B B B * === 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律
p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 4. 阿马加分体积定律 V RT n V /B B =* 此式只适用于理想气体。 5. 范德华方程 RT b V V a p =-+))(/(m 2m nRT nb V V an p =-+))(/(22 式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。 此式适用于最高压力为几个MPa 的中压范围内实际气体p ,V ,T ,n 的相互计算。 6. 维里方程 ......)///1(3m 2m m m ++++=V D V C V B RT pV 及 ......)1(3'2''m ++++=p D p C p B RT pV 上式中的B ,C ,D,…..及B‘,C‘,D‘….分别称为第二、第三、第四…维里系数,它们皆是与气体种类、温度有关的物理量。 适用的最高压力为1MPa 至2MPa ,高压下仍不能使用。 7. 压缩因子的定义 )/()/(m RT pV nRT pV Z == Z 的量纲为一。压缩因子图可用于查找在任意条件下实际气体的压缩因子。但计算结果常产生较大的误差,只适用于近似计算。 第二章 热力学第一定律 1. 热力学第一定律的数学表示式
物理化学实验报告-BZ振荡反应
物理化学实验报告 BZ 振荡反应 1.实验报告 (1)了解BZ 反应的基本原理。 (2)观察化学振荡现象。 (3)练习用微机处理实验数据和作图。 2. 实验原理 化学振荡:反应系统中某些物理量随时间作周期性的变化。 BZ 体系是指由溴酸盐,有机物在酸性介质中,在有(或无)金属离子催化剂作用下构成的体系。有苏联科学家Belousov 发现,后经Zhabotinski 发现而得名。 本实验以 +4 ~ CH 2(COOH)2 ~ H 2SO 4作为反映体系。该体系的总反应为: 体系中存在着下面的反应过程。 过程A : 2 3 过程B : 4 5 6 Br - 的再生过程: 当[Br - ]足够高时,主要发生过程A ,2反应是速率控制步骤。研究表明,当达到准定态 当[Br -]低时,发生过程B ,Ce +3 被氧化。4反应是速率控制步骤。4.5反应将自催化产生HBrO 2
可以看出:Br - 和 HbrO 2的。当K 3 [Br - ]>K 4时,自催化过程不可能发生。自催化是BZ 振荡反应中必不可少的步骤,否则该振荡不能发生。研究表明,Br - 的临界浓度为: 若已知实验的初始浓度,可由上式估算[Br - ]crit 。 体系中存在着两个受溴离子浓度控制的过程A 和过程B ,当[Br - ]高于临界浓度[Br - ]crit 时发生过程A ,当[Br - ]低于[Br -]crit 时发生过程B 。[Br - ]起着开关的作用,他控制着A,B 之间的变化。这样体系就在过程A 、过程B 间往复振荡。 在反应进行时,系统中[Br - ]、[HbrO 2]、[Ce +3 ]、[Ce +4 ]都随时间作周期性的变化,实验中,可以用溴离子选择电极测定[Br - ],用铂丝电极测定[Ce +4 ]、[Ce +3 ]随时间变化的曲线。溶液的颜色在黄色和无色之间振荡,若再加入适量的FeSO 4邻菲咯啉溶液,溶液的颜色将在蓝色和红色之间振荡。 从加入硫酸铈铵到开始振荡的时间为t 诱 ,诱导期与反应速率成反比。 即 并得到 本实验使用的BZ 反应数据采集接口系统,并与微型计算机相连。通过接口系统测定电极的电势信号,经通讯口传送到PC 。自动采集处理数据。 3.实验仪器与试剂 BZ 反应数据采集接口系统 恒温槽 溴酸钾0.25 mol ·dm -3 磁力搅拌器 硫酸3.00 mol ·dm -3 丙二酸0.45mol ·dm -3 硫酸铈铵4×10-3 mol ·dm -3 微型计算机 反应器 4.实验步骤
大学物理化学实验汇总
实验一 电导的测定及其应用 一、实验目的 1、 测量氯化钾水溶液的电导率,求算它的无限稀释摩尔电导率。 2、 用电导率测量醋酸在水溶液中的解平衡常数。 3、 掌握恒温水槽及电导率仪的使用方法。 二、实验原理 1、根据电导公式:G=kA/l 式中k 为该电解质溶液目的电导率,其中 l/A 称为电导池常数,由于l 与A 不易精确测量,因此,试验中就是用一种已知电导率的溶液求出电导池常数k cell ,然后把欲测的溶液放入该电导池测出其电导值,再根据公式G=kA/l 求出摩尔电导率 , k 与 的关系为: 2、 总就是随着溶液的浓度的降低而增大的, 对于强电解质系 对于特定的电解质与溶剂来说,在一定温度下,A 就是一个常数,所以将 作图得到一 条直线,将所得的直线推至c=0可求得A m ∞。 3、对于弱电解质,其 无法用 ,由离子独立运动定律: 求得,其中 A m ∞+ 与A m ∞-分别表示正、负离子的无限稀摩尔电导率,它与温度及离子的本性有关。在无限稀的弱电解质中: 以cAm 对 作图,根据其斜率求出K 、、 三、实验仪器及试剂 仪器:梅特勒326电导仪1台,量杯50ml 2只 ,移液管125ml 9只,洗瓶1只 ,洗耳球1只。 试剂:10、00mol/m3 KCl 溶液, 100、0 mol/m3HAC 溶液 , 电导水。 四、实验步骤 1、 打开电导率仪器开关,预热5分钟。 2、 KCl 溶液电导率的测定: (1) 用移液管准确移取25ml 10、00mol/m3的KCl 溶液,置于洁净、干燥的量杯中,测定器电 导率3次,取其平均值。 (2) 再用移液管准确量取25、00ml 电导水,置于上述量杯中,搅拌均匀后,测定器电导率3 次,取其平均值。 m c κ = Λ m m,+ m, νν+--∞ ∞ ∞ =+ΛΛΛ m Λ m Λ m Λ m m ∞ =-ΛΛ m Λ m m ∞ =-ΛΛ m m = α∞ΛΛ() 2 m m m m 2 m m m m 1c c c K c c ∞∞ ∞∞?? ??-?=-=ΛΛΛΛΛΛΛΛΛ
初中物理基本单位、基本公式、基本常数大全
初中物理公式 物理量计算公式备注 速度v= s / t 1m / s = 3.6 Km / h 声速v= 340m / 光速C = 3×10^8 m /s 密度ρ= m / V 1 g / cm^3 = 103 Kg / m 合力 F = F1 - F2 (F1、F2在同一直线线上且方向相反) F = F1 + F2 (F1、F2在同一直线线上且方向相同 ) 压强 p = F / S 适用于固、液、气 p =ρg h 适用于竖直固体柱和液体 浮力①F浮= G – F ②漂浮、悬浮:F浮= G ③F浮= G排=ρ液g V排 物体浮沉条件 ①F浮>G(ρ液>ρ物)上浮至漂 浮 ②F浮=G(ρ液=ρ物)悬浮 ③F浮<G(ρ液<ρ物)下沉杠杆平衡条件F1 *L1 = F2 *L 2 杠杆平衡条件也叫杠杆原理 滑轮组 F = G / n ( 理想滑轮组) F =(G动+ G物)/ n (忽略轮轴间的摩擦) η=G/ nF(实际情况n:作用在动滑轮上绳子股数) 功W = F S = P t 1J = 1N?m = 1W?s 功率P = W / t = Fv 1KW = 10^3 W,1MW = 10^3KW 有用功W有用= G h(竖直提升)= F S(水平移动)= W总– W额=ηW总额外功W额= W总– W有= G动h(忽略轮轴间摩擦)= f L(斜面) 总功W总= W有用+ W额= F S = W有用/ η 机械效率η= W有用/ W总 热量Q=cm(t-t°) 电流I=U/R 电功W=UIt =Pt 电功率P=W/t=UI =I2R=U2/R 串联电路I=I1=I2 电流处处相等 U = U 1+ U 2 干路电压等于各支路电压之和 R=R1+R2 总电阻等于的电阻之和
大学物理化学实验思考题答案总结
蔗糖水解速率常数的测定 1.蔗糖水解反应速率常数和哪些因素有关? 答:主要和温度、反应物浓度和作为催化剂的H+浓度有关。 2.在测量蔗糖转化速率常数时,选用长的旋光管好?还是短的旋光管好? 答:选用长的旋光管好。旋光度和旋光管长度呈正比。对于旋光能力较弱或者较稀的溶液,为了提高准确度,降低读数的相对误差,应选用较长的旋光管。根据公式(a)=a*1000/LC,在其他条件不变的情况下,L越长,a越大,则a的相对测量误差越小。 3.如何根据蔗糖、葡萄糖、果糖的比旋光度数据计算? 答:α0=〔α蔗糖〕Dt℃L[蔗糖]0/100 α∞=〔α葡萄糖〕Dt℃L[葡萄糖]∞/100+〔α果糖〕Dt℃L[果糖]∞/100 式中:[α蔗糖]Dt℃,[α葡萄糖]Dt℃,[α果糖]Dt℃分别表示用钠黄光作光源在t℃时蔗糖、葡萄糖和果糖的比旋光度,L(用dm表示)为旋光管的长度,[蔗糖]0为反应液中蔗糖的初始浓度,[葡萄糖]∞和[果糖]∞表示葡萄糖和果糖在反应完成时的浓度。 设t=20℃L=2 dm [蔗糖]0=10g/100mL 则: α0=66.6×2×10/100=13.32° α∞=×2×10/100×(52.2-91.9)=-3.94° 4.试估计本实验的误差,怎样减少误差? 答:本实验的误差主要是蔗糖反应在整个实验过程中不恒温。在混合蔗糖溶液和盐酸时,尤其在测定旋光度时,温度已不再是测量温度,可以改用带有恒温实施的旋光仪,保证实验在恒温下进行,在本实验条件下,测定时要力求动作迅速熟练。其他误差主要是用旋光仪测定时的读数误差,调节明暗度判断终点的误差,移取反应物时的体积误差,计时误差等等,这些都由主观因素决定,可通过认真预习实验,实验过程中严格进行操作来避免。 乙酸乙酯皂化反应速率常数测定 电导的测定及其应用 1、本实验为何要测水的电导率? 答:因为普通蒸馏水中常溶有CO2和氨等杂质而存在一定电导,故实验所测的电导值是欲测电解质和水的电导的总和。作电导实验时需纯度较高的水,称为电导水。水的电导率相对弱电解质的电导率来说是不能够忽略的。所以要测水的电导率。 2、实验中为何通常用镀铂黑电极?铂黑电极使用时应注意什么?为什么?
物理化学公式及概念
物理化学公式及概念 一、气体 2211 1., , 33 p mnu pV mNu u u === 为根均方速率, 2.,(B B A R pV nRT Nk T k N == = 理想气体状态方程:玻尔兹曼常数) 123.Dalton i i p p p p x p =++= 道尔顿()分压定律:……;分压:在同一温度下,各别气体单独存在,并占有与混合气体相同体积时的压力 ,33 4., , 22t t m B E k T E RT u === 2 1.5 *2 245.()2mv kT m Maxwell f v e v kT -?? = ?π??麦克斯韦()速率分布定律: 06.()ln p Mgh Boltzmann p RT =-玻尔兹曼分布: 7.A B v v = 气体扩散定律:()()228.), m m m a a van der Waals p V b RT p V nb nRT V V ???? +-=+-= ? ?????范德华(方程: 二、热力学第一定律 1. 隔离系统(孤立系统)、封闭系统、敞开系统 2. 广度性质、强度性质 3. 热动平衡、力学平衡、相平衡、化学平衡 4. 等温过程、等压过程、等容过程、绝热过程、环状过程 5.W p dV δ=-体外体积功: 6.,U Q W dU Q W ?=+=δ+δ 7. 功与过程、准静态过程、可逆过程 8.,p def H U PV H Q +?= 焓:
,,9.,,,p m v m p v p v p v p v C C R C C nR Q Q H U C C dT T dT T δδ -=-=???? ??= === ? ???????热容: 112211 2110.() , () 1 p v v C pV TV p T C p V p V W C T T W γγγγγγ--= ===-==-= -理想气体绝热可逆过程方程和做功: 热容商或绝热指数常数常数常数 2 2 11 ,,11.T T p m v m T T H nC dT U nC dT ?=?=??理想气体任意过程: 12.1c h T T η =- 热机效率: 13.p v r r Q Q nRT H U nRT =+??=?+?化学反应的热效应:或 14.() (0), D E n n B B B D E def d d n n d ξξνξξνν += = 反应进度:…… 15.o o o r B r r m H H H n νξ?? ?== ??标准摩尔焓变: 16.()Hess 盖斯定律 17.o o o r m c m sol m H H H ???几种热效应:标准摩尔生成焓、标准摩尔燃烧焓、标准摩尔溶解热 2 1 21,18. ()()(), () T o o r m r m p p B p m T B Kirchhoff H T H T C dT C C B ν?=?+? ?=∑?基尔霍夫定律: ,19.o r m p H T C ? = ∑生成物和剩余物 绝热反应:反应释放的热量全部用于提高生成物和多余物的温度, 三、热力学第二定律 1.S ?熵是状态函数,当始态终态一定时,有定值,它的数值可由可逆过程的热温商求得 2. 0 iso sys sur dS S S =?+?≥ 213. () (R R Q dS Q TdS T S S T δ= ==-?、等温过程) max 21124. ln ln R W Q V p S nR nR T T V p -?= ===理想气体等温可逆变化:
大学物理化学实验报告
年月日评定: 姓名:学号: 年级:专业: 室温:大气压: 一、实验名称:BET容量法测定固体的比表面积 二、实验目的: 三、实验原理: 四、实验数据及处理: 五、讨论思考: 1. 氮气及氢气在该实验中的作用是什么? 2. 若用Langmuir方法处理测量得到的数据,样品的比表面偏大还是偏 小?
年月日评定:姓名:学号: 年级:专业: 室温:大气压: 一、实验名称:恒温水浴的组装及其性能测试 二、实验目的: 三、实验原理: 四、实验数据及处理: 请完成下表: 表1 恒温槽灵敏度测量数据记录
五、作图: 以时间为横坐标,温度为纵坐标,绘制25℃和30℃的温度—时间曲线,求算恒温槽的灵敏度,并对恒温槽的性能进行评价。 六、讨论思考: 1. 影响恒温槽灵敏度的主要因素有哪些,试作简要分析? 2. 欲提高恒温槽的控温精度,应采取哪些措施?
年月日评定: 姓名:学号: 年级:专业: 室温:大气压: 一、实验名称:最大泡压法测定溶液的表面张力 二、实验目的: 三、实验原理: 四、实验数据及处理 1.以纯水的测量结果计算仪器毛细管常数K′,纯水的表面张力σ查书附录。 ?p1=?p2=?p3= 平均值:?p=K′=σ /?p 2.计算各溶液的σ值(K′=σ /?h) 表1 各溶液的表面张力σ c/mol· L-1 σ /N·m-1 3.做σ-c图,并在曲线上取十个点,分别做出切线,求得对应的斜率(dσ -d c)r,求算各浓度的吸附量Γ,附图。
表2 各溶液的吸附量 4. 做(c /Γ)-c 图,由直线斜率求其饱和吸附量∞Γ,并计算乙醇分子的横 截面积σB ,附图。 表3 c /~c 数据表 斜率= ,∞Γ= , σB =1/∞ΓL = 五、讨论思考: 1. 与文献值(见书中附录)对照,检验你的测定结果,并分析原因。 2. 增(减)压速率过快,对测量结果有何影响?表面张力测定仪的清洁与 否和温度之不恒定对测量结果有何影响?
物理化学专业术语
爆炸界限explosion limits 霍根-华森图Hougen-Watson Chart 德拜和法尔肯哈根效应Debye and Falkenhagen effect 德拜-休克尔极限公式Debye-Huckel’s limiting equation 德拜立方公式Debye cubic formula 聚沉值coagulation value 聚沉coagulation 聚(合)电解质polyelectrolyte 精馏rectify 键焓bond enthalpy 触变thixotropy 解离化学吸附dissociation chemical adsorption 简并度degeneracy 感胶离子序lyotropic series 催化剂catalyst 隔离法the isolation method 隔离系统isolated system 道尔顿定律Dalton law 道尔顿分压定律Dalton partial pressure law 超电势over potential 缔合化学吸附association chemical adsorption 等温等容位Helmholtz free energy 等温等压位Gibbs free energy 等温方程equation at constant temperature 等焓线isenthalpic line 等焓过程isenthalpic process 等几率定理theorem of equal probability 焦耳定律Joule's law 焦耳-汤姆生效应Joule-Thomson effect 焦耳-汤姆生实验Joule-Thomson experiment 焦耳-汤姆生系数Joule-Thomson coefficient 焦耳Joule 敞开系统open system 菲克扩散第一定律Fick’s first law of diffusion 粗分散系统thick disperse system 第三定律熵third-law entropy 第二类永动机perpetual machine of the second kind 第一类永动机perpetual machine of the first kind 盖斯定律Hess law 盖·吕萨克定律Gay-Lussac law s9 焓enthalpy 混合熵entropy of mixing 混合物mixture 接触角contact angle
大学物理化学实验报告-原电池电动势的测定.docx
大学物理化学实验报告-原电池电动势的测 定 篇一:原电池电动势的测定实验报告_浙江大学 (1) 实验报告 课程名称:大学化学实验p实验类型:中级化学实验实验项目名称:原电池电动势的测定 同组学生姓名:无指导老师冷文华 一、实验目的和要求(必填)二、实验内容和原理(必填)三、实验材料与试剂(必填)四、实验器材与仪器(必填)五、操作方法和实验步骤(必填)六、实验数据记录和处理七、实验结果与分析(必填)八、讨论、心得 一、实验目的和要求 用补偿法测量原电池电动势,并用数学方法分析二、实验原理: 补偿法测电源电动势的原理: 必须严格控制电流在接近于零的情况下来测定电池的电动势,因为有电流通过电极时,极化作用的存在将无法测得可逆电动势。 为此,可用一个方向相反但数值相同的电动势对抗待测电池的电动势,使电路中没有电流通过,这时测得的两级的电势差就等于该电池的电动势e。 如图所示,电位差计就是根据补偿法原理的,它由工作电流回路、标准回路和测量电极回路组成。 ① 工作电流电路:首先调节可变电阻rp,使均匀划线ab上有一定的电势降。 ② 标准回路:将变换开关sw合向es,对工作电流进行标定。借助调节rp 使得ig=0来实现es=uca。③ 测量回路:sw扳回ex,调节电势测量旋钮,直到ig=0。读出ex。 uj-25高电势直流电位差计: 1、转换开关旋钮:相当于上图中sw,指在n处,即sw接通en,指在x1,即接通未知电池ex。 2、电计按钮:原理图中的k。 3、工作电流调节旋钮:粗、中、细、微旋钮相当于原理图中的可变电阻rp。
-1-2-3-4-5-6 4、电势测量旋钮:中间6只旋钮,×10,×10,×10,×10,×10,×10,被测电动势由此 示出。 三、仪器与试剂: 仪器:电位差计一台,惠斯登标准电池一只,工作电源,饱和甘汞电池一支,银—氯化银电极一支,100ml容量瓶5个,50ml滴定管一支,恒温槽一套,饱和氯化钾盐桥。 -1 试剂:0.200mol·lkcl溶液 四、实验步骤: 1、配制溶液。 -1-1-1-1 将0.200 mol·l的kcl溶液分别稀释成0.0100 mol·l,0.0300 mol·l,0.0500 mol·l,0.0700 -1-1 mol·l,0.0900 mol·l各100ml。 2、根据补偿法原理连接电路,恒温槽恒温至25℃。 3、将转换开关拨至n处,调节工作电流调节旋钮粗。中、细,依次按下电计旋钮粗、细,直至检流计 示数为零。 4、连好待测电池,hg |hg2cl2,kcl(饱和)‖kcl(c)|agcl |ag 5、将转换开关拨至x1位置,从大到小旋转测量旋钮,按下电计按钮,直至检流计示数为零为止,6个 小窗口的读数即为待测电极的电动势。 -1-1-1-1 6、改变电极中c依次为0.0100 mol·l,0.0300 mol·l,0.0500 mol·l,0.0700 mol·l,0.0900 -1 mol·l,测各不同浓度下的电极电势ex。
