上半年中国11类新药研发进展

2014上半年中国1.1类新药研发进展
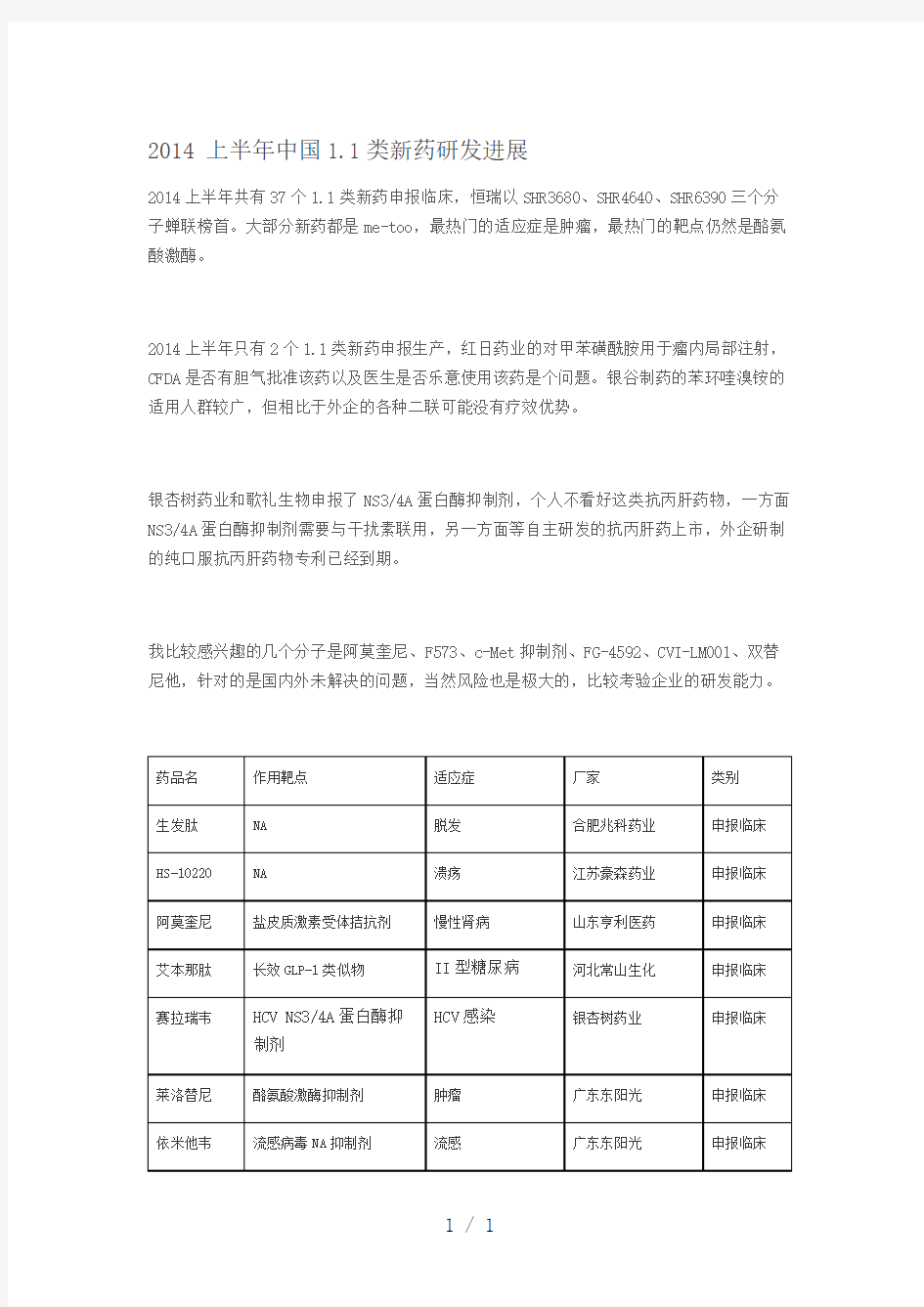
2014上半年共有37个1.1类新药申报临床,恒瑞以SHR3680、SHR4640、SHR6390三个分子蝉联榜首。大部分新药都是me-too,最热门的适应症是肿瘤,最热门的靶点仍然是酪氨酸激酶。
2014上半年只有2个1.1类新药申报生产,红日药业的对甲苯磺酰胺用于瘤内局部注射,CFDA是否有胆气批准该药以及医生是否乐意使用该药是个问题。银谷制药的苯环喹溴铵的适用人群较广,但相比于外企的各种二联可能没有疗效优势。
银杏树药业和歌礼生物申报了NS3/4A蛋白酶抑制剂,个人不看好这类抗丙肝药物,一方面NS3/4A蛋白酶抑制剂需要与干扰素联用,另一方面等自主研发的抗丙肝药上市,外企研制的纯口服抗丙肝药物专利已经到期。
我比较感兴趣的几个分子是阿莫奎尼、F573、c-Met抑制剂、FG-4592、CVI-LM001、双替尼他,针对的是国内外未解决的问题,当然风险也是极大的,比较考验企业的研发能力。
(本资料素材和资料部分来自网络,仅供参考。请预览后才下载,期待您的好评与关注!)
药物化学-赵炜新药研发的新思路和新技术
南开大学现代远程教育学院考试卷 《药物化学》 主讲教师:赵炜 一、请同学们在下列(10)题目中任选一题,写成期末论文。 1、抗肿瘤化学药的研究进展 2、抗生素使用中的前景和存在的风险 3、代谢拮抗原理在新药研发中的应用 4、抗病毒药的研究进展和存在的问题 5、论安全用药 6、COX-2选择性抑制剂在临床和临床前的研究现状 7、广泛应用于临床的心血管系统药物综述 8、新药研发的新思路和新技术 9、口服降糖药的种类和代表性药物 10、新型奎诺酮类抗菌药的临床用途和存在的风险 新药研发的新思路和新技术 前言:近5年来,我国创新药研发有了很大程度的提升,尤其是2018年,国内化药、生物药等创新药申报出现了大幅度的增加,2018年申报的生物创新药相比2017年涨幅达到了126.7%。实,我国对“新药”的定义经历了多次变革。“新药”的定义从1985年“我国未生产过的药品”,到2002年“未曾在中国境内上市销售的药品”,再到2015年才终于确定为“未在中国境内外上市销售的药品”,新药从那个“中国新”大到“全球新”的转变,整整摸索了30年。本文主要探讨目前新药研发的一些新技术与新思路。 一、新药研发的意义 新药代表着制药工业的科研和生产技术水平。新药的发展直接影响着防病治病的质量和进程。一种有效的好的新药诞生,不仅标志着国家制药工业的发展水
平,而且能根本改变某种疾病的治疗状况。如1935年磺胺药的问世大大提高了化学治疗水平;1940年青霉素的应用,改变了细菌严重感染疾病的治疗进程;1944年以后,链霉素、对氨基水杨酸、异烟肼的相继发现,开始了结核病治疗的新时期;消毒药、麻醉药的发现,改变了外科手术的整体面貌等。这一切都和新药紧紧相连。可以说,新药是人们防病治病、康复保健药品中最具活力的部分,是企业求得生存和发展的必备条件;新药的研究开发也是药品进入国际市场、促进我国药学事业发展的需要。因此,世界各国花费大量的人力、物力、财力积极研究争相开发新药。 二、新药研发的新思路与新技术 (一)合成生物学技术 CAR-T (CAR代表嵌合抗原受体,T代表T细胞)细胞治疗是癌症免疫治疗兴趣的主要驱动因素之一。这是一种基于细胞的治疗方法,从病人身上提取T细胞,然后对其进行改造,使其具有特定的受体,帮助其识别和攻击癌症。嵌合抗原受体通过融合一个识别癌症的靶结合域和一个激活域来工作,激活域使T细胞进入攻击癌症的模式。然后在实验室中培育出大量这种经过修饰的细胞,并将它们送回病人体内。第一个CAR-T疗法在2017年被FDA批准,还有更多的药物正在临床试验中。 合成生物学有潜力为改善CAR-T细胞疗法等免疫疗法提供工具,从而帮助更多的患者。目前CAR-T仍存在许多潜在的挑战,包括攻击非癌细胞所产生的毒性、可导致"克隆逃逸"的癌细胞多样性、将正确剂量的CAR-T注入病人体内、T细胞免疫抑制(关闭)和T细胞凋亡(细胞死亡)。受体工程新型受体可以用来检测不同类型的分子,并开启细胞的某些输出功能。受体越容易被设计,就有越多的分子
新药研发基本流程图
新药研发基本流程 概述近年来,由于国家政策的支持,我国的生物医药产业正在成为发展最活跃的产业,医药研发进展可谓日新月异。鉴于药监局的监管政策在不断更新,从事医药研发的企业和人员越来越多。考虑到从事医药研发的新人的增加,有必要将新药研发的基本流程做一个简单梳理。现代药物的概念除了我们传统意义上的小分子化合物(如阿司匹林,青蒿素),还包括多肽、蛋白质和抗体,(寡)核苷酸,小分子—抗体复合物,还有疫苗。下面以传统的小分子化合物药为例,就新药(主要以1.1类创新药为例)研发从无到有,到最后上市的基本流程做一个概述。 新药的发现(Drug Discovery) 1.药物作用靶点(target)以及生物标记(biomarker)的选择与确认 早期人们对药物作用靶标认识有限,往往只知道有效,但不知如何起效。比如,百年来,人们知道阿司匹林(aspirin)具有解热、消炎、
止痛、抗血栓,甚至抗癌作用。直到1971年,英国人John R. Vane 在《Nature》期刊发文才阐明了Aspirin作用机理为抑制前列腺素合成,并于1982荣获Nobel生理和医学奖。现代生物医学的研究进展,以及人类基因图谱的建立,让人类对疾病的机理了解更加准确,为新药开发提供了明确的方向、具体的靶标。 2.先导化合物(lead compound)的确定 一旦选定了药物作用的靶标,药物化学家(medicinal chemist)首先要找到一个对该靶标有作用的化合物。这个化合物可以来自天然产物(动物、植物、海洋生物);也可以是根据靶标的空间结构,计算机模拟设计、合成的化合物;还可以根据文献报道或以前其它项目的研究发现。比如,某一类化合物具有作用于该靶标的药理活性或副反应等等。治疗勃起障碍的药物Viagra就是由其副作用开发而成。目前我们常用的方法是跟踪国外研发机构对某一靶标的药物开发,以他们的化合物作为先导,希望设计出更优秀的化合物。 3.构效关系的研究与活性化合物的筛选 围绕先导化合物,设计并合成大量新化合物,通过对所合成化合物活性数据与化合物结构的构效关系分析,进一步有效的指导后续的化合物结构优化和修饰,以期得到活性更好的化合物。 4.候选药物(candidate)的选定 通过构效关系研究,几轮优化所有筛选出来的满足基本生物活性的最优化合物,一般就选作为候选药物,进入开发。此时,从事新药发现的药物化学家工作暂告结束。
浅谈生物技术药物的研究进展及趋势
龙源期刊网 https://www.360docs.net/doc/274229076.html, 浅谈生物技术药物的研究进展及趋势 作者:代润松 来源:《新课程·中学》2017年第11期 摘要:随着科学技术水平的不断提高,生物技术药物为人类的疾病治疗与预防做出了卓 越的贡献,这也使世界各个国家高度重视生物技术药物的研究工作。为此,通过对国内外在生物技术药物的研究进展进行阐述,以此探讨生物技术药物的未来发展趋势。 关键词:生物技术;药物;研究进展;发展趋势 一、生物技术药物的研究进展 (一)国外生物技术药物的研究进展 自20世纪80年代人工胰岛素诞生以来,生物技术药物的研发进入了高速发展时期,各个国家纷纷大力开展生物技术药物的研发工作,仅在20世纪90年代中末期,美国的FDA机构就批准了三四十种生物技术药物,近些年来生物技术药物的批准种类逐年递增,在21世纪初期,所批准的药物就已高达将近80种。欧美等其他发达国家在生物技术的种类上也不断丰富。除此之外,国外还对以往生物技术药物的适应症进行了明确统计,这些生物技术药物主要包括用于血友病、血小板减少症、急性心肌炎治疗的重组血液因子,用于治疗糖尿病、生长素缺乏症、甲状腺病、低血糖的重组人激素,用于治疗贫血、皮肤病、神经性溃疡等症病的促红细胞生长因子,此外还有重组干扰素、白介素,治疗甲肝、乙肝病毒的疫苗、用于癌症治疗的单克隆抗体等。 (二)国内生物技术药物的研究进展 我国对生物技术药物研究予以了高度重视,目前我国在生物技术药物的研发成果主要包括IFN类型药物、GM-CSF药物、EPO药物、EGF药物及其衍生物、胰岛素、TNF药物、乙肝疫苗、胸苷激酶细胞制剂等诸多种类,在新型活性蛋白质突变体方面,我国相继研发出了肿瘤坏死因子突变体、神经营养因子突变体、人降钙素突变体、尿激酶突变体、重组水蛭突变体、人重组血红蛋白突变体。在融合蛋白的生物技术研发方面,我国研发出了TNF/1L-6融合蛋白、用于前列腺癌症治疗的TNF/PSP94融合蛋白、血小板单链抗体/尿激酶原融合蛋白、尿激酶/水蛭素12肽融合蛋白及用于帕金森治疗的酶氨酸转化酶/BDNF融合蛋白。在克隆天然活性物质基因药物研发方面,相继研发出鲨肝HSS、SCDI抑制因子、TGGIP抑制蛋白、SFP、AOP、蜂毒多肽等。随着生物技术药物种类的不断增长,现有的生物技术药物在主要分类上共包括单克隆抗体、激素、基因治疗剂、疫苗、细胞因子、反义药物及抗血栓因子等,特别是近些年来核酸基因药物的产品种类正在不断增加,正处于研发过程中的疫苗更高达九十几种,而处于临床试验中的反义药物种类也在不断上涨,相比于20世纪,我国在生物技术药物的研发种类上要超过以往三倍,并且仍在不断增长中。
(医疗药品)中国式新药研发模式及格局变化分析
中国式新药研发模式及格局变化分析 科贝源(北京)生物医药科技有限公司 程增江 1中国药品研发力量各阶层分析 目前中国的药品研发力量包括: 国家科研院所、民营研发机构、“海龟”团队、CRO公司、药企研究所、外企在华研发中心。 1.1国家所有的科研院所及药研力量 研究院所 包括原医药管理局体系的,医科院体系的,医工院体系的,军事医学体系的,卫生部系统的等。比如,四川抗菌素工业研究所,天津药物研究院,上海医药工业研究院,上海中药创新研究中心,卫生部北京生物制品研究所,卫生部成都生物制品研究所,卫生部兰州生物制品研究所,中国科学院成都生物研究所,中国科学院广州化学研究所,中国科学院华南植物园(原华南植物研究所),中国科学院昆明植物研究所,中国科学院上海生命科学院,中国科学院上海生物化学与细胞生物学研究所,中国科学院上海药物研究所,中国科学院植物研究所,军事医学科学院,中国医学科学院药物研究所,中国医学科学院药物植物研究所。医科院省级研究所基本仍归国家所有。 国家所有的药学院校有: 北京大学药学院、复旦大学药学院、华东理工大学药学院、山东大学药学院、沈阳药科大学、四川大学华西医学中心药学系、天津大学药物科学与技术学院、厦门大学医学院药学系、浙江大学药学院、中国药科大学、中南大学研究所、
中山大学药学院、中国医科大学药学系、第二军医大学药学院、烟台大学药学院,若干所中医药大学。 工程中心 有发改委的、教育部、科技部的:基因工程与资源药物工程研究中心、中药制药与新药开发关键技术工程研究中心、新药工程研究中心、中药复方药物开发国家工程研究中心、基因组药物国家工程研究中心、国家中药制药工程技术研究中心、国家海洋药物工程技术研究中心、国家天然药物工程技术研究中心、国家新药开发工程技术研究中心、国家中成药工程技术研究中心、国家中药现代化工程技术研究中心、农业与医药基因工程研究中心、中药固体制剂制造技术国家工程研究中心、国家药物及代谢产物分析研究中心。 国家新药筛选实验室及新药筛选技术平台 国家新药筛选实验室:中国科学院上海药物研究所、中国医学科学院、中国协和医科大学药物研究所药物筛选中心、中国药科大学新药筛选中心、新中新药筛选实验室、复旦大学药学院、抗病毒药物筛选中心、地奥集团新药筛选中心新药筛选技术平台研究:抗肿瘤、抗心脑血管病新药药效学关键技术及平台研究、临床前药物代谢动力学关键技术及平台研究、临床前安全评价关键技术及平台研究、临床试验关键技术及平台研究 “圈养动物”:国家院所 国家所有的院所、高校拥有最优秀的人才、设备、技术平台,“九五”前曾经一直被认为是中国新药研发的主体,然而巨大的国家投入被转化为学术论文和纸上成果,并没有转化为期望的新药项目。 在市场机制的冲击下,这些机构显得机制僵化、缺乏活力,人才象笼中的
药物分析新技术的研究进展
药物分析新技术的研究进展 【摘要】本文介绍近年来药物分析领域中发展起来的几种新技术,包括高效毛细管电泳技术、高效液相色谱-质谱联用技术、高速逆流色谱技术、时间分辨荧光分析法、手性药物的液相色谱分析法,以及它们的最新 应用进展。 药物分析目的是保证药物的质量和用药的安全有效。它研究药物的化学检验、药物稳定性、生物利用度、药物临床监测和中草药有效成分的定性和定量等。传统的药物分析,大多是应用化学方法分析药物分子,控制药品质量。然而,现代药物分析在计算机技术以及分析技术的飞速发展下已经发生了翻天覆地的的变化。本文主要介绍一些基于现代色谱、现代波谱、色谱连用技术上的用于药物分析的现代化技术方法。 1、高效毛细管电泳技术 高效毛细管电泳(high performance capillary electrophore-sis,HPCE)又称毛细管电泳(CE)。毛细管电泳 ( CE)是 80年代后期在世界范围内迅速发展起来的一种分离分析技术,是经典电泳技术和现代微柱分离相结合的产物。其分析应用的范围极广 ,小至无机离子 ,大至生物大分子 ,都可以用 CE来测定。HPCE 在DNA、氨基酸及蛋白质的分析中应用非常广泛,已在生命科学和生物工程等领域中显示出极其重要的应用前景,被用于DNA分析,如实现微量DNA的检测、DNA片段的分离、DNA的测序、DNA突变的检测、DNA损伤判断、临床诊断等[1]。 HPCE 技术因其特别适宜快速大量地分析复杂的中药成分而被广泛用于中药材鉴别和质量控制、中药有效成分的分离与测定、中成药和中药制剂的分析。韩乐等[2]建立了HPCE 同时测定玄参中梓醇、桃叶珊瑚苷、哈巴苷、哈巴俄苷、毛蕊花糖苷及肉桂酸含量的方法,用于玄参药材内在质量的评价和控制。Yu 等[3]等采用中心组合设计法和多变量分析法,以黄芩苷、黄芩素和汉黄芩素作为控制标准建立黄芩毛细管指纹图谱,对34个不同产地的黄芩进行质量分析控制,方法快速、精密、可靠,对所有来源的药材进行了质量评价。 2、高效液相色谱-质谱联用技术 高效液相色谱-质谱(High performance liquid chro-matography-mass spectrometry,HPLC-MS)联用技术是近几年来发展起来的一项新的分离分析技术。它将高效液相色谱(HPLC)对复杂样品的高分离能力,与MS具有高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来,在生物、药物、临床医学、化工和环境等领域得到了广泛的应用,是分析和鉴定复杂混合物的强有力的工具,尤其适用于生物样品中痕量药物的测定。Zhu等[4]采用液相色谱-串联质谱联用(LC-MS/MS)法测定人血浆中奥普力农. 3 高速逆流色谱技术 高速逆流色谱(high-speed countercurrent chromatogra-phy,HSCCC)技术是20 世 纪80 年代发展起来的一种连续高效的新型液-液分配色谱分离技术,最初由美国国立健 康研究院(NIH)的Ito教授研制开发。HSCCC最大的优点是无需固相载体作固定相,并 具有操作简单快捷、分离纯度高、样品回收率高、适用范围广、可一步制备纯品的优点。既 适用于小量分析,也可用于规模纯化,在中药、生化、食品、天然产物化学、环境分析等领域 有着广泛的应用。 HSCCC 在天然植物活性成分的分离中得到了相当广泛的应用,在有机酸、黄酮、生物碱、植物多酚、醌类、萜类、木脂素、香豆素、皂苷等几乎所有的天然植物化学成分的分离中 都有应用。HSCCC可以用来对天然产物的粗提物进行有效成分的提纯以及对天然产物进 行除杂处理。 王晓丽等[5]通过紫外-可见分光光度计法对高速逆流色谱仪分离芦荟多糖的溶剂系统进 行研究,探索出分离芦荟多糖的溶剂系统为PEG600-KH2PO4-K2HPO4-H2O (5∶15∶15∶65,w/w)体系。钱俊青等[6]采用高速逆流色谱法分离纯化大豆异黄酮,并选 用HPLC法测定样品的质量分数,成功分离得到大豆苷91.65%,染料木苷92.97%。高 赛男等[7]采用正己烷-乙酸乙酯-甲醇-水(3.0∶5.0∶3.5∶5.0,v/v)溶剂体系,采用高速逆流 色谱法从丁公藤中成功分离纯化得到东莨菪内酯,纯度可达98.04%。 4 时间分辨荧光分析法 时间分辨荧光分析(timeresolved fluorescence assay,TR-FA)是近年来发展起来的非同
新药研发现状和医药行业发展趋势.docx
作者:文章来源:CPhI制药在线发布时间:2014-04-30 近日,中国科学院院士、上海科学技术协会主席、上海市生物产业行业协会会长陈凯先院士在第二届中国(上海)国际及技术进出口交易会--张江药谷技术创新与国际合作论坛上针对新药研发和医药行业发展主题进行了精彩演讲。 全球新药研发现状 创新药物的研究与开发,集中体现了生命科学和微生物技术领域前沿的新成就与新突破,体现了多学科交叉的高新技术与集成。根据陈凯先院士的讲话,全球新药研发可以总结出如下特点:药物研发重心随着世界疾病谱发生变化。七八十年代主要研发重心为感染性疾病、消化系统疾病、高血压,九十年代后主要集中在高血压、糖尿病、抑郁症,而如今因为环境的恶化以及人口老龄化问题,药物研发的重心主要集中在肿瘤、慢性病和老年疾病; 整个药物市场持续增大,但是增速有所变化。美国、欧洲、日本等发达国家仍然占市场很大的份额,发展速度将趋向稳定。而以中国、印度、俄罗斯为代表的新兴市场正快速发展; 仿制药市场快速增长。随着重磅炸药专利到期的高峰到来,仿制药市场将得到极大的发展,市场份额比重预估将从2011年25%增加到2016年35%,仿制药在新兴市场中占的比重非常显著,而成熟市场中稳定在14%-18%。比如在2011年,Leva公司仍然是非专利药物市场的龙头,但是诺华正迎头赶上,很多大型医药公司纷纷转型仿制药; 学术性、技术性的研究对新药的发展起到了积极的作用。当前化学药还是市场的主导,生物技术药比重上升的非常快; 药物开发风险增加。美国药物研究中心(CMR)分析表明新开发项目的药物Ⅱ期临床实验成功率已经从28%(2006-2007年)降到18%(2008-2009年)。近年来,新药Ⅲ期临床实验和新药申报的平均成功率已经降至50%左右。失败的原因主要是安全性不好、有效性不够等问题; 研发投入持续高涨,投入产出比持续降低。预估R&D投入占销售额将从2008年的20.2%下降至2018年的16.9%。预计至2018年整个制药业的R%D投入将由2004年的879亿美元上升到1494亿美元。 由此可见,新药研发的市场格局正在慢慢发展变化,药物开发的成本正不断上升,因专利到期而失去独占市场权利的“重磅炸药”级产品,在带来很多新机遇的同时也会使市场竞争更加激烈。 全球医药行业发展趋势 审批程序多、时间长一直让药企非常头疼。对此,FDA已经加快审批程序,据陈凯先院士介绍,申办者向FDA提交会议申请,FDA接到申请后14日以内将给予答复。若同意,则书面回复具体的时间、地点等安排,申办者向FDA提交会议信息包,并确认会议议程,召开会议并记录,会议结束后
国内药企最好研发十强
“国内最佳研发产品线”十佳工业企业评选结果出炉 更大到更强,这是中国人的期盼和目标,也是医药人的梦想和努力的方向。如今这一梦想正落在一个个新药的蕴育中,医药研发领域正在从量的积累向质的突跃发生转变。 为了更敏锐地发现中国医药研发领域的竞争优势,发现中国医药最具发展潜力、最贴近市场需求、最融合默契的科工一体,发现最具战略谋划和发展眼光的领袖企业,挖掘引领中国医药产业发展的未来新秀,上海医药工业研究院和中国医药工业信息中心组织专家成立了评选小组,对国内制药行业进行了首届国内最佳研发产品线十佳工业企业的评选。此次评选,不仅是医药行业的开创之举,同时,将对中国医药市场和资本市场产生深远的影响,中国医药产业的结构调整将在品种创新与品牌提升中得到优化和发展。 2010年8月18日,在上海宾馆举行2010年(第27届)全国医药工业信息年会暨首届全国 医药工业百强企业发布会上,会议承办方中国医药工业信息中心(上海医药工业研究院信息中心)首度权威发布了“国内最佳研发产品线”十佳工业企业榜单。他们是: 第一家 集科研、生产和销售为一体的大型医药上市企业,是国内最大的抗肿瘤药物的研究和生产基地,国家定点麻醉药品生产厂家。该公司的研究中心被评为国家级企业技术中心和“重大新药创制”孵化器基地,并建立了国家级博士后科研工作站,承担多项国家级科技专项项目。 据《中国新药审批监测系统》监测,2008年以来CDE受理该公司的新药申请30件(17个品种),全部为3类及以上新药,其中一类新药11件,2类新药1件,3类新药18件。主要 涉及抗肿瘤药、骨骼与肌肉用药、麻醉及其辅助用药、内分泌及代谢调节用药等多个治疗领域。 持续的创新,必将巩固其在抗肿瘤药物、麻醉药品、内分泌系统用药等核心领域的竞争优势,给企业的发展带来源源不断的动力,相信公司必能践行“为民众创造健康生活”的承诺,并将在其国际化的征程上越走越远。 这就是江苏恒瑞医药股份有限公司。
中药新药研究与开发的现状及思考
郑州大学本科毕业论文 专业 姓名 准考证号 论文题目 20 年月日 注:准考证号、姓名要规范填写并准确无误
目录 一、中药发展现状 (2) 二、中药学发展的趋势 (2) 三、未来中药学的基本特征 (3) 四、面向21世纪中药新药研究、开发的思考 (4) 五、中药的不良反应多有几种原因引起 (5) 六、提高中药质量及管理减少不良反应的发生 (7) 七、测试分析方法的现代化是提高中药新药研制水平的保证 (8) 八、小结 (9) 九、参考文献 (10)
中药新药研究与开发的现状及思考 【论文摘要】理性看待中药毒性,合理应用中药。凡是药品都具有利害两重性,毒性多是不合理用药引起的,临床上不合理用药主要是药物的滥用、乱用和误用,而合理用药就是有效、安全、经济的使用药物。总结追求安全有效目标的措施。【论文关键词】中药新药;研究开发;现状;方法 现今社会是个科学技术发展突飞猛进的时代,科学发展的综合化,技术发展的高新化以及高新科技的产业化是21世纪科学技术发展的主要特征,这一趋势将在新药研究开发中得到充分的体现。本文试论世纪之交中药新药研究开发现状及思考,以期加快中药新药创新的步伐。 中药是天然品,很多人认为是安全的,有些慢性病人喜欢多用中药,甚至常吃中成药。似乎认为有病治病,无病保安康,实际上并非如此。凡是药品都具有利害两重性,中药也不能滥用。 一、中药发展现状 中药研究开发是国际热门课题,国际市场每年药用植物及制品(包括保健品等)的交易额超过300亿美元;日本是较重视中药研究开发的国家,年销售额达1500亿日元美国国会1994年批准了把草药列为《饮食补充剂》的法案之后,1997年又制定了“植物药在美批准法”(草案),不再要求草药产品是已知结构的单体纯品,而可以是成分固定、疗效稳定、安全可靠的复方混合制剂。德国在欧洲是传统药年销售额最大国家,达22亿美元。 我国的中药新药研究开发已走上科学化、规范化、标准化和法制化的轨道。至今已有1 141种中药新药通过注册,其中一类新药占11.5%,二类占6.5%,三、四类各占40%,五类占2%。反映新药研制水平的一二类新药的数量明显偏少;对于三类新药的研制也多相重复,忽视了发展创新、基础研究及科研水平的提高;研制的整体水平不高,低水平重复现象严重。尽管如此,新药仍取得了很高的经济效益,占整个药品销售额10%以上,利润大约在20%以上。 中药的发展前景十分广阔,已受到世界的瞩目。中国已向美国FDA进行了首次的复方中药注册申请,并分别于1997年12月和1998年3月通过了“复方丹参滴丸”和“银杏灵”新药临床研究(IND)预审,实现了中药的历史性突破,随之而来将会有更多成熟的中药品种进入世界。 二、中药学发展的趋势 1、中药理论研究系统化没有理论,中医药学不可能存在到今天;没有理论,中医药科研教学等学术机构就没有存在的必要。中药理论除了中医的阴阳、脏象
AI技术助力新药研发
导读 近年来,人工智能正在加速新药要研发的速度。目前,全球有近100家初创企业已在探索用于研发新药的人工智能方法。与此同时,诺华、辉瑞、强生、礼来、GSK等国际知名药企也在积极尝试与人工智能企业合作。 ?图片来源:视觉中国 在大多数企业将人工智能布局在辅助诊断和健康管理方面时,一些企业也在尝试将人工智能应用于新药研发。 近日,晶泰科技宣布完成4600万美金(约合3.2亿元人民币)的B+轮融资,由国寿大健康基金领投,SIG(海纳亚洲)、雅亿资本跟投。这一轮融资将用于晶泰科技的业务扩展与智能药物研发平台的建设。
就在晶泰科技宣布融资前,中电药明这家由中电数据与药明康德合资成立的公司正式亮相。 中电数据和药明康德双方表示将基于诊疗和处方数据,为生命科学行业机提供健康医疗数据 解决方案。其中,为制药企业提供新药研发、上市后药效评估的医疗数据分析产品也是中电 药明这家公司的一个重要业务。 实际上,人工智能正在加速新药研发的速度。目前,全球有近100家初创企业已在探索用于 研发新药的人工智能方法。与此同时,诺华、辉瑞、强生、礼来、GSK等国际知名药企也在 积极尝试与人工智能企业合作。 ◆◆◆ AI辅助新药研发风口初现 “在提供算法服务方面,取决于药企的经费预算。业界领先的创新药企平均每家每年的研发预算在50亿美金以上。而在新药开发方面,人工智能的应用市场在于能否通过计算比别人更快地发现、研发出新药。”在晶泰科技联合创始人温书豪看来,人工智能辅助新药研发这个领域是没有天花板的。 正是由于对这个行业寄予了很高的希望,目前人工智能辅助新药研发领域创业企业不断涌现,并吸引了资本的目光。在英国,使用人工智能助力新药开发的Benevolent AI公司成立5年来 已经开发出24个候选药物,且已有药物进入临床二期试验阶段。近期,Benevolent AI也获 得了1.15亿美元的投资,准备将其人工智能技术应用于运动神经元疾病、帕金森病和其他难 治疾病的药物研发。 在中国,2018年也是人工智能辅助新药研发领域风口初现的一年。
张伯礼--我国新药研发的进展及趋势
我国新药研发的进展及趋势 张伯礼 中国中医科学院 天津中医药大学
报告内容◆医药产业概况◆重大新药创制◆中药现代化进展
TUTCM & CACMS 一、全球医药产业发展现状 520 567 611 656 702 752 800 858 896 942 9.20% 9.00% 7.80% 7.40% 7.00% 7.10% 6.40% 7.30% 4.50% 5.10% 0.0% 1.0% 2.0% 3.0% 4.0% 5.0% 6.0% 7.0% 8.0% 9.0%10.0%0 10020030040050060070080090010002002 2003 2004 2005 2006 2007 2008 2009 20102011 年增 长率 年销售额(十亿美元)
2009~2011年,医药工业总产值实现了21%左右的增长;预计“十二五”期间仍可保持20%的增长速度 5263 6542 8667 10382 12560 15450 18231 21695 26034 31241 24.0% 32.0% 20.0% 21.0% 23.0% 18.0% 19.0% 20.0% 20.6% 5.0% 10.0% 15.0% 20.0% 25.0% 30.0% 35.0% 5000 10000 15000 20000 25000 30000 35000 医药工业总产值变化趋势 我国医药产业规模不断扩大
二、“重大新药创制”科技重大专项 ◆是保障我国人民健康、维护国家经济 安全和社会稳定的迫切需求 ◆是促进我国医药产业实现跨越发展、 建设医药强国的重大战略举措
中国百强药企的新药研发思路
中国百强药企的新药研发思路 内容来源:医药经济报 导读: 制药行业的产品力主要源于创新和研发的积累和突破。除了华药、哈药、石药这样的传统大型国有制药企业,以及华润、复星这样的资本巨鳄,大部分制药企业的发展都离不开其核心品种的成功。比如复方丹参滴丸之于天士力,心血康之于地奥。 在全球范围内,近年来发展最快的制药企业如Roche、BMS、Celgene、Gilead、Biogen等,年均研发投入都不低于营销收入的15%。对比中国制药企业,虽然有所进步,但整体而言研发投入依然远低于西方水平。据CFDA南方医药经济研究所的报告,2012年制药行业的平均研发投入仅占销售收入的1.62%。相对于行业平均水平,百强企业的研发投入强度明显较高,一些以创新为核心的企业,研发投入强度达到了6%以上。这样也形成了一个良性循环:百强企业因为收入较高,可以提供较高研发投入以提升企业的产品力,产品力的提升则能带来更高的销售收入。对于中小企业而言,多数由于经费有限,研发投入不可能太高,那就必须把有限的经费用在刀刃上。借鉴百强企业的新品研发思路,无疑有利于选择合适的研发方向。不过,相比于研发投入,企业似乎更有兴趣将投入用于销售。笔者查看48家在内地上市的百强企业发现,总体来看,销售费用占营业收入的比例高达23.2%,研发投入仅占3.9%。上市企业由于信息披露较为公开,更具参考价值。根据CFDA南方医药研究所的中国制药工业百强榜,上市公司已经占据了绝大多数。因此,我们筛选出部分国内上市公司、核心业务为药品(不含原料药)、研发投入强度超过6%的百强企业。根据公开数据,梳理其新药研究进展,分析其研发思路。 海正药业 研发投入强度:14.9% 特点:以西方投入水平支持转型 海正药业曾是一家优秀的外向型原料药企。不过近年来,海正逐步向“研发营销型”转型。其2013年研发投入强度14.9%,接近西方药企水平。较高的研发投入增强了产品竞争力,2013年海正制剂业务销售额增长50%,达到15亿元。
新药研发前景发展
新药研发前景发展 摘要:通过分析我国新药研发现状及我国新药研发的优势、影响我国新药研发的因素等阐述我国新药研发的未来前景 关键词:新药研发发展前景优势影响因素机遇 Abstract: by analyzing the present situation of Chinese research and development of new drugs and new drug research and development advantages, the influence factors of new drug research and development in China, expounds the future prospects of the new drug R & D in China Keywords: new drug development opportunities influence factors research and development advantages 医药研发是一个多学科、高科技、高难度、高投入、长周期、高风险、高回报的产业。从生产能力看我国药品生产能力居世界前列,但在研发领域中国已经落后发达国家20年。我们应该清醒地看到,目前我国西药市场上有97%的药品都是仿制药品。在主导国际市场的主要药品中,几乎没有中国的专利产品,一种仿制药可以有几十家企业同时生产,而且大部分还是原料药产品技术含量低附加值低。随着我国加入WTO对药品的知识产权保护进一步加强,国外制药巨头纷纷在我国建厂,同时在我国设立新药研发中心国内制药企业面临着巨大的生存和发展压力。因此有必要对我国新药研发的发展前景进行研究。 1.我国新药研发现状 我国的新药研发体系主要由科研院所、大专院校、医药技术开发公司和生产企业的研发部门4部分构成。截至2007年,我国有研发机构3 775家。国立和部分地方性科研院所承担着国家各类科技攻关项目,其发展方向和技术力量各有偏重,在药物的基础和应用研究领域发挥着主导作用。部属院校和部分综合性大学的重点实验室也承担了许多国家级科研项目,研究内容各有特色,是我国药学高端人才的主要培养基地和创新药物研究体系的重要组成部分。但我国制药产业创新能力弱,国际市场竞争能力差,经过近几十年的努力和探索,我国的新药研究开发工作已经积累了丰富的经验,建立了一大批实力相当的研究机构,培养了大批新药研究人才,为我国的新药研究奠定了基础。目前我国的新药研究与开发也正与发达国家逐步接轨,科研院所越来越注重基础研究,企业逐步成为新药研发的主体,每年申报新药发明专利的数量也不断增加,我国的新药研发已进入了一个新的阶段。但就总体水平而言,我国创新药物研究还只是处于起步阶段,与先进国家比较还有相当大的差距。 2.我国新药研发的优势 2.1中药资源的优势独特 新版《中药大辞典》收载的中药材种类达12 807种,其中药用植物11 146种,药用动物l 581种,药用矿物80种。近年来国家启动了中药材标准化种植采集(GAP)计划,一批优质中药材生产基地已经形成。建设中成药制造企业的投资成本较低,但产品的利润空间巨大,如采取稳定可控的质量监测体系和切实有效的市场营销策略,赢利能力将会得到充分体现。实施中药现代化战略,将发挥我国在这一领域里的知识优势、资源优势和市场优势,为研发具有我国自主知识产权的创新药物和植物药提供物质保障和技术支撑。 2.2行业集聚优势 我国自1991年3月开始陆续建立了54个国家级高新技术产业开发区,在此基础上,正在或已经建立了一批包括国家级生物医药产业基地在内的新药研究开发园区。生物医药园区的建设是促进生物技术产业化、培育新兴产业、带动地方经济增长的重要途径,促进了我国生物医药产业的集聚化发展,并充分凸显区位优势、聚集优势、政策优势、人才优势、机制优势和服务优势。 2.3 政策导向优势 《国家中长期科技发展规划纲要(2006—2020年)》将“重大新药创制”确定为16个科技重大专项之一。根据“重大新药创制”项目的总体安排,我国预算投入66亿元人民币,研发出一系列治疗恶性肿瘤、心血管疾病等10类重大疾病的创新药物。2006年以来,还先后出台了《国家“十一五”科学技术发展规划》、《国家科技支撑计划“十一五”发展纲要》,将生命科学与医
中药新药研发工作的现状及思考
内容摘要:【关键词】中药;新药;标准化;规范化;研发 我国中药的临床应用已相当广泛,但中药的临床疗效却始终不能令人满意,如何提高中药的临床疗效,确保人民用药安全有效已成为每个医药工作者共同面对的问题。本文着重从中药新药研发过程中存在的问题谈几点看法,仅供同行参考。 【关键词】中药;新药;标准化;规范化;研发 我国中药的临床应用已相当广泛,但中药的临床疗效却始终不能令人满意,如何提高中药的临床疗效,确保人民用药安全有效已成为每个医药工作者共同面对的问题。本文着重从中药新药研发过程中存在的问题谈几点看法,仅供同行参考。 1 新药临床欠缺实实在在的疗效 在中药新药研制和评审中,重基础(药学、药理学、毒理学)轻临床的现象比较普遍,新药临床实验的地位未得到应有的重视。新药上市后的临床再评价更是稀有[1]。前几年,我国每年都有上百种中药新药获得批准文号投入市场,新药治疗病种无所不及,甚为广泛,而疗效到底如何?却值得我们反思。另外,新药一旦获得批准文号,厂家和医药经销公司就会大做广告、大力宣传、扩大药物知名度,但多数品种往往名不副实,在市场上难以获得持久生存,走走过场就销声匿迹,所以新药品种经常变换。所有这些情况表明中药新药欠缺实实在在的临床疗效。 2 中药临床试验未达到标准化、规范化 临床疗效评价标准和临床试验规范(gcp)的应用对实现药品的最终价值是极其重要的,由于我国传统中医中药辨证施治理论重视整体的反应及其症状的改善,病与证、症,病种和病类,证名与证候等概念的称谓非常复杂,常常引起理解各异,让许多关心中药的人“雾里看花”[2],难于与国际接轨。因此,在实施gcp过程中,要注意与国际gcp惯例相统一,即以疾病的实际变化来评价药物的作用,使中药在中医理论指导下,用大规模的标准化临床实验提供科学依据,发挥其最大的作用。 3 中外新药临床研究现状的对比 我国近年来在新药临床研究方面无论在技术要求和政策方面都取得了长足发展,但与欧美发达国家相比仍处于较低水平,主要表现在研制单位和临床研究人员的新药研发的理念和素质,临床研究管理水平和监督力度等方面的滞后。美国fda的药品审评和研究中心(简称cder)非常重视新药的研究阶段,注重保护受试者的权益,确保临床研究申报材料的科学性、真实性、完整性,除了“随机、盲法、对照”的原则以及gcp的有关规定外,cder对临床研究基地、医院的审评委员会、研制单位、临床研究督察员(monitor)和合同研究中介机构(cro)进行不定期的现场实地核查[3]。因此,中药新药的有效性、安全性、质量可控性3个方面是今后新药研发工作的重中之重。
我国新药研究与开发的现状、问题和对策资料讲解
我国新药研究与开发的现状、问题和对策
我国新药研究与开发的现状、问题和对策 第二军医大学新药评价中心 新药研究与开发是指新药从实验室研究到上市、扩大临床应用的整个过程。我国新药研究与开发已经取得了很大的成就,尤其是1985年实施《药品管理法》后,我国新药研究与开发开始走上法制化、规范化和科学化的轨道。但应该看到,我国新药研究与开发的总体水平与先进国家相比还有很大的差距,形势异常严峻。本文就我国新药(西药)研究与开发的现状、存在的问题及其相应的对策作一概述。 1 我国新药研究与开发的现状 1.1 90年代世界上市新药概况1990~1996年7年间世界首次上市新原料药(NCEs)共308个,每年上市40~51个;其中日本为98个,美国62个,欧共体10国为128个。我国是世界制药第2大国,但只有2个新原料药上市(1992年和1994年各1个)。可见我国在创新药物研制方面与发达国家的差距之大。 从分布情况来看,上市前4名的新药类别依次为抗感染药、心血管药、抗肿瘤药和神经精神药,分别占总数的20.78%、18.83%、13.96%和10.39%。表明这4类药物是90年代新药研究与开发的重点和热点。 1.2 我国1985~1996年上市新药(西药)概况1985~1996年我国共批准西药新药1218个(批文数)。1986年5个,1996年上升到332个,呈逐年较大幅度增长的趋势。其中一类创新药54个,仅占总数的4.33%,品种更少(34个)。而二类仿制药占23.4%,60%以上是改变剂型的四类药。说明我国创制新药能力太弱,仿制新药能力还可以,而低水平的剂型变换是主流。因此,加强一类新药的研制已迫在眉睫,势在必行。 从分布情况来看,前4名的新药类别依次为抗感染药、心血管药和解热镇痛药,分别占总数的23.63%、11.91%和10.79%。与国外情况有差异,表明我国有必要加大抗肿瘤药和神经精神药物的研究和开发。 总之,我国新药研究与开发的势头很猛,特别是中美两国签定了知识产权备忘录,我国对美、日、欧等一些先进国家的独占专利药品实行行政保护,1993年1月1日实施药品专利,恢复我国“关贸总协定缔约国”地位的谈判已近尾声。这一形势对我国医药工业既是挑战,又是机遇。这会更加激励我国的科研机构、医药院校和企业研制申报新药的积极性。也更明显看到新药创制的迫切性和严峻性。要和国际接轨,赶上发达国家新药研究与开发的水平,我们还有很长的路要走,还有许多有待于解决的问题。 2 我国新药研究与开发存在的问题 2.1 与先进国家相比差距明显我国新药研制(一类药)的主要差距是创制能力不强。究其原因主要是长期以仿制为主。据统计,我国药品(化学药品)生产97%以上是仿制品。如
全球新药研发现状1
全球新药研发现状 世界范围内,新药研发费用正逐年增加,上市新药数量却不断减少,新药研发效率正逐年降低。经济和政治环境在很大程度上影响着跨国公司是否在某个国家投资和进行新药研发。鉴于此,各个国家也在为各自的医药产业发展制订更合适的政策。涉及的方面综述如下: 科技发展:科技发展是医药行业快速成长的强大动力。随着现代生活方式的改变,疾病发生情况也发生了显著改变,研发工作也有相应调整。生物技术、计算机技术和信息技术在医药产品研发和医药产业中的应用,带来了一些可喜的成果。 传统的研发、生产、销售模式仍将继续,而IT技术与客户管理、企业管理技术的融合将带来医疗市场的革命,将对医药营销模式产生深远影响。以高通量筛选技术为基础,综合采用计算机处理、新型分析手段、先进设备和快捷的信息技术已经使新药先导物质的发现时间大大缩短。 制药业也是研发全球化程度最高的产业之一,美国有30%的新药研发工作在境外进行,而境内进行的研发活动有49%是由外国企业开展的。跨国公司通过全球研发网络,整合各国的智力资源,能获得强大的协同效应。 药品消费的变化:全球药品消费有85%以上集中于美、欧、日等几个发达国家和地区。全球经济发展不均衡导致药品消费不均衡,这为药品市场日后增长提供了机会。随着发展中国家经济的发展,其用药水平势必随之提高,这是制药业极大的市场机遇。但是,目前,各国医疗费用多由国家、保险公司和个人共担,政府为控制医疗费用,希望推广疗效确切、价格相对便宜的非专利药物。这对制药企业来说又是一大挑战。新药研发也变得更具挑战性了。研发中心转移:政府重视程度、知识产权保护、基础设施、现有产业规模和人才资源等五大必要因素影响着新药研发工作的进行。随着新药研发成本增加,很多跨国公司把部分研发机构转向发展中国家,通常采用与当地机构合作建立研发机构的方式开展工作。此举既可以节约成本,又便于顺利打入当地市场。事实上,如今研发和技术创新日益趋于全球化的变化趋势在某些国家(如瑞典)于上世纪六七十年代便开始了。外资管理体制的自由化、外资政策中有关对外商研发活动的激励措施、允许外商股权参与、允许外商与东道国大学和科技中心合作、知识产权保护措施的强化均可促进跨国公司研发活动在海外东道国的分散化。此外,国家建立科学园区之类的政策行动也对跨国公司将其研发活动安排在国外的决策产生了积极的诱导作用。2004年7月1日,国际制药企业诺和诺德中国研发中心在北京中关村生命科学园落成,成为继罗氏制药之后又一家在中国设立全球研发中心的跨国制药企业。对于制药企业来说,研发是企业的核心,一般制药企业都不在其母国外设立研发中心。但中国的研发成本低,有大量研发人才以及患者样本,使临床试验中的样本采集非常便捷,从而极大加速试验进程。外企研发中心开展项目研究势必带来产品开发技术,并训练一批研发人员,但对国内企业来说也意味着更激烈的竞争。 药物基因组学的发展使个性化药品成为未来药物研发的重点。目前, 每个成功上市的新药至少需要8亿美元研发费用, 整个生命周期的资金投入大约需要15亿美元, 但是进人1期临床试验的产品只有10%能够上市。即使成功上市, 只有30%的商业化上市产品能够盈利。FDA 在2002年批准的新药申请中, 只有2%是NMEs,绝大多数是产品线延伸及新剂型等,按照传统的高通量筛选方法开发药物已越来越困难,而药物基因组学为药物研发带来曙光。人类基因计划(HGP)研究结果预计有10万目标药物,人类的30万个基因, 50万单核苷酸可以有无穷的组合, 从而达到治疗个体疾病的目的。在利用基因组学技术开发药物的临床前研究阶段, 跨国制药公司正投人高比例的R&D费用,这与以往小公司、科研单位从事这方面研究有明显的不同。目前重磅炸弹药品一般销售额为30-50亿美元, 但许多业内人士认为个性化药物时代将是重磅炸弹药物的结束。比较成功的个性化药物的例子是Genentech 公司的Herceptin , 年销售额超过5亿美元, 该药目标人群是年龄为25-30 岁的乳腺癌妇女。罗氏公
国内新药研发发展情况分析
国内新药研发发展情况分析 经过多年的发展,国内新药研发的硬件、软件都得到了极大的提高,企业的创新意识有所提高,研发投入有所增加,大型制药企业都建立了具有一定实力的研究所;新药筛选、计算机辅助设计、现代生物技术等新技术不断应用于新药研发--所有这些进展都标志着我国新药研发水平有所提高。但是,国内新药研发也存在着一定的问题。 新药研发障碍多 企业利润水平下降,研发投入不足国际大型制药公司一般会把利润的10%~20%用于研发。而国内整个医药工业的研发投入却严重不足,1/3的企业由于亏损,更是先要解决生存问题,无力投资研发。从总体看,全国2007年投入药品研发的总资金估计还不到辉瑞公司76亿美元的1/3。 研发资源浪费严重国内的药品研发整体水平不高,研究过多地集中在几个热门品种上。大量的研发资金被浪费,研发效率低下。真正用于创新性研究的资金极其有限。 新药研制开发主体错位制药水平先进的国家,新药研发的主体是企业,大学、研究院所着重基础研究。而在我国,新药研究主要由专业院校和国家的研究院所来承担。虽然科技部明确在"十一五"期间,重点支持企业创新研究,但是要实现这个目标,仍任重道远。 业内研发心态浮躁,缺乏长远战略从2004年开始,我国每年申报的新药都有上万个,但真正的创新药物很少。由于相比创新药物,仿制药、改剂型研究投入少、风险小,而且仿制药、改剂型药也属于新药,企业可以自主定价,从而保证企业得到可观的回报,导致国内企业对此类药物研发趋之若鹜,而真正新药研发投入逐年减少。 过度仿制由于低水平重复研制过多,企业的利润空间越来越小,许多企业甚至连正常的生产都难以维持,更不用谈斥巨资进行新药研发了。企业因此越来越失去竞争能力,最终导致恶性循环。 在研发技术上和知识产权方面与发达国家相比还有很大差距我国新技术和新型制剂研究长期滞后,脂质微囊、靶向给药、缓控释等新剂型新药申报数
