铁、钴、镍实验报告
铁、钴、镍实验报告
一、实验目的
二、实验内容
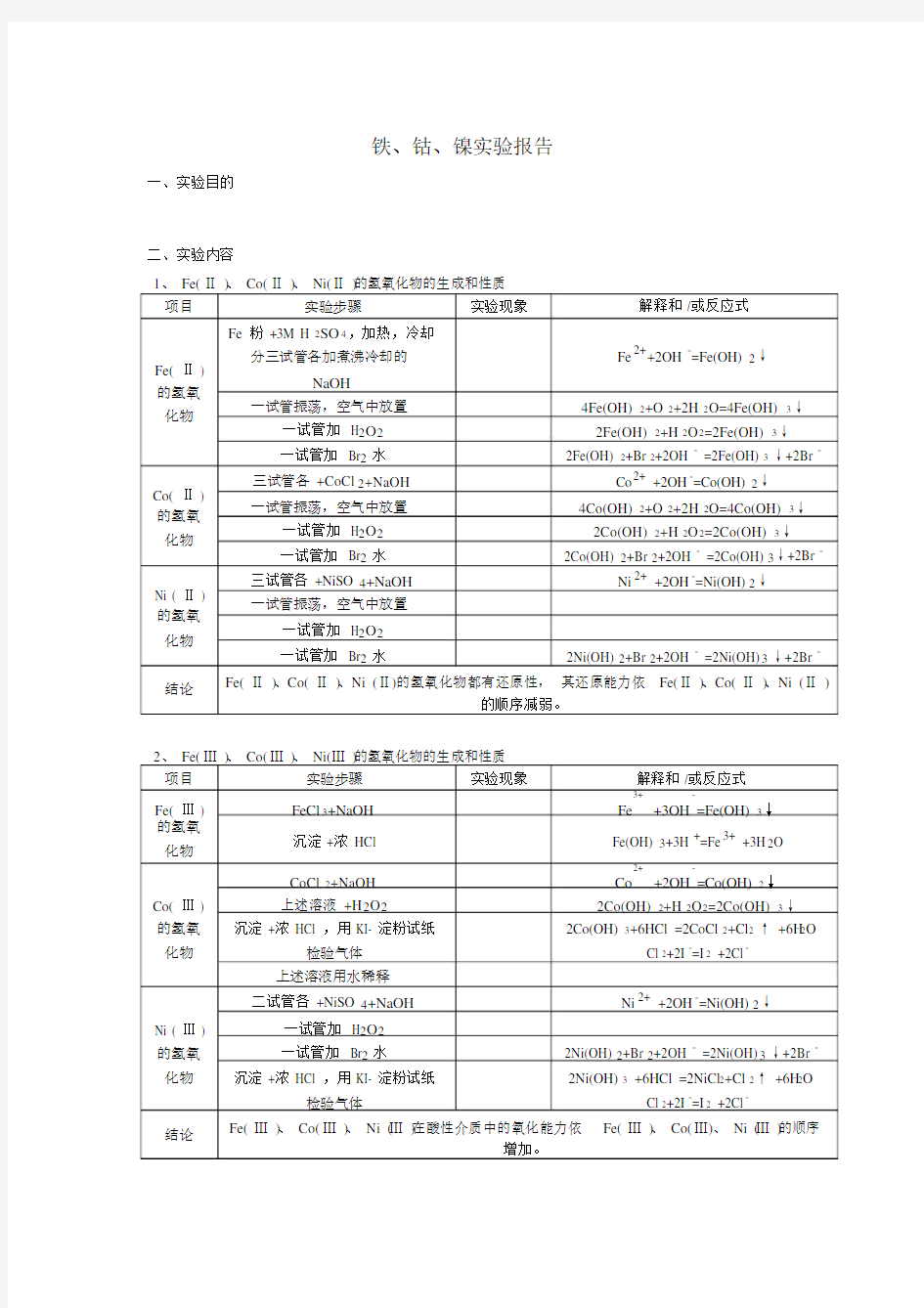
1、 Fe( Ⅱ )、 Co( Ⅱ )、 Ni( Ⅱ )的氢氧化物的生成和性质
项目实验步骤实验现象解释和 /或反应式Fe 粉 +3M H 2SO4,加热,冷却
Fe( Ⅱ )分三试管各加煮沸冷却的Fe2++2OH -=Fe(OH) 2↓NaOH
的氢氧
一试管振荡,空气中放置4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3↓化物
一试管加 H2O22Fe(OH) 2+H 2O2=2Fe(OH) 3↓
一试管加 Br2水2Fe(OH) 2+Br 2+2OH - =2Fe(OH) 3↓+2Br -
Co( Ⅱ )三试管各 +CoCl 2+NaOH Co2+ +2OH -=Co(OH) 2↓
一试管振荡,空气中放置4Co(OH) 2+O 2+2H 2O=4Co(OH) 3↓
的氢氧
一试管加 H2O22Co(OH) 2+H 2O2=2Co(OH) 3↓
化物
一试管加 Br2水2Co(OH) 2+Br 2+2OH - =2Co(OH) 3↓+2Br -
Ni ( Ⅱ )三试管各 +NiSO 4+NaOH Ni 2+ +2OH -=Ni(OH) 2↓一试管振荡,空气中放置
的氢氧
一试管加 H2O2
化物
一试管加 Br2水2Ni(OH) 2+Br 2+2OH - =2Ni(OH) 3↓+2Br -
结论Fe( Ⅱ )、Co( Ⅱ )、Ni ( Ⅱ)的氢氧化物都有还原性,其还原能力依 Fe( Ⅱ )、Co( Ⅱ )、Ni ( Ⅱ )
的顺序减弱。
2、 Fe( Ⅲ )、 Co( Ⅲ )、 Ni( Ⅲ )的氢氧化物的生成和性质
项目实验步骤实验现象解释和 /或反应式
Fe( Ⅲ )FeCl3+NaOH
3+-
Fe+3OH =Fe(OH) 3↓
的氢氧
沉淀 +浓 HCl Fe(OH) 3+3H +=Fe3+ +3H 2O 化物
CoCl 2+NaOH
2+-
Co+2OH =Co(OH) 2↓
Co( Ⅲ )上述溶液 +H 2O22Co(OH) 2+H 2O2=2Co(OH) 3↓
的氢氧沉淀 +浓 HCl ,用 KI- 淀粉试纸2Co(OH) 3+6HCl =2CoCl 2+Cl2↑ +6H2O 化物检验气体Cl 2+2I -=I 2 +2Cl -
上述溶液用水稀释
二试管各 +NiSO 4+NaOH Ni 2+ +2OH -=Ni(OH) 2↓
Ni ( Ⅲ )一试管加 H2O2
2Ni(OH) 2+Br 2+2OH - =2Ni(OH) 3↓+2Br -的氢氧一试管加 Br2水
化物沉淀 +浓 HCl ,用 KI- 淀粉试纸2Ni(OH) 3 +6HCl =2NiCl 2+Cl 2↑ +6H2O 检验气体Cl 2+2I -=I 2 +2Cl -
结论Fe( Ⅲ )、 Co( Ⅲ )、 Ni ( Ⅲ )在酸性介质中的氧化能力依Fe( Ⅲ )、 Co( Ⅲ)、 Ni ( Ⅲ )的顺序
增加。
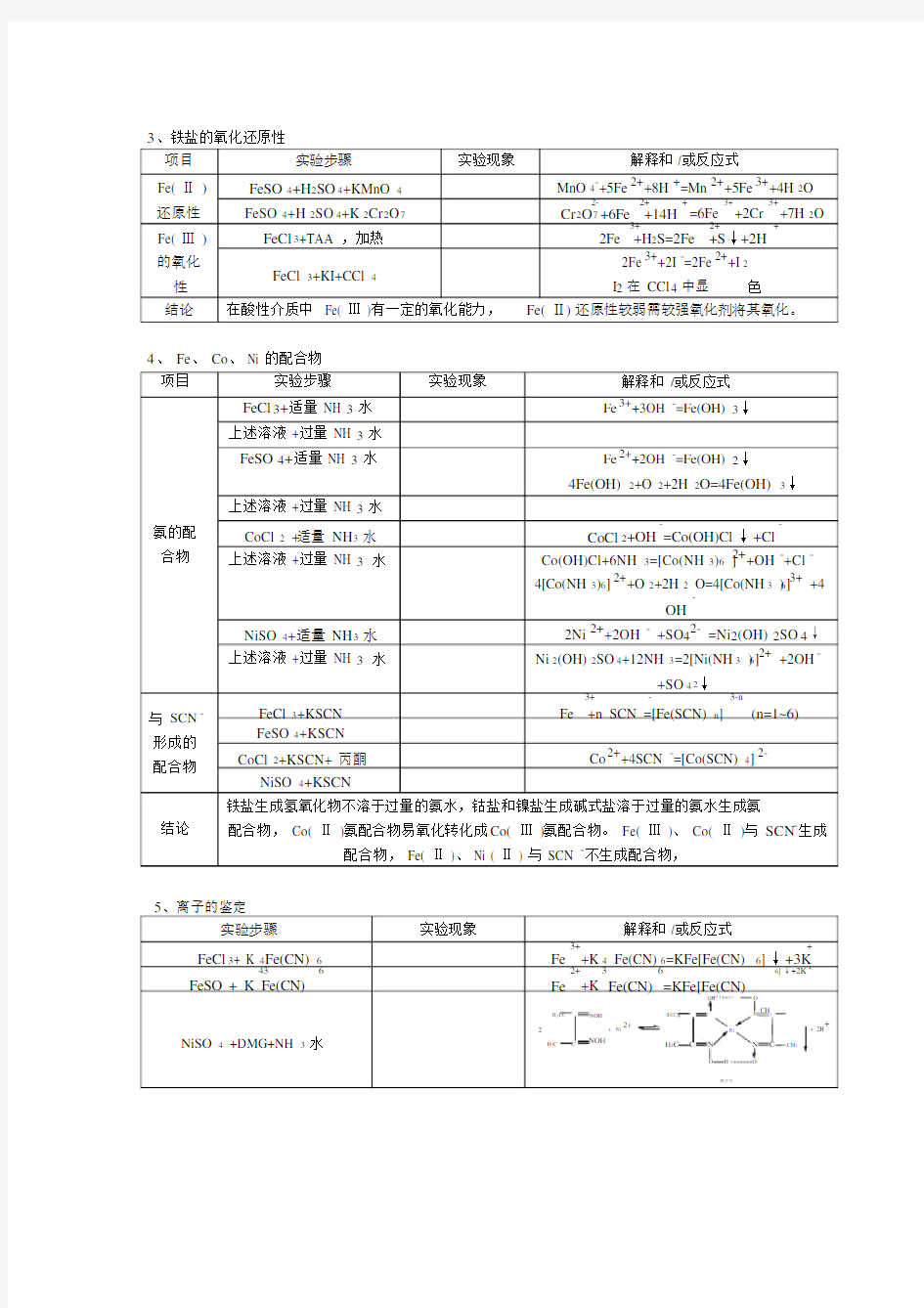
3、铁盐的氧化还原性
项目实验步骤实验现象解释和 /或反应式
Fe( Ⅱ )FeSO4+H2SO4+KMnO 4MnO 4-+5Fe2++8H +=Mn 2++5Fe3++4H 2O
还原性FeSO4+H 2SO4+K 2Cr2O7
2-2++
=6Fe
3+
+2Cr
3+
+7H 2O Cr2O7+6Fe +14H
Fe( Ⅲ )FeCl3+TAA ,加热
3+2++ 2Fe +H2S=2Fe +S↓+2H
的氧化
FeCl 3+KI+CCl 42Fe3++2I -=2Fe2++I 2
性I2在 CCl 4中显色结论在酸性介质中 Fe( Ⅲ )有一定的氧化能力,Fe( Ⅱ) 还原性较弱需较强氧化剂将其氧化。
4、 Fe、 Co、 Ni 的配合物
项目实验步骤实验现象解释和/或反应式
FeCl3+适量 NH 3水Fe3++3OH -=Fe(OH) 3↓
上述溶液 +过量 NH 3水
FeSO4+适量 NH 3水Fe2++2OH -=Fe(OH) 2↓
4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3↓上述溶液 +过量 NH 3水
氨的配合物
与SCN-形成的配合物
结论
CoCl 2 +适量 NH 3水CoCl
--
2+OH =Co(OH)Cl↓+Cl
上述溶液 +过量 NH 3水Co(OH)Cl+6NH 3=[Co(NH 3)6 ]2++OH -+Cl -
4[Co(NH 3)6] 2++O 2+2H 2 O=4[Co(NH 3 )6]3+ +4
-
OH
NiSO 4+适量 NH 3水2Ni 2++2OH - +SO42- =Ni 2(OH) 2SO4↓上述溶液 +过量 NH 3水Ni 2(OH) 2SO4+12NH 3=2[Ni(NH 3 )6]2+ +2OH -
+SO42↓FeCl 3+KSCN
3+-3-n
Fe +n SCN =[Fe(SCN) n](n=1~6) FeSO4+KSCN
CoCl 2+KSCN+ 丙酮Co2++4SCN -=[Co(SCN) 4] 2-NiSO 4+KSCN
铁盐生成氢氧化物不溶于过量的氨水,钴盐和镍盐生成碱式盐溶于过量的氨水生成氨
配合物, Co( Ⅱ )氨配合物易氧化转化成Co( Ⅲ )氨配合物。 Fe( Ⅲ )、 Co( Ⅱ )与 SCN-生成配合物, Fe( Ⅱ )、 Ni ( Ⅱ ) 与 SCN -不生成配合物,
5、离子的鉴定
实验步骤实验现象解释和 /或反应式
FeCl3+ K 4Fe(CN) 6
3+
+K 4 Fe(CN) 6=KFe[Fe(CN)
+ Fe6]↓+3K
4362+36
=KFe[Fe(CN)6]↓+2K+
FeSO + K Fe(CN)Fe+K Fe(CN)
OH O
H3CC NOH H3CC N NC CH
3
2+ Ni 2+
Ni+ 2H
+
NiSO 4 +DMG+NH 3水H3C C NOH H3C C N N C CH3
O H O
鲜红色
