培训机构化学讲义模板
有机化学教师讲义
授课日期:__ 时段:___ 教学主管签字:___________
辅导科目:化学学员姓名:年级:高二
学科教师:课时数:第_ 次课
课题1、有机化合物的分类2、有机化合物结构特点
1、让学生掌握有机化合物的分类方法
2、掌握同分异构体同分异构现象
3、掌握碳原
教学目标
子成键特点4、熟悉常见官能团
教学重点1、同分异构体同分异构现象2、有机化合物基本分类
教学难点1、同分异构体同分异构现象2、有机化合物主要类别及官能团
教学内容
第一节有机化合物的分类
1、有机化合物分类:烃和烃的衍生物
2、按分子中碳的骨架分类:链状有机化合物和环状有机化物
3、特殊原子、原子团和官能团分类:烷烃、烯烃、炔烃、芳香烃、卤代烃、醇、
酚、醚、醛、羧酸酯等
例如:
烷烃:链烃中分子碳原子之间都以单键相连的称为烷烃
环烷烃:脂环烃中,碳环中碳原子之间都以单键相连的称为环烷烃
芳香烃:环烃中分子中有苯环的称为芳香烃
烃的衍生物:烃分子中的氢原子被有关原子或原子团取代后的产物
环状芳香族化合物:+其他脂肪烃
芳香烃:+C、H化合物脂肪族化合物链状
苯的同系物:+烷烃基脂肪烃衍生物
芳香族包含芳香烃包含苯的同系物
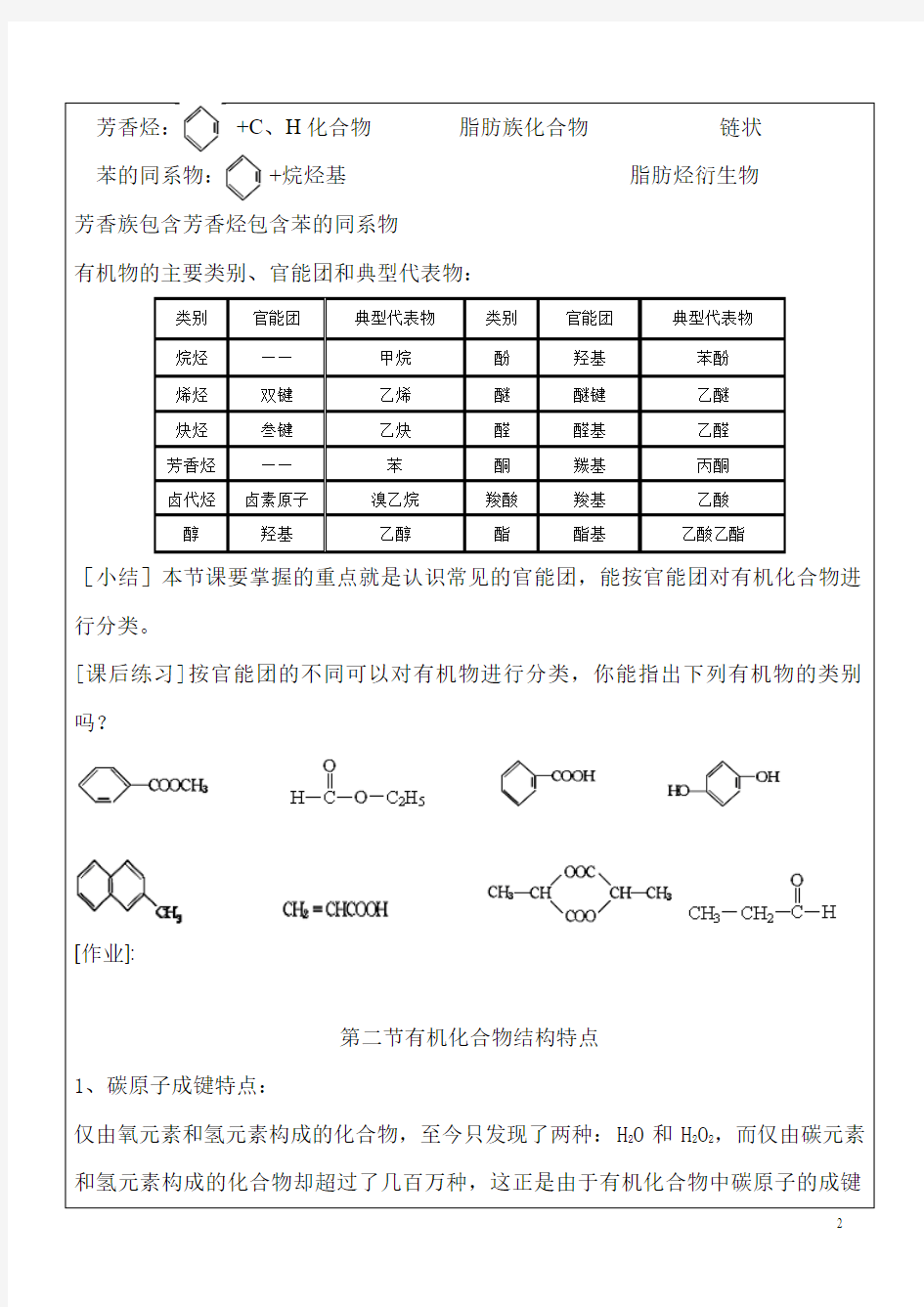
有机物的主要类别、官能团和典型代表物:
类别官能团典型代表物类别官能团典型代表物
烷烃——甲烷酚羟基苯酚
烯烃双键乙烯醚醚键乙醚
炔烃叁键乙炔醛醛基乙醛
芳香烃——苯酮羰基丙酮
卤代烃卤素原子溴乙烷羧酸羧基乙酸
醇羟基乙醇酯酯基乙酸乙酯
[小结]本节课要掌握的重点就是认识常见的官能团,能按官能团对有机化合物进行分类。
[课后练习]按官能团的不同可以对有机物进行分类,你能指出下列有机物的类别吗?
[作业]:
第二节有机化合物结构特点
1、碳原子成键特点:
仅由氧元素和氢元素构成的化合物,至今只发现了两种:H2O和H2O2,而仅由碳元素和氢元素构成的化合物却超过了几百万种,这正是由于有机化合物中碳原子的成键
特点所决定的。
碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子。碳原子通过共价键与氢、氧、氮、硫、磷等多种非金属形成共价化合物。科学实验证明,甲烷分子里,1个碳原子与4个氢原子形成4个共价键,构成以碳原子位中心,4个氢原子位于四个顶点的正四面体立体结构。键角均为109o28’
2、键长、键角、键能
键长:原子核间的距离称为键长,越小键能越大,键越稳定。
键角:分子中1个原子与另外2个原子形成的两个共价键在空间的夹角,决定了分子的空间构型。
键能:以共价键结合的双原子分子,裂解成原子时所吸收的能量称为键能,键能越大,化学键越稳定
3、有机物结构的表示方法
4、同分异构现象
同分异构体:化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。具有同分异构现象的化合物互称同分异构体。
构造异构:(1)碳链异构(2)位置异构(3)官能团异构
构型异构:顺反异构
5、等效氢原则
1、同一碳原子上的氢等效
2、同一个碳上连接的相同基团上的氢等效
3、互为镜面对称位置上的氢等效。
[课后练习]:
1、写出C5H11Cl的同分异构体
2、写出分子式为C5H10O的醛的同分异构体
教学反思
学员听课
情况概述
课堂突发情
况及
处理方式
有无达到预
期目标及调
整方式
化学选修三,人教版知识点总结
选修三知识点 第一章原子结构与性质 1能级与能层 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而
是指这样顺序填充电子可以使整个原子的能量最低。 (2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则 洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。 4.基态原子核外电子排布的表示方法 (1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。 ③外围电子排布式(价电子排布式) (2)电子排布图(轨道表示式)是指将过渡元素原子的电子排布式中符合上一周期稀有气体的原子的电子排布式的部分(原子实)或主族元素、0族元素的内层电子排布省略后剩下的式子。每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。如基态硫原子的轨道表示式为 二.原子结构与元素周期表
培训机构专职教师劳动合同模板
乙 方 (劳动 者): 身 份 证号 码 户 籍 地 址 现 居 住 地 联 系 电 话 甲方(用人单位): 劳 动 合 同
甲乙双方根据《中华人民共和国劳动法》和《中华人民共和国劳动法合同法》等法 律、法规、规章的规定,在平等自愿、协商一致的基础上,同意订立本劳动合同,共同遵守本合同所列条款。 一、合同类型和期限 第一条甲、乙双方选择以下第种形式确定本合同期限: (一)有固定期限:自年月日起至年月日止。 (二)无固定期限:自年月日起至法定的或本合同所约定的终止条件出 现时止。 其中试用期自年月日至年月日止,共天。 (三)甲方安排乙方执行工作制。 1.标准工时 2.综合计时 3.不定时 二、工作内容 第二条根据甲方工作需要,乙方同意从事___________________ 位工作。经甲、乙双方 协商同意,可以变更工作岗位,并签订《劳动岗位变更书》,《劳动岗位变更书》作为合同附件与本合同具有同等法律效力。 第三条乙方应按照甲方的有关制度规定和要求,按时完成规定的工作数量,达到规定的质量标准。 三、保守甲方商业秘密 第四条乙方担负甲方教师、课程销售及经营管理工作,应保守甲方的教学法、业务往来、学生信息等技术及通讯和信息数据等商业秘密。 四、劳动保护和劳动条件 第五条甲方执行国家和地方有关劳动保护的法律、法规和规章,为乙方提供必要的工作和办公条件,制定操作规程、工作规范等制度及其标准。 第六条甲方负责对乙方进行企业文化、职业道德、人事制度、奖惩制度及有关规章制度的教育和培训。 第七条乙方有权拒绝甲方的违章指挥,对甲方及其管理人员漠视乙方安全健康的行为,有权提
商品混凝土公司安全生产标准化管理体系方案资料汇编(2019-2020新标准实施模板)
Q/WSS Q/WSS-2019 商品混凝土站安全生产标准化管理体系全套方案资料标准汇编 编号:Q/WSS-002-2019 2019-2020版 编制: 审核: 批准: 受控状态: 发布日期:2019-05-15 实施日期:2019-08-15 XX商品混凝土公司
目录 第1章编制说明 (1) 1.1 制定原则 (1) 1.2 编制及管理 (1) 1.3 文本及文字要求 (2) 1.4 其他 (3) 第2章标准化体系编制依据 (4) 2.1安全生产法律 (4) 2.2安全生产法规 (6) 2.3安全规章 (8) 第3章目标 (17) 3.1 安全生产目标管理制度 (17) 3.1.1 目的 (17) 3.1.2 范围 (17) 3.1.3 内容 (17) 3.2 2019年度安全生产目标 (20) 3.3 年度安全生产目标分解 (22) 3.4 安全生产目标实施计划和考核办法 (23) 3.4.1 附责任书1:安全生产目标责任书(管理层样本) (24) 3.4.2 附责任书2:安全生产目标责任书(员工样本) (27) 3.4.3 附表1:安全生产目标考核台账 (29) 第4章组织机构和职责 (31) 4.1 安全机构设置与安全管理人员配备的管理制度 (31) 4.2 安全生产领导小组 (32) 4.3 安全生产领导小组工作章程 (33) 4.3.1 附表1:安全会议记录 (36) 4.4 安全管理机构 (38) 4.4.1 附图1:安全管理组织机构图 (40) 4.5 商混站安全员任命通知 (41) 4.5.1 附表1:安全管理人员统计台账 (42) 第5章安全生产责任制 (44) 5.1 安全生产责任制的制定、沟通、培训、评审、修订及考核的管理制度 (44) 5.1.1 附表1:安全生产责任制与权限培训记录 (47) 5.1.2 附表2:安全生产责任制评审表 (49) 5.1.3 附表3:安全生产责任制落实情况考核台帐 (50) 5.2 组织机构体系及职责 (51) 5.2.1 商混站层级管理图 (51) 5.2.2 组织机构体系 (52) 5.2.3 管理职责 (52) 5.3 商品混凝土站各级岗位职责 (54) 5.3.1 站长岗位职责 (54)
高中化学选修三知识点总结(精选课件)
高中化学选修三知识点总结第一章原子结构与性 质 一.原子结构 1.能级与能层 2。原子轨道 3.原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。...文档交流仅供参考...
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错. 说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和....文档交流仅供参考... (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子.换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。...文档交流仅供
参考... (4)洪特规则:当电子排布在同一能级的不同轨道 (能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hun d)规则。比如,p3的轨道式为或,而不是。...文档交流 仅供参考... 洪特规则特例:当p、d 、f轨道填充的电子数为全 空、半充满或全充满时,原子处于较稳定的状态。即p 0 、d 0、f 0、p 3、d 5、f7、p6、d 10、f 14时,是较稳定状态....文档交流 仅供参考... 前36号元素中,全空状态的有4B e 2s 22p 0 、12Mg 3s 23p 0、20Ca 4s23d0;半充满状态的有:7N 2s22p 3、15P 3s 23p 3、24C r 3d 54s 1、25Mn 3d 54s 2、33A s 4s 24p 3;全充满状态的有10Ne 2s22p 6、18Ar 3s 23p 6、29Cu 3d 104s 1、30Z n 3d104s 2、36Kr 4s 24p6。...文档交流 仅供参考... 4。 基态原子核外电子排布的表示方法 (1)电子排布式 ①用数字在能级符号的右上角表明该能级上排布的 电子数,这就是电子排布式,例如K:1s 22s 22p 63s 23p 64s 1。...文档交流 仅供参考... ②为了避免电子排布式书写过于繁琐,把内层电子 达到稀有气体元素原子结构的部分以相应稀有气体的元 ↑↓ ↑ ↓ ↓ ↓ ↑ ↑ ↑
2017年人教版高中化学选修3讲义课时作业2
课时作业2构造原理能量最低原理 时间:45分钟满分:100分 一、选择题(共44分) 1.在基态多电子原子中,下列关于核外电子能量的叙述错误的是() A.最易失去的电子能量最高 B.电离能最小的电子能量最高 C.p轨道电子能量一定高于s轨道电子能量 D.在离核最近区域内运动的电子能量最低 解析:选项C没有指明p轨道电子和s轨道电子是否处于同一电子层。 答案:C 2.(双选题)下列原子结构示意图能表示能量最低状态(基态)的是() A. B. C. D. 解析:A、C两项中基态原子的核外电子排布符合构造原理。B 项和D项中均出现了第二层未排满8个电子,第三层却排布电子的现象,这不是基态,而是激发态。 答案:AC 3.下列各组指定的元素不能形成AB2型化合物的是() A.1s22s22p2和1s22s22p4 B.1s22s22p63s23p4和1s22s22p4
C.1s22s22p63s2和1s22s22p5 D.1s22s22p5和1s22s22p4 解析:先由电子排布式确定是何种元素,再分析判断。A项中的C和O可以形成CO2;B项中的S和O可以形成SO2;C项中的Mg 和F可以形成MgF2;D项中的F和O不能形成AB2型化合物。 答案:D 4.电子在一个原子的下列能级中排布时,最后一个排布的是() A.n s B.n p C.(n-1)d D.(n-2)f 解析:根据原子中能级的能量高低顺序:n s<(n-2)f<(n-1)d 兼职教师聘用合同 甲方(聘用单位):____________________________________ 法定代表人:_________________________________________ 乙方(受聘人):______________________________________ 甲乙双方本着友好合作精神,根据国家和本市有关法规、规定,按照自愿、平等、协商一致的原则,签订本合同。 第一条合同期限 1.合同有效期:自_______年_______月_______日至_______年_______月_______日止,甲方聘请乙方担任课程兼职任课教师,合同期满聘用关系自然终止。 2.聘用合同期满前一个月,经双方协商同意,可以续订聘用合同。 3.本合同期满后,任何一方认为不再续订聘用合同的,应在合同期满前一个月书面通知对方。 第二条甲方的权利 1.要求乙方提供身份证、学历证书以及职称资格证书的原件和复印件;组织乙方参加受聘前的面试,面试通过后方可允许乙方上岗。 2.要求乙方的正式受聘后的第一节课作为试讲课,甲方免付授课报酬。 3.要求乙方按教学计划按时完成授课,维护授课时的教学秩序,保证教学内容真实有效;于每次授课时要求乙方提供教案交予甲方。 4.组织学生对乙方的授课质量进行评议,并根据学生的评议结果制定整改措施。 5.根据自身情况对课时进行调整,对授课内容进行变更,但必须提前通知乙方。 6.要求并监督乙方遵守相关工作纪律,并对违规行为进行相应处理。 第三条甲方的义务 1.按时支付授课报酬:甲方在确定无教学质量方面的问题后,按每标准课时元作为授课报酬支付给乙方。无特殊情况,甲方需在次月15号支付乙方每月的授课报酬。 2.向乙方提供学生的背景资料,讲明授课要达到的目的,协助提供和授课 社会实践材料汇编文档排版要求 一、目录 “目录”两字方正粗宋简体二号 目录正文仿宋 GB2312 四号 二、文章 大标题方正粗宋简体小二 小标题方正粗宋简体三号 正文仿宋 GB2312 四号 段中大标题仿宋 GB2312 三号加粗 段中小标题仿宋 GB2312 四号号加粗 行距 1.5倍行距 段前段后均为0行 首行缩进 2字符 三、表格 表格标题仿宋 GB2312 小四号加粗 表格内容仿宋 GB2312 小四 表格备注仿宋 GB2312 小四 特殊表格可以横向打印,要求如上。 三、页边距 双面打印均为2.2厘米 注:正文分层时,不要使用自动生成模式(如:自动生成的(一)、(二)……);数字使用要求:依次为:一、(一) 1. (1); 汇编中报告字体要求亦如上。 报告格式要求 一、页面设置: 纸张大小:A4 纸张方向:纵向 页边距:双面打印,上、下、左、右均为2.2厘米 行距:1.5倍行距 二、各类标题 大标题:黑体小二,居中,加粗 副标题:宋体小三,居中 正文中各题头:宋体四号,加粗 数字标号题头:宋体小四,加粗 【摘要】、【关键字】都要顶格写 三、姓名及院系 姓名:写在副标题下面,且在前加□,宋体小三,居中 系别:用括号标注在姓名后面(与姓名同行),宋体小三,居中 四、正文 正文:宋体小四,首行缩进2字符 图表:须美观大方,注明图或表 表格标题宋体五号加粗 表格内容宋体小四号 表格备注宋体小四号 特殊表格可以横向打印,要求如上。注意:表格的标题(即表头)写在表格的上方。 共青团湖北师范学院委员会实践部制 调查报告参考文献具体格式 一、参考文献的类型 根据 GB3469-83《文献类型与文献载体代码》规定,以单字母标识: M——专著(含古籍中的史、志论著 C——论文集 N——报纸文章 J——期刊文章 D——学位论文 R——研究报告 S——标准 P——专利 A——专著、论文集中的析出文献 Z——其他未说明的文献类型 电子文献类型以双字母作为标识: DB——数据库 CP——计算机程序 EB——电子公告 非纸张型载体电子文献,在参考文献标识中同时标明其载体类型: DB/OL——联机网上的数据库 DB/MT——磁带数据库 M/CD——光盘图书 CP/DK——磁盘软件 J/OL——网上期刊 EB/OL——网上电子公告 二、具体范例 1、专著、论文集、学位论文、报告 [序号]主要责任者.文献题名[文献类型标识].出版地:出版者,出版年.起止页码(任选). 注意:[序号]+作者+标点为英文输入法下的圆点+参考文章的名称+中括号中注明文章类型+圆点+空格+出版地址+冒号+出版社名称+逗号+出版时间+圆点。文章作者有多个的,中间用逗号隔开,出版社名称和出版时间用逗号隔开。 [1]刘国钧,陈绍业,王凤翥. 图书馆目录[M]. 北京:高等教育出版社,1957.15-18. [2]辛希孟. 信息技术和信息服务国际研讨会论文集:A集[C]. 北京:中国社会科学出版社,1994. [3]张筑生. 微分半动力系统的不变集[D]. 北京:北京大学数学系数学研究所,1983. [4]冯西桥. 核反应堆压力管道和压力容器的LBB分析[R]. 北京:清华大学核能技术设计研究院,1997. [5] Gill,R. Mastering English Literature[M] . London: Macmillan,1985. 培训机构教师合同范本 甲方: 乙方: 甲乙双方本着友好合作精神,根据国家和本市有关法规、规定,按照自愿、平等、协商一致的原则,签订本合同。 第一条合同期限 1.合同有效期:自_______年_______月_______日至_______年_______月_______日止,合同期满聘用关系自然终止。 2.聘用合同期满前一个月,经双方协商同意,可以续订聘用合同。 3.本合同期满后,任何一方认为不再续订聘用合同的,应在合同期满前一个月书面通知对方。 第二条乙方的权利 (小学、初中、高中一对一)按约定取得、、人民币次课的授课报酬;(小学、初中小班教学)按约定取得、人民币次课的授课报酬。 周一到周五的托管班工资方案:以月为单位,每月基本工资,另外每位同学(第一个月每位老师限带10人,从第二个月起按个人教学能力增加学生人数) 注明: 1、每次课两个小时。 2、小学生期中或期末考试每位同学达到90分以上者,每次课的课时费增加2元(一对一学生增加5元)初中生达到A线者每次课增加3元课时费,个别学生另作要求。 3、托管班的学生下个月续费者奖励5元每人,流失一个罚款。 4、工作满一年者每个月基本工资增加一百。 5、小班学生以六个为基准,学生每多出一个人,每次课的 课时费增加5元。特别情况另行通知,达到双方意见统一。 6、学生试课成功,在交费的第一时间将奖励该老师人。 第三条乙方的义务 1.为甲方的授课积极准备教案(每周四晚上之前将本周末上课内容发送给甲方);按时到岗、认真上课;保证每次课时(45分钟节课)的完整,内容的充实;对学生进行考勤及纪律管理。 2.甲方提出的其它合理要求,例如:课后对有关上课内容的询问解答等。 3.遵守甲方的各项规章制度和劳动纪律。 第四条甲方的权利 1.要求乙方按教学计划按时完成授课,维护授课时的教学秩序,并提供最终考试成绩等。 2.组织学生对授课质量进行评议,并根据学生的评议对授课内容及人员进行调整。 3.有权根据自身情况对课时进行调整,对授课内容进行变更, 第一节晶体的常识 学业要求素养对接 1.能说出晶体与非晶体的区别。 2.能结合实例描述晶体中微粒排列的周期性 规律。 3.认识简单的晶胞。 微观探析:晶体与非晶体的区别。 模型认知:晶胞的判断与相关计算。 [知识梳理] 一、晶体 1.晶体与非晶体的本质差异 自范性微观结构 晶体有原子在三维空间里呈周期性有序排列 非晶体无原子排列相对无序 2.获得晶体的三条途径 (1)熔融态物质凝固。 (2)气态物质冷却不经液态直接凝固(凝华)。 (3)溶质从溶液中析出。 3.晶体的特点 (1)自范性: ①定义:晶体能自发地呈现多面体外形的性质。 ②形成条件:晶体生长的速率适当。 ③本质原因:晶体中粒子在微观空间里呈现周期性的有序排列。 (2)各向异性:某些物理性质常常会表现出各向异性。 (3)晶体有固定的熔点。 (4)外形和内部质点排列的高度有序性。 【自主思考】 1.区分晶体与非晶体的最可靠的方法是什么? 提示最可靠的方法是对固体进行X-射线衍射实验。 二、晶胞 1.概念 晶胞是描述晶体结构的基本单元。 2.结构 习惯采用的晶胞都是平行六面体,晶体是由无数晶胞“无隙并置”而成。 (1)“无隙”:相邻晶胞之间没有任何间隙。 (2)“并置”:所有晶胞都是平行排列的,取向相同。 (3)所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。 3.晶胞中微粒数目的计算 (1)平行六面体(立方体形)晶胞中微粒数目的计算。 ①晶胞的顶角原子是8个晶胞共用; ②晶胞棱上的原子是4个晶胞共用; ③晶胞面上的原子是2个晶胞共用。 如金属铜的一个晶胞(如图所示)均摊到的原子数为8×1 8 +6× 1 2 =4。 (2)几种晶胞中原子数目的确定。 结合下图,钠、锌、碘、金刚石晶胞中含有原子的数目分别为2、2、8、8。 【自主思考】 2.晶胞是否全是平行六面体? 提示不一定,如有的晶胞呈六棱柱形。 3.由晶胞构成的晶体,其化学式是否表示一个分子中原子的数目? 提示不表示,只表示每个晶胞中各类原子的最简整数比。 [自我检测] 第一单元 分子构型与物质的性质 第1课时 分子的空间构型目标与素养:1.能准确判断共价分子中中心原子的杂化轨道类型,能用杂化轨道理论和价层电子对理论判断分子的空间构型。(宏观辨识与微观辨析)2.利用“等电子原理”推测分子或离子中中心原子的杂化轨道类型及空间构型。(证据推理与模型认知) 一、杂化轨道理论与分子的空间构型 1.sp3杂化与CH4分子的空间构型 (1)杂化轨道的形成 碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”,形成能量相等、成分相同的4个sp3杂化轨道。 (2)sp3杂化轨道的空间指向 碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。 (3)共价键的形成 碳原子的4个sp3杂化轨道分别与4个H原子的1s轨道重叠形成4个相同的σ键。 (4)CH4分子的空间构型 CH4分子为空间正四面体结构,分子中C—H键之间的夹角都是109.5°。 (1)杂化轨道数与参与杂化的原子轨道数相同,但形状不同。 (2)杂化轨道为使相互间的排斥力最小,故在空间取最大夹角分布,不同的杂化轨道伸展方向不同。 (3)杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对。 (4)未参与杂化的p轨道,可用于形成π键。 2.sp2杂化与BF3分子的空间构型 (1)sp2杂化轨道的形成 硼原子2s轨道上的1个电子进入2p轨道。1个2s轨道和2个2p轨道发生杂化,形成能量相等、成分相同的3个sp2杂化轨道。 (2)sp2杂化轨道的空间指向 硼原子的3个sp2杂化轨道指向平面三角形的三个顶点,3个sp2杂化轨道间的夹角为120°。 (3)共价键的形成 硼原子的3个sp2杂化轨道分别与3个氟原子的1个2p轨道重叠,形成3个相同的σ键。 (4)BF3分子的空间构型 BF3分子的空间构型为平面三角形,键角为120°。 3.sp杂化与BeCl2分子的空间构型 (1)杂化轨道的形成 Be原子2s轨道上的1个电子进入2p轨道,1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的2个sp杂化轨道。 (2)sp杂化轨道的空间指向 两个sp杂化轨道呈直线形,其夹角为180°。 选修3知识点总结 第一章原子结构与性质 一.原子结构 1.能级与能层 2.原子轨道 3.原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 记忆方法有哪些? 能级交错:由构造原理可知,电子先进入4s 轨道,后进入3d 轨道,这种现象叫能级交错。 说明:构造原理并不是说4s 能级比3d 能级能量低(实际上4s 能级比3d 能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。 (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。比如,p3的轨道式为 或,而不是。 洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。即p 0、d 0、f 0、p3、d 5、f 7、p 6、d 10、f 14时,是较稳定状态。 前36号元素中,全空状态的有4Be 2s 22p 0、12Mg 3s 23p 0、20Ca 4s 23d 0;半充满状态的有: 7N 2s 22p 3、15P 3s 23p 3、24Cr 3d 54s 1、25Mn 3d 54s 2、33As 4s 24p 3;全充满状态的有10Ne 2s 22p 6 、18Ar 3s 23p 6、29Cu 3d 104s 1、30Zn 3d 104s 2、36Kr 4s 24p 6 。 4. 基态原子核外电子排布的表示方法 (1)电子排布式 ①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s 22s 22p 63s 23p 64s 1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K :[Ar]4s 1。 ③外围电子排布式(价电子排布式) (2)电子排布图(轨道表示式)是指将过渡元素原子的电子排布式中符合上一周期稀有气体的原子的电子排布式的部分(原子实)或主族元素、0族元素的内层电子排布省略后剩下的式子。 每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。 如基态硫原子的轨道表示式为 举例: ↑↓ ↑ ↓ ↓ ↓ ↑ ↑ ↑ 第3课时溶解性手性无机含氧酸分子的酸性 [学习目标定位] 1.能够根据“相似相溶”规律分析物质在不同溶剂中的溶解性的变化。2.认识手性异构体和手性分子,会判断手性碳原子。3.学会常见无机含氧酸酸性的判断方法。 一、溶解性 1.“相似相溶”规律 非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。 2.影响物质溶解性的因素 (1)外界条件——温度、压强等。 (2)分子结构——“相似相溶”规律。 (3)氢键——如果溶质与溶剂之间能形成氢键,则溶解度增大。 (4)反应——溶质与水发生反应时可增大其溶解度,如SO2与H2O反应生成H2SO3,NH3与H2O反应生成NH3·H2O等。 “相似相溶”规律的应用 根据“相似相溶”规律,可以判断溶质在溶剂中的溶解度的大小、萃取剂的选择、以及物质之间分离提纯方法的确立。 例1碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为() https://www.360docs.net/doc/2b7292448.html,l4和I2都不含氢元素,而H2O中含有氢元素 https://www.360docs.net/doc/2b7292448.html,l4和I2都是非极性分子,而H2O是极性分子 https://www.360docs.net/doc/2b7292448.html,l4与I2都是直线形分子,而H2O不是直线形分子 https://www.360docs.net/doc/2b7292448.html,l4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大 【考点】溶解性 【题点】依据“相似相溶”规律比较物质的溶解性 答案 B 解析CCl4和I2都是非极性分子,而H2O是极性分子,根据“相似相溶”规律可知碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,与相对分子质量、是否是直线形分子、是否含有氢元素等没有直接的关系,B正确。 二、手性 1.概念 (1)手性异构体:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称为手性异构体。 (2)手性分子:具有手性异构体的分子叫做手性分子。 2.手性分子的判断 (1)判断方法:有机物分子中是否存在手性碳原子。 (2)手性碳原子:有机物分子中连有四个各不相同的原子或原子团的碳原子。如,R1、R2、R3、R4互不相同,即*C是手性碳原子。 手性分子的理解 (1)手性同分异构体(又称对映异构体、光学异构体)的两个分子互为镜像关系,即分子形式的“左撇子和右撇子”。 (2)构成生命体的有机物绝大多数为手性分子。两个手性分子的性质不同,且手性有机物中必定含手性碳原子。 例2当一个碳原子连接四个不同的原子或原子团时,该碳原子叫“手性碳原子”。下列化合物中含有两个手性碳原子的是() A. B. C. D. 【考点】手性分子 【题点】手性碳原子的判断 答案 C 解析由题意可知,A项、B项与D项中各有1个手性碳原子;C项中有2个手性碳原子。 高中化学选修三第三章晶体结构与性质 一、晶体常识 1、晶体与非晶体比较 2、获得晶体的三条途径 ①熔融态物质凝固。 ②气态物质冷却不经液态直接凝固(凝华)。 ③溶质从溶液中析出。 3、晶胞 晶胞是描述晶体结构的基本单元。晶胞在晶体中的排列呈“无隙并置”。 4、晶胞中微粒数的计算方法——均摊法 某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。中学常见的晶胞为立方晶胞。 立方晶胞中微粒数的计算方法如下: ①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8 ②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4 ③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2 ④晶胞内部粒子为1个晶胞独自占有,即为1 注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。 二、构成物质的四种晶体 1、四种晶体的比较 晶体类型分子晶体原子晶体金属晶体离子晶体熔沸点很低很高一般较高,少部分低较高 溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等 与水反应) 大多易溶于水等 极性溶剂 导电传热性一般不导电,溶于水 后有的导电 一般不具有导电 性(除硅) 电和热的良导体 晶体不导电,水溶 液或熔融态导电 延展性无无良好无 物质类别及实例气态氢化物、酸(如 HCl、H2SO4)、大多数 非金属单质(如P4、 Cl2)、非金属氧化物 (如SO2、CO2,SiO2 除外)、绝大多数有机 物(有机盐除外) 一部分非金属单 质(如金刚石、硅、 晶体硼),一部分 非金属化合物(如 SiC、SiO2) 金属单质与合金(Na、 Mg、Al、青铜等) 金属氧化物(如 Na2O),强碱(如 NaOH),绝大部分 盐(如NaCl、CaCO3 等) (1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。 金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。 (2)原子晶体 由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅 (3)离子晶体 一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。 (4)分子晶体 ①分子间作用力越大,物质熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。 ②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。 ③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,熔、沸点越高。 ④同分异构体,支链越多,熔、沸点越低。 (5)金属晶体 金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。 三、几种典型的晶体模型 晶体晶体结构示意图晶体中粒子分布详解 CsCl 晶体每8个Cs+、8个Cl-各自构成立方体,在每个立方体的中心有一个异种粒子(Cs+或Cl-)。在每个Cs+周围最近的等距离(设为a/2)的Cl-有8个,在每个Cs+周围最近的等距离(必为a)的Cs+有6个(上下左右前后),在每个Cl-周围最近的等距离的Cl-也有6个 2016-2017学年度第一学期 教室装扮大赛 材 料 汇 编 主办:共青团鞍山师范学院 化学与生命科学学院委员会 承办:化学与生命科学学院宣传部 2016年10月25日 目录1········································································活动申请书2········································································安全预案3········································································活动策划书 4········································································人员名单5········································································活动心得6········································································活动总结 鞍山师范学院教室装扮大赛活动申请表 2016-2017学年度第一学期化学与生命科学学院 宣传部主题活动 安 全 预 案 主办:共青团鞍山师范学院 化学与生命科学学院委员会承办:化学与生命科学学院宣传部 2016年10月19日 1.下列说法中,正确的是() A.冰融化时,分子中H—O键发生断裂 B.原子晶体中,共价键越强,熔点越高 C.分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高 D.分子晶体中,分子间作用力越大,该物质越稳定 解析:A项,冰为分子晶体,融化时破坏的是分子间作用力,故A项错误;B项,原子晶体熔点的高低取决于共价键的强弱,共价键越强,熔点越高,故B项正确;C项,分子晶体熔、沸点的高低取决于分子间作用力的大小,而共价键的强弱决定了分子的稳定性大小,所以C项错误,D项也错误。故选B。 答案:B 2.SiCl4的分子结构与CCl4相似,对其进行下列推测,不正确的是() A.SiCl4晶体是分子晶体 B.常温、常压下,SiCl4是气体 C.SiCl4的分子是由极性键形成的非极性分子 D.SiCl4的熔点高于CCl4 解析:由于SiCl4具有分子结构,所以属于分子晶体。影响分子晶体熔、沸点的因素是分子间的作用力,在这两种分子中都只有范德华力,SiCl4的相对分子质量大于CCl4的相对分子质量,所以SiCl4的分子间作用力,熔、沸点比CCl4高。CCl4的分子是正四面体结构, SiCl4与它结构相似,因此也是正四面体结构,是含极性键的非极性分子。 答案:B 3.(双选题)下列性质符合分子晶体特点的是() A.熔点1 070 ℃,易溶于水,水溶液能导电 B.熔点10.31 ℃,液态不导电,水溶液能导电 C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃ D.熔点97.81 ℃,质软,导电,密度为0.97 g/cm3 解析:本题考查分子晶体的性质。分子晶体中分子之间是以分子间作用力相结合的,分子晶体具有低熔点、易升华、硬度小等性质。A项熔点高,不是分子晶体的性质;D项能导电,不是分子晶体的性质,该项所述是金属钠的性质。故选BC。 答案:BC 4.(双选题)下列关于原子晶体的说法中错误的是() A.原子晶体中不存在独立的“分子” B.原子晶体中所有原子之间以共价键结合成空间网状结构 C.金刚石是原子晶体,所以其化学性质稳定,即使在高温下也不与氧气发生反应 D.原子晶体中必须有共价键,可能存在分子间作用力 解析:原子晶体中原子之间以共价键结合形成空间网状结构,故原子晶体中不存在单独的“分子”;由原子晶体的定义可知,原子晶体中只有共价键,不存在分子间作用力。碳的化学性质不活泼,但在 第一章原子结构与性质 一.原子结构 1.能级与能层 2.原子轨道 3.原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。 说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。 (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。换言之, 一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。比如,p3的轨道式 为或 ,而不是。 洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。 前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。 4. 基态原子核外电子排布的表示方法 (1)电子排布式 ①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K :[Ar]4s1。 (2)电子排布图(轨道表示式) 每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。 如基态硫原子的轨道表示式为 二.原子结构与元素周期表 1.原子的电子构型与周期的关系 (1)每周期第一种元素的最外层电子的排布式为ns1。每周期结尾元素的最外层电子排布式除He 为1s2外,其余为ns2np6。He 核外只有2个电子,只有1个s 轨道,还未出现p 轨道,所以第一周期结尾元素的电子排布跟其他周期不同。 (2)一个能级组最多所容纳的电子数等于一个周期所包含的元素种类。但一个能级组不一定全部是能量相同的能级,而是能量相近的能级。 2.元素周期表的分区 (1)根据核外电子排布 ①分区 ②各区元素化学性质及原子最外层电子排布特点 ↑↓ ↑ ↓ ↓ ↓ ↑ ↑ ↑ 第一章原子结构与性质 一.原子结构 1.能级与能层 注意: 每个能层的能级种数为n;轨道总数为n2 ;每个轨道最多容纳电子数为2 每个能层最多容纳电子数为2n2 2.原子轨道:不同能级上的电子出现概率约为90%的电子云空间轮廓图称为原子轨道 3.原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按能量由低到高的顺序填入核外电子运动轨道(能级),叫做构造原理。 1s / 2s 2p / 3s 3p / 4s 3d 4p / 5s 4d 5p / 6s 4f 5d 6p / 7s 5f 6d 7p 能级交错:原子轨道的能量关系是:n s<(n-2)f<(n-1)d<n p 【能级组:n s (n-2)f (n-1)d n p;一个能级组中的各能级能量相近但不同】 (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 基态原子:处于最低能量状态的原子激发态原子:处于能量较高状态的原子 基态原子可以吸收能量使核外电子跃迁到较高能级变成激发态,形成吸收光谱 激发态原子也可释放能量使核外电子跃迁到较低能级变成低能激发态或基态,形成发射光谱 现代化学中常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 (焰火、激光、灯光、霓虹灯光、焰色反应等许多可见光都与核外电子跃迁释放能量有关) (3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特规则。比如,p3的轨道式为 或,而不是 洪特规则特例:当p、d轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。即p0、d0、p3、d5、p6、d10时,是较稳定状态。 前36号元素全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18 Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。 4. 基态原子核外电子排布的表示方法 (1) 电子排布式: ①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如 19K:1s22s22p63s23p64s1 ①简化的电子排布式:把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如19K:[Ar]4s1 12Mg:[Ne]3S2 (2) 电子排布图(轨道表示式) 每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。如基态硫原子轨道表示式 (3)价电子排布式或轨道表示式 ①主族元素:只需表示出最外层的电子(如Na:3s1;Cl:3s23p5) ②第四周期的过渡元素:要写出3d和4s两个能级的电子排布(如Fe:3d64s2)。 二.原子结构与元素周期表 1.元素周期表的分区:除ds外,区的名称来自按构造原理最后填入电子的能级符号。 ↑↓↑ ↓↓↓ ↑↑↑ 高中化学第三章第四节离子晶体讲义含解析新人教版选 修3061317 离子晶体 1.了解离子晶体的结构特点。 2.能根据离子晶体的结构特点解释其物理性质。 3.了解晶格能的定义及应用。 细读教材记主干 1.什么是离子键?其成键微粒有哪些? 提示:带相反电荷离子之间的相互作用叫作离子键,其成键微粒是阴、阳离子。 2.由离子键构成的化合物叫离子化合物;离子化合物一定含离子键,可能含共价键,含离子键的化合物一定是离子化合物。 3.离子晶体是由阴、阳离子通过离子键结合而成的晶体。决定离子晶体结构的重要因素有:几何因素(正负离子的半径比),电荷因素(正负离子的电荷比),键性因素(离子键的纯粹程度)。 4.离子晶体硬度较大,难以压缩,具有较高的熔点和沸点,固体不导电,溶于水或在熔融状态下可以导电。 [新知探究] 1.概念 由阳离子和阴离子通过离子键结合而成的晶体。 (1)构成粒子:阳离子和阴离子。 (2)作用力:离子键。 2.决定晶体结构的因素 3.离子晶体的性质 熔、沸点熔、沸点较高,难挥发 硬度硬度较大,难以压缩 溶解性一般在水中易溶,在非极性溶剂中难溶 导电性固态时不导电,熔融状态或在水溶液中能导电 4.常见的离子晶体 晶体晶胞晶胞详解 NaCl ①在NaCl晶体中,Na+的配位数为6,Cl- 的配位数为6 ②与Na+(Cl-)等距离且最近的Na+(Cl-)有 12个 ③每个晶胞中有4个Na+和4个Cl- ④每个Cl-周围的Na+构成正八面体图形 续表 晶体晶胞晶胞详解 CsCl ①在CsCl晶体中,Cs+的配位数为8,Cl -的配位数为8 ②每个Cs+与6个Cs+等距离相邻,每个 Cs+与8个Cl-等距离相邻 CaF2 ①在CaF2晶体中,Ca2+的配位数为8,F- 的配位数为4 ②每个晶胞中含有4个Ca2+和8个F- 1.离子晶体中的“不一定” (1)离子晶体中不一定都含有金属元素,如NH4NO3晶体。 (2)离子晶体的熔点不一定低于原子晶体,如MgO的熔点(2 800 ℃)高于SiO2的熔点(1教育培训机构与老师签的合同
2013材料汇编、报告格式
培训机构教师合同范本
高中化学 第3章 第一节 晶体的常识讲义+精练(含解析)新人教版选修3
2019-2020同步苏教化学选修三新突破讲义:专题4 第1单元 第1课时 分子的空间构型
【人教版】高中化学选修3知识点总结
化学新人教选修三讲义:第二章第三节分子性质第3课时含答案
(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题
材料汇编模板
2017年人教版高中化学选修3讲义3-2
(完整word)化学选修三知识点,推荐文档
人教版化学选修三物质结构化学讲义
高中化学第三章第四节离子晶体讲义含解析新人教版选修3061317
