11 配位化合物及配位平衡习题解答

11配位化合物及配位平衡习题 (p368-369)参考解答
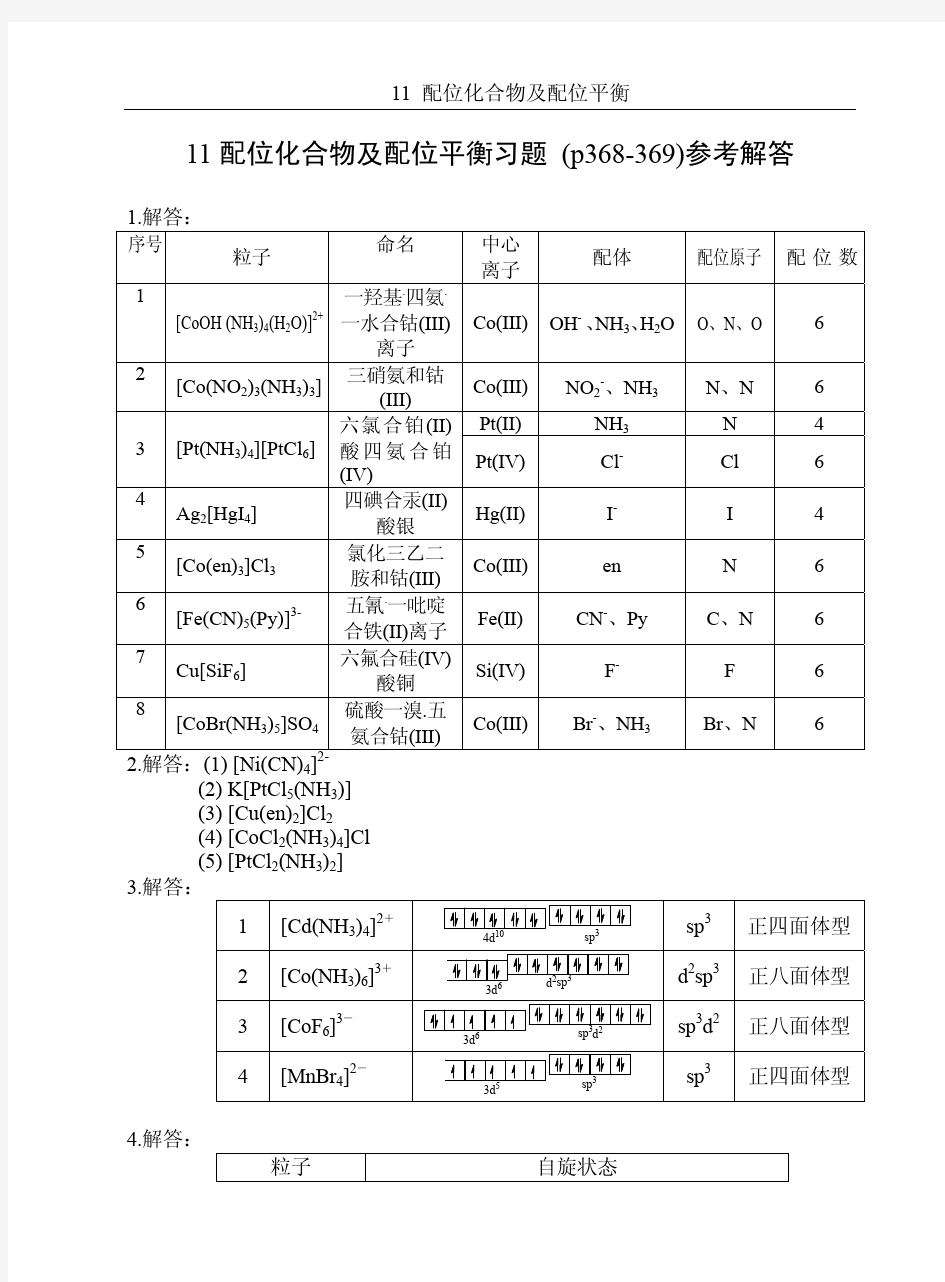
1.解答: 序号 粒子
命名
中心离子 配体 配位原子 配位数 1
[CoOH (NH 3)4(H 2O)]2+一羟基.四氨.
一水合钴(III)
离子
Co(III)OH - 、NH 3、H 2O O 、N 、O 6 2 [Co(NO 2)3(NH 3)3]
三硝氨和钴
(III) Co(III)NO 2-、NH 3
N 、N
6
Pt(II)NH 3N 4 3 [Pt(NH 3)4][PtCl 6]六氯合铂(II)
酸四氨合铂
(IV)
Pt(IV)Cl -Cl 6 4 Ag 2[HgI 4]
四碘合汞(II)
酸银
Hg(II)I -I 4
5 [Co(en)3]Cl 3
氯化三乙二
胺和钴(III)
Co(III)en N 6 6 [Fe(CN)5(Py)]
3-五氰.一吡啶合铁(II)离子
Fe(II)CN -、Py C 、N 6
7 Cu[SiF 6]
六氟合硅(IV)
酸铜
Si(IV)F - F 6 8 [CoBr(NH 3)5]SO 4
硫酸一溴.五
氨合钴(III) Co(III)
Br -、NH 3
Br 、N
6
2.解答:(1) [Ni(CN)4]2-
(2) K[PtCl 5(NH 3)] (3) [Cu(en)2]Cl 2
(4) [CoCl 2(NH 3)4]Cl (5) [PtCl 2(NH 3)2]
3.解答:
4.解答:
粒子
自旋状态
(1)Fe(en)22
+
高自旋 外轨型 (2)Mn(CN)64-
低自旋 内轨型 (3)K 3[Fe(CN)6]
低自旋 内轨型 (4)Pt(CN)42
-
低自旋 内轨型 5.解答:[Fe(H 2O)6]2
+:高自旋,2g 和e g 电子排布为:
磁矩:μ=
B.M 9.4
[Fe(CN)6]2
-:低自旋, t 2g 和e g 电子排布为:
磁矩为:μ=
B.M 06.解答: [Ag +
]= 4.0×10-7mol·L -17.解答:无AgI 沉淀生成。 8.解答: K θf =3.5×1012
9.解答: E θ
(AuCl 4-
/Au)= -1.04V
10.解答:;
117
3L mol 10
8.2]Al [??+?×=13-4L mol 104.1]AlF [???×=13-25L mol 101.7]AlF [???×=;
13-36L mol 104.1]AlF [???×=11.解答:(1) [Mg 2+]=6.2×10-5 mol ?L ?1; (2) [Mg 2+]=3.8×10-8mol ?L ?1 12.解答: L mol 107.3 [Y] -1-11?×=13.解答:lg c =7.75>6,可以标定。 θ/
ZnY K 14.解答:lg c =9.21>6,可以滴定。
θ/ZnY K 15.解答:=7.73>6,可以准确滴定。
θ/
CuY lg cK 16.解答:pH=6.00时不能直接滴定Mg 2+;pH min =9.66(此时基本不生成沉淀) 17.解答:(1)可进行分别滴定。(2)滴定Zn 2+适宜的pH 范围(3.97,6.38)。 18解答:(1)lg αZn =5.10; (2)lg K Zn'Y'= 10.95;
(3) mol ?L ?1 ; [Zn 2+]=6.4×10080.0][Zn /=-7mol ?L ?1
19.解答:(1)总硬度(CaCO 3)=
1
L mg 1.332??(2)Ca 含量(CaCO 3)=
1L mg 7.203??Mg 含量(MgCO 3)=
1L mg 2.97??20.解答: 结构组成 AgCl 沉淀质量
[CrCl 2(H 2O)4]Cl·2H 2O 53.83g [CrCl(H 2O)5]Cl 2·H 2O 107.7g [Cr(H 2O)6]Cl 3 161.5g
21.解答:(1) [Fe(OH)(H 2O)5]2+ no isomers
(2) [RuBr 2(NH 3)4]+ have 2
顺式-二溴·四氨合钌(III) 反式-二溴·四氨合钌(III)
(3) [Co(NH3)4(H2O)2]3+ have 2
顺式-四氨·二水合钴(III) 反式-四氨·二水合钴(III)
22.解答:顺式-二氯·二氨·二水合铬(III)结构式:
可能的异构体有:
其中(I)、(II)为反式二氨异构体。
23.解答:配体en比配体F-具有更强的场强,F-引起的中心离子Co3+d轨道分裂能小
于en引起的中心离子Co3+d轨道分裂能。所以电子在[CoF6-]3-的e g与t2g之间
跃迁需要的能量比[Co(en)3]3+的小,即[CoF6-]3-电子跃迁吸收的光波波长比
[Co(en)3]3+的长,[CoF6-]3-显示出的颜色对应的光波波长比[Co(en)3]3+的短
。所以黄色溶液应该是[Co(en)3]3+的溶液,而[CoF6-]3-溶液成蓝色。24.解答:(1) [CuBr4]2-、[Cu(H2O)6]2-
(2)正方形场配合物 [CuBr4]2-中心离子d轨道分裂能比八面体场
[Cu(H2O)6]2-配合物d轨道分裂能小,[Cu(H2O)6]2-的电子跃迁能大于
[CuBr4]2-,[Cu(H2O)6]2-显示的颜色波长大于[CuBr4]2-,[Cu(H2O)6]2-呈淡
蓝色,而[CuBr4]2-呈深紫色。
第十一章 配位化合物
第十一章配位化合物 一、选择题 1. 配位数为6的配离子的空间构型是: A、三角锥形 B、四面体形 C、平面四边形 D、八面体形 2. Fe(Ⅲ)形成的配位数为6 的内轨配合物中,Fe3+离子接受孤对电子的空轨道是: A、d2sp3 B、sp3d2 C、p2d4 D、sd5 3. 在[CoCl(NH3)3(en)]2+中,中心离子Co3+的配位数为: A、3 B、4 C、5 D、6 4. [Cr(en)3]2+离子中铬的配位数及配合物中配体的个数是: A、3,3 B、3,6 C、6,6 D、6,3 5. 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋或低自旋的电子构型是: A、d2 B、d3 C、d6 D、d9 6. 形成高自旋配合物的原因是: A、分裂能△< 电子成对能P B、分裂能△= 电子成对能P C、分裂能△> 电子成对能P D、不能只根据分裂能△和电子成对能P确定 7. 在[CoCl(NH3)3(en)]2+中,中心离子Co3+的配位数为: A、3 B、4 C、5 D、6 8. 对于配离子[Co(NH3)5H2O]3+,下列命名正确的是: A、一水五氨合钴(Ⅲ)离子 B、五氨一水合钴(Ⅲ)离子 C、氨一水合钴(Ⅲ)离子 D、五氨一水合钴离子 9. Ni(Ⅱ)形成的配位数为4具有四面体形的配合物中,Ni2+离子接受孤对电子的空轨道是: A、sp3 B、sp3d2 C、spd2 D、dsp2 10. 对于配离子[CoCl(NH3)3(en)]2+,下列命名正确的是: A、三氨一氯乙二胺合钴(Ⅲ)离子 B、一氯三氨乙二胺合钴(Ⅲ)离子 C、一氯乙二胺三氨合钴(Ⅲ)离子 D、乙二胺一氯三氨合钴(Ⅲ)离子 11. Co(Ⅱ)形成的配位数为6 的外轨配合物中,Co2+离子接受孤对电子的空轨道是: A、d2sp3 B、p2d4 C、s p2d3 D、sp3d2
《配位化合物与配位滴定法》习题答案
《配位化合物与配位滴定法》习题答案 9-1 命名下列配合物,并指出中心离子、配位体、配位原子和中心离子的配位数。 (1)[CoCl 2(H 2O)4]Cl (2)[PtCl 4(en)] (3)[Ni Cl 2(NH 3)2] (4)K 2[Co(SCN)4] (5)Na 2[SiF 6] (6)[Cr(H 2O)2(NH 3)4]2 (SO 4)3 (7)K 3[Fe(C 2O 4)3] (8)(NH 4)3[SbCl 6]·2H 2O 9-2 已知磁矩,根据价键理论指出下列配离子中中心离子的杂化轨道类型和配离子的空间构型。 (1)[Cd(NH 3)4]2+ (μ=0 B M) (2)[PtCl 4]2- (μ=0 B M) (3)[Mn(CN)6]4- (μ=1.73 B M) ( 4 ) [CoF 6]3- (μ=4.9 B M)
(5)[BF 4]- (μ=0 BM) (6)[Ag(CN)2]- (μ=0 B M) 9-3 解释下列名词 (1)配位原子 (2)配离子 (3)配位数 (4)多基(齿)配位体 (5)螯合效应 (6)内轨型和外轨型配合物 (7)高自旋和低自旋配合物 (8)磁矩 答:见教材。 9-4 选择适当试剂,实现下列转化。 Ag →AgNO 3→AgCl ↓→[Ag(NH 3)2]Cl →AgBr ↓→Na 3[Ag(S 2O 3)2]→AgI ↓→K[Ag(CN)2] →Ag 2S ↓ 答:转化路线: ↓?→???→?→?→???→?↓?→????→?↓?→???→?- - - - - ?S Ag ]K[Ag(CN)AgI ])O [Ag(S Na AgBr ]Cl )[Ag(NH AgCl AgNO Ag 22232323NH 32232233 S KCN I O S Br O H Cl HNO 要点:应记忆题给各常见配合物和沉淀物的稳定转化顺序。 9-11 用EDTA 标准溶液滴定金属离子M ,试证明在化学计量点时, (1)() ' 2 1MY pK pMY pM -= (2))(lg 2lg )(lg M c K MY c MY += 证明:
第八章配位平衡与滴定
第八章配位平衡与配位滴定法 一、选择题 1. 关于配合物,下列说法错误的是() A. 配体是一种可以给出孤对电子或π键电子的离子或分子 B .配位数是指直接同中心离子相结合的配体总数 C. 广义地讲,所有金属离子都可能生成配合物 D. 配离子既可以存在于晶体中,也可以存在于溶液中 2. 关于外轨型与内轨型配合物的区别,下列说法不正确的是() A. 外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大 B. 中心离子轨道杂化方式在外轨型配合物是ns、np、nd轨道杂化,内轨型配合物是(n-1)d、ns、np轨道杂化 C. 一般外轨型配合物比内轨型配合物键能小 D. 通常外轨型配合物比内轨型配合物磁矩小 3. 当下列配离子浓度及配体浓度均相等时,体系中Zn2+离浓度最小的是() A.Zn(NH3)42+ B. Zn(en)22+ C. Zn(CN)42- D. Zn(OH)42- 4. Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe3+离子接受孤对电子的空轨道是() A. d2sp3 B. sp3d2 C. p3d3 D. sd5 5.下列配离子能在强酸性介质中稳定存在的是() A.Ag(S2O3)23-B.Ni(NH3)42+C.Fe(C2O4)33-D.HgCl42- 6. 测得Co(NH3)63+的磁矩μ=0B.M,可知Co3+离子采取的杂化类型为( ) A.d2sp3 B.sp3d2 C.sp3 D. dsp2 7.下列物质具有顺磁性的是() A.Ag(NH3) +B.Fe(CN)64-C.Cu(NH3)42+D.Zn(CN)42- 8.下列物质中,能作为螯合剂的为( ) A. HO-OH B. H2N-NH2 C. (CH3)2N-NH2 D. H2N-CH2-CH2-NH2 9. 在[RhBr2(NH3)4]+中,Rh的氧化数和配位数分别是() A.+2和4 B.+3和6 C. +2和6 D. +3和4 10.Cu(en)22+的稳定性比Cu(NH3)42+大得多,主要原因是前者() A. 配体比后者大 B.具有螯合效应
第七章 配位化合物要点
第七章 配位化合物 一、单项选择题 1. 下列物质中不能作为配体的是 ( B ) A. NH 3 B. NH 4+ C. OH - D. NO 2- 2. 下列离子或化合物中,具有顺磁性的是 ( B ) A. Ni(CN)- 24 B. CoCl - 24 C. Co(NH 3)+ 36 D. Fe(CO)5 3.在配合物[Co(NH 3)4(H 2O)]2(SO 4)3中,中心离子的配位数为 ( B ) A. 4 B. 5 C. 9 D. 12 4. 配离子[Co(NH 3)6]2+的空间构型为 ( A ) A. 八面体 B. 四方锥形 C. 四面体 D. 三角双锥 5. EDTA 是四元弱酸,当其水溶液pH ≥ 12时,EDTA 的主要存在形式为 ( C ) A. H 4Y ; B. H 3Y -; C. Y 4-; D. HY 3- 6.下列关于价键理论对配合物的说法正确的是 ( C ) A. 任何中心离子与任何配体都可形成外轨型化合物; B. 任何中心离子与任何配体都可形成内轨型化合物; C. 中心离子用于形成配位键的原子轨道是经过杂化的等价轨道; D. 以sp 3d 2和d 2sp 3杂化轨道成键的配合物具有不同的空间构型。 7.下列物质中能被氨水溶解的是 ( B ) A. Al(OH)3 B. AgCl C. Fe(OH)3 D. AgI 8. 下面哪一个不属于EDTA 与金属离子形成螯合物的特点 ( B ) A. 具有环状结构 B . 稳定性差 C. 配位比一般为1:1 D. 易溶于水 9. 下列说法欠妥的是: ( C ) A. 配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。 B. 螯合物以六员环、五员环较稳定。 C. 配位数就是配位体的个数。 D. 二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。 10. AgCl 在11mol L -?氨水中比在纯水中的溶解度大,其原因是 ( B ) A. 盐效应 B. 配位效应 C. 酸效应 D. 同离子效应 11. 离子以dsp 2杂化轨道成键而形成的配合物,其空间构型是 ( A ) A. 平面正方形 B. 四面体形 C. 直线形 D. 八面体形 12. 22Cu(en)+的稳定性比234Cu(NH )+ 大得多, 主要原因是前者 ( B ) A. 配体比后者大; B. 具有螯合效应; C. 配位数比后者小; D. en 的分子量比NH 3大。 13. Al 3+与EDTA 形成 ( A ) A. 鳌合物 B. 聚合物 C. 非计量化合物 D. 夹心化合物 14.下列说法中错误的是 ( D ) A. 配体的配位原子必须具有孤电子对。 B. 配离子的配位键愈稳定,其稳定常数愈大。 C. 配合物的颜色最好用晶体场或配位场理论解释。 D. 配合物的颜色最好用价键理论来解释。 15. 下列几种物质中最稳定的是 ( A ) A. [Co(en)3]Cl 3 B. [Co(NH 3)6] (NO 3)3 C. [Co(NH 3)6]Cl 2 D. Co(NO 3)3
第11章 配位化合物(10)
第11章配位化合物 一.是非题(判断下列各项叙述是否正确,对的在括号中填“√ ”,错的填“×”)。 1.1 复盐和配合物就象离子键和共价键一样,没有严格的界限。() 1.2 Ni(NH3)2Cl2无异构现象,[Co(en)3]Cl3有异构体。 ()1.3 配离子 AlF63-的稳定性大于 AlCl63-。()1.4 已知[CaY]2-的Kθ为6.3×1018,要比[Cu(en)2]2+的Kθ= 4.0×1019小,所以后者更难离解。()1.5 MX2Y2Z2类型的化合物有 6 种立体异构体。()1.6 内轨配合物一定比外轨配合物稳定。()1.7 当CO作为配体与过渡金属配位时,证明存在“反馈π键”的证据之一是CO 的键长介于单键和双键 之间。()1.8 Fe3+和 X-配合物的稳定性随 X-离子半径的增加而降低。()1.9 HgX4-的稳定性按 F-??→I-的顺序降低。()1.10 CuX2-的稳定性按的 Cl-??→Br-??→I-??→CN-顺序增加。()
二.选择题(选择正确答案的题号填入) 2. 1 根据晶体场理论,在一个八面体强场中,中心离子 d 电子数为()时,晶体场稳定化能最大。 a. 9 b. 6 c. 5 d. 3 2. 2 下列各配离子中,既不显蓝色有不显紫色的是() a. Cu(H2O)24+ b. Cu(NH3)24+ c. CuCl24+ d. Cu(OH)24+ 2. 3 下列化合物中,没有反馈π键的是() a. [Pt(C2H4)Cl3]- b. [Co(CN)6]4- c. Fe(CO)5 d. [FeF6]3-
2. 4 在下列锰的化合物中,锰的氧化数最低的化合物是 () a. HMn(CO)5 b. Mn(NO)3(CO) c. Mn2(CO)10 d. CH3Mn(CO)5 2. 5 下列离子中配位能力最差的是() a. ClO4- b. SO24- c. PO34- d. NO3- 2. 6 M位中心原子,a, b, d 为单齿配体。下列各配合物中有顺反异构体的是() a. Ma2bd(平面四方) b. Ma3b c. Ma2bd(四面体) d. Ma2b(平面三角形) 2. 7 Ag(EDTA)3-中银的配位数是() a. 1
配位反应及配位滴定法
第九章 配位反应及配位滴定法 配位化合物简称配合物,是一类组成比较复杂的化合物,它的存在和应用都很广泛。生物体的金属元素多以配合物的形式存在。例如叶绿素是镁的配合物,植物的光合作用靠它来完成。又如动物血液中的血红蛋白是铁的配合物,在血液中起着输送氧气的作用;动物体的各种酶几乎都是以金属配合物形式存在的。当今配合物广泛地渗透到分析化学、生物化学等领域。我国著名科学家光宪教授作了如下的比喻:把21世纪的化学比作一个人,那么物理化学、理论化学和计算化学是脑袋,分析化学是耳目,配位化学是心腹,无机化学是左手,有机化学和高分子化学是右手,材料科学是左腿,生命科学是右腿,通过这两条腿使化学科学坚实地站在目标的地坪上。配位化学是目前化学学科中最为活跃的研究领域之一。本章将介绍配合物的基本概念、结构、性质和在定量分析化学中的应用。 §9-1 配合物的组成与定义 一、配合物及其组成 例如在硫酸铜溶液中加入氨水,开始时有蓝色Cu 2(OH)2SO 4沉淀生成,当继续加氨水过量时,蓝色沉淀溶解变成深蓝色溶液。总反应为: CuSO 4 + 4NH 3 = [Cu(NH 3)4]SO 4 (深蓝色) 此时在溶液中,除SO 42-和[Cu(NH 3)4]2+外,几乎检查不出Cu 2+的存在。再如,在HgCl 2溶液 中加入KI ,开始形成桔黄色HgI 2沉淀,继续加KI 过量时,沉淀消失,变成无色的溶液。 HgCl 2 + 2KI = HgI 2↓+ 2KCl HgI 2 + 2KI = K 2[HgI 4] 象[Cu(NH 3)4]SO 4和K 2[HgI 4]这类较复杂的化合物就是配合物。配合物的定义可归纳为:由一个中心元素(离子或原子)和几个配体(阴离子或分子)以配位键相结合形成复杂离子(或分子),通常称这种复杂离子为配离子。由配离子组成的化合物叫配合物。在实际工作中一般把配离子也称配合物。由中心离子和配体以配位键结合成的分子,如[Ni(CO)4]、 [Co(NH 3)3Cl 3]也叫配合物。 在[Cu(NH 3)4]SO 4中,Cu 2+占据中心位置,称中心离子(或形成体);中心离子Cu 2+的围, 以配位键结合着4个NH 3分子,称为配体;中心离子与配体构成配合物的界(配离子),通常 把界写在括号;SO 42-被称为外界,界与外界之间是离子键,在水中全部离解。 [Cu (NH 3)4] SO 4 K 3[Fe(CN)6] ↑↑↑↑↑↑↑↑中心离子 中心离子配体配体配位数配位数外界内界 外界内界配合物 配合物 1.中心离子 配合物的核心,它一般是阳离子,也有电中性原子,如[Ni(CO)4]中的Ni 原子。中心离子绝大多数为金属离子特别是过渡金属离子。
第七章配位化合物
第七章 配位化合物 第一节 配合物的组成及命名 一、配合物的组成 1、配合物 配离子:由两种不同离子或一种离子与一种分子形成的复杂离子称之。 如:[]+ 23)(NH Ag 、[]+ 243)(NH Cu 、[]- 36)(CN Fe 、[]- 46)(CN Fe 配合物:含配离子的化合物。 如:[]Cl NH Ag 23)(、[]443)(SO NH Cu 、[]63)(CN Fe K 、[]64)(CN Fe K 有时也把配离子笼统称为配合物。 2、配合物的组成 配合物结构较复杂,但一般都有一个成分作为配合物的核心,其它部分围绕这一核心有规则地排列。 (1)中心离子(配合物的形成体):位于配合物中心的离子或原子。 多为具有空轨道的过渡元素的金属离子(d 区、s d 区)。 少数为高氧化数非金属原子,如:[]- 26SiF 、[]- 6PF 。 个别为中性原子,如:[]4)(CO Ni 、[]5)(CO Fe 。 (2)配位体 ★含义:与中心原子结合的分子或离子。多为含孤对电子的分子或离子。 如3NH 、O H 2、-Cl 、-CN 、- SCN 等。 ★分类:根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配体。 单齿配体:一个配位体只含一个配位原子。 多齿配体:一个配位体只含两个或两个以上的配位原子。 (3)配位原子:配位体中直接与中心离子结合的原子。配位原子大多为电负性较大的非金属原子,如:N 、O 、F 、 C 、S 、x 等。 (4)配位数: ★含义:直接与中心原子结合的配位原子数。 单齿配体:配位数=配位体数。 多齿配体:配位数=配位体数×一个配位体所含配位原子的个数(齿数)。如:[]+ 22)(en Pt
配位化合物与配位平衡
第七章配位化合物与配位平衡 7.7.11简答题 (1)配合物的条件稳定常数与绝对稳定常数有何不同? (2)酸效应曲线是怎样绘制的?它在配位滴定中有什么用途? (3)金属指示剂应具备什么条件? (4)提高配位滴定选择性的方法有哪些? (5)掩蔽干扰离子的方法有哪些?配位掩蔽剂、沉淀掩蔽剂应具备什么条件? 7.7.22填空题 (1)用EDTA滴定Ca2+、Mg2+时,可用________掩蔽Fe3+。 (2)用EDTA滴定Bi3+时,可用________掩蔽Fe3+。 (3)在Ca2+、Mg2+混合溶液中测定Ca2+,要消除Mg2+的干扰,应用________掩蔽法。 (4)用EDTA测定Al3+、Fe3+、Ca2+、Mg2+混合溶液中的Al3+、Fe3+,最简单的方法是________。在pH=2时,直接滴定________;在pH=4~6时用________滴定法测定Al3+。 (5)配位滴定的方式有________。SO42-、PO43-、Li+、Na+等一般可采用________;与EDTA反应慢、本身又易水解或封闭指示剂的金属离子可用________;虽与EDTA形成稳定配合物,但缺少变色敏锐的指示剂的金属离子用________;测定锡青铜合金中锡含量时用________。 7.3有一钴配合物,其百分组成分别如下:O23.2%,S11.6%,Cl13.0%,H5.4%,N25.4%,该配合物的水溶液与AgNO3溶液相遇不产生沉淀,但与BaCl2溶液反应生成白色的BaSO4沉淀,它与稀碱溶液无反应,写出此配合物的化学式。 7.4试计算并比较标准状态下[Ag(NH3)2]+、[Ag(CN)2]-、[Ag(S2O3)2]3-氧化能力的相对强弱。 7.5计算AgCl在1升0.1mol·L-1NH3·H2O中的溶解度。问100克AgCl能否全部溶解在1升1mol·L-1的氨水中? 7.7.660.020mol·L-1的Cu2+溶液100mL与0.28mol·L-1氨水100mL相混合,求溶液中Cu2+的浓度为多少? 7.7计算pH=5.0时,ZnY2-的条件稳定常数。假设Zn2+与EDTA的浓度均为0.010mol·L-1,问pH=5.0时,能否用EDTA溶液准确滴定Zn2+? 7.8试求以EDTA滴定浓度各为0.01mol·L-1的Fe3+和Fe2+溶液时所允许的最高酸度(最低pH)。 7.9在0.10mol·L-1[Ag(NH3)2]+溶液中,含有1.0mol·L-1游离氨,求溶液中Ag+的浓度。 7.10设溶液中含有浓度均为0.010mol·L-1的Pb2+、Bi3+两种离子,问能否利用控制酸度的方法单独滴定Bi3+,而Pb2+不干扰。 7.11请拟订用EDTA测定Bi3+、Al3+、Pb2+、Mg2+混合溶液中Pb2+离子含量的简要方案。 7.12如何利用掩蔽和解蔽的方法测定Co2+、Cd2+、Mg2+混合溶液中各组分的含量? 7.13称取0.5000克的煤试样,灼烧并使其中的硫完全氧化成为SO42-。处理成溶液并除去重金属离子后,加入0.05000mol·L-1BaCl220.00mL使之生成BaSO4沉淀。过量的Ba2+用0.02500 mol·L-1EDTA滴定,用去20.00mL,计算煤中硫的百分含量。 7.14水的硬度有用mg·L-1CaO表示的,还有用硬度数表示的(每升水中含10mgCaO为1
(完整版)配位平衡和配位滴定法
配位平衡和配位滴定法自测题 一.填空题 1. 钴离子Co3+和4个氨分子、2个氯离子生成配离子,它的氯化盐的分子式为_______________ , 叫做 ____________ 。 2. 溴化一氯三氨二水合钴(山)的内界为______________ ,外界为_____________ 。 3. 四氯合铂(II)酸四氨合铜(II)的化学式为______________ 。 4. 在[RhBr 2(NH3)2]+中,Rh的氧化态为______________ ,配位数为______________ 。 5. K[CrCI 4(NH3)2]的名称是__________ ,Cr的氧化数是 __________ ,配位数是 __________ < 6. 配离子[PtCI(NO 2)(NH 3)4]2+中,中心离子的氧化数为_____________ ,配位数为 _________ 该化合物的名称为 _________________ 。 7. 螯合物是由 __________ 和__________ 配位而成的具有环状结构的化合物。 8. 在[Ag(NH 3)2]NO3溶液中,存在下列平衡:Ag+ + 2NH 3 = [Ag(NH 3)2]+。(1)若向溶液中力口 入HCI,则平衡向 _______ 移动;(2)若向溶液中加入氨水,则平衡向____________ 移动。 9. [PtCI(NO 2)(NH3)4]CO3名称为_________________ ,中心离子的氧化数为_______ ,配离子 的电荷数为 ________ 。 10. KCN为剧毒,而K4[Fe(CN)6]无毒,这是因为__________________________ 。 11. 金属离子M溶液的pH值增大时,副反应系数Y(H) _________________ ,M(OH) ________________ , 条件稳定常数K MY,的变化趋势是 _________________ 。 12. 配位滴定中,若金属离子的原始浓度为0.01 mol/L,且以目视观察指示剂颜色变化的方 式确定终点,只有当 _____________ ,才能进行准确滴定(误差小于0.1%)。 13. 由于EDTA分子中含有___________ 和 _______ 两种配位能力很强的配位原子,所以它能 和许多金属离子形成稳定的_________________ 。 14. 配位滴定所用的滴定剂本身是弱酸或弱碱,容易给出或接受质子,因此试液的酸度引起 滴定剂的副反应是严重的。这种由于__________ 离子的存在,而使配体参与 ______ 反应能力降低的现象被称为酸效应。 15. EDTA酸效应曲线图中,金属离子位置所对应的pH值,就是滴定这种金属离子所允许 的 ________________ 。 16. 配位滴定的直接滴定过程中,终点时试液所呈现的颜色是________________________ 的颜色。 17. 在酸性及弱碱性条件下,EDTA与金属离子形成配合物的过程中,因有 ____________ 放出, 应加 ______________ 控制溶液的酸度。
第十一章配位化合物
第十一章 配位化合物 一. 是非题: 1. 因[Ni(NH3)6]2+ 的K s=5.5×108, [Ag(NH3)2]+ 的K s=1.1×107, 前者大于后者,故溶液中 [Ni(NH3)6]2+比[Ag(NH3)2]+稳定() 2. H[Ag(CN)2]- 为酸,它的酸性比HCN强() 3. 因CN-为强场配体,故[30Zn(CN)4]2-为内轨型化合物() 二. 选择题: 1. 在[Co(en)(C2O4)2]-中,Co3+的配位数是() A.3 B.4 C.5 D.6 E.8 2. 下列配离子中属于高自旋(单电子数多)的是() A. [24Cr(NH3)6]3+ B. [26FeF6]3- C. [26Fe(CN)6]3- D. [30Zn(NH3)4]2+ E. [47Ag(NH3)2]+ 3. 下列分子或离子能做螯合剂的是() A.H2N-NH2 B.CH3COO- C.HO-OH D.H2N-CH2-NH2 E.H2NCH2CH2NH2 4. 已知[25Mn(SCN)6]4-的μ=6.1×AJ?T-1,该配离子属于() A.外轨 B.外轨 C.内轨 D.内轨 E.无法判断 5. 已知H2O和Cl-作配体时,Ni2+的八面体配合物水溶液难导电,则该配合物的化学式为 () A. [NiCl2(H2O)4] B. [Ni (H2O)6] Cl2 C. [NiCl(H2O)5]Cl D. K[NiCl3(H2O)3] E. H4[NiCl6] 三. 填充题: 1. 配合物[Cr(H2O)(en)(C2O4)(OH)]的名称为,配位数为。 2. 配合物“硝酸氯?硝基?二(乙二胺)合钴(III)”的化学,它的 外层是。 3. 价键理论认为,中心原子与配体间的结合力是。 四. 问答题:
配位平衡与配位滴定法
第八章 配位平衡与配位滴定法 §8-1 配合物 教学目的及要求:1.掌握配合物及其组成。 2.掌握配合物命名。 教学重点:配合物命名。 教学难点:配合物命名。 一、配合物及其组成 1.中心离子 中心离子绝大多数为金属离子特别是过渡金属离子。 2.配体和配位原子 配合物中同中心离子直接结合的阴离子或中性分子叫配体,配体中具有孤电子对并与中心离子形成配位键的原子称为配位原子(单基(齿)配体,多基(齿)配体) 3.配位数 配合物中直接同中心离子形成配位键的配位原子的总数目称为该中心离子的配位数 配位数=配位体数×齿数 4.配离子的电荷数 配离子的电荷等于中心离子和配体电荷的代数和。 [Cu (NH 3)4] SO 4 K 3[Fe(CN)6] ↑↑↑↑↑↑↑↑中心离子中心离子配体配体配位数配位数外界 内界外界内界 配合物 配合物 二、配合物的命名
配离子按下列顺序依次命名:阴离子配体→中性分子配体→“合”→中心离子(用罗马数字标明氧化数)。氧化数无变化的中心离子可不注明氧化数。若有几种阴离子配体,命名顺序是:简单离子→复杂离子→有机酸根离子;若有几种中性分子配体,命名顺序是:NH 3→H 2O →有机分子。各配体的个数用数字一、二、三……写在该种配体名称的前面。 对整个配合物的命名与一般无机化合物的命名相同,称为某化某、某酸某和某某酸等。由于配离子的组成较复杂,有其特定的命名原则,搞清楚配离子的名称后,再按一般无机酸、碱和盐的命名方法写出配合物的名称。 举例:K 4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 H[AuCl 4] 四氯合金(Ⅲ)酸 [CoCl 2(NH 3)3(H 2O)]Cl 氯化二氯三氨一水合钴(Ⅲ) [PtCl(NO 2)(NH 3)4]CO 3 碳酸一氯一硝基四氨合铂(Ⅳ) [Ni(CO)4] 四羰基合镍 §8-2 配离子的配位离解平衡教学目的及要求: 1.理解配位平衡常数。 2.掌握配位平衡的移动。 教学重点: 1. 配位平衡常数的计算。 2. 配位平衡的移动。 教学难点:配位平衡常数的计算。 一、配离子的稳定常数 配位 Cu 2+ + 4NH 3 ? [Cu(NH 3)4]2+ 离解 4 NH Cu ])[Cu(NH f )()/(32243ΘΘΘΘ c /c c c c /c K ?= ++ 简写为:4 NH Cu ] )[Cu(NH f )(32243c c c K ?= ++
第七章配位化合物
第七章 配位化合物 教学目标: 1、掌握配合物的基本概念和配位键的本质。 2、掌握配合物价键理论的主要论点,并能用此解释一些实例。 3、了解螯合物的性质。 4、掌握配合物稳定常数的意义,应用和有关计算。 5、掌握配合物形成时的性质变化。 教学重点: 1、掌握配合物的基本概念和配位键的本质。 2、配合物稳定常数的意义,应用及有关计算。 教学难点: 1、配合物稳定常数的意义,应用及有关计算。 教学过程: 第一节 配位化合物的基本概念 1-1 配位化合物的基本概念 配合物定义: 配合物是由于可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配位体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。 “不定域电子”指π电子 “空位”指空轨道 这个定义抓住了配合物的本质特点,即配合物中一定存在配位键,这是与简单化合物的本质区别,按照这个区别配合物可以是: 配合分子 [C o (NH 3)3Cl 3] 在水溶液中主要以分子存在 配盐 [C u (NH 3)4]SO 4 配酸 H 2[PtCl 6] 配离子 [Cu(NH 3)4]2+、[Ag(NH 3)2]+也常称配合物 配合物与简单化合物区别: 1、配合物中一定存在配位键。 2、从实验入手,检测出离子的存在形式。 3、配合物组成不符合经典的化学键理论。 1-2 配位化合物的组成 以[C u (NH 3)4]SO 4为例来说明,详见课本图。 1、配位体 含有孤对电子的分子或离子含有孤对电子的分子或离子。如:(……) 配位原子:配位体中提供孤对电子对与中心原子形成配位键的原子。 常见的配位原子一般是半径较小,电负性较大的p 区原素。如:C ,N ,O ,F ,P ,S ,Cl , Br ,I ,H +等。 当配位体中有两个以上的原子有孤电子对时,哪一个原子配位则应由实验测定,一般将配位原子写在靠近中心原子的位置上。 根据配位体中配位原子数目,可将配位体分为两种: 单齿配体:只含有一个配位原子 如::NH 3 H 2O :
8.配位平衡和配位滴定法
习 题八 一、选择题(将正确答案的序号填在括号内) 1.下列配合物中心离子的配位数有错误的是( ) a.[Co(NO 2)3(NH 3)3]; b.K 2[Fe(CN)5NO]; c.[CoCl 2(NH 2)2(en)2]; d.[Co(NH 3)4Cl 2]Cl 。 2.关于配合物,下列说法错误的是( ) a.配体是一种可以给出孤对电子或π健电子的离子或分子; b.配位数是指直接同中心离子相连的配体总数; c.广义地讲,所有金属离子都可能生成配合物; d.配离子既可以存在于晶体中,也可以存在于溶液中。 3.关于外轨型与内转型配合物的区别,下列说法不正确的是( ) a.外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大; b.中心离子轨道杂化方式在外轨型配合物是ns 、np 、nd 轨道杂化,内轨型配合物是 (n-1)d 、ns 、np 轨道杂化; c.一般外轨型配合物比内轨型配合物键能小; d.通常外轨型配合物比内轨型配合物磁矩小。 4.当下列配离子浓度及配体浓度均相等时,体系中Zn 2+离子浓度最小的是( ) a.()+ 243NH Zn ; b.()+ 22en Zn ; c. ()- 24CN Zn d.()- 24OH Zn 。 5.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是( ) a.d 2sp 3; b.sp 3d 2; c.p 3d 3 d.sd 5 6.下列配离子能在强酸性介质中稳定存在的是( ) a. ()- 32 32O S Ag ; b. ()+ 24 3NH Ni ; c. ()- 33 42O C Fe ; d.- 24HgCl 。 7.测得 ()+ 36 3NH Co 的磁矩μ=0.0B· M,可知Co 3+离子采取的杂化类型为( ) a.d 2sp 3; b.sp 3d 2; c.sp 3 ; d.dsp 2 8.下列物质具有顺磁性的是( ) a. ()+2 3NH Ag ; b.()-46CN Fe ; c.()+ 243NH Cu ; d.()- 24CN Zn 9.下列物质中,能作为螯合剂的为( ) a.HO-OH ; b.H 2N-NH 2; c.(CH 32)2N-NH 2; d.H 2N-CH 2-CH 2-NH 2。 10.在[RhBr 2(NH 3)4]+中,Rh 的氧化数和配位数分别是( ) a.+2和4; b.+3和6; c.+2和6; d.+3和4 11.()+ 22en Cu 的稳定性比()+ 243NH Cu 大得多,主要原因是前者( ) a.配体比后者大; b.具有螯合效应; c.配位数比后者小; d.en 的分子量比NH 3大。 12.下列离子中,形成配合物的能力最强的是( ) a.Cu 2+; b.Ca 2+; c. Zn 2+; d.Mg 2+
第七章配位化合物汇总
第七章配位化合物(计划学时数:3) [教学目的]通过本章讲解使学生掌握配合物的一些基本概念,并了解使配离子电离平衡发生移动的因素。 [教学要求] 1.掌握配位化合物的定义、组成、结构特征和系统命名。 2.理解配位化合物稳定常数的意义,理解酸度等因素对配位平衡的影响。 3.掌握螯合物的结构特征和特性。 4.了解配位化合物在生物、医药等方面的应用。 [总学时] 3学时 [学时分配]第一节配合物的基本概念1学时 第三节配位平衡1学时 第四节螯合物0.5学时 第五节配合物在生命科学中的应用0.5学时 [重点内容] 配合物的基本概念和配位平衡 [难点内容] 配位平衡的移动] [使用教具] 挂图 [教学方法] 讲解、启发、提问 [作业] 90页1、2、3、4
第一节配合物的基本概念 (本节是重点内容,从配合物的组成入手,重点介绍配离子的结构特点及其命名) [讲解] CuSO4 + NaOH →↓ CuSO4 + NH3→深兰色溶液→无沉淀 (CuSO4可以电离出Cu2+,与OH-结合生成沉淀;而深兰色溶液中加NaOH无沉淀,说明其中没有Cu2+,其结构非常特殊。) 一、配合物的定义 1.配离子(或配分子):由简单阳离子或中性原子和一定数目的中性分子或负离子以配 位键结合形成的、具有一定特征的的复杂离子或分子叫配离子 或配分子; 2.配位化合物:由配离子或配分子所组成的复杂化合物叫配位化合物。习惯上配离子也叫配合物。 明矾KAl(SO4)2·12H2O、铬钾矾KCr(SO4)2·12H2O的晶体和水溶液都不含 复杂离子,是复盐。 二、配合物的组成 [讲解] 以上述实验中深兰色溶液中的物质为例,介绍配合物的结构组成。 配合物一般由内界和外界两部分组成。配离子是内界,它是配合物的特征部分,其性质、结构与一般离子不同,因此,常将配离子用方括号括起来。方括号内是配合物的内界,不在内界的其它离子是配合物的外界。内界与外界以离子键结合。 [CoCl3(NH3)3]没有外界. [Cu (NH3) 4 ]2+SO42-K2+ [ Hg I 4 ]2- 1. 中心离子(或原子):是配合物的形成体,位于配离子或配分子的中心,是配合物的 核心部分,它们都是具有空的价电子轨道的离子或原子,其半径小电荷多 是较强的配合物的形成体。常见的是过度金属离子或分子如:大、电荷 多不易形成,原子也可形成配合物。 2. 配位体:在配离子或配分子内与中心离子或原子结合的负离子或中性分子叫配位 体。如NH3CN- 配位原子:配位体中具有孤对电子的直接与中心离子结合的原子叫配位原子。常见的配位原子有N、O、S 根据一个配位体中所含配位原子的数目配位体可分为:
第十一章 配位化合物习题解答
第十一章 配位化合物习题解答 1.指出下列配合物(或配离子)的中心原子、配体、配位原子及中心原子的配位数。 (1) H 2[PtCl 6] (2) NH 4[Cr(NCS)4(NH 3)2] (3) [Co(NH 3)6](ClO 4)2 (4) Na 2[Fe(CN)5(CO)] (5) [Cr(OH)(C 2O 4) (H 2O)(en)] 7.计算下列反应的平衡常数,并判断下列反应进行的方向。已知:lg K s θ([Hg(NH 3)4]2+ ) = 19.28;lg K s θ(HgY 2-) = 21.8;lg K s θ([Cu(NH 3)4]2+) = 13.32;lg K s θ([Zn(NH 3)4]2+) = 9.46 ;lg K s θ([Fe(C 2O 4)3]3-) = 20.2;lg K s θ([Fe(CN)6]3-) = 42 (1)[Hg(NH 3)4]2+ + Y 4- HgY 2- + 4NH 3 (2)[Cu(NH 3)4]2+ + Zn [Zn(NH 3)4]2+ + Cu 2+ (3)[Fe(C 2O 4)3]3- + 6CN - [Fe(CN)6]3- + 3C 2O 42- 解:反应均为配离子相互转化,配离子之间的转化方向是由稳定常数小的转化为稳定常数大的,通过两个配离子的稳定常数的组合形成新的平衡常数的大小来判断。 (1)] Hg ][Y ][)NH (Hg []Hg []NH ][HgY [] ][Y )[Hg(NH ] NH ][[HgY 2424 32432- 424 343- 2+ - ++ - + = = K 2 19 2124 3s 210 3.310 90.110 3.6} ])Hg(NH {[} [HgY]{?=??= = + - θθ K K s 该反应进行的方向是 [Hg(NH 3)4]2+ +Y 4- =[HgY]2- +4NH 3 ,即:反应正向进行。
配位平衡与配位滴定法
第七章 配位平衡与配位滴定法 一.选择题 1. 298.15K 时,。 稳稳212723100.1)])(([,107.1)])(([?=?=-Θ+ΘCN Ag K NH Ag K 则下列反应:-+-+?+CN NH Ag NH CN Ag 2])([2])([2332在298.15K 时的标准平衡常数为( )。 A.14107.1-? B.13109.5? C.28107.1? D.3107.1-? 2. 下列配合物中,属于弱电解质的是( )。 A.Cl NH Ag ])([23 B.42])([SO en Cu C.Cl NH CrCl ])([432 D.])([333NH CrCl 3. 298.15K 时,,100.5][,100.1][29241524?=?=-Θ-Θ)()(稳稳HgI K HgCl K 则下列反应: ----+?+Cl HgI I HgCl 4][4][2424在298.15K 时的标准平衡常数为( ) 。A.44100.5? B.14100.5? C.15100.2? D.45100.2-? 4. 25℃时,配离子---+])([,])([,])([,])([23232223CN Ag O S Ag SCN Ag NH Ag 的Θ稳 K lg 分别为7.07,10.08,13.46和21.1。则在浓度相同的下列配离子溶液中,Ag +浓度最小的是( )。 A.+])([23NH Ag B.-])([2SCN Ag C.-3232])([O S Ag D.-])([2CN Ag 5. 下列配合物的名称正确的是( )。 A.][63AlF Na 六氟合铝(Ⅲ)化钠 B.])([333ONO CoCl K 三硝基·三氯合钴(Ⅲ)酸钾 C.3423233)(])()([SO O H NH Cr 硫酸三水·三氨合铬 D.]][)([443PtCl NH Cu 四氯合铂(Ⅱ)酸四氨合铜(Ⅱ) 6. 某配合物的化学式为,533NH CrCl ?在该配合物水溶液中加入过量的AgNO 3溶液,仅能沉淀出2/3的Cl -;加入浓NaOH 溶液并加热,没有氨逸出。由此可判断该配合物的内界是( )。 A.])([333NH CrCl B.+])([432NH CrCl C.+253])([NH CrCl D.+233])([NH CrCl 7.下列说法错误的是( )。 A.配位个体在溶液中很难解离出中心原子和配体 B.中心原子的配位数等于配体与中心原子形成的配位键数 C.配位个体的电荷数不一定等于中心原子的氧化值
第七章 配位化合物
第七章金属配位化合物 1.是非判断题 1-1中心离子的未成对电子数越多,配合物的磁矩越大。 1-2配合物由内界和外界组成。 1-3配位数是中心离子(或原子)接受配位体的数目。 1-4配位化合物K3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。 1-5一般说来,内轨型配合物比外轨型配合物稳定。 1-6配合物中由于存在配位键,所以配合物都是弱电解质。 1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。 1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。 1-9电负性大的元素充当配位原子,其配位能力强。 1-10在螯合物中没有离子键。 1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。 1-12配合物的几何构型取决于中心离子所采用的杂化类型。 1-13外轨型配离子磁矩大,内轨型配合物磁矩小。 1-14配离子的配位键越稳定,其稳定常数越大。 1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH3)4]2+,使铜溶解。 2.选择题 2-1下列配合物中属于弱电解质的是 A.[Ag(NH3)2]Cl B. K3[FeF6] C.[Co(en)3]Cl2 D.[PtCl2(NH3)2] 2-2下列命名正确的是 A.[Co(ONO)(NH3)5Cl]Cl2亚硝酸根二氯·五氨合钴(III) B.[Co(NO2)3(NH3)3] 三亚硝基·三氨合钴(III) C.[CoCl2(NH3)3]Cl 氯化二氯·三氨合钴(III)
D.[CoCl2(NH3)4]Cl 氯化四氨·氯气合钴(III) 2-3配位数是 A.中心离子(或原子)接受配位体的数目 B.中心离子(或原子)与配位离子所带电荷的代数和 C.中心离子(或原子)接受配位原子的数目 D.中心离子(或原子)与配位体所形成的配位键数目 2-4在配位分子3KNO2·Co(NO2)3中,配位数为 A. 3 B. 4 C. 5 D. 6 2-5在配位分子CrCl3·4H2O中,配位数为 A. 3 B. 4 C. 5 D. 6 2-6已知某化合物的组成为CoCl3·5NH3·H2O,其水溶液显弱酸性,加入强碱并加热至沸,有氨放出,同时产生三氧化二钴的沉淀;加AgNO3于另一份该化合物的溶液中,有AgCl沉淀生成,过滤后,再加入AgNO3而无变化,但加热至沸又产生AgCl沉淀,其重量为第一次沉淀量的二分之一,故该化合物的化学式为 A.[CoCl2(NH3)5]Cl·H2O B. [Co(NH3)5H2O]Cl3 C.[CoCl(NH3)5]Cl2·H2O D. [CoCl2(NH3)4]Cl·NH3·H2O 2-7某元素作为中心离子所形成的配位离子呈八面体形结构,该离子的配为数可能是A. 2 B. 4 C. 6 D. 8 2-8CuSO4·5H2O中,与中心离子(Cu2+)配位的水分子数是 A. 5 B. 2 C. 1 D. 4 2-9乙二胺四乙酸根(-OOCCH2)2NCH2CH2N(CH2COO-)2可提供的配位原子数为 A. 2 B. 4 C. 6 D. 8 2-10在硫酸四氨合铜溶液中滴加BaCl2,有白色沉淀产生,而滴加NaOH无变化。滴加Na2S时则有黑色沉淀生成,上述实验证明 A.溶液中有大量的SO42- B.C(Cu2+)·C2(OH-)< θ [()]2 K Cu OH SP C. C(Cu2+)·C(S2-)>() θ,溶液中仍有微量的Cu2+ D.以上三种均是 K CuS SP 2-11下列叙述正确的是
配位滴定法测试题
配位滴定法测试题 一、选择题 1 EDTA与大多数金属离子的络合关系是(). A: 1:1 B: 1:2 C: 2:2 D: 2:1 2 水的硬度为1度时,则意味着每升水中含氧化钙()毫克. A: 1 B: 10 C: 100 D: 3. 关于EDTA,下列说法不正确的是(). A: EDTA是乙二胺四乙酸的简称 B: 分析工作中一般用乙二胺四乙酸二钠盐 C: EDTA与钙离子以1:2的关系配合 D: EDTA与金属离子配合形成螯合物 4 用铬黑T作指示剂测定水的总硬度时,需加入氨水-氯化铵缓冲溶液的pH值为( ). A: pH<8 B: pH=9~10 C: pH<11 D: pH>10 5.当溶液中有两种离子共存时,欲以EDTA溶液滴定M而N不受干扰的条件是()。 A K’MY/K’NY≥105; B K’MY/K’NY≥10-5; C K’MY/K’NY≤106; D K’MY/K’NY=108; 6.在配位滴定中,直接滴定法的条件包括()。 A lgcK'MY≤8 B 溶液中无干扰离子 C 有敏锐无封闭作用的指示剂 D 反应在酸性溶液中进行 7.标定EDTA溶液时,加入六亚甲基四胺溶液的作用是()。 A 缓冲溶液 B 指示剂 C 掩蔽干扰离子 D 消除指示剂封闭 8.国家标准规定的标定EDTA溶液的基准试剂是( )。 A MgO B ZnO C Zn片 D Cu片 9用EDTA测定SO42-时,应采用的方法是()。 A 直接滴定 B 间接滴定 C 连续滴定 D 返滴定 10.配制EDTA标准溶液用自来水,在直接滴定中将使测定结果() A 偏大 B 偏小 C 不影响 D 大小不确定 的有效浓度[Y]与酸度有关,它随着溶液pH增大而()。 A 增大 B 减小 C 不变 D 先增大后减小 12.配位滴定时,金属离子M和N的浓度相近,通过控制溶液酸度实现连续测定M和N 的条件是()。 A lgKNY - lgKMY ≥2 和lg cK′MY和lgcK′NY ≥ 6 B lgKNY - lgKMY ≥5 和lg cK′MY和lgcK′NY ≥ 3 C lgKNY - lgKMY ≥5 和lg cK′MY和lgcK′NY ≥6 D lgKNY - lgKMY ≥8 和lg cK′MY和lgcK′NY ≥4 13.配位滴定分析中测定单一金属离子的条件是() A lg(cK’MY)≥8 B cK’MY≥10-8 C lg(cK’MY) ≥6 D cK’MY ≥10-6 14 用EDTA标准滴定溶液直接滴定无色金属离子时,终点溶液所呈颜色是()。 A 金属指示剂与金属离子形成配合物的颜色 B 指示剂本身颜色 C EDTA与指示剂生成配合物的颜色 D EDTA的颜色 15 在配位滴定中,指示剂与金属离子所形成的配合物的稳定常数()。 A KMIn〈KMY B KMIn>KMY C KMIn应尽量小 D KMIn应尽量大 16 配位滴定(直接滴定法)终点所呈现的颜色是()。 A 游离的金属离子的颜色 B EDTA与待测离子形成的配合物的颜色。 C 游离的金属指示剂的颜色 D 金属指示剂与待测离子形成的配合物的颜色。
