人教版必修2第1章 第1节元素周期表第2课时学案

第2课时元素的性质与原子结构
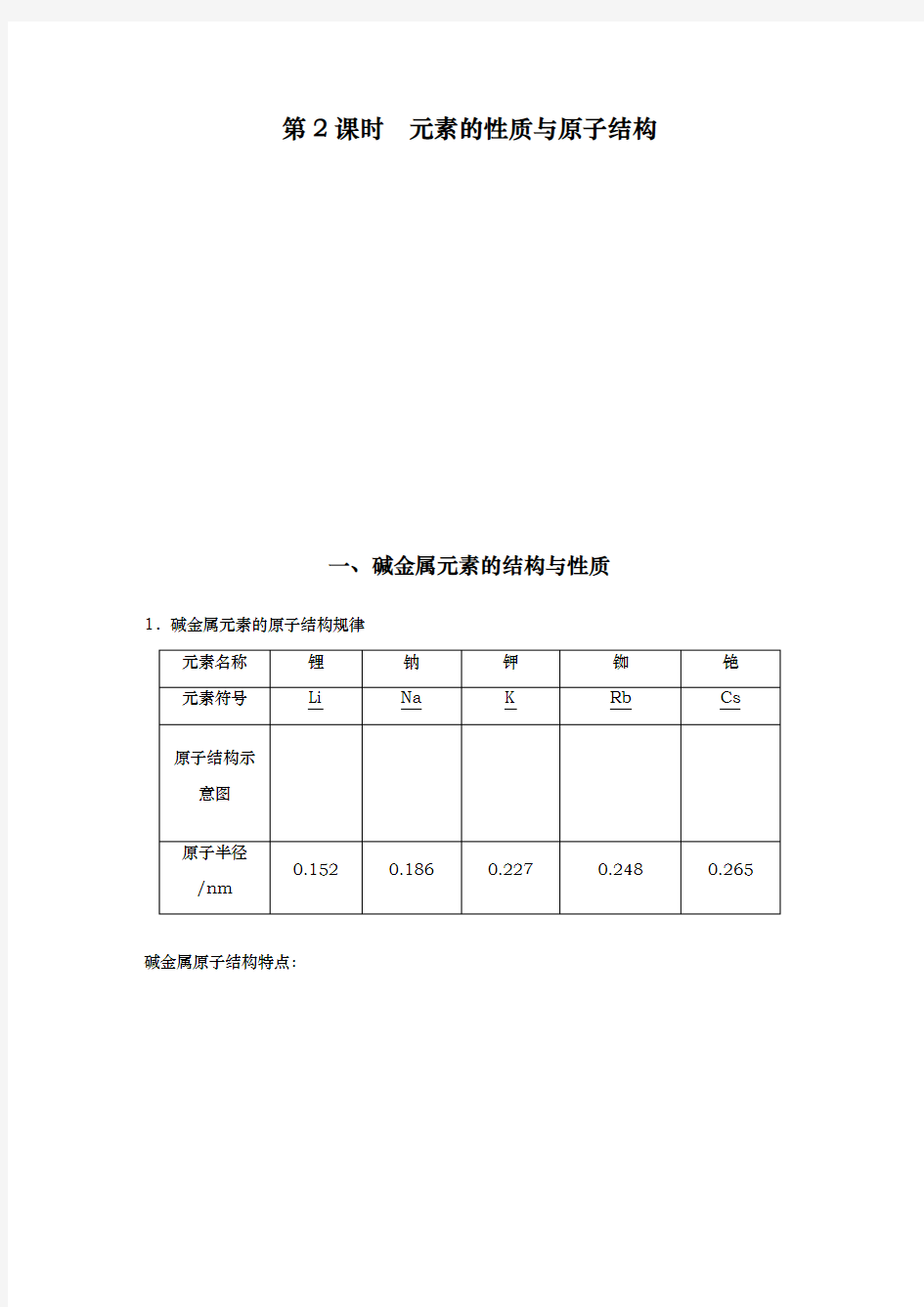
一、碱金属元素的结构与性质1.碱金属元素的原子结构规律
碱金属原子结构特点:
2.碱金属单质的物理性质
3.碱金属单质的化学性质
(1)实验探究
①钠、钾与氧气反应
②钠、钾与水反应
(2)碱金属的原子结构与化学性质的递变关系:
从Li到Cs,随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,元素金属性逐渐增强。
(1)碱金属单质的密度均小于水(×)
(2)碱金属单质的熔、沸点随着原子序数的增加而降低(√)
(3)碱金属单质与水剧烈反应生成碱和氢气(√)
(4)碱金属单质在空气中燃烧生成过氧化物(×)
(5)碱金属元素的原子半径逐渐增大,金属性依次增强(√)
(6)钾比钠原子半径大,钾比钠活泼,所以钾可以从氯化钠溶液中置换出钠单质(×)
(2018·北京汇文中学月考)已知铷(Rb)是37号元素,其相对原子质量是85.5,与钠同主族,回答下列问题:
(1)铷位于第________周期,其原子半径比钠元素的原子半径________(填“大”或“小”)。
(2)铷单质性质活泼,写出它与氯气反应的化学方程式:_____________________________。铷单质易与水反应,反应的离子方程式为_______________________________________,
实验表明,铷与水反应比钠与水反应________(填“剧烈”或“缓慢”)。
(3)同主族元素的同类化合物的化学性质相似,分别写出①过氧化铷与CO 2反应的化学方程式:_____________________________________________;
②过量的RbOH 与AlCl 3反应的离子方程式:_______________________________________ ________________________________________________________________________。 答案 (1)五 大 (2)2Rb +Cl 2=====点燃
2RbCl 2Rb +2H 2O===2Rb ++2OH -+H 2↑ 剧烈 (3)①2Rb 2O 2+2CO 2===2Rb 2CO 3+O 2 ②4OH -+Al 3+===AlO -2+2H 2O
解析 (2)Rb 的密度比水大,遇水后沉在水底与水反应,铷的还原性比钠强,与水反应比钠剧烈。(3)可根据钠的相应化合物发生的反应进行类推。
碱金属性质的相似性和递变性
(1)相似性
化合物—最高价氧化物对应的水化物的化学式为ROH ,且均为强碱 (2)递变性
具体情况如下:
①与氧气反应
从Li→Cs,与氧气反应越来越剧烈,产物越来越复杂。如Li与O2生成Li2O,Na与O2生成Na2O2,K与O2生成KO2。
②与H2O(或酸)的反应
从Li→Cs,与H2O(或酸)反应越来越剧烈。如K与H2O反应能发生轻微爆炸,Rb、Cs则遇水会发生爆炸。因Na、K等活泼的金属易与H2O反应,故不能从水溶液中置换出不活泼的金属,只有在熔融状态下才能置换出不活泼的金属。
③最高价氧化物对应的水化物的碱性:LiOH 二、卤族元素的结构与性质 1.卤族元素的原子结构 卤族元素原子结构特点: 2.卤素单质的物理性质及递变规律 3.卤素单质的化学性质 (1)与氢气的化合 (2)卤素单质间的置换反应 4.卤族元素性质与原子结构的关系 从F到I,随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,得电子能力逐渐减弱,元素非金属性逐渐减弱。 (1)卤素单质颜色逐渐加深,熔、沸点逐渐升高,密度逐渐增大(√) (2)卤素单质随着核电荷数增加,氧化性依次减弱,与H 2反应剧烈程度依次减弱,生成气态氢化物的稳定性增强(×) (3)卤素按F 、Cl 、Br 、I 的顺序,其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大,原子核对电子的吸引作用减弱(√) (4)卤素原子最外层电子数都是7个,所以卤素单质易得电子,在氧化还原反应中卤素单质只表现氧化性(×) 1.卤族元素单质化学性质的相似性和递变性 (1)相似性(用X 代表卤族元素): 单质X 2 ????? 与氢气反应:X 2+H 2===2HX 与水反应?? ? 如X 2 +H 2 O===HX +HXO X 为Cl 、Br 、I , 例外:2F 2 +2H 2 O===4HF +O 2 与NaOH 反应:2NaOH +X 2 ===NaX +NaXO +H 2 O 化合物→最高价氧化物对应水化物(除氟外)都为强酸 (2)递变性 具体表现如下: ①与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,其水溶液的酸性逐渐增强,即: 稳定性:HF>HCl>HBr>HI; 还原性:HF 酸性:HF ②最高价氧化物对应水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。 2.从原子结构角度认识卤族元素性质的递变规律 (2018·南京外国语学校高一期中)某校化学学习小组设计了相关实验来探究元素周期律。该组同学为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。 实验过程及现象: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸; Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹; Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a; Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色。 请回答下列有关问题。 (1)B中溶液由黄色变为棕红色时发生反应的离子方程式为_____________________________。 (2)验证氯气的氧化性强于碘的实验现象是___________________________________。 (3)由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐________(填“减弱”或“增强”)。 (4)B和C仪器口放置浸有NaOH溶液的棉花的作用是________________________________。答案(1)2Br-+Cl2===2Cl-+Br2 (2)湿润的淀粉-KI试纸变蓝 (3)减弱 (4)吸收未反应的氯气,防止污染空气 解析(1)Cl2与NaBr溶液反应生成Br2和NaCl,反应的离子方程式为2Br-+Cl2===2Cl -+Br2。 (2)湿润的淀粉-KI试纸变蓝色,说明有单质碘生成,即说明氯气的氧化性强于碘。 (3)由实验可知氯气的氧化性强于溴,而溴的氧化性强于碘,所以同主族元素从上到下,原子的得电子能力逐渐减弱。 (4)B和C仪器口放置浸有NaOH溶液的棉花的作用是吸收未反应的氯气,防止其对空气造成污染。 1.(2019·沈阳月考)下列说法错误的是( ) A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 B.Li、Na、K、Rb元素的原子半径逐渐增大,金属性依次增强 C.因为Na比K容易失去电子,所以单质Na比K的还原性强 D.O与S为同主族元素,且O比S的非金属性强 答案 C 解析K比Na容易失去电子,所以单质K比Na的还原性强,C项错误。2.(2018·天津一中高一期中)下列说法正确的是( ) A.Li在氧气中燃烧主要生成Li2O2 B.砹位于第六周期ⅦA族,其简单氢化物的稳定性大于氯化氢 C.卤族元素单质的熔、沸点随原子序数的增大而升高 D.第二周期非金属元素的简单氢化物溶于水后,水溶液均呈酸性 答案 C 解析Li在氧气中燃烧生成Li2O,A错误;元素非金属性越强,简单氢化物越稳定,同主族元素,从上到下非金属性依次减弱,则简单氢化物的稳定性依次减弱,所以砹化氢的稳定性小于氯化氢,B项错误;随原子序数的增大,卤族元素单质的熔、沸点逐渐升高,C项正确;第二周期非金属元素的简单氢化物溶于水后,水溶液不一定呈酸性,如氨气溶于水后溶液显碱性,D项错误。 3.下列关于卤素(用X表示)的叙述正确的是( ) A.HF、HCl、HBr、HI的稳定性依次增强 B.卤素单质与水都生成HX和HXO C.其单质都有颜色,都有毒 D.卤素单质与其他物质化合时,均表现为还原性 答案 C 4.(2018·哈尔滨三中模拟)砹(At)属于卤族元素,下列关于砹(At)及其化合物具有的性质推测不正确的是( ) A.单质砹易溶于某些有机溶剂 B.AgAt是难溶于水的有色固体 C.HAtO4的酸性比HClO4的弱 D.HAt难溶于水,且受热很难分解 答案 D 解析单质溴、碘易溶于某些有机溶剂,故砹单质也易溶于某些有机溶剂,A项正确;由AgCl、AgBr、AgI的溶解度逐渐降低,颜色逐渐加深可知,B项正确;元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,所以HAtO4的酸性比HClO4的弱,C项正确;在卤族元素中,非金属性越弱,对应的简单氢化物稳定性越差,故砹化氢的稳定性比碘化氢差,受 热易分解,D项错误。 5.根据元素周期表回答下列问题: (1)自然界稳定存在的元素中,金属性最强的元素是________,非金属性最强的元素是____________。 (2)在稳定存在的碱金属元素中,最高价氧化物对应水化物的碱性最强的是________,写出钠与水反应的离子方程式:_________________________________________________。 (3)卤族元素中,氢化物热稳定性最强的是________;写出向KI溶液中通入Cl2的反应离子方程式:_________________________________________________________________。 考点碱金属的性质和卤素性质 题点碱金属与卤素的变化规律 答案(1)Cs F (2)CsOH 2Na+2H2O===2Na++2OH-+H2↑(3)HF Cl2+2I-===2Cl-+I2 解析(1)自然界稳定存在的元素中,金属性最强的是第ⅠA族的Cs;非金属性最强的元素是F。 (2)在稳定存在的碱金属元素中,碱性最强的是CsOH,Na与水反应的离子方程式为2Na+2H2O===2OH-+2Na++H2↑。 (3)卤族元素中,氢化物热稳定性最强的是HF,Cl2与KI溶液反应的离子方程式为Cl2+2I -===I2+2Cl-。 题组一碱金属结构与性质的变化规律 1.(2018·云南民族大学附中月考)下列有关碱金属的说法不正确的是( ) A.均为ⅠA族元素,最外层均有1个电子 B.单质的还原性:Li>Na>K>Rb>Cs C.碱性:LiOH<NaOH<KOH<RbOH<CsOH D.由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大 答案 B 解析碱金属位于周期表第ⅠA族,主族序数等于原子最外层电子数,最外层电子数为1,故A正确;同主族元素,从上到下电子层数依次增加,失电子能力越来越强,还原性逐渐增强,单质的还原性:Li<Na<K<Rb<Cs,故B错误;金属性越强形成的碱的碱性越强,LiOH<NaOH<KOH<RbOH<CsOH,故C正确;同一主族元素,从上到下,电子层数、原子半径依次增大,故D正确。 2.下列各性质中符合图示关系的是( ) ①化合价②ROH的碱性③密度④最外层电子数⑤核外电子层数⑥单质失e-能力A.②④⑤⑥B.②⑤⑥ C.②③⑤⑥D.①②③⑤ 答案 B 3.下列关于碱金属元素的说法正确的是( ) ①原子结构的相同点是最外层电子数相同,都为1 ②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大 ③具有相似的化学性质,都是活泼金属 ④都具有强还原性,在化合物中显+1价 ⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强 A.①③④B.①③⑤ C.②④⑤D.全部 答案 D 解析碱金属元素原子的最外层都有一个电子,都易失去一个电子,具有强还原性,在化合物中显+1价,①③④正确;碱金属元素从Li到Cs,原子半径逐渐增大,原子核对核外电子的束缚力逐渐减弱,失电子能力逐渐增强,②⑤正确。 题组二卤素结构与性质的变化规律 4.下列各组物质性质比较的表示中,正确的是( ) A.还原性:HF>HCl>HBr>HI B.稳定性:HF C.与水反应由易到难:Cl2>Br2>I2>F2 D.密度:F2 答案 D 解析A项应为HI>HBr>HCl>HF;B项应为HF>HCl>HBr>HI;C项应为F2>Cl2>Br2>I2。5.下列关于卤族元素由上到下性质递变规律的叙述,正确的是( ) ①单质的氧化性增强②单质的颜色加深③气态氢化物的稳定性增强④单质的沸点升高⑤阴离子的还原性增强 A.①②③B.②③④ C.②④⑤D.①③⑤ 答案 C 解析F2、Cl2、Br2、I2氧化性依次减弱,其对应的阴离子F-、Cl-、Br-、I-的还原性依次增强,故①错误,⑤正确;F2、Cl2、Br2、I2的颜色由淡黄绿色→黄绿色→深红棕色→紫黑色,逐渐加深,②正确;HF、HCl、HBr、HI的稳定性逐渐减弱,③错误;F2、Cl2、Br2、I2在通常情况下其状态变化规律为气→液→固,则沸点逐渐升高,④正确,C正确。 6.下列说法正确的是( ) A.F、Cl、Br原子的最外层电子数都是7,次外层电子数都是8 B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律C.卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是随着核电荷数增加电子层数增大起主要作用 D.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,砹易溶于水,难溶于CCl4答案 C 解析F的次外层电子数为2,Br的次外层电子数为18,A项错误;元素的非金属性强弱可以根据其最高价氧化物对应水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,B 项错误;由单质碘微溶于水、易溶于四氯化碳可推知,砹微溶于水,易溶于CCl4,D项错误。题组三元素金属性、非金属性强弱的判断 7.(2019·武汉调研)下列叙述中,能说明金属a的活泼性肯定比金属b的活泼性强的是( ) A.a原子的最外层电子数比b原子的最外层电子数少 B.a原子电子层数比b原子的电子层数多 C.1 mol a从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多 D.常温时,a能从水中置换出氢,而b不能 8.X、Y是元素周期表第ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是( ) A.X原子的电子层数比Y原子的电子层数多 B.Y的单质能将X从NaX的溶液中置换出来 C.X的单质比Y的单质更容易与氢气反应 D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强 答案 C 解析因X、Y是元素周期表第ⅦA族中的元素,若X的电子层数多,则说明X比Y的非金属性弱,A错误;B项事实说明Y比X更活泼,错误;C项根据单质与H2化合的难易判断,X2与H2化合更容易,说明氧化性:X2>Y2,则非金属性:X>Y,C正确;D项判断依据错误,应根据最高价氧化物对应水化物的酸性强弱判断。 9.(2018·上海交通大学附中月考)不能用来证明非金属性Cl>I的事实是( ) A.ICl中I是+1价,Cl是-1价 B.稳定性:HCl>HI C.酸性:HCl<HI D.Fe3+可以氧化I-,但不能氧化Cl- 答案 C 解析ICl中I是+1价,Cl是-1价,说明氯的非金属性强于碘,选项A正确;元素的非金属性越强,对应氢化物的稳定性越强,选项B正确;同主族元素从上而下离子半径逐渐增大,离子半径越大,结合氢离子的能力越弱,无氧酸的酸性越强,故酸性:HCl<HI不能说明氯元素的非金属性强于碘元素,选项C不正确;Fe3+可以氧化I-,但不能氧化Cl-,说明I-的还原性强于Cl-,简单离子的还原性越强,对应单质的氧化性越弱,则元素的非金属性越弱,选项D正确。 题组四同主族元素性质递变规律 10.砹(At)原子序数为85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是( ) A.砹是有色固体 B.非金属性:At<I C.HAt非常稳定 D.I2能从砹的可溶性盐溶液中置换出At2 解析同主族从上到下元素的单质从气态、液态、固态变化,且颜色加深,则砹是有色固体,故A正确;同一主族元素,其非金属性随着原子序数的增大而减小,所以非金属性:At A.CsOH是一种可溶于水的强碱 B.Cs在空气中燃烧,生成一种氧化物Cs2O C.Cs与水反应,能发生爆炸,并放出O2 D.加热Cs2CO3,可生成氧化铯和二氧化碳 答案 A 12.借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( ) A.已知Ca是第四周期ⅡA族的元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 B.已知As是第四周期ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强 C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 D.已知Cl的核电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大 答案 D 解析由碱金属元素和卤族元素的递变性可知,同主族元素从上到下金属性递增,非金属性递减,最高价氧化物对应的水化物碱性增强,金属活动性增强,非金属气态氢化物稳定性减弱,A、B、C错误;同主族元素随核电荷数的增大,原子半径递增,D正确。 13.某同学为验证同主族元素性质的递变规律,准备了如下药品:①氯化钠溶液②氢氧化钠溶液③硝酸④水⑤钠⑥镁条⑦铝条⑧钾 (1)准备选用的药品是__________。 (2)所做的实验是______________________________________________(用化学方程式表示),判断依据_____________________________________。 答案(1)④⑤⑧ (2)2Na+2H2O===2NaOH+H2↑、2K+2H2O===2KOH+H2↑钾与水反应比钠与水反应剧烈,推断钾比钠活泼 解析钠、钾与水反应的共同点:①都浮在水面上,②四处游动,③熔化为一个闪亮的小球,④有“嘶嘶”的响声; 不同点:钾与水反应比钠与水反应更剧烈,反应可产生火焰,并发出轻微的爆炸声。14.据报道,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷是37号元素。根据相关知识回答下列问题: (1)铷(Rb)位于元素周期表的第______周期______族。 (2)关于铷的结构和性质判断正确的是____________(填序号)。 ①与水反应比钠剧烈 ②原子半径比钠小 ③氧化物暴露在空气中易吸收CO2 ④阳离子最外层电子数和镁相同 ⑤是还原剂 《元素周期表》 郑怡10101570104 一、教学内容分析 《元素周期表》选自人教版高中《化学》(必修二)第一章《物质结构元素周期律》第一节《元素周期表》。本节课为《元素周期表》第二课时,以元素的性质与原子结构为主要教学内容。 物质结构和元素周期律是化学的重要理论知识,也是中学化学教学的重要内容.通过学习这部分知识,可以使学生对所学元素化合物等知识进行综合、归纳,从理论进一步加深理解.同时作为基础元素化学的理论指导,也为学生继续学习打下理论基础.本章内容虽然是理论性知识,但教材结合元素化合物知识相互融合,这对于学生理解和掌握是很有利的。 二、学情分析 在初中化学,学生虽然已经知道元素周期表结构,学生的每本书的最后也附有元素周期表的彩图。但那时学生们所学的元素彼此是独立的。而高中学习本节之前,老师也相应地提到过不少的元素周期律,但并没有明确指出此为元素周期律。 通过上一课时的讲解学生们已经明确地知道了元素周期表的基本结构、元素周期表的编排原则以及元素的原子结构与其在周期表中的位置关系。但对于同主族元素随着原子核外电子排布呈周期性变化还理解不够深入和全面,关于应用周期律还没有涉及。 三、教学目标 (一)知识与技能目标 1、通过对有关数据和实验事实分析,了解原子结构与元素性质之间的关;。 2、通过碱金属单质与水反应、卤素单质与氢气反应、卤素单质间的置换反应来感知主 族元素的递变规律; 3、通过对同主族元素性质的金属性与非金属性的递变规律的归纳,能初步学会总结元 素递变规律的能力,具有把元素的性质、元素周期表的位置与元素组成微粒的结构 初步联系起来并在一定条件下相互转化的运用能力。 (二)过程与方法目标 1、通过对获取的大量事实和数据等信息进行加工、分析,培养学生学归纳、概括能力、 口头表达能力和交流能力; 2、通过案例的探究,激发学生主动学习的意识,并且掌握从大量的事实和数据中分析 总结规律、透过现象看本质等科学抽象的方法; 3、通过对元素周期律的探究,培养学生利用各种图表的分析、处理数据能力。 (三)情感态度与价值观目标 1、通过对元素性质的递变规律元素结构的联系能使学生初步树立“量变引起质变”,“通 过现象看本质”等唯物主义观念; 2、通过学习,培养学生理解求知与探索“感性→理性→感性”的认知过程; 3、通过学习,培养学生勤于观察,勤于总结思考的科学态度。 元素周期表》(第二课时) 一、教材分析 物质结构和元素周期律是化学的重要理论知识,也是中学化学教学的重要内容。而元素周期表是元素周期律的具体表现形式,是学习化学的重要工具。元素周期表在初中化学中已有简单介绍,本节书的总体思路是在初中已有知识的基础上让学生学习元素周期表,突出原子结构与元素原子在周期表中的位置关系后,引导学生思考原子结构与元素性质的关系,得出元素性质主要与原子核外电子排布密切相关的结论,最后,引导学生思考原子核与元素的性质是否有关引出核素概念,了解放射性同位素的应用。 在教学时可将本节教材分为三个课时,第一课时主要认识元素周期表的结构以及其与原子结构的关系;第二课时主要探究元素的化学性质与原子结构的关系;第三课时探究元素的化学性质与原子结构的关系,小结元素性质与原子核外电子排布密切相关后,学习核素及同位素概念。 二、学情分析 在人教版九年级上册第四单元物质构成的奥秘中,学生对元素周期表的简介以及原子的核外电子排布等知识已有所了解,从元素周期表中能够获取元素名称、符号、原子序数、原子相对原子质量等信息,知道最外层电子数为8(第一周期为2)的结构化学性质稳定,金属元素最外层电子数一般少于4,反应中易失去电子,非金属元素的最外层电子数一般多于4,反应中易得到电子。结合学生过往已有的知识,本节课将从实验出发,以一系列的实验事实凸显元素的原子结构(尤其是最外层电子数)与化学性质之间的密切联系,丰富学生对元素周期表的认识,深刻理解“元素周期表是学习和研究化学的重要工具”的含义。 教材中对碱金属元素化学性质的探究通过实验归纳得出,这要求学生能够准确描述实验现象并进行对比归纳;对卤族元素化学性质的探究则将实验事实以表格的形式呈现,这对学生处理信息的能力提出了较高的要求,能够从文字中筛选出关键内容进行对比,归纳出“递变性”规律。另外,本节课除了要让学生发现同一主族元素“递变性”外,还要从同一主族元素化学性质的“相似性”归纳出结构与性质的关系,要求学生有较为全面的思维能力,能够充分挖掘未知的潜在性规律。 三、教学目标 1、知识与技能: 《元素周期表》(第二课时) 元素周期表教学设计 (40907063 丁胜根) 一、教材分析 物质结构和元素周期律是化学的重要理论知识,也是中学化学教学的重要内容。而元素周期表是元素周期律的具体表现形式,是学习化学的重要工具。元素周期表在初中化学中已有简单介绍,本节书的总体思路是在初中已有知识的基础上让学生学习元素周期表,突出原子结构与元素原子在周期表中的位置关系后,引导学生思考原子结构与元素性质的关系,得出元素性质主要与原子核外电子排布密切相关的结论,最后,引导学生思考原子核与元素的性质是否有关引出核素概念,了解放射性同位素的应用。 在教学时可将本节教材分为三个课时,第一课时主要认识元素周期表的结构以及其与原子结构的关系;第二课时主要探究元素的化学性质与原子结构的关系;第三课时探究元素的化学性质与原子结构的关系,小结元素性质与原子核外电子排布密切相关后,学习核素及同位素概念。 二、学情分析 在人教版九年级上册第四单元物质构成的奥秘中,学生对元素周期表的简介以及原子的核外电子排布等知识已有所了解,从元素周期表中能够获取元素名称、符号、原子序数、原子相对原子质量等信息,知道最外层电子数为8(第一周期为2)的结构化学性质稳定,金属元素最外层电子数一般少于4,反应中易失去电子,非金属元素的最外层电子数一般多于4,反应中易得到电子。结合学生过往已有的知识,本节课将从实验出发,以一系列的实验事实凸显元素的原子结构(尤其是最外层电子数)与化学性质之间的密切联系,丰富学生对元素周期表的认识,深刻理解“元素周期表是学习和研究化学的重要工具”的含义。 教材中对碱金属元素化学性质的探究通过实验归纳得出,这要求学生能够准确描述实验现象并进行对比归纳;对卤族元素化学性质的探究则将实验事实以表格的形式呈现,这对学生处理信息的能力提出了较高的要求,能够从文字中筛选出关键内容进行对比,归纳出“递变性”规律。另外,本节课除了要让学生发现同一主族元素“递变性”外,还要从同一主族元素化学性质的“相似性”归纳出结构与性质的关系,要求学生有较为全面的思维能力,能够充分挖掘未知的潜在性规律。 (时间:45分钟满分:60分) 中国教育资源网https://www.360docs.net/doc/4818990213.html, 积累与运用(15分) 1.下列词语中,加点字的注音全部正确的一项是()(3分) A.倩.影(qiàn)青荇.(xìnɡ) 栉.风沐雨(jié) 呕.心沥血(ǒu) B.漫溯.(suò) 笙.箫(shēnɡ) 桀骜不驯.(xùn) 从.容不迫(cónɡ) C.彳亍 ..(chì chù) 颓圮.(sǐ) 无济.于事(jì) 载.歌载舞(zài) D.长篙.(ɡāo) 斑斓.(lán) 荒谬.绝伦(miù) 味同嚼.蜡(jiáo) 解析A项“栉”应读“zhì”;B项“溯”应读“sù”;C项“圮”应读“pǐ”。 答案 D 2.下列书写完全正确的一项是()(3分) A.陷井哀怨轻手蹑脚水波荡漾 B.破锭凄婉柔声细语波光艳影 C.回溯太息力挽狂澜招摇过市 D.沉淀迷茫悄无生息沉默寡言 解析A项“井”应为“阱”,B项“锭”应为“绽”,D项“生”应为“声”。 答案 C 3.下列各句中,加点的成语使用恰当的一项是()(3分) A.徐志摩可以说是新诗的诗魂,茅盾说他既是中国的布尔乔亚的“开山诗 人”又是“末代诗人”,他以后的继承者未见有能望其项背 ....的。 B.诗人在乘船离开马赛的归国途中,面对汹涌的大海和辽阔的天空,展纸 执笔,信手拈来 ....,记下了这次重返康桥的切身感受。 C.他完全沉醉在大自然的怀抱里,临到他要离开伦敦的前夕,在一个美丽 的黄昏,他漫步于康桥,举步维艰 ....,写下了这首诗。 D.夕阳下流淌的康河,波光潋滟,栩栩如生 ....,河畔的金柳姿态婀娜如妩媚的新娘,动人心弦。 解析B项“信手拈来”指随手拿来,多形容写文章时能得心应手地运用词汇和选用材料,此处应指思路畅通;C项“举步维艰”形容行动困难或生活艰难, 人教版必修一第一单元第2课诗两首《再别康桥》教学设计 教学目标 1、感受康桥柔美秀丽的风光,在诵读中体会作者对康桥的情感。 2、体会诗歌中的意象美。 学情分析 通过意象赏析诗歌的方法。 重点难点 1、感受康桥柔美秀丽的风光,在诵读中体会作者对康桥的情感。 2、体会诗歌中的意象美。 教学过程 【导入】再别康桥 上个世纪二十年代,中国诗坛出现了一颗耀眼的明星,他才华横溢,文笔洒脱;他感情丰富,风度翩翩;他轻轻的来,又悄悄的走,不曾带走人世间的一片云彩,却永远投影在读者的波心。他就是---徐志摩,今天,让我们和徐志摩一起《再别康桥》。 【讲授】再别康桥 1、作者介绍(请学生介绍) 徐志摩(1897—1931),原名徐章垿,浙江海宁人。1916年秋赴京读大学,曾拜梁启超为师。19 18年8月赴美国留学,获文学硕士学位。1920年追随罗素而赴英国,后进康桥大学(剑桥大学)学习。是“新月”诗派最有代表性的诗人。他一生追求:爱、自由和美。1931年11月1 9日,从南京乘飞机去北平,途中飞机失事,不幸遇难,时年35岁。代表诗集《志摩的诗》《翡冷翠的一夜》《猛虎集》《云游集》。 2、了解背景 康桥,即剑桥,英国剑桥大学的所在地。徐志摩留学英国两年,大部分时间在此度过。这是他一生最美好的时光。1925年和1928年,他出国途径英格兰,两次重返母校。本诗是他1928年故地重游以后,在归国的轮船上写的。康桥的一切,早就给他留下了美好的印象,如今又要和它告别了,千缕柔情、万种感触涌上心头。 3、徐志摩的康桥情结: 在那里,他接受了资产阶级教育,形成以“爱、自由、美”为核心的人生观和“康桥理想”; 康桥:诗人自由之梦飞翔的地方,康桥:诗人美之梦蕴积的地方,康桥:诗人爱之梦破灭的地方。 【活动】再别康桥 初读诗歌,感知诗情 第一章物质结构元素周期律 第一节元素周期表 一、元素周期表的结构: 元素周期表有7个横行,每一个横行叫做一个周期。其中第一、二、三周期叫做短周期,四至六周期 叫做长周期,第七周期由于没有排满叫做不完全周期。 1.周期序数=电子层数主族序数=最外层电子数 2.除第 1 周期只包括氢和氦,第7 周期尚未填满外,每一周期的元素都是从最外层电子数为 1 的碱金属开始,逐步过渡到最外层电子数为7 的卤素,最后以最外层电子数为8 的稀有气体结束。 短周期(第1、2、3 周期) 周期:7 个(共七个横行)长周期(第4、5、6 周期) 周期表不完全周期(第7 周期) 主族7 个:ⅠA-ⅦA 族:16 个(共18 个纵行)副族7 个:IB- ⅦB 第Ⅷ族 1 个(3 个纵行) 零族(1 个)稀有气体元素 口诀:三长、三短、一不完全;七主七副一零一Ⅷ 二.元素的性质和原子结构: (一)碱金属元素: 相似性:最外层电子数相同,都为1个 1. 原子结构递变性:从上到下,随着核电核数增大,电子层数增多 2.碱金属化学性质的相似性: 点燃 点燃 4Li + O 2 2Li 2O 2Na + O 2 Na 2O2 2 Na + 2H 2O = 2NaOH + H2↑2K + 2H 2O =2KOH + H2↑ 通式:2R + 2 H 2 O =2 ROH + H 2 ↑ 产物中,碱金属元素的化合价都为+1价。 结论:碱金属元素原子的最外层上都只有 1 个电子,因此,它们的化学性质相似。 3.碱金属化学性质的递变性: 递变性:从上到下(从Li 到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对 最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。所以从Li 到Cs 的金属性逐渐增强。 第一单元第二课 一、选择题 1.(2018·重庆名校高一联考)从战国时期开始,中国出现了中央集权的政治制度。随着秦汉大一统的实现,以□□□□为核心的官僚体制成为当时社会的主宰。此处省略的是(C) A.察访推荐B.血缘关系 C.皇权独尊D.相权独大 [解析]据题干材料“中央集权的政治制度”和“秦汉大一统的实现”可知当时的政治制度为专制主义中央集权制度,因此其核心为皇权独尊,C项正确。 2.(2018·银川育才中学高一期末)在秦朝,被称为“百官之首”的是(B) A.三公B.丞相 C.太尉D.御史大夫 [解析]通过仔细阅读材料并结合所学知识不难发现,秦朝的丞相是一人之下、万人之上,负责协助皇帝处理政事,所以在秦朝,丞相也就被称为“百官之首”。 0 0 3.(2018·太原高一联考)《史记·秦始皇本纪》说:“天下之事无小大皆决于上,上至以衡石量书,日夜有呈,不中呈不得休息。”这段话表明皇帝制度的主要特点是(B) A.朝议裁决B.集权独断 C.世袭传承D.政务繁忙 [解析]“天下之事无小大皆决于上”反映了君主专制集权、独断专行的特点,故选B 项。 4.(2018·梅州高一期末)傅乐成在《中国通史》中说:秦朝以前,无论名义上如何,中国实际是分裂的……“诸夏”或“中国”都是个笼统的概念,并没有确切的范围和实际的组织;到此“中国”二字有了具体的表现,它代表着一个庞大帝国和它的土地人民。促使此处“中国”概念变化的是(B) A.分封制B.郡县制 C.宗法制D.王位世袭制 [解析]材料中“到此‘中国’二字有了具体的表现”指秦朝时期。秦朝推行郡县制,实现了中央对地方政权直接有效的控制,把全国的每个地方、每户人家都纳入国家政治体制之中。 5.(2018·安徽师大附中高一期末)秦朝在历史上存在的时间虽然仅仅15个年头,但它却是一个十分重要的朝代。这是因为秦朝(A) 人教版高中政治必修一第二课教案 第二课多变的价格 全课概述 本课从分析影响价格的因素和价格变动对生活、生产的影响两个角度入手,让学生初步认识市场形成价格,价格反过来影响市场、引导市场的辩证关系,让学生通过感受市场、价格、生活、生产之间的相互制约、相互影响,认识价值规律及其作用等经济现象、经济规律。 本课分为2个框题:一影响价格的因素。二、价格变动的影响。 新课标要求:归纳影响价格变化的因素,理解价格变动的意义,认清价格与价值的关系,评价商品和服务价格的变化对生产、生活的影响。 新课程学习 2.1 影响价格的因素 【新课标要求】 (一)知识目标 1、识记买方市场和卖方市场、社会必要劳动时间、劳动生产率、价值规律的基本含义。 2、理解价格变动的影响、价格与价值关系、价值量与劳动生产率关系、价值规律表现形式。 3、运用有关知识解释生活中某些商品价格变动的原因,寻找并解释生活中某些处于买方市场和卖方市场的商品、服务。 (二)能力目标 1、懂得价格的不断变动是一种正常的经济现象,是市场发挥资源配置作用的表现。 2、知道价格的变动不是任意的,是围绕价值变动的,市场交易的本质和核心是等价交换。 (三)情感、态度与价值观目标 培养学生积极参与日常经济生活的自主性和独立精神,尊重他人劳动、平等待人 的精神。 【教学重点】理解供求、价值、价格之间的关系,价值规律。 【教学难点】劳动生产率与价值量的关系。 【教学方法】教师启发、引导,学生自主阅读、思考,讨论、交流学习成果。【教学过程】 (一)引入新课 教师活动:指导学生阅读教材设置的镜头一至四,并回忆生活中商品价格变动情况,提出问题:日常生活中,商品的价格是不是固定不变的?为什么? 学生活动:通过阅读教材,回忆生活活动,得出商品价格是经常变动的结论,思考讨论它为什么变动,从而引发探究欲望和兴趣。 (二)进行新课 影响价格的因素 1、供求影响价格 教师点评:影响价格的因素很多,气候、时间、地域、生产、文化、生活习俗等,都可以引起价格变动。 因为这些因素的变化,往往会引起某种商品供应量或者需求量的变化,也就是改变供求关系,从而引起商品价格变化。供求关系是怎样引起价格变化的呢?(1)各种因素对价格的影响是通过改变商品的供求状况来实现的。 学生活动:思考问题,讨论后发言。 教师活动:引导学生讨论,并进行点评。 (2)商品供不应求,买者争相抢购,价格上涨,形成卖方市场 教师活动:引导学生阅读教材,了解卖方市场含义。 (3)商品供过于求,卖者争相出售,价格下降,形成买方市场 教师活动:引导学生阅读教材,了解买方市场含义。 教学过渡:供求变化会引起价格变动,但是,价格的涨落不是无限的,请看教材13页的例子。为什么会出现这一结论? 2、价值决定价格 教师活动:指导学生思考,什么是商品的价格? 学生活动:学生回答所提问题。 【课题】第一节元素周期表(第2课时) 【课标要求】 知识与技能要求:了解原子结构与元素性质的关系,能初步学会总结元素递变规律的能力。 过程与方法要求:具有把元素的性质、元素周期表的位置与元素组成微粒的结构初步联系起来 并在一定条件下相互转化的运用能力。 情感与价值观要求:通过对元素性质的递变规律与元素组成微粒结构的联系。从而认识事物变 化过程中量变引起质变的规律性,接受辨证唯物主义观点的教育。 【教学重点】元素性质的递变规律与元素组成微粒结构的联系 【教学方法】讨论、比较、实验、归纳。 【教学过程设计】 【复习导入】我们把ⅠA 称为碱金属族,我们为什么要把他们编在一个族呢?请同学们画出碱金 属的原子结构示意图,分析碱金属原子结构的共同之处。 [思考与交流]我们知道物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何?是否完全相同? [实验1]将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速的投入到热坩埚中, 观察现象。同钠与氧气的反应比较。 [实验2]在培养皿中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到培养皿中,观察 现象。同钠与水的反应进比较。 [归纳与整理]二、元素的性质与原子结构 钠钾 与氧气的反应 与水的反应 (一)碱金属的化学性质 1、与非金属的反应 Li+O2 Na+O2 K+O2 K、Rb等碱金属与O2反应,会生成超氧化物。 Rb、Cs在室温时,遇到空气会立即燃烧。 2、与水的反应 K+H2O Rb+H2O 除Na、K外,其他碱金属元素也都可以和水反应生成相应的碱与H2。 [小结]2M+2H2O == 2MOH+H2↑碱性: [思考与交流]根据实验讨论钠与钾的性质有什么相似性和不同。你认为元素的性质与他们的原子结构有关系吗? (二)碱金属的物理性质的比较(见课本第7页) 课堂练习1:碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是: 第一章 物质结构 元素周期律 第一节 元素周期表 一、元素周期表的结构: 元素周期表有7个横行,每一个横行叫做一个周期。其中第一、二、三周期叫做短周期,四至六周期叫做长周期,第七周期由于没有排满叫做不完全周期。 1.周期序数=电子层数 主族序数=最外层电子数 2.除第1周期只包括氢和氦,第7周期尚未填满外,每一周期的元素都是从最外层电子数为1的碱金属开始,逐步过渡到最外层电子数为7的卤素,最后以最外层电子数为8的稀有气体结束。 短周期(第1、2、3周期) 周期:7个(共七个横行) 长周期(第4、5、6周期) 、 周期表 不完全周期(第7周期) 主族7个:ⅠA-ⅦA 族:16个(共18个纵行)副族7个:IB-ⅦB 第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素 口诀:三长、三短、一不完全;七主七副一零一Ⅷ 二.元素的性质和原子结构: (一)碱金属元素: 相似性:最外层电子数相同,都为1个 1. 原子结构 递变性:从上到下,随着核电核数增大,电子层数增多 ] 2.碱金属化学性质的相似性: 4Li + O 2 2Li 2O 2Na + O 2 Na 2O 2 2 Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H 2O = 2KOH + H 2↑ 通式: 2R + 2 H 2O = 2 ROH + H 2 ↑ 产物中,碱金属元素的化合价都为+1价。 结论:碱金属元素原子的最外层上都只有1个电子,因此,它们的化学性质相似。 3.碱金属化学性质的递变性: 递变性:从上到下(从Li 到Cs ),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最 点燃 点燃 (一)从群雄割据到大统一 1.宗法制分封制被破坏西周灭亡后,公元前770年周平王东迁洛邑,春秋时期开始。周王室逐渐失去了天下共主的地位,诸侯国的力量逐渐强大起来。宗法分封制的原则遭到破坏,原为周王垄断的分封权力下移,诸侯不断擅自进行分封,小宗取代大宗的现象也频繁发生。2.春秋大国争霸一些强大起来的诸侯,打着“尊王”的旗号进行争霸战争。兼并战争使众多分散的小国逐渐被大国吞并。标志着奴隶社会的瓦解,新的生产关系发展起来。3.战国社会剧变公元前475年左右,中国历史进入战国时期。这一时期,社会发生了一系列重大变化。(1)各大国国君不再满足原来的封号,战国中期以后,先后改称“王”。“王”本来是周朝最高统治者的称号。各大国的国君改称“王”,反映出这些国君已经不满足于诸侯的政治地位,他们已经公开表示不再承认周朝的分封。(2)不少大国还出现了卿大夫夺位的政变。卿大夫夺位,彻底打破了周朝分封的统治秩序。(3)由于诸侯国之间竞争激烈,各国不得不在政治、经济和军事等方面进行变革。各国变法改革以及战争是新兴地主阶级对奴隶制度的宣战,最终使新的生产关系确立。 4.秦国的强大及统一1)秦的强大:经过商鞅变法,秦国废除了旧制度,封建经济得到迅速发展,秦国逐渐强大起来。商鞅变法是战国时期最彻底的政治经济改革,是秦国能够发展成为实力最强大的诸侯国的最主要原因。2)秦的统一:经过100多年的奋斗,它先后消灭了韩、赵、魏、楚、燕、齐等国。公元前221年,秦王嬴政结束了数百年割据混战的局面,建立了空前统一的大帝国。 (二)“始皇帝”和三公九卿 秦统一后,在全国范围内建立了强大的中央集权制度。权力的高度集中,成为秦王朝政治制度的基本特征 1.秦王朝政治制度的基本特征——权力的高度集中(1)首先是皇权至上秦王嬴政自称“皇帝”,并将国家的司法、立法和行政、军事等大权总揽于一人之手。(2)其次是“家天下”的皇位继承制“家天下”的皇位继承制是君主权力集中的另一体现。皇帝称号建立后,嬴政规定自己死后帝位传给子孙,妄想皇位永远由他的后裔承袭下去,他自称“始皇帝”。历史上称之为“秦始皇”。“始”——秦始皇希望自己皇帝的宝座传给子孙后代,源源不绝。2.中央政府的组成及特点1)三公九卿及其职权(1)三公:是指丞相、御史大夫和太尉。左、右丞相为“百官之首”,辅佐皇帝处理全国政务;御史大夫是副丞相,掌管律令、图籍,并负责监察百官;太尉协助皇帝管理军务。三方互不相属,互相牵制。(2)九卿:三公之下,秦代中央政府还有很多重要官职,合称九卿。他们分管着国家和皇家的各种事务。2)中央政府的特点:以三公九卿为主的中央政府各级官员,在地位、职责和权力等方面都处于互相配合、互相牵制的状态,任何人都无法独揽朝政,军国大权最终操纵在皇帝一人之手。(三)废分封,置郡县 1.秦朝的地方管理体制——郡县制1)郡县制的推行2)郡县制的内容 2.秦朝选拔和考察官吏的制度为维持各级官僚机构的正常运行和带好地发挥应有效能,秦帝国还制定了一套选拔和考察官吏的制度。 3.秦朝细密、严苛的法律秦帝国制定的法律十分细密、严苛。秦法是嬴政加强皇权、巩固中央集权的政治体制的工具。秦朝法律细密、严苛,“轻罪重刑”的原则。秦律在加强皇权、巩固中央集权方面起了重要作用,但也给人民带来了极大的苦难。 4.中央集权政体的作用和意义由秦代开始形成的中央集权的政治体制,彻底打破了传统的贵族分封制,奠定了古代大一统王朝制度的基础,对此后两千多年的中国政治与社会产生了重要影响。 五、关于君主专制中央集权制度的综合分析 1专制主义和中央集权的概念:专制主义是就中央的决策方式而言的,主要是帝位终身制 课时2元素周期表核素 发 展目标 体系构建 1.通过了解元素周期表的结构(周期族),认 识原子结构与元素周期表中位置间的关系, 培养学生“宏观辨识与证据推理”的核心 素养。 2.知道A Z X的含义,知道元素、核素、同位 素的含义,培养“微观探析与模型认知”的 核心素养。 一、元素周期表 1.元素周期表的出现与演变 2.原子序数 (1)含义:按照元素在周期表中的顺序给元素编号。 (2)原子序数与元素的原子结构之间存在的关系: 原子序数=核电荷数=质子数=核外电子数。 二、元素周期表的结构 1.编排原则 2.元素周期表的结构 (1) (2)族 ①主族,共七个主族:包括ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA,分别在周期表的第1、2、13、14、15、16、17纵行。由短周期和长周期元素共同构成。 ②副族,包括ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB和第Ⅷ族,分别在周期表的第11、12、3、4、5、6、7纵行和在周期表的第8、9、10纵行。完全由长周期元素构成。 ③0族:在周期表的第18纵行,为稀有气体元素。元素原子的最外层电子数为8(第一周期的He为2),原子结构稳定,化学性质不活泼,通常很难发生化学反应,化合价为零价,定为0族。 (3)常见族的别称:第ⅠA族(除氢外)—碱金属元素,ⅦA——卤族元素,0族—稀有气体元素,ⅣA、ⅤA、ⅥA族依次又叫碳族、氮族、氧族。 3.元素周期表中方格中的符号的意义 (1)元素周期表中所含元素种类最多的族是哪族?共有多少种元素? [提示]ⅢB;32。 (2)同一周期,ⅡA与ⅢA族的原子序数差一定为1吗?为什么? [提示]不一定,可能为1、11、25。 三、核素 1.氢元素的三种核素 氢元素的原子核 原子名称原子符号(A Z X)质子数(Z) 中子数(N) 1 0 氕11H 1 1 氘21H或D 1 2 氚31H或T (1)核素:把具有一定数目质子和一定数目中子的一种原子叫做核素。 (2)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。如11H、D、T互称为同位素。 (3)核素(原子)符号 质量数为A、质子数为Z的核素(原子)表示为A Z X。 (4)同位素的特征 ①同一种元素的各种同位素的化学性质几乎完全相同;物理性质略有差异。 ②在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的比率。 (5)同位素的用途 ①146C在考古工作中用于测定一些文物的年代。 ②21H、31H用于制造氢弹。 ③利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。 ④利用18O作为示踪原子探究有机反应机理。 微点拨:元素的相对原子质量是按照该元素各种核素所占的一定百分比计算的平均值。即M(元素)=M1×a%+M2×b%+M3×c%+…(其中M1、M2…为核素的相对原子质量,a%、b%…,为各核素的原子百分比。) 高一化学必修二元素周期表知识点总结 化学是自然科学的一种,在分子、原子层次上研究物质的组成、性质、结构与变化规律。为大家推荐了高一化学必修二元素周期表知识点,请大家仔细阅读,希望你喜欢。 一、元素周期表(元素周期表的结构) 1.原子序数: 按照元素在周期表中的顺序给元素编号,得到原子序数。 2.原子序数与原子结构的关系 原子序数=核电荷数=核外电子数=质子数 二、元素周期表的结构 1.周期 周期:具有相同电子层数的元素,按照原子序数递增的顺序从左到右排列的一行,叫周期。 (1)元素周期表共有7个横行,每一横行称为一个周期,故元素周期表共有7个周期; (2)周期的分类 第一、二、三周期,所排元素种类: 2、8、8,短周期;第四、五、六、七周期,所排元素种类:18、18、32、32,长周期。 此外: 镧系元素 57La~71Lu 15种元素第六周期,IB族; 锕系元素 89Ac~103Lr 15种元素第七周期,IB族; 超铀元素92U号元素以后。 (3)周期序数与电子层数的关系:周期序数=同周期元素具有的电子层数。 (4)每一周期都是从碱金属开始卤素惰性元素(第一与第七周期例外 ); (5)每一周期,从左向右,原子半径从大到小;主要化合价从+1~+7,-4~-1,金属性渐弱,非金属性渐强。 2. 族 原子核外最外层电子数相同的元素,按照原子电子层数递增的顺序从上到下排列成纵行,叫族。 (1)元素周期表共有18个纵行,除8、9、10三个纵行称为Ⅷ外,其余15个纵行,每一个纵行称为一个族,故元素周期表共有 16 个族。族的序号一般用罗马数字表示; (2)族的分类 长短周期共同组成的族为主族,用A表示;完全由长周期元素构成的族为副族,用B表示,并用罗马数字表示其序号;稀有气体元素所在的列为零族,计作0 族类 A B 族数 第一单元第二课 时间:45分钟满分100分 一、选择题(本大题共12小题,每小题4分,共48分) 1.(2018·合肥高一月考)《三字经》中说:“周辙东,王纲坠。”这反映出( C ) A.春秋战国时期诸侯割据混战B.封建社会已经确立 C.宗法分封制逐渐遭到破坏D.人民渴望东周实现统一 [解析] 分析材料并结合所学知识可知,西周被少数民族灭亡后,周平王东迁,东周开始,但周天子大权旁落,王室日益衰微,诸侯逐渐强大,宗法制、分封制逐渐遭到破坏。故答案选C项。 2.(2018·广州学业水平测试)秦始皇统一六国,创立了( D ) A.分封制度B.世袭制 C.宗法制度D.皇帝制度 [解析] 本题考查学生对基础知识的识记和再现能力。A、B、C三项在西周时已实行,秦统一后创立了皇帝制度。 3.(2018·湖南学业水平测试)皇,古为上天,光明之意;帝,生物之主,兴益之宗。秦始皇统一全国后,自以“德兼三皇,功过五帝”,用皇帝作为自己的称号。其主观目的是( B ) A.炫耀文治武功B.树立专制权威 C.寻求暴政依据D.宣扬君权神授 [解析] 题干反映秦始皇认为皇、帝都不能彰显自己,故将两者合而为一,其主观目的是树立专制权威,故选B项;从题干表面上看有炫耀文治武功的特点,但不是主观目的,C、D两项与题意无关。 4.(2018·郑州高一检测)下列有关秦朝皇帝制度的表述,不正确的是( D ) A.皇权具有至高无上的地位B.实行“家天下”的皇位继承制 C.皇帝总揽全国的军政大权D.皇权受到三公九卿的制约 [解析] 本题要求回答不正确的选项,皇权至上、皇位继承、皇帝独尊都是其重要特点,皇权不可能受到三公九卿的制约,D项说法不符合史实,符合题意。 第一单元第二课第2框 基础演练 一、选择题 1.某商品的价格(P)与其需求量(Q)存在如图所示关系。在其他条件不变的情况下,下列判断正确的是(A) ①该商品价格由P A向P B运动时,会导致其需求量增加 ②该商品需求量由Q B向Q A运动时,会导致其价格下降 ③该商品的价格由P B向P A运动时,会导致其替代商品需求量减少 ④该商品需求量由Q A向Q B运动时,会导致其互补商品需求量减少 A.①②B.①③ C.②④D.③④ [解析]本题考查价格变动的影响、影响价格的因素的相关知识。一般来说价格下降需求增加,该商品价格由P A向P B运动时,意味着价格下降,会导致其需求量增加;该商品需求量由Q B向Q A运动时,需求量减少,会导致其价格下降,故①②正确。 2.面对企业招工难、用工贵的现状,“机器换人”近年在沿海地区成为工业转型升级的首选。“机器换人”(C) ①可以有效提高单位产品的价值量 ②可以提高企业的劳动生产率 ③是价值规律起作用的表现 ④能根除招工难、用工贵的问题 A.①②B.①④ C.②③D.③④ [解析]“机器换人”可以提高企业的劳动生产率,②正确;价格影响供求,受劳动力价格上涨的影响,企业选择了劳动力的替代品——机器,这说明“机器换人”是价值规律起作用的表现,③正确;产品的价值与生产该商品的社会劳动生产率成反比,不考虑其他因素,该行业普遍采用机器人,可以提高社会劳动生产率,此时单位产品的价值量下降,①不选;“机器换人”不能根除招工难、用工贵的问题,④不选。 3.2019年3月,鸡蛋价格连续下跌。假设其他条件不变,下列图示能正确反映鸡蛋价 格下跌带来的影响是(D) A.①③B.①④ C.②③D.②④ [解析]鸡蛋价格连续下跌,生产者获益减少,供给量减少,②当选,排除①;鸡蛋为生活必需品,商品价格变动对生活必需品的影响较小,④比③更符合题意,④当选。 4.打折促销是企业在特定市场范围或经营时期内,根据商品原价确定让利系数,进行减价销售的一种方式,是现代市场上频繁采用的一种促销手段。打折对消费者的影响,可示意为(B) [解析]商品价格的变化与需求量的变化呈反向关系,A、D错误;“打折促销”意味着商品价格下降,人们增加对该商品的购买,导致其需求量增加,B正确;C表示的是在价格不变的情况下,需求量增加,不符合题意。 5.下面是不同商务模式的一般流程图。 《元素周期律和元素周期表第二课时》习题 考查点一:元素周期表的结构 1.下列元素在元素周期表“金属区与非金属区分界线”上的是 ( )。 A.Be和Al B.F和Cl C.As和Sb D.Li和Na 解析沿着硼、硅、砷、碲、砹和铝、锗、锑、钋的交界处画一条虚线,该虚线将元素进行分区,左侧为金属元素,右侧为非金属元素。 答案 C 2.A、B为短周期元素,B3+比A2-离子少一个电子层,若A的原子序数为n,则B的原子序数为( )。 A.n+5 B.n+11 C.n-3 D.n+3 解析A、B为短周期元素,B3+比A2-少一个电子层,A、B属同周期元素且A、B均不在第一周期,A、B在第二或第三周期,A最外层有6个电子,B最外层有3个电子,A原子序数为n,B原子序数为n-3。 答案 C 3.ⅡA族元素的原子序数为x,则同周期ⅢA族元素的原子序数( )。 A.只有x+1 B.可能是x+8 C.可能是x+2 D.可能是x+1或x+11或x+25 解析如果是第2、3周期元素,原子序数相差1;如果是第4、5周期元素,原子序数相差11;如果是第6周期元素,原子序数相差25。 答案 D 4.下列各表为元素周期表的一部分(表中数字代表元素的原子序数),其中正确的是( )。 A B C D 解析2号元素位于零族,3、11、19号元素位于第ⅠA族,6、14、32号元素位于第ⅣA族,12号位于第ⅡA族,7号元素位于第VA族,故A、B、C项错误,D项正确。 答案 D 5.一些科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表第7周期、ⅣA族。由此,下列说法正确的是 ( )。 A.第7周期有50种元素 B.该原子的质量数是184 C.该元素相对原子质量是292 D.该原子核外有114个电子 答案 D 6.A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C 两元素的原子核外电子数之和等于B元素原子的质子数。B元素原子核 内质子数和中子数相等。 (1)写出A、B、C三种元素的名称__________、__________、__________。 (2)B位于元素周期表中第______周期第________族。 (3)C的原子结构示意图为__________。 解析设元素A、C之间的元素的原子序数为x,则元素A的原子序数为x-1,元素C 的原子序数为x+1,元素B的原子序数为x+8,由题意知,x-1+x+1=x+8,所以x=8,故元素A为氮元素,元素B为硫元素,元素C为氟元素。 答案(1)氮硫氟(2)3 ⅥA (3) 7.某研究性学习小组以元素周期表为课题研究“短周期元素在周期表中的分布”,他们提出三种方案,所得三种周期表,第2、3周期的元素位置未变化,仅第1周期的H、He 两元素位置改变。试依据方案,完成以下问题: (1)方案Ⅰ:根据已制得的活泼金属氢化物,如KH,可将氢元素归为__________族,氦元素原子的最外层电子数为2,已达到稳定结构,属于__________族。 (2)方案Ⅱ:氦元素的位置不变,氢元素的位置根据同族元素最高正化合价与最低负化合价的绝对值相等,可归为__________族。 (3)方案Ⅲ:根据同族元素原子最外层电子数相等,应将氦元素归为__________族。 解析(1)根据活泼金属氢化物KH中氢元素的化合价为-1价,这与卤族元素性质类似, 第一课第一框 揭开货币的神秘面纱 一、货币的本质 1.商品及其基本属性 (1)含义:商品是用于________的劳动产品。 (2)商品的基本属性:________和_____________是商品的两个基本属性。 ①____________是指商品能够满足人们某种需要的属性。 ②_________是指凝结在商品中的无差别的人类劳动。 (3)商品交换的本质:商品生产者之间的________交换。 2.货币的产生 (1)货币是________________发展到一定阶段的产物。 (2)最初的商品交换是物物交换,为克服物物交换存在的困难,出现了大家普遍乐意接受的商品,即__________________。 (3)一般等价物是从________中分离出来, 可以直接和其他一切商品相交换并表现其他一切____________的商品。 3.货币的本质 (1)含义:货币是从商品中分离出来的_______地充当一般等价物的商品。 (2)货币的本质是________________。 二、货币的基本职能 1.货币的职能的含义 货币在经济生活中所起的__________,是货币_________的体现。 2.货币的基本职能 货币从________时起,就具有价值尺度和____________两种基本职能。 (1)价值尺度①含义:货币所具有的表现和衡量其他一切商品______________的职能。 ②特点:货币在执行该职能时,并不需要_______的货币,只需要_______上的货币。 (2)流通手段 ①含义:货币充当商品交换______的职能。②特点:货币在执行该职能时,必须用现实的货币。 3.货币流通规律 在一定时期内,流通中所需要的货币量同商品价格总额成正比,同货币流通速度成反比。用公式表示:流通中所需要的货币量= _______________/__________________。 4.货币的其他职能: 贮藏手段、____________、世界货币等职能。 三、纸币 1.含义:纸币是由国家(或某些地区)发行的、_________使用的______________。 2.发行规律:纸币的发行量必须以流通中所需要的_________为限度,否则,可能会出现通货膨胀或通货紧缩,影响人民的生活和社会的经济秩序。 3.通货膨胀:是指经济运行中出现的 ______、_______的物价上涨的现象。 4.通货紧缩:与通货膨胀相反,它表现为物价全面持续_________,通常伴随着经济衰退出现。 5.电子货币:随着信息技术的迅猛发展,特别是银行计算机________的实现,出现了用_______________进行贮存、转账、购买、支付的____________________。 第一课第二框信用工具和外汇一、信用工具 1.结算方式和信用工具 (1)结算方式 第2课时 三维目标 知识与技能 1.掌握卤族元素的性质与原子结构的关系。 2.了解核素、同位素、质量数等概念。 过程与方法 1.归纳、比较法:归纳总结卤族元素性质。 2.自主探究:探究卤族元素性质递变规律。 情感、态度与价值观 1.通过探究、分析,培养学生创新思维能力。 2.培养理论联系实际的能力。 要点提示 教学重点 卤族元素性质与原子结构的关系。 教学难点 质量数、同位素、核素的概念。 教具准备 多媒体课件、实物投影仪、试管、烧杯、胶头滴管;新制饱和氯水、NaBr溶液、KI溶液、CCl4、苯、溴水。 教学过程 导入新课 师:上节课我们学习了元素周期表的结构,请同学们画出周 期表的短周期部分。 生:练习。 (实物投影:两份同学的作业) 请几位同学点评存在的问题。 生1:未标主、副族。 生2:未把过渡元素位置留出。 师:看似简单,要正确画出,必须做有意识的记忆。 推进新课 师:在必修1中我们已经学过氯气的性质,请同学们画出Cl 原子结构示意简图。并在周期表中找到氯元素所在的位置,说出卤族元素包含哪几种元素。 生:看书。翻阅周期表。 师:借鉴上节课推导碱金属元素的性质递变规律的方法,结合已学过的氯元素的性质,根据教材提供的卤素的原子结构,请同学们推测氟、溴、碘的可能性质,并比较与Cl2的相同与不同之处。 板书:一卤族元素 1.结构 2.性质 生1:氯原子最外层有7个电子,很容易得到1个e-而表现出很强的氧化性,Cl2很活泼,是典型的强氧化剂,可以和金属、H2、H2O等反应,我认为F、Br、I原子结构与Cl原子 相似,最外层都有7个电子,F2、Br2、I2也应该是较强的氧化剂,也可以和金属、H2、H2O等发生反应。 板书:3.性质变化规律 生2:碱金属元素中,Li、K与Na性质相似,是由于它们的原子结构相似。但它们的原子结构也有不同之处:原子序数不等,原子半径不等,因此导致了性质上的不同。F、Br、I原子结构也有与Cl原子结构不同地方,因此,F2、Br2、I2的性质与Cl2也有不同的地方。 生3:从Li→Cs,原子半径逐渐增大,原子核对核外电子的引力逐渐减弱,越来越容易失去电子。卤族元素与之相似,从F→I,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,因此,F2、Cl2、Br2、I2的氧化性可能依次减弱。 师:同学们分析得很有道理,理论推测是否正确呢?如何验证? 生:可以通过实验验证。 多媒体播放 元素非金属性强弱判断依据 1.非金属元素单质与H2化合的难易程度:化合越容易,非金属性也越强。 2.形成气态氢化物的稳定性:气态氢化物越稳定,元素的非金属性也越强。 第2课《雨巷》教案 一、导入新课 听歌曲《雨巷》。同学们,在正式进入新课之前,我想先请大家听一首歌。听歌的时候请同学们一起闭上眼睛,感受一下歌曲的旋律和意境。 听完歌曲,教师提问:这首歌给我们描绘的是怎样的一个画面?表达了怎么样的感情? 这首歌曲《雨巷》是根据我国现代的著名诗人戴望舒的同名诗歌改编的,今天我们就来学习这首优美的诗歌,让我们来感受一下,诗人通过这首诗歌到底要表达怎么样的感情,看看与同学们的理解到底一不一样?现在就让我们一起走进《雨巷》,走进戴望舒的内心世界…… 二、整体感知。 1、集体朗读,初步感知诗歌的感情基调。 ①相信同学们已经预习过课文了,那就请大家一起带着感情地朗读一下这首诗。 ②读完全诗,你最强烈的情感体验是什么?(忧愁的,哀伤的) ③是的,诗中没有大江东去似的慷慨豪迈,也没有涓涓细流似的轻快明丽,而是笼罩着一层淡淡的忧愁。那么,我们该用怎样的感情基调去朗读呢?(低沉的,感伤的) ④对,咱们把它概括为低沉幽怨,行吗?(生表示赞同),那就让我们读出这种感觉来。 2、请一位学生单独朗读。 ①那么谁愿意来给我们大家朗读一下呢? ②表扬一下。节奏把握得较好,能体现感伤忧愁的感情基调。 3、这首诗中,诗人用了哪些词语着意表现诗歌的这种凄美、感伤的基调? ①诗人在描写"我"时,用了"彷徨""彳亍""冷漠" "凄清" "惆怅"等词语来表现诗人的孤寂、迷惘的心情。 ②在描写"姑娘"时,用了"哀怨又彷徨""结着愁怨" "凄婉迷茫"表现了"姑娘"像"我"一样的迷惘、彷徨。 ③在描写雨巷时,用了"颓坦" "寂寥"两个词,描绘了一幅寂寞、凄清的"雨巷"图 三、创作背景,作者生平 1、大家读了一遍,便有了这么多的感觉。的确,我们感觉到这首诗很低沉、伤感,充满着愁绪和无奈。"我"为什么会这样哀怨?为什么会产生这样失落、惆怅的情感呢?让我们来了解一下作者。 明确:戴望舒(1905-1950),浙江杭县人,现代诗人。主要有诗集《我的记忆》(包括《旧锦囊》、《雨巷》、《我的记忆》三辑,与1929年出版)、《望舒草》等。他是中国新诗发展中“现代派”的代表诗人,成名作《雨巷》被叶圣陶先生誉为“替新诗的音节开了一个新的纪元”,作者也由于此诗获得“雨巷诗人”的称号。 《雨巷》产生的1927年夏天,是中国历史上一个最黑暗的时代。反动派对革命者的血腥屠杀,造成了笼罩全国的白色恐怖。原来热烈响应了革命的青年,一下子从火的高中堕入了夜的深渊。他们中的一部分人,找不到革命的前途。他们在痛苦中陷于彷徨迷惘,他们在失望中渴求着新的希望的出现,在阴暗中盼望飘起绚丽的彩霞。《雨巷》就是一部分进步青年这种心境的反映。 四、内容理解。意象和象征。 1、《雨巷》是在这样的背景下创作的,原来诗人有着这样的情感和经历。因而,他会在诗歌里选取一些形象来传达自己的思想感情。这些凝聚着诗人情感的形象,我们称之为意象。下面我再请一位同学朗读这首诗,其他的同学找一找这首诗中作者描绘了哪些意象? ①"雨巷" ②"丁香般的姑娘" ③"我" ④"油纸伞" ⑤"颓圮的篱墙" ⑥"太息一般的眼光" 明确:诗歌的意象不同于一般的形象,它是凝聚着诗人情感的形象。因此,这首诗中的主要意象有三个"我""丁香一样的结着愁怨的姑娘""雨巷"。而其余几个形象则属于诗歌的细节。 2、在描写姑娘这一意象时,诗人为什么把她比喻为丁香般的姑娘,而不用精品教案 元素周期表(第二课时)
《元素周期表》第二课时教学设计
元素周期表第二课时教学设计
人教版语文必修一第2课《诗两首》测试卷(含答案解析)
高中语文 人教版必修一第一单元第2课诗两首《再别康桥》教学设计
高中化学必修二元素周期表专题练习(带答案)
2018年秋人教版高一历史必修一试题:第2课 随堂练习
人教版高中政治必修一第二课教案
元素周期表(第二课时)
高中化学必修二元素周期表专题练习(带答案)
高一历史必修一第二课知识点
高中化学新人教版必修1第4章 第1节 课时2 元素周期表 核素学案
高一化学必修二元素周期表知识点总结
最新人教版高一历史必修一试题:第2课 课时作业 Word版含解析
2020人教版政治必修一 第2课 第2框
《元素周期律和元素周期表第二课时》习题1
高中政治必修一(第一课至第二课)知识点
元素周期表第2课时
高中语文必修一第2课 《雨巷》公开课教案
