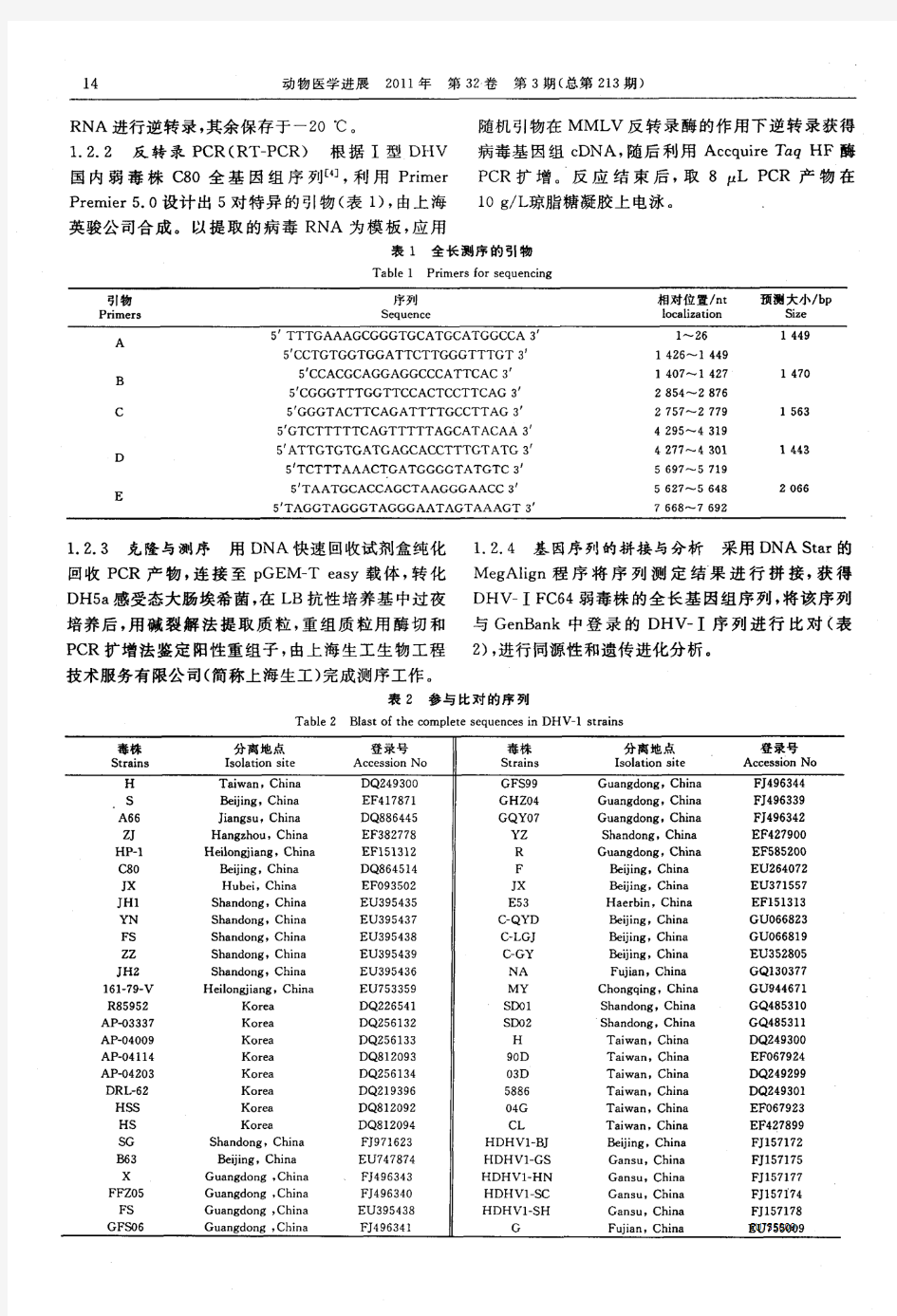
鸭肝炎病毒FC64株的全基因组序列测定与分析

(推荐)乙型肝炎病毒耐药基因及分型检测
乙型肝炎现状如何? 乙型病毒性肝炎是由乙肝病毒(hepatitis B virus,HBV)感染引起的、以肝脏炎性病变为主,并可引起多器官损害的一种疾病,主要存在于肝细胞内,可引起肝细胞炎症、坏死和纤维化。 乙型肝炎病毒(HBV)感染呈世界性分布,全球约有3.6亿感染者,每年约有100万人死于与HBV相关的肝脏疾病。我国属于感染的高发区,现有的慢性HBV感染者约9300万例。 乙型肝炎病毒(HBV)基因分型的临床意义 HBV根据DNA差异可分为A、B、C、D、E、F、G、H八种类型,不同型别在流行特征,致病性,对药物治疗反应等方面存在差异,其中,我国以B型和C型为主,感染HBV基因型B的患者发生肝纤维化及肝细胞癌的平均年龄要比感染HBV基因型C的患者的年龄大。 通过分型检测,可判断病毒复制活跃程度及突变发生率情况。研究表明,与HBV-B型相比,C型复制较活跃,不易发生HBeAg血清转换;HBV-B型易产生前C区突变,C型核心启动子区变异发生率更高,与重型肝炎发病机制密切相关,可作为肝癌高危指标之一。同时,HBV-B、C型患者易产生拉米夫定耐药突变,通过分型检测,可指导临床治疗方案制定,有针对性进行临床治疗,更大程度上提高患者的生活质量。 乙肝的治疗方式有哪些? HBV感染主要的治疗方法是抗病毒治疗,国内外普遍使用的药物有干扰素和核苷(酸)类。由于干扰素需要反复注射,且副作用较多,近年来,核苷(酸)类似物(NA)已成为抗HBV感染的主要方法之一,NA因其抑制病毒复制能力强、使用方便、耐受性好且疗效确切,适用于不同阶段的肝病患者,是长期治疗的合理选择。但随着治疗时间的延长,往往会出现病毒耐药株,从而需要监测乙型肝炎病毒耐药基因型,指导临床用药。 乙肝病毒产生耐药的机理是什么? HBV对某种药物的耐药性一般是指由HBV基因组上某些位点的变异导致这种药物对HBV的抑制作用减弱或无作用。通常分为以下几种: (1)原发性耐药变异:指药物作用靶位的基因及其编码的氨基酸发生变异,导致变异病毒株对治疗药物的敏感度下降; (2)继发性耐药变异(又称补偿性耐药变异):指由于原发性耐药变异病毒株复制能力下降,在原发性耐药变异的基础上,病毒株也可在其他位点发生变异,这些变异可部分恢复变异病毒的复制能力或可导致变异病毒对药物敏感度的进一步下降; (3)基因型耐药:指检测到已在体外的表型分析研究中被证实与抗病毒药物耐药相关的HBV变异; (4)表型耐药:通过体外复制系统证实检测到的HBV变异会降低其对抗病毒药物的敏感度。 HBV属于嗜肝DNA病毒科,基因组长约3.2kb,是部分双链环状DNA结构。HBV基因组含有4个部分重叠的开放读框(open reading frame,ORF),分别为S基因区、C基因区、P基因区和x基因区。产物为含末端蛋白、间隔区、逆转录酶区和RNA酶H区4部分的HBV聚合酶。 HBV虽然属于DNA病毒,但其复制过程并非DNA—DNA的直接复制过程,而是经过前基因组RNA的中间过程,即DNA—RNA—DNA的复制过程。在前基因组RNA逆转录为负链DNA的过程中,HBV逆转录酶由于缺乏严格的校正机制,导致HBV复制过程中核苷酸错配率较高,发生变异的频率为每年(1.4~3.2)X105核苷酸替换/位点。HBV复制的这种过程和特点,决定了同一患者体内不同的HBV株基因序列之间也存在差别。 核苷(酸)类药物主要通过抑制HBV聚合酶的逆转录酶区活性,阻止HBV复制过程中以HBV的前基因组RNA为模板逆转录生成新的病毒DNA,从而发挥抑制病毒复制的作用,HBV前基因组RNA是以HBV的cccDNA 为模板合成的,即NA的药效靶点在cccDNA的下游,所以NA不能直接清除已经存在的cccDNA。
肉鸭常见三大传染病
肉鸭常见三大传染病 (一)鸭病毒性肝炎: 是由鸭病毒性肝炎病毒引起的雏鸭急性传染病,主要发生于3—20日龄雏鸭,春季3-4月份最易流行,一周龄以内的小鸭死亡率可达80%以上,2—3周龄50%左右。4周龄以后发病死亡率很低。其临床症状主要为神经症状,角弓反张。全身痉挛,头竭力向背部后勾,双脚向后反复抽蹬,很快衰竭死亡。 病理变化主要是肝脏肿大,表面有散在大小不等的出血点,胆囊肿大,充满胆汁,肾多数肿胀,脾肿大,成花斑状。 在疫区,一日龄雏鸭,在颈背部皮下,注射高免血清,预防量0.5ml,治疗量1.0ml,连续2—3天。如用鸭病毒性肝炎弱毒苗注射1—7日龄雏鸭,5—6天产后生保护力。 根本解决本病的办法是种鸭在产蛋前一个月,注射鸭病毒性肝炎病毒,二周后重复接种一次,可为其后代提供三周保护力。(二)鸭瘟(鸭病毒性肠炎):
是由疱疹病毒引起的一种急性、高度致死性的传染病,其特征为两脚麻痹,腹泻,粪便呈绿色或青灰色,部分病鸭头颈肿大,俗称“大头瘟”或“软脚瘟”,死亡率可达60—90%。 该病对不同年龄和品种的鸭均可感染,具有诊断意义的病理变化,主要为食道粘膜有条纹状黄色假膜,剥离后留下溃疡。泄殖腔病变与食道相似,但不易剥离。 一旦发病,迅速将鸭群分离成病鸭群、假定健康群和健康群,隔离饲养,并紧急接种疫苗,初期感染的鸭群,注射鸭瘟高免血清1—2ml,有一定疗效,鸭瘟流行地区和受威胁地区,20日龄以上雏鸭接种疫苗,可保护6个月,成年鸭接种疫苗,可保护一年。(三)鸭传染性浆膜炎: 本病是由鸭疫里奥氏杆菌引起的急性或慢性传染病,我国在1982年,在北京地区饲养的北京鸭中,首先发现此病,1—3周龄的鸭都易感,但以2—4周龄的雏鸭高发,在污染的环境中,发病率可达90%,死亡率50—90%不等,饲养管理粗放,环境被污染,
全基因组重测序数据分析
全基因组重测序数据分析 1. 简介(Introduction) 通过高通量测序识别发现de novo的somatic和germ line 突变,结构变异-SNV,包括重排 突变(deletioin, duplication 以及copy number variation)以及SNP的座位;针对重排突变和SNP的功能性进行综合分析;我们将分析基因功能(包括miRNA),重组率(Recombination)情况,杂合性缺失(LOH)以及进化选择与mutation之间的关系;以及这些关系将怎样使 得在disease(cancer)genome中的mutation产生对应的易感机制和功能。我们将在基因组 学以及比较基因组学,群体遗传学综合层面上深入探索疾病基因组和癌症基因组。 实验设计与样本 (1)Case-Control 对照组设计; (2)家庭成员组设计:父母-子女组(4人、3人组或多人); 初级数据分析 1.数据量产出:总碱基数量、Total Mapping Reads、Uniquely Mapping Reads统计,测序深度分析。 2.一致性序列组装:与参考基因组序列(Reference genome sequence)的比对分析,利用贝叶斯统计模型检测出每个碱基位点的最大可能性基因型,并组装出该个体基因组的一致序列。3.SNP检测及在基因组中的分布:提取全基因组中所有多态性位点,结合质量值、测序深度、重复性等因素作进一步的过滤筛选,最终得到可信度高的SNP数据集。并根据参考基 因组信息对检测到的变异进行注释。 4.InDel检测及在基因组的分布: 在进行mapping的过程中,进行容gap的比对并检测可信的short InDel。在检测过程中,gap的长度为1~5个碱基。对于每个InDel的检测,至少需 要3个Paired-End序列的支持。 5.Structure Variation检测及在基因组中的分布: 能够检测到的结构变异类型主要有:插入、缺失、复制、倒位、易位等。根据测序个体序列与参考基因组序列比对分析结果,检测全基因组水平的结构变异并对检测到的变异进行注释。
鸭常见疾病诊断
肉鸭常见的病毒病有:鸭病毒性肝炎、鸭瘟; 常见的细菌病有:传染性浆膜炎、大肠杆菌病,巴氏杆菌病;支原体病; 寄生虫病多见于球虫病。 1. 鸭病毒性肝炎:由鸭肝炎病毒引起,多见于3周以下的雏鸭发病。 ①表现:突然发病,无任何症状死亡,几小时后波及全群,精神委靡、缩头、垂翅、 闭眼;运动失调,倒地旋转,角弓反张;少数病鸭腹泻,排黄白色或灰绿色稀便, 病重者爪呈紫红色。 ②剖检:肝脏肿大,质地柔软,呈淡红色或外观呈班驳样;表面有出血点或出血斑; 脾肿大,呈班驳样;肾肿,充血;胆囊扩张,胰腺肿大。 ③治疗:早期用抗病毒药+广谱抗菌药+电解多维治疗有效,中后期治疗效果较差; 病鸭用高免血清治疗效果显著,发病早期每只雏鸭肌肉或皮下注射康复血清或高 免血清0.5毫升能够防止感染发病和降低死亡率。 2.鸭瘟:又名鸭病毒性肠炎,大头瘟,由鸭瘟病毒引起,多见于15—20天以后的 肉鸭发病。 ①表现:病鸭高热不退,食欲降低,渴欲增加,两肢发软,常卧地不起;病鸭眼,流泪,有 脓性分泌物,眼睑水肿,流鼻涕,头颈肿大;腹泻,排出绿色或灰白色粪便,翻 开泄殖腔可见黏膜上充血、水肿、有出血点,严重时覆盖一层假膜。 ②剖检:皮肤皮下充血出血;全身浆膜黏膜和内脏器官有出血斑,腺胃黏膜出血,淋巴组织 坏死,消化道黏膜有坏死斑点、出血、溃疡或形成假膜;肝脏上有白色点状坏死 和出血斑,胆囊肿大,气管黏膜出血。
③治疗:早期用抗病毒药+广谱抗菌药+电解多维治疗有效,中后期治疗效果较差;高免血清 早期治疗,每只鸭肌肉注射0.5—1.0ml有一定疗效;聚肌胞〔一种内源性干 扰素〕进行早期治疗,每只鸭肌肉注射1.0ml,3天1次,连用2—3次。 3.传染性浆膜炎:由鸭疫里氏杆菌引起,2周以后易发病。 ①表现:急性病例突然死亡,病鸭表现精神沉郁、厌食、呆立、咳嗽、眼鼻分泌 物增多;死前神经症状明显,头颈震颤、摇头或点头,呈角弓反张,也有的 鸭死前阵发性痉挛。 ②剖检:主要特征浆膜出现广泛性的多少不等的纤维素性渗出,心包膜、肝被 膜、气囊及脑膜常见。 ③治疗:用氟苯尼考、丁胺卡那、先锋霉素、氧氟沙星、林可霉素等治疗有效。 4.巴氏杆菌病:又称禽出败、禽霍乱,由多杀性巴氏杆菌引起,多发于中后期。 ①表现:精神呆顿、食欲废绝、口渴增加;口鼻中流出黏液,呼吸困难,口张 开、频频摇头,又称“摇头瘟”,病鸭剧烈腹泻,排除绿色或白色稀粪,有时 混有血液;瘫痪死亡。 ②剖检:卡他性出血性肠炎,气囊和肠管表面有一种黄色的干酪样渗出物沉积, 肝脏肿大,色泽变淡,质地稍硬,表面散布着许多灰白色针头大的坏死点。 ③治疗:用喹诺酮类(氟哌酸、环丙杀星等),磺胺类药物,链霉素、土霉素、 庆大霉素、氟苯尼考等治疗有效。 5.大肠杆菌病:由大肠杆菌引起,多见于卫生条件差的鸭群,10日龄以后多发。 ①表现:患鸭食欲减退或废绝,精神不振,呼吸困难,咳嗽,黄绿色水样腹泻,死 前有神经症状,体重迅速减轻。
鸭肝炎病毒株的分离、鉴定和致病性
毕业论文 外文文献翻译 姓名 学号201208920145年级2012级 专业动物医学 系(院)生命科学学院 二〇一四年四月
鸭肝炎病毒株的分离、鉴定和致病性 摘要[目的]本研究的目的是确定和分析病原体以及最近流行的鸭病毒性肝炎难以控制的原因.[方法]从临沂、潍坊和滨州以及山东省的其他地区呈典型的临床症状的鸭的肝脏和脾脏分离到的病毒,接种于鸡胚或鸭胚,进行RT-PCR,血清学试验、鸭回归试验对其致病特点进行了观察。[结果]分离到4种鸭肝炎病毒(DHV)毒株,以及第5代尿囊液的半数致死量为103.41-105.20每毫升。在DHV 病毒株和1型鸭肝炎病毒之间,血清交叉保护率为20%-80%。4日龄健康鸭的死亡率为50%-100%。所有的可疑鸭有鸭病毒性肝炎的典型病变,24-48小时后死亡高峰出现。[结论]不同DHV的毒力菌株有区域差异。 关键词:鸭肝炎病毒;鉴定;分离;毒力 鸭病毒性肝炎(DVH)是由鸭肝炎病毒(DHV)引起雏鸭的一种急性严重传染病,它的特征病变是肝炎和出血。鸭肝炎病毒可以分为三种类型,I型鸭病毒性肝炎分布于全球,1型鸭肝炎病毒的变异株已经在印度,埃及和美国发现。鸭肝炎病毒在欧洲、美国和亚洲国家广泛传播,导致了养鸭业的严重损失。在中国,1958年首次分离到鸭肝炎病毒。鸭肝炎病毒已经在许多地区发生或流行,严重影响养鸭业的发展。为了有效地控制鸭病毒性肝炎的发生和流行,并确定其病原,我们分离并鉴定了4株DHV 。此外,并观察它们的生物学特性。 1.材料和方法 1.1 材料标准的冻干AV21-1-1株和Ⅰ型DHV阳性血清是从中国兽医药品监察所(中国北京)购得,9-11日龄SPF鸡胚从北京梅里亚重要实验动物技术有限公司(中国北京)购买,11-12日龄非免疫鸭胚从山东昌邑孵化场(中国潍坊)购得,4日龄雏鸭从平度鸭场购买(中国平度)。 1.2 样品采集在临沂、潍坊、滨州及山东省其他地区无菌采取疑似鸭病毒性肝炎的肝脏,制备组织涂片。分别分别接种肝脏样品于琼脂平板,巧克力琼脂平板和麦康凯琼脂平板上,接着在有氧或无氧条件下,37℃下培养3-4天。将培养物进行亚甲基蓝染色和革兰氏染色后,在显微镜下观察,以确定是否有细菌存在。病料用研钵分别研碎,加人3一5倍的灭菌生理盐水后,加人终浓度为1000ug/ml 的青霉素、链霉素,在4℃保存,备用。3000 r / min 离心10分钟,弃去上层脂肪和沉淀颗粒。取中间的透明液体,-20℃保存。 1.3 鸡胚接种通过尿囊腔接种10枚9-11日龄鸡胚,0.2ml每胚,然后在37℃下培养,分别控制鸡胚接种的DHV AV21-1-1株和接种生理盐水。对鸡胚的生长和生
乙型肝炎病毒分型(B型、C型、D型)和耐药突变基因检测.doc
乙型肝炎病毒分型(B型、C型、D型)和耐药突变基因检测 一.检验项目:乙型肝炎病毒分型(B型、C型、D型)和耐药突变基因检测 二.检验目的:在进行抗病毒治疗前和抗病毒治疗中进行乙型肝炎病毒分型和耐药突变基因检测,能够:1). 区分中国和其他亚洲国家常见的HBV-B、C、D基因型; 2). 检测HBV抗病毒药物5个热点突变位点的6种突变类型; 3). 对HBV实行动态监控,辅助确定个性化的临床诊疗方案,进行HBV流 行病学研究。 三.临床意义: HBV基因型分为9种(A-I),其分布具有地域性,中国乃至亚洲流行的乙型肝炎病毒几乎都是B、C型,此外还有少量D型,不同的基因型易发生的突变类型不同,与病情转归也密切相关,如基因型C较B更容易引起严重的肝炎或肝癌,对干扰素的应答率A型高于D型,B型高于C型,C型高于D型。与C型患者相比,B型患者较早出现HBeAg血清学转换,较少进展为慢性肝炎,肝硬化和原发性肝细胞癌。 核苷(酸)类似物,如拉米夫定(Lamivudine,LMV),替比夫定(Telbivudine,LdT),阿德福韦酯(Adefovir,ADV)和恩替卡韦(Enticavir,ETV)等是抗HBV常见药物。但这些药物都无法彻底清除大多数乙肝病人体内的HBV,患者需要长期维持治疗。HBV在宿主体内感染以及抗病毒治疗的过程中会发生基因变异,并在宿主体内免疫系统的压力下和在治疗干预过程中进行变异的优势选择,以达到逃逸免疫、对抗药物、实现物种生存的目的,进而发生耐药。乙肝病人一旦出现耐药突变,其肝功能恶化的比例将显著增高,甚至快速进展至肝衰竭。 四.标本送检要求:4ml黄色帽血清管,空腹采集后立即送检,室温放置不宜超过2小时,如不能立即送检可于4℃保存一周,如需长期保存请放入-20℃冻存,运输过程中请注意保持低温。 五.开单名称:乙型肝炎病毒分型和耐药突变基因检测 进入本科室“医生工作站”→选择开单病人“姓名”→选择“项目类别”→选择“检验” →选择“乙型肝炎病毒分型和耐药突变基因检测”→确定 或进入本科室“医生工作站”→选择开单病人“姓名”→选择“项目类别”→选择“检验”→选择“实验室”→选择“乙型肝炎病毒分型和耐药突变基因检测”→确定六.收费:570元/例 七.送检时间:周一至周日8:00am-12:00am 八.送检地点:检验科三楼服务台 九.报告时间:抽血后,7个工作日后进入我院计算机检查报告系统,查看检测结果。 联系电话:84206146 检验科
鸭病毒性肝炎的治疗方法
鸭病毒性肝炎的治疗方法 鸭病毒性肝炎简称鸭肝炎,是由鸭病毒性肝炎病毒引起雏鸭的一种以肝脏呈现出血性炎症为特征的急性烈性传染病。主要特征为肝脏肿大,有出血斑点和神经症状。 本病主要发生于4~20日龄雏鸭,成年鸭有抵抗力,鸡和鹅不能自然发病。病鸭和带毒鸭是主要传染源,主要通过消化道和呼吸道感染。饲养管理不良,缺乏维生素和矿物质,鸭舍潮湿、拥挤,均可促使本病发生。本病发生于孵化雏鸭的季节,一旦发生,在雏鸭群中传播很快,发病率可达100%。 本病潜伏期1~4天,突然发病,病程短促。病初精神萎靡,不食,行动呆滞,缩颈,翅下垂,眼半闭呈昏迷状态,有的出现腹泻。不久,病鸭出现神经症状,不安,运动失调,身体倒向一侧,两脚发生痉挛,数小时后死亡。死前头向后弯,呈角弓反张姿势。本病的死亡率因年龄而有差异,1周龄以内的雏鸭可高达95%,1~3周龄的雏鸭不到50%;4~5周龄的幼鸭基本上不死亡。剖析可见特征性病变在肝脏。肝肿大,呈黄红色或花斑状,表面有出血点和出血斑,胆囊肿大,充满胆汁。脾脏有时肿大,外观也类似肝脏的花斑。多数肾脏充血、肿胀。心肌如煮熟状。有些病例有心包炎、气囊中有微黄色渗出液和纤维素絮片。 肝脏水肿,并有许多针尖大至黄豆粒大出血点。胆囊肿大,充满胆汁。显微镜下观察,肝细胞在感染初期呈空泡化,后期则出现病灶性坏死,中枢神经系统可能有血管套现象。脾肿大,呈斑驳状。肾肿胀,血管明显,呈暗紫色树枝状。 治疗方法:对雏鸭采取严格的隔离饲养,尤其是5周龄以内的雏鸭,应供给适量的维生素和矿物质,严禁饮用野生水禽栖息的露天水池的水。孵化、育雏、育成、肥育均应严格划分,饲管用具要定期清洗、消毒。流行初期或孵坊被污染后出壳的雏鸭,立即注射香港龙达生物的高免血清—鸭肝双抗,每只0.3~0.5毫升,可以预防感染或减少病死。
浅析乙肝病毒基因突变检测及治疗(一)
浅析乙肝病毒基因突变检测及治疗(一) 一、概况 由于我国人民生活水平低和卫生资源溃乏,造成乙肝泛滥。据统计:我国有乙肝病毒携带者约1.5亿、慢性迁延性肝炎约2500万、慢性活动性肝炎约1000万、重症肝炎约150万、肝硬化约100万和肝癌16~30万。肝硬化和肝癌80%以上是由乙肝病毒引起,而且80%左右来源于家族性垂直传播、与病人接触而感染机率很少。乙肝传染病已被国家疾病预防控制中心列为重点监控的疾病之一。 乙型肝炎病毒(HBV)属嗜肝病毒科,基因结构复杂,根据HBV-DNA核苷酸序列异质性≧8%为一种基因型的规定,HBV目前分为A~H8个基因型,其中A、B、C、F4个基因型存在不同的亚型,且分布呈区域性。由于其在复制过程中HBV-DNA聚合酶缺乏校正功能,导致易于变异,有报导HBV的基因型与基因型变异可能与HBV相关性肝癌的发生发展有关。HBV 变异给疾病的预防、诊断、治疗和预后带来了新问题,不同基因型的基因变异、临床表现及对抗病毒、肝移植等的治疗反应存在差异。 二、变异及区域 HBV受自然压力、个体免疫力和药物治疗作用出现变异。HBV有四个开放阅读框架(ORE)即S、C、P、X区。 1、C区变异:用基因芯片检测HBV前C区和C基因启动子(BCP)区4位点突变,发现前C 区A1896、前C区A1814、BCP区nt176 2、BCP区nt1764突变检出率分别是58.57%、12.86%、54.29%、52.86%。突变的发生依次是慢重肝、慢乙肝重度、中度、轻度,血清病毒标志是HBeAg(-)HBeAb(+)、HBV-DNA定量在104-106copy/ml之间的突变发生率最高。可以解释小三阳DNA阳性之原因:HBeAg前C区A1896位的G变异成A,密码子UGG变为终止UAG,使HBeAg不能合成,但不影响病毒复制。 2、S区变异:前S1有识别功能,前S2是介导受体进入功能。前S区的变异可能是病毒逃避宿主免疫的一种方法,前S区的变异决定不同的HBV亚型。124、131位变异或122-124间插入变异可改变S抗原决定簇的构型,致HBsAg假阴性。145、141、126、133位氨基酸的改变,用常规试剂仍可检出HBsAg,但可能削弱HBsAg的无免疫性,使高效价的乙肝免疫球蛋白或接种诱生的HBsAb难与变异株的HBsAg结合,缺乏中和特性,使HBsAg与HBsAb 同时阳性。在HBV-DNA阳性时,无论是乙肝病毒基因变异株或野毒株,前S1抗原是判断乙型肝炎病毒复制的重要指标。 3、P区变异:用微孔板核酸杂交法检测乙肝病毒P基因区变异,突变位点主要位于HBV-DNA 聚合的区域(YMDD),M1(蛋氨酸)可被VC(缬氨酸)或IC(异亮氨酸)替代。研究用拉米夫啶(LMV)治疗慢性乙肝而发生耐药的有关变异可见:LMV本身可引起HBV的变异即YMDD变异,用LMV四周后50-70%的病人出现YMDD变异。 4、X区变异:HBV-X蛋白对信号转导通路及细胞凋亡有影响,X蛋白对核转运影响和对线粒体直接作用。X区变异引起X蛋白(HBXAg)过度表达,激活体内癌基因和抑制抑癌基因,导致肝癌的发生。有报导:用聚合酶链反应检测原发性肝细胞癌(HCC)患者癌组织及癌周组织中HBV-X基因,检出率分别为68%和77%。
人类全基因组测序
1 技术优势 全基因组测序(Whole Genome Sequencing,WGS)是利用高通量测序平台对人类不同个体或群体进行全基因组测序,并在个体或群体水平上进行生物信息分析。可全面挖掘DNA 水平的遗传变异,为筛选疾病的致病及易感基因,研究发病及遗传机制提供重要信息。 全基因组测序 平台优势 HiSeq X 测序平台 读长:PE150 通量:1.8T/run 测序周期:3 天 专为人全基因组测序准备、测序周期短、通量高
生物信息分析 技术路线 技术参数 样品要求 样本类型:DNA 样品 样本总量:≥1.0 μg DNA (提取自新鲜及冻存样本) ≥1.5 μg DNA (提取自FFPE 样本)样品浓度:≥ 20 ng/μl 测序平台及策略HiSeq X PE150 测序深度 肿瘤:癌组织(50X),癌旁组织/血液样本(30X)遗传病:30~50 X 项目周期37天
3 案例解析 该研究选取3个家系中6个患者和1个正常个体,首先使用基因芯片寻找纯合突变位点,然后对其中无亲缘关系的2例患者采用全基因组测序研究,在2例患者非编码区域均发现相同的变异,10号染色体PTF1A 末端发生一个点突变(chr10:23508437 A>G),且变异在患病人群和细胞试验中均得到了验证。研究解释了生长发育启动子隐性变异是罕见孟德尔遗传病的常见致病原因,同时说明许多疾病的致病突变也可能位于非编码区。 图1 检出的变异信息 智力障碍是影响新生儿心智发育的一类疾病。这项研究选取50个经过基因芯片和全外显子测序未确诊致病因子的trio 家系,全基因组测序检出84个de novo SNVs 和8个de novo CNVs,及一些结构变异(如VPS13B、STAG1、IQSEC2-TENM3),检出率为42%。揭示编码区的de novo SNVs 和de novo CNVs 是导致智力障碍的主要因素,全基因组测序可以作为可靠的遗传性检测应用工具。 案例一 单基因病研究——全基因组测序鉴定PTF1A末端增强子常染色体隐性突变导致胰腺 发育不全[1] 案例二 复杂疾病研究——全基因组测序解析智力障碍的主要致病因素[2] 图2 PTF1A 的家系图谱
编制说明鸭肝炎病毒1型和3型双重RT PCR检测方法
4 附件安徽省地方标准编制说明 检测方型双RT-PC鸭肝炎病型标准名安徽省市场监督管理局下发《关于下201年第一批安徽省地方标准制修订任务来划的函》(皖市监函20151号),编号2019-1-10 安徽省农业科学院畜牧兽医研究负责起草单 安徽省合肥市庐阳区农科南4单位地 参加起草单安徽省动物疫病预防与控制中心 标准起草 序姓单职职电 编制情况 、编制过程简 2011日,收到《安徽省市场监督管理局关于下2019年第一批安徽省地方标准制修计划的函(皖市监[2019] 51号)后,立即成立了标准编制工作小组,分工协作,进行标准制订编工作 标准起草过程标准编制小组成立后,明确了组员间的分工协作,在查阅相关资料和总结前期试研究的基础上由潘孝成牵头编制了标准初稿并将初稿分别发给每位标准起草人进行修改完善202月中旬完成标准送审稿第一版 征求意见情况2022日在安徽省农业科学院网站公开征求意见并发送电子稿至安徽农大学、安徽省兽药饲料监察所及部分市、县疫控中心专家征求意见 、制定标准的必要性和意 鸭肝炎病毒Duck Hepatitis Virus, DHV是一种引起雏鸭鸭病毒性肝(Duck viral hepatitis, DVH主要病原。鸭病毒性肝炎主要以雏鸭发生肝炎为病理特征,具有高度传染性和接触性,发病迅速死亡高呈世界性分布DH可分三个血清型在我国主要流行的血清型DHV-DHV-感雏鸭发病后的临床症状和病理变化非常相似,并且二者混合感染情况也比较普遍,给该病的正确诊断防治带来了极
大的困难 200年《中华人民共和国农业部公告》112号将鸭病毒性肝炎列为二类动物疫病。本标准建立RT-PC方法将有助于对鸭肝炎病型型的快速诊断以及有效区分,以达到在准确的诊断基础上展鸭病毒性肝炎的防控工作 、制定标准的原则和依据,与现行法律法规、标准的关系,特别是强制性标准的协调 本标准依据生产中鸭病毒性肝炎诊断需要遵《中华人民共和国动物防疫法及相关法律法规遵守执行国家强制性标准及编制规则 目前尚无“鸭肝炎病型型双RT-PC检测方法”的国家或行业标准 、主要条款的说明,主要技术指标、参数、试验验证的论述(详细说明4. 本标“引物设计为根genban上已发布DHV-DHV-保守序列设计即考虑到引的广泛代表性,又考虑到引物的特异性,且经实际验证,符合设计要求 )本标准中“结果判定PC结果判定,当阳性对照出720b左右642b左右扩增条带阴性对照未出现目的条带时实验结果成立被检样品出720b左右扩增条带DHV-核酸阳性被样品出642b左右扩增条带DHV-核酸阳性 、标准中如果涉及专利,应有明确的知识产权说 、采用国际标准或国外先进标准的,说明采标程度,以及国内外同类标准水平的对比情 、重大分歧意见的处理经过和依 、贯彻标准的要求和措施建议(包括组织措施、技术措施、过渡办法、实施日期等 本标准作为推荐性地方标准,应自本标准发布之日起在省内动物疫病诊断机构、规模鸭场全面推施行 安徽省农业科学院畜牧兽医研究所有安徽省目前唯一一家获CM认证的动物疫病检测机“安省农科院兽医临床诊断指导中心”,该中心对外开展疫病诊断和检测服务,标准获批后,中心利用该准进行鸭病毒性肝炎的诊断,并指导养鸭场开展鸭病毒性肝炎的预防和控制;另外通过各种途径向省动物疫控检测部门等宣贯该标准,建议它们将“鸭肝炎病型型双RT-PC检测方法”列为其诊鸭病毒性肝炎PC诊断方法 、废止现行相关标准的建 1、其它应予说明的事 注:没有的请填写.
乙型肝炎病毒基因分型方法简述
乙型肝炎病毒基因分型方法简述 邵 玲 张 男 【摘要】乙型肝炎病毒是一种嗜肝脱氧核糖核酸病毒,属于一种复合体DNA病毒。乙型肝炎病毒可按两种方法分型:血清型和基因型。随着分子生物学的发展以及对乙型肝炎病毒研究的深入,乙型肝炎病毒血清分型法已不能适应对该病毒感染研究的需要,而出现的基因分型法则引起广泛的重视。 【关键词】乙型肝炎病毒;基因分型方法 H epatitis B virus gene minute method summ ary S HA O L in Z HA N G N an 【Abstract】The hepatitis B virus is one kind is addicted to the liver deoxyribonucleic acid virus,belongs to one kind of complex DNA virus.The hepatitis B virus may according to two method minutes:Blood serum and genotype.Along with molecular biology’s development as well as to hepatitis B virus research’s thorough,a hepatitis B virus blood serum minute law has not been able to adapt to this virus infection research need,but appears a gene minute principle brings to the widespread attention. 【K ey w ords】Hepatitis B virus;Gene minute method 乙型肝炎病毒是一种嗜肝脱氧核糖核酸病毒,属于一种复合体DNA病毒。乙型肝炎病毒可按两种方法分型:血清型和基因型。随着分子生物学的发展以及对乙型肝炎病毒研究的深入,乙型肝炎病毒血清分型法已不能适应对该病毒感染研究的需要,而出现的基因分型法则引起广泛的重视。1988年Ok2 mamoto[1]对18株不同亚型的HBV基因序列两两进行比较后,根据核苷酸序列异源性>8%的原则,将18株HBV DNA序列分为A~D4个基因型,提出了HBV基因型的概念。1992年Norder[2]发现ayw4和adw4q-两旧亚型之间及基因型A~D 之间S基因差异>4%,提出了两种新的基因型E,F,1994年Norder通过全基因序列P3测定加以证实。2000年Stuyver[3],在研究来自法国和美国的慢性乙肝病人血清样本时,发现有13株病毒无法归入A~F型,命名为G型。随后,日本和德国也相继发现了G基因型。2002年Arauz~Ruiz[4]对10株HBV进行基因型研究,发现其中3株虽与F型相近,但与F型又有明显的不同,进而命名为H型。截止现今,HBV基因型可分为A~H八型。 目前,国内外对HBV进行基因分型主要有“基因序列测定法、聚合酶链反应———限制性片段长度多态性分析法、基因型特异性表位单克隆抗体的EL ISA、基因型特异性线形探针检测法、基因型特异性引物PCR法和基因芯片技术”。 1 基因分型原理 1.1 全基因序列测定。全基因序列测定是根据HBV所有病毒核苷酸异源性>8%进行分型的。Okamoto对从日本及印度尼西亚adw2慢性携带者中分离出的3株HBV进行全序列测序及比较,其核苷酸的异质性为3.9%~5.6%,而与美国2株相同血清亚型HBV序列比较,异质性达8.3%~9.3%,达到甚至超过不同血清亚型HBV的异质性,从而说明血清学分型不能真正反映HBV基因变异。再经对18株HBV DNA进行两两比较分析,根据同源性<92%、异质性>8%,将其分为A, B,C及D4个基因型,初步建立了基因分型体系。12年后Stuyver使用该方法,发现了一种新的3248bp的HBV基因型G 。 1.2 S基因序列测定。由于乙型肝 炎病毒基因可分为p基因、前s基因、编 码HBs4的s基因、C基因及X基因(如 图),可分别对它们进行研究,从而找出各 个基因型在各个基因之间的差异。Nor2 der[5]对32例HBV患者s基因测序结果 进行分析,并建立进化树,基因型间异质 性>4%。除证实了Okamoto的A~D分型外,还发现了2个新的基因型E和F,使HBV基因型达到6个(A~F)。在其后对28例HBV全基因组、p基因、前s基因、编码HBs4的s基因、C 基因及X基因分别比较并建立进化树,进一步证实根据s基因序列分型最接近全基因组,从而证明了单独使用S基因进行分型的可靠性。目前,此法尚在使用,主要有SSP和SSO[6],即基因型特异性引物PCR法和基因型特异性线形探针检测法。 2 基因分型方法 2.1 序列测定法。即直接测定核苷酸序列,根据差异分型。自Okamoto据HBV基因型之间的全序列异质性8%进行分型以来,测序由于方法直接、可靠而成为主要鉴定HBV基因型的方法。同全序列进化树图比较,发现S基因的序列变化同全基因序列的变化一致,可用S基因序列代替全基因序列进行分型,界限为核昔酸序列的异质性4.0%。该法虽较为可靠但操作繁琐、费用昂贵,不适于临床大量标本检测。 2.2 聚合酶链反应———限制性片段长度多态性分析法(PCR~RFL P)。目前常用的基因分型方法,通过PCR扩增出目标基因片段(通常为S基因或Pres/s基因),用特定的限制性内切酶进行酶切,根据酶切图谱进行基因分型。Mizokami[7]通过分子进化方法对已知基因型的68例HBV患者全基因、106例HBV患者s基因序列进行分析,发现并确认基因型特异性酶切位点区域。Lindh[8]对不同基因型S基因的特异酶切位点进行分析,设计使用限制性内切酶Trp509I和Hinf I使S基因PCR产物产生不同长度的酶切片段,成功地将166/180例患者HBV实现A-F基因分型。RFL P敏感性高,但酶切位点易受基因变异影响,且遇混合感染或酶切不完全,会出现复杂条带,影响分型结果判断。 2.3 基因型特异性表位单克隆抗体的酶联免疫吸附法(EL ISA)PreS2多肽有多组抗原表位。基因型不同抗原表位也不同,从而可以鉴定不同基因型。Usuda[9]等用此法制备前S2区域基因型特异性表位的单克隆抗体,并用辣根过氧化酶进行标记,对68例HBV阳性患者血清检测,分型结果与S基因测序分型完全一致。在后期实验中发现,适用于大规模的流行病学调查,使较大范围的HBV的研究成为可能。 2.4 基因型特异性线形探针检测法。该方法是设计型特异的探针,检测HBV扩增产物,以产物的不同长度或与探针的反应性来区分不同型别。Kato[10]利用G基因型的病毒在核心区有36个核苷酸的插入,设计引物用PCR的方法可以对G基因型进行特异的筛查。早在1983年Wu用酶切的方法研究血清型的酶切图谱,来区分不同的血清型。王虹[11]等采用PCR2核酸杂交/EL ISA检测,主要是联合利用PCR、核酸杂交和酶联免疫技术,设计前C和C区的探针,可以快速准确的区分HBV的基因型。另外Van G eyt[12]根据A~F基因型的保守序列设计了18种型特异性探针与HBV S (下转12页)
全球首次完成杨树全基因组测序
全球首次完成杨树全基因组测序 由美国能源部启动并实施的杨树全基因组测序计划已圆满完成,并于2004年9月21日对公众开放了全序列数据库。南京林业大学科研人员尹佟明副教授参与了此项研究。杨树基因组的新闻发布及庆祝会定于12月6日在美国加州举行。该项研究可望使杨树这一重要树种的品种改良时间大大缩短,用区区几十年跨越千年关。 研究的完成,使杨树成为继拟南芥和水稻之后,第三个测定全序列的植物,并且是第一个测定全基因组序列的多年生木本植物。杨树因此被广泛接受为研究多年生植物基因组的模式物种,这使该项工作具有重大的科学意义。杨树同时又是一种重要的工业用材树种,杨树全基因组计划实施,将为生物能源的开发提供知识贮备,具有重要的实际应用价值。目前,杨树的改良还处在一种半野生的初级改良阶段,在基因组研究的基础上,通过群体和数量遗传学的手段在杨树属不同树种间开发有用等位基因,并通过遗传工程的手段进行基因重组,可望在几十年的时间里完成一般作物几千年的改良历程。 杨树全基因组全序列用“鸟枪法测定”,序列库中共含有7,649,993个序列片段,去除叶绿体基因组的污染,测得的序列大约为8×基因组长度。目前对序列拼接的组装已完成了483Mb,占杨树基因组物理全长的90%以上,基本上覆盖了杨树基因组常染色体的大部分。基于基因芯片和单核苷酸多态性检测技术,对小的序列拼接及序列间隙的填充工作正在进行中,预期这部分工作将于明年完成。南京林业大学尹佟明副教授自2001年以来一直参与此项研究,对杨树基因组的注释工作将于今年12月初完成。 国际杨树基因组计划协作组的总负责人杰瑞先生认为,从世界范围来看,杨树在中国的林业生产中占有的比重是最大的,因此在杨树基因组信息的应用方面,中国在未来的研究中可能会居于世界前列。杨树全基因组计划的完成对我国从事林业及生物技术的科学家而言,提供了前所未有的机遇和挑战。 Science 15 September 2006: Vol. 313. no. 5793, pp. 1596 - 1604 DOI: 10.1126/science.1128691 RESEARCH ARTICLES The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray) G. A. Tuskan,1,3* S. DiFazio,1,4S. Jansson,5J. Bohlmann,6I. Grigoriev,9U. Hellsten,9N. Putnam,9S. Ralph,6S. Rombauts,10 A. Salamov,9J. Schein,11L. Sterck,10 A. Aerts,9 R. R. Bhalerao,5 R. P. Bhalerao,12 D. Blaudez,13 W. Boerjan,10 A. Brun,13 A. Brunner,14 V. Busov,15 M. Campbell,16 J. Carlson,17 M. Chalot,13 J. Chapman,9 G.-L. Chen,2 D. Cooper,6 P. M. Coutinho,19 J. Couturier,13 S. Covert,20 Q. Cronk,7 R. Cunningham,1 J. Davis,22 S. Degroeve,10 A. Déjardin,23 C. dePamphilis,18 J. Detter,9 B. Dirks,24 I. Dubchak,9,25 S. Duplessis,13 J. Ehlting,7 B. Ellis,6 K. Gendler,26 D. Goodstein,9 M. Gribskov,27 J. Grimwood,28 A. Groover,29 L. Gunter,1 B. Hamberger,7 B. Heinze,30 Y. Helariutta,12,31,33 B. Henrissat,19 D. Holligan,21 R. Holt,11 W. Huang,9 N. Islam-Faridi,34 S. Jones,11 M. Jones-Rhoades,35 R. Jorgensen,26 C. Joshi,15 J. Kangasj?rvi,32 J. Karlsson,5 C. Kelleher,6 R. Kirkpatrick,11 M. Kirst,22 A.
乙肝病毒基因分型
乙肝病毒基因分型 近年来,随着分子生物学技术的迅猛发民和对HBV认识的不断深入,国内外许多学者对HBV基因分型及其临床的相关性开展了大量的研究.HBV基因分型比血清亚型更能反映原型病毒株之间的自然异质性.HBV基因分型方法有多种,以全基因测序为HBV基因分型的金标准,基于全基因核甘酸序列比较,HBV可分为A、B、C、D、E、F、G、H8个基因型。HBV基因型呈地理区域性分布,且不则基因型致病性不同,HBV基因型与乙型肝炎病情的进展,临床表现、治疗、预后有密切的关系。 近年来HBV基因分布的研究成为国内外学者关注的研究热点。研究发现,HBV基因的分布具有一定的地域性,A型主要分布在西欧、北欧、北美洲及非洲地区,B型和C型是亚洲和大洋洲的特征性基因型,B型主要见于中国、日本、印度尼西亚、越南和巴西,D型分布最为广泛,主要分布在中东、北非和南欧,也是地中海地区HBV的主要基因型,还发现于亚洲少数地区;E型主要分布于非洲撒哈拉沙漠地带;F型主要分布于美国、南美洲和土著居民;G型在法国、美国、德国、英国和意大利被发现;H 型已在尼加拉瓜、墨西哥及美国加利氟尼亚地区被发现。 大量研究表明,我国HBV基因型南方以B型为主,北方以C型为主,D
型仅见于西部及少数民簇地区,A,F型偶有发现,还未发现其它性别。也有学者研究表明D基因型在我国宁夏地区,广东地区和香港地区约占感染者15%,因而HBV基因型在我国的确切分布状况仍不十分清楚。 HBV基因型的临床意义 (1)HBV基因型与病毒复制及变异的关系 HBV基因型与病毒复制水平及病毒标志物的表达有一定的相关性。Watanabe等研究报道,基因C型的HBeAg阳性率高于B型和A型,而B型HBeAg阴性率高于C型,同时B型血清HBeAg清除率较C型显著常见且较早发现;基因C型血清HBV DNA水平显著高于B型;A型的HBV DNA自然清除率高于D型和F型,同时A型的HBsAg自然清除率也比D型高;以上均提示C型HBV复制较活跃,易形成持续病毒血症,不易发生e系统血清转换发生快,免疫清除HBV较C型早。 (2)HBV基因型临床疾病谱及疾病预后的关系 HVB感染不仅可以引起急.慢性病毒性肝炎,而且还与肝硬化(LC)和干细胞癌(HCC)的发生,发展有密切关系。HBV感染的临床转归一方面决定于患者的年龄和免疫能力,另一方面也与感染病毒株的基因型种类密切相关。近年研究发现HBV基因型是影响慢性乙型肝炎的临床转归的主要决
鸭子常见疾病治疗
鸭常见传染病及其防治 一、鸭瘟 鸭瘟是由鸭瘟病毒引起的一种急性、热性传染病,主要发生于1月龄以上的鸭,其临床特征表现为高热、流泪、排绿色稀粪。有的病鸭出现头颈部肿大,因此称之为大头瘟。该病的发病率和死亡率很高。 1、免疫程序:肉鸭在1~7日龄经皮下注射0.5毫升鸭瘟鸡胚化弱毒苗,其免疫力可保持至上市。蛋鸭在20日龄进行首免,每只鸭肌肉注射0.5毫升,2个月后加强免疫1次,60日龄以上鸭每只肌肉注射1毫升,免疫期为6个月。 2、治疗:(1)高免血清疗法。每只病鸭颈背部皮下注射高免血清1毫升。(2)高免卵黄疗法。每只病鸭颈背部皮下注射高免卵黄2毫升,同时口服高免卵黄液2毫升。(3)鸭瘟鸡胚化弱毒菌紧急接种法。每只鸭注射鸡胚化弱毒苗1毫升,要做到1鸭1针。(4)干扰素疗法。每只成鸭肌注1毫克聚肌胞,每隔3天肌注1次,连用2~3次。(5)中药疗法。紫花地丁、大蒜、大血藤、香附子、萱草根各30克,陈皮、枇杷叶各20克,车前草10克,加水煎至100毫升,每只每次口服1毫升,每天喂3次,连用1周。 二、鸭霍乱 该病是由多杀性巴氏杆菌引起的急性败血性传染病,其特征病变是肝脏肿大质脆,表面有许多白色针尖大小的坏死
灶。 1、预防:(1)禽霍乱731弱菌苗,接种2月龄以上的鸭群,免疫期可达3个半月。(2)禽霍乱氢氧化铝胶苗,用于2月龄以上的鸭群,每只鸭肌注2毫升,间隔10天再注射1次,免疫期为3个月。(3)禽霍乱油乳剂灭活苗,用于2月龄以上的鸭群,每只鸭皮下注射1毫升,免疫期为6个月。 2、治疗:(1)西药疗法,可选用磺胺类药物、青霉素、氯霉素、喹乙醇等,对该病均有疗效。(2)高免血清疗法,用异种动物制备的禽霍乱高免血清每只注射0.5毫升。(3)中草药疗法,饲料中拌入复方霍乱灵散,连用1周。 三、鸭病毒性肝炎 鸭病毒性肝炎是由鸭肝炎病毒引起的小鸭的一种高度致死性、急性传染病,其特征是发病急、传播快、死亡率高,临床表现为角弓反张,病理变化为肝脏发生炎性肿大,并有出血斑点,主要侵害3周龄以下的雏鸭。 1、免疫方法:(1)成年种鸭开产前皮下注射鸭肝炎鸡胚化弱毒苗2次,每次1毫升,间隔期为2周。利用这种免疫蛋孵出的雏鸭,一般可以度过易感期,免遭鸭肝炎病毒的危害。(2)用鸭病毒性肝炎弱毒苗直接免疫雏鸭,对无母源抗体的雏鸭应在1日龄作颈背部皮下免疫接种。 2、防治:(1)高免卵黄疗法,每只病鸭颈背部皮下注射高免卵黄2毫升,同时口服高免卵黄液2毫升。(2)高免血
