工业盐酸中铁含量的测定
工业盐酸中铁含量的测定
1、实验目的
(1)了解并掌握1,10-菲啰啉分光光度法测盐酸中铁含量的方法及操作
(2)进一步掌握分光光度计的使用方法
(3)熟练比色皿的清洗,装样等操作
(4)加强对一般溶液的配制操作练习
2、实验原理
(1)分光光度计的工作原理是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度。
(2)盐酸羟胺能将三价铁还原为二价铁。
(3)在pH为的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。
3、实验仪器
分析天平、紫外-可见分光光度计、洗瓶、胶头滴管、烧杯、比色皿、玻璃棒、移液管、洗耳球、pH试纸、滤纸、容量瓶、量筒。
4、实验药品
工业盐酸、浓氨水、浓盐酸、氢氧化钠、盐酸羟胺、乙酸——乙酸钠缓冲溶液、铁标夜(硫酸亚铁按)、1,10-菲啰啉试剂。
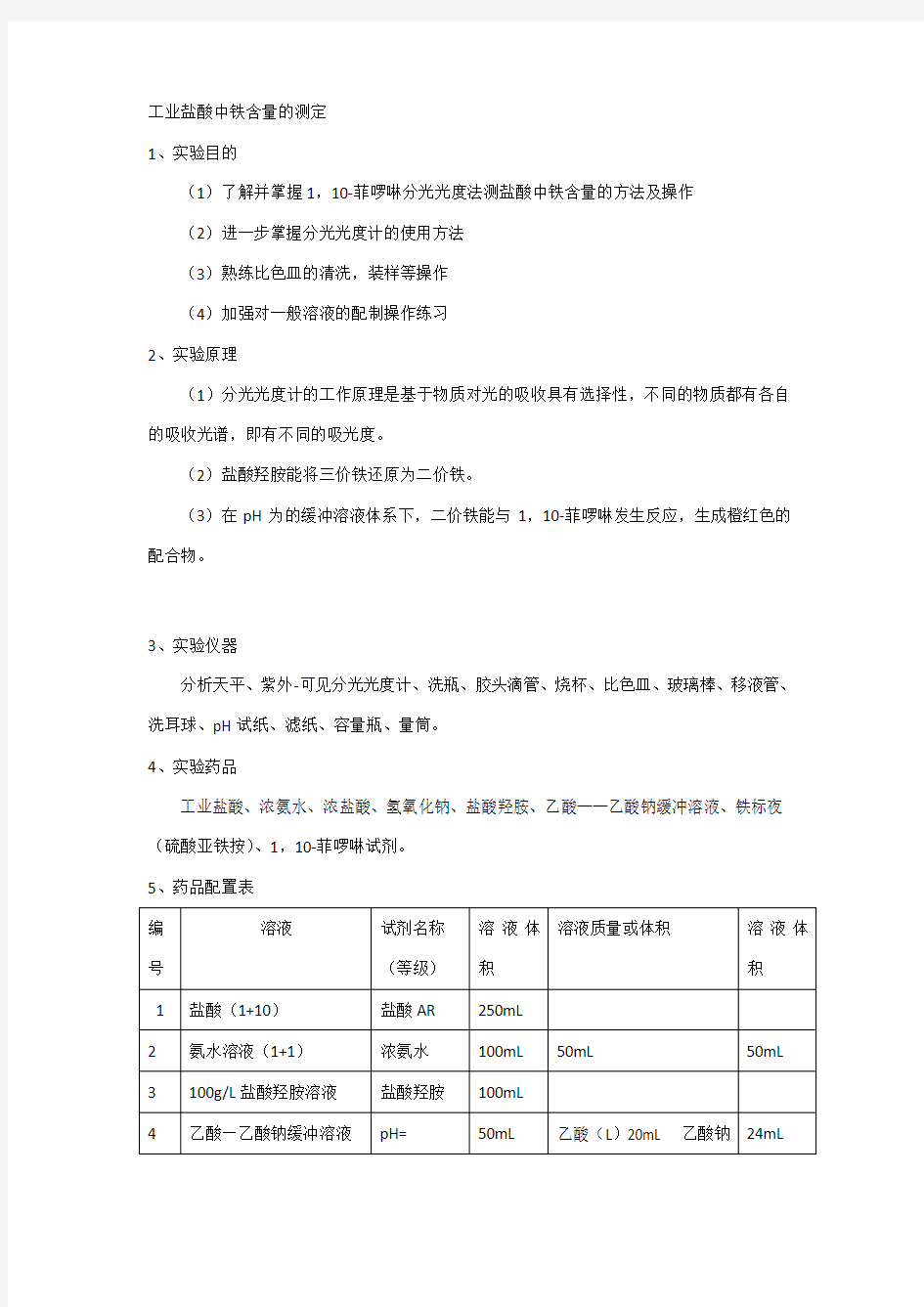
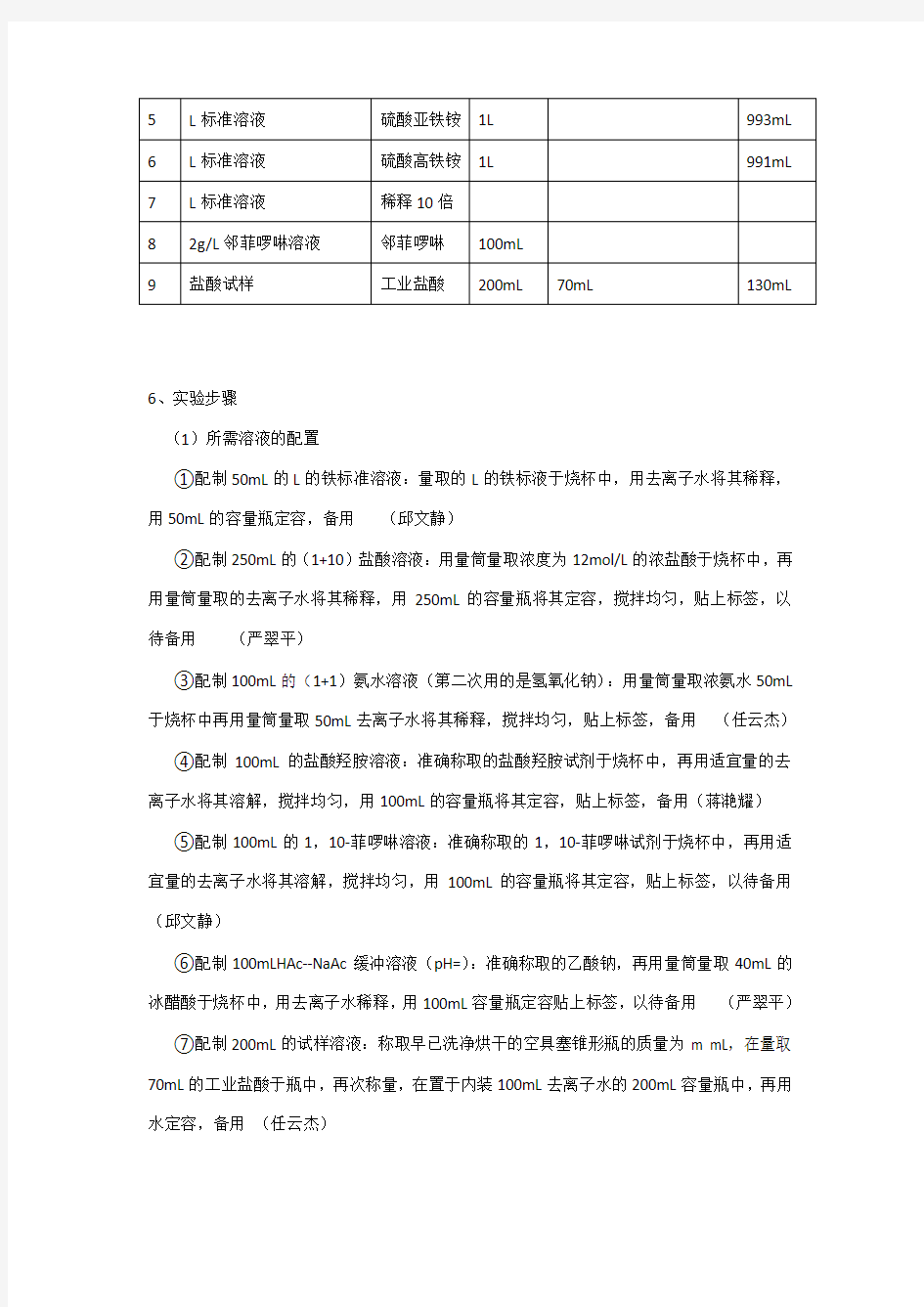
5、药品配置表
6、实验步骤
(1)所需溶液的配置
①配制50mL的L的铁标准溶液:量取的L的铁标液于烧杯中,用去离子水将其稀释,用50mL的容量瓶定容,备用(邱文静)
②配制250mL的(1+10)盐酸溶液:用量筒量取浓度为12mol/L的浓盐酸于烧杯中,再用量筒量取的去离子水将其稀释,用250mL的容量瓶将其定容,搅拌均匀,贴上标签,以待备用(严翠平)
③配制100mL的(1+1)氨水溶液(第二次用的是氢氧化钠):用量筒量取浓氨水50mL 于烧杯中再用量筒量取50mL去离子水将其稀释,搅拌均匀,贴上标签,备用(任云杰)
④配制100mL的盐酸羟胺溶液:准确称取的盐酸羟胺试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,备用(蒋滟耀)
⑤配制100mL的1,10-菲啰啉溶液:准确称取的1,10-菲啰啉试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,以待备用(邱文静)
⑥配制100mLHAc--NaAc缓冲溶液(pH=):准确称取的乙酸钠,再用量筒量取40mL的冰醋酸于烧杯中,用去离子水稀释,用100mL容量瓶定容贴上标签,以待备用(严翠平)
⑦配制200mL的试样溶液:称取早已洗净烘干的空具塞锥形瓶的质量为m mL,在量取70mL的工业盐酸于瓶中,再次称量,在置于内装100mL去离子水的200mL容量瓶中,再用水定容,备用(任云杰)
(2)标准曲线绘制——测定铁标液的吸光度
①按照下列表格量取贴标溶液分别置于6个50mL的容量瓶中
(蒋滟耀)
②向每个容量瓶中加入10mL的(1+1)的盐酸溶液,加水至20mL处,用氨水溶液调至pH为2~3,再加入1mL盐酸羟胺溶液,5mLHAc--NaAc缓冲溶液和2mL1,10—菲啰啉溶液,再用水稀释至刻度,摇匀,静置15min。(邱文静)
③制作空白样:用一个空的容量瓶依次加入第二步中的试剂(不加铁标样)再用其润洗玻璃比色皿后装样,在波长510nm处,调整分光光度计零点(严翠平)
④用适宜的比色皿装以上六个容量瓶的溶液,在波长为510nm处测得相应的吸光度
(任云杰)
⑤以铁含量(ug)为横坐标,与其相应的吸光度为纵坐标绘制标准曲线(蒋滟耀)(3)测定工业盐酸中铁的含量
①配制试料:量取的试样溶液置于50mL的容量瓶中(蒋滟耀)
②测定准备:向试料中加水至20mL处,用氨水溶液调至pH值为2~3,再加入1mL 盐酸羟胺溶液,5mLHAc----NaAc缓冲溶液和2mL1,10—菲啰啉溶液再用水稀释至刻度处,摇匀,静置15分钟。(邱文静)
③空白试验:向一个未加试料的50mL的容量瓶中加入10mL(1+1)盐酸溶液,再加入相同的与试料溶液中的其他试剂,再用其润洗玻璃比色皿在装样,在波长510nm处,调整风光光度计零点。(严翠平)
④用试料溶液润洗玻璃比色皿,再装样,在波长为510nm处测定其吸光度,平行三组。
(任云杰)
八、测定结果
(1)计算标准曲线的线性回归方程。
对于无基体干扰或能消除基体干扰的浓度波动较大的大批样品的测试,我们通常选择的方法是分光光度法中最经典的方法——标准曲线法。这种方法也是实际工作中使用最多的一
种定量方法。其特点是:对仪器要求不高,是分光光度法中简便易行的方法。
工作曲线的绘制方法是:配制4个以上的浓度不同的待测组分的标准溶液,以空白溶液为参比溶液,在选定的波长下,分别测定各标准溶液的吸光度。以标准溶液浓度为横坐标,吸光度为纵坐标,在坐标纸上绘制曲线。同时,在相同条件相对待测物试样进行显色反应,并测定其吸光度A 。再从标准曲线上查找待测组分的浓度C 。标准曲线可通过计算机绘制,也可以用回归分析法进行拟合。计算公式:
y=ax+b
其中:()()()
∑∑-=---=
n
i n
i x x y y x x a 1
2
1
x a y b -=
(2)在测得试料溶液的吸光度与标准曲线相对比,找到试料溶液中相对铁的含量为m 铁含量以铁的质量分数
ω计算:
1
32210m m -?=
?
1m ——式样质量的数值,单位为克(g )
; 2m ——由标准曲线查得的试料中铁含量的数值,单位为微克(ug )。 (3)允许差
平行测定结果之差的绝对值不大于%。 取平行测定结果的算术平均值为报告结果。 九、注意事项
1、菲啰啉溶液配制好后应避光保存,防止分解
2、在使用比色皿时,注意保护光学面
3、在实验过程中,盐酸具有腐蚀性,防止溅到皮肤,伤害皮肤组织
4、在量取盐酸,浓氨水等有刺激性试剂时,请勿大口吸气,且操作尽量减少时间 十、实验讨论
1、邻菲啰啉比比色测定铁的原理是什么用该法测出的铁含量是否是式样中亚铁含量
2、绘制标准曲线和测定试样为什么要在相同条件下进行这里主要指哪些条件
铁含量的测定方法
铁含量的测定方法 铁含量的测定采用邻菲啰啉比色法。 一、原理 在一定酸度条件下,试液中亚铁离子(Fe2+)与1,10-邻菲啰啉生成红色配合物,于波长为506nm处,测定其吸光度,即可计算出铁含量。 二、试剂和仪器 柠檬酸三钠水溶液,150g/L;盐酸羟胺溶液,50 g/L;盐酸溶液,3mol/L;氨水溶液,2.5%;1,1 0-邻菲啰啉溶液,2.5 g/L:称量2.5g1, 10-邻菲啰啉溶于80℃的约l00ml水中,加lml浓盐酸,冷却后加水稀释至1000ml,储于阴凉处备用; 醋酸-醋酸钠缓冲溶液:称量272g醋酸钠(NaCH3·CO2·3H2O)于约500m1水中,加入冰醋酸240ml,加水稀释至1000ml; Fe2+标准溶液,lmg/ml:称量7.024g硫酸亚铁铵于约500ml水中,加入浓盐酸10ml,移入l000ml 容量瓶中,稀释至刻度; Fe2+标准溶液,20?g/ml:吸取lmg/ml的亚铁标准溶液20ml于1000ml容量瓶中,用水稀释至刻度,混匀,临用前配制。 仪器:分光光度计;1cm比色皿。 三、测定步骤 (一)工作曲线的绘制 量取20?g/ml的亚铁标准溶液0.00m1、2 .50m1、5 .00ml、10.00ml、20.00ml(相当于分别含0、50、100、200、400?g/ Fe2+)分别加入l00ml烧杯中,用水稀释至50ml,加入150g/L柠檬酸三钠溶液5m1,用3mol/L盐酸或2.5%氨水溶液调节溶液pH为2.4~2.6,加入50 g/L盐酸羟胺溶液5ml混匀,加入1,10-邻菲罗琳溶液5m1,加入醋酸-醋酸钠缓冲溶液l0ml,将溶液移入到l00 ml容量瓶中,用水稀释至刻度,混匀放置60min。 用分光光度计在波长506nm处用lcm比色皿,以水为参比溶液测定该标准系列的吸光度,以Fe2+标准溶液浓度(?g/100ml)为横坐标,以其对应吸光度作纵坐标绘制工作曲线。 (二)湿法磷酸中铁含量的测定 吸取1 ml湿法磷酸,用水稀释至100m1,混匀,移取1m1到100m1的烧杯中,用水稀释至50m1,以下操作同工作曲线的绘制,测定其吸光度。 不加试样,在同样条件下进行空白试验。 (三)计算 总铁含量按下式计算 w(Fe)= 式中:m1为从工作曲线上查得被测试液Fe的质量,?g;m0为从工作曲线上查得试剂空白溶液中Fe的质量,?g;m为吸取试样溶液相当于试样的质量,g
重量法测定硫酸根
水中硫酸根的测定:重量法 1.方法原理 硫酸盐在盐酸溶液中,与加入的氯化钡形成硫酸钡沉淀。在接近沸腾的温度下进行沉淀,并至少煮沸20分钟,使沉淀陈化之后过滤,洗沉淀至无氯离子为止,烘干或者灼烧沉淀,冷却后,称硫酸钡的质量。 2.干扰及消除 样品中包含悬浮物、硝酸盐、亚硫酸盐和二氧化硅可使结果偏高。碱金属硫酸盐,特别是碱金属硫酸氢盐常使结果偏低。铁和铬等能影响硫酸盐的完全沉淀,使测定结果偏低。 硫酸钡的溶解度很小,在酸性介质中进行沉淀,虽然可以防止碳酸钡和磷酸钡沉淀,但是酸度较大时也会使硫酸钡沉淀溶解度增大。 3. 适用范围 本方法可用于测定地表水、地下水、咸水、生活污水及工业废水中的硫酸盐。水样有颜色不影响测定。可测定硫酸盐含量10mg/L以上的水样,测定上限为5000mg/L。 4. 仪器 水浴锅、烘箱、马福炉、滤纸(酸洗并经过硬化处理,能阻留微细沉淀的致密无灰分滤纸,即慢速定量滤纸)、0.45μm滤膜、熔结玻璃坩埚G4(30ml) 5、试剂 ① 1+1盐酸 ② 100mg/L的氯化钡溶液:将100g±1g二水合氯化钡溶于约800ml水中, 2-。加热有助于溶解,冷却并稀释至1L。此溶液可长期保存,1ml可沉淀约40mgSO 4 ③ 0.1%甲基红指示剂 ④硝酸银溶液(约0.1mol/L):将0.17g硝酸银溶解于80ml水中,加0.1ml 硝酸,稀释至100ml。贮存于棕色试剂瓶中,避光保存。 ⑤无水碳酸钠 ⑥(1+1)氨水 测定步骤 ①沉淀:移取适量经0.45um滤膜过滤的水样(测可溶性硫酸盐)置于500mL
烧杯中,加2滴(0.1%)甲基红指示液,用(1+1)盐酸或(1+1)氨水调至试液呈橙黄色,再加2mL盐酸,然后补加水使试液的总体积约为200mL。加热煮沸5min(此时若試液出现不溶物,应过滤后再进行沉淀),缓慢加入约10mL热的(100g/L)氯化钡溶液,直到不再出现沉淀,再过量2mL。继续煮沸20 min,放置过夜,或在50~60℃下保持6h使沉淀陈化。 ②过滤:用已经恒重过的玻璃坩埚(G4)过滤沉淀,用带橡皮头的玻璃棒将烧杯中的沉淀完全转移到坩埚中去,用热水少量多次地洗涤沉淀直到没有氯离子为止。 在含约5mL(0.1mol/L)硝酸银溶液的小烧杯中检验洗涤过程中氯化物。收集约5mL的过滤洗涤水,如果没有沉淀生成或者不变浑浊。即表明沉淀中已不含氯离子。 ③干燥和恒重:取下坩埚并在105℃±2℃干燥大约1~2h. 然后将坩埚放在干燥器中,冷却至室温后,称重。再将坩埚放在烘箱中干燥10 min,冷却,称重,直到前后两次的重量差不大于0.0002g为止。 ④计算: 硫酸根(mg/L)=m*0.4115*1000/V 式中: m——从试样中沉淀出来的硫酸钡的质量(mg); V——试液的体积(mL); 0.4115——硫酸钡重量换算为硫酸根的系数。 ⑤注意事项: 使用过的玻璃坩埚清洗:可用每升含8gNa2—EDTA和25 mL乙醇胺的水溶液将坩埚浸泡过夜,然后将坩埚在抽滤情况下用水充分洗涤。 用少量无灰滤纸的纸浆与硫酸钡混合,能改善过滤效果并防止沉淀产生蠕升现象。在此种情况下,应将过滤并洗涤好的沉淀放在铂坩埚中,在800℃灼烧1 h,放在干燥器中冷却至恒重。 出自《水和废水监测分析方法》第四版,中国环境科学出版社
铁矿石中铁含量测定方案
重铬酸钾法测定铁矿石中铁的含量(无汞法) 一、实验目的 1. 掌握重铬酸钾法测定亚铁盐中铁含量的原理和方法; 2. 了解氧化还原指示剂的作用原理和使用方法。 二.原理: 经典的重铬酸钾法测定铁时,每一份试液需加入饱和氯化汞溶液10mL,这样约有480mg 的汞排入下水道,而国家环境部门规定汞的允许排放量是0.05mg·L-1,因此,实验中的排放量是大大超过允许排放量的。实际上,汞盐沉积在底泥和水质中,造成严重的环境污染,有害于人的健康。近年来研究了无汞测铁的许多新方法,如新重铬酸钾法,硫酸铈法和EDTA 法等。本法是新重铬酸钾法。 新重铬酸钾法是在经典的有汞重铬酸钾法的基础上,去掉氯化汞试剂,采用钨酸钠作为 指示剂指示Fe3+还原Fe2+ 的方法。试样用硫-磷混酸溶剂后,先用氯化亚锡还原大部分Fe3+,继而用三氯化钛定量还原剩余部分的Fe3+,当Fe3+定量还原成Fe2+ 之后,过量一滴三氯化钛溶液,即可使溶液中作为指示剂的六价钨(无色的磷钨酸)还原为蓝色的五价钨化合物,俗称“钨蓝”,故使溶液呈现蓝色。滴入重铬酸钾溶液,使钨蓝刚好褪色,以消除少量还原剂的影响。“钨蓝”的结构式较为复杂 定量还原Fe3+时,不能单用氯化亚锡,因为在此酸度下,氯化亚锡不能很好的还原W(Ⅵ)为W(V),故溶液无明显颜色变化。采用SnCl2-TiCl3联合还原Fe3+为Fe2+
,过量一滴TiCl3与Na2WO4作用即显示“钨蓝”而指示。如果单用TiCl3为还原剂也不好,尤其是试样中铁含量高时,则使溶液中引入较多的钛盐,当加水稀释试液时,易出现大量的四价钛沉淀,影响测定。在无汞测定铁实验中常用SnCl2-TiCl3联合还原,反应式如下: 2Fe3++SnCl42-+2Cl-=2Fe2++SnCl62- Fe3++Ti3++H2O=Fe2++TiO2++2H+ 试液中Fe3+已经被还原为Fe2+,加入二苯胺磺酸钠指示剂,用K2Cr2O7标准溶液滴定溶液呈现稳定的紫色即为终点。 三.试剂: (1) K2Cr2O7标准溶液c(1/6 K2Cr2O7)=0.1000mol·L-1 (2) 硫磷混酸:将200mL浓硫酸缓慢加入到500mL去离子水中,再加入300mL浓磷酸中,充分搅拌均匀,冷却后使用。 (3) 浓HNO3 (4) HCl(1+1) (5) Na2WO4 25%水溶液:称取25g Na2WO4溶于适量水中(若浑浊则应过滤),加入2~5mL浓H3PO4,加水稀释至100mL。 (6) SnCl2溶液10%:称取10g SnCl2·2H2O溶于40mL浓的热HCl,加水稀释至100mL。 (7) TiCl3 1.5%:量取10mL原瓶装TiCl3溶液,用(1+4)的HCl稀释至100mL。加入少量石油醚,使之浮在TiC l3溶液的表面上,用以隔绝空气,避免TiCl3氧化。
分光比浊法测定硫酸根离子
分光比浊法测定硫氰酸铵中硫酸根 摘要:通过实验,建立了在酸性介质中,吸收波长为410 nm、以聚乙烯醇(PVA)作稳定剂测定硫氰酸铵成品中硫酸根的分光比浊分析方法。试验考察了稳定剂的选择、稳定剂的PVA浓度、PVA存在下体系的稳定时间、盐酸加入量、硫氰酸根的影响等因素对该法的影响并进行优化。 由于硫氰酸铵成品中硫酸根含量极少,测定其含量不能用普通的重量法和滴定法,而传统的目视比浊法不能得到精确连续的数据,且带有个人主观性。根据目视比浊法的原理,采用分光光度计比浊法来测定硫氰酸铵成品中少量的硫酸根。本实验基于在酸性介质中,试样溶液中的硫酸盐与加入的钡离子形成细微的硫酸钡结晶,使水溶液混浊,其混浊程度和试样中硫酸盐含量呈正比关系这一原理,采用聚乙烯醇作稳定剂,用分光比浊法测定硫氰酸中硫酸盐,测试结果准确,且操作简便、快捷,可批量检测,尤其适合工厂或基层实验室的常规分析,具有较高的实用价值。 1.实验部分 1.1仪器与试剂 6B-80型COD快速测定仪; 硫酸盐标准溶液:称取0.1479g无水硫酸钠,溶于少量水中,并定容至1000ml,即为0.1mg/ml-1硫酸盐(SO42-)标准贮备溶液。 盐酸:(1+3)盐酸溶液; 无水乙醇(95%,分析纯); 氯化钡溶液:称取62.5g氯化钡 (AR),溶于二次蒸馏水,移入250ml容量瓶,稀释至刻度。 稳定剂:称取20g醇(AR)放入烧杯,加入100 ml二次蒸馏水,置于电炉上加热,边加热边搅拌,直到聚乙烯醇完全溶解,待冷却后移入1000 ml容量瓶,润洗烧杯3次,移入容量瓶,稀释至刻度。 1.2实验方法 称取20g试样(准确至0.0001g),置于干燥清洁的烧杯中,加水20ml,用玻璃棒搅拌5min,用滤纸过滤得澄清待测溶液。取3ml待测液于50ml比色管,加1ml盐酸,摇匀,加入3ml氯化钡和10ml PVA溶液,用水定容至50 ml,摇匀,静置20 min。在410 nm波长、1cm比色皿条件下,以硫酸根标准溶液空白为参比测定其吸光值。 1.3 实验原理 吸光比浊法的原理[2]:以Tyndall效应为基础,当溶液中的颗粒受到光照射后,发生散射作用。散射光强度(I)用reyleigh公式表示: I=KI0uV2/λ 4 (1) 式中:K为常数;I0为入射光强度;K为波长;u为单位体积的粒子数;V为单个粒子的体积。由上式可知,在吸光浊度法测定中,散射光强度I愈大,吸光度A愈高,且与单位体积的粒子数u
工业盐酸杂质测定标准
工业盐酸 1、含量 (1)试剂 ①混合指示剂(溴甲酚绿-甲基红混合指示剂)②氢氧化钠标准溶液1.0mol/L (配制见标准溶液的配制) (2)测定步骤 取盐酸1-2mL(V)于250mL锥形瓶中,用蒸馏水稀释至100mL左右,再加2-3滴混合指示剂,用1.0mol/L(a)氢氧化钠标准滴定溶液滴定到溶液呈亮绿色为止,记下消耗的体积V1。 (3)计算 C=错误!未找到引用源。×100% C————盐酸的含量,% a————氢氧化钠标准溶液的浓度,mol/L V1————消耗氢氧化钠标准溶液的体积,mL V————吸取盐酸的体积,mL M————盐酸的摩尔质量,g/mol 2、盐酸中杂质的测定 2.1盐酸中硫酸盐、亚硫酸盐的测定 方法一:比浊法 硫酸盐取本品25g(21ml),加碳酸钠试液2滴,置水浴上蒸干;残渣加水20ml溶解后,依法检查(附录ⅧB),与标准硫酸钾溶液1.25ml制成的对照液比较,不得更浓(0.0005%)。
亚硫酸盐取新沸过的冷水50m1,加碘化钾1g、碘滴定液(0.01mol/L)0.15ml与淀粉指示液1.5m1,摇匀;另取本品5ml,加新沸过的冷水50ml稀释后,加至上述溶液中,摇匀,溶液的蓝色不得完全消失。 方法二:离子色谱法 用离子色谱仪测定蒸干稀释后测硫酸盐、亚硫酸盐的含量,具体操作方法见离子色谱仪的操作规程。 方法三:分光光度法(只限于硫酸盐) 本方法规定了用比浊法测定工业用合成盐酸中硫酸盐含量,适用于各级工业用合成盐酸。 1) 方法原理 将工业用合成盐酸样品蒸发至干,用盐酸溶解残渣,用甘油—乙醇混合液做稳定剂,加入氯化钡制得硫酸钡悬浮液,用分光光度计测定悬浮液的浊度。 2) 试剂和材料 a二水氯化钡(GB 652) b甘油(GB 687)—乙醇混合液:1+2溶液 c硫酸盐标准溶液:0.1000g/L溶液,按GB 602配制 d盐酸(GB 622):1.000mol/L溶液,按GB 602配制 3)仪器 一般实验室仪器和分光光度计和水浴锅 4) 样品 a 实验室样品 按本标准采样法采样。
两种硫酸根含量测定方法的比较
两种硫酸根含量测定方法的比较 为了更快更准确地测定出卤水中硫酸根离子的含量,参照国家标准方法,我们对两种硫酸根含量的测定方法--分光光度法和容量滴定法进行了比较。 1、前言 湖北沙隆达股份有限公司盐矿是由企业自筹资金、自主开发的盐矿,由于地质结构原因,硫酸根含量一直较高。为了了解采层矿物质构成,同时为下一步硫酸根处理工序提供依据,我们必须对开采出的卤水中的硫酸根含量进行快速准确的分析。参照国家标准方法,我们对分光光度法和容量滴定法进行了比较,以期找到一种同时具有简便、快捷、准确等特性的实验方法。 2、原理 2.1、分光光度法 在酸性介质中,一定浓度SO42-与Ba2+生成Ba-SO4沉淀。加入酸-盐-甘油试剂可以帮助形成物理性质均匀的细粒并阻止沉淀的沉降而呈现悬浮物状态,在420nm处测其吸光度。在一定浓度范围内,服从郎白-比尔定律,即A=£bc SO4 2- +Ba2+→BaSO4 2.2、容量滴定法 在酸性介质中,氯化钡与样品中的硫酸根生成难溶的硫酸钡沉淀,过剩的钡离子在pH=10 的介质中以铬黑T 作指示剂,用EDTA 标准溶液滴定,间接测定硫酸根含量。 3、仪器 3.1、722 或721 型分光光度计(配比色皿一套); 3.2、50mL具塞比色管一套; 3.3、一般实验室常用玻璃仪器。 4、试剂及制备方法 4.1.1、特备试剂:将50mL甘油,30mL浓盐酸,300mL蒸馏水,100mL95%乙醇,75克氯化钠混匀。 4.1.2、0.25g/mL氯化钡溶液:取25克氯化钡溶于100mL蒸馏水中。 4.1.3、硫酸根标准贮备溶液(10mg/mL):准确称取7.3930g(称准至0.0001g)已烘干的基准硫酸钠(G、R)溶于100mL 水中,全量转入500mL 容量瓶中,加水定容,摇匀。 4.1.4、硫酸根标准使用溶液(1mg/mL):准确移取10.00mL 硫酸钠标准贮备溶液于100mL 容量瓶中,加水定容,摇匀。 4.2.1、20g/L 盐酸羟胺溶液:称取10 克盐酸羟胺固体,用蒸馏水溶解并稀释至500 毫升。
工业盐酸中硫酸盐含量的测定-铬酸钡分光光度法(精)
中华人民共和国电力行业标准 DL 422.4—91 工业盐酸中硫酸盐含量的测定 ——铬酸钡分光光度法 中华人民共和国能源部1991-10- 04 批准1992-04- 01实施 1 方法概要 硫酸根与过量的铬酸钡-酸悬浊液作用,把部分铬酸钡转化为硫酸钡沉淀,并定量置换出黄色铬酸根离子,可间接求出硫酸根含量。本方法的硫酸根测定范围为0.1~0.5mg。 2 试剂 2.1 氢氧化氨分析纯溶液(3+4。 2.2 醋酸分析纯溶液(1+15。 2.3 盐酸优级纯溶液(1+500。 2.4 95%乙醇。 2.5 铬酸钡-酸悬浊液。将2.5g铬酸钡加到由100mL醋酸(2.2和100mL盐酸(2.3 组成的混合溶液中,激烈振摇混匀后,保存在聚乙烯瓶中。 2.6 含钙离子的氨水。称取1.85g无水氧化钙溶解于500mL氨水(3+4中,贮存于聚乙烯瓶中。 2.7 硫酸钾分析纯标准溶液。 2.7.1 准确称取1.8150g已在700℃灼烧30min的硫酸钾于250mL烧杯中,用二级试剂水溶解后移至1L容量瓶中并稀释至刻度,摇匀。此溶液为A液(1mL中含1 mg。 2.7.2 准确吸取25mLA液(2.7.1于250mL容量瓶中,用二级试剂水稀释至满刻度,摇匀。此溶液为B液(1mL中含0.1mg。 2.8 1mol/L盐酸(优级纯。
3 仪器 3.1 分光光度计。 4 测定方法 4.1 绘制0.1~0.5 mg 准曲线。 4.1.1 按表1规定取硫酸钾工作溶液注入一组25mL比色管中。用二级试剂水稀释至10mL刻度。再加入4mL铬酸钡-酸悬浊液充分摇匀,在20~30℃水浴中恒温5 min。 4.1.2 取1 mL含钙的氨水澄清液(用后应立即将瓶盖盖严,防止吸收空气中二氧化碳分别加入比色管中,充分摇匀后,再分别加入95%乙醇10mL充分摇匀,放置 10min。将比色管内澄清液用干的中速定量滤纸过滤(弃去初始滤液。在波长370nm 处,用10mm的比色皿,以试液空白为参比,测定各显色液的吸光度值。以所测吸光度值和相应的硫酸根(含量绘制工作曲线。 表1 硫酸盐标准曲线的制作 4.2用带线性回归的计算器对吸光度值与硫酸根含量的数据作回归处理,以硫酸根 (含量作自变量,相应的吸光度值作因变量输入计算器,就可得到吸光度值- 硫酸根(含量的线性回归方程。 5试样的测定 5.1吸取20mL试样,用相对密度换算成质量或称重,移入内装少量二级试剂水或称重(称准至0.001g的小烧杯中,小心充分摇匀,在沸水浴上蒸发至干。残留物加1mol/L盐酸3mL,用二级试剂水移入25mL,容量瓶中稀释至刻度,摇匀,为待测液。 5.2吸取待测液10mL注入25mL比色管中。以下测定按4.1.1、4.1.2条所述操作步骤进行发色测定吸光度值。从标准曲线查出相应的硫酸含量(mg,或者根据试样吸光度值,从回归方程求出相应硫酸根含量(mg。
硫酸亚铁铵中铁含量测定
硫酸亚铁铵中铁含量测定 一、实验目的 1. 掌握重铬酸钾法测定亚铁盐中铁含量的原理和方法; 2. 了解氧化还原指示剂的作用原理和使用方法。 二、实验原理 K 2Cr 2 O 7 在酸性介质中可将Fe2+离子定量地氧化,其本身被还原为Cr3+,反应式为: Cr 2O 7 2- + 6Fe2+ + 14H+═ Cr3+ + 6Fe3+ + 7H 2 O 滴定在H 3PO 4 —H 2 SO 4 混合酸介质中进行,以二苯胺磺酸钠为指示剂,滴定至溶液 呈紫红色,即为终点。 三、试剂 硫酸亚铁铵(学生自制)、K 2Cr 2 O 7 (AR)、二苯胺磺酸钠0.2%、H 3 PO 4 85% 等。 四、实验步骤 1、准确称取1~1.5g(NH 4) 2 SO 4 ?FeSO 4 ?6H 2 O样品,置于250 mL烧杯中,加入8 mL 3 mol?L-1H 2SO 4 防止水解,再加入蒸馏水加热溶解,然后定量转移至250mL容量 瓶中定容,充分摇匀。平行移取三份25.00 mL上述样品溶液分别置于三个锥形 瓶中,各加50 mL H 2O、10 mL 3 mol?L-1 H 2 SO 4 ,再加入5~6滴二苯胺磺酸钠指 示剂,摇匀后用K 2Cr 2 O 7 标准溶液滴定,至溶液出现深绿色时,加5.0 mL 85% H 3 PO 4 , 继续滴至溶液呈紫色或紫蓝色。计算试液中Fe的含量。 实验流程
五、数据记录与处理 K 2Cr 2O 7标准溶液, 用滴定管准 确量取25.00ml 上述溶液于锥形瓶中 溶液呈深绿色时加入5mL 磷酸
五、注意事项: 1、滴定至溶液呈深绿色时加入磷酸 六、思考题: 1、本实验中加入硫酸和磷酸的作用是什么? 2、以二苯胺磺酸钠为例,说明氧化还原指示剂的变色原理 参考文献:张龙、潘亚芬《化学分析技术》 邢文卫、李炜《分析化学实验》
硫酸根离子精确检测方法
2.重量法 2.1.原理概要 样品溶液调至弱酸性,加入氯化钡溶液生成硫酸钡沉淀,沉淀经过滤、洗涤、烘干、称重,计算硫酸根含量。 2.2.主要试剂和仪器 2.2.1.主要试剂 氯化钡:0.02mol/L溶液; 配制:称取2.40g氯化钡,溶于500mL水中,室温放置24h,使用前过滤; 盐酸:2mol/L溶液; 甲基红:0.2%溶液。 2.2.2.仪器 一般实验室仪器。 2.3.过程简述 吸取一定量样品溶液〔见附录A(补充件)〕,置于400mL烧杯中,加水至150mL,加2滴甲基红指示剂,滴加2mol/L盐酸至溶液恰呈红色,加热至近沸,迅速加入40mL(硫酸根含量>2.5%时加入60mL)0.02mol/L氯化钡热溶液,剧烈搅拌2min,冷却至室温,再加少许氯化钡溶液检查沉淀是否完全,用预先在120℃烘至恒重的4号玻璃坩埚抽滤,先将上层清液倾入坩埚内,用水将杯内沉淀洗涤数次,然后将杯内沉淀全部移入坩埚内,继续用水洗涤沉淀数次,至滤液中不含氯离子(硝酸介质中硝酸银检验)。以少量水冲洗坩埚外壁后,置电烘箱内于120±2℃烘1h后取出。在干燥器中冷却至室温,称重。以后每次烘30min,直至两次称重之差不超过0.0002g视为恒重。 2.4.结果计算 硫酸根含量按式(1)计算。 硫酸根(%)=(G1-G2)×0.4116 ×100 (1) W 式中:G1——玻璃坩埚加硫酸钡质量,g; G2——玻璃坩埚质量,g; W——所取样品质量,g; 0.4116——硫酸钡换算为硫酸根的系数。 2.5.允许差 允许差见表1。 表1 硫酸根,%允许差,% <0.50 0.03 0.50~<1.50 0.04 1.50~3.50 0.05 2.6.分析次数和报告值 同一实验室取双样进行平行测定,其测定值之差超过允许差时应重测,平行测定值之差如不超过允许差取测定值的平均值作为报告值。
硫酸根测定
硫酸根测定 --剩余滴定法 吸取1ml 样品溶液(提纯后溶液(沉淀后混合溶液)均为为1ml ,),置于150mL 锥形瓶中,加1滴1mol /L 盐酸,加入10.00mL 0.02mol /L 氯化钡溶液(硫酸根含量大于0.6%时,加入10.00mL ),于搅拌器上搅拌片刻,放置5min ,加入10mL mg-EDTA 溶液(与氯化钡量同),15mL 无水乙醇(占总体积30%),5mL 氨性缓冲溶液,4滴铬黑T 指示液,用0.02mol /L EDTA 标准溶液滴定至溶液由酒红色变为亮蓝色。另取一份1ml 与测定硫酸根时相同的样品溶液,置于150mL 锥形瓶中,加入5mL 氨性缓冲溶液,4滴铬黑T 指示液,然后用0.02mol /L EDTA 标准溶液滴定至溶液由酒红色变为亮蓝色为止 (EDTA 用量为钙、镁离子总量。) 结果计算 硫酸根含量按式(4)计算。 硫酸根(%)= TEDTA /SO24×(V1+V2-V3) ×100 (4) ///////////////////////////////////////////////////////////////// (主要计算公式: TEDTA /SO24 =TEDTA /Mg2+×3.9515 (2) 式中:TEDTA /Mg2+------------------EDTA 标准溶液对镁离子的滴定度,g /mL ; TEDTA /Mg2+= W×20/500 ×0.2987 (3) 式中: W ——称取氧化锌的质量,单位为g ; V ——EDTA 标准溶液的用量,单位为mL ; 3.9515——镁离子换算为硫酸根的系数。9515.3422≈+-分子量 分子量d Mg So 0.2987——氧化锌换算为镁离子的系数。2987.0O 4≈分子量 分子量Zn Mg ////////////////////////////////////////////////////////////////////////////////////////////////// 式中:TEDTA /SO24-——EDTA 标准溶液对硫酸根的滴定度,g /mL ; V1——滴定5.00mL 氯化钡溶液EDTA 标准溶液的用量,mL ; V2——滴定钙、镁离子总量EDTA 标准溶液的用量,mL ; (V2的值得5被总是小于氢氧化镁法测定结果的EDTA 量。) V3——滴定硫酸根EDTA 标准溶液的用量,mL ; W ——所取样品质量,g 。 硫酸根,% 允许差,% <0.50 0.03 0.50~<1.50 0.05 1.50~3.50 0.06 同一实验室取双样进行平行测定,其测定值之差超过允许差时应重测,平行测定之差如不超过允许差取测定值的平均值作为报告值
食品中铁含量的测定
食品中铁含量的测定 食品安全检验技术(理化部分) 食品中铁的测定有火焰原子吸收光谱法,二硫腙比色法(邻菲啰啉,磺基水杨酸,硫氰酸盐比色法等)两种国家标准方法.下面对原子吸收分光光度法,分光光度法(邻二氮菲法)进行详细阐述. (一)原子吸收分光光度法 1,原理 经湿法消化样品测定液后,导入原子吸收分光光度计,经火焰原子化后,吸收波长248.3nm的共振线,其吸收量与铁的含量成正比,与标准系列比较定量. 2,主要试剂: (1)高氯酸-硝酸消化液:1+4(体积比) (2)0.5mol/LHNO3溶液 (3)铁标准储备液:每毫升相当于1mg铁. (4)铁标准使用液:取10.0mL(3)液于100mL容量瓶中,加入0.5mol/L硝酸溶液,定容. 3,主要仪器原子吸收分光光度计(铁空心阴极灯) 4,操作方法: 样品处理品系列标准溶液的配制仪器参考条件的选择标准曲线的绘制样品测定 仪器参考条件的选择:波长248.3nm;光源为紫外;火焰:空气-乙炔;其它条件按仪器说明调至最佳状态. 5,结果计算: 式中 X----样品的铁含量,mg/100g(或μg/100mL); ρ----测定用样品液中铁的浓度, μg/mL; ρ0----试剂空白液中铁的浓度,μg/mL; m----样品的质量或体积,g或mL; V----样品处理液总体积,mL; f----稀释倍数. 6,说明 (1)所用玻璃仪器均经硫酸-重铬酸钾洗液浸泡数小时,再以洗衣粉充分洗刷,其后用水反复冲洗,再用去离子水冲洗烘干. (2)本方法最低检出浓度为0.2μg/mL. (二),分光光度法(邻二氮菲法) 1,原理: 在pH为2~9的溶液中,二价铁离子与邻二氮菲生成稳定的橙红色配合物,在510nm有最大吸收,其吸光度与铁的含量成正比,故可比色测定. 2,试剂 ①盐酸羟胺溶液:10% ②邻二氮菲水溶液(新鲜配制):0.12% ③醋酸钠溶液:10% ④盐酸:1mol/L ⑤铁标准溶液: 3,测定方法: ①样品处理:干法灰化 ②标准曲线绘制:吸取10g/mL铁标准溶液0.0mL,1.0mL,3.0mL,4.0mL,5.0mL,分别置于50mL容量瓶中,
GB320-2006工业用合成盐酸
工业用合成盐酸 1 范围 本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。 本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。 3 要求 3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。 3.2 工业用合成盐酸应付表1给出的指标要求。 表1 指标 4 采样 4.1 产品按批检验。生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。用户以每次收到的同一批次的工业用合成盐酸为一批。 4.2 工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代表性样品。生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。 4.3 工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。 4.4 将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。样品量不少于500mL。样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。 5 试验方法
除非另有说明,在分析中仅使用确认为分析纯试剂和GB/T6682中规定的三级水或相当纯度的水。 试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。 5.1 外观 目视观察 5.2 总酸度的测定 滴定法 5.2.1 原理 试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。反应式如下: H + +OH - →H 2O 5.2.2 试剂 5.2.2.1 氢氧化钠标准滴定溶液:c (NaOH )=1mol/L 5.2.2.2 溴甲酚绿指示液:1g/L 。 5.2.3 仪器 一般的实验室仪器和以下仪器。 5.2.3.1 锥形瓶,100mL (具磨口塞)。 5.2.3.2 滴定管,50mL ,有0.1mL 分度值。 5.2.4 分析步骤 5.2.4.1 试料 量取约3ml 实验室样品,置于内装约15ml 水并已称量(精确到0.0001g )的锥形瓶(5.2.3.1)中,混匀并称量(精确到0.0001g )。 5.2.4.2 测定 向试料(5.2.4.1)中加入(2~3)滴溴甲酚绿指示液(5.2.2.2),用氢氧化钠标准滴定溶液(5.2.2.1)滴定至溶液由黄色变为蓝色为终点。 5.2.5 结果计算 总酸度以氯化氢(HCl )的质量分数ω1计,数值以%表示,按式(1)计算: 01m 10100c )1000/(M V m M V C =?= ω (1) 式中: V ——氢氧化钠标准滴定溶液的体积的数值,单位为毫升(mL ); C ——氢氧化钠标准滴定溶液浓度的准确数值,单位为摩尔每升(mol/L ); M 0——试料的质量的数值,单位为克(g );
味精中硫酸盐含量的测定
抚顺师范高等专科学校 毕业论文(设计) 论文(设计)题目:成品味精中硫酸盐含量的测定及控制学生姓名:田爽 指导教师:李峰 学校:抚顺师范高级专科学校 系别:生化系 班级: 07级生物实验技术班 邮编: 113006 2010年2月
成品味精中硫酸盐含量的测定及控制 摘要成品味精中硫酸盐是味精的杂志指标,当味精中硫酸盐的含量过高时说明产品的纯度不够。所以硫酸盐含量的定量测定,对于控制味精中硫酸盐的含量具有十分重要的意义。本文主要阐述了味精生产中硫酸盐含量的定量测定其主要原理是Ba2+与SO42-生成硫酸钡沉淀(Ba2++SO42-=BaSO4 ),其混浊度的吸光值与硫酸盐的浓度存在线性关系,可以定量测定出硫酸盐的含量。 关键词硫酸盐吸光度线性关系改进 前言 味精作为一种调味品,在改善饮食结构、提高饮食档次方面已经成为人们日常生活中不可缺少的食品。然而每年国家质检总局对味精产品质量进行了国家监督抽查,发现有一部分味精硫酸盐含量超标。硫酸盐含量超标,说明企业在生产味精时没有把好质量关。 硫酸盐是味精的杂志指标,硫酸盐含量超标说明产品纯度不够。当味精中硫酸盐的含量过高时会使味精发黄,严重时还会使味精产生难闻的气味使味精的质量大大降低。当人体大量摄入硫酸盐时还会出现腹泻、脱水、和胃肠道紊乱的现象。根据GB/T8967—2007中规定,成品味精中硫酸盐含量应≤0.05%。由此可见硫酸盐含量的测定对于控制味精中硫酸盐的含量具有十分重要的意义。 1. 味精的发展史简介[6]、[12] 味精为调味料的一种,主要成分为谷氨酸钠。此外还含有少量食盐、水分、脂肪、糖、铁、磷等物质。谷氨酸钠是一种氨基酸谷氨酸的钠盐。是一种无嗅无味的晶体,在232℃时解体熔化。谷氨酸钠的水溶性很好,在100ml水中可以溶解74g谷氨酸钠。主要作用为增加食品的鲜味,在中国菜里用的最多,也可用于汤和调味汁。 味精于1909年被日本味之素(味の素)公司所发现并申请专利。纯的味精外观为一种白色晶体状粉末。当味精溶于水(或唾液)时,它会迅速电离为自由的钠离子和谷氨酸盐离子(谷氨酸盐离子是谷氨酸的阴离子,谷氨酸则是一种天然氨基酸)。要注意的是如果在100℃以上的高温中使用味
实验十一 盐酸普鲁卡因注射液含量的测定
实验十一盐酸普鲁卡因注射液含量的测定 一、目的要求 1.掌握亚硝酸钠滴定法测定盐酸普鲁卡因注射液含量的原理及操作方法; 2.掌握盐酸普鲁卡因注射液含量的计算方法; 3. 掌握检验结果的处理与判断,能够规范书写检验原始记录及检验报告书; 4. 正确并更科学合理地解释检验中的现象,处理检验中的异常情况。 二、实验原理 分子结构中具有芳伯胺基的药物,在酸性溶液中课与亚硝酸钠反应,生成重氮盐,因此可用亚硝酸钠滴定法测定含量,用外指示剂法确定滴定终点。 三、仪器与试剂 1. 仪器电子天平或分析天平(0.1mg)、酸式滴定管、烧杯 2. 试剂 亚硝酸钠(分析纯)、无水碳酸钠、对氨基苯磺酸(分析纯)、浓氨水、盐酸(1→2)、溴化钾(分析纯)、淀粉碘化钾试纸 四、实验步骤 1. 亚硝酸钠滴定溶液(0.05mol/L)的配制与标定 取亚硝酸钠约1.8g,加无水碳酸钠0.05g,加水适量使溶解成500mL,作为滴定溶液,摇匀后待标定。 取在120℃干燥至恒重的基准对氨基苯磺酸约0.25g,精密称定,加水30mL及浓氨水3mL,溶解后加盐酸(1→2)20mL,搅拌,在30℃以下用亚硝酸钠滴定溶液迅速滴定。滴定时将滴定管尖端插入液面下约2/3处,事先通过计算,一次将反应所需的大部分亚硝酸钠滴定溶液在搅拌条件下迅速加入,使其尽快反应。然后将滴定管尖提出液面,然后用水淋洗尖端,再缓缓滴定至溶液使碘化钾试纸变蓝为终点。1mmol亚硝酸钠相当于173.2mg对氨基苯磺酸,计算出亚硝酸钠滴定溶液的浓度。 2. 盐酸普鲁卡因注射液含量的测定 精密量取规格为40mg/2mL的盐酸普鲁卡因注射液5mL于200mL烧杯中,加水使成120mL,加入盐酸(1→2)5mL,溴化钾1g,用亚硝酸钠滴定溶液迅速滴定。滴定时将滴定管尖端插入液面下约2/3处,事先通过计算,一次将反应所需的大部分亚硝酸钠滴定溶液在搅拌条件下迅速加入,使其尽快反应。然后将滴定管尖提出液面,然后用水淋洗尖端,再缓
铁矿中铁含量的测定
铁矿中铁含量的测定 化学生物郭梦雨 (四川农业大学四川雅安,625014) 【摘要】本实验运用了改进的重铬酸钾法测定铁的原理,首先是试样用盐酸加热分解, 让有铁的氧化物及硅酸盐都变成氧化铁进入溶液中。先用氯化亚锡将大部分三价铁离子还原成二价铁, 以钨酸钠为指示剂, 用三氯化钛将剩余的三价铁还原成二价铁至生成/ 钨蓝 , 再用重铬酸钾标准溶液氧化至蓝色消失, 加入硫磷混合酸,以二苯胺磺酸钠为指示剂, 用重铬酸钾标准液滴定。用SnCl2- TiCl3- K2Cr2O7 滴定分析法测得铁矿石中铁含量为(19.460.78)% ±, 相对标准偏差为0.03 【关键词】重铬酸钾法、、铁矿石 In the iron mine the assaying of iron content Guo Mengyu 20114049 Chemistry And Biology (Sichuan Agricultural University, Yaan 625014) 【Abstract 】This experiment made use of potassium dichromate method to measurese ferrous principle . First of all, ferric ions was reduced toferrous iron by the stannous chloride, other ferric iron was reduced to ferrous iron by titanium trichloride to generate / tungsten blue0 with sodium tungstate as the indicator . Next, the solution was titratedby potassium dichromate standard solution until the blue was disappeared. After adding mixed acid, the solution was titrated by potassium dichromate standard solution with dipheny lamine sulfonante as indicator.Finally get, in iron content for ±,the average opposite error margin measuring distinguishes to 0.03. (19.460.78)% 【Key words】potassium dichromate method;scraps iron 1引言 铁矿的主要成分是Fe2O3·xH2O。对铁矿来说,盐酸是很好的溶剂,溶解后生成的Fe3+离子,必须用还原剂将它预先还原,才能用氧化剂K2Cr2O7溶液滴定。重铬酸钾法是测铁的国家标准方法。在测定合金、矿石、金属盐及硅酸盐等的含铁量时具有很大实用价值。经典的K2Cr2O7法测定铁时,用SnCl2作预还原剂,多余的SnCl2用HgCl2除去,然后用K2Cr2O7溶液滴定生成的Fe2+离子。这种方法操作简便,结果准确。但是HgCl2有剧毒,造成严重的环境污染,近年来推广采用各种不同汞盐的测定铁的方法。本实验采用的是SnCl2-TiCl3联
工业用合成盐酸
工业用合成盐酸 令狐采学 1范围 本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。 本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。 3要求 3.1外观:工业用合成盐酸为无色或浅黄色透明液体。 3.2工业用合成盐酸应付表1给出的指标要求。 表1 指标 4采样 4.1 产品按批检验。生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。用户以每次收到的同一批次的工业用合成盐酸为一批。 4.2 工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代
表性样品。生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。 4.3 工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。 4.4将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。样品量不少于500mL。样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。 5 试验方法 除非另有说明,在分析中仅使用确认为分析纯试剂和 GB/T6682中规定的三级水或相当纯度的水。 试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。 5.1外观 目视观察 5.2总酸度的测定滴定法 5.2.1原理 试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。反应式如下: H++OH-→H2O 5.2.2 试剂
硫酸根测定
硫酸根测定----EDTA滴定法 本方法适用于循环冷却水和天然水中硫酸根的测定,水样中硫酸根含量大于200mg/L时,可进行适当稀释。 1.原理 水样中加入氯化钡,与硫酸根生成硫酸钡沉淀。过量的离子在氯化镁存在下,以铬黑T为指示剂,用EDTA滴定。 2.试剂 1+1盐酸溶液 0.5%铬黑T乙醇溶液(同总硬度的测定) 氨—氯化铵缓冲溶液(PH=10.3)同总硬度的测定。 0.0125mol/L氯化钡溶液:称取3.054g氯化钡(BaCl2·2H2O)溶于100ml水中,移入1000ml容量瓶中,稀释至刻度。 0.01mol/LEDTA标准溶液。同总硬度的测定。 0.01mol/L氯化镁溶液的配制 称取2.1g氯化镁(MgCl2·6H2O)溶于少量水中,移入1000ml容量瓶中,稀释至刻度。同总硬度的测定 3.仪器 滴定管:酸式25ml。 电炉。 4.分析步骤 4.1 水样的测定 吸取经中速滤纸干过滤的水样50ml于250ml锥形瓶中,加入3滴1+1盐酸溶液,在电炉上加热微沸0.5分钟,再加入10ml 0.0125mol/L氯化钡溶液,微沸10分钟,冷却10分钟后,加入5ml 0.01mol/L氯化镁溶液,10ml氨—氯化铵缓冲溶液,6—10滴镉黑T指示剂,用0.01mol/LEDTA标准溶液滴定,溶液从酒红色至纯蓝色为终点。记录EDTA标准溶液的消耗量V4. 水样中硬度的测定 吸取经中速滤纸干过滤后水样50ml,加10ml氨—氯化铵缓冲溶液,6—10滴镉黑T指示剂,用0.01mol/LEDTA标准溶液滴定至纯蓝色。记录EDTA标
准溶液的消耗量V2. 氯化钡、氯化镁消耗EDTA标准溶液的体积V3。 准确吸取10ml 0.0125mol/L氯化钡溶液,5ml 0.01mol/L氯化镁溶液于250ml 锥形瓶中,加水50ml,再加入10ml氨—氯化铵缓冲溶液,6—10滴镉黑T 指示剂,用0.01mol/LEDTA标准溶液滴定至纯蓝色。 5.分析结果的计算 水样中硫酸根离子的含量X(毫克/升),按下式计算: 96×(V 2﹢V 3 - V 4 )×M 2 X = --------------------- ×1000 V W 式中; M 2 ---EDTA标准溶液的摩尔浓度,mol/L V W---水样体积,毫升 6.允许差 硫酸根含量在100mg/L范围内时,平行测定两结果差不大于4mg/L 7.结果表示 取平行测定两结果的算术平均值,作为水样的硫酸根含量。 8.注意事项 可根据实际水样中的硫酸根含量确定水样的吸取体积。
硫酸根的测定——EDTA滴定法
硫酸根的测定——EDTA滴定法 本方法适用于循环冷却水和天然水中硫酸根离子的测定,水样中硫酸根含量大于200mg/L时,可进行适当稀释。 1.0 原理 水样中加入氯化钡,与硫酸根生成硫酸钡沉淀。过量的钡离子在氯化镁存在下,以铬黑T为指示剂,用EDTA滴定。 2.0 试剂 2.1 1+1盐酸溶液。 2.2 0.5%铬黑T乙醇溶液(同总硬度的测定) 2.3 氨-氯化铵缓冲溶液(PH=10.3) 2.4 0.0125mol/L氯化钡溶液 称取3.054g氯化钡(BaCl2·2H2O)溶于100mL水中,移入1000mL溶量瓶中,稀释至刻度。 2.5 0.01mol/L氯化镁溶液的配制 称取2.1g氯化镁(MgCl2·6H2O)溶于少量水中,移入1000mL容量瓶中,稀释至刻度。 2.6 0.01mol/LEDTA标准溶液 3.0 仪器 3.1 滴定管:酸式25mL。 3.2 电炉。 4.0 分析步骤 4.1 水样的测定 吸取经中速滤纸干过滤的水样50mL于250mL锥形瓶中,加入三滴1+1盐酸,在电炉上加热微煮半分钟,再加入10mL0.0125mol/L氯化钡溶液,微沸半分钟,再加入10mL0.0125mol/L氯化钡溶液,微沸10分钟,冷却10分钟后,加入5mL0.01mol/L氯化镁溶液,10mL氨-氯化铵缓冲液,6-10滴铬黑T指示剂,用0.01mol/LEDTA标准溶液滴定,溶液从酒红色至纯蓝色为终点。 4.2 水中硬度的测定 吸取经中速滤纸干过滤后水样50mL,加10mL氨-氯化铵缓冲溶液,6~10滴铬黑T指示剂,用 0.01mol/LEDTA标准溶液滴定至纯蓝色。 4.3 氯化钡、氯化镁消耗EDTA标准溶液的体积。准确吸取10mL 0.0125mol/L氯化钡溶液,5mL0.01mol/L 氯化镁溶液于250mL锥形瓶中,加水50mL,再加入10mL氨-氯化铵缓冲溶液及6-10滴铬黑T指示剂,用0.01mol/LEDTA标准溶液滴至纯蓝色。 5.0 分析结果的计算 水样中硫酸根离子的含量X(毫克/升),按下式计算: X=96×(V 2 +V 3 -V 4 )×M 2×1000 V w 式中:V2—测定水样硬度时消耗EDTA的体积,毫升; V3—滴定氯化钡和氯化镁溶液时消耗EDTA标准溶液的体积,毫升; V4—测定水样硫酸根时消耗EDTA标准溶液的体积,毫升; M2—EDTA标准溶液的摩尔浓度,摩尔/升; V w—水样体积,毫升。 6.0 允许差 硫酸根含量在100mg/L范围内时,平行测不定期两个结果差,不大于4mg/L。7.0 结果表示
