金属的性质和金属材料复习教学设计

金属的性质和金属材料
复习课教学设计
一、复习教学目标
1.知识目标:了解金属的物理性质,认识金属材料在生产、生活和社会发展
中的重要作用;掌握金属的一些重要化学性质。
2.能力目标:通过比较学习,帮助学生形成获取信息和处理信息的能力,并
构建出与金属材料相关联的知识体系。
3.情感目标:激励学生的合作参与意识,在探究活动中增进合作、增进友谊。
并使学生体会到化学学科不是孤立的,它影响到方方面面,我们的生产生活离不开化学。
二、复习教学要点
1.金属的化学性质
2.有关金属活动性顺序的解题思路
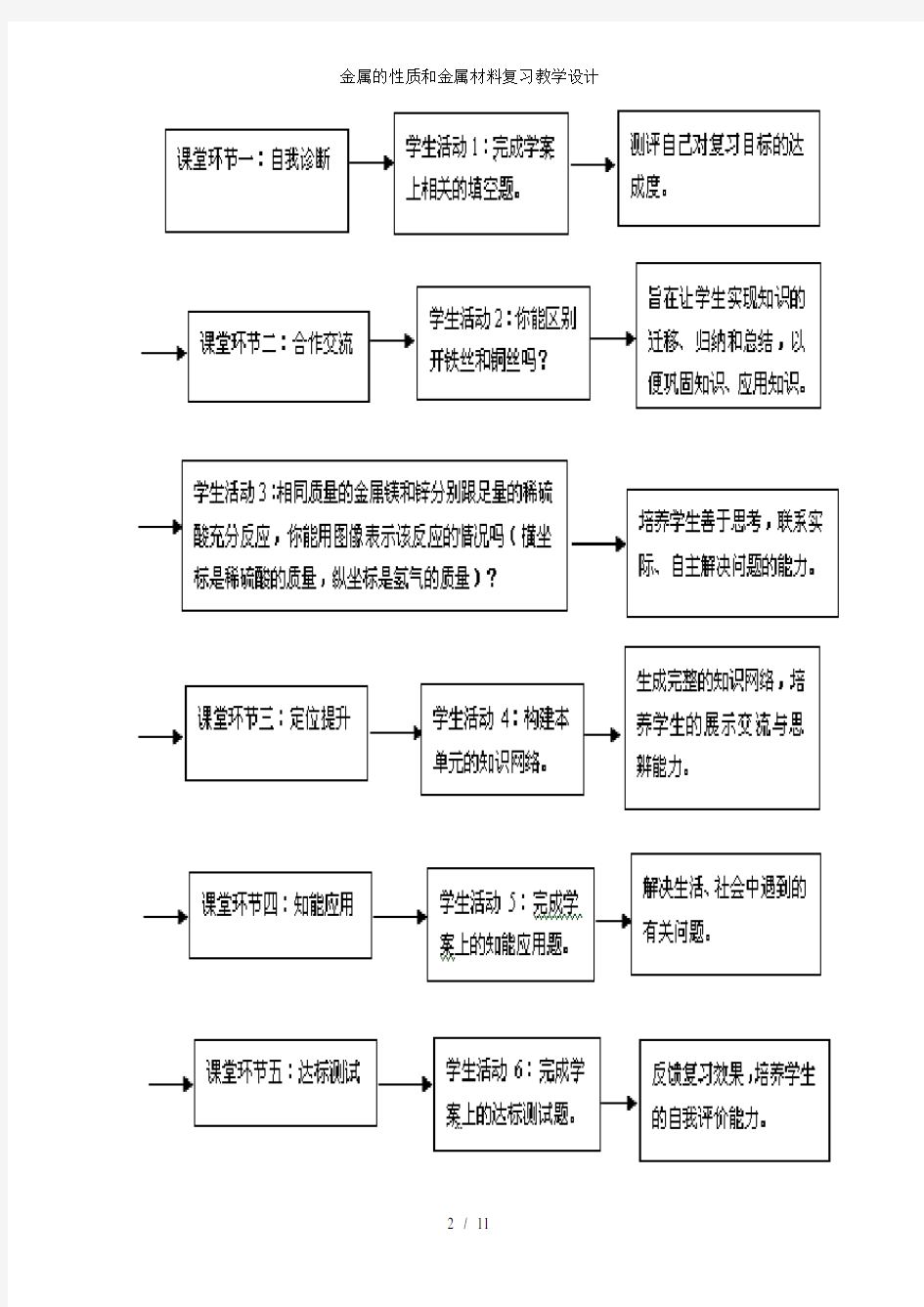
三、复习教学流程
四、复习教学过程设计
1、引导学生对学习过的金属和金属材料,这部分知识进行回顾和总结。首先请同学们独立完成学案上的“自我诊断”。
学生活动:参照“自我诊断”,测评自己对复习目标的达成度。对于出现的疑问,采取看书或小组内交流的形式解决。
(设计意图:使学生通过回顾教材内容,从知识、技能、方法等方面搞好自我排查,发现自己的不足与存在的问题)
2、引导学生复习金属的物理性质:出示一根铁丝和铜丝,你能区别开铁丝和铜丝吗?你是利用了它们的什么性质把它们区别开的?
学生活动:小组内讨论、交流,在此基础上选派代表发言。
(设计意图:通过发散性思维训练,培养学生综合分析问题和解决问题问题的能力。)
3、引导学生突破难点1:相同质量的金属镁和锌分别跟足量的稀硫酸充分反应,你能用图象表示该反应的情况吗(横坐标表示的是稀硫酸的质量,纵坐标表示的是氢气的质量)?
学生活动:在小组内合作交流的基础上完成任务,并将结论填写在学案上。
教师活动:引导学生总结曲线的斜率和高度分别是由什么决定的。
(设计意图:通过进行学法指导,使学生意识到及时总结解题规律的重要性。)
4、引导学生进行重要的小结:通过刚才的系统复习,请同学们尝试总结本单元的知识网络,并将其写在学案上。
学生活动:在小组内合作交流的基础上完成任务,小组选代表到黑板前展
示本组完成的知识网络,并且提出自己的疑问和困惑,其他学生答疑、补充、评价。
(设计意图:解决各组的疑难问题,生成完整的知识网络,培养学生的展示交流与思辨能力。)
5、发放达标测试题,实施达标测试。
学生活动:学生小组内交流、讨论,并将小组内不能解决的问题拿到全班同学面前进行讨论、解决。并根据各自的课堂表现,对自己从知识与技能掌握、学习方法运用、复习效率等方面进行评价,找出优缺点,有利于改进今后的复习。
(设计意图:从三维目标考虑,知识与能力方面的达标主要以测试的形式进行,过程与方法、情感态度与价值观方面的主要通过自评或他评完成。具体评价要从学习方法、学习态度、合作交流、展示表现等方面考虑。)
《金属的性质和金属材料》复习学案一、考点梳理,自我诊断
考点一:金属的性质
⑴常温下一般为(汞为液态),有金属光泽。
1.金属的物理性质⑵大多数呈(铜为紫红色,金为黄色)
⑶有良好的、、
2
化学性质实例现象
与O2反应1、Mg + O2 —
2、Fe + O2—
3、Cu + O2 —
4、Al + O2 —
1、发出耀眼白光,生成色粉末
2、四射,生成色固体
3、生成色固体
4、缓慢氧化
金属+酸→盐+ H2↑Zn+ H2SO4 —
Fe+H2SO4—
A l+ H2SO4—
Zn + HCl—
Fe+ HCl—
A l+ HCl—
金属+盐→另一金属+另一盐(“前换后,盐可溶”)F e + CuSO4—
现象:
Cu + AgNO3 —现象:
【归纳小结】已学的化学反应基本类型,有以下三类:
⑴化合反应 A+B==AB 化学方程式:,
⑵ AB==A+B 化学方程式:,
⑶ A+BC==AC+B 化学方程式:。
考点二:金属活动性顺序表及其应用
1.内容:K Ca
2.应用:在金属活动性顺序里:
⑴金属的位置越靠前,它的活动性就越
⑵位于前面的金属能置换出盐酸、稀硫酸中的(不可用浓硫酸、硝酸)
⑶位于的金属能把位于的金属从它们的中置换出来。(除K、Ca、Na)
考点三:金属材料(包括和 )
合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
★一般说来,合金的熔点比各成分,硬度比各成分,抗腐蚀性能更好
■钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,可用来制造人造骨等。
(1)熔点高、密度小
优点(2)可塑性好、易于加工、机械性能好
(3)抗腐蚀性能好
知识点四:金属资源的利用和保护
⑴原理:在高温下,利用焦炭与氧气反应生成的把铁从铁矿石里出来。
⑵原料:铁矿石、焦炭、石灰石、空气。常见的铁矿石有磁铁矿(主要成分是)、赤铁矿(主要成分是)
2.铁的锈蚀
⑴铁生锈的条件是:铁与、接触(铁锈的主要成分:Fe2O3·XH2O)
(铜生铜绿的条件:铜与、、接触。铜绿:Cu2(OH)2CO3)
⑵防止铁制品生锈的措施:
①保持铁制品表面的、
②表面涂:如涂油、刷漆、电镀、烤蓝等
③改变内部结构:如制成合金。
⑶铁锈很,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。
⑷铝与氧气反应生成的薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
3.金属资源的保护和利用①防止金属腐蚀
保护金属资源的途径:②回收利用废旧金属
③合理开采矿物④寻找金属的代用品
二、知识网络
代
表
物
铁
金属材料冶炼
原料
原理
设备
制成不锈钢
防锈措施
分
类
成分合金纯金属
性
能
通
性
化
性
与O2反应
与酸反应
与盐反应
涂油、刷漆
电镀、烤蓝
金属活动性顺序
三、知能应用
1.市场上有人用铝代替纯银制作戒指,下列方法不能将其鉴别出来的是()
A、利用水、天平和量筒测密度
B、浸入稀盐酸中观察有无气泡产生
C、浸入硫酸铜溶液中观察是否变色
D、浸入氯化钙溶液中观察是否产生白色沉淀
2.生活处处皆化学。请根据你所学的化学知识,判断下列做法中不正确的是()
A、用一氧化碳作气体燃料
B、铁制品电焊前用稀硫酸除铁锈。
C、在不锈钢桶内配置农药波尔多液(含有硫酸铜溶液)
D、冰箱里放置活性炭除异味。
3.将铁片分别放入下列溶液中完全反应后溶液的质量会变轻的是()
A.稀硫酸 B.稀盐酸 C.硫酸铜溶液 D.硫酸亚铁溶液
4.下列各组物质中前者是化合物,后者是混合物的是 ( )
A.稀盐酸氧化铁 B.铁钢 C.石灰石大理石 D.生石灰水泥
5.下列物质,能通过金属和酸直接反应得到的是()
A、FeCl
3 B、CuCl
2
C、FeCl
2
D、AgCl
6.下图是同学们经常使用的铅笔,在组成铅笔的各种材料中:
(1) (每空填一种即可,填序号)能导电的是______,含有单质的是_____,含有机物的是_____,燃烧时产物中有二氧化碳的是_____ 。
(2)该铅笔中④的主要成分是金属铝,将一小片该金属放入稀盐酸中,观察到的现象是
________________,反应的化学方程式是_________________________________。
Fe 2O 3
石灰水
C 7.某钢铁厂高炉炼铁的主要反应过程如下:
焦炭
(1)请在方框内填入相应物质的化学式。
(2)写出步骤①②③的化学方程式:①
② ③ (3)从高炉上排出的废气叫高炉废气,请推测高炉废气的主要成份为 。 四、达标测试
1.右图标出的是有关灯泡组成的物质,请根据右图回答下列问题. ⑴所标物质中属于金属材料的是 属于非金属单质 的是 (各写一种即可)
⑵物质的性质决定其用途,请你就图中标出的物质举一例 说明: ⑶比较锡和铜的活动性强弱可采用 的方法。
2.有位同学设计了下列实验(装置及药品如图所示),回答: ⑴玻璃管中观察到的现象是 ,发生反应 的化学方程式为_________________________。
⑵在C 处看到的现象是 ,发生反应的化学 方程式为_____________________________。
⑶本实验设计中,在B 处所采取措施的目的是 ,其优点是 。
3.还原性铁粉在潮湿的空气中容易生锈。现有m1 g 生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
过量空气、高温
①
焦炭、高温
②
赤铁矿、高温
③
生铁
⑴装置A中反应的化学方程式是_____。
⑵某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数。B中的最佳试剂是_____(填序号),实验时B中反应的化学方程式是__ ___。
①澄清石灰水②氢氧化钠浓溶液③稀盐酸④水
⑶上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③____________________。
4.请你参与某学习小组的探究活动,并回答相关问题:
发现问题:小丽发现盛水的铁锅在与水面接触的部位最易生锈;小茜发现自己的铜制眼镜框表面出现了绿色的铜锈;小玲发现苹果切开不久,果肉上就会产生一层咖啡色的物质,好象生了“锈”一般。
提出问题:这三种物质“生锈”的原因是什么?收集证据:
⑴回忆已有知识:铁生锈的条件是____________________。
⑵查阅有关资料:“铜锈”主要成分是Cu
2(OH)
2
CO
3
(俗称铜绿);苹果“生锈”是果肉
里的物质(酚和酶)与空气中的氧气发生了一系列的反应,生成咖啡色的物质。
⑶实验探究:将四小块铜片分别按下图所示放置一个月,观察现象如下:(提示:NaOH
溶液可用来吸收CO
2
)
装置现
象铜片不生锈铜片不生锈铜片不生锈
铜片生锈且水面附
近锈蚀最严重
由实验可知,铜生锈是铜与水、______、______等物质共同作用的结果。
得出结论:三位同学认为这些物质“生锈”除了可能与水有关外,还可能都与______(填物质名称)有关。
⑷反思与应用:利用所得结论进行填空:
①写出一种防止铁或铜等金属制品生锈的具体方法________________________;
②请你提出一条延长食品保质期的建议__________________________________。
5.实验室有以下试剂:Zn、Cu、Fe、Zn SO
4溶液、Fe SO
4
溶液、Cu SO
4
溶液。
选择合适的试剂设计实验,证明Zn、 Cu 、Fe的活动性顺序,你能用几种方法?你选用的试剂是什么?
6.把相同体积、相同质量分数的足量稀盐酸,分别滴加到等质量、颗粒大小相同的X、Y、Z
三种较活泼的金属中,生成H
2
的质量与反应时间的关系如下图所示。这三种金属的活动性顺序为;假如X、Y、Z都是+2价金属,则相对原子质量由大到小的顺序为
7.小可同学为测定某铁合金的含铁量,做了如下实验,称取11.4克样品,放入质量为50.0
