离子半径表
化学元素的离子半径及共价半径
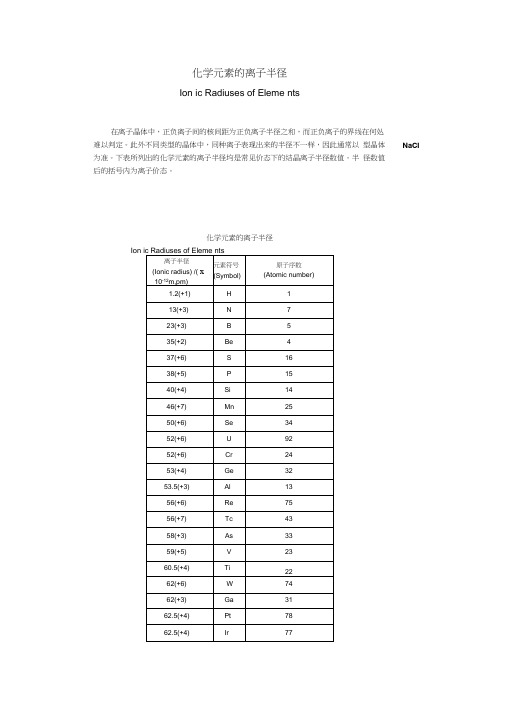
化学元素的离子半径
Ion ic Radiuses of Eleme nts
在离子晶体中,正负离子间的核间距为正负离子半径之和,而正负离子的界线在何处
难以判定。
此外不同类型的晶体中,同种离子表现出来的半径不一样,因此通常以型晶体
NaCI 为准。
下表所列出的化学元素的离子半径均是常见价态下的结晶离子半径数值。
半径数值
后的括号内为离子价态。
化学元素的离子半径
化学元素的共价半径
Covale nt Radiuses of Eleme nts
共价半径是指连接相同原子的共价键键长的一半。
分子或晶体内部相邻原子的共价半
径的和与这些原子的核间距离相等。
在假定原子结构是球对称的情况下,正常的共价半径是指典型的共价键或者配位键中由该原子的核中心到其外层价电子的距离。
多重键的键长比单键短。
一般,双键半径是单键半径的86%三键半径是单键半径的78%。
下表所列均为共价单键半径。
化学元素的共价半径
Covale nt Radiuses of Eleme nts。
水合离子半径列表

水合离子半径列表
水合离子是指在水溶液中与水分子结合形成的离子。
水合离子的半径大小受到离子本身电荷、离子化合物的性质以及水分子的结构等因素的影响,因此并不存在一个固定的水合离子半径列表。
不同离子的水合半径可以通过实验测定或理论计算获得。
以下是一些常见水合离子的水合半径范围(单位为埃):
- 钠离子(Na+):6 - 8.3 Å
- 氯离子(Cl-):6 - 7.6 Å
- 铵离子(NH4+):7 - 11 Å
- 铜离子(Cu2+):4 - 6.5 Å
- 铁离子(Fe3+):4 - 6 Å
- 铝离子(Al3+):4 - 6 Å
- 镁离子(Mg2+):4 - 6 Å
- 银离子(Ag+):4 - 6 Å
需要注意的是,以上数值仅供参考,实际数值可能会有所变化,并且不同文献中给出的数值也可能存在差异。
对于更具体的离子水合半径信息,建议查阅相关化学或物理学专业的参考书籍或科学文献。
离子半径表

3 4 Nb 5
2 Nd 3
2
VI VII VIII IX XII VI VI VIII IV VI VII VIII VIII IX VI VIII IX XII IV IVSQ V VI High Spin Low Spin Low Spin
1.16 1.26 1.32 1.38 1.53 0.86 0.82 0.93 0.62 0.78 0.83 0.88 1.43 1.49 1.123 1.249 1.303 1.41 0.69 0.63 0.77 0.83 0.74 0.7 0.62 1.24 1.24 1.15 1.01 1.12 0.89 0.86 0.85 1.21 1.22 1.24 1.26
1.3 1.31 1.33 0.08 0.63 0.64 0.61 0.78 0.92 0.49 0.58 0.55 0.645 0.78 0.585 0.25 1.8 0.47 0.55 0.62 0.938 1 1.053 1.107 0.73 0.39 0.53 -0.38 -0.18 0.58 0.71 0.76
C
C * C C R* R E R R R P
A P A * * C C
C C R E R
4
3 Cf 4 -1 5 7 3 Cm 4
Cl
IX X XII VI VIII X XII VI VI VIII VI IIIPY IV VI VI VI VIII IV V High Spin Low Spin High Spin Low Spin High Spin High Spin Low Spin High Spin
R
* C
C E R* C R
2
VI
VII Mn 3 VIII V
离子半径表之欧阳道创编

0.67 E 0.83 R*
VII
High Spin 1.04
0.9
C
VIII
1.1
0.96 R
V
0.72 0.58
VI
High Spin 0.785 0.645 R* Low Spin 0.72 0.58 R
IV
0.53 0.39 R
VI
0.67 0.53 R*
IV
0.47 0.33 R
IV
0.395 0.255
0.675 0.535 R*
VII
1.35 1.21
2
VIII
1.4
1.26
IX
1.45 1.31
Am
3
VI VIII
1.115 0.975 R 1.23 1.09
4
VI VIII
0.99 0.85 R 1.09 0.95
3
VI
0.72 0.58 A
As
5
IV VI
0.475 0.335 R*
0.6
0.81 0.67 C
Low Spin 0.79 0.65 R
High Spin 0.885 0.745 R*
1.04
0.9
Low Spin 0.685 0.545 R*
High Spin 0.75 0.61
0.54
0.4
High Spin 0.67 0.53 R
Low Spin 0.87 0.73 E
0.6
E
Low Spin 0.7
0.56 R*
Low Spin 0.62 0.48 R
1.24
1.1
E
1.24
1.1
1.15 1.01 R
离子半径表
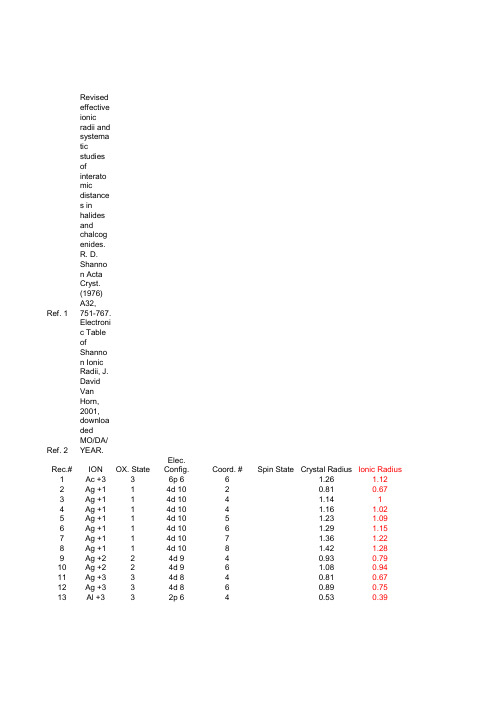
Fe+2 Fe+2 Fe+2 Fe+2 Fe+3 Fe+3 Fe+3 Fe+3 Fe+3 Fe+4 Fe+6 Fr+1 Ga+3 Ga+3 Ga+3 Gd+3 Gd+3 Gd+3 Gd+3 Ge+2 Ge+4 Ge+4 H+1 H+1 Hf+4 Hf+4 Hf+4 Hf+4 Hg+1 Hg+1 Hg+2 Hg+2 Hg+2 Hg+2 Ho+3 Ho+3 Ho+3 Ho+3 I-1 I+5 I+5 I+7 I+7 In+3 In+3 In+3 Ir+3 Ir+4 Ir+5 K+1 K+1
151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201
Bk +4 Bk +4 Br -1 Br +3 Br +5 Br +7 Br +7 C +4 C +4 C +4 Ca +2 Ca +2 Ca +2 Ca +2 Ca +2 Ca +2 Cd +2 Cd +2 Cd +2 Cd +2 Cd +2 Cd +2 Ce +3 Ce +3 Ce +3 Ce +3 Ce +3 Ce +3 Ce +4 Ce +4 Ce +4 Ce +4 Cf +3 Cf +4 Cf +4 Cl-1 Cl+5 Cl+7 Cl+7 Cm+3 Cm+4 Cm+4 Co+2 Co+2 Co+2 Co+2 Co+2 Co+3 Co+3 Co+4 Co+4
下列化合物中阳离子半径与阴离子半径

下列化合物中阳离子半径与阴离子半径在化学反应中,离子的尺寸是一个非常重要的因素。
阳离子和阴离子的尺寸不同,这意味着它们与其他离子或分子的相互作用方式也不同。
在下面的列表中,我们将探讨一些常见的化合物,它们的阳离子和阴离子半径是多少。
1. NaCl:钠离子的半径为0.95 ,氯离子的半径为1.81 。
因此,氯离子比钠离子大。
2. CaCl2:钙离子的半径为1.00 ,氯离子的半径为1.81 。
因此,氯离子比钙离子大。
3. Fe2S3:铁离子的半径为0.78 ,硫离子的半径为1.80 。
因此,硫离子比铁离子大。
4. MgSO4:镁离子的半径为0.72 ,硫酸根离子的半径为1.80 。
因此,硫酸根离子比镁离子大。
5. K2CO3:钾离子的半径为1.38 ,碳酸根离子的半径为1.76 。
因此,钾离子比碳酸根离子大。
6. CuSO4:铜离子的半径为0.73 ,硫酸根离子的半径为1.80 。
因此,硫酸根离子比铜离子大。
总之,阳离子和阴离子的尺寸不同,这直接影响它们与其他离子或分子的相互作用方式。
在化学反应中,这种相互作用方式是非常重要的。
- 1 -。
水合离子半径列表

水合离子半径列表水合离子是指在水中溶解时与水分子之间发生相互作用形成的离子化合物。
水合离子的稳定性和性质与其周围水分子和离子的相互作用密切相关。
水合离子的大小是评估其性质和稳定性的重要参数之一。
本文将介绍一些常见的水合离子及其估计的半径数值。
(1) 氢离子(H+): 氢离子是最简单的水合离子,其半径较小,约为0.23 Å。
(2) 氢氧根离子(OH-): 氢氧根离子是水的碱性离子,其半径约为1.40 Å。
(3) 氨离子(NH4+): 氨离子是一种氮源离子,其半径约为 3.01 Å。
(4) 亚硫酸根离子(SO3²⁻): 亚硫酸根离子是含有二氧化硫的阴离子,其半径约为2.58 Å。
(5) 氯离子(Cl-): 氯离子是一种常见的阴离子,其半径约为3.55 Å。
(6) 钠离子(Na+): 钠离子是一种常见的阳离子,其半径约为4.00 Å。
(7) 硝酸根离子(NO3-): 硝酸根离子是一种常见的阴离子,其半径约为4.23 Å。
(8) 溴离子(Br-): 溴离子是一种常见的阴离子,其半径约为4.56 Å。
(9) 氢氧根离子(HSO3-): 氢氧根离子是亚硫酸根离子的共轭酸,其半径约为2.70 Å。
(10) 碳酸根离子(CO3²⁻): 碳酸根离子是一种常见的阴离子,其半径约为4.57 Å。
本文介绍了一些常见水合离子及其估计的半径数值。
水合离子的半径大小直接影响其在水中的化学性质和稳定性。
通过了解水合离子的半径,可以更好地理解其在化学反应和溶液中的行为。
值得注意的是,水合离子的半径是估计值,实际数值可能因环境和实验条件不同而有所偏差。
因此,在具体研究和应用中,需要更加准确地确定水合离子的半径数值。
