常见根的离子符及化合价
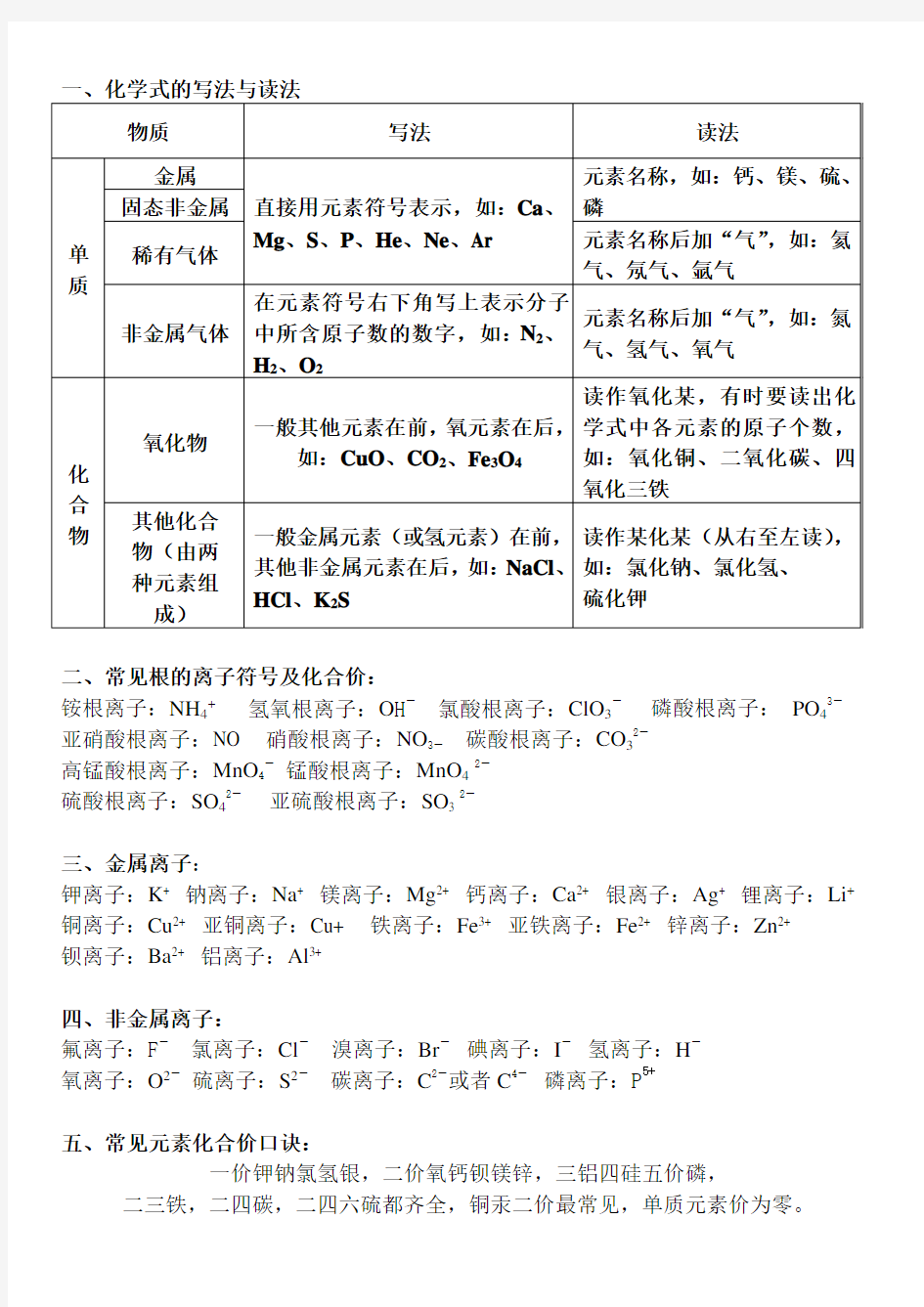

二、常见根的离子符号及化合价:
铵根离子:NH4+氢氧根离子:O H-氯酸根离子:ClO3-磷酸根离子:PO43-亚硝酸根离子:NO 硝酸根离子:NO3-碳酸根离子:CO32-
高锰酸根离子:MnO4-锰酸根离子:MnO42-
硫酸根离子:SO42-亚硫酸根离子:SO3 2-
三、金属离子:
钾离子:K+ 钠离子:Na+ 镁离子:Mg2+ 钙离子:Ca2+ 银离子:Ag+ 锂离子:Li+铜离子:Cu2+ 亚铜离子:Cu+ 铁离子:Fe3+ 亚铁离子:Fe2+ 锌离子:Zn2+
钡离子:Ba2+ 铝离子:Al3+
四、非金属离子:
氟离子:F-氯离子:Cl-溴离子:Br-碘离子:I-氢离子:H-
氧离子:O2-硫离子:S2-碳离子:C2-或者C4-磷离子:P5+
五、常见元素化合价口诀:
一价钾钠氯氢银,二价氧钙钡镁锌,三铝四硅五价磷,二三铁,二四碳,二四六硫都齐全,铜汞二价最常见,单质元素价为零。
六、常见物质的名称、俗称及化学式
元素常见化合价
元素常见化合价 【主要离子】例子该化合价的性质元素及单质的其他性质 氢H +1(主要) 【H+】在大多数化合物中,如HCl、H2O、NaHCO3、NH3等●有三种同位素:1H、2H(或D)、3H(或T)●单质有还原性●可燃●密度最小的气体●无色无味 -1 【H-】在活泼金属氢化物中及其衍生物,如NaH、KH、CaH2、KBH4等有强还原性,可以和水反应放出H?2 锂Li +1 【Li+】锂化合物如LiCl、LiOH、Li2O等焰色为深红色●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素6Li用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成Li2O●强还原剂 钠Na +1 【Na+】钠化合物如NaCl、Na2O2等焰色为黄色●银白色的活泼金属,可以和水反应,保存在煤油中●熔点比水低,密度、硬度小●和醇、酸反应放出氢气●在空气中燃烧生成Na2O2●强还原剂 钾K +1 【K+】钾化合物如KCl、KNO3等焰色为紫色(混有Na+时会为黄色,透过蓝色钴玻璃才能看到紫色)●银白色活泼金属,可以和水反应,比钠更剧烈,保存在煤油中●熔点比水低、密度、硬度小●强还原剂●在空气中燃烧生成K2O2和KO2●钾钠合金用作核反应堆的冷却剂 铷Rb 铯Cs +1 【Rb+】 【Cs+】铷、铯化合物如RbCl、CsCl等铷的焰色为浅紫色,铯的焰色为天蓝色●铷 是银白色金属,铯是略带金黄色光泽的金属,熔点低,和水极其猛烈地反应●铯可以在空气中自燃●强还原剂 镁Mg +2 【Mg2+】镁化合物如MgCl2、MgSO4等●银白色活泼金属,和沸水略有反应●在空气中燃烧生成MgO,也有Mg3N2生成●能在CO2等大多数气体中燃烧●和酸剧烈反应●强还原剂●军事上用作照明弹 钙Ca +2 【Ca2+】钙化合物如CaCl2、CaSO4、CaO等焰色为砖红色●银白色活泼金属,和水反应●密度比水大●在空气中缓慢氧化或燃烧生成CaO●强还原剂 锶Sr 钡Ba +2 【Sr2+】 【Ba2+】锶、钡化合物如SrCl2、BaSO4等锶的焰色为深红色,钡的焰色为黄绿色;Ba2+有毒●银白色活泼金属,可以和水反应●密度比水大●强还原剂●可以在空气中燃烧 硼B +3 【BO33-】大多数硼化合物如H3BO3、B2O3等 铝Al +3 【Al3+】
离子、化学式与化合价
[学习目标集成] 1.初步了解核外电子是分层排布的;了解原子结构的表示方法;会认1~18号元素的原子结构示意图;了解原子结构与元素化学性质的关系。 2.了解离子形成的过程;认识离子也是构成物质的一种粒子;初步了解氯化钠化合物的形成过程。 3.熟练的根据给出的粒子结构示意图判断粒子的种类,能书写简单的离子符号。 4.熟记常见元素及原子团的化合价。 5.了解化学式的涵义,并用规范的语言描述化学式的意义; 6.了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量进行有关简单计算。 7.能看懂某些商品标签或说明书上标示的物质成分和含量 重点:核外电子排布规律及其与元素化学性质的关系,离子的形成和离子表示方法,根据化学式进行简单的计算。 难点:核外电子分层运动想象表象的形成,理解化合价的意义。 [知识要点梳理] 知识点一:核外电子的分层排布 1.电子层: 核外电子运动有自己的特点,在含有多个电子的原子里,电子的能量是不相同的,按电子的能量差异,将核外电子分成不同的能层,能量低的电子通常在离核较近的区域运动,能量高的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层(图11—1)。 2.核外电子的分层排布规律 第一层不超过2个,第二层不超过8个……最外层不超过8个。 【要点诠释】每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
3.原子结构示意图 原子结构示意图可简洁、方便地表示原子的结构,其各部分的意义如图11-2所示(以铝原子为例) 【要点诠释】元素性质与原子最外层电子数的关系 化学上根据事实,把原子最外电子层有8个电子(只有一个电子层的具有2个电子)的结构,称为相对稳定结构。稀有气体元素原子最外电子层是相对稳定结构,金属元素和非金属元素的原子在化学反应中有通过得失电子或共用电子,达到相对稳定结构的倾向。元素的最外层电子数主要决定了元素的化学性质。 元素分类金属元素非金属元素稀有气体元素 最外层电子数较少(一般少于4个)较多(一般4~7个)8个(氦是2个) 得失电子倾向易失去最外层电子易得到电子相对稳定、不易得失电子化学性质不稳定不稳定稳定 知识点二:离子 1.概念: 因得失电子而带电荷的原子(或原子团)叫离子,如Na+、Cl-(或SO42-)等。 2.离子的分类 3.离子的形成: 阳离子:金属元素的原子易失去电子,使原子核外电子所带的负电荷比原子核带的正电荷少,使原子带上正电荷,就变成了阳离子。(核电荷数=质子数>核外电子数)阴离子:非金属元素的原子易得到电子,使原子核外电子所带的负电荷比原子核带的正
初中常用元素化合价表
钾 K +1 氯 Cl -1,+1,+5,+7 钠 Na +1 氧 O -2,-1 银 Ag +1 硫 S -2,+4,+6 钙 Ca +2 碳 C +2,+4 镁 Mg +2 硅 Si +4 钡 Ba +2 氮 N -3,+2,+3,+4,+5 锌 Zn +2 磷 P -3,+3,+5 铜 Cu +1,+2 硫酸根 SO4 -2 铁 Fe +2,+3,碳酸根 CO3 -2 铝 Al +3 硝酸根 NO3 -1 锰 Mn +2,+4,+6,+7 氢氧根 OH -1 氢 H +1 铵根 NH4 +1 氟 F -1 磷酸根 PO4 -3 氯酸根 ClO3 -1(Cl +5价) 关于化合价的口诀,方便大家记忆: 氢+1,氧-2, 银锂钠钾+l价, 锌镁钙钡+2价, 铝+3,硅+4. 只遇金属或是氢, 氮磷-3硫-2, 氟氯溴碘总-1. 可变价,不可怕, 具体判断"和为零". 单质为零要记清. "亚铜" +1"铜" +2, "亚铁" +2"铁" +3, 置换反应铁+2, 复分解时价不变. 关于化合价要准确记着金属元素化合价和原子团的化合价。一般非金属元素化合价是让你求的,所以只需要你了解非金属元素一般显负价,当含氧时显正价就可以了。具体是几不需要。
正一氢银和钠钾, 正二钙钡镁锌汞, 铜是一二,铁二三, 铝的价态是正三。原子团化合价口诀 OH氢氧根-1价, NO3硝酸根-1价 SO4硫酸根-2价 CO3碳酸根-2价 PO4磷酸根-3价 NH4铵根+1价 这种原子团化合价的记法便于掌握原子团的组成、名称、化合价。我们的学生一般都背这个。 一价钾钠氯(-1)氢银,二钾氧(-2)钙钡镁锌 三铝四硅五价磷 二三铁,二四炭,二四六硫都齐全 铜汞二价最常见 一价高锰、氯、硝酸根 二价锰、硫、碳酸根 三价磷酸根 元素化合价常用口诀表(金属显正价,非金属显负价) 一价钾钠氯氢银, 二价氧钙钡镁锌,
【全新版】常见元素的化合价记忆口诀4
一些常见元素和根的化合价 元素和根的名称元素和根 的符号 常见的 化合价 元素和 根 的名称 元素和根 的符号 常见的 化合价 钾K +1 氯Cl -1 +1 +5 +7 钠Na +1 溴Br -1 银Ag +1 氧O -2 钙Ca +2 硫S -2 +4 +6 镁Mg +2 碳 C +2 +4 钡Ba +2 硅Si +4 铜Cu +1 +2 氮N -3 +2 +3 +4 +5 铁Fe +2 +3 磷P -3 +3 +5 铝Al +3 氢氧根OH -1 锰Mn +2 +4 +6 +7 硝酸根NO3-1 锌Zn +2 硫酸根SO4-2 氢H +1 碳酸根CO3-2 氟 F -1 铵根NH4+1 1、化合价有正价和负价 (1)氧元素通常显-2价(2)氢元素通常显+1价 (3)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价 (4)一些元素在不同物质中可显不同的化合价 口诀(一)正一氢锂钠钾银铵根,负一氟氯溴碘氢氧根, 二价氧钙镁钡锌,三铝四硅五价氮磷 二三铁、二四碳,二四六硫都齐全, 锰有二四六和七,铜汞二价最常见。 单质为0酸根负,一价硝酸根,二价硫酸碳酸根,三价就是磷酸根。 口诀(二)一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷; 二三铁二四碳,二四六硫都齐;铜汞二价最常见。 口诀(三)氟氯溴碘负一价;正一氢银与钾钠。氧的负二先记清;正二镁钙钡和锌。 正三是铝正四硅;下面再把变价归。全部金属是正价;一二铜来二三铁。 锰正二四与六七;碳的二四要牢记。非金属负主正不齐;氯的负一正一五七。 氮磷负三与正五;不同磷三氮二四。硫有负二正四六;边记边用就会熟。 口诀(四)一价氢氟钾钠银,二价氧钙钡镁锌,三铝四硅五氮磷,一二铜汞四七锰,二三铁二四碳,二四六硫三五氮,一五七氯常常见,单质为零永不变。 钾钠银氢正一价,钙镁钡锌正二价,铜一二(+),铁二三(+),铝正三, 氢正一,氧负二。钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧是负二价;铜正一正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正六。 常见元素化合价记忆口诀
看离子化合价的变化规律
看离子化合价的变化规律 例如: KMnO4+HCl(浓)=KCl+MnCl2+Cl2+H2O (高锰酸钾+浓盐酸=氯化钾+二氯化锰+氯气+水) 这个有两个方法 第一观察法,这个比较难掌握,没固定公式,看个人水平,我自己总结的 你看这个方程式,先从高锰酸钾下手,高锰酸钾的氧是偶数个,所以生成物的水必要配偶数,也就是说生成物里的HCl必须满足“偶数个H”的条件(不懂我也没办法)然后,盐酸既然配了偶数,则Cl必为偶数,看生成物那里,要使总数成为偶数,KCl必须陪偶数,试着配一个2先,则高锰酸钾配2,所以Mn在反应物里有2个,二氯化锰也配2,高锰酸钾这时候有8个氧,所以水配8,所以有16个H生成,所以HCl配16,即有16个Cl所以氯气配5(因为这时候二氯化锰配了2就是有了4个氯,KCl有2个氯,所以氯气有10个Cl即5分子的氯气) 怎么样,懂吗? 第二个方法就是化合价的升降法 看这个方程式的各个化合物,如果你不知道什么叫化合价那算了 先看高锰酸钾,这里Mn是+7价,在二氯化锰里却是+2价 所以Mn:+7→+2---少了5个电子 再看氯原子,在氯化钾和二氯化锰里化合价都没变,只有氯气里从-1价变为0价 所以Cl:-1→0---多了一个电子
我们设有x分子的Mn少了5个电子,即减少了5x份的电子,设y分子的氯气多了1个电子,因为一个氯气分子里有2个氯原子,所以一共升高2y份的电子 即5x=2y所以x、y的最简比就是2:5 然后把2代到原有的高锰酸钾或生成的二氯化锰里面去(锰的来源或生成),把5代到氯气里(因为只有它的氯的化合价是变了的),以后的应该就懂了吧,高锰酸钾和二氯化锰还有氯气的都出来了,其他的还不懂你就太不应该了 化合价升降配平基本原则 ⒈反应前后各元素的原子个数相等,即质量守恒。 ⒉氧化剂得电子总数与还原剂失电子总数相等,即电子守恒。 ⒊氧化剂化合价降低的总数值与还原剂化合价升高的总数值相等。 配平步骤⒈标变价:写出反应物和生成物的化学式,标出变价元素的化合价。 ⒉列变化:列出反应前后元素化合价的升、降变化值。 ⒊求总数:使化合价升高和降低的总数相等。 ⒋配系数:用观察的方法配平其他物质的化学计量数,配平后,把单线改成等号。 ⒌查守恒:检查方程式两边是否“质量守恒”和“电荷守恒”。 在配平时,是先考虑反应物,还是先考虑生成物,一般有如下规律: ⒈若氧化剂和还原剂中某元素的化合价全部改变,配平宜从氧化剂、还原剂开始,即先考虑反应物。(正向配平) ⒉若氧化剂(或还原剂)中某元素化合价只有部分改变,配平宜从氧化产物、还原产物开始,即先考虑生成物。(逆向配平) ⒊自身氧化还原反应方程式,宜从生成物开始配平。(逆向配平) ⒋同一反应物中有多种元素变价,可将该物质作为一个整体考虑,即求该物质的一个分子中各变价元素的化合价升、降值的代数和。 配平方法 氧化还原反应方程式的配平方法有:化合价升降法、离子-电子法、待定系数法等;配平技巧有:零价配平法、平均标价法、化整为零法、整体分析法等等。为使同学们快速灵活地运用“化合价升降法“配平氧化还原反应方程式,本文介绍如下,希望对大家有所启发。 ①零价法 用法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降值相等,最后用观察法配平其他物质的化学计量数。 试配平Fe3C + HNO3 -Fe(NO3)3 + NO2 + CO2 + H2O。 分析:复杂物质Fe3C按常规化合价分析无法确定其中Fe和C的具体化合价,此时可令组成该物质的各元素化合价均为零价,再根据化合价升降法配平。 Fe3C →Fe(NO3)3 和CO2 整体升高13价,HNO3 →NO2 下降1价(除了Fe、C以外,只有N变价)。 易得Fe3C + 22HNO3 = 3Fe(NO3)3 + 13NO2+ CO2 + 11H2O。 ②平均标价法 用法:当同一反应物中的同种元素的原子出现两次且价态不同时,可将它们同等对待,即假定它们的化合价相同,根据化合物中化合价代数和为零的原则予以平
离子与化合价的异同
离子与化合价的异同 离子和化合价是化学教学中的一大重点,也是难点。在化学教学中,由于离子符号和元素化合价的标法非常相似,学生在学习时容易混淆。为了使学生能正确书写离子符号和标出元素化合价,现将离子和化合价的异同总结如下: 一、相同点 离子所带的电荷数与元素化合价在数值上是相等的,离子所带的电荷的正负与元素化合价的正负相一致。在离子化合物中,元素化合价的数值就是这种元素的一个原子得失电子的数目,化合价的正负与离子所带电荷的正负相一致。如在氯化纳中,1个纳原子失去1个电子,钠离子带1个单位的正电荷,纳的化合价即为+1价,1个氯原子得到1个电子,氯离子带1个单位的负电荷,氯的化合价即为-1价;在氯化镁中,1个镁原子失去2个电子,镁离子带2个单位的正电荷,镁的化合价就是+2价,而1个氯原子得到1个电子,氯离子带1个单位的负电荷,氯的化合价就是-1价。在共价化合物中,元素化合价的数值就是这种元素的一个原子与其它元素的原子形成共用电子对的数目。化合价的正负由电子对的偏移来决定,电子对偏向哪种原子,哪种原子就显负价,偏离哪种原子,哪种原子就显正价。如在氯化氢中,氯原子和氢原子共用一对电子,电子对偏向氯原子,则氯离子带1个单位的负电荷,氯元素的化合价就是-1价,电子对偏离氢原子,则氢离子带1个单位的正电荷,氢元素的化合价就是+1价。 二、不同点 离子是指带电的原子或原子团,而化合价是指一种元素一定数目的原子和其它元素一定数目的原子相化合的性质,在书写离子符号和标元素化合价时,有许多不同之处: (1)离子带的电荷数与元素化合价所标的位置不一样:写离子符号时,离子所带的电荷数应标在元素符号的右上角,如Ba2+、O2- 而元素化合在元素符号的正 上方,如、。 (2)数值与“+”、“-”的前后顺序不一样:在写离子符号时,数值在前,符号“+”、“-”在后,而标元素化合价时,符号“+”、“-”在前,数值在后。
常见化学元素化合价38069
化学元素的化合价助记口诀 一价氢氯钠钾银, 二价氧钙钡镁锌, 三铝四硅五价磷, 二三铁,二四碳, 二四六硫都齐全, 铜汞二价最常见。 正一钾钠银氢铵 正二钙镁钡和锌 三铝四硅氧负二 一二铜二三铁二四碳 氟氯负一磷正五 氢氧根 -1 硝酸根 -1 硫酸根 -2 碳酸根 -2 一价氢氯(负)钾钠银 二价氧(负)钡钙镁锌 三铝四硅五价磷 二三铁,二四碳 二四六硫都齐全(-2、+4、+6)铜汞二价最常见 莫忘单质价为零 最常见的有:氢正一,氧负二
化学式的写法 1、各种物质的化学式都是通过实验方法测定出来的,一种纯净物只能由一个化学式来表示,不能主观臆造 2、单质的化学式的写法 (1)金属单质、固体非金属单质、稀有气体单质用元素符号表示。如金属单质:Fe (铁)、Na (钠);固体非金属:S (硫)、P (磷)等;稀有气体:He (氦)、Ne (氖)等 (2)氧气等多原子分子构成的单质,在元素符号的右下角添上下标,表示一个分子含有多(氯气)2Cl (臭氧),3O (氧气)、2O 少个该原子。如: 3、化合物的化学式的写法——根据化合价来写化学式 (1)一般是正价的元素(或原子团)写在左边,负价元素(或原子团)写在右边 (2)在金属化合物中,金属元素一般呈正价,非金属呈负价;在化合物中,氧元素一般呈-2价,氢元素一般呈+1价 (3)化合物中,各种元素化合价的代数和为零 注意: (1)标注某元素的化合价时,务必要写在该元素符号的正上方,先标电性,后标数目 如:+2表示在氧化铜中铜元素呈+2价 (2)某些元素具有可变价态,它们表示在与其他元素化合形成化合物时,会出现多种可能 特别:Fe 在命名时,+3价就是铁,而在+2价时要被称为亚铁 9 、初中一般常见的原子团及化合价 10、化学式反映了物质的组成 1、化学式(formular ),就是用元素符号和数字的组合来表示纯净物组成的式子。 提出的依据:任何纯净物都有固定的组成,不同的物质组成不同 2、化学式所表示的含义(一般包括宏观和微观角度) 微观上:表示某物质;表示该物质由哪些元素组成的 宏观上:表示该物质的一个分子或者一个原子;由分子构成的物质,还可以表示一个分子的构成情况 +2 CuO
离子符号与化合价
常见阳离子: 氢离子——H+钠离子——Na+镁离子——Mg2+铝离子——Al3+钾离子——K+钙离子——Ca2+银离子——Ag+钡离子——Ba2+锌离子——Zn2+铜离子——Cu2+汞离子——Hg2+ 铁离子——Fe3+亚铁离子——Fe2+ 铵根离子——NH 4 + 常见阴离子: 氯离子——Cl-硫离子——S2-氧离子——O2-氟离子——F- 氢氧根离子——OH-硫酸根离子——SO 42-硝酸根离子——NO 3 - 碳酸根离子——CO 32-碳酸氢根离子——HCO 3 - 磷酸根离子——PO 43-亚硫酸根离子——SO 3 2— 高锰酸根离子——MnO 4-锰酸根离子——MnO 4 2- 氯酸根离子——ClO3- 化合价口诀:(括号中为负价) 一价氢(氯)钾钠银, 二价(氧)钙钡镁锌, 三铝四硅五价磷, 二三铁、二四碳, (二)四六硫都齐全, 氮有负三和正五, 铜汞二价最常见, 莫忘单质价为零。 默写(第1遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳 酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子
默写(第2遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第3遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第4遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子
离子符号与化合价
氢离子——H + 钠离子——Na + 镁离子——Mg 2+ 铝离子——Al 3+ 钾离子——K + 钙离子——Ca 2+ 银离子——Ag + 钡离子——Ba 2+ 锌离子——Zn 2+ 铜离子——Cu 2+ 汞离子——Hg 2+ 铁离子——Fe 3+ 亚铁离子——Fe 2+ 铵根离子——NH 4+ 常见阴离子: 氯离子——Cl - 硫离子——S 2- 氧离子——O 2- 氟离子——F - 氢氧根离子——OH - 硫酸根离子——SO 42- 硝酸根离子——NO 3- 碳酸根离子——CO 32- 碳酸氢根离子——HCO 3- 磷酸根离子——PO 43- 亚硫酸根离子——SO 32— 高锰酸根离子——MnO 4- 锰酸根离子——MnO 42- 氯酸根离子——ClO 3- 化合价口诀:(括号中为负价) 一价氢(氯)钾钠银, 二价(氧)钙钡镁锌, 三铝四硅五价磷, 二三铁、二四碳, (二)四六硫都齐全, 氮有负三和正五, 铜汞二价最常见, 莫忘单质价为零。 默写(第1遍): 氢离子 铝离子 钾离子 银离子 钡离子 锌离子 铜离子 铁离子 亚铁离子 镁离子
氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第2遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第3遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚
初级中学化学资料全套汇编(元素符号,化合价口诀,离子符号,俗名,化学式,化学方程式)
1. 初中化学常用的30种元素的元素符号 HHeLiBeB 氢氦锂铍硼 CNOFNe 碳氮氧氟氖 NaMgAlSiP 钠镁铝硅磷 SClArKCa 硫氯氩钾钙 MnFeCuZnAg 锰铁铜锌银 IBaPtAuHg 碘钡铂金汞2.化合价口诀 负一硝酸氢氧根,负二硫酸碳酸根。 负三记住磷酸根,正一价的是铵根。 一价氢氯钾钠银;二价氧钙钡镁锌。 三铝四硅五价磷,二三铁,二四碳。 二四六硫价都齐全,铜汞二价最常见。 单质零价永不变。
3.离子符号 硝酸根离子:NO3- 氢氧根离子:OH- 硫酸根离子:SO42- 碳酸根离子:CO32- 氢离子:H+ 氯离子:Cl- 钾离子:K+钠离子:Na+ 银离子:Ag+ 氧离子:O2-钙离子:Ca2+钡离子:Ba2+ 镁离子:Mg2+锌离子:Zn2+铝离子:Al3+亚铁离子:Fe2+ 铁 离子:Fe3+ 硫离子:S2- 铜离子:Cu2+ 4.俗名 生石灰:CaO 熟石灰:Ca(OH)2 火碱、烧碱、苛性钠:NaOH 纯碱、苏打:Na2CO3 小苏打:NaHCO3 5. 化学式(正前负后,标价化简,交叉检验) 单质 氢气H2氦气He氧气O2氮气N2氖气Ne钠Na硅Si铝Al 硫S氯气Cl2钾K氩气Ar 锰Mn铁Fe铜Cu锌Zn 镁Mg银Ag镉Cd锡Sn 氙气Xe钡Ba铂Pt金Au 硒Se碘I2臭氧O3铅Pb 氧化物 水H2O过氧化氢H2O2一氧化碳CO 一氧化氮NO二氧化氮NO2氧化钠Na2O 氧化铝Al2O3二氧化硅SiO2五氧化二磷P2O5三氧化硫SO3二氧化硫SO2氧化钙CaO 氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化铜Cu O氧化镁MgO二氧化碳CO2 酸 硝酸HNO3盐酸HCl硫酸H2SO4碳酸H2CO3乙酸CH3COOH 碱
常见元素和根的化合价韵语1
常见元素和根的化合价韵语: (Ⅰ)元素 一价氢氯钾钠银;(K Na H Ag +1价; F -1价; Cl Br I -1、+1、+5、+7价) 二价氧镁钙钡锌;(O -1、-2价;Mg Ca Ba Zn +2价) 三铝四硅五价磷;(Al +3价;Si +4价;P -3、+3、+5价;N -3、+1、+2、+3、+4、+5价) 二四六价硫记准;(S -2、+4、+6价), 单质为零铜正二;(单质中元素化合价为零。Cu +1、+2价) 铁有二三碳二四;(Fe +2、+3价,C -4、+2、+4价) 金正非负和为零。(金属元素无负价,化合物中各元素正、负化合价代数和为零。) 另附: 氟氯溴碘负一价;正一氢银锂钠钾。 氧的负二先记清;正二钡钙镁和锌。 正三是铝正四硅;下面再把变价归。 全部金属是正价;一二铜来二三铁。 锰有正二四六七;碳的二四要牢记。 非金属负主正不齐;氯有负一正一五七。 氮磷都有负三正三五;不同磷三氮二四。 二四六硫都齐全;边记边用就会熟。 (Ⅱ)根 氢氧、硝、高锰、氯酸根,根价负一记在心。(O -2H +1 - N +5O -2 3- M +7nO -2 4- C +5lO -23-) 碳、硫、亚硫、锰酸根,根价负二不用问,(C +4O -2 32- S +6O -2 4 2- S +4O -2 32- M +6 nO -2 42-) 铵根正一,负三是磷。(N -3H +1 4+ P +5O -2 43-) 另附: 一价铵根硝酸根;氢卤酸根氢氧根。 高锰酸根氯酸根;高氯酸根醋酸根。 二价硫酸碳酸根;氢硫酸根锰酸根。 暂记铵根为正一;负三有个磷酸根。 注:根价-1:硝酸根NO 3-、氢氧根OH -、高锰酸根MnO 4-、氯酸根ClO 3-、、 氢卤酸根(氟离子F -、氯离子Cl -、溴离子Br -、碘离子I -)、 高氯酸根ClO 4-、醋酸根CH 3COO -; 根价-2:碳酸根CO 32-、硫酸根SO 42- 、锰酸根MnO 42-、亚硫酸根SO 3 2- 、
离子符号与化合价之欧阳光明创编
常见阳离子: 欧阳光明(2021.03.07) 氢离子——H+钠离子——Na+ 镁离子——Mg2+铝离子——Al3+ 钾离子——K+钙离子——Ca2+银离子——Ag+ 钡离子——Ba2+ 锌离子——Zn2+铜离子——Cu2+汞离子——Hg2+ 铁离子——Fe3+亚铁离子——Fe2+ 铵根离子——NH4+ 常见阴离子: 氯离子——Cl-硫离子——S2-氧离子——O2-氟离子——F- 氢氧根离子——OH-硫酸根离子——SO42-硝酸根离子——NO3- 碳酸根离子——CO32-碳酸氢根离子——HCO3- 磷酸根离子——PO43-亚硫酸根离子——SO32— 高锰酸根离子——MnO4-锰酸根离子——MnO42- 氯酸根离子——ClO3-
化合价口诀:(括号中为负价) 一价氢(氯)钾钠银, 二价(氧)钙钡镁锌, 三铝四硅五价磷, 二三铁、二四碳, (二)四六硫都齐全, 氮有负三和正五, 铜汞二价最常见, 莫忘单质价为零。 默写(第1遍): 氢离子铝离子 钾离子 银离子 钡离子 锌离子 铜离子 铁离子亚铁离子镁离子 氯离子 钠离子 硫离子 钙离子氧离子氟离子 汞离子 铵根离子氢氧根离子 硝酸根离子碳酸根离子 碳酸氢根离子硫酸根离子 磷酸根离子 高锰酸根离子 锰酸根离子 亚硫酸根离子 氯酸根离子 默写(第2遍): 氢离子铝离子 钾离子 银离子 钡离子 锌离子 铜离子 铁离子亚铁离子镁离子 氯离子 钠离子 硫离子 钙离子氧离子氟离子 汞离子 铵根离子氢氧根离子 硝酸根离子碳酸
根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第3遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第4遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子
看离子化合价的变化规律
看离子化合价的变化规律
看离子化合价的变化规律 例如: KMnO4+HCl(浓)=KCl+MnCl2+Cl2+H2O (高锰酸钾+浓盐酸=氯化钾+二氯化锰+氯气+水) 这个有两个方法 第一观察法,这个比较难掌握,没固定公式,看个人水平,我自己总结的 你看这个方程式,先从高锰酸钾下手,高锰酸钾的氧是偶数个,所以生成物的水必要配偶数,也就是说生成物里的HCl必须满足“偶数个H”的条件(不懂我也没办法)然后,盐酸既然配了偶数,则Cl必为偶数,看生成物那里,要使总数成为偶数,KCl必须陪偶数,试着配一个2先,则高锰酸钾配2,所以Mn在反应物里有2个,二氯化锰也配2,高锰酸钾这时候有8个氧,所以水配8,所以有16个H生成,所以HCl配16,即有16个Cl所以氯气配5(因为这时候二氯化锰配了2就是有了4个氯,KCl有2个氯,所以氯气有10个Cl即5分子的氯气) 怎么样,懂吗? 第二个方法就是化合价的升降法 看这个方程式的各个化合物,如果你不知道什么叫化合价那算了 先看高锰酸钾,这里Mn是+7价,在二氯化锰里却是+2价 所以Mn:+7→+2---少了5个电子 再看氯原子,在氯化钾和二氯化锰里化合价都没变,只有氯气里从-1价变为0价 所以Cl:-1→0---多了一个电子
等对待,即假定它们的化合价相同,根据化合物中化合价代数和为零的原则予以平均标价,若方程式出现双原子分子时,有关原子个数要扩大2倍。 试配平NH4NO3-HNO3+N2+H2O。 【分析】NH4NO3中N的平均化合价为+1价,元素化合价升降关系为: NH4NO3 →HNO3:+1→+5升4×1价 NH4NO3 →N2:+1→0 降1×2价 易得5NH4NO3 = 2HNO3 + 4N2 + 9H2O ③整体标价法 用法:当某一元素的原子或原子团(多见于有机反应配平)在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零的原则予以整体标价。 试配平S+Ca(OH)2-CaSx+CaS2O3+H2O 【分析】CaSx中S元素的化合价为-2/x。CaS2O3中S元素的化合价为+2。要配平方程式,那么右边S元素的化合价和要为0。则由于在CaSx中有X个S元素,则起元素化合价和为-2,而在CaS2O3中有两个S元素,其元素化合价之和为+4。要想右边S元素化合价和为零,则CaSx应乘以2。那么在右边一共有2X+2个S元素,所以 易得2(x+1)S + 3Ca(OH)2 = 2CaSx + CaS2O3 + 3H2O 例题 1.一般化学方程式的配平 例1: +1 -2 +5+2 +2+6 Cu2S+HNO3—Cu(NO3)2+NO↑+H2SO4+H2O 【分析】从化合价的变化可知,Cu2S为还原剂,HNO3为氧化剂,氧化剂、还原剂不属于同一种物质,应正向配平,以正向变价元素的原子个数为准来表示价态变化。Cu2S中两个+1价的Cu变为两个+2价的Cu化合价升高了2,一个-2价的S变为一个+6价的S化合价升高了8,共升高了10;而在HNO3中,一个+5价的N变为+2价的N化合价降低了3。求最小公倍数使化合价升降总数相等,则Cu2S的系数为3,HNO3的系数为10。这一过程可直观的表示为(“↑“表示化合价的升高,“↓“表示化合价的降低,对应“ד前的数值;“ד后的数值表示含变价元素物质的系数。下同)+1 +22Cu→2Cu ↑2-1 +6 ↑10×3 S→S ↑8 +5 +2 N→N ↓3×10 所以Cu2S的系数为3,HNO3的系数为10,进而确定氧化产物Cu(NO3)2、H2SO4的系数分别为6和10;再根据质量守恒定律配平其它物质的系数得(注:要把未变价的HNO3加上): 3Cu2S+22HNO3 6Cu(NO3)2+10NO↑+3H2SO4+8H2O 例2: -3+6 +40 (NH4)2SO4—NH3↑+SO2↑+N2↑+H2O 【分析】从化合价的变化知:氧化剂、还原剂属于同一种物质,应逆向配平,以逆向物质中变价元素的原子个数为准来表示价态的变化。则有:
化合价、离子和化学式的书写
常见元素离子、化合价与某些物质化学式的练习 一、常见的离子 1.氢离子_ 2.氧离子_ 3.氟离子_ 4.钠离子_ 5.镁离子_ 6.铝离子_ 7.硫离子_ 8.氯离子_ 9.钾离子_ 10.钙离子_ 11.铜离子_ 12.亚铁离子_ 13.铁离子_ 14.银离子_ 15.钡离子_ 16.锌离子_ 17.氢氧根离子_ 18.硝酸根离子_ 19.硫酸根离子_ 20.碳酸根离子_ 21.铵根离子_ 二、常见元素(化合物中)的化合价 1. H _ 价 2. O _ 价 3. F _ 价 4. Na _ 价 5. M g _ 价 6. Al 价 7. K _ 价 8. Ca _ 价 9.Zn _ 价10.A g_ 价11. Ba _ 价12.H g价 13.Br_ 价14.Fe_ 价15.Cu _ _ 价 三、某些物质的化学式 1、单质 (1)单原子类 ①稀有气体类 氦气_ 氖气_ 氩气_ ②非金属固体类 碳_ 硫黄_ 红磷(白磷)_ ③金属类 汞(水银)_ 铁_ 铜_ (2)多原子类(形如Xn) ①某气 氢气_ 氧气_ 氮气_ 氯气 ②其他臭氧_ 2、化合物
(1)氧化物 水过氧化氢氧化亚铁三氧化二铁(氧化铁)四氧化三铁氧化亚铜氧化铜氧化汞 三氧化二铝(氧化铝)氧化镁氧化钙二氧化锰五氧化二磷二氧化硫三氧化硫 一氧化氮二氧化氮一氧化碳二氧化碳(2)金属化合物 氯化钾氯化钠氯化钙氯化钡 氯化银氯化亚铜氯化铜氯化镁 氯化锌氯化亚铁氯化铁氯化铝 碘化钾硫化钠 (3)根团化合物 ①氢氧化某 氢氧化钾氢氧化钠氢氧化钙氢氧化钡 氢氧化铜氢氧化亚铁氢氧化铁氢氧化铝 ②硝酸某 硝酸钾硝酸钠硝酸铜硝酸汞硝酸银 硝酸钡硝酸锌硝酸镁硝酸亚铁硝酸铁 ③硫酸某 硫酸钾硫酸钠硫酸铜硫酸钡 硫酸钙硫酸亚铁硫酸铁硫酸铝 ④碳酸某 碳酸钾碳酸钠碳酸钡碳酸钙碳酸镁 ⑤某铵 氯化铵硫酸铵碳酸铵硝酸铵 ⑥某酸 盐酸硫酸碳酸硝酸 ⑦其他氯酸钾高锰酸钾锰酸钾
常见原子团化合价及离子化学式书写
常见原子团化合价及离子: 练习: 写出下列离子符号: 钙离子__Ca2+____铝离子__ Al3+_ ____镁离子Mg2+_ 钾离子___K+___铁离子_ Fe3+_ ____ 亚铁离子____ Fe2+_ __氢离子__H+_____银离子_ Ag+ ____铜离子Cu2+_ 锌离子Zn2+_ 硫离子S2-氯离子Cl-钠离子___ Na+ ___氧离子__O2-____镁离子__ Mg2+_ 钡离子__Ba2+_____ 硝酸根离子___ NO3-___铵根离子__ NH4+____碳酸根离子CO32- 硫酸根离子SO42-氢氧根离子OH-磷酸根离子__ PO43-____ 写出下列物质的化学式: 氧化钾氧化钠氧化钙氧化亚铁氧化铁氧化铝 K2O Na2O CaO FeO Fe2O3 Al2O3 氯化钾氯化钠氯化银氯化铵氯化钙氯化钡氯化铝 KCl NaCl AgCl NH4 Cl CaCl2 BaCl2 AlCl3 氯化镁氯化铜氯化锌氯化亚铁氯化铁 MgCl2 CuCl2 ZnCl2 FeCl2 FeCl3 氢氧化钾氢氧化铝氢氧化钙氢氧化钡氢氧化镁氢氧化铜 KOH Al(OH)3 Ca(OH)2 Ba(OH)2 Mg(OH)2 Cu(OH)2 氢氧化钠氢氧化铁氢氧化锌氢氧化亚铁 NaOH Fe(OH)3 Zn(OH)2 Fe(OH)2 碳酸钾硫酸钾硝酸钾碳酸钠硫酸钠硝酸钠 K2 CO3 K2SO4 KNO3 Na2 CO3 Na2SO4 NaNO3 碳酸银硫酸银硝酸银碳酸铵硫酸铵硝酸铵 Ag2 CO3 Ag2 SO4 AgNO3 (NH4)2 CO3 (NH4)2SO4 NH4 NO3 碳酸钙硫酸钙硝酸钙碳酸钡硫酸钡硝酸钡 CaCO3 CaSO4 Ca(NO3)2 BaCO3 BaSO4 Ba(NO3 )2 碳酸镁硫酸镁硝酸镁碳酸铜硫酸铜硝酸铜 MgCO3 MgSO4 Mg(NO3 )2 CuCO3 CuSO4 Cu(NO3 )2
离子符与化合价
常见阳离子: 氢离子——H +钠离子——Na +镁离子——Mg 2+铝离子——Al 3+ 钾离子——K +钙离子——Ca 2+银离子——Ag +钡离子——Ba 2+ 锌离子——Zn 2+铜离子——Cu 2+汞离子——Hg 2+ 铁离子——Fe 3+亚铁离子——Fe 2+ 铵根离子——NH 4+ 常见阴离子: 氯离子——Cl -硫离子——S 2-氧离子——O 2-氟离子——F - 氢氧根离子——OH -硫酸根离子——SO 42-硝酸根离子——NO 3- 碳酸根离子——CO 32-碳酸氢根离子——HCO 3- 磷酸根离子——PO 43-亚硫酸根离子——SO 32— 高锰酸根离子——MnO 4-锰酸根离子——MnO 42- 氯酸根离子——ClO 3- 化合价口诀:(括号中为负价) 一价氢(氯)钾钠银, 二价(氧)钙钡镁锌, 三铝四硅五价磷, 二三铁、二四碳, (二)四六硫都齐全, 氮有负三和正五, 铜汞二价最常见, 莫忘单质价为零。
默写(第1遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第2遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第3遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子 默写(第4遍): 氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子汞离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子亚硫酸根离子氯酸根离子
6:离子、化合价和化学式
6:离子、化合价和化学式
中考化学总复习六 一. 教学内容: 1、离子 2、化合价和化学式 二. 教学目标: 1. 初步了解核外电子排布的知识,元素的性质与原子最外层电子数目的关系;了解离子的形成过程。 2. 了解化合价的涵义,掌握确定化合物中元素化合价的规则,熟记常见元素及原子团的化合价。 3. 掌握元素(或原子团)化合价,离子的表示方法,理解化学符号中阿拉伯数字的意义。 4. 了解化学式的概念及其意义,掌握应用化合价推求化学式的基本技能,掌握化学式的写法和读法。 三. 重点、难点: 重点:1. 离子的形成。 2. 确定化合物中元素化合价的规则,常见元素原子团的化合价。 3. 应用化合价推求化学式,化学式的写法和读法。
难点:1. 应用化合价推求化学式。 2. 化学符号周围阿拉伯数字的意 义。 【典型例题】 [例1] 下列符号只具有微观意义而不具有宏观意义的是( ) A. O B. Cu C. 2 2N D. O H 2 思维点拔:元素符号和化学式既有宏观的意义,又有微观意义,当他们的前面有系数时,则只具有微观意义,表示原子或分子的数目,这些数目是可以改变的;而化学式中元素符号右下角的角码数,表示的是该物质中各元素的原子个数比,或者是该物质的一个分子中各元素的原子数目,这些数目是通过实验测定的客观事实,因此化学式中元素符号右下角的数字不能改动。 答案:C [例2] 分别求出高锰酸钾(4 KMnO ),锰酸钾(4 2 MnO K ) 中锰元素的化合价。 思维点拔:上述两种化合物中,钾元素为1+价,氧元素为2-价,根据化合物中正负化合价代数和为零的规则,列方程,可求出Mn 的化合价。 解:设4 KMnO 、 4 2 MnO K 中的Mn 的化合价分别为x 价、
常见元素及原子团的化合价表
常见元素及原子团的化合价表 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验 Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁 Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成HCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理 Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理 BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理 Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理 FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成 AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成 MgCl2+2NaOH = Mg(OH)2↓+2NaCl CuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成 CaO+ H2O = Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆 Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱 Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成 Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成 AgNO3+NaCl = AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子
常见离子符及化合价识记
常见离子符号(识记) Na+(钠离子)Cl-(氯离子)Mg2+(镁离子)Ca2+(钙离子) O2-(氧离子)H+(氢离子)OH-(氢氧根离子)SO 4 2-(硫酸根离子) CO 32-(碳酸根离子)NO 3 -(硝酸根离子)NH 4 +(铵根离子)K+(钾离子) Fe2+(亚铁离子)Fe3+(铁离子)Al3+(铝离子)Cu2+(铜离子) 常见离子符号(识记) Na+(钠离子)Cl-(氯离子)Mg2+(镁离子)Ca2+(钙离子) O2-(氧离子)H+(氢离子)OH-(氢氧根离子)SO 4 2-(硫酸根离子) CO 32-(碳酸根离子)NO 3 -(硝酸根离子)NH 4 +(铵根离子)K+(钾离子) Fe2+(亚铁离子)Fe3+(铁离子)Al3+(铝离子)Cu2+(铜离子) 常见离子符号(识记) Na+(钠离子)Cl-(氯离子)Mg2+(镁离子)Ca2+(钙离子) O2-(氧离子)H+(氢离子)OH-(氢氧根离子)SO 4 2-(硫酸根离子)
CO 32-(碳酸根离子)NO 3 -(硝酸根离子)NH 4 +(铵根离子)K+(钾离子) Fe2+(亚铁离子)Fe3+(铁离子)Al3+(铝离子)Cu2+(铜离子) 常见离子符号(识记) Na+(钠离子)Cl-(氯离子)Mg2+(镁离子)Ca2+(钙离子) O2-(氧离子)H+(氢离子)OH-(氢氧根离子)SO 4 2-(硫酸根离子) CO 32-(碳酸根离子)NO 3 -(硝酸根离子)NH 4 +(铵根离子)K+(钾离子) Fe2+(亚铁离子)Fe3+(铁离子)Al3+(铝离子)Cu2+(铜离子) 常见离子符号(识记) Na+(钠离子)Cl-(氯离子)Mg2+(镁离子)Ca2+(钙离子) O2-(氧离子)H+(氢离子)OH-(氢氧根离子)SO 4 2-(硫酸根离子) CO 32-(碳酸根离子)NO 3 -(硝酸根离子)NH 4 +(铵根离子)K+(钾离子) Fe2+(亚铁离子)Fe3+(铁离子)Al3+(铝离子)Cu2+(铜离子)
