高中化学 第1章第1节 元素周期表(带详细解析) 新人教版必修2

第一章物质结构元素周期律
第一节元素周期表
重难点一元素周期表
1.构成原子(离子)的微粒间关系
(1)原子序数=核电荷数=核内质子数=核外电子数(原子中)。
(2)离子电荷数=质子数-核外电子数。
(3)质量数(A)=质子数(Z)+中子数(N)。
(4)质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
(5)质子数(Z)=阴离子的核外电子数-阴离子的电荷数。
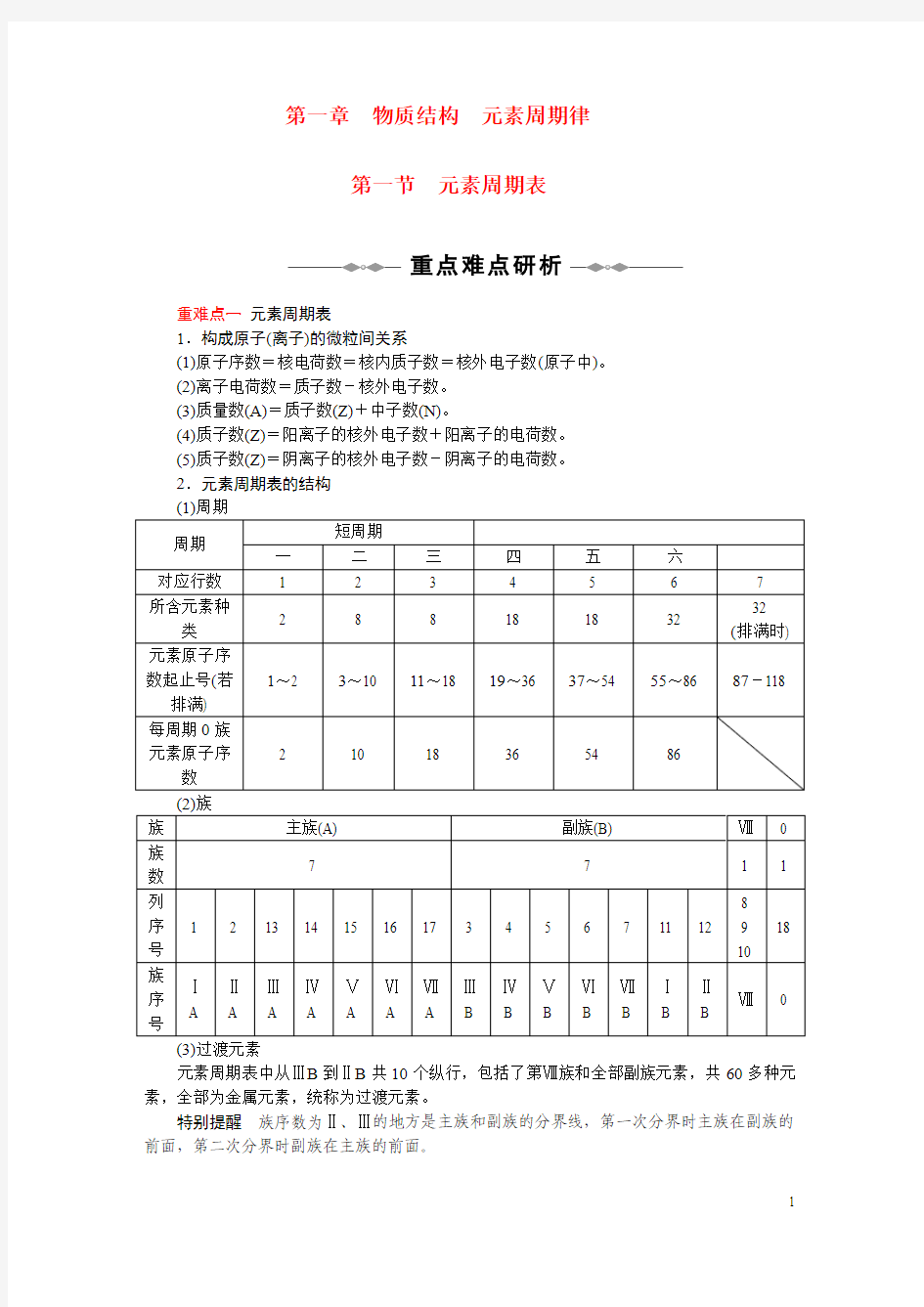
2.元素周期表的结构
元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。
“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。 “第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。 重难点二 零族定位法确定元素的位置 1.
2.比大小定周期
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的两种0族元素,那么该元素就和序数大的0族元素处于同一周期。
3.求差值定族数
(1)若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA 族或ⅡA 族。
(2)若比相应的0族元素少1~5时,则应处在同周期的ⅢA ~ⅦA 族。 (3)若差其他数,则由相应差值找出相应的族。 重难点三 元素的性质与原子结构 1.碱金属单质的相似性和递变性 (1)相似性
①与O 2反应生成相应的氧化物,如Li 2O 、Na 2O 等。 ②与Cl 2反应生成RCl ,如NaCl 、KCl 等。
③与H 2O 反应,能置换出H 2O 中的氢,反应通式为2R +2H 2O===2ROH +H 2↑。
④与非氧化性酸反应,生成H 2,反应通式为2R +2H +===2R +
+H 2↑。(R 表示碱金属元素)
(2)递变性
从Li 到Cs ,随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱,失电子能力逐渐增强,金属性逐渐增强。表现为:
①与O 2的反应越来越剧烈,产物更加复杂,如Li 与O 2反应只能生成Li 2O ,Na 与O 2
反应还可以生成Na 2O 2,而K 与O 2反应能够生成KO 2等。
②与H 2O 的反应越来越剧烈,如K 与H 2O 反应可能会发生轻微爆炸,Rb 与Cs 遇水发生剧烈爆炸。
③对应离子的氧化性依次减弱,即氧化性:Li +>Na +>K +>Rb +>Cs +
。 ④最高价氧化物对应水化物的碱性逐渐增强,CsOH 的碱性最强。
特别提醒 (1)碱金属单质性质的相似性和递变性是其原子结构的相似性和递变性的必然结果。
(2)因Na 、K 等很活泼的金属易与H 2O 反应,故不能从溶液中置换出不活泼的金属。 2.卤素单质的相似性、递变性和特性 (1)相似性
①与H 2反应生成相应的氢化物:X 2+H 2===2HX 。 ②与活泼金属(Na 等)反应生成相应的金属卤化物:
2Na +X 2=====点燃
2NaX 。
③与H 2O 反应:
X 2+H 2O===HX +HXO(X 指Cl 、Br 、I) 2F 2+2H 2O===4HF +O 2 (2)递变性
①从上到下,卤素单质的氧化性逐渐减弱,阴离子的还原性逐渐增强,即氧化性:F2>Cl2>Br2>I2,还原性:I->Br->Cl->F-。
②随着原子序数递增,与H2反应越来越难,氢化物的稳定性逐渐减弱,还原性逐渐增强,其水溶液的酸性逐渐增强,HCl、HBr、HI的熔、沸点依次升高。
③卤素单质与变价金属(如Fe)反应时,与F2、Cl2、Br2生成高价(如FeBr3),而与I2只能生成低价(FeI2)。
(3)卤素单质的特殊性质
①氟元素无正价,无含氧酸。
②Cl2易液化。
③Br2是在常温下唯一的一种液态非金属单质。
④碘为紫黑色固体,易升华,淀粉遇I2变蓝色。
特别提醒F与Cl、Br、I的性质在某些方面差别较大:(1)卤素单质与水的反应;(2)F-的还原性极弱;(3)氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸;(4)F无正价、无含氧酸,而Cl、Br、I有最高正价和含氧酸。
3.同主族元素性质递变规律
由碱金属元素和卤素的性质来看,元素的化学性质,主要由原子的最外层电子数决定,其次是电子层数。原子结构相似的元素,它们的化学性质表现出相似性和递变性。同主族从
归纳总结由碱金属元素、卤素推导出的同主族元素金属性、非金属性变化规律适合其他所有同主族元素,这里必须强调的是金属性增强是指同主族的金属元素之间的金属性相比,自上而下金属性增强;非金属性减弱是指同主族的非金属之间,非金属性随原子序数的增大逐渐减弱。如第ⅣA族中,非金属性C>Si,金属性Ge 4.元素金属性和非金属性强弱的比较 (1)金属性强弱的比较 比较金属性的强弱,其实质是看元素原子失去电子的能力,越易失电子,金属性越强。 ①从元素原子结构判断 a.当最外层电子数相同时,电子层数越多,原子半径越大,越易失电子,金属性越强。 b.当电子层数相同时,核电荷数越多越难失电子,金属性越弱(以后学)。 ②从元素单质及其化合物的相关性质判断 a.金属单质与水或酸反应越剧烈,元素金属性越强。 b.最高价氧化物对应水化物的碱性越强,元素金属性越强。 ③根据金属活动性顺序表判断 一般来说排在前面的金属元素其金属性比排在后面的强。 ④离子的氧化性强弱判断 离子的氧化性越强,则对应金属元素的金属性越弱。 特别提醒 金属性强弱的比较,关键是比较原子失去电子的难易,而不是失去电子的多少。如Na 失去一个电子,而Mg 失去两个电子,但Na 的金属性比Mg 强。 (2)非金属性强弱的比较 比较元素非金属性的强弱,其实质是看元素原子得到电子的难易程度,越易得电子,非金属性越强。 ①从元素原子结构判断 a .当电子层数相同时,核电荷数越多,非金属性越强; b .当最外层电子数相同时,核电荷数越多,非金属性越弱。 ②从元素单质及其化合物的相关性质判断 a .单质越易跟H 2化合,生成的氢化物也就越稳定,氢化物的还原性也就越弱,其非金属性也就越强。 b .最高价氧化物对应水化物的酸性越强,其非金属性越强。如H 2SO 4的酸性强于H 3PO 4,说明S 的非金属性比P 强。 c .非金属单质间的置换反应,例如:Cl 2+2KI===2KCl +I 2,说明氯的非金属性比碘强。 d .元素的原子对应阴离子的还原性越强,元素的非金属性就越弱。如S 2- 的还原性比Cl - 强,说明Cl 的非金属性比S 强。 特别提醒 (1)金属性和非金属性讨论的对象是元素,具体表现为该元素的单质或特定化合物的性质。 (2)氧化性和还原性讨论的对象是具体物质或某物质中的特定粒子,具体表现在该物质中某元素得失电子的能力。 重难点四 核素 1.元素、核素、同位素之间的区别和联系 (2)元素、核素、同位素之间的关系图 2.元素的相对原子质量 (1)元素的相对原子质量就是按照该元素各种同位素原子所占的一定百分比算出的平均值。 (2)元素的相对原子质量的计算 设某元素有多种不同的核素,A、B、C……表示各核素的相对原子质量,a%、b%、c%……为各核素的原子数目百分数,则元素的相对原子质量计算式为Mr=A·a%+B·b%+C·c%+…… 例如,氯元素有3517Cl和3717Cl两种天然、稳定的同位素,3517Cl的原子数目百分数为75.77%,37 Cl的原子数目百分数为24.23%;3517Cl的相对原子质量为34.969,3717Cl的相对原子质量为17 36.966。则氯元素的相对原子质量为: 34.969×75.77%+36.966×24.23%=35.453。 题型1 元素周期表的结构 例1若把周期表原先的主、副族号取消,由左到右按原顺序编为18列。如碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是() A.第3列元素种类最多,第14列元素的化合物种类最多 B.第10列元素全部是金属元素 C.第18列元素单质全部是气体 D.只有第2列元素的原子最外层有2个电子 解析第3列元素中包括镧系和锕系元素,各有15种元素,所以种类最多,第14列元素中包括碳元素,碳元素可形成有机物,故化合物的种类最多,A正确;第10列为过渡金属,故B正确;第18列元素为稀有气体元素,单质全部为气体,故C正确;D项中除第2列元素的原子最外层有2个电子外,其他如He、部分过渡金属元素最外层也是2个电子。 答案 D 对每一族中各原子的最外层电子数不熟悉,忽略He最外层也是两个电子。 题型2 元素位置的确定 例22007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是() A.钅仑第七周期B.镭第七周期C.铼第六周期D.氡第六周期解析经推算第七周期的稀有气体元素的原子序数为118,所以111号元素位于第七周期,故C项和D项是错误的;又知镭为第ⅡA族元素,排除B项,所以A项正确。 答案 A 题型3 原子结构与元素性质 例3铯是一种碱金属元素,下列关于铯及其化合物的叙述不正确的是() A.硫酸铯的化学式为Cs2SO4 B.氢氧化铯是一种强碱 C.可以电解熔融的氯化铯制取铯 D.碳酸铯受热易分解成氧化铯和二氧化碳 解析我们熟悉碱金属中钠的性质,而铯与钠同主族,其结构上的相似性和递变性决定了它们在化学性质上的相似性和递变性。铯和钠一样,最外层只有一个电子,在化合物中通常显+1价;氢氧化钠是强碱,而铯的金属性比钠强,所以其最高价氧化物对应的水化物也是一种强碱;和钠一样,铯也可以用电解熔融盐的方法制取;碳酸钠受热不易分解,类比可 推知碳酸铯也不易分解。 答案 D 解决此类问题,应充分利用元素性质的相似性和递变性,利用已知物质的性质以点带面,类推新物质的性质。 题型4 核素、同位素 例4 2007年诺贝尔化学奖得主Gerhard Ertl 对金属Pt 表面催化CO 氧化反应的模型进 行了深入研究。下列关于202 78Pt 和198 78Pt 的说法正确的是( ) A.202 78Pt 和198 78Pt 的质子数相同,互称为同位素 B.202 78Pt 和198 78Pt 的中子数相同,互称为同位素 C.202 78Pt 和198 78Pt 的核外电子数相同,是同一种核素 D.202 78Pt 和198 78Pt 的质量数不同,不能互称为同位素 解析 202 78Pt 与198 78Pt 是同一种元素的不同原子,因此它们互称为同位素。质子数相同而中子数不同的同一元素的不同原子之间互称为同位素。元素原子的质子数和核外电子数相等。有一定数目的质子和一定数目的中子的一种原子,就是一种核素。 答案 A 1.查阅元素周期表中的有关信息,填写下表…… 碱金属元素原子的最外层电子数均是1。 2.实验: (1)将一干燥的坩埚加热,同时取一小块钾…… 提示 3.思考与交流:通过回忆和观察钠和…… 提示 钾、钠都与O 2、H 2O 等发生反应,但钾比钠反应剧烈,且钾与氧气反应时产物比钠复杂。 钾、钠的原子最外层电子数都为1,故均为活泼金属;钾的电子层数多,原子半径大,原子核对最外层电子的吸引力减弱,故钾比钠更易失去最外层电子,性质更活泼。 卤族元素的原子结构如下所示…… 提示 剧烈程度:逐渐减弱。 生成的氢化物的稳定性:逐渐减弱。 完成下列实验,观察现象…… 提示 1.1 1 Cs Li 7 1 F F 2.C 3.C 4.A [由质量数和质子数计算可得中子数为99,而166 67Ho 的核外电子数与质子数相等,即为质子数与中子数之差,99-67=32。] 5.(1)63Li 73Li (2)14 6C 14 7Al (3)2311Na 24 12Mg 解析 决定元素种类的是原子的质子数。质子数相同的核素属于同一种元素,质子数相同而中子数不同的核素互为同位素。 6.以硫元素为例 7. 周期表中的位置 8.略。 9.(1)4Li + O 2=====点燃 2Li 2O 还原剂 氧化剂 (2)2K + 2H 2O===2KOH +H 2↑ 还原剂 氧化剂 (3)Br 2 + 2KI===2KBr +I 2 氧化剂 还原剂 (4)2FeCl 2+Cl 2===2FeCl 3 还原剂 氧化剂 10.(1) (2)甲与乙:C +O 2=====点燃 CO 2(或2C +O 2=====△ 2CO) 乙与丙:2Na +O 2=====点燃 Na 2O 2(或4Na +O 2===2Na 2O) 乙与丁:4Al +3O 2=====点燃2Al 2O 3 11.不可以。113种元素,并不等于只有113种原子,因为有些元素存在同位素,所以,原子的种类实际多于113种。 12.略。 1.我国稀土资源丰富。下列有关稀土元素144 62Sm 与150 62Sm 的说法正确的是( ) A.14462Sm与15062Sm互为同位素 B.14462Sm与15062Sm的质量数相同 C.14462Sm与15062Sm是同一种核素 D.14462Sm与15062Sm的核外电子数和中子数均为62 答案 A 解析14462Sm和15062Sm是同一种元素的不同核素,质量数、中子数均不同,互为同位素。 2.下列叙述错误的是() A.13C和14C属于同一种元素,它们互为同位素 B.1H和2H是不同的核素,它们的质子数相等 C.14C和14N的质量数相等,它们的中子数不等 D.6Li和7Li的电子数相等,中子数也相等 答案 D 解析13C、14C互为同位素;14C、14N质量数都为14,中子数分别为8、7;1H、2H互为同位素,质子数相等;6Li、7Li互为同位素,质子数和电子数都对应相等,但中子数不相等。 3.在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为() A.5Z B.5Z+18 C.5Z+10 D.5Z+8 答案 C 解析题目给出周期表中的部分元素的位臵关系,根据该特点,D、B、E不可能是第ⅠA、第ⅡA和第ⅢA族元素,且分别位于第二、三、四周期;根据相邻元素原子序数的关系,可知原子序数分别为A:Z-1;C:Z+1;D:Z-8;E:Z+18,因此这五种元素核电荷数之和为5Z+10。 4.已知钡的活动性介于钠和钾之间,下列叙述正确的是() A.钡与水反应不如钠与水反应剧烈 B.钡可以从KCl溶液中置换出钾 C.氧化性:K+>Ba2+>Na+ D.碱性:KOH>Ba(OH)2>NaO H 答案 D 解析A中由于钡的活动性比钠强,所以钡与水反应比钠与水反应更剧烈,故A错;B 中钡的活动性不如钾且先与水发生反应,故不能臵换出钾,故B错;C中由于金属性:K>Ba>Na,故氧化性为Na+>Ba2+>K+,故C错;D中元素的金属性越强,其对应的最高价氧化物的水化物的碱性越强,故KOH>Ba(OH)2>NaOH,D说法正确。 5.下列不能说明氯元素的非金属性比硫元素强的事实是() ①HCl比H2S稳定②HClO氧化性比H2SO4强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S⑤氯原子最外层有7个电子,硫原子最外层有6个电子 A.②⑤B.①②C.①②④D.①③⑤ 答案 A 解析含氧酸的氧化性不能作为判断非金属性强弱的依据,而最外层电子数多的非金属性不一定强,如非金属性O>I。 6. 如图所示是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是() ①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐 ②Y、Z的气态氢化物的水溶液的酸性:Y ③Z的单质在常温下是液体,可与铁粉反应 ④Z的原子序数比Y的大19 ⑤Z所在的周期中含有32种元素 A.①②③④B.①②③④⑤C.只有③D.只有①④答案 A 解析从题中各元素在周期表中所处的位臵,得出该图为元素周期表右上角的一部分,由此可以依次判断出各元素:R为He,X为N,Y为S,Z为Br。X的气态氢化物为NH3,而Y的最高价氧化物对应的水化物为H2SO4,它们可反应生成硫酸铵,①正确;Y、Z的气态氢化物分别为H2S、HBr,HBr的水溶液为强酸,H2S的水溶液为弱酸,故②正确;说法③符合客观事实,正确;Z的原子序数为35,而Y的原子序数为16,④正确;Z所在周期为第四周期,从19号元素开始,到36号元素结束,共18种元素,⑤错误。综上所述,正确的答案为A。 7.A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B (1)A、B、C三种元素的名称分别为__________、_______________、________; (2)B元素位于元素周期表中第______周期、第____族; (3)C的原子结构示意图为____________,C的单质与水反应的化学方程式为________________________________________________________________________; (4)比较B、C的原子半径:B____C,写出足量的A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:____________________________________________________ ________________________________________________________________________。 答案(1)氮硫氟(2)三ⅥA (3)2F2+2H2O===4HF+O2 (4)>2NH3+H2SO4===(NH4)2SO4 解析依题意,A、B、C为短周期元素,从A、B、C的相对位臵看,A、C只能处在第二周期,而B处在第三周期。设A的原子序数为x-1,则C的原子序数为x+1,B的原子序数为x+8,则有:(x-1)+x+1=x+8,得:x=8。所以A、B、C的原子序数分别为7、16、9,对应的元素符号分别为N、S、F。S的原子半径比同主族的O要大,而O比同周期的F要大,因此,S的原子半径大于F的原子半径。 8.实验探究是体验知识的产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空: 实验名称:氯、溴、碘的氧化性强弱比较 (1)完成该实验需用到的仪器是________________________________________________________________________; (2)CCl 4在实验中所起的作用是________________________________________________________________________ ________________________________________________________________________; (3)在实验②中四氯化碳层颜色变化过程为________________________________________________________________________ ________________________________________________________________________; (4)该同 学的实验缺陷是________________________________________________________________________, 改进的办法是________________________________________________________________________ ________________________________________________________________________。 答案 (1)试管、量筒 (2)萃取剂,使生成的Br 2、I 2溶于其中,便于观察现象 (3)由无色逐渐变为橙红色 (4)不能证明溴的氧化性强于碘 再做一组实验④,步骤为: KI 溶液+溴水+1 mL CCl 4,振荡,静置,观察CCl 4层颜色 解析 利用非金属单质间的臵换反应来比较单质的氧化性强弱。Cl 2能臵换出Br 2、I 2, Br 2能臵换出I 2,则说明氧化性Cl 2>Br 2>I 2。 第1课时元素周期表 1.下列各表为周期表的一部分(表中数字代表元素的原子序数),其中正确的是() B 14 D 答案 D 2.甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是() A.x+2 B.x+4 C.x+8 D.x+18 答案 B 解析元素周期表中,相邻两个周期内上下相邻两种元素的原子序数之差与周期表的结构的关系存在以下几种情况: 左上图:上下差2;右上图:上下差8;左下图:上下差18;右下图:上下差32。因此,同族相邻两种元素的序数之差为2、8、18、32。 3 答案 解析6号元素比Ne(10)少4个电子,10-6=4,有2个电子层,最外层电子数为4,位于第二周期第ⅣA族;13号元素比Ne(10)多3个电子,有3个电子层,最外层电子数为3,位于第三周期第ⅢA族;34号元素比Kr(36)少2个电子,共有4个电子层,最外层电子数为6,位于第四周期第ⅥA族;53号元素比Xe(54)少1个电子,共有5个电子层,最外层电子数为7,位于第五周期第ⅦA族;88号元素比Rn(86)多2个电子,共有7个电子层,最外层电子数为2,位于第七周期第ⅡA族。 1.下列说法正确的是() A.元素周期表中元素排序的依据是原子的核电荷数 B.元素周期表有十六个纵行,也就是十六个族 C.原子的最外层电子数相同的元素,一定属于同一族 D.电子层数相同的粒子,对应元素一定属于同一周期 答案 A 解析元素周期表有十八个纵行,十六个族,第Ⅷ族占三个纵行;Be和He的最外层电子数都是2,但不属于同一族;Ne和Na+的电子层数都是2,但不属于同一周期。 2.在现行元素周期表中,所含元素种数最多的族和周期分别是() A.第ⅠA族第六周期B.第Ⅷ族第六周期 C.第ⅢB族第六周期D.第ⅢA族第六周期 答案 C 解析现行元素周期表中,第六、七周期第ⅢB族为镧系和锕系元素,各有15种元素,由于第七周期未排满,故第六周期第ⅢB族元素最多。 3.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是() A C D 答案 D 解析A项,5号元素位臵不相符;B项,5号元素与15号元素相对位臵不正确;C项,2号元素位臵不正确。 4.已知A为第ⅡA族元素,B为第ⅢA族元素,A、B的原子序数分别为m和n,且它们为同一周期的元素,下列关系式错误的是() A.n=m+1 B.n=m+11 C.n=m+25 D.n=m+10 答案 D 解析本题考查元素周期表的结构。第ⅡA族、第ⅢA族短周期中相邻原子序数差1; 四、五周期中由于中间有副族和第Ⅷ族元素的存在,故第ⅡA族、第ⅢA族原子序数差11; 六、七周期中由于镧系、锕系元素的存在,两者相差25。 5.有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,阳离子所带正电荷a A.a>b>c>d B.b>a>d>c C.c>b>a>d D.b>a>c>d 答案 B 解析由于a、b、c、d对应的阴、阳离子的电子层结构相同,即核外电子总数相等。由于a、b形成阳离子,c、d形成阴离子,则a、b的原子序数大于c、d的原子序数,由于离子所带电荷数:a 6.根据等电子原理:由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特性。以下各组粒子结构不相似的是() A.CO和N2B.O3和NO-2C.CO2和N2O D.N2H4和C2H4答案 D 解析据题给信息,等电子体的特点是原子数相同,各原子最外层电子数之和相同。题给四个选项中原子数均相同,故只需比较其各原子最外层电子数之和是否相等即可。显然,D项中N和C的最外层电子数不等,其分子中的各原子最外层电子数之和必然不等,其他选项中最外层电子数之和均相等。 7.下图为元素周期表的一部分(数字为原子序数),其中x为35的是() 答案 D 解析根据元素周期表的结构及每周期所含元素种类可知在上述四个选项中x的数值分 别为: 8.A和M为两种主族元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法中正确的是() A.A和M的原子序数之差为8 B.A和M原子的电子总数之和可能是11 C.A和M原子的最外层电子数之和为8 D.A和M原子的最外层电子数之差为7 答案 B 解析本题是从原子及离子中的电子数(原子序数)、电子层数、最外层电子数的关系角度命制的,考查学生对这方面知识的理解及灵活运用的能力。高考中有关这类问题的出现频率高、形式多样,值得重视。 A是短周期元素,能形成A2-,则A为O或S,若A为O,则M为Li或K,若A为S,则M为Na,据此可知,A的原子序数为偶数,M的原子序数为奇数,A和M的原子序数之差不可能为8,最外层电子数之和也不可能为8,A、C项错误;A为O,B为Li时,A原子和M原子的电子总数之和为11,A和M原子最外层电子数之差为6-1=5,B项正确,D 项错误。注意:族序数为偶数的主族元素,其原子序数为偶数,原子最外层电子数也为偶数,族序数为奇数的主族元素,其原子序数为奇数,原子最外层电子数也为奇数,据此规律进行判断也能快速解题。 9.X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y 强的是() A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物沸点低 C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来 答案 C 解析本题是ⅦA族元素非金属性的比较,因此必须与本族元素的特性联网考虑。A选项中X原子电子层数多于Y,因此在同族中X在Y的下方,根据同主族元素由上向下,非金属性减弱可知,X的非金属性比Y弱,故A错误;B是氢化物的沸点问题,Y的氢化物如果是HF,X的氢化物是HCl,由于氢键的存在导致沸点反常,虽然Y的氢化物沸点比X的氢化物沸点高,但是Y的非金属性却高于X的非金属性,B选项有一定的干扰能力;C项比较的是氢化物的稳定性,X的氢化物稳定,说明其非金属性强,举例如:稳定性HF>HCl>HBr>HI;D中Y单质能够将X的离子从其盐溶液中臵换出来,说明Y非金属性强于X,与题干相反。 10.短周期元素中,若两种元素的原子序数相差8,则它们() A.一定是同族元素B.周期数一定相差1 C.只能形成1∶1型化合物D.只能形成1∶2型化合物 答案 B 解析原子序数相差8的短周期元素可能在同一主族,也可能不在同一主族,如H和F;在短周期元素中列举符合条件的化合物可有HF、SO2、SO3、SiC等。 11.A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知:A、B同周期,A、C 处于同一主族;C 原子核内的质子数等于A 、B 原子核内的质子数之和;C 原子最外层电子数是D 原子最外层电子数的3倍。试回答: (1)写出元素的名称:A__________、C____________。 (2)写出由B 、D 组成的两种化合物的电子式分别为:___________、__________。 (3)C 的固态氧化物属于____________晶体。写出表示C 的氧化物的一种重要的工业用途________________________________________________________________________。 (4)A 、C 的最高价氧化物对应水化物中酸性较强的是__________(写水化物的分子式)。 (5)写出C 的氧化物与D 的最高价氧化物对应水化物反应的离子方程式________________________________________________________________________。 答案 (1)硼 铝 (2)Na + [··O ··]2- Na + Na + [··O ··O ··]2- Na + (3)离子 作耐火材料或电解冶铝 (4)H 3BO 3 (5)Al 2O 3+2OH -===2AlO - 2+H 2O 解析 由A 、C 同主族,原子半径C>A ,则A 、C 电子数相差8,C 原子核内的质子数等于A 、B 原子核内的质子数之和,推出B 原子的质子数为8,即B 为O 元素,C 为第三周期元素,由C 原子最外层电子数是D 原子最外层电子数的3倍,若D 最外层为1个电子,则C 最外层为3个电子,若D 最外层是2个电子,则C 最外层是6个电子,则C 与B 是同主族元素了,不符合题意,故C 为Al 元素,D 为Na 元素,A 为B 元素。 12.下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。 (1)表中所列元素a 、b 、c 、d 、e 、f 、m 中: 属于短周期元素的有____________________________________________________; 属于主族元素的有_____________________________________________________; e 元素在元素周期表中的位置是第______周期、第____族。 (2)下列哪组元素的单质可能都是电的良导体( ) A .a 、c 、h B .b 、g 、j C .c 、h 、l D .d 、e 、f (3)i 元素属于________(填“金属”或“非金属”)元素,它的最高化合价是________价,最低化合价是________价。它的单质能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出它的单质与氧气反应的化学方程式:________________________________________________________________________。 答案 (1)a ,b ,c ,f ,m a ,b ,c ,d ,f 四 ⅣB (2)AD (3)非金属 +5 -3 4P +5O 2=====点燃 2P 2O 5 解析 (1)短周期为前三周期,前三横行的元素有b 、h 、a 、c 、f 、i 、l 、m ,主族元素分别位于第1、2、13、14、15、16、17纵行,故属于主族元素的有b 、a 、c 、d 、f 、h 、g 、i 、j 、l ,e 位于第四横行,第四纵行,属于第四周期第ⅣB 族。 (2)金属和石墨是电的良导体,属于金属的有a 、c 、d 、e 、f 、g ,故选A 、D 。 (3)i 为磷元素,属于非金属元素,最高化合价是+5价,最低化合价是-3价。 13.A 、B 、C 、D 、E 五种短周期元素的原子序数依次增大,上述元素中只有一种金属 元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。 (1)写出A、B、C、D、E五种元素的名称: A.________,B.________,C.________,D.________,E.________。 (2)写出DB2使澄清石灰水变浑浊的化学方程式: ________________________________________________________________________。 (3)写出C、E的单质分别与NaOH溶液反应的离子方程式:________________________________________________________________________,________________________________________________________________________。 答案(1)碳氧铝硫氯 (2)SO2+Ca(OH)2===CaSO3↓+H2O (3)2Al+2OH-+2H2O===2AlO-2+3H2↑ Cl2+2OH-===Cl-+ClO-+H2O 解析AB2、DB2均可使澄清石灰水变浑浊,且原子序数A 14.Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线。 Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M 与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。 (1)请写出下列元素的元素符号: X________,Y________,M________。 (2)请写出下列反应的离子方程式: N单质与NaOH溶液反应:________________________________________________。 (3)Y与Z相比,非金属性较强的元素是__________(填元素符号),可以证明该结论的实验是(用离子方程式表示)___________________________________________________。 答案Ⅰ. Ⅱ.(1)O Cl H (2)Si+2OH-+H2O===SiO2-3+2H2↑ (3)Cl Cl2+S2-===2Cl-+S↓ 解析根据题意推断X为氧元素,Z为S元素;X在第二周期,Y与Z同周期,Y在第三周期,则M只能为H元素;Y的最高化合价与最低化合价代数和为6,设最高化合价为a,则最低负化合价a-8,a+(a-8)=6 a=7,则Y为Cl元素;N为第三周期半径最大的非金属,则N为Si。 第2课时元素的性质与原子结构 1.下列关于碱金属的原子结构和性质的叙述中,不正确的是() A.碱金属原子最外层都只有一个电子,在化学反应中容易失去 B.都是强还原剂 C.都能在O2中燃烧生成过氧化物 D.都能与水反应生成碱 答案 C 解析由于碱金属元素从Li到Cs的金属性增强,单质活性增强,在O2中燃烧的产物越来越复杂,故C不正确。 2.关于卤素(用X表示)的下列叙述正确的是() A.卤素单质与水反应均可用X2+H2O===HXO+HX表示 B.HX都极易溶于水,它们的热稳定性随核电荷数的增大而增强 C.卤素单质的颜色从F2―→I2随相对分子质量的增大而加深 D.X-的还原性依次为F-<Cl-<Br-<I-,因此相对分子质量小的卤素单质可将相对分子质量大的卤素从它的盐溶液里置换出来 答案 C 解析F2与水的反应为2F2+2H2O===4HF+O2,故A错误;HX的热稳定性随核电荷数增大而减弱,即HF>HCl>HBr>HI,故B错误;F2不能将氯、溴、碘从它们的盐溶液中臵换出来,而是先与水作用产生O2,故D错误。 3.微量元素硒(Se)对人体有保健作用,已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,下列对硒元素性质的描述不正确的是() A.硒化氢不稳定 B.最高价氧化物的化学式是SeO3 C.硒与铁反应可生成FeSe D.酸性强弱顺序:H2SO4 答案 D 解析硒与氧、硫同主族,随原子序数的增大,元素的非金属性减弱,其对应的氢化物稳定性减弱,最高价氧化物对应水化物的酸性减弱,D项错误;由于硫为弱氧化剂,与Fe 反 应只生成低价态化合物;由递变性可知A、C正确。 1.2007年5月8日,央视《新闻在线》播出“刑侦专家班茂森曾根据痕迹侦破贵州县长灭门案”的故事。痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就会跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由灰褐色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是() A.①AgNO3②NaBr③AgBr B.①AgNO3②NaCl③AgCl C.①AgCl②AgNO3③NaCl D.①AgNO3②NaI③AgI 答案 B 解析汗液的成分中含有NaCl,与AgNO3反应生成AgCl,AgCl见光分解。 2.下列叙述中正确的是() A.在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 B.由于活泼性Na C.金属锂不能保存在煤油中,金属钾可以保存在煤油中 D.虽然自然界含钾的物质均易溶于水,但土壤中钾含量太少,故需施用钾肥 答案 C 解析碱性氧化物是指与酸反应生成盐和水的氧化物,过氧化物(如Na2O2)、超氧化物(如KO2)、臭氧化物(如CsO3)等与酸反应的产物中有氧气,均不属碱性氧化物;因为碱金属与水均能发生反应,故金属钾不能从NaCl溶液中臵换出金属钠;自然界中含钾的物质(如正长石、白云母等矿石)一般不溶于水。 3.钾的金属活动性比钠强,根本原因是() A.钾的密度比钠的小 B.钾原子的电子层数比钠原子多一层 C.钾与水反应比钠与水反应剧烈 D.加热时,钾比钠更易气化 答案 B 4.已知:①钾比水轻;②钾的熔点低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱性。某学生将一块金属钾投入滴有酚酞试液的水中,该实验能证明上述四点性质中的() A.①④B.①②④C.①③④D.①②③④ 答案 D 解析钾、钠与水反应的现象相似,钾比钠更活泼,与水反应更剧烈。钾浮在水面上从而推知①正确;钾熔化成闪亮的小球推知②③正确;溶液颜色变化推知④正确。 5.砹是核电荷数最大的卤族元素,推测砹及其化合物最不可能具有的性质是() A.HAt很不稳定B.砹是白色固体 C.AgAt不溶于水D.砹易溶于某些有机溶剂 答案 B 解析根据卤族元素的递变规律:氢化物稳定性递减,A正确;颜色逐渐加深,B错误;AgX除AgF外均不溶于水,C正确;Br2、I2易溶于有机溶剂,D正确。 6.下列叙述中正确的是( ) A .除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 B .除短周期外,其他周期均有18种元素 C .副族元素中没有非金属元素 D .碱金属元素是指第ⅠA 族的所有元素 答案 C 解析 短周期中,F 元素无正化合价,因此A 错误;第六周期有32种元素,因此B 不正确;副族元素全部是金属元素,因此C 正确;碱金属指除H 之外的第ⅠA 族的元素,因此D 不正确。 7.向NaBr 和KI 的混合溶液中,通入足量的Cl 2后,将溶液蒸干并灼烧,最后得到的物质是( ) A .NaBr 和KI B .NaBr 和KCl C .NaCl 和KCl D .NaCl 、KCl 和I 2 答案 C 解析 向NaBr 和KI 的混合溶液中通入足量的Cl 2,Br -和I - 被氧化为Br 2和I 2,Br 2易挥发,I 2易升华,蒸干、灼烧后,只有NaCl 和KCl 。 8.碱金属(如锂、钠、钾、铷等)溶于汞中可形成良好的还原剂“汞齐”,取7 g 某种碱金属的汞齐与水作用得到2.24 L H 2(标准状况),并得到1 L 密度为ρ g/cm 3的溶液,则溶液中溶质的质量分数可以是( ) A.0.8ρ% B.0.48ρ% C.0.32ρ% D.0.7ρ % 答案 AB 解析 汞不能与水反应,碱金属(M)能与水反应:2M +2H 2O===2MOH +H 2↑,所以碱金属的物质的量为0.1 mol ×2=0.2 mol ,碱金属的摩尔质量< 7 g 0.2 mol =35 g/mol ,相对原子 质量小于35的碱金属只有Li 、Na ,分别计算可知答案。 9.为了比较卤素单质的氧化性强弱,可在实验室先制取Cl 2,并将Cl 2依次通入NaBr 溶液和淀粉KI 溶液中。有如下图所示的仪器(橡胶塞均为双孔)及药品,试回答: (1)若所制气体从左向右流向时,上述仪器接口的连接顺序为____接____、____接____、____接____。 (2)实验开始后装置4中反应的化学方程式为________________________________________________________________________ ________________________________________________________________________。 (3)装置3的作用是________________________________________________________________________, 反应的离子方程式为________________________________________________________________________。 (4)装置1中产生的现象是________________________________________________________________________, 高一化学必修2《元素周期表》知识点总结 知识回顾: 1、原子的结构: ●原子是由原子核和电子组成;原子核由质子和中子组成 ●原子的质量集中在原子核上,电子的质量很小,几乎可以忽略不计 ●一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电,所以 原子对外显中性 2、元素的定义: 具有相同核电荷数(质子数)的一类原子的总称 一、元素周期表的结构 1、原子序数 原子序数=核电荷数=质子数=核外电子数 2、周期 ●按原子序数递增的顺序,把电子层数相同的元素自左向右排成横行,每行叫做一个 周期。 ●元素周期表共有七个周期,从上到下依次命名为第一周期、第二周期等 从上到下行数 名称元素种数原子的电子 层数 同周期内元素原子序数变 化规律 常用名又名 1 第一周期短周期 2 1 从左到右依次增大 2 第二周期8 2 3 第三周期8 3 4 第四周期长周期18 4 5 第五周期18 5 6 第六周期32 6 7 第七周期7 3、族 ●按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行, 每一个纵行称为一个族.共18行 ●元素周期表共有十八个纵行,除8、9、10三个纵行叫第Ⅷ族外,其余每个纵行各为 一个族,它们又被划分为十六个族。 ●族分为主族和副族,主族用罗马数字加“A”表示,如ⅠA族;副族用罗马数字加”B” 来表示,如ⅡB。0族和Ⅷ族则不加“A”或“B” 注意:① 1,2行对应为ⅠA,ⅡA;13---17行对应为ⅢA---ⅦA ② 3---7行对应为ⅢB ---ⅦB;11,12行对应为ⅠB,ⅡB。 ③ 8,9,10对应为Ⅷ ④ 18行对应0族 二、元素的性质与原子结构 1、碱金属元素 知识回顾:Na的物理性质和化学性质 ●从上到下原子的电子层数在增加,原子半径逐渐增大,所以失电子的能力逐渐增强 ●从上到下金属性逐渐增强(金属性包括 ●碱金属元素的化学性质 R+2H2O====2ROH+H2 4Li+O2====2Li2O 4Na+O2====2Na2O(缓慢氧化) Na+O2==△===Na2O2 2、卤族元素 第一章物质结构元素周期律 第一节元素周期表 第一课时 教学过程 【复习导入】展示一张元素周期表 阅读教材]第4页了解元素周期表发展史 思考与交流] (1)我们按照元素在周期表中的顺序给元素编号,得到原子序数。可见原子序数与原子结构间存在什么关系?(结合1-18号元素原子结构) (2)元素周期表的编排原则:把相同的元素排在同一横行,把相同的元素按电子层数递增的顺序排在同一个纵行 (3)元素周期表中有多少横行、纵行? (4)为什么我们将稀有气体元素称为0族元素? 归纳与整理] 一、元素周期表 (一)元素周期表的结构 1、周期:元素周期表共有个横行,每一横行称为一个, 故元素周期表共有个周期 ①周期序数与电子层数的关系: ②周期的分类 元素周期表中,我们把1、2、3周期称为,周期称为长周期。课堂练习1]请大家根据元素周期表,完成下表内容。 思考与交流] 如果不完全周期排满后,应为几种元素? 归纳与整理] ①族的分类 元素周期表中,我们把个纵行共分为个族,其中个主族, 个副族,一个族,一个族。 a、主族:由元素和元素共同构成的族, 用A表示:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA b、副族:完全由元素构成的族,用B表示:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB c、第Ⅷ族:三个纵行 d、零族:第纵行,即稀有气体元素 ②主族序数与最外层电子数的关系: ③族的别称 ⅠA称为元素ⅡA称为元素ⅣA称为元素 ⅤA称为元素ⅥA称为元素ⅦA称为元素 零族称为元素 【小结知识】 周期的结构:三短、四长、七横行; 族的结构:七主、七副、零八族。 课堂练习2] 请描述出Na、C、Al、S在周期表中的位置。 课堂练习3]某元素位于第二周期,第ⅦA 族它是___元素。 P相邻的同族元素的原子序数是 【板书设计】 一、元素周期表 (一)元素周期表的结构 1、周期: ①周期序数与电子层数的关系: ②周期的分类 2、族: ①族的分类 ②主族序数与最外层电子数的关系: ③族的别称 作业:1、整理、归纳本节教学案 2、完成【课时作业】 【课时作业】班级姓名学号 1.19世纪中叶,门捷列夫的突出贡献是 人教版高中化学必修2《元素周期表》的教学设计 一、在教材中的地位和作用 本节课的内容选自于人民教育出版社出版的高中化学必修模块《化学2》第一章《物质结构元素周期律》第一节《元素周期表》的第一课时。通过义务教育九年级和高一必修《化学1》的学习,学生已经基本具备了一定的化学基础知识,为本节的学习奠定了一定的基础。元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律,是我们学习化学的重要工具。通过学习元素周期表,为以后学习元素周期律做好了铺垫。 二、教学目标 【知识与技能】 1.了解门捷列夫的成长史及其发现元素周期表的艰辛历程; 2.初步理解和掌握元素周期表的结构、周期和族的概念以及元素的“位-构”关系; 3.巧记周期表中的元素。 【过程与方法】 1.通过亲自编排元素周期表,培养学生的抽象和逻辑思维能力; 2.通过解读元素周期表,阅读教材,培养学生归纳总结,形成规律的能力; 3.通过推导元素的原子结构和位置之间的关系,培养学生的分析和推理能力。 【情感态度与价值观】 1.通过了解门捷列夫的成长史及其发现元素周期表的艰辛历程,培养学生在逆境中勇于挑战自我、不断追求真理的坚韧不拔的精神和勇于创新、不断探索的科学品质; 2.在“纸牌游戏”中,感受科学家发现元素周期表的情景,培养学生善于观察、勤于思考总结的科学态度,同时,激发学生学习化学的兴趣。 【教学重点】1.元素周期表的结构;2.元素在周期表中的位置与原子结构的关系。 【教学难点】元素的原子结构与其在元素周期表的位置的相互推断。 三、设计思路以故事引入新课题→纸牌游戏→周期表的编排规则和结构→周期表的巧记方法→达到开发学生智力,培养学生的创新精神和科学发现能力的目的。 元素周期表典型例题 1.两种微粒的质子数和电子数都相等,则这两种微粒肯定不会是 ( ) A.两种不同的原子 B.一种原子和一种分子 C.两种不同的离子 D.一种原子和一种离子 2.元素的下列性质,随原子序数的递增不是周期性变化的是() A.相对原子质量 B.化合价 C.原子半径 D.元素的化学性质 3.下列对有关元素的叙述能说明该元素一定是主族元素的是 () A.原子核外N层比M层少8个电子的元素 B.原子核外L层比M层多一个电子的元素 C.最高价为+6价的元素 D.无负化合价的元素 4.下列各组元素中按微粒半径递增顺序排列的是() A、Li Na K B、Ba2+ Ca2+ Mg2+ C、Ca2+ K+ Cl- D、N O F 5.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数() A.只有x+1 B.可能是x+8 C.可能是x+2 D.可能是x+1或x+11或x+25 6.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈 碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径 最小的元素,则它们的原子序数由小到大的顺序是() A. A、B、C、D、E B. E、C、D、B、A C. B、A、D、C、E D.C、D、A、B、E 7.短周期元素 X 和 Y 可以形成 XY 4 型化合物, 若 X 的原子序数为 m , Y 的原子序数为 n , 则 m 和n 的相互关系为() A.m – 13 = n B.n + 5 = m C.m + 8 = n D.n – 11 = m 8、已知一个N 2O 3 分子的质量为a g,一个N 2 O 5 分子的质量为b g,若以氧原子 质量的1/16作为相对原子质量标准,则NO 2 的相对分子质量为() A. 8(b+a)/(b-a) B. 16(b+a)/(b-a) C. 8(b-a)/(b+a) D. 16(b-a)/(b+a) 9.有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE 单质与足量酸作用,在标准状况下能产生3.36LH 2 ;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: (1)五种元素的名称:A__________,B__________,C__________,D___________, E___________。 (2)画出C原子、A离子的结构示意图:____________。 第一节元素周期表(第一课) 课题:第一节元素周期表(第一课时) 授课班级高一 课时 教学目的 知识 与 技能 1、了解元素周期表的结构以及周期、族等概念 2、使学生了解原子结构、元素性质及该元素在周期表中的位置三者间的关 系,初步学会运用周期表。 过程 与 方法 1、引导学生自主学习:认识周期表的结构 2、自主探究:探究原子结构与性质的关系 情感 态度 价值观 1、通过对元素周期表编制过程的了解,使学生正确认识科学发展的历程, 并以此来引导自己的实践,同时促使他们逐渐形成为科学献身的高贵品质 2、了解元素周期表的意义,认识事物变化由量变引起质变的规律,对学生 进行辨证唯物主义教育 重点元素周期表的结构以及周期、族等概念难点元素在周期表中的位置和原子结构的关系 知识结构与板书设计第一节元素周期表 一、元素周期表 原子序数=核电荷数=质子数=核外电子数1.周期: 三短,四长 2. 族: 主族:短周期+长周期 A 副族:完全长周期 B 0族:稀有气体元素 Ⅷ族:8,9,10纵行 3.过渡元素:副族+第Ⅷ族 元素位置 电子层数 最外层电子数 教学过程 教学步骤、内容教学方法、手段、师生活动 [视频]《元素周期表之歌》 [引言]到目前为止人类已经发现了112种元素,并随着科技的发展不断地探索发现新的元素。早在人们发现元素的那一刻起,科学家们就一直探索元素的奥秘,这些元素性质不同,有的活泼,有的不活泼。它们之间存在着什么联系呢?元素周期表是根据什么得来的呢?这得从 元素周期表的发展史说起了 讲解元素周期表发展历程 [讲]门捷列夫总结前人的不足,按照元素原子核电荷数递增的顺序将不同种类的元素排入周期表。于是得到了我们今天的元素周期表。在这张表里原子核电荷数即为原子在周期表中的序数。根据我们初中所学的原子核外电子排布知识,即可得到以下的结论。 [板书] 第一节元素周期表 一、元素周期表 原子序数=核电荷数=质子数=核外电子数 [过渡]今后,我们只需知道原子的核电荷数或质子数,就能知道该元素在周期表中的排序了。那我们要想再具体的定位该元素在周期表中的位置,就需要更加详尽的表述喽。 [提问]请同学们数一数,元素周期表有多少个横行? 7个横行 [讲]我们把元素周期表中的每一个横行称作一个周期,每一个纵行称作一个族。下面,我们先来认识元素周期表中的横行——周期。 [板书] 1.周期: [讲]下面请同学们看元素周期表中的前三周期,确定每一周期有多少种元素。然后,在试着数数下面的几个周期,确定每一周期有多少种元素 第一周期2种,第二、三周期8种,第四、五周期18种 第六周期和第七周期由于分别有镧系和锕系元素存在,所以这两个周期应该有32种元素。由于第七周期还有部分元素未发现,所以目前在元素周期表中只有26种元素。一、二、三周期元素种类较少,我们称之为短周期,其它四个周期为长周期。第七周期为排满,故有时也被称为不完全周期。帮助学生正视科学探索的艰辛,培养学生热爱科学,追求真理的执着理念 结合核外电子排布知识 以第三周期前三种元素:Na、Mg、Al 核外电子排布为例 重点内容 逐层分析 第一讲 元素周期表 【展示目标 聚焦学习】 1、原子结构 2、元素周期表 3、碱金属元素及其性质 4、卤族元素及其性质 【知识精讲 深化思维】 要点一:原子结构 1、元素周期表的诞生及其发展 诞生:1869年,俄国化学家门捷列夫编制出第一张元素周期表; 依据:将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行; 意义:揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑; 发展:随着化学科学的不断发展,元素周期表中为未知元素留下空位先后被排满; 成熟:当原子结构的奥秘被发现后,元素周期表中的元素的排列依据由相对原子质量改 为原子的原子序数,形成现行的元素周期表。 2、元素周期表的编排原则 (1)原子与元素的关系 ①原子的结构 原子的结构 ???? ?? ?? ??? ?一个单位的负电荷)核外电子(一个电子带中子(不带电)电荷)个质子带一个单位的正质子(原子核(带正电)1 在一个原子中:核电荷数 = 质子数 = 核外电子数 =原子序数 ②元素的定义:质子数相同的一类原子的总称; 关系:元素将原子分类,按照质子数是否相同分类,对应的一类原子就是一种元素。 原子序数与元素的原子结构之间的关系: 原子序数=核外电子数=质子数=核电荷数。 (2)原子核外电子排布的规律 核外电子遵循“2n2”的规律:其中“2n2”指的是每一层最多容纳的电子数;“n”指的是电子层数。 每一层排满是最稳定的结构,每当排下那一层电子的时候,首先要看看能不能排满,如果不能排满,则以上一层为标准来排,然后依次类推。 (3)编排原则 1.元素周期表的结构 (1)周期(七横七周期,三短四长) 专项训练物质结构和元素周期律(推断题) 1、下列元素周期表的一部分,表中阿拉伯数字(1 、 2?? ) 是原周期表中行或列的序号.参 照元素 A~I 在表中的位置,回答下列 . 行 118 横行 1A21314151617 2B C D E 3F G H I (1)B 、C、H 三元素中非金属性最的是________(写出元素名称 ) ,写出由一种化物制取CD 气体的化学方程式。 (2)表中某元素能形成两性氧化物,写出氧化物溶于氧化溶液反的离子方程式: 。 (3)表中某元素的在常温下气,元素能与A~ I 中的一种元素构成原子个数比 1∶1 和 1∶2 的两种化合物X 和 Y,元素能与 A~ I 中的另一种元素构成原子个数比1∶ 1 和 1∶ 2 的两种化合物 Z 和 M.写出 Z 与 Y反的化学方程式:。 (4)F B C D E的原子半径序:(化学符号表示) F D E 的离子半径序(化学符号表示,下同) 最高正价最高的是:族序数最大的是: 2、已知 X、Y、Z、W是短周期元素中的四种非金属元素,它的原子序数依次增大.X 元素的原子形成的离子就是一个子, Z、W在元素周期表中于相的位置,它的在常温下均无色气体, Y 原子的最外子数是内子数的 2 倍. (1) 写出 Z 在元素周期表中的位置。 (2)在一定条件下,由 X与Z反生E,写出反的化学方程式:____ _________________; E 在催化存在的条件下,可用于原汽尾气中的_____________. (3) 由 X、Z、W三种元素成的某种是;由X、Y、Z、W四种元素可成酸式,化合物的水溶液与足量NaOH溶液在加条件下反的离子方程式 。 (4)工上用 E 送气的管道是否漏气,可察到大量白烟,同有Z 生成,写出化 学方程式,反中被氧化的 E 与参与反的 E 的量之比 ________________________。 《元素周期表》练习题2016.03.01 1、下列关于元素周期表的说法,错误的是 A.元素周期表是元素按原子量大小排列而成的 B.从第一周期到第三周期元素,其原子的价电子数和族数是一致的 C.主族元素中(氢除外)族序数越小的元素,其最高价氧化物的水化物碱性越强 D.元素周期表是元素周期律的具体表现形式 2.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是()A.HF B.H3O+C.NaH D.H2O2 3.如果发现了原子序数为116的元素,对它的正确叙述是下列组合中的() ①位于第七周期;②是非金属元素;③最外电子层含有6个电子;④没有放射性;⑤属 于氧族元素;⑥属于卤素 A.①③⑤ B.①③⑥ C.②④⑥ D.②③⑤ 4.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数() A.只有x+1 B.可能是x+8 C.可能是x+2 D.可能是x+1或x+11或x+25 5.同一主族的两种元素的原子序数之差不可能是 A 16 B 26 C 36 D 46 6.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是() A.半导体材料砷化镓 B.吸氢材料镧镍合金 C.透明陶瓷材料硒化锌 D.超导材料K 3C 60 7.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是() A.该元素属于第七周期 B.该同位素原子含有114个电子,184个中子 C.该元素为金属元素,性质与82Pb相似 D.该元素位于ⅢA族 8.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径 最小的元素,则它们的原子序数由小到大的顺序是() A.A、B、C、D、E;B.E、C、D、B、A;C.B、A、D、C、E;D.C、D、A、B、E 9.在短周期元电子层只有1个或2个电子的元素是 A 金属元素 B 稀有气体元素 C 非金属元素 D 无法确定为哪一类元素 10.下列说法中正确的是 A 周期表中的主族都有非金属元素 B 周期表中的主族都有金属元素 C 周期表中的非金属元素都位于短周期 D 周期表中的非金属元素都位于主族和0族 11.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO 4>H 2 YO 4 >H 3ZO 4 ,则下列各判断中正确的是 A.原子半径:X>Y>Z B.单质的非金属性:X>Y>Z C.气态氢化物稳定性:X<Y<Z D.原子序数:X>Y>Z 12.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比应为 A.39∶61 B.61∶39 C.1∶1 D.39∶11 第一章 物质结构 元素周期律 第一节 元素周期表 一、元素周期表的结构: 元素周期表有7个横行,每一个横行叫做一个周期。其中第一、二、三周期叫做短周期,四至六周期叫做长周期,第七周期由于没有排满叫做不完全周期。 1.周期序数=电子层数 主族序数=最外层电子数 2.除第1周期只包括氢和氦,第7周期尚未填满外,每一周期的元素都是从最外层电子数为1的碱金属开始,逐步过渡到最外层电子数为7的卤素,最后以最外层电子数为8的稀有气体结束。 短周期(第1、2、3周期) 周期:7个(共七个横行) 长周期(第4、5、6周期) 、 周期表 不完全周期(第7周期) 主族7个:ⅠA-ⅦA 族:16个(共18个纵行)副族7个:IB-ⅦB 第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素 口诀:三长、三短、一不完全;七主七副一零一Ⅷ 二.元素的性质和原子结构: (一)碱金属元素: 相似性:最外层电子数相同,都为1个 1. 原子结构 递变性:从上到下,随着核电核数增大,电子层数增多 ] 2.碱金属化学性质的相似性: 4Li + O 2 2Li 2O 2Na + O 2 Na 2O 2 2 Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H 2O = 2KOH + H 2↑ 通式: 2R + 2 H 2O = 2 ROH + H 2 ↑ 产物中,碱金属元素的化合价都为+1价。 结论:碱金属元素原子的最外层上都只有1个电子,因此,它们的化学性质相似。 3.碱金属化学性质的递变性: 递变性:从上到下(从Li 到Cs ),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最 点燃 点燃 118电Ⅰ A主族金属类金属非金属卤素惰性气体碱金属碱土金属过渡金属镧系金属锕系金属Ⅷ A子 层 1 1 H 2 He 11-18 族序号*人造元素2K 氢氦ⅠA-ⅧA 主族序号元素符号放射性元素 Hydrogen Helium 2ⅠB-ⅦB 主族序号元素中文名称单质在常温状态下为气态1314151617 1.00794Ⅱ AⅢ AⅣ AⅤ AⅥ AⅦ A 4.002602 Ⅷ 第Ⅷ族元素中文名称单质在常温状态下为液态 23 Li 4 Be 5 B 6 C7 N8 O9 F10 Ne 22元素中文名称单质在常温状态下为固态222222K 锂1铍2硼3碳4氮5氧6氟7氖8L Lithium Beryllium Boron Carbon Nitrogen Oxygen Fluorine Neon 6.9419.012210.81112.010714.0067415.999418.998403220.1797 311 Na12 Mg13 Al14 Si15 P16 S17 Cl18 Ar 22222222K 钠8镁8铝8硅8磷8硫8氯8氩8L 12345678M Sodium Magnesium Aluminum Silicon Phosphorus Sulfur Chlorine Argon 3456789101112 22.9897724.305Ⅲ BⅣ BⅤ BⅥ BⅦ BⅧⅠ BⅡ B26.98153828.085530.97376132.06635.45339.948 419 K20 Ca21 Sc22 Ti23 V24 Cr25 Mn26 Fe27 Co28 Ni29 Cu30 Zn31 Ga32 Ge33 As34 Se35 Br36 Kr 222222222222222222K 钾8钙8钪8钛8钒8铬8锰8铁8钴8镍8铜8锌8镓8锗8砷8硒8溴8氪8L 889101113131415161818181818181818M Potassium1Calcium2Scandium2Titanium2Vanadium2Chromium1Manganese2Iron2Cobalt2Nickel2Copper1Zinc2Gallium3Germanium4Arsenic5Selenium6Bromine7Krypton8N 39.098340.07844.9559147.86750.941551.996154.93804955.845758.933258.693463.54665.3869.72372.6374.921678.9679.90483.798 537 Rb38 Sr39 Y40 Zr41 Nb42 Mo43 Tc44 Ru45 Rh46 Pd47 Ag48 Cd49 In50 Sn51 Sb?52 Te53 I54 Xe 222222222222222222K 铷8锶8钇8锆8铌8钼8锝*8钌8铑8钯8银8镉8铟8锡8锑8碲8碘8氙8L 181818181818181818181818181818181818M Rubidium8Strontium8Yttrium9Zirconium10Niobium12Molybdenum13Technetium13Ruthenium15Rhodium16Palladium1Silver18Cadmium18Indium18Tin18Antimony18Tellurium18Iodine18Xenon18N 122211211012335678O 85.467887.6288.9058591.22492.9063895.9698101.1102.9055106.4107.8682112.411114.818118.71121.76127.6126.90447131.393 655 Cs56 Ba72 Hf73 Ta74 W75 Re76 Os77 Ir78 Pt79 Au80 Hg81 Ti82 Pb83 Bi84 Po85 At86 Rn 22222222222222222K 铯8钡8镧系铪8钽8钨8铼8锇8铱8铂8金8汞8铊8铅8铋8钋8砹*8氡8L 1818181818181818181818181818181818M Cesium18Barium18Hafnium32Tantalum32Tungsten18Rhenium32Osmium32Iridium32Platinum32Gold32Mercury32Thallium32Lead32Bismuth32Polonium32Astatine32Radon32N 8810118131415171818181818181818O 132.90545 1 137.327 2 178.49 2 180.9479 2 183.84 2 186.207 2 190.23 2 192.217 2 195.078 1 196.96655 1 200.59 2 204.3833 3 207.2 4 208.98038 5 209 6 210 7 222 8P 787 Fr88 Ra104 Rf105 Db106 Sg107 Bh108 Hs109 Mt110 Ds111 Rg112 Cn113 Unt114 Fl115 Uup116 Lv117 Uus118 Uuo 22222222222222222K 钫*8镭8锕系钅卢*8钅杜*8钅喜*8钅波*8钅黑*8钅麦*8钅达*8钅仑*8钅哥*8*8*8*8*8*8*8L 1818181818181818181818181818181818M Francium32Radium32unnilquadium32dubnium3232Bohrium323232Darmstadtium32Roentgenium3232323232323232N 1818323232323232323232323232323232O 223 8 226 8 265 10 268 11 271 12 270 13 277 14 276 15 281 17 280 18 285 18 284 18 289 18 288 18 293 18 294 18 294 18P 12222222112345678Q 57-7057 La58 Ce59 Pr60 Nd61 Pm62 Sm63 Eu64 Gd65 Tb66 Dy67 Ho68 Er69 Tm70 Yb71 Lu 222222222222222K 镧系镧8铈8镨8钕8钷*8钐8铕8钆8铽8镝8钬8铒8铥8镱8镥8L 181818181818181818181818181818M Lanthanum18Cerium19Praseodymium21Neodymium22Promethium23Samarium24Europium25Gadolinium25Terbium27Dysprosium28Holmium29Erbium30Thulium31Ytterbium32Lutetium32N lanthanides998888898888889O 138.9055 2 140.115 2 140.90765 2 144.24 2 145 2 150.36 2 151.964 2 157.25 2 158.92534 2 162.5 2 164.93032 2 167.259 2 168.93421 2 173.1 2 174.967 2P Q 89-10289 Ac90 Th91 Pa92 U93 Np94 Pu95 Am96 Cm97 Bk98 Cf99 Es100 Fm101 Md102 No103 Lr 222222222222222K 锕系锕8钍8镤8铀8镎*8钚*8镅*8锔*8锫*8锎*8锿*8镄*8钔*8锘*8铹*8L 181818181818181818181818181818M Actinium32Thorium32Protactinium32Uranium32Neptunium32Plutonium32Americium32Curium32Berkelium32Californium32Einsteinium32Fermium32Mendelevium32Nobelium32Lawrencium32N actinides181820212224252527282930313232O 227.028 9 232.0381 10 231.03588 9 238.02891 9 237 9 244 8 243 8 247 9 247 8 251 8 252 8 257 8 258 8 259 8 262.11 9P 222222222222222Q 高一化学必修二元素周期表知识点总结 化学是自然科学的一种,在分子、原子层次上研究物质的组成、性质、结构与变化规律。为大家推荐了高一化学必修二元素周期表知识点,请大家仔细阅读,希望你喜欢。 一、元素周期表(元素周期表的结构) 1.原子序数: 按照元素在周期表中的顺序给元素编号,得到原子序数。 2.原子序数与原子结构的关系 原子序数=核电荷数=核外电子数=质子数 二、元素周期表的结构 1.周期 周期:具有相同电子层数的元素,按照原子序数递增的顺序从左到右排列的一行,叫周期。 (1)元素周期表共有7个横行,每一横行称为一个周期,故元素周期表共有7个周期; (2)周期的分类 第一、二、三周期,所排元素种类: 2、8、8,短周期;第四、五、六、七周期,所排元素种类:18、18、32、32,长周期。 此外: 镧系元素 57La~71Lu 15种元素第六周期,IB族; 锕系元素 89Ac~103Lr 15种元素第七周期,IB族; 超铀元素92U号元素以后。 (3)周期序数与电子层数的关系:周期序数=同周期元素具有的电子层数。 (4)每一周期都是从碱金属开始卤素惰性元素(第一与第七周期例外 ); (5)每一周期,从左向右,原子半径从大到小;主要化合价从+1~+7,-4~-1,金属性渐弱,非金属性渐强。 2. 族 原子核外最外层电子数相同的元素,按照原子电子层数递增的顺序从上到下排列成纵行,叫族。 (1)元素周期表共有18个纵行,除8、9、10三个纵行称为Ⅷ外,其余15个纵行,每一个纵行称为一个族,故元素周期表共有 16 个族。族的序号一般用罗马数字表示; (2)族的分类 长短周期共同组成的族为主族,用A表示;完全由长周期元素构成的族为副族,用B表示,并用罗马数字表示其序号;稀有气体元素所在的列为零族,计作0 族类 A B 族数 第一节元素周期表 一、元素周期表的结构: 元素周期表有7个横行,每一个横行叫做一个周期。其中第一、二、三周期叫做短周期,四至六周期 叫做长周期,第七周期由于没有排满叫做不完全周期。 1 ?周期序数=电子层数 主族序数=最外层电子数 2 ?除第1周期只包括氢和氦,第 7周期尚未填满外,每一周期的元素都是从最外层电子数为 1的碱金属 开始,逐步过渡到最外层电子数为 7的卤素,最后以最外层电子数为 8的稀有气体结束。 主族7个:I A- WA I 族:16个(共18个纵行)副族7个:IB- W B 第忸族1个(3个纵行) '零族(1个)稀有气体元素 口诀:三长、三短、一不完全;七主七副一零一忸 二?元素的性质和原子结构: (一)碱金属元素: r 相似性:最外层电子数相同,都为1个 1.原子结构I 递变性:从上到下,随着核电核数增大, 2 ?碱金属化学性质的相似性: 4Li + O 2 点燃li 2 O 2Na + 0 通式: 2R + 2 H 20 = 2 R0H + H 2 产物中,碱金属元素的化合价都为+1价。 结论:碱金属元素原子的最外层上都只有 1个电子,因此,它们的化学性质相似。 3 .碱金属化学性质的递变性: 递变性:从上到下(从 Li 到Cs ),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对 最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。所以从 渐增强。 结论: 1) 原子结构的递变性导致化学性质的递变性。 2) 金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物 (氢氧化物)碱性越强,金属性越强。 4.碱金属物理性质的相似性和递变性: 周期表 f 短周期(第1、 2、3周期) (周期:7个(共七个横行) 长周期(第4、 不完全周期(第 5、6周期) 7周期) 电子层数增多 点燃 -Na 2Q 2 Na + 2H 20 = 2NaOH + 2K + 2H 2 O 2K0H + Li 至U Cs 的金属性逐 化学元素周期表的规律总结?比如金属性非金属性等 元素周期表中元素及其化合物的递变性规律 1 原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 2 元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外); (2)同一主族的元素的最高正价、负价均相同 (3) 所有单质都显零价 3 单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增 4 元素的金属性与非金属性 (1)同一周期的元素电子层数相同。因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增; (2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。 5 最高价氧化物和水化物的酸碱性 元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 6 非金属气态氢化物 元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。 7 单质的氧化性、还原性 一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。 一、原子半径 同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减; 同一族中,从上到下,随着原子序数的递增,元素原子半径递增。 第一节元素周期表3 1.α射线是α粒子组成的,α粒子是一种没有核外电子的粒子,它带有2个单位正电荷的质量数等于4,由此可判断,α粒子带有个质子,个中子。 2.某粒子用R n-表示,下列关于该粒子的叙述不正确的是( ) A.所含质子数=A-n B.所含中子数=A-Z C.所含电子数=Z+n D.所带电荷数=n 3.某元素M n+核外有a个电子,该元素的某种原子的质量数为A,则该原子的核内中子数为( )A.A-a+n B.A-a-n C.A+a-n D.A+a+n 4、已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族? 6、元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。请你在元素大厦中为119号元素安排好它的房间() A.第八周期第IA族 B.第七周期第ⅦA族 C.第七周期第0族 D.第六周期第ⅡA族 7、短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原 子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题: (1)A的元素符号;D的原子结构示意图。 (2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是。 (3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是(填写具体的化学式 )。 (4)CA2与D元素的单质在水溶液中反应的化学方程式是。 参考答案:1、2,2 2、A 3、B 4、第四周期ⅠA族第五周期ⅦA族 5、A 6、A 7、(1)O ,(2)S2- > O2- > Na+ (3)Na2O2,SCl2,Cl2O (4)SO2 +Cl2 + 2H2O = 2HCl + H2SO4 初三化学元素周期表 原子序数元素符号元素名称相对原子质量元素名称读音 1 H 氢 1.0079 (qīng) 2 He 氦 4.0026 (hài) 3 Li 锂 6.941 (lǐ) 4 Be 铍 9.0122 (pí) 5 B 硼 10.811 (péng) 6 C 碳 12.011 (tàn) 7 N 氮 14.007 (dàn) 8 O 氧 15.999 (yǎng) 9 F 氟 18.998 (fú) 10 Ne 氖 20.17 (nǎi) 11 Na 钠 22.9898 (nà) 12 Mg 镁 24.305 (měi) 13 Al 铝 26.982 (lǚ) 14 Si 硅 28.085 (guī) 15 P 磷 30.974 (lín) 16 S 硫 32.06 (liú) 17 Cl 氯 35.453 (lǜ) 18 Ar 氩 39.94 (yà) 19 K 钾 39.098 (jiǎ) 20 Ca 钙 40.08 (gài) 21 Sc 钪 44.956 (kàng) 22 Ti 钛 47.9 (tài) 23 V 钒 50.94 (fán) 24 Cr 铬 51.996 (ga) 25 Mn 锰 54.938 (měng) 26 Fe 铁 55.84 (tiě) 27 Co 钴 58.9332 (gǔ) 28 Ni 镍 58.69 (nia) 29 Cu 铜 63.54 (t?ng) 30 Zn 锌 65.38 (xīn) 31 Ga 镓 69.72 (jiā) 32 Ge 锗 72.5 (zhě) 33 As 砷 74.922 (shēn) 34 Se 硒 78.9 (xī) 35 Br 溴 79.904 (xiù) 36 Kr 氪 83.8 (ka) 37 Rb 铷 85.467 (rú) 38 Sr 锶 87.62 (sī) 39 Y 钇 88.906 (yǐ) 40 Zr 锆 91.22 (gào) 元素周期表 __________________________________________________________________________________ __________________________________________________________________________________ 1.掌握元素周期表的结构。认识元素在周期表中的位置与其原子的电子层结构的关系。 2.知道金属、非金属在元素周期表中的位置及其性质的递变规律。 3.认识元素、核素、质量数和同位素的含义。 知识点一.元素周期表的结构 1.世界上第一张元素周期表是在1869年由俄国化学家门捷列夫绘制完成的,随着科学的不断发展,已逐渐演变为现在的常用形式。 2.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。 3.编排原则 (1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。 (2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。 4.元素周期表的结构 5.元素周期表中的特殊位置 (1).分区 ①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。 ②各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。 ③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。 (2).过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。 (3).镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。 (4).锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。 (5).超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。 结构巧记口诀: 横行叫周期,现有一至七,四长三个短,第七尚不满。 知识·巧学 一、元素周期表 1.原子序数 按元素在周期表中的顺序,由小到大给元素编号,这种编号叫做原子序数。 要点提示原子序数不是元素本身所具有的,是人为规定的,是人们给元素的一种编号,不是元素的性质。 2.原子序数与原子结构的关系 原子:原子序数=核电荷数=质子数=核外电子数 原子呈电中性,而质子带正电,核外电子带负电,且每个质子和电子所带的电量相等,所以两者的数目也必定相等。 同理可以推出: ①阳离子:原子序数=核电荷数=质子数>核外电子数 ②阴离子:原子序数=核电荷数=质子数<核外电子数 规律总结阴离子的核外电子数等于其核电荷数与其离子所带电荷数之和,阳离子核外电子数等于其核电荷数与其离子所带电荷数之差,这个规律叫做阴加阳减规律。 3.元素周期表的编排原则 将电子层数相同的元素,按照原子序数递增的顺序排成横行,称为周期。 将最外层电子数相同的元素,按照电子层数递增的顺序排成纵行,称为族。 4.周期 元素周期表有7个横行,即七个周期。周期序数等于该周期元素的原子具有的电子层数。 短周期:一、二、三周期称为短周期 长周期:四、五、六周期称为长周期 不完全周期:第七周期,因未排满被称为不完全周期 5.族 元素周期表有18个纵行,共16个族。最外层电子数=主族数 主族:由短周期元素和长周期元素共同构成的族,叫做主族 副族:完全由长周期元素构成的族,叫做副族。 除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行称作一族。稀有气体元素族称为0族。Ⅷ族不是副族,0族也不是主族。 记忆要诀族序口诀: 族序逐个加(即族序数从左到右逐渐递增) 两A五BⅧ(两A即从ⅠA到ⅡA,五B即再从ⅢB直到ⅦB,再是Ⅷ族) 族序一七零(即接着族序数又从一到七,最后一列族序数是零) 两B五A零(两B即先是两个副族,五A即再是五个主族,最后是零族) 6.元素周期表的结构 元素周期表共有7个横行,18个纵列,112格。其中每一格表示一种元素,格子的颜色分两种,其中蓝色部分表示非金属,橘黄色部分表示金属,绿色部分表示过渡元素;每一格均标有元素名称、化学符号、原子序数以及该元素的相对原子质量。 二、元素的性质与原子结构 1.碱金属元素 (1)原子结构 ? 第 1 讲元素周期表 【展示目标聚焦学习】 1、原子结构 2、元素周期表 3、碱金属元素及其性质 4、卤族元素及其性质 【知识精讲深化思维】 要点一:原子结构 1、元素周期表的诞生及其发展 诞生:1869 年,俄国化学家门捷列夫编制出第一张元素周期表; 依据:将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行; 意义:揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑; 发展:随着化学科学的不断发展,元素周期表中为未知元素留下空位先后被排满; 成熟:当原子结构的奥秘被发现后,元素周期表中的元素的排列依据由相对原子质量改为原子的原子序数,形成现行的元素周期表。 2、元素周期表的编排原则 (1)原子与元素的关系 ①原子的结构 ??质子(1个质子带一个单位的正电荷) ?原子核(带正电)? ? 原子的结构? ?中子(不带电) ?核外电子(一个电子带一个单位的负电荷) ?? ? 在一个原子中:核电荷数= 质子数= 核外电子数=原子序数 ②元素的定义:质子数相同的一类原子的总称; 关系:元素将原子分类,按照质子数是否相同分类,对应的一类原子就是一种元素。 原子序数与元素的原子结构之间的关系: 原子序数=核外电子数=质子数=核电荷数。 (2)原子核外电子排布的规律 核外电子遵循“2n2”的规律:其中“2n2”指的是每一层最多容纳的电子数;“n”指的是电子层数。 每一层排满是最稳定的结构,每当排下那一层电子的时候,首先要看看能不能排满,如果不能排满,则以上一层为标准来排,然后依次类推。 (3)编排原则 1. 元素周期表的结构 (1)周期(七横七周期,三短四长)高一化学必修2《元素周期表》知识点总结
高中化学必修2【教案】第1章第1节 元素周期表
高中化学必修2《元素周期表》的教学设计
化学必修二元素周期表典型例题
必修二元素周期表(第一课时)教案
必修二元素周期表知识点
(完整)高一化学必修2-元素周期表的推断专题训练.docx
必修二元素周期表练习题汇编
高中化学必修二元素周期表专题练习(带答案)
化学元素周期表高清详细 版
高一化学必修二元素周期表知识点总结
高中化学必修二元素周期表专题练习
化学元素周期表的规律总结
高一化学必修2-元素周期表同步练习
初三化学元素周期表(完整版)
人教版高中化学必修二第1讲:元素周期表(学生版)
最新人教版高中化学必修2《元素周期表》知识点总结
(完整版)必修二元素周期表知识点
