化合物的命名
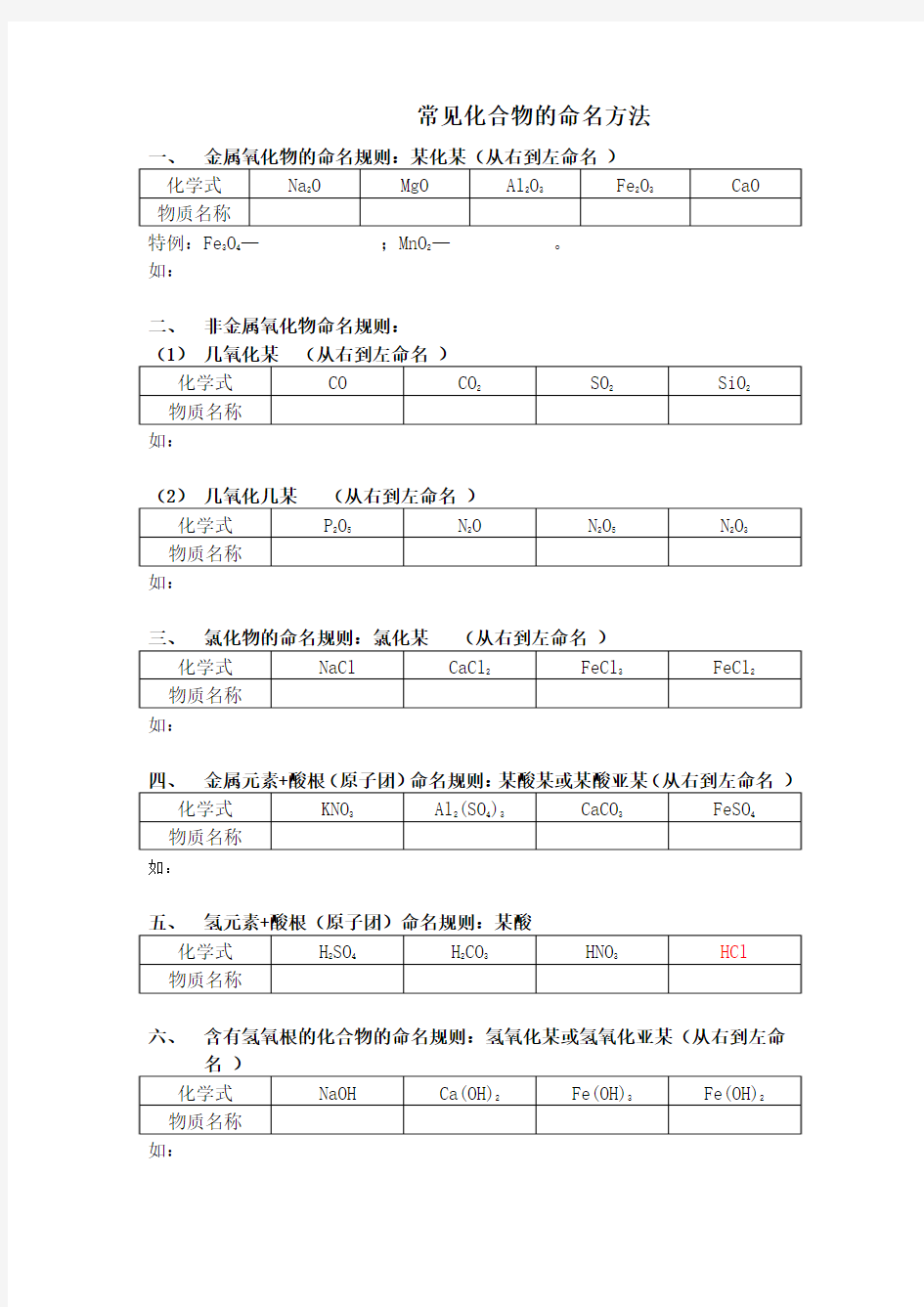
常见化合物的命名方法
特例:Fe
3O
4
—;MnO
2
—。
如:
二、非金属氧化物命名规则:
如:
如:
如:
如:
六、含有氢氧根的化合物的命名规则:氢氧化某或氢氧化亚某(从右到左命
如:
课题:配位化合物的基本概念
课题:配位化合物的基本概念 课型:课时:上课时间: 学习目标: 1、了解配合物的形成原理 2、知道配位键、配合物、配离子等基本概念 3、掌握配合物的组成和命名 重、难点: 1、配合物的组成 2、配合物的命名 学习过程: 课前检测: (一)完成下面方程式: 1、硫酸铜与氨水反应 2、硫酸铜与氯化钡反应 3、硝酸银与氨水反应 (二)溶度积规则Qi与Ksp的关系 学习新课 一、配合物的定义 [实验探究] 1、取一支试管加入5mL 0.1mol/L CuSO4溶液,然后逐滴加入2mol/L NH3·H2O 溶液至过量,观察并记录现象 。 2、将上述溶液分成两份,一份滴加数滴0.1mol/L BaCl2溶液,另一份滴加数滴1mol/L NaOH溶液,观察并记录现象 。 3、分析实验现象,你能得出什么结论: 。 (沉淀-溶解平衡考虑) [自学反馈]预习P130配合物的定义,理解下列几个基本概念 1、配位键 2、配离子 3、配合物 二、配合物的组成 [自学反馈]预习P131配合物的组成,掌握配合物的组成 以[Cu(NH3)4]SO4为例,分析其组成 [Cu(NH3)4]SO4
1、中心原子:通常是, 例如:。 2、配位体:提供的分子和离子叫配位体 例如:。 配位原子:配位体中原子叫配位原子 例如:。 3、配位数:作为直接与结合的的数目,即形成配位键的数目称为配位数。 4、配离子的电荷数:配离子的电荷数等于和电荷数的代数和。 5、内界和外界:配合物分为内界和外界,其中称为内界,与内界发生电性匹配的称为外界。 三、配合物的命名 [自学反馈]预习P132配合物的命名,熟悉配合物的命名规则 1、配离子的命名: 2、配位酸: 3、配位碱: 4、配位盐: 自学检测:命名下列配合物 (1)K2[PtCl6] (2)K4[Fe(CN)6] (3)[Co(NH3)6]Cl3; (4)[CrCl2(H2O)4]Cl (5)[Co(NO3)3(NH3)3] (6)[Fe(CO)5]
杂环化合物命名
杂环化合物命名 一)特定杂环的俗名合半俗名 IUPAC 原则规定,具有特定俗名和半俗名的杂环共45 个 HH Thiophene Furan1H-Imidazole1H-Pyrazole Thiazole 噻吩呋喃1H- 咪唑1H- 吡咯噻唑 O N N N N N N N 2H-Pyran Pyridine Pyrazine Pyrimidine 2H-b 吡喃吡啶哌嗪嘧啶 Oxazole 恶唑 Pyridazine 哒嗪 4H-Quinolizine Quinoline 4H-喹嗪喹啉 Phthalazine [1,8]Naphthyridine Quinoxaline 酞嗪[1,8]萘 啶喹喔啉 7 Phenanthroline 654 Phenoxathiine Phenanthridine 菲啶菲咯啉(1 ,7 位) 吲嗪1H- 吲哚 7H-Purine 7H- 嘌呤 吩噻恶 64 9H-beta- Carboline 9H-bete- 咔啉 1H-Indazole 1H- 吲唑 Acridine 丫啶 Phenazine 吩嗪 9H-Carbazole 10H-Phenothiazine 10H- 吩噻嗪以上杂环氢的位置不同者,把H(大写、斜体)及其标号放在词首,在并环
上者,注明边号(用 a 、b 、c 表示) 当杂原子在环上的位置不同时,可视为异构体 几点说明 ( 1) 杂环的写法可以不同,但是位号不变。 ( 2) 单杂环的编号从杂原子开始, 并使其他杂原子或指示氢位号尽可能小; 杂 原子不 同时,要使优先的杂原子号小,常见的位 O ,S ,-NH- ,-N=顺序; 只含一个杂原子的单杂环,也可对杂原子旁的碳用 αβ γ进行编号。 ( 3) 稠杂环有其固定的编号顺序, 通常从一端开始,依次编号一周(公用碳不 编号, 如需编号时,用前一位加 a,b,c 表示),并尽可能使杂原子,特别使 优先的杂原子号小; 也有的杂环按相应的环烃编号, 此时杂原子编号最大 (见咔唑,丫啶),嘌呤使个特例,不仅公用碳编号,且编号顺序也很特 别。 ( 4) 含两个以上杂原子的五元单杂环, 其中至少含一个氮原子的通称 “某唑”; 含两 个以上杂原子(至少一个位氮)的六元单杂环多称为“某嗪” ;含氧 的称“恶”;含硫的称“噻”。例如: 5) 杂环已经含有最大数目的非聚集双键之外, 还含有的饱和氢原子 (两个二 价元素 中间的饱和氢不算)称做“指示氢”或“额外氢”或“标氢” 。指 示氢不同的异构体,以其位号加“ H ”(斜体大写)作词首来表示。 6) 若杂环尚未含有最大数目的非聚集双键, 这样的饱和氢原子为外加氢。 命 名时要 指明加氢的位置和数目,全部饱和可以省略位置。 7) 含活泼氢的杂环及其衍生物, 可能存在互变异构体, 结构不同,名称也异; 命名 时尚需标明两种可能的位号 。 8) 杂环母环的名称确定之后。 就可参照芳香化合物的命名方法, 将环上取代 基位 置,数目及名称,以词首或词尾的形式加在环名的前后,有时杂环也 NN [1,3,4]Oxadiazole 1, 3, 4-恶二唑 [1,2,5]Thiadiazole 1, 2, 5-噻二唑 N N N N [1,2, 4]Tr iazine 1,2, 4-三嗪 O 4H-Pyran 4H-吡喃 3H-Indole 3H- 吲 哚 4aH-Carbazole 4aH- 咔 唑 2H-Isoindole 异吲 哚 Isothiazole 异噻唑 Isoxazole 异恶唑 Isoquinoline 异喹啉
完整版化合物英文命名规则
Nomenclature of Inorganic Compounds无机化合物的命名 (Prefix词头,前缀Suffix词尾,后缀Stem词根) 1.Trivial Names俗名 H2O water不说dihydrogen oxide NH3 ammonia不说nitrogen trihydride CaO quicklime CaCO3 limestone 2.Systematic Nomenclature系统命名 1)Oxide氧化物——先命名非氧元素 ZnOzinc oxide CaO calcium oxide CO carbon oxide Na2O2 sodium peroxide H2O2hydrogen peroxide 注:peroxide过氧化物 2)Hydroxide氢氧化物(base碱) Ba(OH)2 barium hydroxide KOH potassium hydroxide 3)Acid酸 Hydro acid氢酸General formula通式:HnX 命名:hydro- + stem of X + -ic acid H2S hydrosulfuric acid(英) hydrosulphuric(美) 氢硫酸S:sulfur(英)、sulphur(美) HBr 氢溴酸hydrobromic acidBr: bromine HCl 氢氯酸(盐酸)hydrochloric acidCl: chlorine HF 氢氟酸hydrofluoric acidF: fluorine Oxoacid or Oxyacid含氧酸General formula通式:HnXOm 命名:Stem of X + -ic acid 注:oxo-(oxy-) 含氧, 氧代 H2SO4 sulfuric acid(英) sulphuric acid(美) H2CO3 carbonic acid H3PO4 phosphoric acid P: phosphorus H3BO3 boric acid B: boron HNO3 nitric acid N: nitrogen If X has two oxidation states: -ic:the higher oxidation state -ous:the lower oxidation state H2SO4 sulfuric acid H2SO3 sulfurous acid 1/5 HNO3 nitric acid HNO2 nitrous acid If X (such as halogens) has more than two oxidation states: halogen卤素 per- (过,高) + -ic:the still higher oxidation state hypo- (次,在?下) + -ous:the still lower oxidation state HClO3 chloric acid HClO2 chlorous acid HClO4 perchloric acid
无机化合物英文命名
无机化合物的命名 (nomenclature of inorganic compound)讲授新课: (一)、元素(element)命名和符号 H hydrogen [?haidr?d??n] He helium ['hi:li?m] Li lithium ['liθi?m Be beryllium [be'rili?m] B boron ['b?:r?n] C carbon [?kɑ:b?n] N nitrogen [?naitr?d??n] O oxygen [??ksid??n] F fluorine ['flu?ri:n] Ne neon [?ni:?n ?ni:?n] Na sodium ['s?udi?m] Mg magnesium [m?g?ni:zi?m] Al aluminum [??lju?mini?m, ??l??mini?m] Si silicon [?silik?n] P phosphorus ['f?sf?r?s] S sulfur [ ['s?lf?] Cl chlorine ['kl?:ri:n]
Ar argon ['ɑ:g?n] Ca calcium [?k?lsi?m] Rb rubidium [ru:'bidi?m] K potassium [p?'t?si?m] Br bromine ['br?umi:n] I iodine [?ai?di:n] Ba barium ['b??ri?m 其他常有元素 Fe : iron ['ai?n] Mn : manganese [?m??g?'ni:z] Cu: copper [?k?p?]拉丁语:Cuprum Zn: zinc [zi?k] Hg: mercury [?m?:kjuri] 来源于古希腊人对它的称呼hydor argyros (水银) Ag: silver [?silv?]拉丁名Argentum 即来自希腊文argyros (明亮) , 元素符号Ag ,与英文名silver 毫不相干; Au: gold [g?uld] 金的拉丁名Aurum 来自希腊文aurora (灿烂) ,元素符号Au ,与英文名gold 也无关系。 Pt: platinum ['pl?tin?m] Mn: Manganese [?m??g?'ni:z] 钚(英语:Plutonium)原子序数为94,元素符号是Pu,[plu:'t?uni?m]东京电 力公司委托外部专门机构进行了检测,并从中检测出微量的钚-238、钚-239和钚-240。【钚-238的半衰期是80多年,钚-239是24000年,钚-240半衰期为6500年,钚-244达8千万年】
常见无机化合物英文命名
最无机化合物的命名绝对给力讲授新课: (一)、元素(element)命名和符号 H hydrogen [?haidr?d??n] He helium ['hi: li?m] Li lithium ['liθi?m Be beryllium [be'rili?m] B boron ['b?: r?n] C carbon [?kɑ: b?n] N nitrogen [?naitr?d??n] O oxygen [??ksid??n] F fluorine ['flu?ri: n] Ne neon [?ni: ?n ?ni: ?n] Na sodium ['s?udi?m] Mg magnesium [m?g?ni:
zi?m] Al aluminum [??lju?mini?m,??l??mini?m] Si silicon [?silik?n] P phosphorus ['f?sf?r?s] S sulfur [ ['s?lf?] Cl chlorine ['kl?: ri: n] Ar argon ['ɑ: g?n] Ca calcium [?k?lsi?m] Rb rubidium [ru: 'bidi?m] K potassium [p?'t?si?m] Br bromine ['br?umi: n] I iodine [?ai?di: n] Ba barium ['b??ri?m 其他常有元素 Fe :
iron ['ai?n] Mn : manganese [?m??g?'ni: z] Cu: copper [?k?p?]拉丁语: Cuprum Zn: zinc [zi?k] Hg: mercury [?m?: kjuri]来源于古希腊人对它的称呼hydor argyros (水银) Ag: silver [?silv?]拉丁名Argentum 即来自希腊文argyros (明亮) ,元素符号Ag ,与英文名silver 毫不相干; Au: gold [g?uld]金的拉丁名Aurum 来自希腊文aurora (灿烂) ,元素符号Au ,与英文名gold 也无关系。 Pt: platinum ['pl?tin?m] Mn: Manganese [?m??g?'ni:
有机化合物的命名
第三节有机化合物的命名 一、烷烃命名时要注意哪些问题?命名的基本原则有哪些? 1.烷烃命名的步骤 口诀为:选主链,称某烷;编号位,定支链;取代基,写在前;标位置,短线连;不同基,简到繁;相同基,合并算。 (1)找主链:最长、最多定主链 ①选择最长碳链作为主链。 应选含6个碳原子的碳链为主链,如虚线所示。 ②当有几个不同的碳链时,选择含支链最多的一个作为主链。如
含7个碳原子的链有A、B、C三条,因A有三个支链,含支链最多,故应选A为主链。 (2)编碳号:编号位要遵循“近”、“简”、“小” ①以离支链较近的主链一端为起点编号,即首先要考虑“近”。如: ②有两个不同的支链,且分别处于距主链两端同近的位置,则从较简单的支链一端开始编号。即同“近”,考虑“简”。如 ③若有两个相同的支链,且分别处于距主链两端同近的位置,而中间还有其他支链,从主链的两个方向编号,可得两种不同的编号系列,两系列中各位次和最小者即为正确的编号,即同“近”、同“简”,考虑“小”。如: (3)写名称 按主链的碳原子数称为相应的某烷,在其前写出支链的位号和名称。原则是:先简后繁,相同合并,位号指明。阿拉伯数字之间用“,”相隔,汉字与阿拉伯数字用“-”连接。如 命名为:2,4,6-三甲基-3-乙基庚烷。
2.烷烃命名的5个原则和5个必须 (1)5个原则 ①最长原则:应选最长的碳链作主链; ②最近原则:应从离支链最近的一端对主链碳原子编号; ③最多原则:若存在多条等长主链时,应选择含支链较多的碳链作主链; ④最小原则:若相同的支链距主链两端等长时,应以支链位号之和为最小为原则,对主链碳原子编号; ⑤最简原则:若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子编号。 (2)5个必须 ①取代基的位号必须用阿拉伯数字“2,3,4……”表示; ②相同取代基的个数,必须用中文数字“二,三,四,……”表示; ③位号2,3,4等相邻时,必须用逗号“,”表示(不能用顿号“、”); ④名称中凡阿拉伯数字与汉字相邻时,必须用短线“-”隔开; ⑤若有多种取代基,不管其位号大小如何,都必须把简单的写在前面,复杂的写在后面。 二、烯烃和炔烃的命名与烷烃的命名有哪些不同之处? 1.主链选择不同 烷烃命名时要求选择分子结构中的所有碳链中的最长碳链作为主链,而烯烃或炔烃要求选择含有碳碳双键或三键的最长碳链作为主链,也就是烯烃或炔烃选择的主链不一定是分子中的最长碳链。 2.编号定位不同 编号时,烷烃要求离支链最近,即保证支链的位置尽可能的小,而烯烃或炔烃要求离双键或三键最近,保证双键或三键的位置最小。但如果两端离双键或三键的位置相同,则从距离取代基较近的一端开始编号。 3.书写名称不同 必须在“某烯”或“某炔”前标明双键或三键的位置。 以CH3CH2CCH2CHCH3CHCH3CHCH2CH3CH3为例 4.实例 (1)选主链:将含碳碳双键或碳碳三键的最长碳链作为主链,并按主链中所含碳原子数称为“某烯”或“某炔”。(虚线框内为主链) (2)编序号:从距离双键或三键最近的一端给主链上的碳原子依次编号,使双键或三键碳原子的编号为最小。
(完整版)配位化合物习题及解析
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H2[PtCl6] 六氯合铂(Ⅳ)酸 【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是 A. [Co(NH3)4(CO3)]+ B. [Co(NH3)5(CO3)]+ C. [Pt(en)(NH3)(CO3)] D. [Pt(en)2(NH3)(CO3)]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF3 B. [Zn(NH3)4]2+ (μ = 0 ) C. [Ni(CN)4]2-(μ = 0 ) D. 【C】A:BF3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH3)4]2+ (μ = 0 )的配位数为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全部排满电子,因此只会发生sp3杂化,形成四个杂化轨道;D:NH4+离子是正面体结构,因此中心原子N原子发生了sp3杂化;C:[Ni(CN)4]2-(μ = 0 )的配位数为4,中心原子提供4个杂
无机化合物的命名法
IUPAC Rules for Inorganic Nomenclature IONIC COMPOUNDS Positive Ions (cations) Monatomic positive ions take the names of the metal from which they are derived: When a metal forms to distinguish between these ions. The accepted practice today is to indicate the charge of the ion by a roman Negative Ions (anions) Monatomic negative ions are named by adding the suffix -ide to the stem of the
The nomenclature of polyatomic anions is more complex. The names of the most Ionic Compounds For ionic compounds, the name of the positive ion (cation) is given first, COVALENT COMPOUNDS For covalent compounds involving metals, the above rules are still used when metals are involved: AlCl3 aluminum chloride SnCl4tin(IV) chloride
杂环化合物的命名
杂环化合物(hetero cyclic compounds)属于环状有机化合物的一种,是指由碳原子和非碳原子共同参与组成环的环状化合物。这种参与成环的非碳原子称为杂原子。杂原子大都属于周期表中Ⅳ、Ⅴ、Ⅵ三族的主族元素,最常见的是氮、氧、硫,其中以氮原子最为多见。按照这个定义,在前面一些章节中曾讨论过的内酯、交酯、环状酸酐和内酰胺等,也应属于杂环化合物。但这些化合物通常容易开环成原来的链状化合物,其性质又与相应的链状化合物相同,因此一般不把它们列入杂环化合物的范围。有机化学中所要讨论的杂环化合物,一般都比较稳定,不容易开环,有些杂环化合物的性质与苯、萘等相似,具有不同程度的芳香性。 杂环化合物的种类繁多,数目庞大。据统计,在已发现的几百万种有机化合物中,杂环化合物约占总数65%以上。这说明杂环化合物在有机化学的各个研究领域中都占有相当重要的地位。 杂环化合物广泛地存在于自然界中,动植物体内所含的生物碱、苷类、色素等往往都含有杂环结构。许多药物,包括天然药物和人工合成药物,例如头孢菌素(抗生素)、羟基树碱(抗肿瘤药)、小檗碱(抗菌药)等也都含有杂环。与人类生命活动及各种代谢关系非常密切的物质 ──核酸,其碱基部分也含有杂环。近几十年来,在杂环化合物的理论和应用方面的研究不断取得重 大进展,许多天然杂环化合物,包括维生素B那样结构极其复杂的杂环分子,已经能够用人工方法进行全合成;同时,人类也合成了许多自然界不存在的杂环化合物。这些化合物作为药物,作为超导材料,作为工程材料,也都具有很重要的意义。 杂环化合物的分类 杂环化合物的种类繁多,其常见的分类方法按所依据的原则不同,可分为按分子所含环系的多少及其连接方式分类和按分子中所含π电子的状态和数量多少分类两种。 按分子所含环系的多少及其连接方式分类 根据这种方法可将杂环化合物分为以下几类: 按分子中所含π电子的状态和数量多少分类
有机化合物命名规则大全
有机化合物命名规则大全 有机化合物种类繁多,数目庞大,即使同一分子式,也有不同的异构体,若没有一个完整的命名(nomenclature)方法来区分各个化合物,在文献中会造成极大的混乱,因此认真学习每一类化合物的命名是有机化学的一项重要内容。现在书籍、期刊中经常使用普通命名法和国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry)命名法, 后者简称IUPAC命名法。 一、链烷烃的命名 1. 系统命名法 (1)直链烷烃的命名 直链烷烃(n?alkanes)的名称用“碳原子数+烷”来表示。当碳原子数为1?10时,依次用天干——甲、乙、丙、丁、戊、己、庚、辛、壬、癸——表示。碳原子数超过10时,用数字表示。例如:六个碳的直链烷烃称为已烷。十四个碳的直链烷烃称为十四烷。烷烃的英文名称是alkane,词尾用ane。表1列出了一些正烷烃的中英文名称: 表1 正烷烃的名称
以上20个碳以内的烷烃要比较熟悉,以后经常要用。烷烃的英文名称变化是有规律的,认真阅读上表即可看出。表中的正(n ?)表示直链烷烃,正(n ?)可以省略。 (2)支链烷烃的命名 有分支的烷烃称为支链烷烃(branched ?chain alkanes )。 (i )碳原子的级 下面化合物中含有四种不同碳原子: CH 3 C CH 33C CH 3H C H H CH 3 (i) (i) (i) (i) (i) (ii)(iii)(iv) ① 与一个碳相连的碳原子是一级碳原子,用1?C 表示(或称伯碳,primary carbon ),1?C 上的氢称为一级氢,用1?H 表示。 ② 与两个碳相连的碳原子是二级碳原子,用2?C 表示(或称仲碳,secondary carbon ),2?C 上的氢称为二级氢,用2?H 表示。 ③ 与三个碳相连的碳原子是三级碳原子,用3?C 表示(或称叔碳,tertiary carbon ),3?C 上的氢称为三级氢,用3?H 表示。 ④ 与四个碳相连的碳原子是四级碳原子,用4?C 表示(或称季碳,quaternary carbon ) (ii )烷基的名称 烷烃去掉一个氢原子后剩下的部分称为烷基。英文名称为alkyl ,即将烷烃的词尾?ane 改为?yl 。烷基可以用普通命名法命名,也可以用系统命名法命名。表2列出了一些常见烷基的名称。
无机化合物之命名
無機化合物之命名 ?Organic chemicals:以石油為基礎的含碳化合物,C-O化合物(CO, CO2, CO32-…)及CN-除外1. Monatomic Ions 單原子離子之稱呼 ? Ion的形成:octet rule 8個價電子為stable (Chap. 10) ?陽離子:(see p.155 Table 6.1) 元素名+ion中英文同 Na+Sodium ion 鈉離子Mg+Magnesium ion 鎂離子 過渡元素,有多種離子態時 Mn2+Manganese (II) ion,二價錳離子 Hg:為Hg+,但都是以一對存在,故記為Hg22+ ?陰離子:(see p.156 Table 6.2) 中文:元素名+離子,如:氯離子 英文:元素名化(ide) ion Cl-:chlorine → chlor ide ion S2-:sulfur → sulf ide ion P3-:phosphorus → phosph ide ion ?離子狀態和原子狀態性質差很大→價電子已改變 ?究竟會成為幾價?→外層為8個價電子(Chap. 10) A系列:單純I A族→ M+I A族→ M2+II A族→ M3+ V A族→ X3-VI A族→ X2-VII A族→ X-若非如此→unstable B系列:d、f過渡元素:能量最高的電子在內層,且差異不大,變化很多種稱呼:Fe Fe+2:文iron (II) ion 讀法:iron two Fe+3:文iron (III) ion 讀法:iron three ?俗名法:(for metal ion) 較低價數者,尾端為ous (亞) 較高價數者,尾端為ic 如Fe2+ ferr ous ion (亞鐵離子);Fe3+ ferr ic ion Cr3+ chrom ic三價鉻;Cr2+ chrom ous (二價鉻、亞鉻) CrO氧化亞鉻 2. Polyatomic Ions 多原子離子(根)之稱呼 ? NH4+、NO3-……等,以一組原子的方式存在較為穩定(根) ?命名稱呼 1. 含氧原子:字尾為ate和ite;ite比ate少一個氧原子 但不同ate、ite離子物質的價數(電荷數)不一定相同 例NO3- nitr ate ion 硝酸根(離子)NO2-nitr ite ion 亞硝酸XX(離子) SO42- sulfate ion 硫酸根離子SO32-sulf ite ion 亞硫酸根離子 2. 字首bi代表氫,而非〝2〞 bi carbonate ion HCO3-(碳酸氫) bi sulfate ion HSO4-(硫酸氫) 3. 字首per代表較ate多一個氧(過),Hyp-代表較ite少一個氧(次) ClO3-chlor ate氯酸XXX;ClO2-chlor ite亞氯酸XX Per chlor ate ClO4-過氯酸XX;Hypo chlor ite ClO-次氯酸XXX 4. 字首thio:一個氧被硫取代(硫代) sulf ate ion SO42-硫酸XX →thio sulf ate ion S2O32-硫代硫酸XX
化合物命名规则复习过程
一般规则 取代基的顺序规则 当主链上有多种取代基时,由顺序规则决定名称中基团的先后顺序。一般的规则是: 取代基的第一个原子质量越大,顺序越高; 如果第一个原子相同,那么比较它们第一个原子上连接的原子的顺序;如有双键或三键,则视为连接了2或3个相同的原子。 以次序最高的官能团作为主要官能团,命名时放在最后。其他官能团,命名时顺序越低名称越靠前。 主链或主环系的选取
以含有主要官能团的最长碳链作为主链,靠近该官能团的一端标为1号碳。 如果化合物的核心是一个环(系),那么该环系看作母体;除苯环以外,各个环系按照自己的规则确定1号碳,但同时要保证取代基的位置号最小。 支链中与主链相连的一个碳原子标为1号碳。 数词 位置号用阿拉伯数字表示。 官能团的数目用汉字数字表示。
碳链上碳原子的数目,10以内用天干表示,10以外用汉字数字表示。 各类化合物的具体规则 烷烃 找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙...)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。 从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。以数字代表取代基的位置。数字与中文数字之间以- 隔开。 有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙
基、丙基的顺序列出所有取代基。 有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以, 隔开,一起列于取代基前面。 烯烃 命名方式与烷类类似,但以含有双键的最长键当作主链。 以最靠近双键的碳开始编号,分别标示取代基和双键的位置。 若分子中出现二次以上的双键,则以“二烯”或“三烯”命名。 烯类的异构体中常出现顺反异构体,故须注明“顺”或”反”。
无机及配位化合物命名练习2 03格式
班级:学号:姓名:成绩 1 / 2 无机及配位化合物命名练习(对50个为100分) AgClO 4 AgF 2 AgIO 3 AgMnO 4 Ag 2C 2O 4 Ag 2Cr 2O 7 Ag 2MoO 4 Ag 2SO 4 Ag 2SeO 4 Ag 2Te Ag 3Br 2 Ag 3Br 3 Ag 3Cl 3 Ag 3I 3 HBr HCN FeO Al(OH)3 Fe 2O 3 Al 2Br 6 ArClF AsBrO AsBr 3 AsClO As 2S 4 AuCN BPO 4 Ba(ClO 4)2 BaMoO 4 Ba(OH)2 BaSi 2O 5 Ba 2P 2O 7 Hg 2(SO 4) HgSO 4 Be(OH)2 BiPO 4 CaH 2 Ca(H 2PO 2)2 SO 3 Ce 2C 3 Cl 2O 7 P 2O 5 CoSb CrVO 4 CsClO 4 CsTaO 3 Cs 2WO 4 Cl 2O 7 Cu(OH)2 ErF 3 ErI 3 EuS N 2O 3 FeZrO 3 Fe 2I 2 Fe 2I 4 Fe 2O 3 Fe 3O 4 GaAsO 4 HClO 2 HClO 3 HClO 4 H 2CO 3 H 2CrO 4 H 2O 2 H 2S 2O 7 H 2S 2O 8 H 3AsO 4 H 4XeO 6 H 6TeO 6 Hg(IO 3)2 Ca(HSO 3)2
班级:学号:姓名:成绩 2 / 2 K 2[CuCl 4] KHSO 4 K 3[Fe(CN)6] MgMoO 4 (NH 4)3N (NH 4)H 2AsO 4 NaHS MgNH 4PO 4 KAl(SO 4)2 Ni(OH)2 NiS NiSO 4 P 4O 10 RbO 2 Tl 2TeO 3 Tl 2WO 4 Yb 2Se 3 Zn(AlO 2)2 Zn(AsO 2)2 Zr(OH)4 Ca(NO 2)2 Hg(NO 3)2 Cd(BrO 3)2 Ca(ClO)2 Ag[Sb(SO 4)2] Li[Ag(S 2O 3)] Rb 2[Be(C 2O 4)2] NH 4[Mn(C 3H 2O 4)2(OH 2)2] K[CrO 3F] K 3[Ir(NO 2)4Cl 2] Rb 2[InCl 5(OH 2)] [Rh(OH)(NH 3)5](NO 3)2 [Ru(NH 3)4(HSO 3)2] [Cr(NH 3)3Cl 3] [Cr(H 2O)5Cl]SO 4 [Cr(H 2O)4Cl 2]Cl [Co(en)2Cl 2]Cl [Cu(NH 3)4]SO 4 [Co(NH 3)4(H 2O)F]2+ [Cu(en)2]2+ K 3[Fe(CN)6] K 2[PtCl 4] [Cr(H 2O)2BrClFI] [Pt(NH 3)Cl 3] [Ti(H 2O)6][CoCl 6] [Cu(en)2][PtCl 4] [Cr(NH 3)6][IrCl 6]
稠杂环化合物的命名规则教学文案
稠杂环化合物的命名: 对这类杂环化合物,可将其母核分解成两个有特定名称的环系,并将其中一个定为基本环,另一个定为附加环。命名时将附加环名称放在前,基本环名称放在后,两环名称间缀以方括号,方括号内分别用阿拉伯数字和小写英文字母表示两环的稠合情况。现就其具体方法说明如下: 一、关于基本环的选择,主要按以下几条规则依次考虑。 ①由杂环和芳环构成的稠杂环,优先选择杂环作基本环。如还有选择时,应优先选择环数较多,且有特定名称的杂环作基本环。例如: Ⅰ中噻唑为基本环,苯为附加环,称为苯并噻唑;Ⅱ称为苯并异喹啉(不称萘并吡啶)。 ②由杂环和杂环构成的稠杂环,环大小不同时,优先选择大环作基本环;环大小相同时,按N、O、S的顺序优先选择基本环。例如:Ⅲ的基本环是吡喃,称呋喃并吡喃;Ⅳ的基本环是呋喃,称噻吩并呋喃。 ③杂环中杂原子数目不同时,含杂原子数目多的环优先;数目相同时,则含杂原子种类多的环优先。例如:Ⅴ应称吡啶并哒嗪(杂原子数目多的优先);Ⅵ应称咪唑并噻唑(杂原子种类多的优先);但Ⅶ应称噻吩并吡咯(含氮杂环优先)。 ④环的大小、杂原子的数目、种类都相同时,优先选择稠合前杂原子编号较小的杂环为基本环。例如:Ⅷ应称吡嗪并哒嗪。 ⑤含有共用杂原子的稠杂环,应视为两环都含有该共用杂原子来进行选择。例如:Ⅸ应称为咪唑并噻唑(含杂原子种类多的优先)。 除以上规定外,尚有一些其他习惯使用的规定,此处不再赘述。
二、稠合方式的表达: 为了将基本环与附加环的稠合方式表达清楚,应先将两部分各自按编号原则编号,再将基本环的每条边按编号方向依次用a、b、c、d……代表,然后将附加环稠合边原子序号写在前,基本环稠合边字母写在后,二者之间用“-”隔开,一起放到两环系名称之间的方括号内。附加环稠合边原子序号在书写时应与基本环字母次序的方向一致,两者顺序相同时小数字在前,大数字在后;反之则大数字在前,小数字在后。例如: 该化合物两环稠合边编号方向相反,命名时应使其一致,所以应称为咪唑并[2,1-b]噻唑,而不称咪唑并[1,2-b]噻唑。 又例如前面所见到的Ⅰ应称为苯并[d]唑(苯环的稠合边原子序号在此无需标出),Ⅳ称为噻吩并[2,3-b]呋喃,Ⅵ称为咪唑并[5,4-d]噻唑,Ⅷ称为吡嗪并[2,3-d]哒嗪。 三、整个稠杂环的编号: 当此类化合物分子中存在有其他取代基或官能团时,需要对整个化合物进行统一编号(此编号方式与表示稠合方式的编号无关),其编号方式应注意以下几点: ①应尽可能使所有杂原子都有最低位次,其次按O、S、NH、N的顺序选择优先编号的杂原子,例如: ②共用碳原子一般不编号(个别例外),但在满足上一条规则的前提下,应尽可能使其具有较低的序号(其编号方式是依整个分子的编号方向在其前一个原子的编号下加注“a”、“b”、“c”等)。例如:下面化合物可有三种不同的编号方式,得到杂原子的编号均为1、4、5、8,但第一种共用碳原子的编号为4a,后两种则为8a,故正确的编号方式应为第一种。 ③氢原子和指示氢的编号应尽可能低。例如:
化合物命名原则
根据IUPAC命名法及1980年中国化学学会命名原则,按各类化合物分述如下. 1.带支链烷烃 主链选碳链最长、带支链最多者. 编号按最低系列规则.从靠侧链最近端编号,如两端号码相同时,则依次比较下一取代基位次,最先遇到最小位次定为最低系统(不管取代基性质如何).例如, 命名为2,3,5-三甲基己烷,不叫2,4,5-三甲基己烷,因2,3,5与2,4,5对比是最低系列. 取代基次序IUPAC规定依英文名第一字母次序排列.我国规定采用立体化学中“次序规则”:优先基团放在后面,如第一原子相同则比较下一原子.例如, 称2-甲基-3-乙基戊烷,因—CH2CH3>—CH3,故将—CH3放在前面. 2.单官能团化合物 主链选含官能团的最长碳链、带侧链最多者,称为某烯(或炔、醇、醛、酮、酸、酯、……).卤代烃、硝基化合物、醚则以烃为母体,以卤素、硝基、烃氧基为取代基,并标明取代基位置. 编号从靠近官能团(或上述取代基)端开始,按次序规则优先基团列在后面.例如, 3.多官能团化合物 (1)脂肪族 选含官能团最多(尽量包括重键)的最长碳链为主链.官能团词尾取法习惯上按下列次序, —OH>—NH2(=NH)>C≡C>C=C 如烯、炔处在相同位次时则给双键以最低编号.例如, (2)脂环族、芳香族 如侧链简单,选环作母体;如取代基复杂,取碳链作主链.例如: (3)杂环 从杂原子开始编号,有多种杂原子时,按O、S、N、P顺序编号.例如: 4.顺反异构体 (1)顺反命名法 环状化合物用顺、反表示.相同或相似的原子或基因处于同侧称为顺式,处于异侧称为反式.例如, (2)Z,E命名法 化合物中含有双键时用Z、E表示.按“次序规则”比较双键原子所连基团大小,较大基团处于同侧称为Z,处于异侧称为E. 次序规则是: (Ⅰ)原子序数大的优先,如I>Br>Cl>S>P>F>O>N>C>H,未共享电子对:为最小;(Ⅱ)同位素质量高的优先,如D>H; (Ⅲ)二个基团中第一个原子相同时,依次比较第二、第三个原子; (Ⅳ)重键 分别可看作 (Ⅴ)Z优先于E,R优先于S. 例如 (E)-苯甲醛肟 5.旋光异构体 (1)D,L构型 主要应用于糖类及有关化合物,以甘油醛为标准,规定右旋构型为D,左旋构型为L.凡分子中离羰基最远的手性碳原子的构型与D-(+)-甘油醛相同的糖称D型;反之属L型.例如, 氨基酸习惯上也用D、L标记.除甘氨酸无旋光性外,α-氨基酸碳原子的构型都是L型. 其余化合物可以通过化学转变的方法,与标准物质相联系确定.例如:
配位化合物
第8章配位化合物 【8-1】命名下列配合物 (1)K2[Ni(CN)4] (2)(NH4)2[FeCl5(H2O)] (2)[Ir(ONO)(NH3)5]Cl2 (3)Na2[Cr(CO)5] 解:(1)四氰合镍(II)酸钾(2)五氯?一水合铁(III)酸铵 (3)二氯化亚硝酸根?五氨合铱(III)(4)五羰基合铬(-II)酸钠 【8-2】写出下列配合物(配离子)的化学式: (1) 硫酸四氨合铜(II)(2) 四硫氰?二氨合铬(III)酸铵 (3) 二羟基?四水合铝(III)离子(4) 二苯合铬 解:(1) [Cu(NH3)4]SO4(2) NH4[Cr(SCN)4(NH3)2] (3) [Al(OH)2(H2O)4]+(4) Cr(C6H6)2 【8-3】AgNO3能从Pt(NH3)6Cl4溶液中将所有的氯沉淀为AgCl,但在Pt(NH3)3Cl4中仅能沉淀出1/4的氯,试根据这些事实写出这两种配合物的结构式。 解:前者为[Pt(NH3)6]Cl4,后者为[PtCl3 (NH3)3]Cl 【8-4】画出下列配合物可能有的几异构体: (1) [PtClBr(NH3)py](平面正方形)(2) [Pt(NH3)4(NO2)Cl]Cl2 (3) [Pt(NH3)2(OH)Cl3] (4) [Pt(NH3)2(OH)2Cl2] 解:(1)有3种几何异构体,即在氯离子的对位可以分别是Br-, NH3或py。 (2)六配位应为正八面体构型,有2种几何异构体,即氯离子是在硝基的对位还是在邻位。 (3)六配位应为正八面体构型,有4种几何异构体,即氨的对位分别可以是氨、羟基和氯离子; 当氨的对位是氯离子时,在赤道平面上又可以有另一个氨的对位是羟基或是氯离子。
无机化合物命名
1.金属氧化物,碱和盐的命名: 原则:先说正离子名(对于有变价的金属后面要有价态标志,如I、II、III等),后说负离子名即可。 负离子的命名:(按照负离子的组成分为三类) 1)All monoatomic anions have names ending with “ide”for example, F- (fluoride), Cl- (chloride), Br- (bromide), S2- (sulfide) and P3- (phosphide). 2)Two polyatomic anions which also have names ending with “ide” are OH- (hydroxide) and CN- (cyanide). 3)Many polyatomic anions contain oxygen in addition to another element. The number of oxygen atoms in such oxyanions is denoted by the use of suffixes “ite” and “ate”, meaning fewer and more oxygen atoms, respectively. In cases where it is necessary to denote more than two oxyanions of the same element, the prefixes “hypo”and “per”, meaning still fewer and still more oxygen atoms, respectively, may be used. 许多的多原子阴离子(polyatomic anion)除了氧原子之外 还有另外一种元素。这类含氧阴离子(oxyanion)中所含氧的 数目由后缀“ite”和“ate”来表示,分别意味着较多的氧原子 和较少的氧原子。在有些场合下,需要表达更多的氧原子和 更少的氧原子时,分别用前缀“hypo”和“per”来表示。(例如 ClO-(hypochlorite), ClO2-(chlorite), ClO3-(chlorate),
