三组分液—液平衡数据测定讲解
三元液液平衡数据的测定

三元液液平衡数据的测定
三元液液平衡数据的测定是研究液体混合物中组分之间的可溶性和界面现象的一种方法。
这种数据通常用于制定化学工艺和优化过程条件。
测定三元液液平衡数据需要一种称为相平衡装置的设备。
这种装置包括一个釜和两个侧口以及温度控制和搅拌设备。
在这个釜中,液体混合物由三种组分组成,并分别以不同的配比混合。
然后,在特定的温度下搅拌并平衡,直到混合物中的三个组分达到平衡状态。
为了测定三元液液平衡数据,需要对相平衡装置进行以下操作:
1. 确定温度 - 确定测量三元液液平衡数据的温度。
通常,这个温度会在化学工艺或实验条件中给出。
然后,设备需要被预热到这个温度并保持稳定。
2. 开始混合 - 将三个液体组分放入装置中。
最好是先加入两个组分,然后在搅拌的同时将第三个组分缓慢添加。
3. 等待达到平衡 - 等待混合物达到平衡状态。
这可能需要几个小时或几天,具体取决于混合物的成分和温度。
4. 取相 - 等待平衡达成之后,通过两个侧口将混合物取出。
根据混合物的成分和当前温度选择取液体相(基础相)或升降级相(液滴)。
5. 检测组分 - 检测并记录所有组分的含量。
这通常是通过气相色谱法或高效液相色谱法来完成的。
6. 重复步骤 - 重新开始另一组混合物,并重复上述步骤。
在完成所有实验之后,三元液液平衡数据可视化为三个维度图。
这个图可以展示它们之间的交互作用和稳定区域。
这些数据可以用于开发和优化化学工艺和反应条件,以满足特定的工业需求。
实验四三元液液平衡数据的测定 (1)

实验四三元液-液平衡数据的测定液-液平衡数据是液-液萃取塔设计及生产操作的主要依据,平衡数据的获得目前尚依赖于实验测定。
一、实验目的(1)测定醋酸水醋酸乙烯在25℃下的液液平衡数据(2)用醋酸-水,醋酸-醋酸乙烯两对二元系的汽-液平衡数据以及醋酸-水二元系的液-液平衡数据,求得的活度系数关联式常数,并推算三元液-液平衡数据,与实验数据比较。
(3)通过实验,了解三元系液液平衡数据测定方法掌握实验技能,学会三角形相图的绘制。
二、实验原理三元液液平衡数据的测定,有两不同的方法。
一种方法是配置一定的三元混合物,在恒定温度下搅拌,充分接触,以达到两相平衡;然后静止分层,分别取出两相溶液分析其组成。
这种方法可以直接测出平衡连接线数据,但分析常有困难。
另一种方法是先用浊点法测出三元系的溶解度曲线,并确定溶解度曲线上的组成与某一物性(如折光率、密度等)的关系,然后再测定相同温度下平衡接线数据。
这时只需要根据已确定的曲线来决定两相的组成。
对于醋酸-水-醋酸乙烯这个特定的三元系,由于分析醋酸最为方便,因此采用浊点法测定溶解度曲线,并按此三元溶解度数据,对水层以醋酸及醋酸乙烯为坐标进行标绘,画成曲线,以备测定结线时应用。
然后配制一定的三元混合物,经搅拌,静止分层后,分别取出两相样品,图1 Hac-H2O-Vac的三元相图示意分析其中的醋酸含量,有溶解度曲线查出另一组分的含量,并用减量法确定第三组分的含量。
三、预习与思考(1)请指出图1溶液的总组成点在A,B,C,D,E点会出现什么现象?(2)何谓平衡联结线.有什么性质?(3)本实验通过怎样的操作达到液液平衡?(4)拟用浓度为0.1mol/L的NaOH定法测定实验系统共轭两相中醋酸组成的方法和计算式。
取样时应注意哪些事项,H2O及V Ac的组成如何得到?四、实验装置及流程(1)木制恒温箱(其结构如图2所示)的作用原理是:由电加热器加热并用风扇搅动气流,使箱内温度均匀,温度有半导体温度计测量,并由恒温控制器控制加热温度。
三元液液平衡数据的测定

三元液液平衡数据的测定引言液液平衡数据是化工及环保行业中重要的参数。
本文将介绍三元液液平衡数据的测定方法。
三元液液平衡数据三元液液平衡数据是指在三组分体系中,三个相互溶解的液体之间平衡的数据。
三元液液平衡数据可以用来确定分离和萃取的操作条件。
三元液液平衡数据的测定方法包括静态法和动态法。
静态法静态法是一种简单的三元液液平衡数据测定方法。
其实验步骤如下:1.将已知质量的固体电解质溶解在水中,加入待测液体A,搅拌均匀。
2.将待测液体B加入混合物中,搅拌10~30min后静置。
3.取上清液,用气相色谱对液相中组分浓度进行分析,得到平衡数据。
使用静态法测定三元液液平衡数据的优点是实验简单,操作方便,缺点是很难测定三个液体系统中所有可能的平衡点,只能测定有限的几个点。
动态法动态法是一种综合测定三元液液平衡数据的方法,通过不断地向一体系中加入两种液体,使体系达到平衡,然后对液相进行组分分析,确定平衡数据。
其实验步骤如下:1.将一个液体加入板式萃取器底部的液相中,上层液体为待测液体A。
2.连续加入待测液体B,加入速度控制在0.1~3.0ml/min之间,收集出口液A与出口液B,以气相色谱法对液相中组分进行分析,获得三元液液平衡数据。
动态法可以获得三元液液平衡数据内各相变的平衡点,但需要操作单位时间较多,且需要设备较为复杂。
三元液液平衡数据的测定方法包括静态法和动态法。
静态法测定简单,操作方便;动态法测定精度更高,可测定所有可能的平衡点。
正确选择三元液液平衡数据的测定方法,对提高化工及环保行业生产效率具有重要意义。
三元液液平衡 实验报告

三元液液平衡实验报告三元液液平衡实验报告摘要:本实验旨在研究三元液液平衡的相关性质和特点。
通过实验观察和数据分析,我们得出了一些关于三元液液平衡的重要结论。
本实验结果对于理解液液平衡的基本原理和应用具有重要意义。
引言:液液平衡是化学工程中重要的基础概念之一。
在化学反应、萃取和分离等过程中,液液平衡的研究对于实现高效的物质转移和分离具有重要作用。
三元液液平衡是指由三种组分组成的液体体系达到平衡状态时的特定条件和性质。
通过实验研究三元液液平衡,我们可以深入了解多组分体系的相互作用和平衡规律。
实验方法:1. 实验装置:使用三颈烧瓶、磁力搅拌器、温度计等设备搭建实验装置。
2. 实验材料:选择合适的溶剂和溶质,确保实验的准确性和可靠性。
3. 实验步骤:a. 将三颈烧瓶装满溶剂,并加热至设定温度。
b. 在烧瓶中加入适量的溶质,并进行搅拌。
c. 通过收集液相样品和测量温度的方法,记录实验数据。
d. 重复实验步骤,改变温度或溶质浓度等条件,获得更多的实验数据。
结果与讨论:通过实验观察和数据分析,我们得出了以下结论:1. 随着温度的升高,液液平衡的相平衡位置发生变化。
这是由于温度对于液体的相互作用力有影响。
2. 溶质浓度对于液液平衡的位置和性质也有显著影响。
高浓度的溶质可能导致相平衡位置的偏移和相平衡曲线的变化。
3. 通过实验数据的分析,我们可以计算出三元液液平衡的平衡常数和平衡浓度。
这些数据对于进一步研究和应用具有重要意义。
4. 三元液液平衡的平衡曲线可以通过绘制相平衡图来表示。
相平衡图可以直观地展示出不同温度和溶质浓度下的相平衡位置和性质。
结论:通过本实验,我们深入了解了三元液液平衡的相关性质和特点。
实验结果对于理解液液平衡的基本原理和应用具有重要意义。
进一步的研究可以探索更复杂的多组分液液平衡体系,并应用于化学工程领域中的物质转移和分离过程中。
05 液液相平衡数据测定

1.滴定管要干燥而洁净,下活塞不能漏液。放水或乙醇时,滴速不可过慢,但也不能快到 连续滴下。锥形瓶要干净,加料和振荡后内壁不能挂液珠。 2.用水(或乙醇)滴定时如超过终点,可用乙醇(或水)回滴几滴恢复。记下各试剂实际 用量。在作最后几点时(环己烷含量较少)终点是逐渐变化,需滴至出现明显浑浊,才停止 滴加。 3.平衡釜搅拌速度应适当,要保持二液层上下完全混合。但也不能过分激烈,以免形成乳
4.计算示例
(1) 浊点滴定法测液—液分层线某次实验的结果列于表 2-2-3。
表 2-2-3 浊点滴定法测液-液分层线(计算示例)
日期______________ 室温 27.0℃
大气压 101.62 kPa
体积(ml)
质量(g)
质量%
编 环已
环 水 乙醇 合计 环 水 乙 终
号烷
水
乙醇
已
已
醇点
烷
烷
四. 实验步骤和分析方法
1.开启气相色谱仪,调定色谱条件,作好分析准备。
2.浊点法测液—液分层线
用干燥移液管取环己烷 2ml,水 0.1ml 放入 250 ml 干燥的锥形瓶中(注意不使液滴沾在
瓶内壁上),向二支酸式滴定管分别加入 20—30 ml 乙醇和水。用滴定管向锥形瓶中缓慢滴
加乙醇(边加边摇动锥形瓶),至溶液恰由浊变清时,记下加入乙醇的 ml 数,得第一数据
实验数据记录按表 2-2-1 和表 2-2-2。
表 2-2-1 浊点滴定法测液-液分层线
日期______________ 室温_______________
大气压______________
体积(ml)
质量(g)
质量%
编
环 水 乙 合 环 水 乙 终点
5.三元液液平衡常数测定实验数据处理方法

5.三元液液平衡常数测定实验数据处理方法
三元液液平衡常数测定实验数据处理通常包括以下几个步骤:
1. 将实验数据绘制成图表:将实验数据以适当的形式绘制成图表,如X-Y图、Y-T图等,以便进行更直观的分析和处理。
2. 计算摩尔分数:对实验数据进行处理,计算出各组分的摩尔分数。
摩尔分数可以通过实验测定得到的物质质量或体积,按摩尔质量或体积比例计算得到。
3. 构建液相平衡方程:根据实验数据和摩尔分数,可以构建液相平衡方程。
平衡方程可以通过质量守恒或化学反应平衡方程得到。
4. 利用平衡常数公式计算平衡常数:根据液相平衡方程和平衡常数公式,可以计算出三元液液平衡常数。
5. 分析结果:对实验数据处理和计算得到的平衡常数进行分析,判断实验数据的可靠性,并作出相应的结论。
需要注意的是,三元液液平衡常数的测定实验数据处理方法可能因具体实验条件和所测物质的不同而有所差异。
在实际操作中,还需要根据实验条件的要求和实验目的进行相应的数据处理和分析方法的选择。
三元物系液液相平衡测定

1 |实验报告课程名称: 化工专业实验 指导老师: 成绩:__________________实验名称: 三元物系液液相平衡测定 实验类型: 热力学实验 同组学生姓名: 一、实验目的和要求(必填) 二、实验内容和原理(必填) 三、主要仪器设备(必填) 四、操作方法和实验步骤 五、实验数据记录和处理 六、实验结果与分析(必填) 七、讨论、心得一、实验目的1. 采用浊点—物性联合法测定乙醇—环己烷—水三元物系的液液平衡双节点曲线和平衡曲线,通过实验了解测定方法,熟悉实验技能。
2. 学会三角形相图的绘制,以及分配系数K ,选择性系数β的计算。
3. 掌握实验的基本原理。
二、实验原理1. 溶解度测定原理乙醇和环己烷、乙醇和水为互溶体系,而水在环己烷中溶解度很小。
在一定温度下,向乙醇和环己烷的混合溶液中滴加水到一定量时,原来均匀清晰的溶液开始分裂成水相和油相两相混合物。
直观的现象是体系开始变浑浊。
本实验先配置乙醇—环己烷溶液,然后加入第三组分水,直到出现浑浊,通过逐一称量各组分来确定平衡组成即溶解度。
2. 平衡结线测定原理定温定压下,三元液液平衡体系的自由度为1。
通过测定在平衡时上层(油相)和下层(水相)的折光指数,并在预先测制的浓度~折光指数关系曲线上查得相应组成,便获得平衡结线。
三、实验仪器及试剂1. 仪器:液液平衡釜、电磁搅拌器、阿贝折光仪、超级恒温槽、电光分析天平、0~50℃的精密温度计、医用注射器、量筒烧杯等。
2. 试剂:分析纯乙醇、环己烷及去离子水。
四、实验步骤1. 打开超级恒温槽的电源开关、加热开关、水循环泵开关,温度稳定在25℃。
2. 将10~12毫升环己烷倒入三角烧瓶,在天平上称重(G 2),然后倒入平衡釜,再将三角烧瓶称重(G 1)。
同样的方法将5~6毫升的无水乙醇加入平衡釜。
3. 打开搅拌器搅拌2~3分钟,使其混合均匀。
4. 用一小医用针筒抽取2~3毫升去离子水,用吸水纸轻轻擦去尖外的水,在天平上称重记下重量。
3 实验3 三元液-液平衡数据的测定2017.9

实验:醋酸-水-醋酸乙烯(乙酯)三元体系
• 溶解度曲线:由于分析醋酸最为方便,因此采用浊 点法测定溶解度曲线 并按此数据 对水层 以醋酸及醋酸乙烯为坐标,对油层以醋酸及水为坐 标,画成曲线,以备测定结线时应用。
• 配制一定的三元混合物:经搅拌,静止分层后,分 别取出两相样品,分析其中的醋酸含量,由溶解度 曲线查出另一组分的含量,并用减量法确定第平行线, 其交点就是被测体 系的组成点。
3 . 溶解度曲线
将一定量的 B和S
混合(和点M)
搅拌、静 置分层
加入一定量的A,则和点的组 成将沿着图中的AM线变化;
加入的A的量使得和点移动到M1, 再次充分搅拌后静置分层,
分离的两部分再次达成平衡, 其组成点为图中的R1和E1点
两者部分互溶,经混合分离后, B中含有部分S,而S中含有部分B,
达成平衡,其组成点为P和Q
再次加入A,进行类似操作, 分别得到达成平衡的点 R2,E2; R3,E3;……。 当加入的A的量达到J点时, 混合物不再分离成两个
相,而是混合成一个相。
将R1R2R3…J E1E2E3… 联结成一条光滑的曲线,称 为溶解度曲线。
掌握实验技能,学会三角形相图的绘制。
二、实验原理
三元液-液平衡数据的测定,有两种不同的方 方法一:
恒温,搅拌
三元混合物
达到两相平衡 静止分层
分析两相组成
• 配制一定的三元混合物,在恒定温度下搅拌,充分接触, 以达到两相平衡;
• 然后静止分层,分别取出两相溶液分析其组成。 • 这种方法可直接测出平衡联结线数据,但分析尚有困难。
三元液-液平衡数据的测定
化学化工学院 陈 姚 梁红 李树华
实验2 三元液-液平衡数据的测定
实验四三组分体系液-液平衡相图测绘

实验四 三组分体系液-液平衡相图测绘实验目的1. 掌握等边三角形坐标表示方法。
2. 学习测绘室温下乙酸正丁酯-水-乙醇三组分体系的液-液平衡相图基本原理三组分体系的组成可用等边三角形坐标图表示。
设以等边三角形三个顶点分别代表三个纯组分A 、B 和C 。
则AB 线上各点代表A 和B 组分的混合体系,AC 线上各点代表A 和C 组成的混合体系,BC 线上各点代表B 和C 组成的混合体系。
将三角形每条边等分为100等分,每份表示质量分数0.01。
按逆时针的方向,每边表示一个组分含量的坐标,构成等边三角形坐标(如图S4–1所示)。
若通过三角形内任何一点O ,引平行于各边的直线。
根据几何原理得:1CA BC AB ====++c b a1CA BC AB ===='+'+'c b a因此,O 点所代表三组分体系的组成可由a’、b’、c’ 线段的长度表示。
若要确定O 点所代表体系中B 的质量分数,只需通过O 点作顶点B 对边AC 的平行线,割BC 边于D 点,CD 线段长即相当于B 组分的质量分数。
其余组分可类推。
如果已知某三组分体系中两组分的质量分数,只需在代表此二组分浓度坐标的两条边上找到相应含量的点,通过这两个点分别作代表这二组分的顶点所对边的平行线,它们的交点就是代表具有此组成体系的点。
等边三角形坐标有两个性质:(1)通过任一顶点B 相其对边引直线BD ,则BD 上的各点所代表的体系中A 、C 两组分含量之比相等(见图S4–2)。
此性质可由三角形相似定理证明。
CAw w c a c a =''''='' (2)如果有两个三组分体系M 和P ,将其混合后,混合体系组成位于MP 线上(见图S4–3)。
若混合体系组成可用O 点表示,则根据杠杆规则:图S4-1 等边三角形座标图S4-2 三角形座标性质(一)OPOM M P =之量之量在乙酸正丁酯-乙醇-水三组分体系中,乙酸正丁酯与水是部分互溶的(实际互溶度很小),而乙醇和乙酸正丁酯、乙醇和水都是完全互溶的,此类体系称为一对部分互溶的三组分体系。
三组分液液平衡相图与萃取
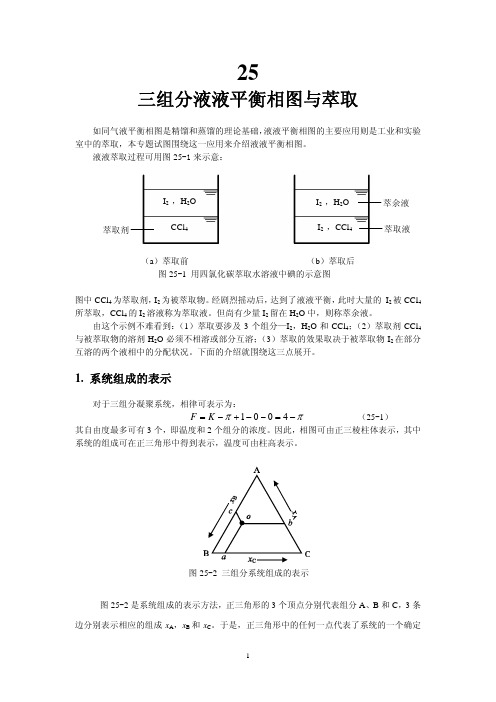
的组成。例如 o 点的组成,可通过 o 点作三条线 oa,ob 和 oc,分别平行于正三角形的 3 条
边,其中 xA=oa,xB=ob,xC=oc。由平面几何不难证明:
xA + xB + xC = oa + ob + oc = 1 这表明 3 个组成中只有 2 个是独立的。
(25-2)
这种表示法有下列 3 个重要的特点:
c
(E) A
c
(R) A
=
(n − n1) / l n1 / v
= KDc,A
(25-11)
n1
=
n⎜⎜⎝⎛
v K Dc,A l
+
v
⎟⎞ ⎟⎠
(25-12)
现若再次用体积为 l 的萃取剂 C 对萃余液作第二次萃取,萃取结果仍有 n2 的 A 残留在 萃余液中,则不难计算
n2
=
n1⎜⎜⎝⎛
v K Dc,Al
A(R 相)
A(E 相)
其平衡条件是 A 在两个液相中的化学势或逸度相等:
μ
(R A
)
=
μ
(E A
)
(25-4)
或
f A( R )
=
f
(E A
)
假如 A 在 R 相和 E 相中都很稀,则由 Henry 定律可得:
f
(R A)ຫໍສະໝຸດ =K(R) Hx , A
xA( R )
(25-5) (25-6)
3
f
( A
1. 系统组成的表示
对于三组分凝聚系统,相律可表示为:
F = K −π +1−0−0 = 4−π
(25-1)
其自由度最多可有 3 个,即温度和 2 个组分的浓度。因此,相图可由正三棱柱体表示,其中
化工热力学实验

实验一二氧化碳临界状态观测及p-v-t关系测定气体的压力、体积、温度(p、v、t)是物质最基本的热力学性质:pvt数据不仅是绘制真实气体压缩因子固的基础,还是计算内能、始、嫡等一系列热力学函数的根据。
在众多的热力学性质中,由于pvt参数可以直接地精确测量,而大部分热力学函数都可以通过pvt参数关联计算,所以气体的pvt性质是研究其热力学性质的基础和桥梁。
了解和掌握真实气体pvt性质的测试方法,对研究气体的热力学性质具有重要的意义。
一、实验目的1. 了解CO2临界状态的观测方法,增加对临界状态概念的感性认识。
2. 加深对课堂所讲工质的热力状态、凝结、汽化、饱和状态等基本概念的理解。
3. 掌握CO2的p-v-t关系的测定方法,学会用实验测定实际气体状态变化规律的方法和技巧。
4. 学会活塞式压力计、恒温器等部分热工仪器的正确使用方法。
二、实验内容1. 测定CO2的p-v-t关系。
在p-v坐标图中绘出低于临界温度(t=20℃)、临界温度(t=31.1℃)和高于临界温度(t=40℃)的三条等温曲线,并与标准实验曲线及理论计算值相比较,并分析差异原因。
2. 测定CO2在低于临界温度时,饱和温度与饱和压力之间的对应关系。
3. 观测临界状态(1) 临界状态时近汽液两相模糊的现象。
(2) 汽液整体相变现象。
(3) 测定的CO2的t c,p c,v c等临界参数,并将实验所得的v c值与理想气体状态方程和范德华方程的理论值相比较,简述其差异原因。
三、实验装置实验装置由压力台、恒温器、试验本体、及其防护罩三大部分组成。
1.整体结构:见图1。
2.本体结构:见图2。
1-高压容器;2-玻璃杯;3-压力油;4-水银;5-密封填料;6-填料压盖;7-恒温水套;8-承压玻璃管;9-CO2空间;10-温度计四、实验原理对简单可压缩热力系统,当工质处于平衡状态时,其状态参效p、v、t之间有:F(p,v,t)=0 或t=f(p,v)(1)。
一种可推广的三组分液—液平衡相图测绘实验体系

一种可推广的三组分液—液平衡相图测绘实验体系作者:王晓琴赵树英俞英俞欣来源:《大学教育》2019年第01期[摘要]通过对三组分体系液—液平衡相图测绘实验进行长期大量的探索研究,发现有机试剂正己醇可与乙醇、水组成理想的三组分液—液平衡体系,该实验体系所得数据绘图效果良好。
同时,正己醇具有毒性低、气味刺激性小、微溶于水的特点,它的应用降低了实验试剂对师生的健康危害,实验室的环境污染得到有效控制。
在实验过程中选用质量量取法,步骤简单,操作方便,数据处理简洁。
该实验可作为成熟的教学或学生兴趣实验推广应用。
[关键词]三组分;平衡相图;物理化学;正己醇[中图分类号] G642.423 [文献标识码] A [文章编号] 2095-3437(2019)01-0090-03在以往的大学化学实验教学中,三组分液—液平衡相图测绘实验曾采用过多种平衡体系,例如苯—乙醇—水[1, 2]、甲苯—乙醇—水[3]、苯—乙酸—水[4]、乙酸正丁酯—乙醇—水[5]以及三氯甲烷—乙酸—水[6]平衡体系等。
这些实验体系在教学过程中或多或少存在着某些方面的问题,例如苯与甲苯试剂毒性大、易挥发、有致癌性,不利于实验师生身心健康;乙酸正丁酯在体积量取法中对聚四氟酸滴管旋塞溶解损毁严重,实验成本较高;三氯甲烷有麻醉作用,光照下易被空气中的氧气氧化成剧毒光气;等等,亟待实验室工作人员做出进一步改进。
为降低实验成本,减少环境污染,向在校本科生贯彻落实绿色化学理念,本实验室通过大量探索研究,确定出一种新的可实施的三组分体系——正己醇—乙醇—水实验体系。
该体系所选试剂正己醇在GB 2760-86[7]、GB 2760–2007[8]中被规定为允许使用的食用香料,广泛应用于食品、酒类[9, 10]、食物保鲜储运[11-13]等工业,同时它还天然存在于各类药材[14, 15]与水果[16, 17]蔬菜[18]中。
正己醇具有毒性低、刺激性气味小的特点,可有效替代其他毒性有机试剂,它不但会减少对实验人员的健康危害,还降低了实验室的环境污染,符合教学实验的绿色化要求。
试验七十六三组分液

一、实验目的
(1)熟悉相律,掌握用三角形坐标表示三组分体 系相图; (2)掌握用溶解度法绘制相图的基本原理; (3)绘制环己烷-水-乙醇三组分体系的平衡相图。
二、实验原理
1、基本概念 相平衡 是热力学在化学领域中的重要应用之一。 研究相平衡在化学、化工的科研和生产中有重要的 意义,例如:溶解、蒸馏、重结晶、萃取、提纯及 金相分析等方面都要用到相平衡的知识。 相图 描述系统的状态如何随温度、压力、组成 等强度性质变化而变化的图形。 相 系统内部物理和化学性质完全均匀的部分称 为一个“相”。相与相之间在指定条件下有明显 的界面,在界面上热力学性质的改变是飞跃式的, 即热力学性质是间断的。
A% = a′= a B% = b′= b C% = c′= c a+b+c=AB
a ' a '' A% '' ' c c C% 常数
杠杆规则 WE DO WD EO
3、绘制三组分液-液体系溶解度曲线及连接线的基本原理
2019/4/5
WE FG WG EF
三、实验仪器与试剂
1、仪器
2、等边三角形坐标表示法
A
(4) 由三个三组分系统D, E,F混合而成的新系统的 物系点,落在这三点组成 三角形的重心位置,即H 点。 先用杠杆规则求出D, E混合后新系统的物系点 G
B
wB
D
G
E
H
F
wA
wC
C
再用杠杆规则求G,F混合后的新系统物系点 H,H 即为DEF的重心。
2、等边三角形坐标表示法
(5) 设S为三组分系统
wB
D
A
当S中析出A组分,剩余 液相组成沿AS延长线变化, 设到达b 。 析出A的质量可以用杠 杆规则求算:
推荐一个绿色化学实验_乙酸正丁酯_乙醇_水三组分液_液平衡相图测绘

第23卷 第6期大学化学2008年12月推荐一个绿色化学实验———乙酸正丁酯2乙醇2水三组分液2液平衡相图测绘孟庆民 刘百军(中国石油大学(北京)化工学院 北京102249) 摘要 介绍了部分互溶的液2液三组分新体系———乙酸正丁酯2乙醇2水的平衡相图实验方法、绘制及此实验体系在实验教学中的实验效果。
可以利用该实验向学生渗透绿色化学的理念。
在高校大学化学和物理化学实验中,一对部分互溶的液2液三组分体系平衡相图实验是具有典型性和代表性的实验之一。
目前国内许多实验教材是用苯2乙醇2水三组分体系[1~5]或甲苯2乙醇2水三组分体系[6]来完成这类实验的,在实验中要大量用到苯或甲苯,而苯和甲苯易挥发、毒性大,既污染环境又对师生的健康不利。
为了降低实验中的污染危害,把绿色化学思想渗透到实验教学中来。
我们采用乙酸正丁酯2乙醇2水的液2液三组分新体系进行大量的反复实验,取得了很好的实验结果,并已在本校2006级学生中应用。
1 1.1 仪器与试剂 电子分析天平,25mL酸式滴定管,50mL具塞锥形瓶,10mL吸量管,50mL梨形分液漏斗,乙酸正丁酯(AR)、无水乙醇(AR)、去离子水。
1.2 实验步骤 (1)共轭溶液配制:在干燥的分液漏斗中,按照表1给定的体积配制。
充分振荡使其达到相平衡,静置分层。
(2)取8个干燥的具塞锥形瓶,按照表2中给定的体积用滴定管及吸量管配不同浓度的水2乙醇溶液及不同浓度的乙酸正丁酯2乙醇溶液。
(3)用滴定管向水及水2乙醇溶液中滴乙酸正丁酯,滴至清液变浊,将每种溶液中滴入乙酸正丁酯的体积记录于表2;用滴定管向乙醇及乙酸正丁酯2乙醇溶液中滴水,滴至清液变浊,将每种溶液中滴入水的体积记录于表2。
滴定时必须充分摇荡,同时注意动作迅速,尽量避免由于乙酸正丁酯及乙醇挥发引入的误差。
此步操作也可用细滴管逐滴加入乙酸正丁酯或水,滴至清液变浊,依减差称质量测得滴入的乙酸正丁酯或水的质量。
(4)乙酸正丁酯2乙醇溶液配制:用移液管取5.00mL乙醇放入干燥的具塞锥形瓶(50mL)中,再在此瓶中用滴定管加入8.50mL乙酸正丁酯,振荡。
化工专业实验讲义

化学工程与工艺专业实验讲义化学工程与工艺专业教研室实验一二元汽—液平衡数据的测定 (1)实验二二氧化碳临界状态观测及P-V-T关系测定 (5)实验三三元液—液平衡数据的测定 (12)实验四乙苯脱氢制苯乙烯 (18)实验五煤油裂解制烯烃 (23)实验六填料塔液相轴向混合特性的测定 (26)实验七沸石催化剂的制备 (34)实验八反应精馏法制乙酸乙酯 (39)实验九恒沸精馏 (43)实验十填料塔分离效率的测定 (50)实验十一液膜分离法脱除废水中的污染物 (52)实验十二碳酸二甲酯生产工艺过程开发 (56)实验一二元汽—液平衡数据的测定汽液相平衡关系是精馏、吸收等单元操作的基础数据。
随着化工生产的不断发展,现有汽液平衡数据不能满足需要。
许多物系的平衡数据很难由理论直接计算得到,必须由实验测定。
平衡实验数据测定方法有两类,即直接法和间接法。
直接法中又有静态法、流动法和循环法等。
其中循环法应用最为广泛。
若要测得准确的汽液平衡数据,平衡釜是关键。
现已采用的平衡釜形式有多种,且各有特点,应根据待测物系的特征,选择适当的釜型。
用常规的平衡釜测定实验数据,需样品量多且测定时间长。
本实验用的小型平衡釜主要特点是釜外有真空夹套保温,可观察釜内的实验现象且样品用量少,达到平衡速度快,因而实验时间短。
一、实验目的1.测定常压下乙醇(1)-水(2)二元汽液平衡数据2.通过实验了解汽液平衡釜的构造,掌握二元汽液平衡数据的测定方法和技能。
3.应用计算机将lewis和colburn二人对乙醇(1)——水(2)在常压下测定的数据用Wilson方程回归得的能量参数,对于自己所得的数据的准确性进行校验。
二、实验原理和计算关联公式以水循环法测定气液平衡数据的平衡釜类型有多种多样,但基本原理都一样,如图1-1所示,当体系达到平衡时,A容器的温度不变,此时A和B中的组成不随时间变化,此时从A和B容器中取样分析,可以得到汽液平衡数据。
根据汽液平衡原理,当汽液两相达到平衡时,除了两相的温度,压力相等之外,任一组在两相中的逸度必须相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验2 三组分体系液—液平衡数据测定一.实验目的1.熟悉用三角形相图表示三组分体系组成的方法;2.掌握用浊点法和平衡釜法测定液—液平衡数据的原理和实验操作,测绘环己烷-水-乙醇三组分体系液—液平衡相图;3.学习使用气相色谱仪分析组成的方法。
二.实验原理液液平衡数据是液液萃取和非均相恒沸精馏过程设计计算及生产操作的重要依据。
液液平衡数据的获得,目前主要是依靠实验测定。
三组份体系液液平衡线常用三角形相图表示。
1.三角形相图设等边三角形三个顶点分别代表纯物质A、B和C(图2-2-1左),AB、BC和CA三条边分别代表(A+B)、(B+C)和(C+A)三个二组分体系,而三角形内部各点相当于三组分体系。
将三角形的每一边分成100等分,通过三角形内部任何一点O引平行于各边的直线a、b和c,根据几何原理,a+b+c=AB=BC=CA=100%,或a`+b`+c` = AB = BC = CA =100%,因此O点的组成可由a`、b`、c` 表示,即O点所代表的三个组分的%组成为,B%= b`,A%= a` ,C%=c`。
如要确定O点的B组成,只需通过O点作出与B的对边AC的平行线,割AB边于D,AD线段长度即相当于B%. 余可类推。
如果已知三组分混合物的任何二个%组成,只须作两条平行线,其交点就是被测体系的组成点。
图2-2-1 等边三角形图等边三角形图还有以下两个特点:(1)通过任一顶点B向其对边引直线BD, 则BD线上的各点所代表的组成中, A、C 两个组分含量的比值保持不变.这可由三角形相似原理得到证明.即a’/c’= a’’/c’’= A%/C% = 常数(图2-2-1中)(2)如果有两个三组分体系D和E,将其混合后,其组成点必位于D、E两点之间的连线上, 例如为O, 根据杠杆规则:E之重/D之重=DO之长/EO之长(图2-2-1右)2.环己烷—水—乙醇三组分体系液—液平衡相图测定方法环己烷—水—乙醇三组分体系中,环己烷与水是不互溶的,而乙醇与水及乙醇与环己烷都是互溶的。
在环己烷与水体系中加入乙醇可促使环己烷与水互溶。
由于乙醇在环己烷层与水层中非等量分配,代表二层浓度的a,b点连线并不一定和底边平行(见图2-2-2)。
设加入乙醇后体系的总组成点为c,平衡共存的二相叫共轭溶液,其组成由通过c的直线上的a,b两点表示。
图中曲线以下的部分为二相共存区,其余部分为单相(均相)区。
(1)液—液分层线的绘制(a) 浊点法现有一环己烷与水二组分体系,其组成为K(图2-2-2),于其中逐渐加入乙醇,则体系总组成的沿K→B方向变化(环己烷与水的比例保持不变),当组成点在曲线以下的区域内,体系为互不混溶的两共轭相,震荡时则出现浑浊状态。
继续滴加乙醇直到曲线上的d点,体系发生一突变,溶液由二相变为一相,外观由浑浊变清。
准确读出溶液刚由浊变清时乙醇的加入量,d点位置可准确确定,此点为液液平衡线上一个点。
补加少量乙醇到e点,体系仍为单相。
再向溶液中逐渐加入水,体系总组成点将沿e→c方向变化(环己烷与乙醇的比例保持不变),直到曲线上的f点,体系又发生一突变,溶液由单相变为二相,外观由清变浑浊。
准确读出溶液刚由清变浊时乙醇的加入量,f点位置可准确确定,此点为液液平衡线上又一个点。
补加少量水到g点,体系仍为二相。
如于此体系再加入乙醇,可获得h点,如此反复进行。
用上述方法可依次得到d、f、h、j……等位于液—液平衡线上的点,将这些点及A和B二顶点(由于环己烷和水几乎不互溶)连接即得到一曲线,就是单相区和二相区的分界线----液-液分层线。
(b) 平衡釜法按一定的比例向一液—液平衡釜(图2-2-3)中加入环己烷、水和乙醇(称好重量)三组分,恒温下搅拌若干分钟,静置、恒温和分层。
取上下二层清液分析其组成,得第一组平衡数据;再补加乙醇,重复上述步骤,进行第二组平衡数据测定……,由此得到一系列二液相的平衡线(类似图2-2-2中,线acb),将各平衡线的端点相连,就获得完整液—液平衡线。
(2)结线的绘制(a)浊点法根据溶液的清浊变换和杠杆规则计算得到。
此法误差较大。
(见参考文献4)(b)平衡釜法由(1)(b)中得到的二液相的平衡线,就是平衡共存二液相组成点的连线——结线。
图2-2-2 滴定路线图2-2-3 液—液平衡釜图2-2-4 LLE 实验装置图三.实验仪器及试剂实验装置见图2-2-4,主要仪器有,液—液平衡釜一台(见图2-2-3)恒温水浴一台(见附录)电磁搅拌器一台气相色谱仪一台(配色谱工作站,见附录)精密天平一台常规玻璃仪器:玻璃温度计(0--100℃),酸式滴定管(50ml二支),刻度移液管(1ml,2ml),锥形瓶(250ml),注射器(10ml 三支)等实验试剂:乙醇(分析纯)、环己烷(分析纯)和蒸馏水。
四.实验步骤和分析方法1.开启气相色谱仪,调定色谱条件,作好分析准备。
2.浊点法测液—液分层线用干燥移液管取环己烷2ml,水0.1ml放入250 ml干燥的锥形瓶中(注意不使液滴沾在瓶内壁上),向二支酸式滴定管分别加入20—30 ml乙醇和水。
用滴定管向锥形瓶中缓慢滴加乙醇(边加边摇动锥形瓶),至溶液恰由浊变清时,记下加入乙醇的ml 数,得第一数据点;于此溶液中再补加乙醇0.5 ml,再用滴定管向锥形瓶中缓慢滴加水(边加边摇动锥形瓶),至溶液恰由清变浊时,记下加入水的ml 数,得第二数据点;再按表2-2-1所给数据加水0.2 ml……得第三数据点;如此反复进行实验,直至表2-2-1中10组数据测完,可获得10组数据。
滴定时要充分摇动,但要避免液滴沾在瓶内壁上。
3.平衡釜法测定液—液平衡数据用注射器(或者移液管)向干燥的液—液平衡釜中加入水、乙醇和环己烷各10 ml(用精密天平准确称量)。
开启恒温水浴,调节到实验温度,并向平衡釜恒温水套通人恒温水(测定室温下平衡数据可不用恒温浴)。
开启电磁搅拌器,搅拌20—30 min ,静置30 min ,分层,取上层和下层样品进行分析(注意:可用微型注射器,由上取样口直接取上、下二层样品。
取样前,微型注射器要用样品本身清洗5—6次)。
所得上下二层组成即为第一组液液平衡数据。
补加乙醇5 ml ,重复上述步骤,测第二组液液平衡数据。
如时间许可,可再加5 ml 乙醇,测第三组数据。
有关数据记录于表2-2-2。
组成分析采用SP6800A气相色谱仪,其原理和操作方法见本书附录。
五.实验数据记录实验数据记录按表2-2-1和表2-2-2。
表2-2-1 浊点滴定法测液-液分层线日期______________ 室温_______________大气压______________表2-2-2 平衡釜法测定LLE数据结果平衡釜温度___________六.实验数据处理1.将各次滴定终点时溶液中各组分的体积,根据其密度(附录)换算成质量,求出相应质量百分组成,其结果列于表2-2-1。
2.将表2-2-1所得结果在三角坐标图(可用等腰直角三角形坐标图)上标出,连成一平滑曲线(液—液分层线),将此曲线用虚线外延到三角形的二个顶点(100%水和100%环己烷点),因为室温下,水与环己烷可看成完全不互溶的。
与本书附录中文献数据得到的结果进行比较。
3.按表2-2-2中实验数据及色谱分析结果,计算出总组成、上层组成和下层组成,计算结果填入表2-2-2,并标入上述三角坐标图上。
上层和下层组成点应在液—液分层线上,总组成点、上层组成点和下层组成点应在同一条直线上。
4.计算示例(1)浊点滴定法测液—液分层线某次实验的结果列于表2-2-3。
表2-2-3 浊点滴定法测液-液分层线(计算示例)日期______________ 室温 27.0℃大气压101.62 kPa(2)平衡釜法测定液—液平衡数据某次实验的结果列于表2-2-4表2-2-4 平衡釜法测定LLE数据结果(计算示例)平衡釜温度27.0℃七.实验结果和讨论1.结果由表2-2-3.浊点滴定法的数据,绘图,得到一平滑的三组分体系液液平衡线。
由平衡釜法测得的上层组成、下层组成和总组成点(表2-2-4)应在一条直线上。
2.讨论(1)对平衡釜法测定液—液平衡数据结果进行评价,试讨论引起误差的原因。
(2)试分析温度和压力对LLE的影响。
3.思考题(1)体系总组成点在曲线内与曲线外时,相数有何不同?(2)用相律说明,当温度和压力恒定时,单相区和二相区的自由度是多少?(3)使用的锥形瓶为什么要预先干燥?(4)用水或乙醇滴定至清或浊以后,为什么还要加入过剩量?过剩多少对实验结果有何影响?八.实验中注意事项1.滴定管要干燥而洁净,下活塞不能漏液。
放水或乙醇时,滴速不可过慢,但也不能快到连续滴下。
锥形瓶要干净,加料和振荡后内壁不能挂液珠。
2.用水(或乙醇)滴定时如超过终点,可用乙醇(或水)回滴几滴恢复。
记下各试剂实际用量。
在作最后几点时(环己烷含量较少)终点是逐渐变化,需滴至出现明显浑浊,才停止滴加。
3.平衡釜搅拌速度应适当,要保持二液层上下完全混合。
但也不能过分激烈,以免形成乳化液,引起分层困难。
用微型注射器取样时,要用样品本身将微型注射器清洗数次。
九.参考文献1.复旦大学,等. 物理化学实验(上). 北京:高等教育出版社,19892.“化学工程手册”编委会编. 化学工程手册,14.萃取与浸取. 北京:化学工业出版社,1981 3.南京化工大学编. 化工热力学实验讲义. 19974.成都科学技术大学. 物理化学实验. 北京:人民教育出版社,19795.王建国,张雅明.乙醇-苯-水-氟化钾体系液液平衡.南京工业大学学报,2002,24(2):74—76.6.Jianguo Wang,Yaming Zhang, et al. Liquid-Liquid Equilibrium For 1-Propanol (or 2-Propanol)-Water Systems Containing Potassium Fluoride. J Chem Eng Date, 2002,47:110—112.附录:试剂的密度数据。
