1全铁亚铁分析方法(酸溶)

全铁分析方法(酸溶)
1、试剂配制
(1)浓盐酸。
(2)25%的钨酸钠溶液。称取25g钨酸钠溶于适量水中,加5ml浓磷酸,用水稀释至100ml,混匀。
(3)100g/L的二氯化锡溶液。二氯化锡10g,溶于30ml盐酸,加热煮至全部溶解,冷却后移入容量瓶,再加水至100ml。
(4)三氯化钛溶液。取现购的15%-20%的三氯化钛溶液2ml,加盐酸8ml,再加水稀释至50ml。该溶液现配现用。
(5)(15+15+70)硫磷混合酸。将150ml硫酸在搅拌下缓慢注入700mI 水中,再加入150ml 磷酸,混合均匀。
(6)浓度为5g/L的二苯胺磺酸钠溶液。称取0.5g二苯胺磺酸钠,溶于100ml水中。
(7)重铬酸钾标准溶液。称取一定质量的预先在150℃下烘干1h的重铬酸钾(基准试剂)溶于水,移入1000mL容量瓶中,用水稀释至刻度,混匀。重铬酸钾分子量294.18g。如配制0.01mol/L,称取2.9418g。
2、实验步骤
1)称取铁矿粉0.1500g左右于250mL锥形瓶中,加入20ml浓盐酸,加热至试样完全溶解。2)加SnCl2至溶液变成淡黄色后,再多加2-3滴。加蒸馏水至100ml,冷却。
3)加钨酸钠溶液5-8滴。加三氯化钛溶液1-2滴,溶液变为蓝色。
4)以重铬酸钾溶液滴定,氧化掉过量的三氯化钛,至溶液蓝色消失,变为无色。无需记数。5)加1:1硫磷混合酸10ml。加指示剂二苯胺磺酸钠5-6滴。
6)以重铬酸钾溶液滴定,紫色为终点。记录消耗的重铬酸钾溶液体积。
3、计算公式
TFe=6*(V-V0)*C*55.85/(10*m)
6——Fe2+与Cr2O72-的反应量之比;
55.85——铁的原子量
m ——铁矿粉称样质量,g;
V——重铬酸钾滴定体积,ml;
V0——滴定空白溶液时消耗重铬酸钾溶液的体积,mL;
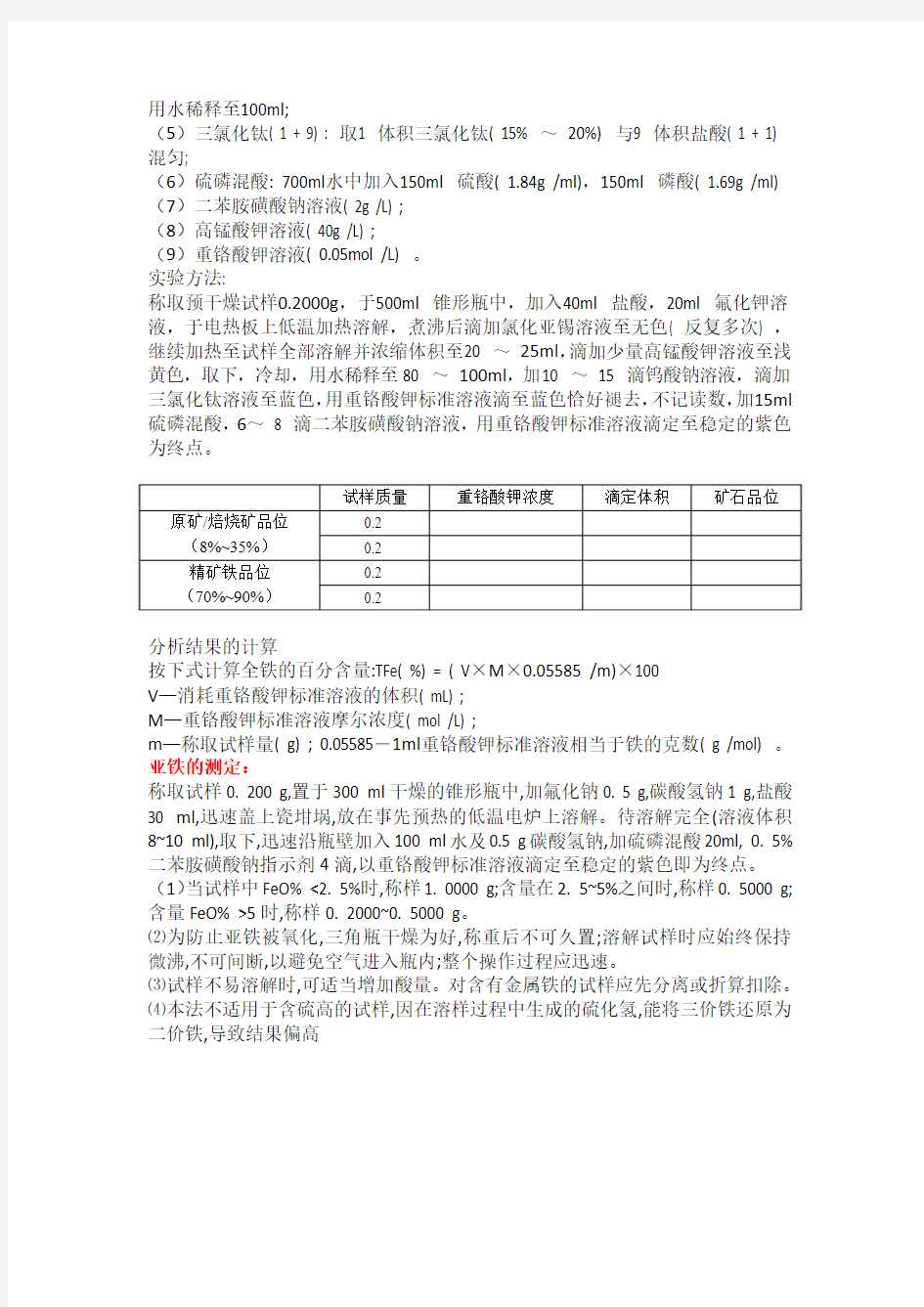
全铁的测定:
试剂:
(1)盐酸( ρ1.19g /ml) ;
(2)氟化钾溶液( 100g /L) ;
(3)氯化亚锡( 150g /L) : 称取15g 氯化亚锡溶于10ml 热盐酸中,用水稀释100ml; (4)钨酸钠( 250g /L) : 称25g 钨酸钠溶于适量水中,加5ml 磷酸( 1.70g /ml) ,
用水稀释至100ml;
(5)三氯化钛( 1 + 9) : 取1 体积三氯化钛( 15% ~20%) 与9 体积盐酸( 1 + 1) 混匀;
(6)硫磷混酸: 700ml水中加入150ml 硫酸( 1.84g /ml),150ml 磷酸( 1.69g /ml) (7)二苯胺磺酸钠溶液( 2g /L) ;
(8)高锰酸钾溶液( 40g /L) ;
(9)重铬酸钾溶液( 0.05mol /L) 。
实验方法:
称取预干燥试样0.2000g,于500ml 锥形瓶中,加入40ml 盐酸,20ml 氟化钾溶液,于电热板上低温加热溶解,煮沸后滴加氯化亚锡溶液至无色( 反复多次) ,继续加热至试样全部溶解并浓缩体积至20 ~25ml,滴加少量高锰酸钾溶液至浅黄色,取下,冷却,用水稀释至80 ~100ml,加10 ~15 滴钨酸钠溶液,滴加三氯化钛溶液至蓝色,用重铬酸钾标准溶液滴至蓝色恰好褪去,不记读数,加15ml 硫磷混酸,6~8 滴二苯胺磺酸钠溶液,用重铬酸钾标准溶液滴定至稳定的紫色为终点。
分析结果的计算
按下式计算全铁的百分含量:TFe( %) = ( V×M×0.05585 /m)×100
V—消耗重铬酸钾标准溶液的体积( mL) ;
M—重铬酸钾标准溶液摩尔浓度( mol /L) ;
m—称取试样量( g) ; 0.05585-1ml重铬酸钾标准溶液相当于铁的克数( g /mol) 。亚铁的测定:
称取试样0. 200 g,置于300 ml干燥的锥形瓶中,加氟化钠0. 5 g,碳酸氢钠1 g,盐酸30 ml,迅速盖上瓷坩埚,放在事先预热的低温电炉上溶解。待溶解完全(溶液体积8~10 ml),取下,迅速沿瓶壁加入100 ml水及0.5 g碳酸氢钠,加硫磷混酸20ml, 0. 5%二苯胺磺酸钠指示剂4滴,以重铬酸钾标准溶液滴定至稳定的紫色即为终点。(1)当试样中FeO% <2. 5%时,称样1. 0000 g;含量在2. 5~5%之间时,称样0. 5000 g;含量FeO% >5时,称样0. 2000~0. 5000 g。
⑵为防止亚铁被氧化,三角瓶干燥为好,称重后不可久置;溶解试样时应始终保持微沸,不可间断,以避免空气进入瓶内;整个操作过程应迅速。
⑶试样不易溶解时,可适当增加酸量。对含有金属铁的试样应先分离或折算扣除。
⑷本法不适用于含硫高的试样,因在溶样过程中生成的硫化氢,能将三价铁还原为二价铁,导致结果偏高
硫酸亚铁铵中铁含量测定
硫酸亚铁铵中铁含量测定 一、实验目的 1. 掌握重铬酸钾法测定亚铁盐中铁含量的原理和方法; 2. 了解氧化还原指示剂的作用原理和使用方法。 二、实验原理 K 2Cr 2 O 7 在酸性介质中可将Fe2+离子定量地氧化,其本身被还原为Cr3+,反应式为: Cr 2O 7 2- + 6Fe2+ + 14H+═ Cr3+ + 6Fe3+ + 7H 2 O 滴定在H 3PO 4 —H 2 SO 4 混合酸介质中进行,以二苯胺磺酸钠为指示剂,滴定至溶液 呈紫红色,即为终点。 三、试剂 硫酸亚铁铵(学生自制)、K 2Cr 2 O 7 (AR)、二苯胺磺酸钠0.2%、H 3 PO 4 85% 等。 四、实验步骤 1、准确称取1~1.5g(NH 4) 2 SO 4 ?FeSO 4 ?6H 2 O样品,置于250 mL烧杯中,加入8 mL 3 mol?L-1H 2SO 4 防止水解,再加入蒸馏水加热溶解,然后定量转移至250mL容量 瓶中定容,充分摇匀。平行移取三份25.00 mL上述样品溶液分别置于三个锥形 瓶中,各加50 mL H 2O、10 mL 3 mol?L-1 H 2 SO 4 ,再加入5~6滴二苯胺磺酸钠指 示剂,摇匀后用K 2Cr 2 O 7 标准溶液滴定,至溶液出现深绿色时,加5.0 mL 85% H 3 PO 4 , 继续滴至溶液呈紫色或紫蓝色。计算试液中Fe的含量。 实验流程
五、数据记录与处理 K 2Cr 2O 7标准溶液, 用滴定管准 确量取25.00ml 上述溶液于锥形瓶中 溶液呈深绿色时加入5mL 磷酸
五、注意事项: 1、滴定至溶液呈深绿色时加入磷酸 六、思考题: 1、本实验中加入硫酸和磷酸的作用是什么? 2、以二苯胺磺酸钠为例,说明氧化还原指示剂的变色原理 参考文献:张龙、潘亚芬《化学分析技术》 邢文卫、李炜《分析化学实验》
碱铜的分析方法
碱铜的分析方法 文件编码(008-TTIG-UTITD-GKBTT-PUUTI-WYTUI-8256)
碱铜分析方法 一、氰化亚铜的测定 1.精取1mL样品; 2.加过硫酸铵1g;加热至清澈; 3.加缓冲液10mL(浓氨水5mL) 4.加水50mL; 5.PAN 3滴。 6.用的EDTA滴定至溶液由蓝色变成绿色为止。 计算方法: CuCN(g/L)= (EDTA)cV× 二、游离NaCN的测定 1.精取1mL样品; 2.加水50mL; 3.加10%KI指示剂2mL; 4.用 AgNO3滴定至微浑浊。 计算: 游离NaCN(g/L)= (AgNO3)cV×49×2 三、酒石酸钾钠的测定 1.精取1mL样品; 2.加水50mL; 3.加10mL浓氨水; 4.用醋酸铅标准液滴定至开始浑浊。 计算: KNaC 4H 4 O 6 ·4H 2 O=醋酸铅滴定度T×V 滴定度:概念:指每毫升标准溶液相当于的待测组分的质量。表示符号:T(标准溶液/待测组分)或T(待测组分/标准溶液)。单位:g/ml、mg/ml。例:用T(EDTA/CaO)=ml的EDTA标准溶液滴定含钙离子的待测溶液,消耗了5ml。则待测溶液中共有。 计算方法: T=n*M/V 氰化铜镀液分析方法(安美特)
(A)铜含量之分析 1) 取样本2毫升。 2)加100毫升纯水。加 2 – 3 克过硫酸铵 ; 3)加热至清澈。 4)加10毫升氨水缓冲液。 5)加数滴 PAN 指示剂。 6)用 N EDTA 滴定至绿色为终点 . 金属铜 ( g/L ) = 所用 EDTA的毫升数 x 氰化铜 ( g/L ) = 所用 EDTA的毫升数 x (B)游离氰化根含量之分析 1) 取试液10毫升。 2)加50毫升纯水。 3)加入 10 毫升 ( 10 % ) KI 碘化钾。 4)用 N 硝酸银滴定至刚呈混浊为终点。 游离氰化钠 ( g/L ) = N 硝酸银滴定数 x 游离氰化钾 ( g/L ) = N 硝酸银滴定数 x (C)氢氧化物含量之分析 1)取试液10毫升 ( 不用加水 )。 2)加10 滴橘橙黄 000 指示剂。 3)用 N 盐酸定至橙黄色为终点 . 氢氧化钠 ( g/L ) = N 盐酸滴定数 x 氢氧化钾 ( g/L ) = N 盐酸滴定数 x
×××片溶出度试验方法学验证
×××片溶出度试验方法学验证 1、溶出度 依据国家食品药品监督管理局国家药品标准新药转正标准第二十八册×××片溶出度试验方法、《中国药典》2010年版二部溶出度测定法(附录Ⅹ C)的有关要求,并参照文献进行本品的溶出度研究。 (1)溶出介质及介质体积的选择 溶出介质应根据制剂的特性选用水、0.01~0.1mol/L盐酸溶液或适宜的缓冲液(pH值一般不超过7.6),应临用新制并经脱气处理。对于极难溶出的品种,可加适量表面活性剂,如十二烷基硫酸钠(0.5%以下),如确需使用有机溶剂,可加适量,如异丙醇、乙醇等(通常浓度在5%以下),但应有依据,并尽量选用低浓度。 溶出介质的体积一般应符合漏槽条件。 ×××在水中微溶,且本品为小规格品种(规格为2.5mg),根据以上溶出介质选择的原则及已有国家标准的方法,选择已有国家标准中采用的溶出介质及体积:0.1mol/L盐酸溶液〔盐酸溶液(9→1000)〕200ml。 (2)溶出方法及其转速的选择 方法的选择一般可参照下列原则: ①对于非崩解型药物,宜采用转篮法。 ②对于崩解型药物,在进行转篮法的整个试验过程中,确保转篮网孔的通透性尤为重要,对于处方中主药或辅料(如胶性物质)影响转篮通透性的固体制剂,一般应采用桨法。 ③制剂中含有难以溶解、扩散的成分,一般应采用桨法。 ④对飘浮于液面的制剂,一般应选用转篮法。如辅料堵塞网孔则选用桨法,将供试品放入沉降篮中,并在正文中加以规定。采用小杯法时不能使用沉降篮。 ⑤小杯法主要用于在转篮法和桨法条件下,溶出液的浓度过稀,即使采用较灵敏的方法仍难以进行定量测定的品种。 转速选择的原则:在质量研究的基础上,尽量选择低转速,转篮法推荐100转/分,最低不得低于50转/分;桨法推荐50转/分,最高不超过75转/分;小杯
硫酸亚铁含量测定
硫酸亚铁中铁含量的测定 一、实验目的 了解K 2Cr 2O 7法测定铁含量的原理和方法。 二、实验原理 在强酸性条件下,K 2Cr 2O 7可以将Fe 2+离子定量氧化: Cr 2O 72- + 6Fe 2+ + 14H + = 2Cr 3+ + 6Fe 3+ + 7H 2O 因此,可用K 2Cr 2O 7标准溶液在H 2SO 4/H 3PO 4混合酸介质中,以二苯胺磺酸钠为指示剂(溶液变紫色为终点)直接滴定Fe 2+离子,测得试样中铁的含量。 三、器材与药品 1.器材 分析天平(0.1mg ),酸式滴定管(50mL ),容量瓶(250mL ),锥形瓶(250mL )等。 2.药品:K 2Cr 2O 7(基准试剂),H 2SO 4(3mol ?L -1),磷酸(85%),二苯胺磺酸钠指示剂(0.2%),FeSO 4·7H 2O (样品)。 四、实验方法 1、K 2Cr 2O 7标准溶液的配制(约0.02mol ·L -1) 准确称取烘干的K 2Cr 2O 7基准试剂1.3~1.5g 于小烧杯中,加入适量去离子水溶解,然后定量转入250mL 容量瓶中,定容,摇匀。 K 2Cr 2O 7标准溶液浓度的计算: 0.250294.18722272O Cr K O Cr ?=-m c 2、硫酸亚铁中铁含量的测定 准确称取0.6~0.7g FeSO 4·7H 2O 样品于250mL 锥形瓶
中,加入10mLH 2SO 4、50mL 去离子水和5mLH 3PO 4,混合 均匀后加入3~4滴二苯胺磺酸钠指示剂①,立即用K 2Cr 2O 7 标准溶液滴定至溶液呈紫色或蓝紫色②,即为终点。重复测 定三次。 硫酸亚铁中铁含量计算:样m cV 55.85 )6(722O Cr K Fe ?=ω,取三次测 定的平均值。 附注 ①二苯胺磺酸钠指示剂变绿时,不能使用。 ②酸性介质中Fe 2+易被空气氧化,故应立即滴定。
碱铜的分析方法
碱铜的分析方法 Prepared on 22 November 2020
碱铜分析方法 一、氰化亚铜的测定 1.精取1mL样品; 2.加过硫酸铵1g;加热至清澈; 3.加缓冲液10mL(浓氨水5mL) 4.加水50mL; 5.PAN 3滴。 6.用的EDTA滴定至溶液由蓝色变成绿色为止。 计算方法: CuCN(g/L)= (EDTA)cV× 二、游离NaCN的测定 1.精取1mL样品; 2.加水50mL; 3.加10%KI指示剂2mL; 4.用 AgNO3滴定至微浑浊。 计算: 游离NaCN(g/L)= (AgNO3)cV×49×2 三、酒石酸钾钠的测定 1.精取1mL样品; 2.加水50mL; 3.加10mL浓氨水; 4.用醋酸铅标准液滴定至开始浑浊。 计算: KNaC4H4O6·4H2O=醋酸铅滴定度T×V 滴定度:概念:指每毫升标准溶液相当于的待测组分的质量。表示符号:T (标准溶液/待测组分)或T(待测组分/标准溶液)。单位:g/ml、mg/ml。例:用T(EDTA/CaO)=ml的EDTA标准溶液滴定含钙离子的待测溶液,消耗了5ml。则待测溶液中共有。 计算方法: T=n*M/V 氰化铜镀液分析方法(安美特)
(A)铜含量之分析 1) 取样本2毫升。 2)加100毫升纯水。加 2 – 3 克过硫酸铵 ; 3)加热至清澈。 4)加10毫升氨水缓冲液。 5)加数滴 PAN 指示剂。 6)用 N EDTA 滴定至绿色为终点 . 金属铜 ( g/L ) = 所用 EDTA的毫升数 x 氰化铜 ( g/L ) = 所用 EDTA的毫升数 x (B)游离氰化根含量之分析 1) 取试液10毫升。 2)加50毫升纯水。 3)加入 10 毫升 ( 10 % ) KI 碘化钾。 4)用 N 硝酸银滴定至刚呈混浊为终点。游离氰化钠 ( g/L ) = N 硝酸银滴定数 x 游离氰化钾 ( g/L ) = N 硝酸银滴定数 x (C)氢氧化物含量之分析 1)取试液10毫升 ( 不用加水 )。 2)加10 滴橘橙黄 000 指示剂。 3)用 N 盐酸定至橙黄色为终点 . 氢氧化钠 ( g/L ) = N 盐酸滴定数 x 氢氧化钾 ( g/L ) = N 盐酸滴定数 x
片剂溶出度分析
片剂溶出度的影响因素分析 溶出度:是指药物从片剂等固体制剂在规定溶剂中溶出的速度和程度。是片剂质量控制的一个重要指标。 固体口服制剂的生物利用度与药物的溶出度密切相关。大多数口服固体制剂在给药后必须经吸收进入血液循环,达到一定血药浓度后方能奏效,从而药物从制剂释放出并溶解于体液是被吸收的前提,这一过程在生物药剂学中称作溶出,而溶出的速度和程度称溶出度,从药品检验的角度上讲,溶出度系指药物从片剂或胶囊等固体制剂在规定的溶剂中溶出的速度和程度。 《中国药典》关于溶出度测定品种在逐年增多,从85 年版开始,为7个品种,90 年版为44 个(4个胶囊),95年版127个,至2000年版药典采用溶出度进行制剂质量控制的品种为183个,2015年则更多,上升幅度之快,也进一步说明了对片剂进行溶出度测定对稳定制剂在质量,提高生物利用度的积极意义。 一般可以通过对辅料的选择,生产工艺的控制,测定条件等方面来分析讨论影响片剂溶出度的因素,提出合适的条件,切实提高片剂的溶出度,从而控制片剂的质量,以利提高片剂的生物利用度。 下文主要是针对一些网上查找及目前本公司现有的苯磺酸氨氯地平分散片生产时影响片剂溶出度的因素进行的可行性分析。 1 处方——辅料的选择 辅料应为“惰性物质”,性质稳定,不与主药发生反应,不影响主药含量测定,对药物的溶出和吸收无不良影响。实际上,辅料的理化性质是影响片剂质量的重要因素,对片剂的性质甚至药效可产生很大的影响,故应重视辅料的选择。 1.1苯磺酸氨氯地平分散片处方组成及处方量
1 苯磺酸氨氯地平---主要原料成分x g 2 微晶纤维素---填充剂(稀释剂)x g 3 磷酸氢钙---填充剂(稀释剂)x g 4 交联羧甲基纤维素钠---崩解剂x g 5 微粉硅胶(二氧化硅)---润滑剂(助流剂、抗粘剂)x g 6 羟丙甲基纤维素(HPMC)---润湿剂(粘合剂)适量 共制成1000片 1.1.1微晶纤维素---填充剂(稀释剂) 微晶纤维素:具有高度可变性,对主药有较大的容纳性,同时有强烈的吸水膨胀作用,能使水分快速进入片剂部、使片剂部和外部都迅速崩解,是较为优良的稀释剂、干燥黏合剂和崩解剂。 国外产品的商品名为Avicel,并根据粒径的不同有若干规格。国产微晶纤维素已在国得到广泛应用,但其质量有待于进一步提高,产品种类也有待于丰富。 另外,片剂中含20%微晶纤维素时崩解较好。成品硬度好,崩解性好。 1.1.2磷酸氢钙---填充剂(稀释剂) 磷酸氢钙属无机盐类,其性质稳定,无嗅无味,微溶于水,与多种药物均可配伍,制成的片剂外观光洁,硬度、崩解良好,对药物无吸附作用。 1.1.3交联羧甲基纤维素钠---崩解剂 交联羧甲基纤维素钠(Croscarmellose sodium,CCNa是交联化的纤维素羧甲基醚,大约有70%的羧基为钠盐型),由于交联键的存在,故不溶于水,但能吸收数倍于本身重量的水而膨胀,所以具有较好的崩解作用。 崩解剂的用量,理论上用量越多,膨胀性越好,但崩解时间不是最短,因为当崩解剂
碱铜的分析方法
碱铜分析方法 一、氰化亚铜的测定 1.精取1mL样品; 2.加过硫酸铵1g;加热至清澈; 3.加缓冲液10mL(浓氨水5mL) 4.加水50mL; 5.PAN 3滴。 6.用0.1N 的EDTA滴定至溶液由蓝色变成绿色为止。 计算方法: CuCN(g/L)= (EDTA)cV×89.56 二、游离NaCN的测定 1.精取1mL样品; 2.加水50mL; 3.加10%KI指示剂2mL; 4.用0.05M AgNO3滴定至微浑浊。 计算: 游离NaCN(g/L)= (AgNO3)cV×49×2 三、酒石酸钾钠的测定 1.精取1mL样品; 2.加水50mL; 3.加10mL浓氨水; 4.用醋酸铅标准液滴定至开始浑浊。 计算: KNaC4H4O6·4H2O=醋酸铅滴定度T×V 滴定度:概念:指每毫升标准溶液相当于的待测组分的质量。表示符号:T (标准溶液/待测组分)或T(待测组分/标准溶液)。单位:g/ml、mg/ml。例:用T(EDTA/CaO)=0.5mg/ml的EDTA标准溶液滴定含钙离子的待测溶液,消耗了5ml。则待测溶液中共有CaO2.5mg。 计算方法:T=n*M/V
氰化铜镀液分析方法(安美特) (A)铜含量之分析 1) 取样本2毫升。 2)加100毫升纯水。加2 – 3 克过硫酸铵; 3)加热至清澈。 4)加10毫升氨水缓冲液。 5)加数滴PAN 指示剂。 6)用0.1 N EDTA滴定至绿色为终点. 金属铜( g/L ) = 所用0.1N EDTA的毫升数x 3.18 氰化铜( g/L ) = 所用0.1N EDTA的毫升数x 4.48 (B)游离氰化根含量之分析 1) 取试液10毫升。 2)加50毫升纯水。 3)加入10 毫升( 10 % ) KI 碘化钾。 4)用0.1 N 硝酸银滴定至刚呈混浊为终点。 游离氰化钠( g/L ) = 0.1 N 硝酸银滴定数x 0.981 游离氰化钾( g/L ) = 0.1 N 硝酸银滴定数x 1.30 (C)氢氧化物含量之分析 1)取试液10毫升( 不用加水)。 2)加10 滴橘橙黄000 指示剂。 3)用 1.0 N 盐酸定至橙黄色为终点. 氢氧化钠( g/L ) = 1.0 N 盐酸滴定数x 4.0 氢氧化钾( g/L ) = 1.0 N 盐酸滴定数x 5.6 ( D ) 碳酸盐含量之分析 1)取样本10毫升。 2)加100毫升纯水。 3)加热至80 O C。 4)加20毫升20% 氯化钡。 5)用滤纸将沉淀物滤去。 6)用热水重复冲洗沉淀物, 直至滤出液不带碱性( 可用pH试纸测试)。 7)将整张滤纸放入滴定瓶。
铜及铜合金化学分析方法
DY/QW014-01 铜及铜合金化学分析方法 作业指导书 1 范围 本指导书规定了铜中锌的测定方法。 本指导书适用于铜中锌量的测定,测定范围:0.0005%~2.00% 。 2 方法提要 试料用硝酸或硝酸加氢氟酸,或盐酸加过氧化氢溶解后,使用空气-乙炔火焰于原子吸收光谱仪波长213.8nm 处测量锌的吸光度,基体铜的干扰在配制标准溶液系列时加入相应量的铜予以消除,合金中存在的其他元素不干扰测定。 3 试剂 除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。 3.1 氢氟酸(ρ1.15g/mL) 3.2 过氧化氢(ρ1.11g/mL) 3.3 过氧化氢(1+9) 3.4 盐酸(1+1) 3.5 硝酸(1+1) 3.6 硼酸溶液(40g/L) 3.7 铜溶液称:取10g 纯铜(锌质量分数小于0.00001%)置于500mL 烧杯中,加入70mL 硝酸(3.5)。加热溶解完全,煮沸除去氮的氧化物,冷却移入500mL 容量瓶中。用水稀释至刻度混匀,此溶液1mL 含20mg 铜。 3.8锌标准贮存溶液:称取0.5000g 纯锌(锌质量分数不小于99.9%),置250mL 烧杯中加入10mL 硝酸(3.5) ,加热至溶解完全,煮沸除去氮的氧化物,冷却后移入1000mL 容量瓶中,用水稀释至刻度,混匀。此溶液1mL 含500μg 锌。 3.9 锌标准溶液:移取20.00mL 锌标准储存溶液(3.8)置于500mL容量瓶中,加入100mL硝酸(1+1),用水稀释至刻度混匀。此溶液1mL含20μg锌。 4 仪器 4.1 原子吸收光谱仪附锌空心阴极灯 4.2 所用原子吸收光谱仪应达到下列指标
测定补血剂中硫酸亚铁的含量 实验报告
实验报告:测定补血剂中硫酸亚铁的含量 高一(11)班笑嘻嘻 摘要:通过测定高锰酸钾溶液反应的量,求出补血剂中硫酸亚铁的质量分数 关键词:硫酸亚铁高锰酸钾补血剂 一、实验仪器与药品 实验仪器:电子天平,烧杯,玻璃棒,100mL容量瓶,胶头滴管,滴定管,铁架台,洗耳球,10mL的移液管 实验药品:1mol/L的稀硫酸,硫酸亚铁固体,0.005mol/L高锰酸钾溶液,蒸馏水 二、实验步骤 检查滴定管是否漏液(旋转夹子至与滴定管垂直位置,加水,若不漏液,则说明滴定管完好) 倒出水,装入0.005mol/L高锰酸钾溶液,(打开旋转夹子,放出气泡)并使滴定管下端尖嘴也充满高锰酸钾溶液,加溶液直至溶液凹液面 最低处与2cm刻度线相平 将滴定管固定在铁架台上 检查容量瓶是否漏液(先向容量瓶内倒少许水,再将瓶塞拧上,用手指顶住,然后将容量瓶倒置,看是否漏液,再将塞子旋转180度, 重复上述过程,若两次均不漏液,则说明容量瓶完好)(气密性良好) 使用电子天平称取1.900g硫酸亚铁,记录其精准读数 将硫酸亚铁转移入烧杯内,用1mol/L的稀硫酸溶解,并用玻璃棒不断搅拌直至完全溶解 将溶解好的硫酸亚铁溶液,用玻璃棒的引流转移入100mL容量瓶 用1mol/L的稀硫酸洗涤烧杯,并将洗涤液用玻璃棒转移入100mL 容量瓶内
重复以上步骤2至3次 定容:向容量瓶内加入蒸馏水,直至离刻度线2至3cm处,改用胶头滴管逐滴加入蒸馏水,直至溶液凹液面最低处与刻度线相平 拧上容量瓶的塞子,用手指顶住塞子,上下震荡,达到摇匀目的 打开塞子,将10mL的移液管放入容量瓶内 捏紧洗耳球,放在玻璃吸管上,手慢慢松开,直至超过零刻度线,迅速拿开洗耳球并用手顶住 缓慢地松开手,直至溶液凹液面最低点与零刻度线相平 用手按紧玻璃吸管并将溶液完全转移至烧杯内 将上述烧杯放在滴定管正下方,调整滴定管位置,使其略高于烧杯 打开滴定管的夹子,开始滴定。一开始可稍快,接近12cm刻度线后,减慢速度,使高锰酸钾溶液逐滴滴入烧杯内,此过程中不断振荡烧 杯,使溶液之间反应更加完全 当加入一滴高锰酸钾溶液后,烧杯内硫酸亚铁溶液由紫红色变为粉红色时,迅速关上夹子,记录滴定管读数 注:以上各部均在水或无药品的情况下模拟后再实验 三、实验现象和结果记录 实验现象:当加入最后一滴高锰酸钾溶液,硫酸亚铁溶液由无色变为粉红色 实验记录: 1、硫酸亚铁精准质量1.900g 2、滴定管读数
化学分析专业技术工作总结doc
化学分析专业技术工作总结 篇一:任工程师以来的专业技术工作报告(分析化学专业) 任工程师以来的专业技术工作报告 本人***,男,汉,1975年10月出生,广东省韶关市**县人。1998年毕业于华南理工大学应用化学专业,获学士学位。1998年6月到广州****分析测试中心工作,XX年11月取得工程师专业技术资格,被聘为工程师。 一、专业知识 被聘工程师以来,本人能学习吸收先进的科技知识,不断更新和充实自己的知识结构,掌握本专业国内外现状及发展趋势,运用基础理论指导科研工作。 XX年11月至今,本人在广州*****分析测试中心从事化学分析与研究工作。本人从事贵金属分析工作已经有9年多的时间,能学习吸收先进的科技知识,不断更新和充实自己的知识结构,掌握了多种贵金属分析方法,是贵金属分析的中坚力量。具有较强的科研创新能力,积极进行科技交流活动,目前在各种核心刊物上共发表论文多篇。 XX年,参加全国专业技术人员计算机应用能力考试,取得了Word 97、Windows98、Network等三个科目的合格证书,XX年又取得了Excel XX、Powerpoint XX等二个科目的合格证书。 XX年,通过了中华人民共和国人事部统一组织的全国职
称外语A级考试,成绩优良。 XX年—XX年,中南大学材料工程专业工程硕士研究生,以优良成绩完成了所有基础课程,已进入写硕士研究生论文阶段。 二、主要工作经历和业绩成果 XX年12月至XX年12月作为主要参加者(在项目中排名第二)参与****技术创新项目“贵金属二次资源中贵金属分析方法研究”。在样品前处理技术及分析测试方面开展了大量的、系统的研究工作,取得研究成果如下:在样品前处理方面,提出了磨样机制取杂铜样品的方法和对高铜含量样品无需预先分离而直接用火试金法分离样品中的金、铂和钯;在分析 测试方面,采用原子吸收光谱法、电感耦合发射光谱法、滴定法和重量法,解决了贵金属二次资源中金、铂和钯的测定问题。该项目部分成果已应用于实际检测工作中,并取得了较好的经济效益,具有广泛的应用前景。该项目XX年12月通过了由中国有色金属工业协会组织的科学技术成果鉴定,并获得XX年度中国有色金属工业协会科学技术奖三等奖。 XX年主要作为参加者参与项目“铜阳极泥中银的分析方法研究”。研究提出了一种简单、快速、结果准确的铜阳极泥中银的分析方法,XX年11月申请发明专利,XX年3月21
USP-1092-溶出度试验的开发和验证(中英文对照版)
(1092)溶出度试验的开发和验证【中英文对照版】 INTRODUCTION 前言 Purpose 目的 The Dissolution Procedure: Developmentand Validation <1092> provides a comprehensive approach covering items to considerfor developing and validating dissolution procedures and the accompanyinganalytical procedures. It addresses the use of automation throughout the testand provides guidance and criteria for validation. It also addresses thetreatment of the data generated and the interpretation of acceptance criteriafor immediate- and modified-release solid oral dosage forms. 溶出实验:开发和验证(1092)指导原则提供了在溶出度方法开发和验证过程中以及采用相应分析方法时需要考虑的因素。本指导原则贯穿溶出度实验的全部过程,并对方法提供了指导和验证标准。同时它还涉及对普通制剂和缓释制剂所生成的数据和接受标准进行说明。 Scope 范围 Chapter <1092> addresses the development andvalidation of dissolution procedures, with a focus on solid oral dosage forms.Many of the concepts presented, however, may be applicable to other dosageforms and routes of administration. General recommendations are given with theunderstanding that modifications of the apparatus and procedures as given in USP general chapters need to be justified. <1092>章节讨论了溶出度实验的开发和验证,重点是口服固体制剂。所提出的许多概念也可能适用于其他剂型和给药途径。关于设备和方法的修改部分在USP通则中给出了合理的说明。 The organization of <1092> follows the sequence of actions often performed inthe development and validation of a dissolution test. The sections appear inthe following sequence. 在进行溶解度实验的开发和验证时,常遵循指导原则<1092>,具体内容如下:1. PRELIMINARY ASSESSMENT (FOR EARLY STAGES OF PRODUCTDEVELOPMENT/DISSOLUTION METHOD DEVELOPMENT) 1.前期评估(对产品开发以及溶出度方法开发的前期研究评估) 1.1 Performing Filter Compatibility 1.1滤膜相容性研究 1.2 Determining Solubility and Stability of DrugSubstance in Various Media 1.2原料药在不同溶出介质中溶解度测定和稳定性研究
贫血药硫酸亚铁的制备和测定
贫血药硫酸亚铁的制备与测定 摘要 硫酸亚铁为蓝绿色单斜结晶或颗粒。无气味。暴露在乾燥空气里容易风化,晶体的表面渐渐变为白色粉末,但易为空气氧化而呈黄色或铁锈色。湿空气中表面氧化成棕色的碱式硫酸铁。在56.6℃成为四水合物,在65℃时成为一水合物。溶于水,几乎不溶于乙醇。其水溶液冷时在空气中缓慢氧化,在热时较快氧化。加入碱或露光能加速其氧化。无水硫酸亚铁是白色粉末,含结晶水的是浅绿色晶体,晶体俗称“绿矾”,溶于水水溶液为浅绿色。高温分解2 FeSO 4·7 H 2O ==高=Fe 2O 3+SO2↑+SO 3↑+14 H 2O 。硫酸亚铁是还原力的酸性盐,它的酸性与硫酸铝及硫酸锌比则较弱。硫酸亚铁的七水合物是绿色小晶体,无臭有毒。 硫酸亚铁为抗贫血药。它可通过铁屑与稀硫酸的反应制成,从水溶液中结晶一般FeSO4- 7H2O,。由于硫酸亚铁的亚铁离子具有还原性,在酸性条件下,可与 高锰酸钾发生发应,因此可以利用已知准确浓度的高锰酸钾溶液测定产品中的硫酸亚铁的含量,微过量的高锰酸根离子使溶液呈现微红色,指示终点。 硫酸亚铁可于制铁盐、氧化铁颜料、媒染剂、净水剂、防腐剂、消毒剂等;医药上作抗贫血药、局部收敛剂及补血剂,可用于子宫肌瘤引起的慢性失血;分析试剂及制铁氧体原料;作为饲料添加剂的铁强化剂;农业上可用作农药,能防治小麦黑穗病,苹果和梨的疤痂病、
果树的腐烂病;食用级用作营养增补剂,如铁质强化剂、果蔬发色剂。也可用作肥料,作为植物铁元素的补充剂,防治植物应缺铁而发生生理性病害,使植物叶色失绿。能除去树干的青苔及地衣。是制造磁性氧化铁、氧化铁红和铁蓝无机颜料、铁催化剂及聚硫酸铁的原料。此外还用作色谱分析试剂等。 硫酸亚铁储存于阴凉、通风的库房。远离火种、热源。防止阳光直射。包装必须密封,切勿受潮。应与氧化剂、碱类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物 关键词铁屑硫酸亚铁减压过滤高锰酸钾 实验部分 一、实验目的: 1、了解无机药物的一般制备方法。 2、了解无机药物的常用检测指标与检测方法。 二、实验原理: 本品是治疗缺铁性贫血的特效药。临床上主要用于慢性失血(月经过多、痔疮出血、子宫肌瘤出血、勾虫病失血等)、营养不良、妊娠、儿童发育期等引起的缺铁性贫血。用铁屑与稀硫酸反应可以制备硫酸亚铁,反应方程式如下: Fe + H2SO4 FeSO + H2 4 从水溶液中结晶出来一般为FeSO4?7H2O,由于硫酸亚铁中的
碱铜的分析方法精编WORD版
碱铜的分析方法精编 W O R D版 IBM system office room 【A0816H-A0912AAAHH-GX8Q8-GNTHHJ8】
碱铜分析方法 一、氰化亚铜的测定 1.精取1mL样品; 2.加过硫酸铵1g;加热至清澈; 3.加缓冲液10mL(浓氨水5mL) 4.加水50mL; 5.PAN 3滴。 6.用0.1N 的EDTA滴定至溶液由蓝色变成绿色为止。 计算方法: CuCN(g/L)= (EDTA)cV×89.56 二、游离NaCN的测定 1.精取1mL样品; 2.加水50mL; 3.加10%KI指示剂2mL; 4.用0.05M AgNO3滴定至微浑浊。 计算: 游离NaCN(g/L)= (AgNO3)cV×49×2 三、酒石酸钾钠的测定 1.精取1mL样品;
2.加水50mL; 3.加10mL浓氨水; 4.用醋酸铅标准液滴定至开始浑浊。计算: KNaC 4H 4 O 6 ·4H 2 O=醋酸铅滴定度T×V 滴定度:??概念:指每毫升标准溶液相当于的待测组分的质量。表示符号:T (标准溶液/待测组分)或T(待测组分/标准溶液)。单位:g/ml、mg/ml。 例:用T(EDTA/CaO)=0.5mg/ml的EDTA标准溶液滴定含钙离子的待测溶液,消耗了5ml。则待测溶液中共有CaO2.5mg。 计算方法: T=n*M/V 氰化铜镀液分析方法(安美特) (A)铜含量之分析 1) 取样本2毫升。 2)加100毫升纯水。加 2 – 3 克过硫酸铵 ; 3)加热至清澈。 4)加10毫升氨水缓冲液。 5)加数滴 PAN 指示剂。 6)用 0.1 N EDTA 滴定至绿色为终点 . 金属铜 ( g/L ) = 所用0.1N EDTA的毫升数 x 3.18
化学药品普通口服固体制剂溶出度方法验证易忽视的几个问题
化学药品普通口服固体制剂溶出度方法验证易忽视的几个问题 审评四部审评八室郑国钢 溶出度系指药物从片剂或胶囊剂等固体制剂在规定的溶出介质中溶出的速度和程度,是一种模拟口服固体制剂在胃肠道中的崩解和溶出的体外试验方法。它是评价药物制剂质量的一个重要指标。 一个完整的溶出度方法验证主要包括以下内容:(1)溶出介质及介质体积的选择;(2)溶出方法(转篮法与桨法)及其转速的选择;(3)溶出量测定方法的验证,(4)溶出度均一性试验(批内)、重现性试验(批间)等。审评中发现提供溶出度方法验证资料往往不全,应引起申报单位注意。 (一)溶出度测定方法的选择 溶出度测定方法的选择包括溶出介质及介质体积的选择、溶出方法(转篮法与桨法)及其转速的选择。根据《化学药物质量标准建立的规范化过程技术指导原则》,溶出介质通常采用水、0.1mol/L盐酸溶液、缓冲液(pH值3~8为主)。对在上述溶出介质中均不能完全溶解的难溶性药物,可加入适量的表面活性剂,如十二烷基硫酸钠等。检查方法转篮法以100转/分钟为主;桨法以50转/分钟为主。 应该注意的是(1)溶出介质的体积需使药物符合漏槽条件,大杯法(第一、二法)常用体积为500~1000ml,小杯法(第三法)常用体积为100~250ml。部分品种为满足在溶出量测定时药物浓度的需要,可采用低于上述限度范围的溶剂。(2)介质、方法、转速的选择一般根据溶出曲线测定结果确定。部分资料简单地通过比较主药在各溶剂中的溶解度来选择溶出介质,我们认为相同的溶剂可能会导致对不同制剂溶出行为的差异,且工艺的选择、辅料的加入能改变主药在不同溶剂中的溶解行为,故仅考虑溶解度是不适合的;部分资料根据单点测定结果进行方法和转速选择,如盐酸左旋多巴甲酯片申报资料中采用篮法100rpm和桨法75rpm比较,结果45min溶出均大于95%,故选择桨法75rpm测定溶出度,单点测定不能很好区分不同处方和生产工艺的溶出情况,也影响溶出拐点的确定,故不合适;考虑今后大生产工艺,申报单位确定溶出度检查方法中常采用高转速或延长取样时间,取样时间与溶出曲线的拐点位置相距较远,导致溶出度测定区分能力不明显,溶出度取样时间常选择溶出曲线的拐点处后推10~20分钟,如果时间较长或太短,可通过适当提高或减低转速等手段重新测定溶出曲线。(3)如是仿制已有国家标准的药品,则
硫酸亚铁—硫酸亚铁的测定—氧化还原滴定法
方法名称:硫酸亚铁—硫酸亚铁的测定—氧化还原滴定法 应用范围:本方法采用氧化还原滴定法测定硫酸亚铁(FeSO4·7H2O)的含量。 本方法适用于硫酸亚铁的测定。 方法原理:取供试品适量,加硫酸与水溶解后,立即用高锰酸钾滴定液(0.02mol/L)滴定至溶液显持续的粉红色。每1mL高锰酸钾滴定液(0.02mol/L)相当于27.80mg的(FeSO4·7H2O)。计算,即得。 试剂: 1. 水(新沸放置至室温) 2. 硫酸 3. 高锰酸钾滴定液(0.02mol/L) 4. 基准草酸钠 仪器设备: 试样制备: 1. 高锰酸钾滴定液(0.02mol/L) 配制:取高锰酸钾3.2g,加水1000mL,煮沸15分钟,密塞,静置2日以上,用垂熔玻璃滤器滤过,摇匀。 标定:取在105℃干燥至恒重的基准草酸钠约0.2g,精密称定,加新沸过冷水250m与硫酸10mL,搅拌使溶解,自滴定管中迅速加入本液约25mL(边加边振摇,以免产生沉淀),待褪色后,加热至65℃,继续滴定至溶液显微红色并保持30秒钟不褪,当滴定终了时,溶液温度应不低于55℃。每1mL高锰酸钾滴定液(0.02mol/L)相当于6.70mg的草酸钠。根据本液的消耗量与草酸钠的取用量,算出本液的浓度,即得。 2. 基准草酸钠 贮藏:置棕色玻璃瓶中,密闭保存。 操作步骤:精密量取本品0.5g,加硫酸与新沸过的冷水各15mL溶解后,立即用高锰酸钾滴定液(0.02mol/L)滴定至溶液显持续的粉红色。每1mL高锰酸钾滴定液(0.02mol/L)相当于27.80mg的(FeSO4·7H2O)。 注1:“精密称取”系指称取重量应准确至所称取重量的千分之一,“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精度要求。 注2:“水分测定”用烘干法,取供试品2~5g,平铺于干燥至恒重的扁形称瓶中,厚度不超过5mm,疏松供试品不超过10mm,精密称取,打开瓶盖在100~105℃干燥5小时,将瓶盖盖好,移置干燥器中,冷却30分钟,精密称定重量,再在上述温度干燥1小时,冷却,称重,至连续两次称重的差异不超过5mg为止。根据减失的重量,计算供试品中含水量(%)。
铜及铜合金国家标准化学分析方法修订
铜及铜合金管材内表面碳含量的测定 编制说明 浙江省冶金产品质量检验站有限公司 二0一六年七月
《铜及铜合金管材内表面碳含量的测定方法》 标准(送审稿)编制说明 1任务来源 根据国标委《国家标准委关于下达<钢铁行业原料场能效评估导则>等135项国家标准制修订计划的通知》(国标委综合〔2015〕59号20152283-T-610)、全国有色金属标准化技术委员会“关于转发2015年第二批有色金属国家、行业标准制(修)订项目计划的通知”(有色标委[2015]29号)及陕西西安有色标准落实会确定《铜及铜合金管材内表面碳含量的测定》(项目编号:20152283-T-610)由浙江省冶金产品质量检验站有限公司负责起草。浙江省冶金产品质量检验站有限公司、浙江海亮股份有限公司、中铝洛阳铜业有限公司为主要起草单位。 2工作简况 2.1立项目的和意义 我国是目前世界上最大的铜加工材生产国与消费国。铜管产量已稳居世界第一,产量占全世界的一半以上,在产品质量、品种及技术水平等方面均已达到世界发达国家水平。然而我国每年都有大量铜管、铜管件因碳膜引起的电化学腐蚀而报废,造成巨大的经济损失。制定《铜及铜合金管材内表面碳含量的测定》标准后,有利于铜管生产、消费企业,通过测定铜管、铜管件内表面碳含量,使内表面碳含量过高成为不合格品,不使用到下游产品中去,从而减少应碳膜引起的电化学腐蚀,增加下游产品的使用寿命,降低经济损失。 2.2申报单位简况 浙江省冶金产品质量检验站有限公司是具有独立法人资格的第三方公正检测机构,浙江省政府第一批授权成立的省级质检机构,我省冶金(有色)行业产品质量检测的专业检验机构,浙江省高级人民法院对外委托司法鉴定机构。 公司拥有一支具有丰富经验的专业技术人员队伍,其中高级工程师5名,检测人员具有较高的专业知识、技术能力和评判能力。公司以高标准进行实验室建设,装备了具有国际、国内先进水平的仪器设备,拥有德国OBLF公司QSG750三基体单火花直读光谱仪、德国MM6宽视野金相显微镜、日本岛津AA-6501F原子
硫酸亚铁分光光度法测定工业盐中的亚铁氰化钾
硫酸亚铁分光光度法测定工业盐中的亚铁氰化钾 1 原理 亚铁氰化钾在酸性条件下与硫酸亚铁作用,生成白色亚铁氰化亚铁沉淀,受空气氧化生成普鲁士蓝,在670nm波长下用光度法测定。 2 试荆和溶液 2.1 硫酸溶液(1+20) 2.2 硫酸亚铁溶液(40g/L):称取硫酸亚铁(FeSO 4·7H 2 0)40g,溶于1L硫酸溶 液(2.1)中,摇匀,过滤。 2.3 氯化钠 2.4 亚铁氰化钾标准溶液:准确称取亚铁氛化钾{K 4[Fe(CN) 6 ·3H 2 0)0.1993 g, 精确到0.0001 g,加少量水溶解,稀释至100 mL 2.5 亚铁氰化钾标准工作溶液:吸取亚铁氰化钾标准溶液(2.4 )5.00mL,稀 释至100 mL 2.6 氢氧化钠溶液(1.0mol/L):称取氢氧化钠10.0g ,溶于250m L水中。 3 仪器设备 一般实验室仪器及符合GB/T 9721规定的分光光度计。 4 分析步骤 4.1 标准曲线制作 吸取亚铁氰化钾标准工作溶液(2.5)0,10,20,30,40,50μg于50m L比色管中,加氯化钠(2.3)5g,加水溶解。加40 g/L硫酸亚铁溶液(2.2)4mL,加水稀释至刻度,摇匀,放置10 min,用1 cm(或3 cm,5 cm)比色池,在波长670 nm 处,以试剂空白为参比测定吸光度。以吸光度为纵坐标,对应亚铁氰根微克数为横坐标绘制标准曲线。 4.2 样品的测定 称取样品5.0g 置于50m L比色管中,加40ml水溶解(若溶液混浊应过滤),加40g/L硫酸亚铁溶液(2.2)4 ml,以下同4.1操作,由测得的吸光度从标准曲线上查出亚铁氰根质量。
食品添加剂硫酸亚铁编制说明(征)
《食品安全国家标准食品添加剂硫酸亚铁》(征求意见稿)编制说明 一任务来源与项目编号、参与协作单位、简要起草过程、主要起草人及其所承担的工作等根据卫生部下达的2010年食品安全国家标准制修订计划项目的有关要求,中国石油和化学工业联 行业文档 (word可编辑版) 合会将于2011年完成《食品添加剂硫酸亚铁》的制定任务,计划编号为:20100102。该标准由中海油天津化工研究设计院、诸暨丰盈化工有限公司、南通励成生物工程有限公司、徐州摩尔医药试剂厂等单位共同负责起草。本标准主要起草人:王彦、傅杏新、刘中士、刘建昆等。 全国化学标准化技术委员会无机化工分会接到制定标准任务,查阅了国内外标准及有关技术资料,并向生产、使用单位发函,进行了调查并广泛征求对修订标准的意见,在此基础上提出了文献小结。 2010年10月22日在江苏南京溧水召开了制定食品添加剂硫酸亚铁国家标准工作方案会。会上代表
对此标准进行了讨论。与会代表就此标准的名称、指标项目和指标参数、分析方法等内容进行了深入、细致的讨论,提出了工作方案,并对各项工作任务及工作进度做了详细的安排。在前一段的工作基础上,由负责起草单位提出标准草案征求意见稿和编制说明,发至各个生产厂和相关企业单位征求意见。 2011年8月8日至12日在青海省西宁市召开了制定食品添加剂硫酸亚铁国家标准工作会。会上标准制定的参与单位对征求意见稿所存在的问题发表意见和建议,会后标准起草人对稿件进行修改后上交卫生部相关部门,用于征求意见稿。 主要起草人中海油天津化工研究设计院的王彦等。主要负责标准的前期调查,检索并翻译相关国外资料,编写文献小结,参加标准各个阶段的工作会议,进行标准的试验验证工作,编写标准各个阶段的稿件等。 二与我国有关法律法规和其他标准的关系 在GB2760—2011《食品添加剂使用卫生标准》的附录C(规范性附录)食品工业用加工助剂使用名单中的表C.1 食品工业用加工助剂使用名单(不含酶制剂),第47项,用作絮凝剂,在饮料(水处理)和啤酒的加工工艺中使用。(GB 2760—2007中给出食品工业用加工助剂的定义:保证食品加工能顺利进行的各种物质,与食品本身无关。如助滤、澄清、吸附、润滑、脱模、脱色、脱皮、提取溶剂、发酵用营养物质等。) 在GB 14880—94《食品营养强化剂使用卫生标准》中规定了增加营养价值而加入食品中的天然或人工的营养素。其中给出: 三国外相关法律、法规和标准情况的说明 目前搜集到的国外标准有:美国食品化学品法典第七版[FCC 7(2011)]《硫酸亚铁》(英文版)(以下简称为FCC)和日本食品添加物公定书(2007)Ⅷ(日文版)(以下简称为日本公定书)。联合食品添加剂专家委员会(JECFA)“硫酸亚铁”[JECFA专论1(2006)JECFA第53届(1999)]。 本次制定我国标准修改采用FCC。 四标准的制修订与起草原则 1 制标原则 ①积极采用国外先进标准; ②有利于促进技术进步,提高产品质量; ③有利于合理利用资源,提高经济效益; ④符合用户要求,保护消费者利益,促进对外贸易。
溶出度(释放度)检测方法建立及验证标准操作规程
溶出度(释放度)检测方法建立及验证标准操作规程 1.目的 为保证检测工作的可靠性和可重现性,在未知样品的检测前必须对检测方法进行验证以证明所采用的检测方法适合于相应的检测要求。 2.范围 建立药品质量标准时、药品生产工艺变更时、制剂组分发生变更时、原分析方法修订时均应进行溶出度或释放度测定的方法学的验证。 3.责任人 检测员、项目负责人、各级项目经理:要求系统、全面验证含量测定方法并记录整理验证数据。 4.程序 4.1 验证内容(以下为溶出度验证方法,释放度具体详见化学药物口服缓释制剂药学研究技术指导原则。) 溶出度系指药物从片剂或胶囊剂等固体制剂在规定的溶出介质中溶出的速度和程度,是一种模拟口服固体制剂在胃肠道中的崩解和溶出的体外试验方法。它是评价药物制剂质量的一个重要指标。 一个完整的溶出度方法验证主要包括以下内容:(1)溶出介质及介质体积的选择;(2)溶出方法(转篮法与桨法)及其转速的选择;(3)溶出量测定方法的验证,(4)溶出度均一性试验(批内)、重现性试验(批间)等。 4.2 验证方法 (一)溶出度测定方法的选择 溶出度测定方法的选择包括溶出介质及介质体积的选择、溶出方法(转篮法与桨法)及其转速的选择。根据《化学药物质量标准建立的规范化过程技术指导原则》,溶出介质通常采用水、0.1mol/L盐酸溶液、缓冲液(pH值3~8为主)。对在上述溶出介质中均不能完全溶解的难溶性药物,可加入适量的表面活性剂,如十二烷基硫酸钠等。检查方法转篮法以100转/分钟为主;桨法以50转/分钟为主。 应该注意的是(1)溶出介质的体积需使药物符合漏槽条件,大杯法(第一、二法)常用体积为500~1000ml,小杯法(第三法)常用体积为100~250ml。
