ICP-AES测定工业废水实验报告

仪器分析实验报告:AES 2012年_05月13日
实验一膜过滤/电感耦合等离子体发射光谱法(ICP-AES)
测定工业废水中铬、锰、铁、镍、铜
姓名:饶建国教师评定________________
一、实验目的
1. 熟悉电感耦合等离子体原子发射光谱仪(ICP-AES)的构造及工作原理;
2. 了解全谱直读等离子体原子发射光谱仪的基本操作;
3. 了解实际样品预处理及ICP-AES在多元素同时测定中的应用。
二、实验原理
电感耦合等离子体(ICP)光源是利用高频感应加热原理,使流经石英管的工作气体(氩气)电离而产生的具有环状结构的高温火焰状等离子焰炬。当试液经过蠕动泵入雾化器后,被雾化的试液以气溶胶的形式进入到等离子焰炬的环形通道中,在其高温作用下被蒸发、原子化、激发并发射出相应的元素特征谱线。ICP光源激发能力强、稳定性好、基体效应小、检出限低、且无自吸效应,线性范围可达几个数量级,是目前性能最好、应用最为广泛的原子发射激发光源。
ICP光源中试样原子发射的各种波长辐射经分光系统后进入检测器被检测,可根据试样激发后是否产生某元素的特征辐射波长进行定性分析;在一定浓度范围及一定工作条件下(如ICP光源的入射功率、观测高度、载气流量等),发射谱线强度与试液中待测元素含量成正比,即I=kc,据此可进行定量分析。原子发射光谱仪中普遍采用的光电检测器,如光电倍增管等,是将入射光强转换成相应大小的电信号进行检测,因此测量信号可等同于入射光强,
采用光电检测器的原子发射光谱仪称为光电直读光谱仪,有多道直读光谱仪、单道扫描光谱仪和全谱直读光谱仪等三种类型,其中全谱直读光谱仪采用了中阶梯光栅分光系统和面阵型电荷转移检测器(CID),可在分光后同时对各波长辐射检测,从而真正体现了原子发射光谱可进行多元素同时检测这一显著优点,而使之成为痕量金属元素分析中最有力的工具之一。全谱直读光谱仪可在一分钟内完成原子发射法所能测定的70余种元素的定性及定量分析,是目前原子发射光谱仪的主流类型,本实验即是采用这种仪器测定工业废水中铬、锰、铁、镍、铜等重金属元素。采集的废水试样中若有悬浮物需经0.45 μm滤膜过滤后才可进行测定。
三、仪器与试剂
1. 仪器
全谱直读等离子体原子发射光谱仪:Prodigy,美国Leeman公司
2. 试剂
高纯Ar
稀硝酸溶液:5%(优级纯)
超纯水
待测水样:是否需要过滤视具体情况而定
铬、锰、铁、镍、铜标准贮备液:均为1.0 mg?mL-1(国家标准物质中心)
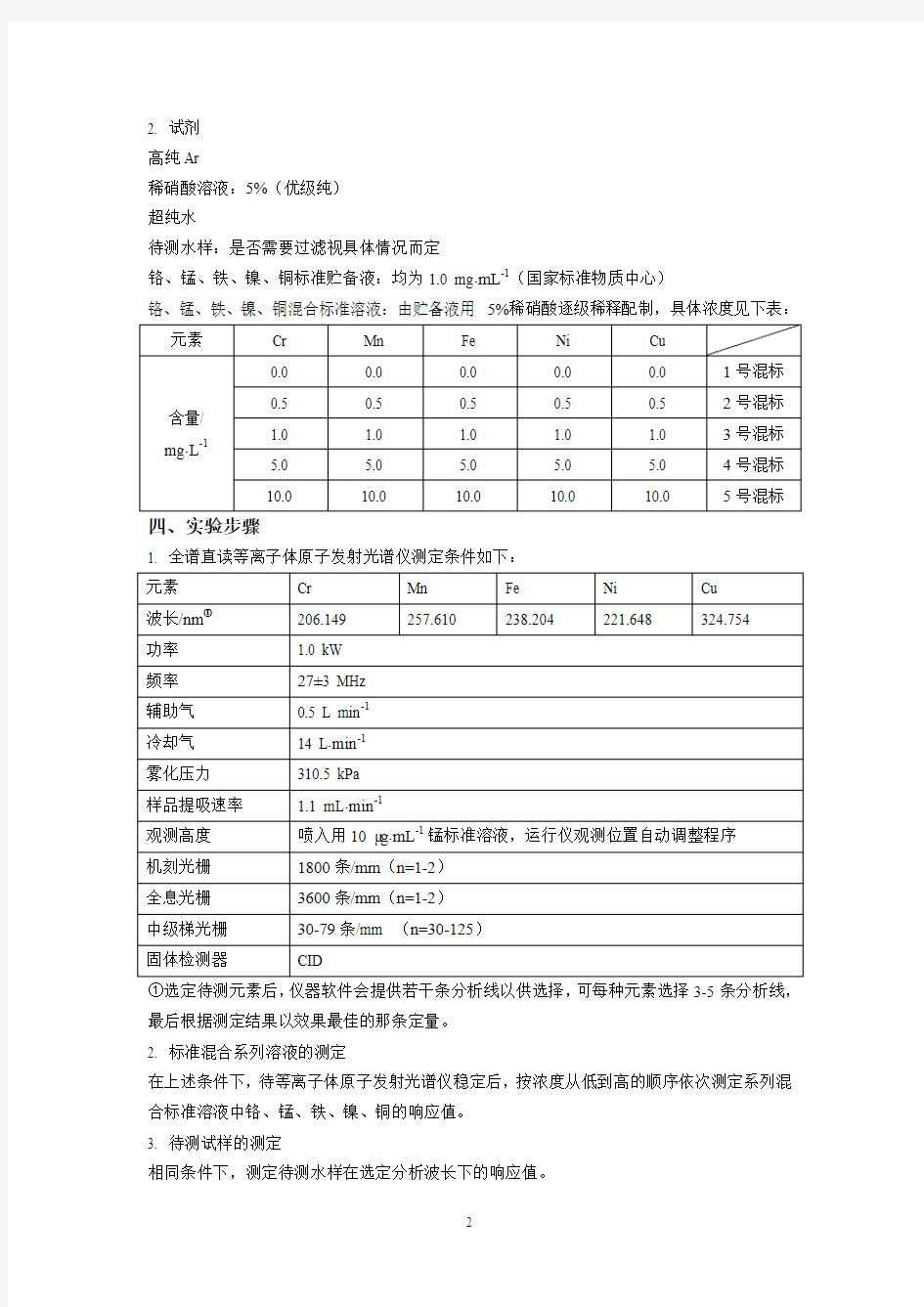
铬、锰、铁、镍、铜混合标准溶液:由贮备液用5%稀硝酸逐级稀释配制,具体浓度见下表:元素Cr Mn Fe Ni Cu
含量/ mg?L-10.0 0.0 0.0 0.0 0.0 1号混标
0.5 0.5 0.5 0.5 0.5 2号混标
1.0 1.0 1.0 1.0 1.0 3号混标5.0 5.0 5.0 5.0 5.0 4号混标10.0 10.0 10.0 10.0 10.0 5号混标
四、实验步骤
1. 全谱直读等离子体原子发射光谱仪测定条件如下:
元素Cr Mn Fe Ni Cu
波长/nm①206.149 257.610 238.204 221.648 324.754
功率 1.0 kW
频率27±3 MHz
辅助气0.5 L min-1
冷却气14 L?min-1
雾化压力310.5 kPa
样品提吸速率 1.1 mL?min-1
观测高度喷入用10 μg?mL-1锰标准溶液,运行仪观测位置自动调整程序
机刻光栅1800条/mm(n=1-2)
全息光栅3600条/mm(n=1-2)
中级梯光栅30-79条/mm (n=30-125)
固体检测器CID
①选定待测元素后,仪器软件会提供若干条分析线以供选择,可每种元素选择3-5条分析线,最后根据测定结果以效果最佳的那条定量。
2. 标准混合系列溶液的测定
在上述条件下,待等离子体原子发射光谱仪稳定后,按浓度从低到高的顺序依次测定系列混合标准溶液中铬、锰、铁、镍、铜的响应值。
3. 待测试样的测定
相同条件下,测定待测水样在选定分析波长下的响应值。
五、数据记录处理
要求:用origin 等绘图软件绘制各元素的标准曲线,根据绘图软件提供的拟合方程和待测水样中各元素的响应值计算待测水样中铬、锰、铁、镍、铜的含量(以mg L -1表示)。实验报告中应提供标准曲线图、拟合方程及相关系数。
Cr 元素 测定波长:205.552
2
4
6
8
10
015000
30000
45000
60000
75000
i n t e n s i t y
Cr-mg/L
R=0.99998 A=114.25896 B=7753.84064 Y=114.25896+7753.84064x Y=23340 C Cr =3.01 Cu 元素 波长:324.75
2
4
6
8
10
200000
400000
600000
800000
1000000
i n t e n s i t y
Cu-mg/L
R=0.9998 A=7817.27577 B=98385.91643 Y=781.27577+98385.91643x Y=243774 C Cu =2.40
Ni 元素 测定波长:341.476
2
4
6
8
10
20000
40000
60000
80000
100000
120000
i n t e n s i t y
Ni-mg/L
R=0.9993 A=851.59677 B=11080.72581 Y=29736 C Ni =2.61
Zn 元素 测定波长:213.856
2
4
6
8
10
050000
100000150000200000250000300000
350000400000450000i n t e n s i t y
Zn-mg/L
R=0.99997 A=912.45961 B=44955.86072 Y=19848 C Zn =0.42
Pb 元素 测定波长 :283.305
2
4
6
8
10
01000
2000
3000
4000
5000
6000
Pb
Linear Fit of Data1_B
M e a n
Conc./ppm
R=0.99923 A=-286.48398 B=551.06546 Y=410 C Pb =0.224PPm
六、Prodigy 全谱直读等离子体原子发射光谱仪的操作及注意事项
1. 开机:先开氩气(调到0.65 Mpa ,小于0.3 Mpa 就要换气),然后按顺序开动变压器、冷却水(只能使用蒸馏水)、固态检测器冷却系统(设置不能低于20℃)以后,开启计算机,启动ICP-AES 光谱仪,再打开计算机中的Salsa 软件,等到二次连接成功以后,关闭软件,把检测系统的温度设定在-44℃,再次打开软件,然后让其进行预热到35℃,大概需要1个小时。
2. 调试:(1)建立方法和命名;(2)元素和波长的选择;(3)输入标准浓度;(4)设置分析参数(一般很少改动)。
3. 测试:(1)点燃等离子体;(2)等离子体定位;(3)波长校准;(4)波长扫描和确认;(5)背景校正;(6)标准曲线的测量和确认;(7)样品分析
4. 关机:关闭仪器前吸入清洗溶液(2%的硝酸溶液)10分钟,然后吸入去离子水10分钟,在线清洗样品引入系统,然后按Extinguish 按钮熄火,再通一段时间氩气,使固态检测器需要驱气干燥后再关闭;然后依次退出软件操作,把软件检测系统的温度设定在20℃ 后,打开软件,等温度到了20℃,关闭软件,松开蠕动泵,关闭计算机,按ICP 的红色按钮关闭仪器,最后依次关闭冷却水,稳压器。 七、思考题
1. 比较原子发射光谱法和原子吸收光谱法在样品分析过程中,各有那些优缺点?
答:原子吸收光谱法是基于物质所产生的原子蒸气对特定谱线的吸收作用来进行定量分析的
方法.
原子发射光谱法是基于原子的发射现象,而AAS则是基于原子的吸收现象.二者同属于光
学分析方法.
原子吸收法的选择性高,干扰较少且易于克服。
由于原于的吸收线比发射线的数目少得多,这样谱线重叠的几率小得多。而且空心阴极灯
一般并不发射那些邻近波长的辐射线经,因此其它辐射线干扰较小。
原子吸收具有更高的灵敏度。
在原子吸收法的实验条件下,原子蒸气中基态原于数比激发态原子数多得多,所以测定的
是大部分原子。
原子吸收法比发射法具有更佳的信噪比
这是由于激发态原子数的温度系数显著大于基态原子。
2.为什么ICP光源能够提高原子发射光谱分析的灵敏度和准确度。
答:1)、温度高,惰性气氛,原子化条件好,有利于难熔化合物的分解和元素激发,有很高
的灵敏度和稳定性;
2)、“趋肤效应”有效消除自吸现象,线性范围宽(4~5个数量级);
3)、ICP中电子密度大,碱金属电离造成的影响小;
4)、Ar气体产生的背景干扰小;
5)、无电极放电,无电极污染
3.通过实验,你认为实验过程中各步骤应该注意哪些事项?
答:1)、氩气的纯度:等离子光谱仪所用氩气的纯度要使用使用高纯氩气,一般要4个9
以上,氩气不纯会造成点不着火或ICP熄火
2)、气流稳定:ICP的气体控制系统是否稳定正常地运行,直接影响到仪器测定数据的好坏,如果气路中有水珠、机械杂物杂屑等都会造成气流不稳定
3)、雾化器:是进样系统中最精密,最关键的部份,需要很好的维护和使用。要定期的清理,特别是测定高盐溶液之后,如果不及时清洗,会造成雾化器堵塞,每次测定完以后,关机之前要把吸管放进稀酸溶液清洗一会。雾化器堵塞以后,要用手堵住喷嘴反吹,千成不要用铁丝等硬物去捅
4)、炬管:每次安装炬管,位置一定要装好,防止炬管烧掉,作样时尤其是高盐份样品,炬管喷嘴会积有盐份,造成气溶胶通道不畅, 常常反映出来的是测定强度下降,仪器反射功率升高等。炬管上积尘或积炭都会影响点燃等离子体焰炬和保持稳定,也影响反射功率,甚至会造成熄火。因此,要定期用酸洗,水洗,最后,用无水乙醇洗并吹干,经常保持进样系统及炬管的清洁。长时间不清洗炬管,会造成很难清洗干净的现象
水样全分析实验报告
环境分析实验报告 小组成员:靳培培、张园园、范君、 梅丽芸、饶海英、闫盼盼 指导老师:刘德启教授 日期:2012年5月19日
水样全分析 一、实验目的 1、了解常见的测定水质的指标; 2、掌握测定常用水质指标的方法; 3、掌握测定COD的方法; 4、学会使用TOC仪、气相色谱、离子色谱及其在水质分析中的应用。 二、实验原理 1、化学需氧量(COD):指在一定的条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。它是表示水中还原性物质多少的一个指标。水中的还原性物质有各种有机物、亚硝酸盐、硫化物、亚铁盐等。但主要的是有机物。因此,COD又往往作为衡量水中有机物质含量多少的指标。化学需氧量越大,说明水体受有机物的污染越严重。 COD的测定,随着测定水样中还原性物质以及测定方法的不同,其测定值也有不同。目前应用最普遍的是重铬酸钾氧化法,其原理是在强酸溶液(硫酸)中,用一定量的K2Cr2O7氧化水样中的有机物,过量的K2Cr2O7以亚铁灵作指示剂,用硫酸亚铁铵标准溶液回滴,根据其用量,算出消耗的重铬酸钾的量,再换算成氧气的量即为COD的值。该法氧化率高,再现性好,适用于测定水样中有机物的总量。 2、总有机碳(Total Oxygen Carbon,TOC):以碳的含量表示水体中有机物质总量的综合指标。在900℃高温下,以铂作催化剂,使水样氧化燃烧,测定气体中CO2的增量,从而确定水样中总的含碳量,表示水样中有机物总量的综合指标。由于TOC的测定采用高温燃烧,因此能将有机物全部氧化,它比BOD5或COD更能直接表示有机物的总量。因此常被用来评价水体中有机物污染的程度。 目前广泛应用的测定TOC的方法是燃烧氧化—非色散红外吸收法。其测定原理是:将—定量水样注入高温炉内的石英管,在900-950℃温度下,以铂和三氧化钴或三氧化二铬为催化剂,使有机物燃烧裂解转化为CO2,然后用红外线气体分析仪测定CO2含量,从而确定水样中碳的含量。因为在高温下,水样中的碳酸盐也分解产生二氧化碳,故上面测得的为水样中的总碳(TC)。为获得有机碳含量,可采用两种方法:一是将水样预先酸化,通入氮气曝气,驱除各种碳酸盐分解生成的二氧化碳后再注入仪器测定。另一种方法是使用高温炉和低温炉皆有的TOC测定仪。将同一等量水样分别注入高温炉(900℃)和低温炉(150℃),则水样中的有机碳和无机碳均转化为CO2,而低温炉的石英管中装有盐酸浸渍的玻璃棉,能使无机碳酸盐在150℃分解为CO2,有机物却不能被分解氧化。将高、低温炉中生成的CO2依次导入非色散红外气体分析仪,分别测得总碳(TC)和无机碳(IC),二者之差即为总有机碳TOC。 3、气相色谱:是利用试样中各组分在气相和固定液液相间的分配系数不同,当汽化后的试样被载气带入色谱中运行时,组分就在其中的两相间进行反复多次分配,由于固定相对各组分的吸附或溶解能力不同,因此各组分在色谱柱中的运行
电动势的测定及其应用(实验报告)
实验报告 电动势的测定及其应用 一.实验目的 1.掌握对消法测定电动势的原理及电位差计,检流计及标准电池使用注意事项及简单原理。 2.学会制备银电极,银~氯化银电极,盐桥的方法。 3.了解可逆电池电动势的应用。 二.实验原理 原电池由正、负两极和电解质组成。电池在放电过程中,正极上发生还原反应,负极则发生氧化反应,电池反应是电池中所有反应的总和。 电池除可用作电源外,还可用它来研究构成此电池的化学反应的热力学性质,从化学热力学得知,在恒温、恒压、可逆条件下,电池反应有以下关系: △r G m =-nFE 式中△r G m 是电池反应的吉布斯自由能增量;n 为电极反应中电子得失数;F 为法拉第常数;E 为电池的电动势。从式中可知,测得电池的电动势E 后,便可求得△r G m ,进而又可求得其他热力学参数。但须注意,首先要求被测电池反应本身是可逆的,即要求电池的电极反应是可逆的,并且不存在不可逆的液接界。同时要求电池必须在可逆情况下工作,即放电和充电过程都必须在准平衡状态下进行,此时只允许有无限小的电流通过电池。因此,在用电化学方法研究化学反应的热力学性质时,所设计的电池应尽量避免出现液接界,在精确度要求不高的测量中,常用“盐桥”来减小液接界电势。 为了使电池反应在接近热力学可逆条件下进行,一般均采用电位差计测量电池的电动势。原电池电动势主要是两个电极的电极电势的代数和,如能分别测定出两个电极的电势,就可计算得到由它们组成的电池电动势。 附【实验装置】(阅读了解) UJ25型电位差计 UJ25型箱式电位差计是一种测量低电势的电位差计,其测量范围为 mV .V 1171-μ(1K 置1?档)或 mV V 17110-μ(1K 置10?档) 。使用V V 4.6~7.5外接工作电源,标准电池和 灵敏电流计均外接,其面板图如图5.8.2 所示。调节工作电流(即校准)时分别调节1p R (粗调)、2p R (中调)和3p R (细 调)三个电阻转盘,以保证迅速准确地调 节工作电流。n R 是为了适应温度不同时标准电池电动势的变化而设置的,当温 图5.8.2 UJ31型电位差计面板图 + - -++- + -标准 检流计 5.7-6.4V 未知1 未知2 K 1 R P2 R P3 R P1 R n K 2 I II III 1.01×10 ×1 未知1 未知2 标准断断粗 中 细 ×1 ×0.1 ×0.001 粗细短路
流体阻力实验报告
. 北京化工大学化工原理实验报告 实验名称:流体阻力实验 班级:化工11 姓名: 学号:2011011 序号: 同组人: 设备型号:流体阻力-泵联合实验装置UPRSⅢ型-第套实验日期:2013-11-4
一、实验摘要 本实验使用104实验室UPRS Ⅲ型第7套实验设备,测量了水流经不锈钢管、镀锌管、突扩管、阀门、层流管的阻力损失。确定了摩擦系数和局部阻力系数的变化规律和影响因素。该实验提供了一种测量实际管路阻力系数的方法,其结果可为管路实际应用和工艺设计提供重要的参考。 关键词:流量,压降,雷诺数,摩擦系数,局部阻力系数 二、实验目的 1、测量湍流直管道的阻力,确定摩擦阻力系数。 2、测量湍流局部管道的阻力,确定局部阻力系数。 3、测量层流直管道的阻力,确定摩擦阻力系数。 三、实验原理 1、直管道和局部管道阻力损失e f h u p gZ u p gZ h +++-++=)2()2(2 2 22211 1ρρ (1) 其中h e =0,z 1=z 2,所以测出管道上下游截面的静压能、动能,代入方程即可求得阻力。 2、根据因次分析法可得: (1)直管道阻力损失2 2 u d l h f ?=λ……(2)。其中,l 为管道长度,d 为管道内 径,u 为管内平均流速。只要测定l ,d ,u ,和λ,代入方程即可求得阻力h f 。
其中,λ的理论值计算方法为:25 .0Re 3163.0=湍流λ ; Re 64 = 层流λ。 对于水平无变径直管道,根据式(1)、(2)可得到摩擦系数的计算方法 为221) (2u l p p d ??-=ρλ测量。 (2)管道局部阻力损失2 2 1 u h f ?=ζ……(3)。其中,ζ为管道局部阻力系数, u 为平均流速(突扩管对应细管流速u 1)。将ζ和u 代入方程即可求得局部阻力h f 。 其中,ζ的理论值计算方法为:2 2 1)1(A A - =突扩管ζ ;常数截止阀=ζ;常数球阀=ζ。 对于水平放置的管件,根据式(1)、(3)可得到局部阻力系数的计算方 法为2 21) 2u p p ?-=ρζ(阀门;2 1 122 2) (2-1u p p u ρ ζ-+ =突扩管。 四、实验流程和设备
水质分析实验报告
实验序号 4 实验名称水质分析 实验时间2010年4月12 实验室生科院实验楼综合2 一.实验预习 1.实验目的 学习和掌握测定水中溶解氧、浊度、氟化物、铁、氨氮和pH、六价铬、硫化物、钙、亚硝酸盐氮、有效氯(总氯)COD和总磷的方法。 了解这些因素在水环境中的地位及对水生生物的影响。 2.实验原理、实验流程或装置示意图 实验原理: 水是水生生物生活的场所,水体洁净程度如何,各种化学成分含量多少,是我们选用不同用途水源时的主要依据,进行水质分析已成为环境分析化学的一个重要组成部分,也是生态工作不可缺少的手段。 溶解氧的测定: 水中溶解氧的测定一般用碘量法,在水样中加入硫酸锰及碱性碘化钠溶液,生成氢氧化锰沉淀,此时氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰 4MnSO4 + 8NaOH 4Mn(OH)2(肉色沉淀) + 4Na2SO4 2Mn(OH)2 + O22MnO(OH)2(棕黄色或棕色沉淀) 2H2MnO3 + 2Mn(OH)22MnMnO3+ 4H2O 加入浓硫酸使已化合的溶解氧(以MnMnO3的形式存在)与溶液中所加入的碘化钾发生反应而析出碘,溶解氧越多,析出的碘就越多,溶液的颜色也就越深。 4KI + 2H2SO44HI + 2K2SO4 2MnMnO3 + 4H2SO4 + 4HI 4MnSO4 + 2I2 + 6H2O 用移液管取一定量反应完毕的水样,以淀粉作指示剂,用硫代硫酸钠溶液滴定碘含量(碘量与溶解氧量成比例关系),计算出水样溶解氧的含量。 氨氮的测定: 氨与碘化汞钾在碱性溶液中生成黄色络合物,其色度与氨氮含量成正比,在0~L的氨氮范围内近于直线。反应式如下: 2K2(HgI4) + 3KOH + NH3 NH2HgOI (黄棕色沉淀) + 7KI + 2H2O 亚硝酸盐测定: 测定亚硝酸盐氮,通常使用重氮比色法,此法是基于亚硝酸盐和对氨基苯磺酸起重氮化作用,再与α-萘胺起偶合反应,生成紫红色染料,与标准液进行比色。 pH测定: 利用玻璃电极作指示电极,甘汞电极作参比电极,组成一个电池。在此电池中,被测溶液的氢离子随其浓度不同将产生相应的电位差。此电位与溶液的pH值的关系,符合能斯特方程式: E = E0 + log[H+] (25℃) E = E0–pH 式中,E0为常数。 浊度(NTU): 基于不同浊度的被测溶液对电磁辐射有选择性吸收而建立的比浊法。 铁: Fe 2+ +二氮杂菲橙红色络合物 基于在pH3~9的条件下,低价态铁离子与二氮杂菲生成稳定的橙红色络合物,对可见
原电池电动势的测定实验报告
实验九 原电池电动势的测定及应用 一、实验目的 1.测定Cu -Zn 电池的电动势和Cu 、Zn 电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握SDC -Ⅲ数字电位差计的测量原理和正确的使用方法。 二、实验原理 电池由正、负两极组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=- (9-1) 式中G ?是电池反应的吉布斯自由能增量;n 为电极反应中得失电子的数目;F 为法拉第常数(其数值为965001C mol -?);E 为电池的电动势。所以测出该电池的电动势E 后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就
可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 4142()()()()Zn s ZnSO m CuSO m Cu s |||| 符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”代表连通两个液相的“盐桥”;1m 和2m 分别为4ZnSO 和4CuSO 的质量摩尔浓度。 当电池放电时, 负极起氧化反应: { }22() ()2Zn Zn s Zn a e ++-+ 正极起还原反应: 22()2()Cu Cu a e Cu s ++-+ 电池总反应为: 2222()()()()Cu Zn Zn s Cu a Zn a Cu s ++++++ 电池反应的吉布斯自由能变化值为: 22ln Cu Zn Zn Cu a a G G RT a a ++?=?- (9-2) 上述式中G ?为标准态时自由能的变化值;a 为物质的活度,纯固体物质的活度等于1,即1Cu Zn a a ==。而在标态时,221Cu Zn a a ++==,则有: G G nFE ?=?=- (9-3) 式中E 为电池的标准电动势。由(9-1)至(9-1)式可得: 22ln Zn Cu a RT E E nF a + + =- (9-4) 对于任一电池,其电动势等于两个电极电势之差值,其计算式为: E ??+-=- (9-5) 对铜-锌电池而言 22,1 ln 2Cu Cu Cu RT F a ??+ + += - (9-6) 22,1 ln 2Zn Zn Zn RT F a ??+ + -= - (9-7) 式中2,Cu Cu ? +和2,Zn Zn ?+是当221Cu Zn a a ++==时,铜电极和锌电极的标准电极电势。 对于单个离子,其活度是无法测定的,但强电解质的活度与物质的平均质量摩尔浓度和
沿程阻力 中国石油大学(华东)流体力学实验报告
实验七、沿程阻力实验 一、实验目的填空 1.掌握测定镀锌铁管管道沿程阻力系数的方法; 2.在双对数坐标纸上绘制λ-Re的关系曲线; 3.进一步理解沿程阻力系数随雷诺数的变化规律。 二、实验装置 在图1-7-1下方的横线上正确填写实验装置各部分的名称 本实验采用管流实验装置中的第1根管路,即实验装置中最细的管路。在测量较大压差时,采用两用式压差计中的汞-水压差计;压差较小时换用水-气压差计。 另外,还需要的测量工具有量水箱、量筒、秒表、温度计、水的粘温表。 F1——文秋利流量计;F2——孔板流量计;F3——电磁流量计; C——量水箱;V——阀门;K——局部阻力实验管路 图1-7-1 管流综合实验装置流程图 三、实验原理在横线正确写出以下公式 本实验所用的管路是水平放置且等直径,因此利用能量方程式可推得管路两点间的沿程水头
损失计算公式: 2 2f L v h D g λ = (1-7-1) 式中: λ——沿程阻力系数; L ——实验管段两端面之间的距离,m ; D ——实验管内径,m ; g ——重力加速度(g=9.8 m/s 2); v ——管内平均流速,m/s ; h f ——沿程水头损失,由压差计测定。 由式(1-7-1)可以得到沿程阻力系数λ的表达式: 2 2f h D g L v λ= (1-7-2) 沿程阻力系数λ在层流时只与雷诺数有关,而在紊流时则与雷诺数、管壁粗糙度有关。 当实验管路粗糙度保持不变时,可得出该管的λ-Re 的关系曲线。 四、实验要求 填空 1.有关常数 实验装置编号:No. 7 管路直径:D = 1.58 cm ; 水的温度:T = 13.4 ℃; 水的密度:ρ= 0.999348g/cm 3; 动力粘度系数:μ= 1.19004 mPa ?s ; 运动粘度系数:ν= 0.011908 cm 2/s ; 两测点之间的距离:L = 500 cm
数据分析实验报告
《数据分析》实验报告 班级:07信计0班学号:姓名:实验日期2010-3-11 实验地点:实验楼505 实验名称:样本数据的特征分析使用软件名称:MATLAB 实验目的1.熟练掌握利用Matlab软件计算均值、方差、协方差、相关系数、标准差与变异系数、偏度与峰度,中位数、分位数、三均值、四分位极差与极差; 2.熟练掌握jbtest与lillietest关于一元数据的正态性检验; 3.掌握统计作图方法; 4.掌握多元数据的数字特征与相关矩阵的处理方法; 实验内容安徽省1990-2004年万元工业GDP废气排放量、废水排放量、固体废物排放量以及用于污染治理的投入经费比重见表6.1.1,解决以下问题:表6.1.1废气、废水、固体废物排放量及污染治理的投入经费占GDP比重 年份 万元工业GDP 废气排放量 万元工业GDP 固体物排放量 万元工业GDP废 水排放量 环境污染治理投 资占GDP比重 (立方米)(千克)(吨)(%)1990 104254.40 519.48 441.65 0.18 1991 94415.00 476.97 398.19 0.26 1992 89317.41 119.45 332.14 0.23 1993 63012.42 67.93 203.91 0.20 1994 45435.04 7.86 128.20 0.17 1995 46383.42 12.45 113.39 0.22 1996 39874.19 13.24 87.12 0.15 1997 38412.85 37.97 76.98 0.21 1998 35270.79 45.36 59.68 0.11 1999 35200.76 34.93 60.82 0.15 2000 35848.97 1.82 57.35 0.19 2001 40348.43 1.17 53.06 0.11 2002 40392.96 0.16 50.96 0.12 2003 37237.13 0.05 43.94 0.15 2004 34176.27 0.06 36.90 0.13 1.计算各指标的均值、方差、标准差、变异系数以及相关系数矩阵; 2.计算各指标的偏度、峰度、三均值以及极差; 3.做出各指标数据直方图并检验该数据是否服从正态分布?若不服从正态分布,利用boxcox变换以后给出该数据的密度函数; 4.上网查找1990-2004江苏省万元工业GDP废气排放量,安徽省与江苏省是 否服从同样的分布?
原电池电动势的测定与应用物化实验报告
原电池电动势的测定及热力学函数的测定 一、实验目的 1) 掌握电位差计的测量原理和测量电池电动势的方法; 2) 掌握电动势法测定化学反应热力学函数变化值的有关原理和方法; 3) 加深对可逆电池,可逆电极、盐桥等概念的理解; 4) 了解可逆电池电动势测定的应用; 5) 根据可逆热力学体系的要求设计可逆电池,测定其在不同温度下的电动势值,计算电池 反应的热力学函数△G 、△S 、△H 。 二、实验原理 1.用对消法测定原电池电动势: 原电池电动势不能能用伏特计直接测量,因为电池与伏特计连接后有电流通过,就会在电极上发生生极化,结果使电极偏离平衡状态。另外,电池本身有内阻,所以伏特计测得的只是不可逆电池的端电压。而测量可逆电池的电动势,只能在无电流通过电池的情况下进行,因此,采用对消法。对消法是在待测电池上并联一个大小相等、方向相反的外加电源,这样待测电池中没有电流通过,外加电源的大小即等于待测电池的电动势。 2.电池电动势测定原理: Hg | Hg 2Cl 2(s) | KCl( 饱和 ) | | AgNO 3 (0.02 mol/L) | Ag 根据电极电位的能斯特公式,正极银电极的电极电位: 其中)25(00097.0799.0Ag /Ag --=+ t ?;而+ ++-=Ag Ag /Ag Ag /Ag 1 ln a F RT ?? 负极饱和甘汞电极电位因其氯离子浓度在一定温度下是个定值,故其电极电位只与温度有关,其关系式: φ饱和甘汞 = 0.2415 - 0.00065(t – 25) 而电池电动势 饱和甘汞理论—??+=Ag /Ag E ;可以算出该电池电动势的理论值。与测定值 比较即可。 3.电动势法测定化学反应的△G 、△H 和△S : 如果原电池内进行的化学反应是可逆的,且电池在可逆条件下工作,则此电池反应在定温定
实验六-实验报告
《数据库原理》实验报告 实验六、视图和图表的定义及使用实验 姓名胡艺敏学号38 系别 女 数计学院 班 级 11计科师 范 主讲教师江凤莲指导教师江凤莲实验日期2013 4-27 专 业 计算机 课程名称数据库原理同组实验者 一、实验目的 使学生掌握利用SQL Server企业管理器的视图创建向导和图表创建向导建立视图表和关系图(图表),加深对视图和图表概念的理解,了解视图和图表的作用。 二、实验要求 1)调出创建视图向导,在图书-读者库中按下列T-SQL描述创建读者视图。 CREATE VIEW 读者_VIEW AS SELECT 图书.*,借阅.* FROM 图书,借阅,读者 WHERE 图书.书号=借阅.书号AND借阅.读者编号=读者.编号; 2)调出向导,按T-SQL描述创建借阅_计算机图书视图。 CREATE VIEW 借阅_计算机图书 AS SELECT 图书.*,借阅.* FROM 图书,借阅 WHERE 图书.书号=借阅.书号AND图书.类别=‘计算机’ 3)调出创建图表向导,完成在图书_读者数据库中建立图书_借阅图表的操作。要求该图表包括图书和借阅两个表,通过“图书.书号=借阅.书号”外码与被参照表之间的关联。 4)查看以上视图和图表的属性,并修改到正确为止。 三、实验类型:验证、设计、综合 四、实验环境
Microsoft SQL Server 2000 五、实验内容: (1)实验代码(可加附页): (1)基本操作实验 1)查看图书-读者库结构信息,根据给定的T-SQL语句确定视图结构信息,如表10所示。 表10 视图结构信息 序号视图名 数据库 名 相关表名列定义元组定义 1 读者_VIEW 图书-读 者 图书,借阅, 读者 图书.*, 借阅.* 图书.书号=借阅.书号 AND 借阅.读者编号=读者. 编号 2 借阅_计算 机图书 图书-读 者 图书,借阅 图书.*, 借阅.* 图书.书号=借阅.书号 AND图书.类别='计算机' 2)查看图书-读者库结构信息,根据题目要求确定图表结构信息,如表11所示。 表11 图表结构信息 图表名数据库名主表名参照表 名 关联定义 读者_VIEW 图书-读 者 借阅图书图书.书号=借阅.书号 (2)实验结果(可加附页):
水污染综合实验报告【精品】
一、实验目的与要求 1.掌握测试不同废水的色度、浊度、COD、电导、pH等水质指标的分析方法。 2.增强对污染物综合分析能力。 3.根据废水水质选择所用的混凝剂、吸附剂类型;根据实验结果计算出所选混凝剂、吸附剂对废水的去除效率。 4.对废水的进一步治理提出可行性治理方案。 二、实验内容 1.根据高锰酸钾法测定废水的COD,利用pH酸度计,光电浊度计,色带,色度计分别测定pH值、浊度、色度,并预习实验内容,进行实验准备。 2.按照自己所取锅炉排污水、洗衣废水或其他废水的水质特点,自己设计实验方案。 3.针对某一废水,实验比较后确定自己认为合适的处理流程。确定每种处理流程最佳投药量、pH值、搅拌速度及其他操作条件。给出治理结果。 4.处理结果达不到排放标准或回用标准的提出进一步治理方案。 三、实验原理 由于胶粒带电,将极性水分子吸引到它的周围形成一层水化膜,水化膜同样能阻止胶粒间相互接触。因此胶体微粒不能相互聚结而长期保持稳定的分散状态。投加混凝剂能提供大量的正离子,可以压缩双电层,降低ζ电位,静电斥力减少,水化作用减弱;混凝剂水解后形成的高分子物质或直接加入水中的高分子物质一般具有链状结构,在胶粒与胶粒之间起吸附架桥作用,也有沉淀捕作用。这样投加了混凝剂之后,胶体颗粒脱稳后相互聚结,逐渐变成大的絮凝体后沉淀。 活性炭吸附就是利用活性炭的固体表面对水中一种或多种物质的吸附作用,以达到净化水质的目的。活性炭的吸附作用产生于两个方面,一是由于活性炭内部分子在各个方向都受着同等大小的力而在表面的分子则受到不平衡的力,这就是其他分子吸附于其表面上,此为物理吸附;另一个是由于活性炭与被吸附物质之间的化学作用,此为化学吸附。活性炭的吸附是上述两种吸附综合作用的结果。 离子交换或臭氧氧化属于深度净化,可以有效降低废水中的含盐量、COD、色度等。强酸H交换器失效后,必须用强酸进行再生,可以用HCl,也可以用H2SO4。相对来说,由于HCl再生时不会有沉淀物析出,所以操作比较简单。再生浓度一般为2%~4%,再生流速一般为5m/h左右。强碱OH交换树脂再生液浓度一般为1%~3%,流速≤5m/h。GB1 45— 9水汽质量标准规定一级复床出水水质为:电导率≤5?S/cm。混床出水残留的含盐量在1.0mg/L以下,电导率在0.2S/cm以下,残留的SiO2在20?g/L以下,pH值接近中性。
原电池电动势的测定实验报告
实验九原电池电动势的测定及应用 一、实验目的 1.测定Cu-Zn电池的电动势和Cu、Zn电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握SDC-Ⅲ数字电位差计的测量原理和正确的使用方法。 二、实验原理 电池由正、负两极组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=-(9-1) 式中G ?是电池反应的吉布斯自由能增量;n为电极反应中得失电子的数目;F为法拉第常数(其数值为965001 ?);E为电池的电动势。所以测出该电池的电动势E后,进而 C mol- 又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计 测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就
可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 4142()()()()Zn s ZnSO m CuSO m Cu s |||| 符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”代表连通两个液相的“盐桥”;1m 和2m 分别为4ZnSO 和4CuSO 的质量摩尔浓度。 当电池放电时, 负极起氧化反应: { }22()()2Zn Zn s Zn a e ++ - + 正极起还原反应: 22()2()C u C u a e C u s + +- + 电池总反应为: 2222()()()()C u Zn Zn s C u a Zn a C u s ++++ ++ 电池反应的吉布斯自由能变化值为: 22ln C u Zn Zn C u a a G G RT a a ++?=?- (9-2) 上述式中G ? 为标准态时自由能的变化值;a 为物质的活度,纯固体物质的活度等于1,即1Cu Zn a a ==。而在标态时,221C u Zn a a + +==,则有: G G nFE ?=?=- (9-3) 式中E 为电池的标准电动势。由(9-1)至(9-1)式可得: 22ln Zn C u a R T E E nF a ++ =- (9-4) 对于任一电池,其电动势等于两个电极电势之差值,其计算式为: E ??+-=- (9-5) 对铜-锌电池而言 22,1ln 2C u C u C u RT F a ??+ ++=- (9-6) 22,1ln 2Zn Zn Zn RT F a ??+ + -=- (9-7) 式中2,Cu Cu ?+ 和2,Zn Zn ?+ 是当221C u Zn a a + +==时,铜电极和锌电极的标准电极电势。 对于单个离子,其活度是无法测定的,但强电解质的活度与物质的平均质量摩尔浓度和
流体阻力实验报告
北京化工大学化工原理实验报告 实验名称:流体流动阻力测定 班级:化工10 学号:2010 姓名: 同组人: 实验日期:2012.10.10
流体阻力实验 一、摘要 通过测定不同阀门开度下的流体流量v q ,以及测定已知长度l 和管径d 的光滑直管和粗糙直管间的压差p ?,根据公式2 2u l p d ρλ?=,其中ρ为实验温度下流体的密度;流体流速 24d q u v π= ,以及雷诺数μ ρdu =Re (μ为实验温度下流体粘度),得出湍流区光滑直管和粗糙直管在不同Re 下的λ值,通过作Re -λ双对数坐标图,可以得出两者的关系曲线,以及和光滑管遵循的Blasius 关系式比较关系,并验证了湍流区内摩擦阻力系数λ为雷诺数Re 和相对粗糙度ε/d 的函数。由公式2 22 1 21p u u ρζ?+ =- 可求出突然扩大管的局部阻力系数,以及由 Re 64= λ求出层流时的摩擦阻力系数λ,再和雷诺数Re 作图得出层流管Re -λ关系曲线。 关键词:摩擦阻力系数 局部阻力系数 雷诺数Re 相对粗糙度ε/d 二、实验目的 1、掌握测定流体流动阻力实验的一般试验方法; 2、测定直管的摩擦阻力系数λ及突然扩大管的局部阻力系数ζ; 3、测定层流管的摩擦阻力系数λ; 4、验证湍流区内摩擦阻力系数λ为雷诺数Re 和相对粗糙度ε/d 的函数; 5、将所得光滑管的λ-Re 方程与Blasius 方程相比较。 三、实验原理 1、直管阻力损失函数:f (h f ,ρ,μ, l ,d ,ε, u )=0 应用量纲分析法寻找hf (ΔP /ρ)与各影响因素间的关系 1)影响因素 物性:ρ,μ 设备:l ,d ,ε 操作:u (p,Z )
水污染控制工程实验报告
水污染控制工程 实验报告 (环境工程专业适用) 2014年至2015 年第 1 学期 班级11环境1班 姓名吴志鹏 学号1110431108 指导教师高林霞 同组者汤梦迪刘林峰吴渊田亚勇李茹茹 程德玺
2014年4月
目录 实验一曝气设备充氧性能的测定 -------------------------------------------------- 1实验二静置沉淀实验----------------------------------------------------------------- 5实验三混凝实验---------------------------------------------------------------------- 8一、实验目的 ------------------------------------------------------------------------- 15
实验一曝气设备充氧性能的测定 一、实验目的 1.掌握表面曝气叶轮的氧总传质系数和充氧性能测定方法 2.评价充氧设备充氧能力的好坏。 二、实验原理 曝气是指人为地通过一些机械设备,如鼓风机、表面曝气叶轮等,使空气中的氧从气相向液相转移的传质过程。氧转移的基本方程式为: d/dt=K La(s-)(1)式中d/dt:氧转移速率,mg/(Lh); K La:氧的总传质系数,h-1; s:实验条件下自来水(或污水)的溶解氧饱和浓度,mg/L; :相应于某一时刻t的溶解氧浓度mg/L, 曝气器性能主要由氧转移系数K La、充氧能力OC、氧利用率E A、动力效率Ep四个主要参数来衡量。下面介绍上述参数的求法。 (1)氧转移系数K La 将(1)式积分,可得 1n(s—)=一K La t+ 常数(2)此式子表明,通过实验测定s和相应与每一时刻t的溶解氧浓度后,绘制1n(s—)与t关系曲线,其斜率即为K La。另一种方法是先作-t曲线,再作对应于不同值的切线,得到相应的d/dt,最后作d/dt与的关系曲线,也可以求出。 (2)充氧性能的指标 ①充氧能力(OC):单位时间内转移到液体中的氧量。 表面曝气时:OC(kg/h)= K La t(20℃)s (标)V (3) K La t(20℃)= K La t 1.02420T(T: 实验时的水温) s (标)=s (实验) 1.013105/实验时的大气压(Pa) V:水样体积 ②充氧动力效率(Ep):每消耗1度电能转移到液体中的氧量。该指标常被用以比较各种曝气设备的经济效率。 Ep(kg/kW·h)=OC/N (4) 式中:理论功率,采用叶轮曝气时叶轮的输出功率(轴功率, kW)。 ③氧转移效率(利用率,E A):单位时间内转移到液体中的氧量与供给的氧量之
六年级科学下册实验报告单
实验报告单
实验通知单 课题 第一单元微小世界 1.放大镜 实验名称 放大镜的构造、作用、用途 实验班级 六年级 实验类别 B 实验组数 10 实验时间 任课教师 实验 准备 分组实验器材:放大镜(最好每个学生都能有一个放大镜,如果只能提供给学生一种放大镜,尽量放大倍数大一点)科学书或报纸上的照片、计算机或电视机屏幕。柱形、球形的透明器皿、塑料薄膜、铁丝、普通玻璃片、平面镜片、水。 教师演示:不同放大倍数的放大镜、图片或课件(如放大镜镜片的结构等)。 规范操作要点 1.正确用放大镜观察物体。 2.比较用肉眼观察和用放大镜观察的不同。 备注 放大镜的作用——放大物体的像(可能学生会说“把物体放大”,提醒学生物体并未变大) 放大镜的用途——我们用放大镜观察校园里的生物、实验中在老师指导下观察花、昆虫等。它是视力不佳者的助视器,还适用于电子产品检验、线路板检验、集邮者欣赏鉴定邮票、
珠宝商鉴定珠宝、公安人员用它观察指纹毛发纤维等、农技人员用它观察花蕊进行人工授粉等、制作微型工艺品的工匠工作时使用… 实验通知单 课题 2.放大镜下的昆虫世界 实验名称 实验班级 六年级 实验类别 B 实验组数 10 实验时间 任课教师 实验 准备 分组实验器材:昆虫或昆虫器官标本、放大镜 教师演示器材:有关昆虫形态构造和生活习性的多媒体课件或图片资料 规范操作要点 提供给学生各种昆虫的标本或昆虫肢体的标本。(因这个寒假的冻灾,估计开学时不会有太多的昆虫,可以利用仪器室原有的标本和蚊蝇蟑螂等常见昆虫及其肢体为观察对象。估计肉眼观察学生的兴趣不会太浓,而且因观察对象小,肉眼的发现可能不会很多。可能的
《水质分析实验》讲义
《水质分析实验》讲义凌琪伍昌年王莉编写 安徽建筑大学环境与能源工程学院 2017年9月
目录 实验一水中颜色测定 实验二水浊度的测定 实验三水电导率的测定 实验四水中六价铬的测定 实验五水中悬浮物测定 实验六水中铜、锌的测定――原子吸收法 实验七水中氨氮的测定――纳氏试剂比色法 实验八COD测定――重铬酸钾消解法 实验九水中石油类的测定 实验十水中硝基苯的测定――液相色谱法 实验十一水中马拉硫磷含量的测定――气相色谱法
实验一水中颜色测定 一、实验意义:水的色度是对天然水或处理后的各种水进行颜色定量测定时的指标,天然水经常显示不同的颜色。腐殖质过多时呈棕黄色,粘土使水呈黄色,硫使水呈浅蓝色。藻类可以使水呈不同的颜色,如绿色、棕绿色、暗褐色、绿宝石色等。当水体受到工业废水的污染时也会呈现不同的颜色。这些颜色分为真色与表色。真色是由于水中溶解性物质引起的,也就是除去水中悬浮物后的颜色,而表色是没有除去水中悬浮物时产生的颜色。这些颜色的定量程度就是色度。色度是评价感官质量的一个重要指标,饮用水水质标准规定色度不应大于15度。 pH值对色度有较大的影响。 天然和轻度污染水可用铂钴比色法测定色度,对工业有色废水常用稀释倍数法辅以文字描述。 二、实验目的和要求 1、掌握铂钴比色法和稀释倍数法测定水和废水色度方法,以及不同方法所适用的范围。 2、预习第二章有关色度的内容,了解色度测定的其他方法及各自特点。 三、铂钴比色法 1、原理 用氯铂酸钾与氯化钴配成标准色列,与水样进行目视比色。每升水中含有1mg铂和0.5mg钴时所具有的颜色,称为1度,作为标准色度单位。 如水样浑浊,则放置澄清,亦可用离心法或孔径0.45um氯膜过滤以去除悬浮物,但不能用滤纸过滤,因滤纸可吸附部分融解于水的颜色。 2、仪器和试剂 ⑴50mL具塞比色管::其刻度线高度应一致。 ⑵铂钴标准溶液:称取 1.246g氯铂酸钾(K2PtCl6)(相当于500mg铂)及1.000g氯化钴(CoCl2· 6H2O)(相当于240mg钴),溶于100mL水中,加100mL盐酸,用水定容至1000mL。此溶液色度为500度,保存在密塞玻璃瓶中,存放在暗处。 3、测定步骤 ⑴标准色列的配置:向50ml比色管中加入0、0.50、1.00、2.00、3.00、3.50、4.00、4.50、 5.00、 6.00及 7.00mL铂钴标准溶液,用水稀释至标线,混匀。各管的色度依次为0、5、10、 20、30、35、40、45、50、60、70度。密塞保存。 ⑵将水样于标准色列进行目视比较。观察时,可将比色管置于白瓷板或白纸上,使广项从管
化工原理实验~流体流动阻力系数的测定实验报告
流体流动阻力系数的测定实验报告 一、实验目的: 1、掌握测定流体流动阻力实验的一般实验方法。 2、测定直管的摩擦阻力系数λ及突然扩大管与阀门的局部阻力系数ξ。 3、验证湍流区内摩擦阻力系数λ为雷诺系数Re与相对粗糙度的函数。 4、将所得光滑管的λ—Re方程与Blasius方程相比较。 二、实验器材: 流体阻力实验装置一套 三、实验原理: 1、直管摩擦阻力 不可压缩流体(如水),在圆形直管中做稳定流动时,由于黏性与涡流的作用产生摩擦阻力;流体在流过突然扩大、弯头等管件时,由于流体运动的速度与方向突然变化,产 生局部阻力。影响流体阻力的因素较多,在工程上通常采用量纲分析方法简化实验,得 到在一定条件下具有普遍意义的结果,其方法如下。 流体流动阻力与流体的性质,流体流经处的几何尺寸以及流动状态有关,可表示为 △P=f (d, l, u,ρ,μ,ε) 引入下列无量纲数群。 雷诺数Re=duρ/μ 相对粗糙度ε/ d 管子长径比l / d 从而得到 △P/(ρu2)=ψ(duρ/μ,ε/ d, l / d) 令λ=φ(Re,ε/ d) △P/ρ=(l / d)φ(Re,ε/ d)u2/2 可得摩擦阻力系数与压头损失之间的关系,这种关系可用试验方法直接测定。 h f=△P/ρ=λ(l / d)u2/2 ——直管阻力,J/kg 式中,h f l——被测管长,m d——被测管内径,m u——平均流速,m/s λ——摩擦阻力系数。 当流体在一管径为d的圆形管中流动时,选取两个截面,用U形压差计测出这两个截面间的静压强差,即为流体流过两截面间的流动阻力。根据伯努利方程找出静压强差 与摩擦阻力系数的关系式,即可求出摩擦阻力系数。改变流速可测出不同Re下的摩擦 阻力系数,这样就可得出某一相对粗糙度下管子的λ—Re关系。 (1)、湍流区的摩擦阻力系数 在湍流区内λ=f(Re,ε/d)。对于光滑管,大量实验证明,当Re在3×103~105范围内,λ与Re的关系遵循Blasius关系式,即λ=0、3163 / Re0、25 对于粗糙管,λ与Re的关系均以图来表示。 2、局部阻力
《测定电池的电动势和内阻》实验报告范例
测定电池的电动势和内阻 日期: 年 月 日 实验小组成员: 【实验目的】 1.掌握测定电池电动势和内阻的方法; 2.学会用图象法分析处理实验数据。 【实验原理】 1.如图1所示,当滑动变阻器的阻值改变时,电路中路端电压和电流也随之改变.根据闭合电路欧姆定律,可得方程组: r r 2211I U I U +=+=εε。 由此方程组可求出电源的电动势和内阻 2 11 221I I U I U I --= ε,2112I I U U r --=。 2.以I 为横坐标,U 为纵坐标,用测出的几组U 、I 值画出U -I 图象,将所得的直线延长,则直线跟纵轴的交点即为电源的电动势值,图线斜率的绝对值即为内阻r 的值;也可用直线与横轴的交点I 短与ε求得短 I r ε =。 【实验器材】 干电池1节,电流表1只(型号: ,量程: ),电压表1只(型号: ,量程: ),滑动变阻器1个(额定电流 A ,电阻 Ω),开关1个,导线若干。 【实验步骤】 1.确定电流表、电压表的量程,按电路图连接好电路。 图1 实验电路图
2.将滑动变阻器的阻值调至最大。 3.闭合开关,调节变阻器,使电流表有明显示数,记录电流表和电压表的示数。 4.用与步骤3同样的方法测量并记录6-8组U、I值. 5.断开开关,整理好器材。 6.根据测得的数据利用方程求出几组ε、r值,最后算出它们的平均值。 7.根据测得的数据利用U-I图象求得ε、r。 【数据记录】 表1 电池外电压和电流测量数据记录 【数据处理】 1.用方程组求解ε、r 表2 电池的电动势ε和内阻计r算记录表 2.用图象
法求出ε、r(画在下面方框中) 图2 电池的U-I图象 【实验结论】 由U-I图象得:电池的电动势ε= V,r= Ω。 【误差分析】 1.系统误差 以实验电路图1进行原理分析。根据闭合电路欧姆定律:E=U+Ir,本实验电路中电压表的示数是准确的,而电流表的示数比通过电源的实际电流小,所以本实验的系统误差是由电压表的分流引起的。为了减小这个系统误差,滑动变阻器R的阻值应该小一些,所选用的电压表的内阻应该大一些。
流体阻力实验报告(借鉴材料)
化工原理实验报告 实验名称:流体流动阻力测定 班级: 学号: 姓名: 同组人: 实验日期:
流体阻力实验 一、摘要 通过测定不同阀门开度下的流体流量v q ,以及测定已知长度l 和管径d 的光滑直管和粗糙直管间的压差p ?,根据公式22u l p d ρλ?=,其中ρ为实验温度下流体的密度;流 体流速24d q u v π= ,以及雷诺数μ ρdu =Re (μ为实验温度下流体粘度),得出湍流区光滑直管和粗糙直管在不同Re 下的λ值,通过作Re -λ双对数坐标图,可以得出两者的关系曲线,以及和光滑管遵循的Blasius 关系式比较关系,并验证了湍流区内摩擦阻力系数λ为雷诺数Re 和相对粗糙度ε/d 的函数。由公式2 22 1 21p u u ρζ ?+ =- 可求出突然扩大管的局 部阻力系数,以及由Re 64=λ求出层流时的摩擦阻力系数λ,再和雷诺数Re 作图得出层 流管Re -λ关系曲线。 关键词:摩擦阻力系数 局部阻力系数 雷诺数Re 相对粗糙度ε/d 二、实验目的 1、掌握测定流体流动阻力实验的一般试验方法; 2、测定直管的摩擦阻力系数λ及突然扩大管的局部阻力系数ζ; 3、测定层流管的摩擦阻力系数λ; 4、验证湍流区内摩擦阻力系数λ为雷诺数Re 和相对粗糙度ε/d 的函数; 5、将所得光滑管的λ-Re 方程与Blasius 方程相比较。 三、实验原理 1、直管阻力损失函数:f (h f ,ρ,μ, l ,d ,ε, u )=0 应用量纲分析法寻找hf (ΔP /ρ)与各影响因素间的关系 1)影响因素 物性:ρ,μ 设备:l ,d ,ε 操作:u (p,Z ) 2)量纲分析 ρ[ML -3],μ[ML -1 T -1], l [L] ,d [L],ε[L],u [LT -1], h f [L 2 T -2] 3)选基本变量(独立,含M ,L ,T ) d ,u ,ρ(l ,u ,ρ等组合也可以) 4)无量纲化非基本变量 μ:π1=μρa u b d c [M 0L 0T 0] =[ML -1 T -1][ML -3]a [LT -1]b [L]c ? a=-1,b=-1,c=-1
