盖斯定律的全面应用
《盖斯定律》 知识清单

《盖斯定律》知识清单一、盖斯定律的定义盖斯定律是指在定压或定容条件下,一个化学反应不管是一步完成还是分几步完成,其反应热是相同的。
换句话说,化学反应的热效应只与起始和终了状态有关,而与变化途径无关。
打个比方,就好像从 A 地到 B 地,不管你是选择直线路径,还是绕了几个弯,最终到达 B 地时所消耗的体力(相当于反应热)是固定的。
二、盖斯定律的意义1、简化热化学计算在实际的化学研究和生产中,很多化学反应并不能直接测量其反应热,但是通过盖斯定律,我们可以利用已知反应的热效应来计算未知反应的热效应。
这大大减少了实验测量的工作量,提高了工作效率。
2、深入理解化学反应的本质它帮助我们从能量的角度更深入地理解化学反应。
无论反应过程多么复杂,只要起始和终了状态确定,能量的变化就是确定的,这反映了化学反应的内在规律性。
3、预测反应的可能性通过对相关反应热的计算和分析,可以初步判断一个反应在特定条件下是否能够自发进行,为化学研究和工业生产提供重要的理论依据。
三、盖斯定律的应用1、计算未知反应的反应热假设我们已知反应 A 的反应热为ΔH₁,反应 B 的反应热为ΔH₂,而我们想要计算的未知反应 C 可以通过反应 A 和反应 B 经过一定的数学组合得到。
那么反应 C 的反应热ΔH₃就可以通过对ΔH₁和ΔH₂进行相应的加、减运算得出。
例如:已知反应①:C(s) + O₂(g) = CO₂(g) ΔH₁=-3935kJ/mol反应②:CO(g) + 1/2O₂(g) = CO₂(g) ΔH₂=-2830 kJ/mol要计算反应 C:C(s) + 1/2O₂(g) = CO(g) 的反应热ΔH₃。
我们可以通过反应①反应②得到反应 C,所以ΔH₃=ΔH₁ ΔH₂=-3935 kJ/mol (-2830 kJ/mol) =-1105 kJ/mol2、设计合理的反应途径在化工生产中,为了提高反应的效率、降低成本或者减少环境污染,需要设计合理的反应途径。
盖斯定律及其在热化学方程式中的应用

盖斯定律及其在热化学方程式中的应用一:盖斯定律要点1840年,瑞士化学家盖斯(G。
H。
Hess,1802—1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径来完成。
如上图表:已知:H2(g)+O2(g)= H2O(g);△H1=-241.8kJ/molH2O(g)=H2O(l);△H2=-44.0kJ/mol根据盖斯定律,则△ H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol 盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。
因此,热化学方程式之间可以进行代数变换等数学处理。
该定律使用时应注意:热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
二:盖斯定律在热化学方程式计算中的应用盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
,它在热化学方程式中的主要应用在于求未知反应的反应热,物质蒸发时所需能量的计算,不完全燃烧时损失热量的计算,判断热化学方程式是否正确,涉及的反应可能是同素异形体的转变,也可能与物质三态变化有关。
其主要考察方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。
又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
盖斯定律的应用

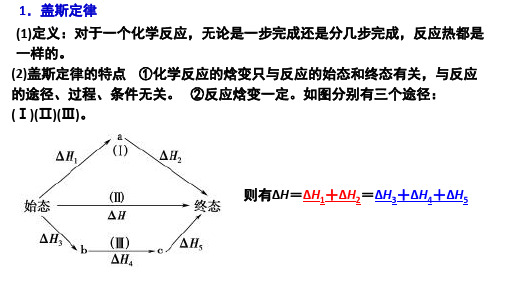
1、盖斯定律的涵义:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变是一样的的。
这就是盖斯定律。
也就是说,化学反应的反应热只与反应体系的始态和终态有关,而与具体的反应进行的途径无关。
2、盖斯定律的应用盖斯定律在科学研究中具有重要意义。
因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。
此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
例如:C(S)+0.5O2(g)=CO(g)上述反应在O2供应充分时,可燃烧生成CO2、O2供应不充分时,虽可生成CO,但同时还部分生成CO2。
因此该反应的△H无法直接测得。
但是下述两个反应的△H却可以直接测得:C(S)+O2(g)=CO2(g) ;△H1= - 393.5kJ/molCO(g)+0.5 O2(g)=CO2(g) ;△H2=- 283.0kJ/mol根据盖斯定律,就可以计算出欲求反应的△H3。
分析上述反应的关系,即知△H1=△H2+△H3△H3=△H1-△H2=-393.5kJ/mol-(-283.0kJ/mol)=-110.5kJ/mol 例5图由以上可知,盖斯定律的实用性很强。
3、反应热计算根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。
反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。
热化学方程式的简单计算的依据:(1)热化学方程式中化学计量数之比等于各物质物质的量之比;还等于反应热之比。
(2)热化学方程式之间可以进行加减运算。
例1:按照盖斯定律,结合下述反应方程式,回答问题,已知:(1)NH3(g)+HCl(g)===NH4Cl(s)△H1=-176kJ/mol(2)NH3(g)+H2O(l)===NH3.H2O(aq) △H2=-35.1kJ/mol(3)HCl(g) +H2O(l)===HCl(aq) △H3=-72.3kJ/mol(4)NH3(aq)+ HCl(aq)===NH4Cl(aq) △H4=-52.3kJ/mol(5)NH4Cl(s)+2H2O(l)=== NH4Cl(aq) △H5=?则第(5)个方程式中的反应热△H是____。
盖斯定律及其应用

盖斯定律及其应用盖斯定律化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步及反应的反应热之和与该反应一步完成的反应热是相同的,这就是盖斯定律。
例如:122(g)2(g)2(l)H 2(g)2(g)2(l)H 2(g)H 1H O H O 21H O H O 2H O ∆∆∆+=+−−→ 可以通过两种途径来完成。
如上图表:已知: 2(g)2(g)2(g)11H O H O ;H 241.8kJ /mol 2+=∆=- 2g 2l 2H O H O H 44.0kJ /mol =∆=()();- 根据盖斯定律,则12H H H 241.8kJ /mol 44.0kJ /mol 285.8kJ /mol ∆=∆∆=+=+-(-)- 其数值与用量热计测得的数据相同。
盖斯定律的应用盖斯定律:当某一物质在定温定压下经过不同的反应过程,生成同一物质时,无论反应是一步完成还是分几步完成,总的反应热是相同的。
即反应热只与反应始态(各反应物)和终态(各生成物)有关,而与具体反应的途径无关。
应用盖斯定律进行简单计算,关键在于设计反应过程,同时注意:⑴ 当反应式乘以或除以某数时,△H 也应乘以或除以某数。
⑵ 反应式进行加减运算时,△H 也同样要进行加减运算,且要带“+”、“-”符号,即把△H 看作一个整体进行运算。
⑶ 通过盖斯定律计算比较反应热的大小时,同样要把△H 看作一个整体。
⑷ 在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
⑸ 当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
【例1】.已知⑴ ()()()2221g g g 1H O H O H akJ /mol 2+=∆;= ⑵ ()()()2222g g g 2H O 2H O H bkJ /mol +=∆;=⑶ ()()()2223g g l 1H O H O H ckJ /mol 2+=∆;= ⑷ ()()()2224g g l 2H O 2H O H dkJ /mol +=∆;=下列关系式中正确的是( )A .a <c <0B .b >d >0C .2a =b <0D .2c =d >0【解析】:⑴、⑵式反应物、生成物的状态均相同,⑴×2=⑵,即2△H 1=△H 2,2a =b ,又H 2的燃烧反应为放热反应,故2a =b <0,C 项符合题意。
盖斯定律的原理及应用

盖斯定律的原理及应用1. 引言盖斯定律是流体力学中的基本定律之一,描述了管道中流体的流动行为。
它由爱尔兰工程师亨利·盖斯于1799年提出,是流体力学领域中的重要原理。
本文将介绍盖斯定律的基本原理以及其在实际应用中的作用。
2. 盖斯定律的原理盖斯定律表述了液体或气体通过管道时的流量与压力之间的关系。
根据盖斯定律,管道内流体的流量Q与压力差△P之间呈线性关系。
具体可以用以下公式表示:Q = kA△P其中,Q表示流量,A表示管道的横截面积,△P表示压力差,k 为比例常数。
该公式可以简化为Q ∝△P。
盖斯定律的基本原理可以通过流体的动量守恒和能量守恒来推导。
根据动量守恒定律,流体在管道中的动量变化等于施加在其上的力乘以时间。
而根据能量守恒定律,单位时间内流过管道某一截面的功率等于管道前后的压力差。
基于这两个定律,可以推导出盖斯定律的数学表达式。
3. 盖斯定律的应用盖斯定律在很多实际应用中起着重要作用,以下列举几个常见的应用场景:3.1 水管系统的设计在设计水管系统时,盖斯定律可以用于确定不同管段的管径。
通过测量进水口和出水口处的压力差,可以根据盖斯定律计算出流量,然后根据流量要求确定相应的管径。
这有助于确保水流的稳定性和高效性。
3.2 汽车制动系统盖斯定律在汽车制动系统中有广泛应用。
制动系统中的刹车片通过液压系统施加力来减速汽车。
根据盖斯定律,当刹车踏板施加的力增大时,液压系统中的压力增加,从而提高了制动力。
这使得汽车的制动更加可控和安全。
3.3 喷气发动机的燃烧室设计盖斯定律在喷气发动机的燃烧室设计中也起着重要作用。
喷气发动机中的燃油通过喷射和燃烧产生高温高压的气体,从而产生推力。
盖斯定律可以用于确定燃烧室中燃气的流动速度和压力分布,有助于提高燃烧效率和推力。
3.4 水力发电站的设计盖斯定律在水力发电站的设计中也有重要应用。
水力发电利用水流的动能来驱动发电机,产生电能。
通过应用盖斯定律,可以计算出水流的流量和压力,从而设计合适的水轮机和水管系统,以提高发电效率。
盖斯定律的例题及解析

盖斯定律的例题及解析盖斯定律的例题及解析引言:盖斯定律,又被称为95/5定律,是指在许多事物中,相对较少的因素或个体对结果的影响最为显著。
这一定律在很多领域都有应用,尤其在经济学、商业管理和社会科学中被广泛运用。
在本文中,我们将通过几个例题深入探讨盖斯定律,并解析相关的概念和原理。
第一部分:盖斯定律的例子1. 企业中的盖斯定律假设在一家企业中,只有5%的员工占据了整个企业利润的95%。
这意味着少数高效能的员工对企业的利润贡献最大。
例如,销售团队中,只有少数销售人员创造了绝大部分的销售额。
此例子展示了盖斯定律在组织内的应用,即少数关键个体对整个组织的影响最为显著。
2. 人口统计中的盖斯定律在人口统计中,盖斯定律也可以得到验证。
例如,在世界范围内,只有5%的人口拥有了95%的财富。
这表明,富裕资源的分配非常不平等。
盖斯定律在人群中的应用,展示了少数人对整个社会或群体的影响力远大于其它大多数。
第二部分:解析盖斯定律的概念和原理1. 基于深度和广度的评估通过对盖斯定律的例子进行评估,我们可以发现这一法则的深度和广度。
盖斯定律强调了少数重要因素或个体对结果的巨大影响,因此可以说具有较大的深度。
而在不同的领域,无论是企业中的盈利、人口的财富分布,还是其他方面的现象,盖斯定律都有着普遍的适用性,这体现了它的广度。
2. 由简到繁、由浅入深的讨论为了更好地理解盖斯定律,我们可以从简单的例子开始,比如企业中的影响力分配或财富分布,逐渐深入探讨更广泛的应用领域,如产品市场份额的分布、人口文化的传播等。
这种由简到繁、由浅入深的探讨方式可以帮助我们更全面地理解盖斯定律,并将其应用到更多的实际问题中。
第三部分:总结和回顾通过对盖斯定律的讨论,我们可以得出以下几个总结和回顾性的内容:1. 盖斯定律强调少数因素或个体对结果的显著影响,这种不平衡的分布在许多领域都有普遍存在。
2. 盖斯定律的深度和广度使其成为一个强有力的理论框架,可以用于解释和预测各种现象。
盖斯定律及其应用

人 教 版 化 学
C( 石墨 ) + O2(g)= CO2(g)
H 2(g) + 1/2O 2(g) = H 2O(l)
ΔH2=- 393.5 kJ· mol
-1
-1
ΔH 3 =- 285.8 kJ ·mol
②
③ 根据盖斯定律求反应 C(石墨)+2H 2(g)= CH 4(g) ④ 的ΔH 4
化学反应原理
已知 25 ℃、101 kPa 下,1 g C8H18(辛烷)燃烧生成二 氧化碳和液态水时放出 48.40 kJ 热量。则 C8H18 的燃烧 热为 ________________。
人 教 版 化 学
化学反应原理
第1章 第三节
[解析 ] 注意燃烧热为燃烧 1 mol 物质所放出的热 量。 1 g C8H18 燃烧生成二氧化碳和液态水时放出 48.40 kJ 热量,则 1 mol C8H18 完全燃烧放出的热量为 48.40 kJ· g
第1章 第三节
[解析 ] 方法一: 因为反应式①②③和④ 之间有以下 关系: ②+③×2-①=④ 所以 ΔH4= ΔH2+ 2ΔH3-ΔH1 =- 393.5+ 2×(- 285.8)- (- 890.3) =- 74.8(kJ· mol 1)
-
人 教 版 化 学
化学反应原理
第1章 第三节
方法二:也可以设计一个途径,使反应物经过一些 中间步骤最后回复到产物:
-1
C.- 244.15 kJ· mol-1
D.+ 244.15 kJ· mol-1
化学反应原理
第1章 第三节
[解析 ] ①×2 得:2C(s)+ 2O2(g)===2CO2(g) =- 787.0 kJ· mol
-1
ΔH4
盖斯定律及其应用-高二化学(人教版2019选择性必修1)

④H2Sg+H2SO4aq===Ss+SO2g+
2H2Ol ΔH4=+61 kJ·mol-1
(3)加和调整好的热化学方程式 (4)求焓变ΔH (5)检查 系统(Ⅰ):①+②+③可得出H2O(l)===H2(g)+1/2O2(g) ΔH=ΔH1+ΔH2+ΔH3
【答案】 H2O(l)===H2(g)+1/2O2(g) ΔH=+286 kJ·mol-1 H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1
系统(Ⅰ) H2SO4aq ΔH2=-151 kJ·mol-1 ③2HIaq===H2g+I2s
ΔH3=+110 kJ·mol-1
系统(Ⅱ)
②SO2g+I2s+2H2Ol===2HIaq +H2SO4aq ΔH2=-151 kJ·mol-1 ③2HIaq===H2g+I2s ΔH3=+110 kJ·mol-1
C.ΔH3=ΔH1-2ΔH2 答案:A
D.ΔH3=ΔH1-ΔH2
解析:热化学方程式①、②和③之间存在关系:①+2×②=③,故有
ΔH1+2ΔH2=ΔH3。
突破点二:盖斯定律的应用
应用一 利用盖斯定律计算反应热
[方法归纳] 有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯,
这给测定反应热造成了困难,此时若应用盖斯定律,就可以间接把它们的反应热计算
解析: 将已知的热化学方程式依次编号为①、②、③、④,将方程式 ③×2-①-④×4得 2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l),所以反应的ΔH=2×(-534 kJ·mol-1)-67.7 kJ·mol-1-4×(+44.0 kJ·mol-1)=-1 311.7 kJ·mol-1。
出来。
盖斯定律及其应用

盖斯定律及其应用盖斯定律及其应用1.盖斯定律的内容对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都一样,即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2.盖斯定律的应用AΔH 1ΔH 2B2 ①C(s)+O 2(g)===CO 2(g) ΔH 1 ②C(s)+12O 2(g)===CO(g) ΔH 2由①-②可得:CO(g)+12O 2(g)===CO 2(g) ΔH =ΔH 1-ΔH 23.运用盖斯定律的三个注意事项(1)热化学方程式乘以某一个数时,反应热的数值必须也乘上该数。
(2)热化学方程式相加减时,物质之间相加减,反应热也必须相加减。
(3)将一个热化学方程式颠倒时,ΔH 的“+”“-”随之改变,但数值不变。
[细练过关]题点(一) 根据盖斯定律确定反应热的关系1.已知:2H 2(g)+O 2(g)===2H 2O(g) ΔH 1 3H 2(g)+Fe 2O 3(s)===2Fe(s)+3H 2O(g) ΔH 2 2Fe(s)+32O 2(g)===Fe 2O 3(s) ΔH 32Al(s)+32O 2(g)===Al 2O 3(s) ΔH 42Al(s)+Fe 2O 3(s)===Al 2O 3(s)+2Fe(s) ΔH 5 下列关于上述反应焓变的判断正确的是( ) A .ΔH 1<0,ΔH 3>0 B .ΔH 5<0,ΔH 4<ΔH 3 C .ΔH 1=ΔH 2+ΔH 3D .ΔH 3=ΔH 4+ΔH 5解析:选B 大多数化合反应为放热反应,而放热反应的反应热(ΔH )均为负值,故A 错误;铝热反应为放热反应,故ΔH 5<0,而2Fe(s)+32O 2(g)===Fe 2O 3(s) ΔH 3 ③,2Al(s)+32O 2(g)===Al 2O 3(s) ΔH 4 ④,由④-③可得:2Al(s)+Fe 2O 3(s)===Al 2O 3(s)+2Fe(s) ΔH 5=ΔH 4-ΔH 3<0,可得ΔH 4<ΔH 3、ΔH 3=ΔH 4-ΔH 5,故B 正确、D 错误;已知:3H 2(g)+Fe 2O 3(s)===2Fe(s)+3H 2O(g) ΔH 2 ②,2Fe(s)+32O 2(g)===Fe 2O 3(s) ΔH 3 ③,将(②+③)×23可得:2H 2(g)+O 2(g)===2H 2O(g) ΔH 1=23(ΔH 2+ΔH 3),故C 错误。
46盖斯定律的全面应用

一、利用盖斯定律计算反应热1.已知在298 K 时下述反应的有关数据如下:C(s)+12O 2(g)===CO(g) ΔH 1=-110.5 kJ·mol -1 C(s)+O 2(g)===CO 2(g) ΔH 2=-393.5 kJ·mol -1 则C(s)+CO 2(g)===2CO(g)的ΔH 为( )A .+283.5 kJ·mol -1B .+172.5 kJ·mol -1 C .-172.5 kJ·mol -1 D .-504 kJ·mol -1 2.(2018·山西重点中学协作体高三上学期开学考)在25 ℃、101 kPa 条件下,C(s)、H 2(g)、CH 3COOH(l)的燃烧热ΔH 分别为-393.5 kJ·mol -1、-285.8 kJ·mol -1、-870.3 kJ·mol -1,则 2C(s)+2H 2(g)+O 2(g)===CH 3COOH(l)的反应热为( )A .-488.3 kJ·mol -1B .+488.3 kJ·mol -1 C .-191 kJ·mol -1 D .+191 kJ·mol -1 二、利用盖斯定律书写热化学方程式3.(2018·甘肃天水模拟)已知在常温常压下:①2CH 3OH(l)+3O 2(g)===2CO 2(g)+4H 2O(g)ΔH 1=-1 275.6 kJ·mol -1 ②2CO(g)+O 2(g)===2CO 2(g)ΔH 2=-566.0 kJ·mol -1 ③H 2O(g)===H 2O(l) ΔH 3=-44.0 kJ·mol -1写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:________________________________________________________________________ ________________________________________________________________________。
第39讲 盖斯定律及应用

提升 关键能力
思维建模
消元法计算反应热的思维流程
返回
<
考 点 二>
反应热大小的比较
整合 必备知识
比较反应热大小注意事项 (1)在比较反应热(ΔH)的大小时,应带符号比较。 (2)同一物质,不同聚集状态时具有的能量不同,相同量的某物质的能量关系: E(物质R,g)>E(物质R,l)>E(物质R,s)。 (3)同一化学反应,反应物的用量越多,|ΔH|越大。对于可逆反应,因反应不能进行 完全,实际反应过程中放出或吸收的热量要小于理论数值。 (4)等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多,则完全燃烧 的ΔH较小。
氮肥保障了现代农业的丰收。为探究
(NH4)2SO4的离子键强弱,设计如图所示
的循环过程,可得ΔH4/(kJ·mol-1)为
A.+533
B.+686
√C.+838
D.+1 143
提升 关键能力
2.[2018·北京,27(1)]近年来,研究人员提出利用含硫物质热化学循环实现太阳能的 转化与存储。过程如下:
提升 关键能力
5.[2023·湖南,16(1)]已知下列反应的热化学方程式: ①C6H5C2H5(g)+221O2(g)===8CO2(g)+5H2O(g) ΔH1=-4 386.9 kJ·mol-1 ②C6H5CH===CH2(g)+10O2(g)===8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·mol-1 ③H2(g)+12O2(g)===H2O(g) ΔH3=-241.8 kJ·mol-1 计算反应④C6H5C2H5(g) C6H5CH==CH2(g)+H2(g)的ΔH4=__+__1_1_8__kJ·mol-1。
《盖斯定律及应用》课件

由于盖斯定律的复杂性,很难准确预测未来的情况。
3 适用性有限
盖斯定律并非适用于所有情况,需要根据具体情况谨慎应用。
总结
揭示实际问题规律
盖斯定律帮助我们认识到很多实际问题中存在的规 律,为问题解决提供思路。
综合考虑
虽然盖斯定律有其局限性,但我们在解决问题时需 要综合ຫໍສະໝຸດ 虑多个因素。《盖斯定律及应用》
通过本课件,我们将详细介绍《盖斯定律及应用》。盖斯定律是一个在各个 领域都具有广泛应用的原理,可以帮助我们更好地理解和解决实际问题。
什么是盖斯定律?
盖斯定律,也称为巴里定律,指的是在任何一个系统中,20%的原因会导致 80%的结果,剩余的80%原因只能导致20%的结果。
盖斯定律的应用
产品管理
从产品功能到销售额,我们 可以运用盖斯定律更好地管 理和优化产品。
市场营销
通过社交媒体推广产品,定 位目标用户和提高知名度, 都可以应用盖斯定律。
人力资源管理
员工绩效评估、招聘与人员 配置、培训和发展等方面, 盖斯定律都可以提供指导和 帮助。
盖斯定律的局限性
1 难以量化
盖斯定律所涉及的原因和结果很难进行精确的量化和确定。
《盖斯定律及应用》课件

对可逆过程的依赖性
总结词
盖斯定律的应用依赖于可逆过程,但实 际反应往往难以达到可逆状态。
VS
详细描述
盖斯定律仅适用于可逆过程,但在实际反 应中,由于各种因素的限制,如反应动力 学、热力学ቤተ መጻሕፍቲ ባይዱ化学平衡等,反应很难完全 达到可逆状态。因此,在应用盖斯定律时 需要考虑这些因素的影响。
对热力学过程的依赖性
详细描述
盖斯定律表明,一个系统的热力学状态变化只取决于起始和 最终状态,而与变化过程中所经历的中间状态无关。这意味 着,通过不同的反应路径,可以达到相同的最终状态,这些 路径的热力学行为是等效的。
盖斯定律的发现与起源
总结词
盖斯定律由苏格兰物理学家和数学家詹姆斯·克拉克·盖斯于19世纪提出。
详细描述
盖斯定律的发展趋势与展望
盖斯定律的理论研究进展
盖斯定律基本原理的完善
随着理论物理学的发展,盖斯定律的基本原理得到进一 步明确和阐述,为相关领域的研究提供更坚实的理论基 础。
盖斯定律与其他理论的融合
盖斯定律与热力学、统计力学等理论相互渗透,形成更 广泛的理论体系,推动相关领域的发展。
盖斯定律在交叉学科中的应用
要点二
详细描述
盖斯定律在多个领域中具有重要意义。在化学反应计算中 ,盖斯定律可以用于计算不同反应路径的能量变化,有助 于理解化学反应的本质和过程。在能源利用方面,盖斯定 律有助于优化能源转换过程,提高能源利用效率。此外, 在环境保护领域,盖斯定律可以帮助我们更好地理解和控 制环境污染物的生成和转化过程。
总结词
盖斯定律的应用受到热力学过程的限制,不 适用于非热力学平衡过程。
详细描述
盖斯定律适用于等温、等压或绝热过程,但 不适用于非热力学平衡过程。在非平衡过程 中,化学反应的热效应不仅与反应途径有关 ,还与反应条件有关。因此,在应用盖斯定 律时需要确保所研究的反应过程符合热力学 的基本原理。
第六章-第一节-第3课时-盖斯定律及其应用

反应热间的关系 ΔH1=aΔH2 ΔH1=-ΔH2
ΔH=ΔH1+ΔH2 =ΔH3+ΔH4+ΔH5
4
归纳总结:
推论一:若某化学反应从始态(S)到终态(L)其焓变为△H1, 而从终态(L)到始态(S)的焓变为△H 2,这两者和为0。
即△H1+ △H 2 = 0 推论二:若某一化学反应可分为多步进行,则其总焓变为各步反 应的焓变之和。 盖斯定律的重要意义:间接地计算某些反应的反应热
②定侧向
H2(g)+I2(g)===2HI(g) ΔH2=-11.0 kJ·mol-1② ③调系数
对应反应:
(g)+I2(g)===
(g)+2HI(g) ④求焓变
ΔH3=__+__8_9_.3__kJ·mol-1。 ③
6
盖斯定律的应用1
新坐标P139-3
★★ 3.(1)(2018·全国卷Ⅰ,节选)已知:2N2O5(g)===2N2O4(g)+O2(g)
高三化学备课组
盖斯定律在 ΔH 求算中的应用 ——变化观念与证据推理
盖斯定律充分体现了能量守恒定律,在近几年高考试题中出现 率 100%,难度中档。呈现形式主要是根据两个或三个已知热化学方 程式推导目标反应的热化学方程式或其 ΔH。体现了变化观念与证据 推理的化学核心素养。
2
一、盖斯定律
化学反应不管是一步完成还是分几步完成,其反应热是相同的,
即化学反应的反应热只与反应体系的始态和终态有关,而与反应的
途径无关。体现了能量守恒定律。
△H1 < 0
(始态)S
△H1 +△H2 = 0
ΔH、ΔH1、ΔH2之间有何关系?
ΔH
A
B
ΔH1ΔH2Fra bibliotekL(终态)
盖斯定律的应用及反应热 的计算和大小比较 新高考化学专题讲解 考点详细分析深入讲解 最新版

盖斯定律的应用及反应 热 的计算和大小比较
详细分析与深入讲解
必备知识通关
1.盖斯定律 不管化学反应是一步完成还是分几步完成,其反应热是相同的。即反应 热只与反应体系的始态和终态有关,而与反应途径无关。如:
途径一:A→B 途径二:A→C→B 则ΔH1、ΔH2、ΔH的关系为ΔH=ΔH1+ΔH2。
2.根据反应进行程度的大小比较反应焓变大小
③C(s)+ 1 O2(g) 2
④C(s)+O2(g)
CO(g) ΔH3 CO2(g) ΔH4
反应④,C完全燃烧,放热更多,|ΔH3|<|ΔH4|,但ΔH3<0,ΔH4<0,故ΔH3>ΔH4。
解题能力提升
3.根据反应物或生成物的状态比较反应焓变大小
⑤S(g)+O2(g) ⑥S(s)+O2(g) 方法一:图像法
ΔH3。则下列判断正确的是
A.ΔH2>ΔH3
B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2
D.ΔH1+ΔH2>ΔH3
解题能力提升
SO2(g)+2OH-(aq)
S(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)
SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)
Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)
CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
。
解题能力提升
解析:(1)将已知热化学方程式依次编号为①、②,根据盖斯定律,由①×3+
高中化学 盖斯定律
不能很好的控制反应的程度,故不能直接通过实验测得△H1
CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+O2(g) = CO2(g)
△H3=-393.5 kJ/mol
(1)消元法 写出目标方程式确定“多余物质”(要消去的物质)然后用消元法逐一消去 “多余物质”,导出“四则运算式”
分析: CO(g) △H1 + △H2 = △H3
H1
H2
C(s)
H3 CO2(g)
C(s)+O2(g) = CO2(g)
△H3=-393.5 kJ/mol
— CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+1/2O2(g) = CO(g) △H1=?
∴△H1 = △H3 - △H2 = -393.5 kJ/mol -(-283.0 kJ/mol)= -110.5 kJ/mol
ΔH2
C
ΔH3=ΔH1+ΔH2 ΔH1=ΔH3- ΔH2
(2)唯一法:对于比较复杂的几步反应,可以换个角度: 找唯 一,调方向,改倍数,不多余
测定 C(s)+1/2O2(g)=CO(g) 的焓变△H1
CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+O2(g) = CO2(g)
△H3=-393.5 kJ/mol
盖斯定律的应用 (1)科学意义:对于无法或较难通过实验测定的反应的焓变,可应用盖斯定律 计算求得。 (2)方法——“叠加法”若一个化学反应的化学方程式可由另外几个化学反 应的化学方程式相加减而得到,则该化学反应的焓变即为另外几个化学反 应焓变的代数和。
第1章第2节能力课时1 盖斯定律的综合应用课件上学期高二化学人教版选择性必修1

K半径大,失电子更容易 吸取热量更少
D.ΔH6+ΔH7=ΔH8
5.硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工 序是 SO2 的催化氧化:SO2(g)+12O2(g)―钒―催―化 ――剂→SO3(g) ΔH=-98 kJ ·mol-1。
回答下列问题:
-①×2+②
V2O4(s)+SO3(g)=V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1① V2O4(s)+2SO3(g)=2VOSO4(s) ΔH1=-399 kJ·mol-1②
诸如果皮等生活垃圾富含水分,如果直接送到焚烧炉里, 难以彻底燃烧。脱水之后的生活垃圾更容易燃烧,利用率自然 更高,产生的固体废物也更少,生活垃圾的处理也更加彻底。
[问题 3] 发酵的垃圾中含有沼气,沼气可以很好地助燃,炉内 温度可达 850 ℃以上。含铅汽油、煤、防腐处理过的木材等各种废 弃物在燃烧温度低于 400 ℃时容易产生二 英。但是燃烧炉温度保持 在 850 ℃以上,可以有效分解二 英,基本可以消除二 英对环境的 不良影响。沼气的主要成分是甲烷,已知 1 g 甲烷完全燃烧生成液态 水时放出 55.64 kJ 的热量,写出甲烷燃烧的热化学方程式,并计算 出甲烷的燃烧热 ΔH 是多少?(素养角度——宏观辨识与微观探析)
4.(2021·河北邢台高二月考)2 mol 金属钠和 1 mol 氯气反应的能
量关系如图所示,下列说法不正确的是( B )
A.ΔH2>0
ΔH2+ΔBCH..3+Δ在ΔH相H4+4同+ΔΔ条HH件 5+5+下ΔΔH, H862=+KΔΔ(HgH)71→=2ΔKH+(1g)
>0 >0
的
ΔH3′<ΔH3
(1)Deacon 直接氧化法可按下列催化过程进行:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盖斯定律的全面应用一、利用盖斯定律计算反应热1.已知在298 K 时下述反应的有关数据如下:C(s)+12O 2(g)===CO(g) ΔH 1=-110.5 kJ·mol -1 C(s)+O 2(g)===CO 2(g) ΔH 2=-393.5 kJ·mol -1 则C(s)+CO 2(g)===2CO(g)的ΔH 为( )A .+283.5 kJ·mol -1B .+172.5 kJ·mol -1 C .-172.5 kJ·mol -1 D .-504 kJ·mol -1 2.(2017·山西重点中学协作体高三上学期开学考)在25 ℃、101 kPa 条件下,C(s)、H 2(g)、CH 3COOH(l)的燃烧热ΔH 分别为-393.5 kJ·mol -1、-285.8 kJ·mol -1、-870.3 kJ·mol -1,则 2C(s)+2H 2(g)+O 2(g)===CH 3COOH(l)的反应热为( )A .-488.3 kJ·mol -1B .+488.3 kJ·mol -1 C .-191 kJ·mol -1 D .+191 kJ·mol -1 二、利用盖斯定律书写热化学方程式3.(2016·甘肃天水模拟)已知在常温常压下:①2CH 3OH(l)+3O 2(g)===2CO 2(g)+4H 2O(g)ΔH 1=-1 275.6 kJ·mol -1 ②2CO(g)+O 2(g)===2CO 2(g)ΔH 2=-566.0 kJ·mol -1 ③H 2O(g)===H 2O(l) ΔH 3=-44.0 kJ·mol -1写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:________________________________________________________________________ ________________________________________________________________________。
4.(2016·宜城一中高三上学期9月月考)(1)如图所示表示的是NO 2和CO 反应生成CO 2和NO 过程中能量变化示意图,请写出NO 2和CO 反应的热化学方程式:________________________________________________________________________。
(2)已知:①Fe 2O 3(s)+3CO(g)===2Fe(s)+3CO 2(g) ΔH =-25 kJ· mol -1 ②3Fe 2O 3(s)+CO(g)===2Fe 3O 4(s)+CO 2(g) ΔH =-47 kJ· mol -1 ③Fe 3O 4(s)+CO(g)===3FeO(s)+CO 2(g) ΔH =+19 kJ· mol -1 请写出CO 还原FeO 的热化学方程式:________________________________________ ________________________________________________________________________。
5.(2016·泉州一中考前模拟)已知:①C(s)+O 2(g)===CO 2(g) ΔH =a kJ·mol -1 ②CO 2(g)+C(s)===2CO(g) ΔH =b kJ·mol -1 ③Si(s)+O 2(g)===SiO 2(s) ΔH =c kJ·mol -1 工业上生产粗硅的热化学方程式为______________________________________________ ________________________________________________________________________。
三、盖斯定律综合利用6.(2016·甘肃第一次诊断)已知:①CH 3OH(g)+32O 2(g)===CO 2(g)+2H 2O(g) ΔH =-a kJ·mol -1 ②CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g) ΔH =-b kJ·mol -1 ③CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(l) ΔH =-c kJ·mol -1 则下列叙述正确的是( )A .由上述热化学方程式可知b >cB .甲烷的燃烧热为b kJ·mol -1 C .2CH 3OH(g)===2CH 4(g)+O 2(g)ΔH =2(b -a )kJ·mol -1 D .当甲醇和甲烷物质的量之比为1∶2时,其完全燃烧生成CO 2和H 2O(l)时,放出的热量为Q kJ ,则该混合物中甲醇的物质的量为Q a +2bmol 7.将煤转化为水煤气的主要化学反应为C(s)+H 2O(g)=====高温CO(g)+H 2(g);C(s)、CO(g)和H 2(g)完全燃烧的热化学方程式分别为C(s)+O 2(g)===CO 2(g) ΔH =-393.5 kJ·mol -1 H 2(g)+12O 2(g)===H 2O(g) ΔH =-242.0 kJ·mol -1 CO(g)+12O 2(g)===CO 2(g) ΔH =-283.0 kJ·mol -1 请回答:(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:________________________________________________________________________________________________________________________________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。
甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下面循环图:并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:__________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。
CO和H2在一定条件下可以合成:①甲醇、②甲醛、③甲酸、④乙酸。
试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
答案精析1.B [根据盖斯定律,ΔH =2×(-110.5 kJ·mol -1)-(-393.5 kJ·mol -1)=+172.5 kJ·mol -1。
]2.A [25 ℃、101 kPa 下,H 2(g)、C(s)和CH 3COOH(l)的燃烧热ΔH 分别是-285.8 kJ· mol -1、-393.5 kJ· mol -1和-870.3 kJ· mol -1,则H 2(g)+12O 2(g)===H 2O(l) ΔH =-285.8 kJ·mol -1①,C(s)+O 2(g)===CO 2(g) ΔH =-393.5 kJ· mol-1②,CH 3COOH(l)+2O 2(g)===2CO 2(g)+2H 2O(l) ΔH =-870.3 kJ·mol -1③,由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H 2(g)+O 2(g)===CH 3COOH(l),其反应热为2×(-285.8 kJ·mol -1)+2×(-393.5 kJ· mol -1)+870.3 kJ·mol -1=-488.3 kJ·mol -1。
] 3.CH 3OH(l)+O 2(g)===CO(g)+2H 2O(g)ΔH =-354.8 kJ·mol -1 4.(1)NO 2(g)+CO(g)===NO(g)+CO 2(g) ΔH =-234 kJ· mol -1 (2)FeO(s)+CO(g)===Fe(s)+CO 2(g) ΔH =-11 kJ· mol -1 5.2C(s)+SiO 2(s)===2CO(g)+Si(s)ΔH =(a +b -c )kJ·mol -1 解析 根据盖斯定律,①+②-③得:2C(s)+SiO 2(s)===2CO(g)+Si(s) ΔH =(a +b -c )kJ·mol -1。
6.C [水蒸气含有的能量比等量的液态水高,当等量的甲烷完全燃烧生成CO 2和液态水时,释放的能量较多,反应热会越小,所以c >b ,A 错误;甲烷的燃烧热指1 mol 甲烷完全燃烧生成CO 2和液态水时放出的热量,因此甲烷的燃烧热为c kJ·mol -1,B 错误;(①-②)×2,整理可得:2CH 3OH(g)===2CH 4(g)+O 2(g) ΔH =2(b -a ) kJ·mol -1,C 正确;根据②、③两式可得1 mol 的气态水变为液态水,放出热量是c -b 2kJ ,当甲醇和甲烷物质的量之比为1∶2时,其完全燃烧生成CO 2和H 2O(l)时,放出的热量为Q kJ ,则该混合物中甲醇的物质的量为Q a +(c -b )+2c mol =Q a +3c -bmol ,D 错误。
] 7.(1)C(s)+H 2O(g)===CO(g)+H 2(g)ΔH =+131.5 kJ·mol -1 (2)乙 甲同学忽略了煤转化为水煤气要吸收热量(3)①减少污染;②燃烧充分;③方便运输(任写两个)(4)②④。
