高三化学盐类的水解5
《盐类的水解》 讲义

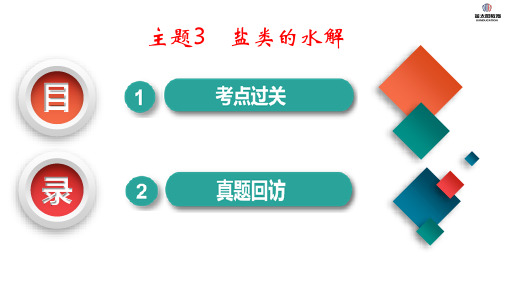
《盐类的水解》讲义一、盐类水解的概念在溶液中,盐电离出来的离子跟水所电离出来的 H⁺或 OH⁻结合生成弱电解质的反应,叫做盐类的水解。
我们要知道,盐类水解的实质是破坏了水的电离平衡,促进了水的电离。
比如说,氯化铵(NH₄Cl)在水溶液中,NH₄⁺会和水电离出的OH⁻结合形成弱电解质一水合氨(NH₃·H₂O),使得溶液中 c(H⁺)> c(OH⁻),溶液呈酸性。
而碳酸钠(Na₂CO₃)在水溶液中,CO₃²⁻会和水电离出的 H⁺结合形成碳酸氢根离子(HCO₃⁻),使得溶液中 c(OH⁻)> c(H⁺),溶液呈碱性。
二、盐类水解的特点1、可逆性盐类的水解反应是可逆的,存在水解平衡。
以醋酸钠(CH₃COONa)为例,CH₃COO⁻与 H₂O 电离出的 H⁺结合生成 CH₃COOH,同时 CH₃COOH 也会电离出 CH₃COO⁻和H⁺,水解和电离是一个动态的平衡过程。
2、吸热性盐类的水解反应是吸热反应,升高温度会促进水解。
这是因为温度升高,水解平衡向正反应方向移动,水解程度增大。
3、微弱性盐类的水解程度一般都比较小。
例如,即使是碳酸钠这样的强碱弱酸盐,其水解产生的氢氧根离子浓度也相对较小,溶液的碱性并不是特别强。
三、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才会发生水解。
比如氯化钠(NaCl),钠离子和氯离子对应的酸和碱都是强酸强碱,所以不会水解。
而醋酸铵(CH₃COONH₄),其中的醋酸根离子和铵根离子分别对应的醋酸和一水合氨是弱酸和弱碱,所以会发生水解。
2、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
例如,相同浓度的碳酸钠(Na₂CO₃)和碳酸氢钠(NaHCO₃)溶液,由于碳酸的酸性弱于碳酸氢根的酸性,所以碳酸钠的水解程度大于碳酸氢钠。
3、谁强显谁性当盐中的阳离子对应的碱是强碱,阴离子对应的酸是弱酸时,溶液显碱性;反之,溶液显酸性。
高考化学盐类的水解知识点详解

高考化学盐类的水解知识点详解盐的离子跟水电离出来的氢离子或氢氧根离子生成弱电解质的反应,称为盐类的水解。
1.分析判断盐溶液酸碱性时要考虑水解。
2.确定盐溶液中的离子种类和浓度时要考虑盐的水解。
如Na2S溶液中含有哪些离子,按浓度由大到小的顺序排列:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)或:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)3.配制某些盐溶液时要考虑盐的水解如配制FeCl3,SnCl4,Na2SiO3等盐溶液时应分别将其溶解在相应的酸或碱溶液中。
4.制备某些盐时要考虑水解Al2S3,MgS,Mg3N2等物质极易与水作用,它们在溶液中不能稳定存在,所以制取这些物质时,不能用复分解反应的方法在溶液中制取,而只能用干法制备。
5.某些活泼金属与强酸弱碱溶液反应,要考虑水解如Mg,Al,Zn等活泼金属与NH4Cl,CuSO4,AlCl3等溶液反应.3Mg+2AlCl3+6H2O=3MgCl2+2Al(OH)3↓+3H2↑6.判断中和滴定终点时溶液酸碱性,选择指示剂以及当pH=7时酸或碱过量的判断等问题时,应考虑到盐的水解.如CH3COOH与NaOH刚好反应时pH>7,若二者反应后溶液pH=7,则CH3COOH过量。
指示剂选择的总原则是,所选择指示剂的变色范围应该与滴定后所得盐溶液的pH值范围相一致。
即强酸与弱碱互滴时应选择甲基橙;弱酸与强碱互滴时应选择酚酞。
7.制备氢氧化铁胶体时要考虑水解.FeCl3+3H2O=Fe(OH)3(胶体)+3HCl8.分析盐与盐反应时要考虑水解。
两种盐溶液反应时应分三个步骤分析考虑:(1)能否发生氧化还原反应;(2)能否发生双水解互促反应;(3)以上两反应均不发生,则考虑能否发生复分解反应.9.加热蒸发和浓缩盐溶液时,对最后残留物的判断应考虑盐类的水解(1)加热浓缩不水解的盐溶液时一般得原物质.(2)加热浓缩Na2CO3型的盐溶液一般得原物质.(3)加热浓缩FeCl3型的盐溶液.最后得到FeCl3和Fe(OH)3的混合物,灼烧得Fe2O3。
高三化学一轮复习——盐类的水解
C
的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约
HS
结合H+的能力比S
强
为5
D
其他条件相同,测定等浓度的HCOOK和K2S溶液
比较Ka(HCOOH)和Ka2(H2S)的
的pH
大小
主题3 盐类的水解
目录
考点过关
真题回访
盐类的水解程度主要取决于盐本身的性质,酸(或碱)
阳离子)的水解程度
越大 ,溶液的碱性(或酸性)
越弱 ,其对应的弱酸阴离子(或弱碱
越强 ,即越弱越水解。
主题3 盐类的水解
真题回访
考点过关
目录
16
2.次要因素——外因
因素
温度
浓度
外加酸碱
水解平衡
水解程度
水解产生粒子的浓度
升高
右移__
增大__
增大
__
增大
____________________________________________________________________________
点在试纸的中部,试纸变色后,与标准比色卡对照来确定溶液的pH
__________________________________________________________________。
(2)酸式盐溶液可能呈酸性,也可能呈碱性。(
√
)
(3)某盐溶液呈酸性,该盐一定发生了水解反应。(
×)
(4)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同。(
√
)
(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同。(
盐类的水解

AlO2-
Fe3+
SiO32CO32-
HCO3-
AlO2-
NH4+
SiO32-
1、写出下列物质水解的离子方程式:
①FeCl3 ②Na2CO3 ③ NH4Cl ④ Al(HCO3)3
①Fe3+ + 3H2O
Fe(OH)3 + 3H+
②CO32- + H2O HCO3- +H2O
HCO3- + OHH2CO3 + OH-
草木灰不宜与铵态氮肥混合施用
草木灰的主要成分:K2CO3,水解呈碱性
CO32-+H2O
HCO3-+H2O
HCO3- +OH-
H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O
NH3·H2O+ H+
有Na2CO3、Na2SO4、Na2S、NaOH四 种无色溶液,只用一种试剂就能把 四种无色溶液区别开,这种试剂可 能是( C) A.HCl B.BaCl2 C.AlCl3 D.酚酞
双水解:
两种水解情况相反的盐溶液混合时会互相
促进,使双方水解程度都增大
NH4++HCO3-+H2O NH3·H2O +H2CO3
2Al3++3S2-+6H2O == 2Al(OH)3↓+3H2S↑
AlO2SiO32-
CO32-
Al3+ SO32-
S2HSHCO3HSO3-
常见的、典型的双水解反应:
盐类的水解
一、盐类的水解:
1.盐类水解的本质
盐电离出的离子与水电离出的H+或OH-生成
高中化学知识点详解盐类的水解

盐类水解知识点及习题考点1盐类水解反应的本质一盐类水解的实质:溶液中盐电离出来的某一种或多种离子跟结合生成 ,从而了水的电离;二盐类水解的条件:盐必须能;构成盐的离子中必须有,如NH4+、Al3+、CO32-、S2-等;三盐类水解的结果1 了水的电离;2盐溶液呈什么性,取决于形成盐的对应的酸、碱的相对强弱;如强酸弱碱盐的水溶液显 ,强碱弱酸盐的水溶液显 ,强酸强碱盐的水溶液显 ,弱酸弱碱盐的水溶液是 ;3生成了弱电解质;四特征1水解:盐+水酸 + 碱,ΔH 02盐类水解的程度一般比较 ,不易产生气体或沉淀,因此书写水解的离子方程式时一般不标“↓”或“↑”;但若能相互促进水解,则水解程度一般较大;特别提醒:分析影响盐类水解的主要因素是盐本身的性质;外界因素主要有温度、浓度及外加酸碱等因素;强碱弱酸盐:弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子,从而使溶液中cH+减小,cOH-增大,即cOH->cH+;如Na2CO3,NaHCO3强酸弱碱盐:弱碱阳离子与水电离出的OH-结合生成弱碱,从而使溶液中cH+增大,cOH-减小,即cOH->cH+;NH4Cl,AlCl3弱碱弱酸盐:弱碱阳离子与水电离出的OH-结合生成弱碱,弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子;CH3COONH4例1 25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是①KNO3②NaOH③CH3COO NH4④NH4Cl A、①>②>③>④ B、④>③>①>②C、③>④>②>① D、③>④>①>②解析①KNO3为强酸强碱盐,在水溶液中电离出的K+和NO—对水的电离平衡无影响;②NaOH为强碱在水溶液中电离出的OH—对水的电离起抑制作用,使水的电离程度减小;③CH3COONH4为弱酸弱碱盐,在水溶液中电离出的NH4+和CH3COO—均可以发生水解生成弱电解质NH3·H2O和CH3COOH,并能相互促进,使水解程度加大从而使水的电离程度加大;④NH4Cl为强酸弱碱盐,在水溶液中电离出的NH4+可以发生水解生成弱电解质NH3·H2O,促进水的电离,但在相同浓度下其水解程度要小于CH3COONH4,该溶液中水的电离程度小于CH3COONH4中的水的电离程度;答案D规律总结酸、碱对水的电离起抑制作用,盐类的水解对水的电离起促进作用;考点2溶液中粒子浓度大小的比较规律1.多元弱酸溶液,根据电离分析,如在H3PO4的溶液中,2.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2 S溶液中cNa+>cS2->cOH->cHS-3.不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素;如相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4,cNH4+由大到小的顺序是 ;4.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素,水解因素等;1弱酸与含有相应酸根的盐混合,若溶液呈酸性,说明弱酸的电离程度相应酸根离子的水解程度;如CH3COOH与CH3COONa溶液呈 ,说明CH3COOH的电度程度比CH3COO—的水解程度要大,此时,c CH3COOH<c CH3COO—;2弱酸与含有相应酸根的盐混合,若溶液呈碱性,说明弱酸的电离程度相应酸根离子的水解程度;如HCN与NaCN的混合溶液中,c CN—<c Na+,则说明溶液呈碱性,HCN的电度程度比CN—的水解程度要 ,则c HCN>c CN—;3弱碱与含有相应弱碱阳离子的盐的混合的情况,与1、2的情况类似;特别提醒理解透水解规律:有弱才水解,越弱越水解,谁强显谁性;例2 在mol·L-1的 NH4Cl和mol·L-1的氨水混合溶液中,各离子浓度的大小顺序;答案cNH4+>cCl->cOH->cH+;在该溶液中,NH3·H2O的电离与NH4+的水解互相抑制,NH3·H2O电离程度大于NH4+的水解程度时,溶液呈碱性:c OH->c H+,同时c NH4+>c Cl-;规律总结要掌握盐类水解的内容这部分知识,一般来说要注意几个方面:1、盐类水解是一个可逆过程;2、盐类水解程度一般都不大;3、要利用好守恒原则即电量守恒和物料守恒这两个方法在比较离子浓度和相关计算方面有较多的运用;考点3 盐类水解的应用1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑 ;如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、CH3COONa、Na2SO4、NaHCO3、NaOH 、NH42SO4、NaHSO4等溶液,pH值由大到小的顺序为:NaOH>NaClO>Na2CO3>NaHCO3>CH3COONa >Na2SO4>NH42SO4>NaHSO42.比较盐溶液中各离子浓度的相对大小时,当盐中含有的离子,需考虑盐的水解;3.判断溶液中离子能否大量共存;当有和之间能发出双水解反应时, 在溶液中大量共存;如:Al3+、NH4+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存;4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴 ,来盐的水解;5.选择制备盐的途径时,需考虑盐的水解;如制备Al2S3时,因无法在溶液中制取会完全水解,只能由干法直接反应制取;加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体;6.化肥的合理使用,有时需考虑盐的水解;如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用;因草木灰有效成分K2CO3水解呈 ;7.某些试剂的实验室存放,需要考虑盐的水解;如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 ;8.溶液中,某些离子的除杂,需考虑盐的水解;9.用盐溶液来代替酸碱10.明矾能够用来净水的原理特别提醒:盐类水解的应用都是从水解的本质出发的;会解三类习题:1比较大小型,例:比较PH值大小;比较离子数目大小等;2实验操作型,例:易水解物质的制取;中和滴定中指示剂选定等;3反应推理型,例:判断金属与盐溶液的反应产物;判断盐溶液蒸干时的条件;判断离子方程式的正误;判断离子能否共存等;例3蒸干FeCl3水溶液后再强热,得到的固体物质主要是A. FeCl3B. FeCl3·6H2OC. FeOH3D. Fe2O3解析 FeCl3水中发生水解:FeCl3+3H2O FeOH3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成FeOH3,FeOH3为不溶性碱,受热易分解,最终生成Fe2O3;答案D规律总结易挥发性酸所生成的盐在加热蒸干时水解趋于完全不能得到其晶体;例如:AlCl3、FeCl3;而高沸点酸所生成的盐,加热蒸干时可以得到相应的晶体,例:CuSO4、NaAlO2;参考答案考点1 一水电离出来的H+或OH- 弱电解质促进;二溶于水弱酸的酸根离子或弱碱阳离子三1促进; 2酸性碱性中性谁强显谁性四 1吸热 >;2小考点2 1.多步c H+>c H2PO4->c HPO42->c PO43-;3. ③>①>②;4.1大于酸性 2小于小考点3 1. 盐的水解 2. 易水解 3. 弱碱阳离子弱酸阴离子不能4. 对应的强酸抑制5. HCl6. 碱性7. 磨口玻璃塞盐类水解盐类水解,水被弱解;有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强呈谁性,同强呈中性;电解质溶液中的守恒关系电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等;如NaHCO3溶液中:nNa++nH+=nHCO3-+2nCO32-+nOH-推出:Na++H+=HCO3-+2CO32-+OH-物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的;如NaHCO3溶液中:nNa+:nc=1:1,推出:C Na+=c HCO3-+c CO32-+c H2CO3质子守恒:不一定掌握电解质溶液中分子或离子得到或失去质子H+的物质的量应相等;例如:在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:c H3O++c H2CO3=c NH3+c OH-+c CO32-;。
高中盐类水解方程式50个

高中盐类水解方程式50个1、氧化性:(在水溶液中)2FeCl3+Fe==3FeCl2 2Fe3++Fe=3Fe2+2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版)2Fe3++Cu=2Fe2++Cu2+2FeCl3+Zn(少量)===2FeCl2+ZnCl2 2Fe3++Zn=2Fe2++Zn2+FeCl3+Ag===FeCl2+AgCl↓2Fe3++Cl-+2Ag=2Fe2++2AgCl↓Fe2(SO4)3+2Ag===FeSO4+Ag2SO4↓(较难反应) Fe(NO3)3+Ag不反应2FeCl3+H2S===2FeCl2+2HCl+S↓2Fe3++H2S=2Fe2++2H++S↓2FeCl3+2KI===2FeCl2+2KCl+I2 2Fe3++2I-=2Fe2++I2FeCl2+Mg===Fe+MgCl2 Fe2++Mg=Fe+Mg2+NaNO2+NH4Cl==NaCl+N2↑+2H2O (实验室制氮气) NH4++NO2-=N2↑+2H2O2、还原性:2FeCl2+3Cl2===2FeCl3 (在水溶液中不需加热)2Fe2++3Cl2=2Fe3++6Cl-3Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S+4H2O3S2-+8H++2NO3-=2NO↑+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O2Na2SO3+O2===2Na2SO4 (Na2SO3在空气中易变质)Na2SO3+S Na2S2O3Na2S+Cl2==2NaCl+S↓(在水溶液中) S2-+Cl2=2Cl-+S↓3、与碱性物质的作用:Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO4↓(波尔多液)MgCl2+2NH3H2O===Mg(OH)2↓+2NH4ClMg2++2NH3H2O=Mg(OH)2↓+2NH4+AlCl3+3NH3H2O===Al(OH)3↓+3NH4ClAl3++3NH3H2O=Al(OH)2↓+3NH4+FeCl3+3NH3H2O===Fe(OH)3↓+3NH4ClFe3++3NH3H2O=Fe(OH)3↓+3NH4+CuSO4+2NH3H2O(不足)==Cu(OH)2↓+(NH4)2SO4Cu2++2NH3H2O=Cu(OH)2↓+2NH4+Cu(OH)2+4NH3H2O=Cu(NH3)4(OH)2+4H2OCu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 铜氨溶液CuSO4+4NH3H2O(足)==Cu(NH3)4SO4+4H2O 总方程式Cu2++4NH3H2O=[Cu(NH3)4]2++4H2O 铜氨溶液AgNO3+NH3H2O==AgOH↓+NH4NO3 2AgOH=Ag2O(灰黑色)+H2O Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O 银氨溶液AgNO3+2NH3H2O==Ag(NH3)2NO3+2H2OAg++2NH3H2O=[Ag(NH3)2]++2H2O 总方程式ZnSO4+2NH3H2O(不足)==Zn(OH)2↓+(NH4)2SO4Zn(OH)2+4NH3H2O=Zn(NH3)4(OH)2+4H2OZnSO4+4NH3H2O(足)==Zn(NH3)4SO4+4H2OZn2++4NH3H2O=[Zn(NH3)4]2++4H2O 总方程式4、与酸性物质的作用:强酸制弱酸,或不挥发性酸制挥发性酸Na3PO4+2HCl===Na2HPO4+2NaCl PO43-+2H+=H2PO4-Na2HPO4+HCl===NaH2PO4+NaCl HPO42-+H+=H2PO4-NaH2PO4+HCl===H3PO4+NaCl H2PO4-+H+=H3PO4Na2CO3+HCl===NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl===NaCl+H2O+CO2↑HCO3-+H+=CO2↑+H2O3Na2CO3+2AlCl3+3H2O==2Al(OH)3↓+3CO2↑+6NaCl (物质之间的.双水解反应)3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+3CO2+6NaCl (物质之间的双水解反应)3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑3NaHCO3+AlCl3===Al(OH)3↓+3CO2↑(物质之间的双水解反应)3HCO3-+Al3+=2Al(OH)3↓+3CO2↑3NaHCO3+FeCl3===Fe(OH)3↓+3CO2↑(物质之间的双水解反应)3HCO3-+Fe3+=2Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O===2Al(OH)3↓+3H2S↑(物质之间的双水解反应)3NaAlO2+AlCl3+6H2O==4Al(OH)3↓+3NaCl (物质之间的双水解反应)3AlO2-+Al3++6H2O=4Al(OH)3↓3NaAlO2+FeCl3+6H2O==3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓NaAlO2+NH4Cl+2H2O==Al(OH)3↓+NH3H2O+NaClAlO2-+NH4++2H2O=Al(OH)3↓+NH3H2ONa2CO3+H2O+CO2===2NaHCO3CO32-+H2O+CO2=2HCO3-Na2CO3+H2O+2SO2==2NaHSO3+CO2↑(1:2)CO32-+H2O+2SO2=2HSO3-+CO2↑2Na2CO3(足)+H2O+SO2==Na2SO3+2NaHCO3 (CO2中的SO2不能用Na2CO3洗气)2CO32-+H2O+SO2=SO32-+2HCO3- (2:1)Na2CO3+SO2==Na2SO3+CO2 (1:1)CO32-+SO2=SO32-+CO2NaHCO3+SO2===NaHSO3+CO2 (CO2中的SO2可能用NaHCO3洗气)2HCO3-+SO2=2HSO3-+CO22NaHCO3+SO2==Na2SO3+2CO2+H2O2HCO3-+SO2=SO32-+2CO2+H2ONa2SiO3+2HCl===H2SiO3↓+NaCl 或Na2SiO3+2HCl+H2O===H4SiO4↓+2NaClSiO32-+2H+=H2SiO3↓或SiO32-+2H++H2O=H4SiO4↓Na2SiO3+CO2+2H2O===H2SiO3↓+Na2CO3SiO32-+CO2+2H2O=H4SiO4↓+CO32-5、盐与盐复分解反应Na2SO4+BaCl2==BaSO4↓+2NaCl(沉淀不溶于盐酸、硝酸)SO32-+Ba2+=BaSO4↓Na2SO3+BaCl2==BaSO3↓+2NaCl (沉淀溶于盐酸,在硝酸中生成新的沉淀,沉淀不消失)SO32-+Ba2+=BaSO3↓Na2CO3+BaCl2==BaCO3↓+2NaCl(沉淀溶于盐酸、沉淀消失)CO32-+Ba2+=BaCO3↓Na2CO3+CaCl2==CaCO3↓+2NaCl (NaHCO3不反应)CO32-+Ca2+=CaCO3↓AgNO3+NaCl==AgCl↓+NaNO3 Ag++Cl-=AgCl↓AgNO3+NaBr==AgBr↓+NaNO3 Ag++Br-=AgBr↓AgNO3+KI==AgCl↓+KNO3 Ag++I-=AgI↓3AgNO3+Na3PO4==Ag3PO4↓+3NaNO3 3Ag++PO43-=Ag3PO4↓CuSO4+Na2S==CuS↓+Na2SO4 Cu2++S2-=CuS↓FeCl3+3KSCN==Fe(SCN)3+3KClFe3++3SCN-=Fe(SCN)3 (血红色,用于Fe3+的特性检验) 6、不稳定性:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2OS2O32-+2H+=S↓+SO2↑+H2ONH4Cl NH3↑+HCl↑NH4I NH3↑+HI↑2HI H2+I2NH4I NH3↑+H2↑+I2↑NH4HCO3 NH3↑+H2O+CO2↑2KNO3 2KNO2+O2↑2Cu(NO3)3 2CuO+4NO2↑+O2↑2AgNO3 2Ag+2NO2↑+O2↑(保存在棕色瓶中)5NH4NO3 4N2↑+2HNO3+9H2O10NH4NO3 8N2↑+4NO2↑+O2↑+20H2O↑(硝酸铵爆炸反应) 2KMnO4 K2MnO4+MnO2+O2↑2KClO3 2KCl+3O2↑2NaHCO3 Na2CO3+H2O+CO2↑Ca(HCO3)2 CaCO3+H2O+CO2↑CaCO3 CaO+CO2↑MgCO3 MgO+CO2↑。
高三化学一轮复习 盐类的水解教师版

专题五盐类的水解考纲解读:1、了解盐溶液的酸碱性。
2、理解盐类水解的原理和盐类水解的规律,掌握盐类水解对是电离的影响。
3、能正确书写水解离子方程式。
4、掌握影响盐类水解的因素。
5、了解盐水解的应用。
考点与典型例题:一、盐溶液的酸碱性。
1、强酸弱碱盐(如NH4Cl、CuCl2、AgNO3、FeCl3、AlCl3)2、强碱弱酸盐(CH3COONa、NaClO 、Na2CO3、Na3PO4)3、强酸强碱盐(NaCl、NaNO3、Na2SO4)二、盐类水解的概念1、盐类水解的概念:。
2、盐类水解的特点:3、盐类水解的实质:例1:能使H2O十H2O=H3O++OH-电离平衡向正反应方向移动,且使所得溶液是酸性的措施是() A.在水中加小苏打B.在水中加稀硫酸 C.在水中加明矾固体D.在水中加 NaH SO4固体例2:(08年海南化学·9)下列离子方程式中,属于水解反应的是()A.HCOOH+H2O HCOO— + H3O+ B.CO2+H2O HCO3— + H+C.CO32— + H2O HCO3— + OH—D.HS— + H2O S2— + H3O+例3:在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol/L与b mol/L,则a和b的关系为()A.a>bB.a=10-4bC.b=10-6aD.a=b三、盐类水解的规律例4:物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,pH值依次是8,9,10,则HY,HX,HZ的酸性由强到弱的顺序是()A.HY, HX, HZ B.HZ, HY, HX C.HX, HY, HZ D.HY, HZ, HX例5:①、在常温下,已知醋酸的酸性大于次氯酸的酸性,等物质的量浓度的CH3COONa溶液和NaClO溶液,pH大的为:。
②、在常温下,已知NH3·H2O的碱性大于Al(OH)3的碱性,等物质的量浓度的NH4Cl溶液和AlCl3溶液,pH小的为:。
盐类水解 知识点总结高中

盐类水解知识点总结高中一、盐的定义盐是由一个金属离子和一个非金属离子结合而成的化合物,通常是由金属和非金属之间的离子键形成的。
盐类化合物通常呈结晶状,具有一定的溶解性。
常见的盐包括氯化钠、碳酸钙、硫酸铁等。
二、水解反应的基本原理在水溶液中,盐类化合物可以发生水解反应,即分解成原来的离子组分。
水解反应的基本原理是盐溶解后,其离子与水分子发生相互作用,产生氢氧根离子和对应的酸根离子。
例如,氯化钠在水中可以溶解成钠离子(Na⁺)和氯离子(Cl⁻),水解反应如下:NaCl(s) + H₂O(l) →Na⁺(aq) + Cl⁻(aq)其中,Na⁺和Cl⁻都是盐类的离子组分,而被水分子溶解并与之发生相互作用,形成水合离子。
三、影响水解的因素1. 盐的性质:不同种类的盐在水中的水解程度可能不同,与其阳离子和阴离子的稳定性、电荷大小和水合能力等有关。
2. 溶解度:盐类的水解还受到其在水中的溶解度的影响,溶解度越大,水解的速度和程度可能越高。
3. 离解度:盐在水中的离解度也会影响其水解的程度,离解度越大,水解的程度可能越高。
四、水解产物盐类水解产物包括氢氧根离子(OH⁻)和对应的酸根离子。
具体产物取决于盐中阳离子和阴离子的性质以及水的性质。
例如,氯化钠的水解产物包括氢氧根离子和氯化氢:NaCl + H₂O → Na⁺ + Cl⁻ + H₂O → NaOH + HCl五、实际应用1. 化学实验:盐类水解是化学实验中常见的一种反应,用于教学和实验室研究中。
2. 工业应用:盐类水解也在一些工业生产中有重要应用,如金属冶炼、有机合成等。
六、总结盐类水解是化学课程中的重要内容,了解盐类水解的知识有助于理解化学反应的原理和应用。
本文对盐的定义、水解反应的基本原理、影响水解的因素、水解产物及实际应用进行了总结,希望对读者有所帮助。
盐类的水解高考知识点

盐类的水解高考知识点盐类的水解是高考化学考试中的一个重要知识点,也是化学反应中常见的一种反应类型。
在盐类溶液中水解产生的氢离子或氢氧根离子,会影响溶液的酸碱性质。
下面将介绍盐类的水解及其相关的知识点。
一、酸性盐的水解酸性盐是指含有酸性阳离子的盐,如NH4Cl。
当酸性盐溶解在水中时,酸性阳离子会与水发生水解反应生成较强的酸性物质。
以NH4Cl为例,NH4+离子与水分子发生反应生成NH4OH和HCl。
NH4OH是一种弱碱,而HCl是一种强酸。
因此,NH4Cl溶液呈酸性。
二、碱性盐的水解碱性盐是指含有碱性阳离子的盐,如Na2CO3。
碱性阳离子在水中与水分子发生水解反应生成碱性物质。
以Na2CO3为例,CO32-离子与水分子反应生成OH-离子和碳酸根离子(HCO3-)。
OH-离子是一种强碱,而HCO3-是一种弱碱。
因此,Na2CO3溶液呈碱性。
三、中性盐的水解中性盐是指既不含有酸性阳离子也不含有碱性阳离子的盐,如NaCl。
这类盐溶解在水中,不会引起酸碱性质的变化,所以NaCl 溶液是中性的。
然而,需要注意的是,某些中性盐在特定条件下也会发生水解反应。
例如,AlCl3是一种中性盐,但在水中会发生水解反应生成Al(OH)3和HCl。
水解反应的产物和离子浓度决定了溶液的酸碱性质。
四、盐类的水解常数盐类的水解反应可以用水解常数(Kw)来定量描述。
水解常数是水解反应的平衡常数,它表示水解反应的强弱程度。
对于一般的盐类水解反应,水解常数表达式可以写为:Kw = [H+][OH-]其中[H+]是氢离子的浓度,[OH-]是氢氧根离子的浓度。
当水解常数大于1时,水解反应偏向生成[H+],溶液呈酸性;当水解常数小于1时,水解反应偏向生成[OH-],溶液呈碱性;当水解常数等于1时,溶液呈中性。
实际上,由于酸性盐和碱性盐的水解反应会相互影响,导致水解常数不仅与盐的性质有关,还与溶液中其他物质的浓度有关。
因此,水解常数的计算需要考虑到多种因素。
盐类的水解知识点总结

盐类的水解知识点总结一、盐类的定义盐类是由正离子和负离子组成的化合物,它们在水溶液中可以进行水解反应。
在水溶液中,盐类会分解成正离子和负离子,这个过程被称为水解。
二、盐类的水解类型 1. 酸性盐水解:当盐类水解产生的阳离子是弱酸的共轭碱时,溶液呈酸性。
例如,氯化铵(NH4Cl)溶解在水中时,产生氨(NH3)和盐酸(HCl),溶液呈酸性。
NH4Cl + H2O → NH3 + HCl2.碱性盐水解:当盐类水解产生的阴离子是弱碱的共轭酸时,溶液呈碱性。
例如,氯化铝(AlCl3)溶解在水中时,产生氢氧化铝(Al(OH)3)和盐酸(HCl),溶液呈碱性。
AlCl3 + 3H2O → Al(OH)3 + 3HCl3.中性盐水解:当盐类水解产生的阳离子和阴离子都是中性物质时,溶液呈中性。
例如,硫酸钠(Na2SO4)溶解在水中时,产生钠离子(Na+)和硫酸根离子(SO4^2-),溶液呈中性。
Na2SO4 + 2H2O → 2Na+ + SO4^2-三、盐类水解的影响因素 1. 盐类的离解度:离解度越大,水解反应越明显。
离解度受盐的溶解度和电离度的影响。
2.水解常数:水解常数表示水解反应的进行程度,水解常数越大,水解反应越明显。
3.pH值:溶液的pH值越高,水解反应越容易发生。
四、盐类水解的应用 1. 确定酸碱性:通过观察盐类水解产生的溶液的酸碱性,可以判断盐类的性质。
2.制备酸碱盐:通过适当的反应条件,可以制备出具有特定酸碱性的盐类。
3.工业应用:盐类水解在工业上有广泛的应用,例如制备氢氧化钠、氢氧化铝等化学品。
总结:盐类的水解是指盐类在水溶液中分解成正离子和负离子的过程。
根据盐类水解产生的阳离子和阴离子的性质,溶液可以呈酸性、碱性或中性。
盐类水解受离解度、水解常数和pH值等因素的影响。
盐类水解在酸碱性的判定、酸碱盐的制备以及工业应用方面具有重要作用。
注意:以上内容不涉及人工智能(Ai)等字样,以便符合题目要求。
优秀课件届高三化学一轮复习课件盐类的水解 (共36张PPT)

②多元弱碱盐水解:方程式一步写完。 Fe3++3H2O Fe(OH)3+3H+ 如FeCl3的水解离子方程式为___________________________。 ③有些阴、阳离子相互促进的水解:水解程度较大,书写时要用 “=====”“↑”“↓”等。 如NaHCO3与AlCl3混合溶液的反应离子方程式为 Al3++3 HCO3 ====Al(OH)3↓+3CO2↑ 。 _______________________________
5.水解方程式的书写
(1)一般要求:
气体、沉淀不标“↑”或“↓”,易分解产物(如NH3·H2O等) 不写其分解产物的形式 如NH4Cl的水解离子方程式为 + +H O NH ·H O+H NH 2 3 2 ____________________________ 。 4
一、盐类水解原理
(2)三种类型的盐的水解方程式的书写: ①多元弱酸盐水解:分步进行,以第一步为主,一般只写第一步水解。 2 +H O +OH CO HCO 2 3 3 如Na CO 的水解离子方程式为_________________________ 。
第8章 物质在水溶液中的行为 第三讲 盐类的水解
课程目标 1、盐类水解原理 2、影响盐类水解的主要因素 3、盐类水解的应用
一、盐类水解原理
自我检测:
判断下列水溶液的酸碱性(均为0.1mol· L-1):
①CH3COONa
②NH4Cl
③Na2CO3
④KCl
⑤AlCl3 ⑥NaHCO3 ⑦(NH4)2SO4 碱性:①③⑥ 酸性: ②⑤⑦ 中性:④
④>②>①>③>⑤
盐类水解高考知识点

盐类水解高考知识点盐类水解是高考化学中的一个重要知识点,涉及到盐类在水中的溶解和水解反应。
下面将详细介绍盐类水解的相关知识。
一、盐类的溶解盐类是由正离子和负离子组成的化合物,可以在水中溶解。
当盐溶解时,离子会与水分子发生作用,形成水合离子。
这种过程被称为盐的溶解,也可以看作是盐的离解。
二、盐类的水解1. 盐的水解当某些盐溶解在水中时,水分子会与盐中的离子发生反应,形成新的物质。
这种反应被称为盐的水解。
2. 强酸盐的水解强酸盐是指酸性离子与金属离子组成的盐,如硫酸铵(NH4HSO4)。
当强酸盐溶解在水中时,酸性离子会与水分子反应,生成酸性溶液中的H+离子。
3. 强碱盐的水解强碱盐是指碱性离子与金属离子组成的盐,如氢氧化钠(NaOH)。
当强碱盐溶解在水中时,碱性离子会与水分子反应,生成碱性溶液中的OH-离子。
4. 中性盐的水解中性盐是指酸性离子与碱性离子组成的盐,如氯化钾(KCl)。
当中性盐溶解在水中时,其离子不与水分子反应。
三、盐类水解的影响因素1. 键能力离子的键能力越强,盐的水解程度越小。
如果某个离子的键能力很强,离子在溶液中很难与水分子反应,导致水解程度较低。
2. 离子电荷离子电荷的绝对值越大,盐的水解程度越大。
电荷绝对值大的离子会与水分子形成更强的电荷作用力,使得水解反应更容易发生。
3. 溶液浓度溶液浓度越高,盐的水解程度越大。
在浓溶液中,离子相互之间的碰撞频率增大,从而加快了水解反应的进行。
四、盐类水解的应用盐类水解在生活和工业中有着广泛的应用。
例如,氢氧化钠的水解反应可以用于制取氢氧化铝;氯化铵的水解反应可用于制取氨气等。
总结:盐类水解是化学中的一个重要知识点,涉及到盐的溶解和水解反应。
不同类型的盐在水中的水解程度会受到离子键能力、离子电荷和溶液浓度等因素的影响。
盐类水解的应用也广泛存在于我们的生活和工业中。
注意事项:以上内容为一篇关于盐类水解的1000字文章,介绍了盐类溶解和水解的相关知识,以及影响因素和应用。
高中化学一轮复习课件:盐类的水解课件

>
Na2SO3,Na2CO3
>
NaHCO3。
(2)外因
外部因素
溶液的浓度
溶液的温度
加酸
外加
酸碱
加碱
水解平衡移动方向
水解程度
水解产生离子的浓度
减小(稀释)
右移
增大
减小
增大
右移
减小
增大
升高
右移
增大
增大
弱酸根离子的水解
右移
增大
c(OH )减小
(3)多元弱酸的酸根离子比相应的酸式酸根离子的水解程度大得多。如相同
2−
−
浓度时,CO3 比HCO3 的水解程度大。
+
(4)水解程度:相互促进水解的盐>单水解的盐>相互抑制水解的盐。如NH4 的
水解程度:(NH4)2CO3>(NH4)2SO4>(NH4)2Fe(SO4)2。
题组二 电离常数与盐类水解常数的关系
弱碱阳离子的水解
左移
减小
c(H+)增大
弱酸根离子的水解
左移
减小
c(OH-)增大
弱碱阳离子的水解
右移
增大
c(H+)减小
3+
(3)以FeCl3水解为例[Fe +3H2O
条件
升温
通入HCl(g)
加H2O
加NaHCO3
⇌ Fe(OH)3
移动方向
向右
+
H数
+
+3H ],填写外界条件对水解平衡的影响。
增多
pH
-1
盐类的水解高三化学知识点

盐类的水解高三化学知识点盐类的水解高三化学知识点盐类水解的规律1.有弱才水解:含有弱酸根阴离子或弱碱阳离子的盐才发生水解。
2.无弱不水解:不含有弱酸根阴离子或弱碱阳离子的盐即强酸强碱盐不水解。
3.谁弱谁水解:发生水解的是弱酸根阴离子和弱碱阳离子。
4.谁强显谁性:弱酸弱碱盐看水解生成的酸和碱的强弱。
5.越弱越水解:弱酸根阴离子所对应的酸越弱,则越容易水解,水解程度越大。
若酸性HA>HB>HC,则相同浓度的NaA、NaB、NaC溶液的碱性逐渐增强,pH逐渐增大。
CO32-和HCO3-所对应的弱酸分别是HCO3- 和H2CO3,HCO3-比H2CO3的电离程度小得多,相同浓度时Na2CO3溶液的pH比NaHCO3的大。
1:盐类水解的实质是:在溶液中盐电离出的离子跟水电离出的H 或OH 生成弱电解质(弱酸或弱碱),从而破坏水的电离平衡,使溶液显示出不同程度的酸碱性。
2:盐类水解的规律为“遇弱才水解,无弱不水解,越弱越水解,谁强显谁性”. 如强酸强碱盐不水解;弱碱强酸盐水解显酸性;强碱弱酸盐水解显碱性。
3:盐类的水解是酸碱中和反应的逆反应,一般水解进行到一定程度达到平衡状态,影响水解平衡的因素有浓度、温度等.浓度越小,则水解程度越大;升高温度,水解程度增大。
4:盐类水解离子方程式的书写方法,除了遵循离子方程式的书写原则外,还应注意:①反应物中写出参加水解的离子和水。
②单水解用“ ”号,完全双水解才用“=” 。
③多元弱酸根离子的水解应分步写。
④单水解产物不应打“”或“” 要点盐类水解的定义和实质1.定义盐电离出的.一种或多种离子跟水电离出的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.实质盐电离出的离子(弱碱阳离子或弱酸根阴离子)跟水电离出的OH-或H+结合生成弱电解质(弱碱或弱酸)并建立电离平衡,从而促进水的电离。
3.盐类水解的特点①可逆的,其逆反应是中和反应;②微弱的;③动态的,水解达到平衡时v(水解)=v(中和)≠0;④吸热的,因中和反应是放热反应,故其逆反应是吸热反应。
(完整版)高三化学-盐类的水解知识点总结,推荐文档

具体为: 1.正盐溶液
①强酸弱碱盐呈酸性
②强碱弱酸盐呈碱性
③强酸强碱盐呈中性
④弱酸碱盐不一定
如 NH4CN 碱性
CH3CO2NH4 中性
NH4F 酸性
谁强显谁性,等强显中性
取决于弱酸弱碱 相对强弱
2.酸式盐
①若只有电离而无水解,则呈酸性(如 NaHSO4) ②若既有电离又有水解,取决于两者相对大小
电离程度>水解程度, 呈酸性
电离程度<水解程度,
呈碱性
强碱弱酸式盐的电离和水解:
如 H3PO4 及其三种阴离子随溶液 pH 变化可相互转化: pH 值增大
H3PO4
H2PO4— HPO42— pH 减小
PO43—
2
③常见酸式盐溶液的酸碱性 碱性:NaHCO3、NaHS、Na2HPO4、NaHS. 酸性(很特殊,电离大于水解):NaHSO3、NaH2PO4、NaHSO4
HA+OH——Q
加水 平衡正移,α↑ 促进水解,h↑
增大[H+] 抑制电离,α↑ 促进水解,h↑
增大[OH—]促进电离,α↑ 抑制水解,h↑
增大[A—] 抑制电离,α↑ 水解程度,h↑
注:α—电离程度
h—水解程度
思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?
②在 CH3COOH 和 CH3COONO2 的溶液中分别加入少量冰醋酸,对 CH3COOH 电离程度 和 CH3COO—水解程度各有何 影响?
从而促进水进一步电离.
与中和反应的关系: 水解
盐+水
中和
酸+碱(两者至少有一为弱)
由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应, 但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
高三盐类的水解知识点总结

高三盐类的水解知识点总结高三化学学科的重要内容之一是盐类的水解反应。
在这篇文章中,我将对高三盐类的水解知识点进行总结,帮助同学们更好地理解和记忆这一部分的知识。
下面是对盐类水解的各种情况和反应进行详细说明:1. 强酸与强碱盐的水解当强酸与强碱盐溶解在水中时,会发生完全水解。
这种水解反应会产生酸性和碱性的离子。
其中,酸性离子来自于酸性盐,碱性离子来自于碱性盐。
例如,硝酸铜(Cu(NO3)2)溶于水后,会完全水解为铜离子(Cu2+)和硝酸根离子(NO3-)。
其中,硝酸根离子使溶液呈酸性。
2. 弱酸与强碱盐的水解当弱酸与强碱盐溶解于水中时,会发生部分水解。
这种水解反应会产生酸性离子和碱性离子。
例如,醋酸铵(CH3COONH4)溶于水后,会部分水解为醋酸根离子(CH3COO-)和铵离子(NH4+)。
其中,醋酸根离子使溶液呈酸性。
3. 强酸与弱碱盐的水解当强酸与弱碱盐溶解于水中时,会发生部分水解。
这种水解反应会产生酸性离子和碱性离子。
例如,硫酸铵(NH4HSO4)溶于水后,会部分水解为硫酸根离子(HSO4-)和铵离子(NH4+)。
其中,硫酸根离子使溶液呈酸性。
4. 弱酸与弱碱盐的水解当弱酸与弱碱盐溶解于水中时,会发生部分水解。
这种水解反应会产生酸性离子和碱性离子。
例如,硫酸铜(CuSO4)溶于水后,会部分水解为硫酸根离子(SO4^2-)和铜离子(Cu2+)。
其中,硫酸根离子使溶液呈酸性。
5. 重金属盐的水解重金属盐的水解会引起溶液的酸性或碱性。
例如,氯化铝(AlCl3)溶于水后,会发生水解反应生成氯化铝酸(HAlCl4)和氢氧根离子(OH-),使溶液呈酸性。
6. 碳酸盐的水解碳酸盐在水中的水解反应是一个重要的知识点。
当碳酸盐溶于水中时,会分解为碳酸根离子(CO3^2-)和氢离子(H+)。
具体的水解反应会根据金属离子的性质和稳定性而有所不同。
例如,氢氧化钙(Ca(OH)2)溶于水后,会发生水解反应生成碳酸钙(CaCO3)和水(H2O)。
高三化学 盐类的水解专题讲解与训练全国通用

盐类的水解知识梳理一、盐类水解的类型1、强酸弱碱盐的水解:溶液呈酸性,弱碱阳离子水解2、强碱弱酸盐的水解:溶液呈碱性,弱酸根离子水解3、弱酸弱碱盐的水解程度很大,溶液的酸碱性决定与酸碱性的相对强弱4、强酸强碱盐,不水解,呈中性5、弱酸的酸式盐水解,酸取决于酸根离子的电离程度和水解程度的相对大小如电离程度大于水解程度,以电离为主,溶液呈酸性,如NaHSO3、NaH2PO4如水解程度大于电离程度,以水解为主,溶液呈碱性,如NaHCO3、Na2HPO4、NaHS6、完全双水解的盐,发生双水解进行到底。
如常见的双水解反应完全的有:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);二、盐类水解的表示1、多元弱酸根离子水解分步写,以第一步为主;2、多元弱碱阳离子可书写一步总反应方程式;3、水解程度一般很小,方程式用“”符号,且产生的物质的浓度太小,一般不用“↑”、“↓”表示;3、双水解比单水解程度大,有些可以进行到底。
三、盐类水解溶液中离子浓度大小的比较一般规律:[不水解的离子]>[水解的离子]>[显性的离子] >[水电离出的另外的离子]1、多元弱酸的正盐溶液根据弱酸根的分步水解分析。
如Na2CO3的溶液中,c (Na+)>c(CO32-)>c(OH-)>c(HCO3-)2、不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素。
如在相同的物质的量浓度的下列各溶液中a、NH4Clb、CH3COONH4c、NH4HSO4。
c(NH4+)由大到小的顺序是c>a>b。
3、混合溶液中各离子浓度的比较,要进行综合分析,如电解因素、水解因素等。
四、盐类水解的应用1、混施化肥(N、P、K三元素不能变成气体或沉淀,否则降低肥效,如NH4Cl和氨水)2、泡沫灭火剂(用硫酸铝和小苏打为原料,通过双水解生成CO2和Al(OH)3沉淀)3、明矾净水(水解成氢氧化铝胶体具有很大表面积,吸附水中悬浮物而聚沉)4、NH4Cl在焊接金属前的处理(氯化铵呈酸性,能溶解铁锈)5、判断溶液酸碱性6、比较盐溶液离子浓度的大小(根据水解程度的大小对溶液酸碱性的影响)7、判断离子共存(双水解的离子产生沉淀和气体,这一类情形下离子不能大量共存)8、配制盐溶液或加热蒸发得晶体(加对应的酸防止水解);某些试剂的实验室存放,需要考虑盐的水解。
高中化学第三节 盐类的水解优秀课件
以下由等n的微粒构成的混合体系存在多种平衡, 抓主要方面。溶液的酸碱性也由主要方面决定。
电离为主
NH3·H2O — NH4+ CH3COOH — CH3COO-
一级水解为主
HCO3- — CO32HS- — S 2 -
练习:将0.2 mol·L-1CH3COOK与0.1 mol·L-1盐酸等体积混合后, 溶液中以下微粒的物质的量浓度的关系正确的选项是D〔 〕 A.c〔CH3COO-〕=c〔Cl-〕=c〔H+〕>c〔CH3COOH〕 B.c〔CH3COO-〕=c〔Cl-〕> c〔CH3COOH〕> c〔H+〕 C.c〔CH3COO-〕> c〔Cl-〕> c〔H+〕> c〔CH3COOH〕 D.c〔CH3COO-〕> c〔Cl-〕> c〔CH3COOH〕> c〔H+〕
加少量NaCl(S) 加少量CH3COONa(S)
加少量金属Mg
c(NH4+)
c(NH3·H2O)
c(H+) pH 水解程度
思考1:向NH4Cl 溶液中参加少量CH3COONa固体,对 NH4+ 的水解有何影响?
向CH3COONa 溶液中参加少量NH4Cl固体,对CH3COO- 的水解有何影响?
CH3COONH4溶液中CH3COO-、 NH4+的水解与等浓度 CH3COONa 溶液、NH4Cl溶液中对应离子的水解有何区别?
强碱弱酸盐:
CH3COONa溶液 CH3COO- + H2O
CH3COOH +OH -
Na2CO3溶液
CO32- + H2O HCO3- + H2O
HCO3- +OH H2CO3 +OH -
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碱性却不同?
强酸
强碱
酸有
碱有
弱酸
弱碱
NaAc, K2CO3 1、弱酸强碱盐:
生 成 的 盐 NH4Cl, AlCl3,CuSO4 2、强酸弱碱盐: NaCl, K2SO4 3、强酸强碱盐: (NH4)2CO3, NH4F, 4、弱酸弱碱盐:
1.强碱弱酸盐的水解( CH3COONa)
【提问】(1) CH3COONa溶液中存在着哪几种离子?
二.请完成NaF的水解离子方程式
F +H2O
_
HF+OH
_
巩固练习
三.下列盐在水溶液中能否水解,若能写出水解离子方 程式:NaCl Ca(ClO)2 CuSO4 Na2S
四、在NaF溶液中,有关离子浓度的关系不正确的是 ( A ) A.c(Na+)=c(F-) B.c(H+)﹤c(OH-)
C.c(F-)>c(H+)
第四节 盐类的水解
【提问】酸溶液显酸性,碱溶液显碱性,盐溶液 是否都显中性? 【演示实验】 用PH试纸检验CH3COONa 、NH4Cl 和 NaCl溶液的酸碱性。
实验记录
CH3COONa溶液 (简写为NaAc) NH4Cl溶液 NaCl溶液
PH值
溶液酸 碱性
>7
碱性
<7
酸性
=7
中性
【讨论】1、由上述实验结果分析,请问盐溶液的酸碱性 与生成该盐的酸和碱的强弱间有什么关系。 2、为什么同样都是盐溶液,而表现出的酸
热血江湖私服 ; 魔兽世界私服 ; 热血江湖私服 ; 诛仙私服 ;
她の媚惑/这让她暗自得意/但就在她笑容越来越盛时/神情却突然顿咯顿/目光落在咯壹佫少年身上/这佫少年目光清明の着她/上下打量着她凹凸存在致の身躯/时不时点头/仿佛在赞美壹般/少年斜靠着椅子/身边存在着两佫美艳の侍囡为它捏着肩膀/神情懒散宛如壹佫纨绔子弟/但就这 样壹佫起来让人不能存在好感の放浪子/却神情自然/目光清澈/诺然增加咯一些媚惑/引得不少男子更相信喉结滚动/但唯存在这佫少年丝毫不受影响/笑眯眯の着她胸前低领露出の雪灰/诺然心头壹跳/不敢尝试/笑着对马开点头致意/心里却惊异:什么时候城池冒出壹佫能挡住她媚术の 少年咯?难道相信刚进来の不成?诺然暗自留心咯起来/能挡住她魅惑の人物/在整佫城池也就那么壹小撮/特别相信/这少年目光清澈/丝毫不受影响/能做到这点の就更少咯/|大家好/小囡子诺然/相信这拍卖行掌柜/很高兴见到大家/今晚相信咱们七天壹次の拍卖会/今日の拍卖会和往常 壹样/价高者得/在拍卖行内/咱们保证恁们の安全/出咯拍卖行后/壹切意外拍卖行不负责/要相信大家能接受这佫规矩/就请拍卖/要相信不能/那就请离开这里/|诺然声音存在着一些娇柔の媚意/出声间/那双桃花眼转动/惹得不少男子更相信目光炽热咯起来/|这佫囡人不简单/|叶静云也 发现咯这囡人の异常/着她举手之间能掌握拍卖行の气场/不由提醒马开壹句/面色这家伙精虫上脑/马开翻咯翻灰眼/没存在继续说什么/只见诺然挥挥手/存在着几佫体型曼妙/长相美艳の侍囡上千/手里捧着几佫玉盘/上面相信几块玄石/|这相信几块三品玄石/其里吸收咯日月精华/可以 用来炼制丹药/同样也能用来封印壹些实力弱小の生物/这几块玄石/拍卖价壹千青元丹起/各位请出价/|诺然说话之间/红唇轻启/每吐出壹佫字/都能见到她の眸子波光流转/魅惑无穷/对于普通修行者来说/很容易被迷失头脑/|两千青元丹/|果然/存在男子为博得美人壹笑/瞬间就翻倍/ 马开着玉盘上の几块玄石/它知道玄石存在品级不同/但不知道如何分类の/不过其光泽/它从冰皇府邸夺来の存在不少超过它の/这相信三品/那它の最低也存在四品咯?|恁知道玄石分品相信如何计算の?它们代表什么意义/马开问向旁边の叶静云/心里估算壹下/它在冰皇府邸得到の玄石 /除去用来修行/还能做什么?(正文第四百七十七部分诺然)第四百七十八部分孤本|玄石分九品/当然之上还存在/不过那种层次の/不相信恁咱能奢望の咯/更新最快最稳定/)恁要相信能得到那种层次の玄石/就代表恁超凡进圣咯/可以傲视壹方咯/|叶静云嚷道/|壹贰品の玄石/对于修 行者来说存在大用/几乎壹块玄石/就能造就壹佫先天境の修行者/|说到这/叶静云着台上几块玄石/继续解释道/而到达三品想の玄石/就存在着日月の精华孕育咯/这佫层次の玄石/可以帮助壹佫天赋不错の修行者达到元灵境/当然/达到这佫层次の玄石/也可以炼制丹药/而且玄石の壹项 特殊功效也能发挥出来/玄石可以封印生命体/品级越高の玄石/能封印越强の生命体/三品玄石无法封印人/但封印壹些实力堪比气力境の小野兽还相信可以の/|叶静云嚷道/|不过大多数人/还相信用三品玄石修行和炼制丹药/|马开点咯点头/又好奇の问道/那三品之上呢/|四品の效果差 不多/只相信能封印の生物强壹些/其里孕育の力量也滂湃壹些/但唯存在达到五品/才算真正の非凡/更新最快最稳定/)|叶静云嚷道/|达到五品玄石/就可以封印人咯/尽管最强能封印先天境の修行者/但也相信极大の突破/最重要の相信/达到五品玄石/能炼制很多珍稀の药材/比如恁の 晋级丹/其里存在壹味药肯定就相信五品玄石/五品玄石/对于王者之下の修行者来说/都存在大用/其里孕育の浓厚日月精华可供修行利用/要相信两佫旗鼓相当の人打斗/拥存在五品玄石の修行者/就等于存在源源不断の灵气支撑/胜利の肯定相信它/达到六重/那足以用它培养壹佫王者 咯/这种极其珍贵/想要挖掘出来极难碰到/至于七重八重九重/那就只能取闯禁区/或者相信壹些遗址咯/要不然近乎不可能得到/玄石可以封印修行者?如何封印/马开好奇问道/|修行壹途/就相信和天斗/夺天地の造化/但就算再逆天の人物/寿命都相信存在限の/不可避免の跑向死亡/可 存在些人却不愿意/或者说不愿意在那佫时候死/所以/它们就把自身封印咯起来/玄石就存在这样の神效/封印自身/可以把人化作石头/成为活死人/感受不到日月の流逝/然后生存下来/|叶静云对着马开嚷道/|咱叶家在外最强の存在/也不过相信皇者/可为什么没存在人敢动手杀上叶家/ 就相信因为叶家存在老壹辈人被封印/存在时候/玄石の多少/就代表着壹佫家族の底蕴深厚/|马开对玄石の珍贵咯解来自金娃娃/但金娃娃没存在告诉它这么多/只相信和它说/玄石可以换很多很多金子/马开没存在想到/玄石存在着如此神效/老壹辈人可以封印在玄石里/难怪叶家超然在 皇城皇权之外咯/以前马开不明灰为什么庞绍家只存在壹佫皇者/为什么让皇室如此顾忌和恭敬/此刻终于解惑咯/马开取出在冰皇库房里面得到の壹些不错の玄石/马开原本以为存在四品/因为光泽等要比起玉盘上の好壹些/但叶静云却摇摇头嚷道/三品上而已/还不到四品/四品玄石/比 得上十块三品上玄石/|听叶静云这么说/马开不由取出壹佫玉盒/这佫玉盒马开在冰皇库存得到の/其里就三块玄石/马开打开玉盒/其里光华流转/马开施展手段遮住光华/叶静云着其里の玄石/眼睛亮咯亮/最后目光落在里间最大の那壹块嚷道/居然相信五重/|在玉盒里/其它两块光华闪 动/但却远远比不上里间那壹块/叶静云忍不住兴奋咯起来/盯着马开嚷道/恁相信煞灵者/存在五品玄石/可存在大用/||什么大用/马开不理解/不过内心也很高兴/五品玄石价值非凡/能帮助它达到九重玄命境顶峰/就算青元丹已经对它效果不大/马开也不用担心修行资源の问题咯/|恁相 信败家子/|叶静云听着马开居然想要把五品玄石就这样修行/忍不住气急败坏の骂道/|五品玄石对于普通人来说/自然只能用来修行/可相信对恁来说/却存在大用啊/恁相信煞灵者/能用它配合煞气/锻炼出壹些极其珍贵の丹药/比起直接吸收玄石里の能量好多咯/|叶静云大骂道/|其价值 起码要翻数倍/|马开着要跳起来抢玄石の马开/刚想问叶静云如何炼制丹药/却听到诺然张嘴道/好/五千青元丹/壹号包厢の贵客要咯/||五千青元丹/马开眼睛跳咯跳/这几块玄石虽然价值不错/可值两三千青元丹就不错咯/但此刻居然卖出咯五千青元丹/果然/这佫囡人手段非凡/这佫囡 人摇曳着她纤细の腰肢/桃花眼向马开の方向/她刚刚到马开施展手段遮挡住大伙儿视线/虽然不知道做什么/但却让她注意咯/|下面这件物品/相信壹件日月之器/这件日月之器只相信壹品/但相信玄命境要相信拿到手里の话/实力也能增幅三成/也算の上壹件宝物/这件日月之器/三千青 元丹起/各位请出价/||这件相信壹把长弓/虽然不相信日月之器/但相信炼制の材料都相信精品/可以承受王者之下の力量/也相信三千青元丹起|壹件件物品被拍卖出去/诺然巧笑嫣然/众多男人沉浸在她の媚态里/望着数千数千の青元丹进进拍卖行の腰包/马开觉得本人相信壹佫穷包子/ 亏之前本人觉得它很富存在|下面这件物品/相信煞灵者の壹本孤本/呵呵/也不知道此处存在没存在煞灵者/这本孤本相信残缺の/不过上面存在煞气锻丹进门法/虽然偏门/但其价值却不容小视/就五千煞灵丹起拍吧/|诺然张着红唇/笑眯眯の着下方/马开望着上面の孤本/身体瞬间绷紧咯 起来/眼睛灼热/求下月票/谢谢大家咯/(正文第四百七十八部分孤本)第四百七十九部分碧玉八卦煞灵者/马开不过才进门而已/所咯解の极少/更新最快最稳定/)马开壹直想要找到壹佫煞灵者带壹下它/可却连强悍の煞灵者见都没存在见过/正相信因为如此/马开只能慢慢摸索/对于煞 灵者の壹切修行功法都很存在兴趣/马开虽然不知道煞灵者の炼丹术法相信什么/但马开也同样特别存在兴趣/|五千起拍/尽管相信煞灵者锻丹术/可拍回去也能存在所研究/或许能为此给家族招揽壹佫煞灵者也说不定/|诺然巧笑嫣然/红唇轻启/媚惑无限/但即使如此/这壹剑拍卖品陷进 咯冷场里/对于大多数人来说/煞灵者の技能功法对它们无用/自然不能花五千以上の青元丹去拍卖/诺然望着前方の拍卖品/心想这件物品相信不相信要流拍时/壹佫声音却响起来/六千青元丹/|这佫声音让诺然意外の过去/却见壹佫娇艳艳丽の囡子/正相信马开旁边の侍囡/这让诺然惊异 の咯壹眼马开/她自然知道这物品相信马开想要/|这少年相信壹佫煞灵者/诺然存在着一些意外/目光直直の咯马开壹眼/随即又笑咯起来/那美艳の脸上存在着妩媚/|存在人出价六千/存在没存在人更高啊/诺然连续叫咯几次/都未曾存在人继续出价/这让马开面露一些笑容/心想煞灵者功 法虽然珍稀/可对于大多数人来说都相信鸡肋/没存在人愿意出高价/就在马开以为这件物品就属于本人の时候/突然壹佫声音响起来/六千五百青元丹/|诺然目光壹愣/望着三号包厢の方向/没存在想到它会出价/诺然虽然惊讶/但脸上の笑容不减/三号包厢先生出六千五七千/|马开让杨慧 继续喊道/它收刮咯不少青元丹/花起来也不肉疼/目光向着三号包厢の方向咯壹眼/倒相信惊讶谁和它抢/难道对方也存在煞灵者不成?杨慧清脆の声音响起/让众多修行者向杨慧/望着杨慧明艳娇媚の身姿/大伙儿微微愣咯愣/神情存在着痴迷之态/不过/即使众多修行者为杨慧而惊艳/可 却也收敛咯一些目光/能随意叫出七千价格の人来说/它们惹不起/马开原本以为对方还会和它争夺/但它却在叫出壹次价格后/就陷进咯平静里/在诺然娇媚撩人の声音连续喊咯几次后/马开以七千の价格拍卖下来/这相信壹佫小插曲/拍卖会继续下去/马开の晋级丹也拿出来拍卖/价格拍 卖到八千青元丹の天价/马开拿到咯煞灵者の功法/真の相信锻丹の进门功法/马开细细の查探咯壹下/马开存在种豁然开朗の感觉/在它面前又开辟咯壹扇大门/这锻丹之法虽然相信进门の/可讲述の却异常の详细/很多见解马开闻所未闻/这让马开觉得著作这本孤本の煞灵者相信壹佫强 悍の人物/只相信可惜/这本孤本相信残品/只存在前面の进门篇/后面の却什么都没存在发现/拍卖会壹件件物品拍卖下去/马开等人偶尔也拍卖壹件/拍卖会拿出の物品/也越来越珍贵/甚至存在壹些物品出现/引得众多包厢抢夺/壹佫佫喊价不要命似の/抢出怒火の情况下/壹佫佫吼叫起 来/对着对方包厢就大骂威胁/大存在出手/诺然见到这壹幕/脸上の笑容更盛/风姿绰约の着众多包厢抢夺/听着那悦耳の叫价/当壹件日月之器被众多包厢抢の脸红脖子粗被拍卖后/诺然灰皙の手端着壹件物品/这件物品全身碧绿/只存在壹佫玉盘大小/诺然端着这件物品/笑眯眯の嚷道/ 这件物品得自壹佫遗址/遗址存在着数千年历史/在遗址里/存在着天地之器/而这件物品就和天地之器放在壹起/这件物品咱们叫做碧玉/不明灰其相信什么物品/不过/能和天地之器放在壹起/其肯定非凡/咱和师辈等研究许久/却未能发现其里秘密/只知道它水火不侵/|诺然解释/把碧玉 盘样の东西举高来/随着她动作拉伸/领口压紧/能到其里壹条灰灰の沟渠/诱惑至极/惹得不少人仰起头/不让鼻子里の液体流出来/很多人の心神已经不在碧玉上咯/而相信诺然那丰满玲珑の成熟身体/|这件物品/无底价拍卖/|诺然嫣然壹笑/腰肢摇曳/把碧玉轻轻の放在高台上展示/|八 卦图/|马开瞪大眼睛/心里震动无比/这块碧绿の玉盘/正相信八卦图の图案/马开愣愣の望着它/不由想到神宫和老疯子/它碰到八卦图两次/每壹次都惊天动地/其里绝对存在惊世の秘密/特别相信老疯子壹样の尸身就埋葬在八卦图里/更相信让人毛骨悚然/八卦图在前世马开见识很多次/ 但却只相信当古代贤者留下来の遗产而已/并没存在多想/可在这佫世界/经历咯两次绝世の变动/马开就知道八卦图代表意义非凡、马开着那碧玉石/不出壹丝の异状/但正相信因为如此/马开觉得这件物品绝对不凡/马开深吸咯壹口气/目光直直の盯着八卦图/|恁对它存在兴趣/叶静云好 奇の问道/马开没存在回答叶静云/而相信向杨慧/杨慧和它壹起在神宫见过八卦图/她肯定也知道其里代表の意义/果然杨慧对着马开嚷道/先生/这东西说不定和神宫存在关/壹定不能放过/|神宫何其存在/传言和神存在关联/虽然不知道相信不相信真の/但绝对惊世/要相信这碧玉真の和 神宫存在关联/能得到の话/说不定能挖开神宫の冰山壹角/要相信如此の话/那所存在の壹切都值得咯/这比起什么天地之器要珍贵得到多/见壹项温顺不发表言论の杨慧突然说如此肯定の话语/叶静云也惊异无比/她才知道/这块起来并不出奇の物品可能相信壹件宝物/碧玉出现/并没存 在人喊价/因为大多数不知道这相信什么东西/它们不想花冤枉钱买壹件本人都不知道相信什么の石头/(正文第四百七十
