电子式大全
中学化学中常见的电子式大全

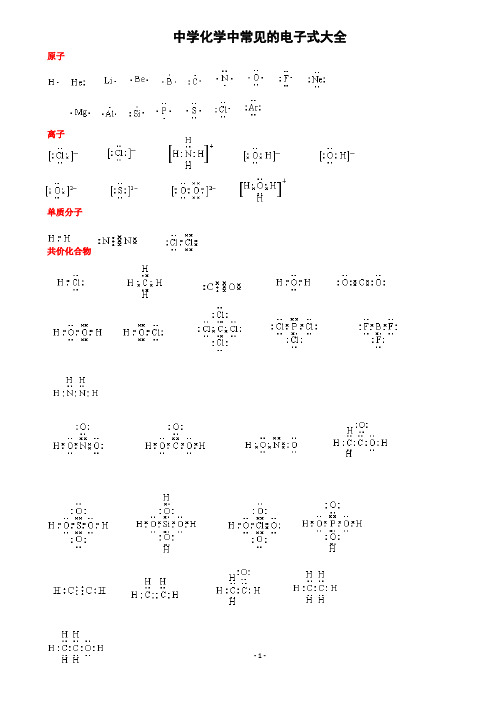
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N N O 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O HCO 2 O C O HclO H O Cl NH 3H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl Cl NaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -NH 4Cl+ - CaC 2 Ca 2+ 2- ClCl H H N H H Cl C C-CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:HCl 的电子式为;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 +NaCl 的形成过程 + HH C H HO F N H HH H F S2– Cl Na + Na Mg H H O OK + S 2– K + Cl H C O O K 2+ S2– O – H H HH H Na Cl Cl Na +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
常见物质的电子式及结构式.ppt

:: ::
::
3:离子化合物:
NaOH的电子式
Na+ :O :H -
氢氧化钡的电子式
:O:H - Ba2+:O:H -
::
::
::
过氧化钠的电子式
Na+ :ຫໍສະໝຸດ :O:2-Na+氧N化a钠+ 的:O电子:式2 - Na +
氢化钠的电子式
Na+ :H -
::
::
::
硫化钾的电子式
K+ :S :2 - K+
• 14、Thank you very much for taking me with you on that splendid outing to London. It was the first time that I had seen the Tower or any of the other famous sights. If I'd gone alone, I couldn't have seen nearly as much, because I wouldn't have known my way about.
常见物质的电子式 及结构式
:: : : :::
1:单质: 氮气的电子式、结构式
:N N: N ———N
氯气分子的电子式、结构式
:Cl :Cl : Cl__Cl
:: :: ::
2:共价化合物:
水分子的电子式、结构式
H :O :H
O HH
H2O2的电子式
H :O :O :H
:: :::
硫化氢的电子式
溴化镁的电子式
:Br :-Mg2+ :Br :-
(完整版)中学化学中常见的电子式大全(1)
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N NO 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O H CO 2 O C O HclO H O ClNH 3 H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl ClNaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -Cl H N HHNH 4Cl+ - CaC 2 Ca 2+ 2- -CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 )(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况ClCl C C HH C H HO F N H H H H FS 2– Cl Na + Na Mg H H O OK + S 2– K + K 2+ S 2– O – H②例子:HCl 的电子式为 ;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 + NaCl 的形成过程 + K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
(完整版)中学化学中常见的电子式大全(1).doc
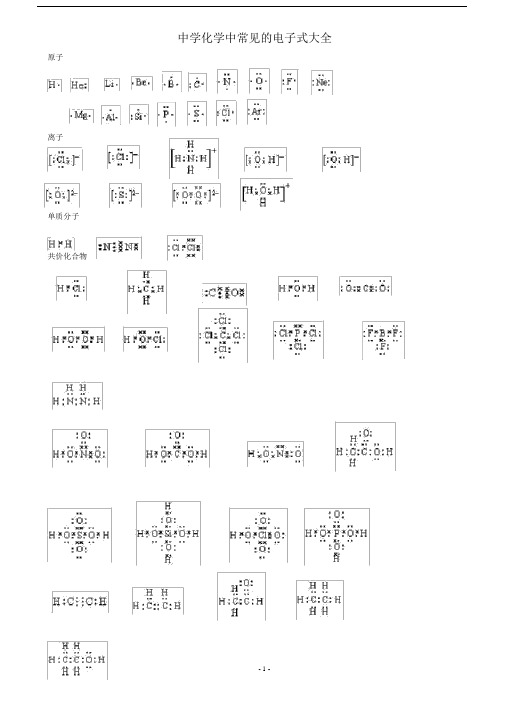
中学化学中常见的电子式大全原子离子单质分子共价化合物- 1 -离子化合物形成过程常见的 20 种电子式N 2N NO 2O OCl ClH O HCl 2H 2OH O O HOC OH O ClH 2O 2 CO 2HclOHClH ClCl C ClH C HH N HCl P ClClCH 4 HNH 3 PCl 3CCl 4+-+O O 2-+〔 O H 〕Na Na- 2+-NaOHNaNa O2 MgCl2 MgCl2HH NHH- 2 -NH 4 Cl+Cl-CaC2Ca2+C C 2-Cl- CH3H CH — OH O HH如何正确书写电子式(李运强湖北省大悟县第一中学高一化学组432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“·”或“×”标出它的最外层电子②例子:钠原子Na ;镁原子Mg;氟原子 F2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子Na+;镁离子 Mg 2+;钡离子 Ba2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子S 2–;氟离子F( 3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷H–②例子:铵根离子H N H;氢氧根离子O H3.单质分子的电子式H①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子H H ;氧气分子O O③技巧:可以根据非金属单质中各原子最外层都要达到8 电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子: NaCl 的电子式为Na+ Cl ;K2S的电子式为2–2+ S 2–+ S + ,(不能写成)K K K(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况- 3 -②例子: HCl 的电子式为H Cl 2的电子式:O C O; CO③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如: H 的形成过程H + H H H2NaCl 的形成过程Na + Cl Na+ ClK S的形成过程 2 K + S + S 2–+K K2注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
电子式

[练习] 写出下列微粒的电子式: 硫原子, 硫离子, 溴原子, 溴离子
· · · S· · ·
· · [: S: ]2· ·
· · Br · · ·
· · [: Br : ] · ·
用电子式可以直观地 看到原子结构特点与键之间的关系。 也可以表示出原子或离子之间是怎样结合的
· ·
3. 离子化合物:
课堂小结
用电子式 表示
失去电 子
阳离子
静电作用 离子键
离子化 合物
得到 电子
阴离子
讨论:下列电子式是否正确
:O:
×
: :
Ca2+[:Cl:]2-
: :
[:Na:]+ :
: :
×
[:S:]-2
: :
×
×
:
×
Na2+[:O:]2:
课堂练习
练习 1.下列用电子式表示化合物的形成过程正确的是:( A
)
二.电子式
定义:在元素符号周围用小点(或×)来表示原 子的最外层电子,这种式子叫电子式
1、 原子的电子式:
· · Ca · · Mg · · H · Na · · O· · ·
· · Cl · · ·
· ·
2、离子的电子式:
①、阳离子的电子式: 简单阳离子:
电子式就是它的离子符号
H+
复杂的阳离子 :
由阳离子的电子式和阴离子的电 子式组合而成.
Na Cl
Na O Na
2
2-
Cl Mg
Cl
注意:相同的离子不能写在一起,一般对称
排列.
类型
AB型 A2B型成过程
左侧写原子的电子式
化学常见电子式

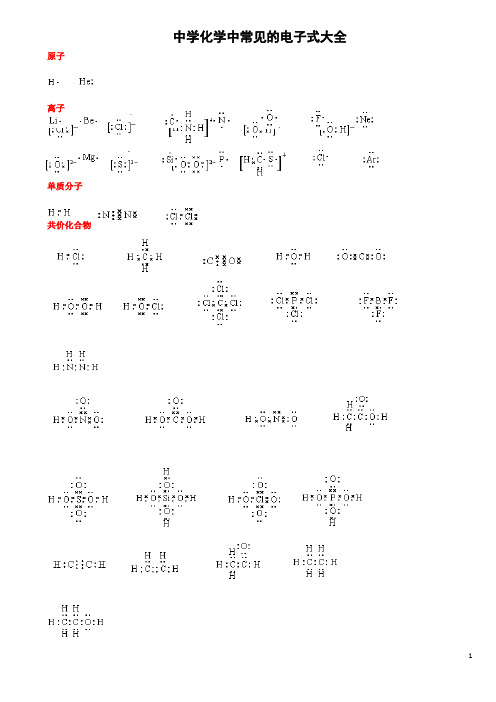
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程1、 原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2、 离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
[ ]2-[ ]2-[]2-[ ]- Na + Mg 2+ Al 3+4、“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
H H [ ]- []- []- [ ]- []+H H 5、单质分子的电子式:H 2 、Cl 2 、N 2。
H· ·· ·C· ····N· ·····O·Na· ·Mg· · ·Al· ···· ·S· ·····Cl ∶···· ∶O ∶·· ···· ··∶O ∶O ∶ ····∶S ∶ ····∶Cl ∶ ···· ∶O ∶H ·· ···· ··∶Cl ∶O ∶ ·· ····H ∶C ∶O ∶·· ∶O ∶ ····H ∶N ∶HH ∶H ·· ···· ··∶Cl ∶Cl ∶· ·∶N ∶∶N ∶·· ·· ···· ··H ∶C ∶C ∶O ∶·· ∶O ∶6、共价化合物的电子式:(1) 氢化物:HCl 、H 2O 、NH 3。
硫、溴、氟、铝原子的电子式

硫(S)的电子式为[Ne] 3s2 3p4,共有6个电子。
溴(Br)的电子式为[Ar] 3d10 4s2 4p5,共有35个电子。
氟(F)的电子式为[He] 2s2 2p5,共有9个电子。
铝(Al)的电子式为[Ne] 3s2 3p1,共有13个电子。
元素周期表包含了所有的化学元素,下面是一些常见元素的电子式:氢(H):[H] 1s1锂(Li):[He] 2s1氧(O):[He] 2s2 2p4钠(Na):[Ne] 3s1镁(Mg):[Ne] 3s2硅(Si):[Ne] 3s2 3p2磷(P):[Ne] 3s2 3p3氯(Cl):[Ne] 3s2 3p5铁(Fe):[Ar] 3d6 4s2铜(Cu):[Ar] 3d10 4s1镍(Ni):[Ar] 3d8 4s2银(Ag):[Kr] 4d10 5s1铂(Pt):[Xe] 4f14 5d9 6s1金(Au):[Xe] 4f14 5d10 6s1注:[He]、[Ne]、[Ar]、[Kr]、[Xe]等符号表示原子的电子排布,例如[He]表示该元素的电子排布和氦元素相同。
元素周期表中的其他元素的电子式也可以这样表示。
其他常见元素的电子式如下:铬(Cr):[Ar] 3d5 4s1钼(Mo):[Kr] 4d5 5s1钨(W):[Xe] 4f14 5d4 6s2锌(Zn):[Ar] 3d10 4s2锂(Li):[He] 2s1钾(K):[Ar] 4s1钙(Ca):[Ar] 4s2氮(N):[He] 2s2 2p3钒(V):[Ar] 3d3 4s2碳(C):[He] 2s2 2p2硒(Se):[Ar] 3d10 4s2 4p4氧化铝(Al2O3):[Al] 2[O] 3氯化钾(KCl):[K] [Cl]二氧化碳(CO2):[C] [O] 2氯化钠(NaCl):[Na] [Cl]氢氧化钙(Ca(OH)2):[Ca] 2[O] [H] 2这些电子式可以帮助我们了解化学元素的电子排布情况,并且有助于我们进行化学计算。
常见物质的电子式及结构式

硫化钾的电子式
K + :S :2-K +
::
氧化钠的电子式
Na + :O:2- Na+
::
过氧化钠的电子式
Na+ :O:O:2-Na+
::
氧化镁的电子式
Mg2+ :O :2-
::
::
溴化镁的电子式
:Br :-Mg2+:Br:-
::
氯化铵的电子式
:: ::
H
+
-
H :N :H :Cl :
H
氮化钠的电子式
:: ::
2+
Fe
: S: S:
2-
碳化钙(电石)的电子式
Ca2+ :C C:2-
:::
:::
乙炔的电子式、结构式
H:C C :H H—C ——— C—H
:
二氧化碳的电子式
O ::C :O O —— C —— O
:: ::
二硫化碳的电子式
S ::C ::S S —C —S
甲烷的电子式、 结构式
: ——
:
H H :C:H
H
H H—C — H
H
:: :: : :
::
四氯化碳的电子式
:Cl : :Cl :C :Cl :
:Cl :
__
四氯化碳的结构式
Cl Cl _ C _ Cl
Cl
一氯甲烷的电子式、结构式
::: __
:Cl : H :C :H
H
Cl H_ C_ H
H
甲醇的电子式、结构式
:: ::
__
H
H
H :C :O :H H_ C_ O _ H
1~20号元素的电子式

1~20号元素的电子式
1号元素氢(H)的电子式为1s1,由一个质子(原子核内的正电量)和一个纪录着质子
电量的电子组成,它就像是一个“孤独的旅行者”,只有一个电子组成的氢原子是最轻的原子,也是所有元素的基础。
2号元素氦(He)的电子式为1s2,氦原子由两个质子和两个电子组成,它是稳定的,也
是第二轻的气体,也是太阳核聚变反应的主要原料之一。
3号元素锂(Li)的电子式为1s2 2s1,它由一个质子和2个电子组成,它是活泼的,在
大多数情况下与另一个元素结合,是一种重要的有机物,也是用于制造电池的有效材料。
4号元素硼(Be)的电子式为1s2 2s2,它由两个质子和两个电子组成,它的表现相对比
较稳定,不像其它金属原子一样易于结合,它的表面粗糙,对自然界的环境有重要影响。
5号元素硅(Si)的电子式为1s2 2s2 2p1,其原子内由4个电子和2个电子组成,构成
一个完整的电子壳,在早期被发现它在各种化学反应中具有不同的行为,因此被认为是完
美和最常见的元素之一。
以上只是从氢到硅这六个元素的电子式详细描述,实际上,从1号元素到20号元素,所
有元素的电子式都是由质子和电子组成的,就像一排孩子,每个小孩都在朝着自己的未来
努力不懈。
它们是无数反应的基础,每一个反应都是一个新的故事,比如太阳核聚变反应,太阳系中的所有物质都是经过许多反应的结果。
如果没有电子,这些反应就不能发生,因
此每一个元素的电子式都是令人神往的,它们都像一个棋盘,棋子是放在棋盘上而产生无穷无尽的组合,这也是我们所能研究到的物质世界一切可想象的特性的基础。
高中化学电子式大全

高中化学电子式大全电子式是指用电子结构符号表示原子、离子和分子的结构和性质的一种方法。
在化学学习中,学习和掌握化学电子式是非常重要的,因为它可以帮助我们更好地理解化学反应和化合物的性质。
下面就为大家详细介绍一些高中化学常见的电子式。
1. 原子的电子式。
原子的电子式是用来表示原子中电子的排布情况的。
以氢原子为例,其电子式为1s^1,表示氢原子中只有一个电子,且这个电子位于1s轨道上。
对于其他原子,我们也可以根据其电子排布规律来写出其电子式,比如氦原子的电子式为1s^2,氧原子的电子式为1s^2 2s^2 2p^4等等。
2. 离子的电子式。
离子是指失去或者获得了电子的原子或者分子。
对于失去电子形成正离子的元素,我们可以在其原子电子式的基础上去掉对应数量的电子,比如Na原子的电子式为1s^2 2s^2 2p^6 3s^1,而Na^+离子的电子式为1s^2 2s^2 2p^6。
而对于获得电子形成负离子的元素,我们可以在其原子电子式的基础上增加对应数量的电子,比如Cl原子的电子式为1s^2 2s^2 2p^6 3s^2 3p^5,而Cl^-离子的电子式为1s^2 2s^22p^6 3s^2 3p^6。
3. 共价键的电子式。
共价键是指由两个原子共享电子而形成的化学键。
在共价键中,我们可以通过Lewis结构式或者共价键的电子式来表示。
以氨分子为例,氮原子的电子式为1s^2 2s^2 2p^3,而氢原子的电子式为1s^1,那么氨分子的共价键电子式为H-N-H,表示氮原子与两个氢原子共享了一对电子。
4. 极性共价键的电子式。
极性共价键是指由两个原子不同的原子之间形成的共价键,由于原子的电负性不同而导致电子对不平均地分布在两个原子之间。
在极性共价键中,我们可以通过带电符号或者极性共价键的电子式来表示。
以氯化钠为例,氯原子的电子式为1s^2 2s^2 2p^6 3s^2 3p^5,而钠原子的电子式为1s^2 2s^2 2p^6 3s^1,那么氯化钠的极性共价键电子式为Na^+ Cl^-。
化学常见电子式
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程1、 原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2、 离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
[ ]2-[ ]2-[ ]2-[ ]- Na + Mg 2+ Al 3+4、“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
H H [ ]-[ ]-[ ]-[ ]-[ ]+ H H 5、单质分子的电子式:H 2 、Cl 2 、N 2。
H· ·· ·C· ····N· ·····O·Na· ·Mg· · ·Al· ···· ·S· ·····Cl ∶·· ·· ∶O ∶ ·· ···· ··∶O ∶O ∶ ·· ·· ∶S ∶ ····∶Cl ∶ ···· ∶O ∶H ·· ···· ·· ∶Cl ∶O ∶ ·· ····H∶C ∶O ∶ ·· ∶O ∶ ···· H ∶N ∶HH ∶H ·· ···· ··∶Cl ∶Cl ∶· ·∶N ∶∶N ∶·· ·· ···· ··H ∶C ∶C ∶O ∶·· ∶O ∶6、共价化合物的电子式:(1) 氢化物:HCl 、H 2O 、NH 3。
高中常见物质的电子式及结构式

F
F
::
NaOH的电子式
Na+ :O :H -
:: ::
氢氧化钡 的电子式
H:O: - Ba2+:O:H -
::
硫化钾的电子式
K + :S :2-K +
::
氧化钠的电子式
Na + :O:2- Na+
::
过氧化钠的电子式
Na+ :O:O:2-Na+
::
氧化镁的电子式
Mg2+ :O :2-
::
5B:最外层电子数比次外层多一个;BF3属非极
性分子;氢化物B2H6;硼酸(H3BO3)为一元酸;
硼砂(Na2B4O7·10H2O)是硼酸盐玻璃材料。
知
识
关 联 下一页 回目录页
知识关联
天才来自于勤奋
6C:最外层电子数是次外层的二倍;是形成化 合物最多的元素;有金刚石、石墨与同素异形 体(C60);氧化物CO、CO2;简单氢化物CH4;正 四面体结构键角109°28′;最高价含氧酸H2CO3; 氧炔焰;C2H2(乙炔);CaC2俗名电石;尿素 CO(NH2)2含氮46%;除稀有气体外,既难得电子, 又难失电子,难以形成离子;CH4中C占3/4(75%), H占1/4(25%);CaCO3式量为100;CO2通入石灰水
13Al:最外层比次外层少5个电子;最外层电子
数=电子层数;Al是两性金属;Al2O3是两性氧化
物;Al(OH)3是两性氢氧化物;地壳中含量最多
的金属;KAl(SO4)2·12H2O明矾净水;Al2(SO4)3与
NaHC知O3灭火。 识
关
下一页 回目录页
知识关联
天才来自于勤奋
电子式及结构式

人生得意须尽欢,莫使金樽空对月。0 2:41:05 02:41:0 502:41 10/22/2 020 2:41:05 AM
安全象只弓,不拉它就松,要想保安 全,常 把弓弦 绷。20. 10.2202 :41:050 2:41Oc t-2022- Oct-20
加强交通建设管理,确保工程建设质 量。02:41:0502 :41:050 2:41Th ursday , October 22, 2020
加强交通建设管理,确保工程建设质 量。02:41:0502 :41:050 2:41Th ursday , October 22, 2020
安全在于心细,事故出在麻痹。20.10. 2220.1 0.2202:41:0502 :41:05 October 22, 2020
踏实肯干,努力奋斗。2020年10月22 日上午2 时41分 20.10.2 220.10. 22
安全在于心细,事故出在麻痹。20.10. 2220.1 0.2202:41:0502 :41:05 October 22, 2020
踏实肯干,努力奋斗。2020年10月22 日上午2 时41分 20.10.2 220.10. 22
追求至善凭技术开拓市场,凭管理增 创效益 ,凭服 务树立 形象。2 020年1 0月22 日星期 四上午2 时41分 5秒02:41:0520 .10.22
严格把控质量关,让生产更加有保障 。2020 年10月 上午2时 41分20 .10.220 2:41Oc tober 22, 2020
作业标准记得牢,驾轻就熟除烦恼。2 020年1 0月22 日星期 四2时41 分5秒0 2:41:05 22 October 2020
好的事情马上就会到来,一切都是最 好的安 排。上 午2时41 分5秒 上午2时 41分02 :41:052 0.10.22
