物质热稳定性的热分析试验方法

物质热稳定性的热分析试验方法
1 主题内容与适用范围
本标准规定了用差热分析仪和(或)差示扫描量热计评价物质热稳定性的热
分析方法所用的试样和参比物、试验步骤和安全事项等一般要求。
本标准适用于在惰性或反应性气氛中、在-50~1000℃的温度范围内有焓变
的固体、液体和浆状物质热稳定性的评价。
2 术语
2.1 物质热稳定性
在规定的环境下,物质受热(氧化)分解而引起的放热或着火的敏感程度。2.2 焓变
物质在受热情况下发生吸热或放热的任何变化。
2.3 焓变温度
物质焓变过程中的温度。
3 方法原理
本方法是用差热分析仪或差示扫描量热计测量物质的焓变温度(包括起始温度、外推起始温度和峰温)并以此来评价物质的热稳定性。
4 仪器和材料
4.1 仪器
差热分析仪(DTA)或差示扫描量热计(DSC):程序升温速率在2~30℃/min 范围内,控温精度为±2℃,温差或功率差的大小在记录仪上能达到40%~95% 的满刻度偏离。
4.2 样品容器
坩埚:铝坩埚、铜坩埚、铂坩埚、石墨坩埚等,应不与试样和参比物起反应。
4.3 气源
空气、氮气等,纯度应达到工业用气体纯度。
4.4 冷却装置
冷却装置的冷却温度应能达到-50℃。
4.5 参比物
在试验温度范围内不发生焓变。典型的参比物有煅烧的氧化铝、玻璃珠、硅
油或空容器等。在干燥器中储存。
5 试样
5.1 取样
对于液体或浆状试样,混匀后取样即可;对于固体试样,粉碎后用圆锥四分
法取样。
5.2 试样量
试样量由被测试样的数量、需要稀释的程度、Y 轴量程、焓变大小以及升温
速率等因素来决定,一般为1~5mg,最大用量不超过50mg。如果试样有突然释放大量潜能的可能性,应适当减少试样量。
6 试验步骤
6.1 仪器温度校准按附录A 进行,校准温度精度应在±2℃范围内。
6.2 将试样和参比物分别放入各自的样品容器中,并使之与样品容器有良好的热接触(对于液体试样,最好加入试样重量20%的惰性材料,如氧化铝等)。将装有试样和参比物的样品容器一起放入仪器的加热装置内,并使之与热传感元件
紧密接触。
6.3 接通气源,并将气体流量控制在10~50mL/min 的范围内(如果在静止状态下进行测量,则不需要通气)。
6.4 根据所用试样的性质来确定试验温度范围。
6.5 按4.1 条的要求调整Y 轴量程。
6.6 启动升温控制器,控制升温速率在10~30℃/min 的范围内,记录温差△T
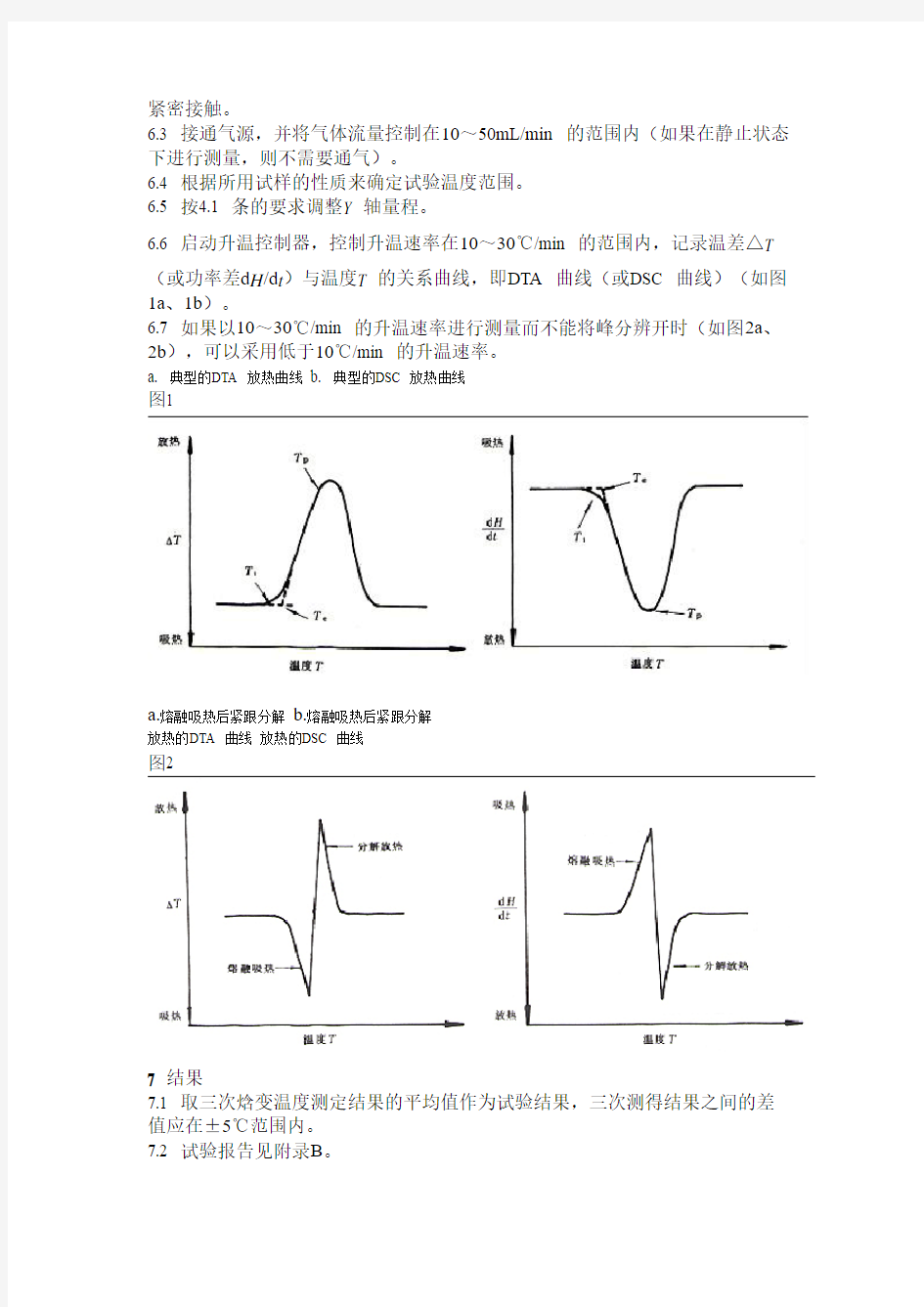
(或功率差d H/d t)与温度T 的关系曲线,即DTA 曲线(或DSC 曲线)(如图1a、1b)。
6.7 如果以10~30℃/min 的升温速率进行测量而不能将峰分辨开时(如图2a、2b),可以采用低于10℃/min 的升温速率。
a. 典型的DTA 放热曲线
b. 典型的DSC 放热曲线
图1
a.熔融吸热后紧跟分解
b.熔融吸热后紧跟分解
放热的DTA 曲线放热的DSC 曲线
图2
7 结果
7.1 取三次焓变温度测定结果的平均值作为试验结果,三次测得结果之间的差值应在±5℃范围内。
7.2 试验报告见附录B。
8 安全事项
用本标准规定的试验方法进行测量时,若不了解被测物质的潜在危险性,在
取样和测量时一定要小心谨慎。如果需要用研磨的方法粉碎试样,应将被测物质视为危险品,并按化学危险品安全操作规程进行操作。
附录 A
差示扫描量热计和差热分析仪的温度校准方法
(补充件)
A1 仪器校准
用表A1 所列物质(纯度大于99.9%)的相转变温度进行仪器校准。
表A1 校准物质的相转变温度
相转变温校准物质度
℃K
汞
水
二苯醚
苯甲酸
铟
锡
铋
铅
锌
锑
铝
银
-38.86
0.00
26.87
122.37
156.63
231.97
271.44
327.50
419.58
630.74
660.37
961.93
234.29
273.15
300.02
395.52
429.78
505.12
544.59
600.65
692.73
903.89
933.52
1235.08
A2 试验步骤
A2.1 两点校准法
A2.1.1 在表A1 中选取两种校准物质。其中,一种物质的相转变温度比被测试样的起始放热温度低,另一种物质的相转变温度比被测试样的终止放热温度高,而且要尽可能接近这两个温度。
A2.1.2 测量各校准物质的表观相转变温度。
A2.1.2.1 将重量为5~15mg 的校准物质和参比物分别放入样品容器中。
A2.1.2.2 把样品容器放入仪器的加热装置内,用流量为10~50mL/min 的氮气
或其他惰性气体冲洗测量装置,直到测量结束。
A2.1.2.3 按4.1 条的要求,调整Y 轴量程。
A2.1.2.4 以10℃/min 的升温速率加热校准物质和参比物,使校准物质通过相转变温度,直至基线重新确立。也可以用其他升温速率,但必须与测量试样时的条件相同。
A2.1.2.5 由得到的DTA 曲线或DSC 曲线测量出表观相转变温度(T e、T p)(如图A1、A2)。
图A1 校准物质相转变的DTA 曲线图A2 校准物质相转变的DSC 曲线
差示扫描量热计或试样与温感元件分开的差热分析仪用T e 作为表观相转变
温度;试样与温感元件紧密接触的某些差热分析仪,用T p 作为表观相转变温度。A2.1.3 按A3.1 计算实际相转变温度。
A2.2 一点校准法
A2.2.1 如果已按A2.1 测出了表观相转变温度,并按A3.2 计算出斜率值(S),若S 值与1.000 的差值在±0.01 的范围内(试验温度与校正温度相差100℃时),则用一点校准法。
A2.2.2 从表A1 中选取一种校准物质,使其相转变温度尽量处在被测试样的放
热峰内。
A2.2.3 按A2.1.2.1 至A2.1.2.6 的步骤测出校准物质的表观相转变温度。
A2.2.4 按A3.1 计算实际相转变温度。
A3 计算
A3.1 假设表观相转变温度(TO)与实际相转变温度(T)之间存在线性关系,
那么它们之间存在下面的关系:
T=(TO×S)+I ??????????(A1)
式中:S-斜率(标准值为1.000);
I-截距。
这两个参数均由A3.2 计算得出。
A3.2 两点校准法
A3.2.1 用表A1 中的校准物质相转变温度和实际测量的表观相转变温度,通过式(A2)和式(A3)计算S 和I。
S=(TS1-TS2)/(TO1-TO2)?????????????????(A2)
I=[(TO1×TS2)-(TS1×TO2)]/(TO1-TO2???????????(A3)
式中:TS1-取自表A1 中的1 号校准物质的相转变温度;
TS2-取自表A1 中的2 号校准物质的相转变温度;
TO1-A2 步骤中测出的1 号校准物质的表观相转变温度;
TO2-A2 步骤中测出的2 号校准物质的表观相转变温度。
A3.2.2 S 要计算到四位有效数字,I 要精确到0.01℃。
A3.3 一点校准法
如果用两点校准法测出的斜率值(S)与标准值1.000 之差在±0.01 的范围
内,那么就用一点校准法,只测出截距。
I=TS1-TO1 ????????????(A4)
A3.4 利用测出的斜率值(S)和截距(I),通过式(A1)计算出被测试样的实际焓变温度。
附录 B
物质热稳定性的热分析试验报告
(参考件)
B1 试验委托单位名称。
B2 试验单位名称和试验负责人。
B3 送样日期和试验日期
B4 试样和参比物的名称、组成、分子式、重量、状态和纯度等。
B5 仪器型号和样品容器。
B6 气氛的组成和压力、静态或动态、密封程度及动态情况,应注明气体流量。B7 程序升温速率和试验温度范围。
B8 Y 轴灵敏度和Y 轴量程。
B9 记录DTA 曲线或DSC 曲线的所有过程,注明起始温度、外推起始温度和峰温。
B10 把测定的焓变温度换算成实际的焓变温度。
B11 用实际的焓变温度来评价物质的热稳定性。
附加说明:
本标准由中华人民共和国公安部提出,由全国消防标准化技术委员会归口。
本标准由公安部天津消防科学研究所负责起草。
本标准主要负责人李子葆、张桂芳、姚萍。
热重分析实验报告
热重分析实验报告
————————————————————————————————作者: ————————————————————————————————日期: ?
材料与建筑工程学院实验报告 课程名称: 材料物理性能 专业:材料科学与工程 班级: 2013级本科 姓名:张学书 学号: 3
指导老师:谢礼兰老师 贵州师范大学学生实验报告 成绩 实验一:STA449F3同步热分析仪的结构原理及操作方法 一、实验目的 1、熟悉同步热分析仪的基本原理。 2、了解STA449 F3型同步热分析仪的构造原理及性能。 3、学习STA449 F3型同步热分析仪的操作方法。 二、实验原理 差示扫描量热法(DSC)是指在加热的过程中,测量被测物质与参比物之间的能量差与温度之间的关系的一种方法技术。图1-1为功率补偿式DSC仪器示意图:
图1-1 功率补偿式D SC 示意图 1.温度程序控制器; 2.气氛控制;3.差热放大器;4.功率补偿放大器;5.记录仪 当试样发生热效应时,譬如放热,试样温度高于参比物温度,放置在它们下面的一组差示热电偶产生温差电势U ΔT ,经差热放大器放大后送入功率补偿放大器,功率补偿放大器自动调节补偿加热丝的电流,使试样下面的电流Is减小,参比物下面的电流IR 增大,而Is +IR 保持恒定。降低试样的温度,增高参比物的温度,使试样和参比物之间的温差ΔT 趋于零。上述热量补偿能及时,迅速完成,使试样和参比物的温度始终维持相同。 设两边的补偿加热丝的电阻值相同,即RS =RR=R,补偿电热丝上的电功率为PS=IR 和P R=IR 。当样品没有热效应时,PS=P R;当样品存在热效应时,PS 和PR 的差ΔP能反映样品放(吸)热的功率: ΔP= PS-PR= IR -IR=(I S+IR)( I S-IR)R =(IS+IR ) ΔV =I ΔV? (1) 由于总电流IS+IR 为恒定,所以样品的放(吸)热的功率ΔP只和ΔV 成正比, 3 1 2 4 5
化学上的“活泼性”和“稳定性”
化学上的“活泼性”和“稳定性” 化学上常涉及“活泼性”和“稳定性”这两个非常重要的概念,例如:“金属(或非金属)的活泼性”;“气态氢化物的稳定性”、“酸的稳定性”等等。在必修课的学习中我们没有进行仔细区分,但是选修3关于共价键参数中给了一系列键能数据,特别是卤素单质的键能数据,不追究还真就糊涂了。 通常而言,很活泼的物质稳定性就差,很稳定的物质活泼性就差。但是“活泼性”和“稳定性”两者所研究的对象往往是有所区别的。“活泼性”通常是指物质的得或失电子的过程,例如:“碱金属是活泼的金属”,“卤素是活泼的非金属”。而稳定性又分为两种情况:一是化学稳定性,;二是热稳定性。化学稳定性通常是指物质因水解、氧化(或还原)而是否变质的化学过程。热稳定性是指物质在常温下或受热时是否分解的化学过程。以下就是一些物质热稳定性的判断规律: 1.一般而言单质的热稳定性与构成单质的化学键牢固程度正相关;而化学键牢固程度又与键能正相关。 具体来说:单质稳定是指分子内原子间的键能大,化学键不易断裂;活泼性是指分子发生化学反应的容易与否。不过单质的稳定性很少单独使用,而单质参与反应的过程实际分两个步骤,一是吸收键断裂所需的能量,将分子分解为原子(体现键能——稳定性),二是将不同原子重新结合形成新物质(体现非金属性)。由于一般反应中供应的能量都很大,很少存在能量不够一个分子反应的情况,当所供应的能量都足够的时候,毫无疑问由非金属性强弱决定反应的容易与否。例如:对于卤素来说,虽然其键能递减(除F2,因为F半径很小,斥力很大则使得键能反常减小),分子越来越不稳定,断裂成原子越来越容易。但是由于卤素原子吸引电子的能力减弱,反应就越难,最终表现为化学性质越不活泼,与非金属性减弱相一致,而与稳定性无关。因此,氟氯溴碘单质反应剧烈程度下降。相反,对于N2,由于三键的存在,键能很大,一般不能满足断键的条件,即使氮电负性较大也不发生反应,所以N2的稳定性决定了不活泼性。 2.气态氢化物的热稳定性:元素的非金属性越强,键能越大,形成的气态氢化物就越稳定(最有规律也最常用)。同主族的非金属元素,从上到下,随核电荷数的增加,非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱;同周期的非金属元素,从左到右,随核电荷数的增加,非金属性逐渐增强,气态氢化物的稳定性逐渐增强。 3.氢氧化物的热稳定性:金属性越强,碱的热稳定性越强(碱性越强,热稳定性越强)。 4.含氧酸的热稳定性:绝大多数含氧酸的热稳定性差,受热脱水生成对应的酸酐。一般地: ①常温下酸酐是稳定的气态氧化物,则对应的含氧酸往往极不稳定,常温下可发生分解。 ②常温下酸酐是稳定的固态氧化物,则对应的含氧酸较稳定,加热时才分解。 ③某些含氧酸分解是发生氧化还原反应,得不到对应的酸酐。例如硝酸、次氯酸。 5.含氧酸盐的热稳定性: ①酸不稳定,对应的盐也不稳定;酸较稳定,对应的盐也较稳定。例如硫酸盐和磷酸盐比较稳定。 ②同一种酸的盐,热稳定性顺序是正盐>酸式盐>酸。 ③同一酸根的盐的热稳定性顺序是碱金属盐>过渡金属盐>铵盐。 ④同一成酸元素,高价含氧酸比低价含氧酸稳定,相应含氧酸盐的稳定性顺序也是如此。
差热分析__实验报告
差热分析 一、实验目的 1. 用差热仪绘制CuSO4·5H2O等样品的差热图。 2. 了解差热分析仪的工作原理及使用方法。 3. 了解热电偶的测温原理和如何利用热电偶绘制差热图。 二、实验原理 物质在受热或冷却过程中,当达到某一温度时,往往会发生熔化、凝固、晶型转变、分解、化合、吸附、脱附等物理或化学变化,并伴随着有焓的改变,因而产生热效应,其表现为物质与环境(样品与参比物)之间有温度差。差热分析就是通过温差测量来确定物质的物理化学性质的一种热分析方法。 差热分析仪的结构如下图所示。它包括带有控温装置的加热炉、放置样品和参比物的坩埚、用以盛放坩埚并使其温度均匀的保持器、测温热电偶、差热信号放大器和信号接收系统(记录仪或微机)。差热图的绘制是通过两支型号相同的热电偶,分别插入样品和参比物中,并将其相同端连接在一起(即并联,见图5-1)。A 两支笔记录的时间—温度(温差)图就称为差热图,或称为热谱图。 图5-1 差热分析原理图 图5-1 典型的差热图从差热图上可清晰地看到差热峰的数目、位置、方向、宽度、高度、对称性以及峰面积等。峰的数目表示物质发生物理化学变化的次数;峰的位置表示物质发生变化的转化温度(如图5-2中T B);峰的方向表明体系发生热效应的正负性;峰面积说明热效应的大小。相同条件下,峰面积大的表示热效应也大。在相同的测
定条件下,许多物质的热谱图具有特征性:即一定的物质就有一定的差热峰的数目、位置、方向、峰温等,因此,可通过与已知的热谱图的比较来鉴别样品的种类、相变温度、热效应等物理化学性质。因此,差热分析广泛应用于化学、化工、冶金、陶瓷、地质和金属材料等领域的科研和生产部门。理论上讲,可通过峰面积的测量对物质进行定量分析。 本实验采用CuSO 4·5H 2O ,CuSO 4·5H 2O 是一种蓝色斜方晶系,在不同温度下,可以逐步失水: CuSO 4·5H 2O CuSO 4·3H 2O CuSO 4·H 2O CuSO 4 (s ) 从反应式看,失去最后一个水分子显得特别困难,说明各水分子之间的结合能力不一样。 四个水分子与铜离子的以配位键结合,第五个水分子以氢键与两个配位水分子和SO 4 2-离子结合。 加热失水时,先失去Cu 2+ 左边的两个非氢键原子,再失去Cu 2+ 右边的两个水分子,最后失去以氢键连接在SO 4 2- 上的水分子。 三、仪器试剂 差热分析仪1套;分析物CuSO 4·5H 2O ;参比物α-Al 2O 3。 四、实验步骤 1、 开启仪器电源开关,将各控制箱开关打开,仪器预热。开启计算机开关。 2、参比物(α-Al 2O 3)可多次重复利用,取干净的坩埚,装入CuSO 4·5H 2O 样品、装满,再次加入CuSO 4·5H 2O 将坩埚填满,备用。 3、抬升炉盖,将上步装好的CuSO 4·5H 2O 样品放入炉中,盖好炉盖。 4、打开计算机软件进行参数设定,横坐标2400S 、纵坐标300℃、升温速率
热分析考试考试)20121210)
热分析习题 一、填空(10分,共10题,每题1分)。 1、差热分析是在程序控温条件下,测量样品坩埚与坩埚间的温度差与温 度的关系的方法。(参比) 2、同步热分析技术可以通过一次测试分别同时提供-TG或 -TG两组信号。(DTA-TG ,DSD-TG) 3、差示扫描量热分析是在程序控温条件下,测量输入到物质与参比物的功率差与温度的关 系的方法,其纵坐标单位为。(mw或mw/mg) 4、硅酸盐类样品在进行热分析时,不能选用材质的样品坩埚。(刚玉) 5、差示扫描量热分析根据所用测量方法的不同,可以分类为热流型DSC 与 型DSC。(功率补偿) 6、与差热分析(DTA)的不同,差示扫描量热分析(DSC)既可以用于定性分析,又可以 用于分析。(定量) 7、差热分析(DTA)需要校正,但不需要灵敏度校正。(温度) 8、TG热失重曲线的标注常常需要参照DTG曲线,DTG曲线上一个谷代表一个失重阶段, 而拐点温度显示的是最快的温度。(失重) 9、物质的膨胀系数可以分为线膨胀系数与膨胀系数。(体) 10、热膨胀系数是材料的主要物理性质之一,它是衡量材料的好坏的一个重要指 标。(热稳定性) 二、名词解释 1.热重分析答案:在程序控温条件下,测量物质的质量与温度的关系的方法。 2.差热分析答案:在程序控温条件下,测量物质与参比物的温度差与温度的关系的方法。 3.差示扫描量热分析答案:在程序控温条件下,测量输入到物质与参比物的功率差与温度的关系的方法。 4.热膨胀分析答案:在程序控温条件下,测定试样尺寸变化与温度或时间的关系的方法。 三、简答题 1.DSC与DTA测定原理的不同 答案:DSC是在控制温度变化情况下,以温度(或时间)为横坐标,以样品与参比物间温差为零所需供给的热量为纵坐标所得的扫描曲线。DTA是测量T-T 的关系,而DSC是保持T = 0,测定H-T 的关系。两者最大的差别是DTA只能定性或半定量,而DSC的结果可用于定量分析。DTA在试样发生热效应时,试样的实际温度已不是程序升温时所控制的温度(如
活泼性与稳定性
活泼性与稳定性 胡征善 化学上常涉及“活泼性”和“稳定性”这两个非常重要的概念,例如:“金属(或非金属)的活泼性”;“气态氢化物的稳定性”、“酸或碱的稳定性”、“单质的活泼性或稳定性”等等。 通常而言,很活泼的物质稳定性就差,很稳定的物质活泼性就差。但是“活泼性”和“稳定性”两者所研究的对象往往是有区别的。“活泼性”通常是指物质的得或失电子的过程,例如:“碱金属是活泼的金属”,“卤素是活泼的非金属”。而稳定性通常是指体系或物质是否能稳定存在,例如浊液不稳定,静置沉淀或分层,在化学性质上稳定性又分为两种情况:一是化学稳定性;二是热稳定性。化学稳定性通常是指物质是否因水解、分解、氧化(或还原)而变质的化学过程。热稳定性是指物质在常温下或受热时是否分解的化学过程。以下就是一些物质热稳定性的判断规律: 1.一般而言,单质的热稳定性与构成单质的化学键牢固程度正相关;而化学键牢固程度又与键能大小有关。 2.气态氢化物的热稳定性:元素的非金属性越强,形成的气态氢化物就越稳定。同主族的非金属元素,从上到下,随核电荷数的增加,非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱;同周期的非金属元素,从左到右,随核电荷数的增加,非金属性逐渐增强,气态氢化物的稳定性逐渐增强。 3.氢氧化物的热稳定性:金属性越强,碱的热稳定性越强(碱性越强,热稳定性越强)。在金属活动顺序表中,金属元素组成的碱通常是从左到右热稳定性减弱,如:KOH和NaOH熔融时也不分解,Cu(OH)2在水溶液中加热至约80℃就分解,AgOH常温下就分解。 4.含氧酸的热稳定性: (1)绝大多数含氧酸的热稳定性差,受热脱水生成对应的酸酐。一般地: ①常温下酸酐是稳定的气态氧化物,则对应的含氧酸往往极不稳定,常温下可发生分解; ②常温下酸酐是稳定的固态氧化物,则对应的含氧酸较稳定,加热时才分解。 (2)某些含氧酸分解是发生氧化还原反应,得不到对应的酸酐。例如硝酸、次氯酸、高锰酸。 5.含氧酸盐的热稳定性: ①酸不稳定,对应的盐也不稳定。例如除钠钾等金属的碳酸盐、次氯酸盐;酸较稳定,对应的盐也较稳定。例如硫酸盐和磷酸盐比较稳定。 ②同一种酸的盐,热稳定性顺序是正盐>酸式盐>酸。 ③同一酸根的盐的热稳定性顺序是碱金属盐>过渡金属盐>铵盐。 ④同一成酸元素,高价含氧酸比低价含氧酸稳定,相应含氧酸盐的稳定性顺序也是如此。
热分析实验报告
热分析实验报告 一、实验目的 1、了解STA449C综合热分析仪的原理及仪器装置; 2、学习使用TG-DSC综合热分析方法。
二、实验内容 1、对照仪器了解各步具体的操作及其目的。 2、测定纯Al-TiO2升温过程中的DSC、TG曲线,分析其热效应及其反应机理。 3、运用分析工具标定热分析曲线上的反应起始温度、热焓值等数据。 三、实验设备和材料 STA449C综合热分析仪 四、实验原理 热分析(Thermal Analysis TA)技术是指在程序控温和一定气氛下,测量试样的物理性质随温度或时间变化的一种技术。根据被测量物质的物理性质不同,常见的热分析方法有热重分析(Thermogravimetry TG)、差热分析(Difference Thermal Analysis,DTA)、差示扫描量热分析(Difference Scanning Claorimetry,DSC)等。其内涵有三个方面:①试样要承受程序温控的作用,即以一定的速率等速升(降)温,该试样物质包括原始试样和在测量过程中因化学变化产生的中间产物和最终产物;②选择一种可观测的物理量,如热学的,或光学、力学、电学及磁学等;③观测的物理量随温度而变化。
热分析技术主要用于测量和分析试样物质在温度变化过程中的一些物理变化(如晶型转变、相态转变及吸附等)、化学变化(分解、氧化、还原、脱水反应等)及其力学特性的变化,通过这些变化的研究,可以认识试样物质的内部结构,获得相关的热力学和动力学数据,为材料的进一步研究提供理论依据。 综合热分析,就是在相同的热条件下利用由多个单一的热分析仪组合在一起形成综合热分析仪,见图1,对同一试样同时进行多种热分析的方法。 图1 综合热分析仪器(STA449C) (1)、热重分析( TG)原理 热重法(TG)就是在程序控温下,测量物质的质量随温度变化的关系。采用仪器为日本人本多光太郎于1915年制作了零位型热天平(见图2)。其工作原理如下:在加热过程中如果试样无质量变化,热天平将保持初始的平衡状态,一旦样品中有质量变化时,
热重分析及其在高分子材料方面的应用
热重分析方法在高分子材料领域的应用 [摘要]热分析是研究物质的物理化学性质随温度变化的一类技术,随着计算机在线分析和反馈控制技术的发展及多种手段联用技术的发展,热分析技术也得到了显著的发展。热分析是高分子的常规表征手段,可用于表征结构相变,分析残余单体和溶剂含量,添加剂的检测,热降解的研究;同时被用于产品质量的检测,生产过程的优化及考察外因对高分子性质的影响等。热重法定量性强,能准确地测量物质的质量变化及变化的速率。根据这一特点,可以说,只要物质受热时发生质量的变化,都可以用热重法来研究。我们可以看出,这些物理变化和化学变化都是存在着质量变化的,如升华、汽化、吸附、解吸、吸收和气固反应等。热重法测定的结果与实验条件有关,为了得到准确性和重复性好的热重曲线,我们有必要对各种影响因素进行仔细分析。影响热重测试结果的因素,基本上可以分为三类:仪器因素、实验条件因素和样品因素。 [关键词]热重分析法;质谱;联用技术 根据热分析协会(ICTA)的归纳分类,目前热分析法共分为9 类 17 种,其中主要和常用的热分析方法是热重法(Thermogravimetry,TG),差热分析法(Differential Thermal Analysis,DTA),差示扫描热量法(Differential Scanning
Calorimetry,DSC)。热重法是在程序控温下,测量物质的质量与温度的关系,通常热重法分为非等温热重法和等温热重法。它具有操作简便、准确度高、灵敏快速以及试样微量化等优点。但热重分析法无法对体系在受热过程中逸出的挥发性组分加以检测,这严重阻碍了热分析技术的应用与发展。因此,将 TG 法与其它先进的检测系统联用,如 TG/MS、 TG/FTIR 等,是现代热分析仪器的一个发展趋势。 1 热分析技术发展简史 热分析方法是仪器分析方法之一,它与紫外分光光度法、红外光谱分析法、原子吸收光谱法、核磁共振波谱法、电子能谱分析法、扫描电子显微镜法、质谱分析法和色谱分析法等相互并列和互为补充的一种仪器分析方法。 热分析技术是在程序温度(指等速升温、等速降温、恒温或步级升温等)控制下测量物质的物理性质随温度变化,用于研究物质在某一特定温度时所发生的热学、力学、声学、光学、电学、磁学等物理参数的变化。由此进一步研究物质的结构和性能之间的关系;研究反应规律;制订工艺条件等。最早发现的一种热分析现象是热失重,由英国人Edgwood 在 1786 年研究陶瓷粘土时首先观察到的,他注意到加热陶瓷粘土到达暗红色时有明显的失重,而在其前后的失重都极小。 1887 年法国的 Le chatelier 使用了热电偶测量温度的方法对试样进行升温或降温来研究粘土类矿物的热性能 研究,获得了一系列粘土试样的加热和冷却曲线,根据这些曲线去鉴
最新差热分析DTA实验报告
差热分析DTA 一、实验目的 掌握热分析方法─差热分析法基本原理和分析方法。 了解差热分析和热重分析仪器的基本结构和基本操作。 二、差热分析基本原理 差热分析法(Differential Thermal Analysis,DTA)是在程序控温下测量样品和参比物的温度差与温度(或时间)相互关系的一种技术。 物质在加热或冷却过程中会发生物理或化学变化,同时产生放热或吸热的热效应,从而导致样品温度发生变化。因此差热分析是一种通过热焓变化测量来了解物质相关性质的技术。样品和热惰性的参比物分别放在加热炉中的两个坩埚中,以某一恒定的速率加热时,样品和参比物的温度线性升高;如样品没有产生焓变,则样品与参比物的温度是一致的(假设没有温度滞后),即样品与参比物的温差DT=0;如样品发生吸热变化,样品将从外部环境吸收热量,该过程不可能瞬间完成,样品温度偏离线性升温线,向低温方向移动,样品与参比物的温差DT<0;反之,如样品发生放热变化,由于热量不可能从样品瞬间逸出,样品温度偏离线性升温线,向高温方向变化,温差DT>0。上述温差DT(称为DTA 信号)经检测和放大
以峰形曲线记录下来。经过一个传热过程,样品才会回复到与参比物相同的温度。 在差热分析时,样品和参比物的温度分别是通过热电偶测量的,将两支相同的热电偶同极串联构成差热电偶测定温度差。当样品和参比物温差DT=0,两支热电偶热电势大小相同,方向相反,差热电偶记录的信号为水平线;当温差DT10,差热电偶的电势信号经放大和A/D换,被记录为峰形曲线,通常峰向上为放热,峰向下为吸热。差热曲线直接提供的信息主要有峰的位置、峰的面积、峰的形状和个数,通过它们可以对物质进行定性和定量分析,并研究变化过程的动力学。峰的位置是由导致热效应变化的温度和热效应种类(吸热或放热)决定的,前者体现在峰的起始温度上,后者体现在峰的方向上。不同物质的热性质是不同的,相应的差热曲线上的峰位置、峰个数和形状也不一样,这是差热分析进行定性分析的依据。分析DTA 曲线时通常需要知道样品发生热效应的起始温度,根据国际热分析协会(ICTA)的规定,该起始温度应为峰前缘斜率最大处的切线与外推基线的交线所对应的温度T(如图2),该温度与其它方法测得的热效应起始温度较一致。DTA峰的峰温Tp虽然比较容易测定,但它既不反映变化速率到达最大值时的温度,也与放热或吸热结束时的温度无关,其物理意义并不明确。此外,峰的面积与
物质热稳定性的热分析试验方法
物质热稳定性的热分析 试验方法 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
物质热稳定性的热分析试验方法 1 主题内容与适用范围 本标准规定了用差热分析仪和(或)差示扫描量热计评价物质热稳定性的热 分析方法所用的试样和参比物、试验步骤和安全事项等一般要求。 本标准适用于在惰性或反应性气氛中、在-50~1000℃的温度范围内有焓变 的固体、液体和浆状物质热稳定性的评价。 2 术语 物质热稳定性 在规定的环境下,物质受热(氧化)分解而引起的放热或着火的敏感程度。 焓变 物质在受热情况下发生吸热或放热的任何变化。 焓变温度 物质焓变过程中的温度。 3 方法原理 本方法是用差热分析仪或差示扫描量热计测量物质的焓变温度(包括起始温度、外推起始温度和峰温)并以此来评价物质的热稳定性。 4 仪器和材料 仪器 差热分析仪(DTA)或差示扫描量热计(DSC):程序升温速率在2~30℃/min 范围内,控温精度为±2℃,温差或功率差的大小在记录仪上能达到40%~95% 的满刻度偏离。 样品容器
坩埚:铝坩埚、铜坩埚、铂坩埚、石墨坩埚等,应不与试样和参比物起反应。气源 空气、氮气等,纯度应达到工业用气体纯度。 冷却装置 冷却装置的冷却温度应能达到-50℃。 参比物 在试验温度范围内不发生焓变。典型的参比物有煅烧的氧化铝、玻璃珠、硅 油或空容器等。在干燥器中储存。 5 试样 取样 对于液体或浆状试样,混匀后取样即可;对于固体试样,粉碎后用圆锥四分 法取样。 试样量 试样量由被测试样的数量、需要稀释的程度、Y 轴量程、焓变大小以及升温 速率等因素来决定,一般为1~5mg,最大用量不超过50mg。如果试样有突然释放大量潜能的可能性,应适当减少试样量。 6 试验步骤 仪器温度校准按附录A 进行,校准温度精度应在±2℃范围内。 将试样和参比物分别放入各自的样品容器中,并使之与样品容器有良好的 热接触(对于液体试样,最好加入试样重量20%的惰性材料,如氧化铝等)。将装有试样和参比物的样品容器一起放入仪器的加热装置内,并使之与热传感元件紧密接触。
热分析技术及其在高分子材料研究中的应用
第33卷第3期2008年9月 广州化学 Guangzhou Chemistry V ol.33, No.3 Sept., 2008 热分析技术及其在高分子材料研究中的应用 翁秀兰1,2 (1. 福建师范大学化学与材料学院,福建福州350007; 2. 福建省高分子材料重点实验室,福建福州350007) 摘要:简要介绍了热分析技术——热重法、差热分析、差示扫描量热法、热机械分析法和动态 机械热分析法等及其在高分子材料领域的广泛应用。热分析技术的方法具有快速、方便等优点, 在高分子材料的研究中发挥着重要作用。 关键词:热分析;高分子材料;应用 中图分类号:O657.99 文献标识码:A 文章编号:1009-220X(2008)03-0072-05 热分析技术是在程序控制温度下测量样品的性质随温度或时间变化的一组技术,它在定性、定量表征材料的热性能、物理性能、机械性能以及稳定性等方面有着广泛地应用。热分析技术已渗透到物理、化学、化工、石油、冶金、地质、建材、纤维、塑料、橡胶、有机、无机、低分子、高分子、食品、地球化学、生物化学等各个领域。 在高分子材料研究领域,随着高分子工业的迅速发展,为了研制新型的高分子材料与控制高分子材料的质量和性能,测定高分子材料的熔融温度、玻璃化转变温度、混合物的组成、热稳定性等是必不可少的[1-2]。在这些参数的测定中,热分析是主要的分析工具。 热分析技术主要包括:热重分析法(TG)、差热分析法(DTA)、差示扫描量热法(DSC)、热机械分析法(TMA)、动态热机械分析法(DMA)等。本文简要介绍了热分析技术及其发展前景及其在高分子材料研究领域的应用。 1 TG及其在高分子材料方面的应用 热重法(TG)是在程序温度控制下测量试样的质量随温度或时间变化的一种技术。热重分析主要研究在惰性气体中、空气中、氧气中材料的热的稳定性、热分解作用和氧化降解等化学变化;还广泛用于研究涉及质量变化的所有物理过程,如测定水分、挥发物和残渣,吸附、吸收和解吸,气化速度和气化热,升华速度和升华热;有填料的聚合物或共混物的组成等[3]。 1.1 高分子材料的组分测定 热重法测定材料组分,方法简便、快速、准确,经常用于进行高分子材料组分分析。通过热重曲线可以把材料尤其是高聚物的含量、含碳量和灰分测定出来,而对于高分子材料的混合物,如果各组分的分解温度范围不同的话,则可以利用TG来确定各个组分的含量[4]。 收稿日期:2007-11-13 作者简介:翁秀兰(1980-),女,福建福清人,研究实习员,负责热分析仪器及从事光催化研究。
实验六 差热分析草酸钙的热分解过程
实验六差热分析草酸钙的热分解过程 一、实验目的 1. 掌握差热分析法的基本原理。 2. 了解热分析仪的结构,掌握仪器的基本操作。 3. 利用差热分析技术研究草酸钙的热分解过程。 二、实验原理 热分析是在程序控制温度下测量物质的物理性质与温度关系的一类技术。程序控制温度一般是指线性升温或线性降温,也包括恒温、循环或非线性升温、降温。物质性质包括质量、温度、热焓变化、尺寸、机械特性、声学特性、电学和磁学特性等等。 在热分析技术中,热重法是指在程序控制温度下,测量物质质量与温度关系的一种技术,被测参数为质量(通常为重量),检测装置为“热天平”,热重法测试得到的曲线称为热重曲线(TG)。热重曲线以质量作为纵坐标,可以用重量、总重量减少的百分数、重量剩余百分数或分解分数表示。曲线从上往下表示质量减少,以温度(或时间)作横坐标,从左向右表示温度(或时间)增加,所得到的重量变化对温度的关系曲线则称之为热重曲线。 热重法的主要特点是定量性强,能准确地测量物质质量变化及变化的速率。在正常的情况下,热重曲线的水平部分看作是恒定重量的特征,变化最陡峭的部分,可以给出重量变化的斜率,曲线的形状和解析取决于试验条件的稳定性。热重曲线开始偏离水平部分的温度为反应的起始温度,测量物质的质量是在加热情况下测量试样随温度的变化,如含水和化合物的脱水,无机和有机化合物的热分解。物质在加热过程中与周围气氛的作用,固体或液体物质的升华和蒸发等,都是在加热过程中伴随有重量的变化。 从热重法派生出微商热重法(DTG)和二阶微商法(DDTG),前者是TG 曲线对温度(或时间)的一阶导数,后者是TG 曲线的二阶导数。 差热分析(DTA)是在程序控制温度下,测量物质与参比物之间的温度差与温度函数关系的一种技术,只要被测物质在所用的温度范围内具有热活性,则热效应联系着物理或化学变化,在所记录的差热曲线上呈现一系列的热效应峰,峰
热稳定性分析方法
版 本 号:0.1 页 码:1/3 发布日期:2009-12-09 实验室程序 编 写: 批 准: 签 发: 文件编号:SHLX\LAB\L2-008 题 目:热稳定性测量方法 1.0 目的 提供了产品热稳定性的测量方法。 2.0 概述 (1)原理 Na 2SO 3 方 法 : 用 1N 的 Na 2SO 3 溶 液 吸 收 样 品 粒 子 中 释 放 的 甲 醛 , 生 成HOCH 2SO 3Na 和 NaOH 。 CH 2O +Na 2SO 3+H 2O →HOCH 2SO 3Na +NaOH (2)本测量方法是利用聚甲醛树脂在高温熔融,产生甲醛气体,随氮气带出,被亚 硫酸钠溶液吸收,由滴定反应生成的氢氧化钠,得出甲醛含量。 3.0 仪器和试剂 【仪器】 (1) 油浴(容量约为 130L ,并配有样品熔融管) (2) 加热器 (3) 过热保护装置 (4) 搅拌器 (5) 自动滴定装置 (6) 数据处理计算机 【试剂】 (1) 0.005mol/l 硫酸 (2) 福尔马林(36.0~38.0%) (3) 亚硫酸钠(Na 2SO 3) (4) 缓冲液(pH 6.86) (5) 缓冲液(pH 9.18) (6) 0.1mol/l NaOH 4.0 定义 甲醛含量通过以下方式表示: (1)K 0 :表示从 2 分钟到 10 分钟之间,聚合物中溶解的甲醛,不稳定端基和聚合 物主链分解出来的甲醛量。转化为每分钟的甲醛含量。 (2)K 1 :表示从 10 分钟到 30 分钟之间,聚合物中剩余的溶解甲醛,不稳定端基
文件编号:SHLX\LAB\L2-008 和聚合物主链分解出来的甲醛量。转化为每分钟的甲醛含量。 (3)K2:表示从50 分钟到90 分钟之间,聚合物不稳定端基和聚合物主链分解出来的甲醛量。转化为每分钟的甲醛含量。 5.0安全注意事项 (1)搁置和取出样品过程中,要穿戴安全手套,以防被烫伤。 (2)电极容易损坏,使用时防止碰撞。 (3)作业时,穿戴安全眼镜和防护手套。 (4)实验过程中使用氮气作为载气,所以要控制好氮气流量,并确保良好的通风。6.0步骤 6.1准备 (1) 确认油浴温度223±2℃,硫酸溶液的量。 (2) 打开参比液添加孔,检查电极内饱和KCL 的量,确保液位超过甘汞位置。 (3) 打开自动电位滴定仪、打印机及电脑电源。 (4) 打开电脑桌面上AT-WIN,输入密码并确认与自动电位滴定仪联机。 (5) 调整氮气流量到60 l/h。 (6) 分别用pH 为6.86(25℃)、9.18(25℃)的缓冲液,对电极进行校正(根据 电脑提示进行),若显示“OK”,则校正通过,否则进行检查并重复校正步 骤。 (7) 对自动电位滴定仪进行排气,确保滴定管路中无气泡。 (8) 用250ml 的烧杯,取150ml 吸收液(1mol/L 亚硫酸钠溶液,它的配制方法: 将250g 的Na 2SO3溶于2000ml 的水中,充分搅拌。),放入磁性搅拌子、加 盖、并将电极、N2管、喷嘴插入溶液中,启动搅拌按钮。 (9) 用硫酸溶液(0.1N)将溶液pH 调节至9.10,待稳定后,用0.1mol/l 甲醛溶 液(配制方法:将81g 的福尔马林放入1L 的容量瓶中,然后加水到刻度线, 配成约0.1mol/l 福尔马林),调节pH 至9.21~9.22,并稳定10 分钟以上。 (10) 电极浸泡液的配制方法:PH=4 的缓冲试剂250ml 一包溶于250ml 水中, 再加入56gKCL,适当加热,搅拌至完全溶解。 6.2步骤 (1) 用铝皿取3.000±0.003g,将其放到小金属底部,然后用钩子,将准备好的 样品放入油浴的熔融管中。 (2) 盖紧硅胶塞,快速按下START,开始试验,试验过程控制pH 值为9.20。 (3) 当实验进行到设定的时间后,自动结束。(按“RESET”键,可手动停止实 验。)测定结束,打印机自动打印结果。 (4) 取出金属筒冷却,取出电极,并将电极放入浸泡液中。
差热分析_实验报告
学生实验报告 实验名称差热分析 姓名:学号:实验时间: 2011/5/20 一、实验目的 1、掌握差热分析原理和定性解释差热谱图。 2、用差热仪测定和绘制CuSO4·5H2O等样品的差热图。 二、实验原理 1、差热分析原理 差热分析是测定试样在受热(或冷却)过程中,由于物理变化或化学变化所产生的热效应来研究物质转化及花絮而反应的一种分析方法,简称DTA(Differential Thermal Analysis)。 物质在受热或者冷却过程中个,当达到某一温度时,往往会发生熔化、凝固、晶型转变、分解、化合、吸收、脱附等物理或化学变化,因而产生热效应,其表现为体系与环境(样品与参比物之间)有温度差;另有一些物理变化如玻璃化转变,虽无热效应发生但比热同等某些物理性质也会发生改变,此时物质的质量不一定改变,但温度必定会变化。差热分析就是在物质这类性质基础上,基于程序控温下测量样品与参比物的温度差与温度(或时间)相互关系的一种技术。 DTA的工作原理(图1 仪器简易图)是在程序温度控制下恒速升温(或降温)时,通过热偶点极连续测定试样同参比物间的温度差ΔT,从而以ΔT对T 作图得到热谱图曲线(图2 差热曲线示意图),进而通过对其分析处理获取所需信息。 图1 仪器简易图
实验仪器实物图 图2 差热曲线示意图 在进行DTA测试是,试样和参比物分别放在两个样品池内(如简易图所示),加热炉以一定速率升温,若试样没有热反应,则它的温度和参比物温度间温差ΔT=0,差热曲线为一条直线,称为基线;若试样在某温度范围内有吸热(放热)反应,则试样温度将停止(或加快)上升,试样和参比物之间产生温差ΔT,将该信号放大,有计算机进行数据采集处理后形成DTA峰形曲线,根据出峰的温度 及其面积的大小与形状可以进行分析。 差热峰的面积与过程的热效应成正比,即 ΔH。式中,m为样品质量;b、d分别为峰的 起始、终止时刻;ΔT为时间τ内样品与参比物的温差;
热重分析实验报告
南昌大学实验报告 学生姓名:_______ 学号:_______专业班级:__________ 实验类型:□演示□验证□综合□设计□创新实验日期:2013-04-09实验成绩: 热重分析 一、实验目的 1.了解热重分析法的基本原理和差热分析仪的基本构造; 2.掌握热重分析仪的使用方法; 3.测定硫酸铜晶体试样的差热谱图,并根据所得到的差热谱图,分析样品在加热过程中发生的化学变化。 二、实验原理 热重法(TG)是在程序控制温度的条件下测量物质的质量与温度关系的一种技术。热重分析仪主要由天平、炉子、程序控温系统、记录系统等几个部分构成。最常用的测量的原理有两种,即变位法和零位法。所谓变位法,是根据天平梁倾斜度与质量变化成比例的关系,用差动变压器等检知倾斜度,并自动记录。零位法是采用差动变压器法、光学法测定天平梁的倾斜度,然后去调整安装在天平系统和磁场中线圈的电流,使线圈转动恢复天平梁的倾斜,即所谓零位法。由于线圈转动所施加的力与质量变化成比例,这个力又与线圈中的电流成比例,因此只需测量并记录电流的变化,便可得到质量变化的曲线。 热重实验仪器主要由记录天平、炉子、程序控温装置、记录仪器和支撑器等几个部分组成,其中最主要的组成部分是记录天平,它基本上与一台优质的分析天平相同,如准确度、重现性、抗震性能、反应性、结构坚固程度以及适应环境温度变化的能力等都有较高的要求。记录天平根据动作方式可以分为两大类:偏转型和指零型,无论哪种方式都是将测量到的重量变化用适当的转换器变成与重量变化成比例的电信号,并可以将得到的连续记录转换成其他方式,如原始数据的微分、积分、对数或者其他函数等,用来对实验的多方面热分析。在上述方法中又以指零型天平中的电化学法适应性更强。发生重量变化时,天平梁发生偏转,梁中心的纽带同时被拉紧,光电检测元件的偏转输出变大,导致吸引线圈中电流的改变。在天平一端悬挂着一根位于吸引线圈中的磁棒,能通过自动调节线圈电流时天平梁保持平衡态,吸引线圈中的电流变化与样品的重量变化成正比,由计算机自动采集数据得到 TG 曲线。燃烧失重速率曲线 DTG 可以通过对曲线的数学分析得到。 热重分析原理如下图所示:
热重分析实验报告
热重分析实验报告 南昌大学实验报告 学生姓名: _______ 学号: _______专业班级:__________ 实验类型:?演示?验证 ?综合?设计?创新实验日期:2013-04-09 实验成绩: 热重分析 一、实验目的 1.了解热重分析法的基本原理和差热分析仪的基本构造; 2.掌握热重分析仪的使用方法; 3.测定硫酸铜晶体试样的差热谱图,并根据所得到的差热谱图,分析样品在加热过程中发生的化学变化。 二、实验原理 热重法(TG)是在程序控制温度的条件下测量物质的质量与温度关系的一种技术。热重分析仪主要由天平、炉子、程序控温系统、记录系统等几个部分构成。最常用的测量的原理有两种,即变位法和零位法。所谓变位法,是根据天平梁倾斜度与质量变化成比例的关系,用差动变压器等检知倾斜度,并自动记录。零位法是采用差动变压器法、光学法测定天平梁的倾斜度,然后去调整安装在天平系统和磁场中线圈的电流,使线圈转动恢复天平梁的倾斜,即所谓零位法。由于线圈转动所施加的力与质量变化成比例,这个力又与线圈中的电流成比例,因此只需测量并记录电流的变化,便可得到质量变化的曲线。 热重实验仪器主要由记录天平、炉子、程序控温装置、记录仪器和支撑器等几个部分组成,其中最主要的组成部分是记录天平,它基本上与一台优质的分析天平相同,如准确度、重现性、抗震性能、反应性、结构坚固程度以及适应环境温度
变化的能力等都有较高的要求。记录天平根据动作方式可以分为两大类:偏转型和指零型,无论哪种方式都是将测量到的重量变化用适当的转换器变成与重量变化成比例的电信号,并可以将得到的连续记录转换成其他方式,如原始数据的微分、积分、对数或者其他函数等,用来对实验的多方面热分析。在上述方法中又以指零型天平中的电化学法适应性更强。发生重量变化时,天平梁发生偏转,梁中心的纽带同时被拉紧,光电检测元件的偏转输出变大,导致吸引线圈中电流的改变。在天平一端悬挂着一根位于吸引线圈中的磁棒,能通过自动调节线圈电流时天平梁保持平衡态,吸引线圈中的电流变化与样品的重量变化成正比,由计算机自动采集数据得到 TG 曲线。燃烧失重速率曲线 DTG 可以通过对曲线的数学分析得到。 热重分析原理如下图所示: 三、实验仪器及试剂 HCT-2 型 TG-DTA 综合热分析仪、镊子、五水硫酸铜晶体等 四、实验步骤 1、打开炉子,将左右两个陶瓷杆放入瓷坩埚容器,关好炉子在操作界面上调零。 2、将坩埚放在天平上称量,记下数值P1,然后将测试样放入已称坩埚中称量,记下试样的初始质量。 3、将称好的样品坩埚放入加热炉中吊盘内。 4、调整炉温,选择好升温速率。 5、开启冷却水,通入惰性气体。 6、启动电炉电源,使电源按给定的速率升温。 7、观察测温表,每隔一定时间开启天平一次,读取并记录质量数值。 8、测试完毕,切断电源,待温度降低至100摄氏度时切断冷却水。 五、实验结果及数据处理
南京大学-差热分析实验报告
差热分析 近代物理实验 一.实验目的 1?掌握差热分析的基本原理及测量方法。 2?学会差热分析仪的操作,并绘制CuSO4 5H2O等样品的差热图。 3?掌握差热曲线的处理方法,对实验结果进行分析。 二.实验原理 1、差热分析基本原理 物质在加热或冷却过程中,当达到特定温度时,会产生物理或化学变化,同时产生吸热和放热 的现象,反映了物质系统的焓发生了变化。在升温或降温时发生的相变过程,是一种物理变化,一般来说由固相转变为液相或气相的过程是吸热过程,而其相反的相变过程则为放热过程。在各种化学变化中,失水、还原、分解等反应一般为吸热过程,而水化、氧化和化合等反应则为放热过程。差热分析利用这一特点,通过对温差和相应的特征温度进行分析,可以鉴别物质或研究有关的转化温度、热效应等物理化学性质,由差热图谱的特征还可以用以鉴别样品的种类,计算某些反应的活化能和反应级数等。 在差热分析中,为反映微小的温差变化,用的是温差热电偶。在作差热鉴定时,是将与参比物 等量、等粒级的粉末状样品,分放在两个坩埚内,坩埚的底部各与温差热电偶的两个焊接点接触,与两坩埚的等距离等高处,装有测量加热炉温度的测温热电偶,它们的各自两端都分别接人记录仪的回路中在等速升温过程中,温度和时间是线性关系,即升温的速度变化比较稳定,便于准确地确定样品反应变化时的温度。样品在某一升温区没有任何变化,即也不吸热、也不放热,在温差热电偶的两个焊接点上不产生温差,在差热记录图谱上是一条直线,已叫基线。如果在某一温度区间样 品产生热效应,在温差热电偶的两个焊接点上就产生了温差,从而在温差热电偶两端就产生热电势差,经过信号放大进入记录仪中推动记录装置偏离基线而移动,反应完了又回到基线。吸热和放热效应所产生的热电势的方向是相反的,所以反映在差热曲线图谱上分别在基线的两侧,这个热电势的大小,除了正比于样品的数量外,还与物质本身的性质有关。 将在实验温区内呈热稳定的已知物质与试样一起放入一个加热系统中,并以线性程序温度对它们加热。如以AI2O3为参比物,它在整个试验温度内不发生任何物理化学变化,因而不产生任何热
草酸钙的热重-差热分析
综合热分析法测定草酸钙 【实验目的】 (1)掌握热重-差热分析原理和ZCT-A型综合热分析仪的操作方法,了解其应用范围。 (2)对草酸钙进行热重及差热分析,测量化学分解反应过程中的分解温度。 (3)测量物质在加热过程中所发生的物理化学变化,绘制相应曲线,从而研究材料的反应过程。 【实验原理】 热分析是物理化学分析的基本方法之一。综合热分析研究物质在加热过程中发生相变或其他物理化学变化时所伴随的能量、质量和体积等一系列的变化,可以确定其变化的实质或鉴定矿物。热分析技术种类很多,比较常用的方法有(1)差热法(DTA),(2)热重法(TG)[包括微分热重(DTG)],(3)差示扫描量热法(DSC)。 (1)热重分析 热重分析是在程序控制温度下,测量物质质量与温度关系的一种技术。热重法实验得到的曲线称为热重(TG)曲线。TG曲线以温度作横坐标,以试样的失重作纵坐标,显示试样的绝对质量随温度的恒定升高而发生的一系列变化。这些变化表征了试样在不同温度范围内发生的挥发组分的挥发,以及在不同温度范围内发生的分解产物的挥发。如图1、图2 CaC2O4·H2O的热重曲线,有三个非常明显的失重阶段。第一个阶段表示水分子的失去,第二个阶段表示CaC2O4分解为CaCO3,第三个阶段表示CaCO3分解为CaO。当然,CaC2O4·H2O的热失重比较典型,在实际上许多物质的热重曲线很可能是无法如次明了地区分为各个阶段的,甚至会成为一条连续变化地曲线。这时,测定曲线在各个温度范围内的变化速率就显得格外重要,它是热重曲线的一阶导数,称为微分热重曲线[图1也现示出了CaC2O4·H2O的微分热重曲线(DTG)]。微分热重曲线能很好地显示这些速率地变化。
热分析常用方法及谱图
常用的热分析方法 l热重法(Thermogravimetry TG) l 差示扫描量热仪(Differential Scanning Calorimetry DSC)l 差热分析(Differential Thermal Analysis DTA) l 热机械分析(Thermomechanical Analysis TMA) l 动态热机械法(Dynamic Mechanical Analysis DMA) 谱图分析的一般方法 《热分析导论》刘振海主编 《分析化学手册》热分析分册 TGA DSC 分析图谱的一般方法——TGA 1. 典型图谱 分析图谱的一般方法——TGA的实测图谱
I、PVC 35.26% II、Nylon 6 25.47% III、碳黑14.69% IV、玻纤24.58% 已知样品的图谱分析 与已知样品各方面特性结合起来分析 如:无机物(黏土、矿物、配合物)、生物大分子、高分子材料、金属材料等热分析谱图都有各自的特征峰。 与测试的仪器、条件和样品结合起来分析 仪器条件样品 应用与举例 TGA DSC/DTA TMA 影响测试图谱结果的因素——测试条件 TGA 升温速率 样品气氛
扫描速率 样品气氛 升温速率对TGA 曲线的影响 气氛对TGA 曲线的影响 PE TGA-7 测试条件: 扫描速率:10C/min 气氛:a. 真空 b. 空气 流量:20ml/min 样品:CaCO3(AR) 过200目筛,3-5mg 扫描速率对DSC/DTA曲线的影响气氛对DSC/DTA曲线的影响 气氛的性质
两个氧化分解峰 曲线b: 一个氧化分解峰, 和一个热裂解峰 影响测试图谱结果的因素——样品方面 TGA/DSC/DTA 样品的用量 样品的粒度与形状 样品的性质 样品用量对TGA/DSC/DTA曲线的影响 样品的粒度与形状对曲线的影响——TGA/DSC/DTA 样品的性质对曲线的影响——TGA/DSC/DTA TGA/ DSC/DTA 热分析曲线的形状随样品的比热、导热性和反应性的不同而不同。即使是同种物质,由于加工条件的不同,其热谱图也可能不同。如PET树脂,经过拉伸过的PET树脂升温结晶峰就会消失。 PET 树脂的DSC 曲线 TGA应用 成分分析 无机物、有机物、药物和高聚物的鉴别与多组分混合物的定量分析。游离水、结合水、结晶水的测定,残余溶剂或单体的测定、添加剂的测定等。 热稳定性的测定 物质的热稳定性、抗氧化性的测定,热分解反应的动力学研究等 居里点的测定 磁性材料居里点的测定 可用TGA测量的变化过程
