免费版本地OpenfilerFCTarget配置实验手册

1.FC Target配置
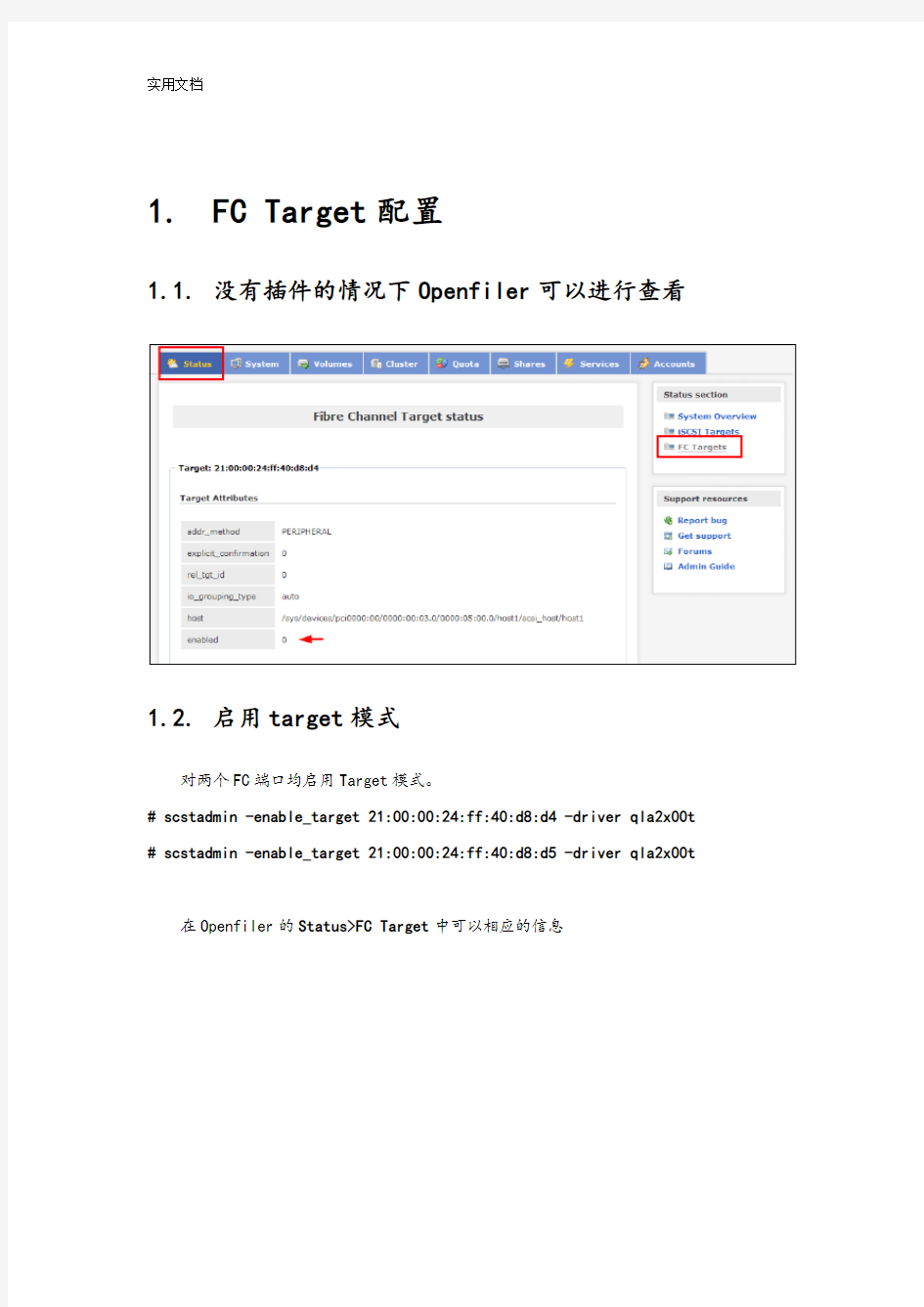
1.1.没有插件的情况下Openfiler可以进行查看
1.2.启用target模式
对两个FC端口均启用Target模式。
# scstadmin -enable_target 21:00:00:24:ff:40:d8:d4 -driver qla2x00t # scstadmin -enable_target 21:00:00:24:ff:40:d8:d5 -driver qla2x00t
在Openfiler的Status>FC Target中可以相应的信息
1.3.创建安全组
对两个存储上的wwn号均进行操作。
# scstadmin -add_group esxi -driver qla2x00t -target 21:00:00:24:ff:40:d8:d4 Collecting current configuration: done.
-> Making requested changes.
-> Adding new group 'esxi' to driver/target 'qla2x00t/21:00:00:24:ff:40:d8:d4': done.
-> Done.
All done.
# scstadmin -add_group esxi -driver qla2x00t -target 21:00:00:24:ff:40:d8:d5 Collecting current configuration: done.
-> Making requested changes.
-> Adding new group 'esxi' to driver/target 'qla2x00t/21:00:00:24:ff:40:d8:d5': done.
-> Done.
All done.
这时,在Openfiler的Status>FC Target中看不到信息了!
通过以下命令检查一下结果
# scstadmin -list_group esxi
Collecting current configuration: done.
Driver: qla2x00t
Target: 21:00:00:24:ff:40:d8:d4
Driver/target 'qla2x00t/21:00:00:24:ff:40:d8:d4' has no associated LUNs. Group: esxi
Group 'esxi' has no associated LUNs or initiators.
Driver: qla2x00t
Target: 21:00:00:24:ff:40:d8:d5
Driver/target 'qla2x00t/21:00:00:24:ff:40:d8:d5' has no associated LUNs. Group: esxi
Group 'esxi' has no associated LUNs or initiators.
1.4.向安全组中添加服务器
写一个脚本文件,将所有的添加命令置于其中。
# vi addsrv.sh
执行一下。
# sh addsrv.sh
这时,在Openfiler的Status>FC Target中又看到信息了!
1.5.创建SCST设备
现在,我们需要在指向逻辑卷的fiber channel device。换句话就说,将SCST与LV 关联起来。
查看当前LV。
# lvdisplay
--- Logical volume ---
LV Name /dev/vg1/lv01
VG Name vg1
LV UUID tSHthB-111U-0Y4c-VvTq-CRWl-O0Sv-rg56PO
LV Write Access read/write
LV Status available
# open 0
LV Size 29.31 GiB
Current LE 938
Segments 1
Allocation inherit
Read ahead sectors auto
- currently set to 256
Block device 253:0
查看当前可用的选项
# scstadmin -list_handler
Collecting current configuration: done.
Handler
-------------
vdisk_fileio
vdisk_blockio
vdisk_nullio
vcdrom
添加SCST设备,设备名为lv01,与名为/dev/vg1/lv01的逻辑卷关联
# scstadmin -open_dev lv01 -handler vdisk_blockio -attributes filename=/dev/vg1/lv01
Collecting current configuration: done.
-> Making requested changes.
-> Opening device 'lv01' using handler 'vdisk_blockio': done.
-> Done.
All done.
查看执行的结果
# scstadmin -list_device
Collecting current configuration: done.
Handler Device
----------------------
vdisk_nullio -
vdisk_fileio -
vdisk_blockio lv01
vcdrom -
All done.
1.6.分配虚拟磁盘给安全组及LUN号
# scstadmin -add_lun 0 -driver qla2x00t -target 21:00:00:24:ff:40:d8:d4 -group esxi -device lv01
Collecting current configuration: done.
-> Making requested changes.
-> Adding device 'lv01' at LUN 0 to driver/target/group 'qla2x00t/21:00:00:24:ff:40:d8:d4/esxi': done.
-> Done.
All done.
# scstadmin -add_lun 0 -driver qla2x00t -target 21:00:00:24:ff:40:d8:d5 -group esxi -device lv01
Collecting current configuration: done.
-> Making requested changes.
-> Adding device 'lv01' at LUN 0 to driver/target/group 'qla2x00t/21:00:00:24:ff:40:d8:d5/esxi': done.
-> Done.
All done.
1.7.保存SCST配置
# scstadmin -write_config /etc/scst.conf
Collecting current configuration: done.
Writing current configuration to file '/etc/scst.conf'..
All done.
这样,又后重新启动器后会自动加载配置了
1.8.如果主机与Openfiler直接相连
需要执行scstadmin -issue_lip
为了方便Openfiler重新启动后自动生效,将其加入到/etc/rc.local最后。
2.VMware主机使用Openfiler资源2.1.使用分配过来的资源资源
有ESXi主机上进行全部重新扫描,就会看到新的磁盘资源
在存储器>添加存储器上,对新分配来的磁盘资源进行格式化操作。
2.2.在存储上查看会话
[root@localhost ~]# scstadmin -list_sessions
Collecting current configuration: done.
Driver/Target: qla2x00t/21:00:00:24:ff:40:d8:d4
Session: 21:00:00:24:ff:2e:6c:2a EXSI 的WWNK Attribute Value Writable KEY ----------------------------------------------------------------- active_commands 0 Yes No LUN 0 lv01 Yes No commands 0 Yes No initiator_name 21:00:00:24:ff:2e:6c:2a Yes No Driver/Target: qla2x00t/21:00:00:24:ff:40:d8:d5
(no sessions)
All done.
化学实验报告 实验__盐酸标准溶液的配制与标定1
实验报告 姓名:班级:同组人:自评成绩: 项目:盐酸标准溶液的配制与标定课程:学号: 一、实验目的 1. 掌握减量称量法称取基准物质的方法,巩固称量操作。 2. 掌握用无水碳酸钠作基准物质标定盐酸溶液的原理和方法。 3. 正确判断甲基红-溴甲酚绿混合指示剂的滴定终点。 二、实验原理 由于浓盐酸易挥发放出HCl气体,直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。标定盐酸的基准物质常用无水碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,终点颜色由绿色变为暗紫色。 用Na2CO3标定时反应为: 2HCl + Na2CO3 ══2NaCl+H2O + CO2↑ 注意事项: 由于反应产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,在接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。 三、仪器和药品 仪器:分析天平,称量瓶,酸式滴定管(50mL),锥形瓶(250mL),量筒(50mL),吸量管(2mL),试剂瓶(250mL),烧杯(250mL),电炉子,石棉网。 试剂:盐酸(A.R),无水碳酸钠(基准物质),甲基红-溴甲酚绿混合指示剂。 四、内容及步骤 1. 盐酸溶液(0.1mol/L)的配制 用移液管移取盐酸1.8mL,加水稀释至200mL,混匀,倒入细口瓶中,密塞,备用。 2. 盐酸溶液(0.1mol/L)的标定 用减量称量法称取在270~300℃灼烧至恒重的基准无水碳酸钠三份,每份重 0.15~0.22g,称至小数点后四位,分别置于三个已编号的250mL锥形瓶中,以50mL蒸馏水溶解,加甲基红-溴甲酚绿混合指示剂10滴,用0.1mol/L盐酸溶液滴定至溶液由绿色变为紫红色,煮沸2分钟,冷却至室温后继续滴定至溶液呈暗紫色为终点,记下消耗HCl标准溶液的体积。平行测定3次,以上平行测定3次的算术平均值为测定结果。 五、实验结果记录与计算 1. 数据记录
一定物质的量浓度溶液的配制实验报告
班级:姓名:评分: 一定物质的量浓度溶液的配制实验报告 【实验目的】1.练习配制一定C B的溶液 2.加深对物质的量浓度概念的理解 3.练习容量瓶的使用方法。【实验仪器】其中玻璃仪器()【实验药品】NaCl、蒸馏水 实验Ⅰ配制100mL1.00 mol/L的NaCl溶液 【实验步骤】 1.计算:需要NaCl固体的质量为g。(写出计算式:)2.称量:用托盘天平称量时,称量NaCl固体的质量为g。 3.溶解:把称好的NaCl固体放入中,用量筒量取ml蒸馏水溶解。 4.移液:待溶液后,将烧杯中的溶液用引流注入容量瓶中。 5.洗涤:用少量蒸馏水洗涤烧杯内壁次,洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。 6.定容:将蒸馏水注入容量瓶,待液面离容量瓶刻度线下时,改用 滴加蒸馏水至。 7.摇匀:盖好容量瓶瓶塞,反复上下颠倒,。 8.装瓶:将配制好的试剂倒入试剂瓶,贴好标签。 注:主要仪器介绍---容量瓶 1.容量瓶是细颈平底玻璃瓶,瓶上标有、和,瓶口配有磨口玻璃塞或塑料塞。 2.常用规格有: mL、 mL、 mL、 mL、 mL等。为了避免在溶解或稀释时因吸热、 放热而影响容量瓶的容积,溶液应先在烧杯中溶解或稀释并冷却至室温后,再将其转移到容量瓶中。 3.使用范围:用来配制一定体积,一定物质的量浓度的溶液 4.注意事项: ①使用前要检查是否漏水(检漏):加水-塞塞-倒立观察-若不漏-正立旋转180°-再倒立观察-不漏。 ②溶解或稀释的操作不能在容量瓶中进行③不能存放溶液或进行化学反应 ④根据所配溶液的体积选取规格⑤使用时手握瓶颈刻度线以上部位,考虑温度因素
实验Ⅱ用98%浓硫酸配制500mL 2.00mol/L稀硫酸 实验用品:实验仪器: (一)实验步骤: 1.计算:需要浓硫酸的体积为mL。(写出计算式:) 2.量取:用量筒量取浓硫酸 3.稀释:。4.移液:待溶液后,将烧杯中的溶液用引流注入容量瓶中。 5.洗涤:用少量蒸馏水洗涤烧杯内壁次,洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。 6.定容:将蒸馏水注入容量瓶,待液面离容量瓶刻度线下时,改用 滴加蒸馏水至。 7.摇匀:盖好容量瓶瓶塞,反复上下颠倒,。 8.装瓶:将配制好的试剂倒入试剂瓶,贴好标签。 实验Ⅲ配制480mL 4mol/L NaOH溶液 (一)实验步骤:(选择容量瓶的规格:mL) 1.计算:需要NaOH固体的质量为g。(写出计算式:)2.称量:用托盘天平称量NaOH时,应注意 3.溶解:把称好的NaOH固体放入中,用量筒量取ml蒸馏水溶解。 4.移液:待溶液后,将烧杯中的溶液用引流注入容量瓶中。 5.洗涤:用少量蒸馏水洗涤烧杯内壁次,洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。 6.定容:将蒸馏水注入容量瓶,待液面离容量瓶刻度线下时,改用 滴加蒸馏水至。 7.摇匀:盖好容量瓶瓶塞,反复上下颠倒,。 8.装瓶:将配制好的试剂倒入试剂瓶,贴好标签。 思考与讨论: 1.比较上述三个实验的步骤,交流一定物质的量浓度溶液配制的注意事项 2.溶液的溶质:所加的物质一定是溶质? 如:用Na2CO3·H2O配制溶液 温馨提示:实验方案设计包括的内容(一个完整的实验方案) 【实验名称】【实验目的】【实验原理】【实验用品】(仪器〈装置〉、药品及其规格等)【实验步骤】【实验现象、数据等记录及其结果分析】【问题和讨论】(试验设计的评价及改进意见)练习:自行设计实验室制取氧气的实验报告
溶液的稀释实验报告
溶液的稀释实验报告 篇一:配制溶液实验报告 篇二:无机化学实验第四版实验三:溶液的配制实验报告 实验名称:溶液的配制 实验日期: 温度:气压: 一. 实验目的 1. 学习比重计,移液管,容量瓶的使用方法 2. 掌握溶液的质量分数,质量摩尔浓度,物质的量浓度等一般配制方法和基本操作 3. 了解特殊溶液的配制 二. 基础知识(详细见课本) 1. 由固体试剂配制溶液 2. 由液体(或浓溶液)试剂配制溶液 三. 基本操作 1. 容量瓶的使用(参见第四章二)
2. 移液管的使用(参见第四章二) 3. 比重计的使用(参见第四章三) 4. 托盘天平及分析天平的使用((参见第四章一) 四. 实验内容 怎样洗涤移液管?水洗净后的移液管在使用之前还要用吸取的溶液来洗涤?为什么? 1把移液管下端的尖端放入洗涤液中,左手拿洗耳球,挤压它,使洗涤液在管中洗涤,再放入水中清答:○ 洗,再用蒸馏水净洗,在使用前,用滤纸将管尖端内外的水吸去○2因为洗净的管中可能含有水,用欲移取的溶液刷洗二至三次,可以确保所移取的溶液的浓度不变。 希望可以帮助更多的同学! 篇三:实验一:一定物质量浓度溶液的配制实验报告 实验目的 1.熟练掌握配制一定物质的量浓度的溶液及容量瓶的使用方法;
2.加深对物质的量浓度概念的理解。 实验内容 配制/L硫酸铜溶液 1. 实验原理 溶液稀释前后溶质的物质的量不变。 2.实验装置图 3.实验所需仪器及药品 托盘天平、小烧杯、药匙、容量瓶(250ml)、胶头滴管、玻璃棒、量筒、蒸馏水、CuSO45H2O固体 4.实验步骤. 计算:所需固体粉固体的质量为: 31m=250×10-×/L×250g·mol-= (2)溶解:将固体置于250ml烧杯中,加入约所配溶液体积一半的水溶解,搅拌并冷却 到室温。 转移液体: 将冷却后的溶液沿玻璃棒转移到容量瓶中。 (4)洗涤:用少量蒸馏水洗涤烧
普通化学实验报告(中石大2017)
中国石油大学(华东)现代远程教育 实验报告 课程名称:普通化学/化学原理1 实验名称:电解质溶液-同离子效应实验形式:在线模拟+现场实践提交形式:在线提交实验报告学生姓名: _______________ 学号:________________ * 年级专业层次: ________________ 怛 提交时间:________ 年________ 月________ 日 学习“同离子效应(一)、(二)”实验,详见《普通化学》(《化学原理1》)课件中
的"实验教学”-“实验内容”-“电解质溶液”,网址https://www.360docs.net/doc/979194934.html,/jpk2013/pthx/fzsy.html ,并回答下面的问题。 一、实验目的 (1)加深对弱电解质的解离平衡、同离子效应、盐类水解等基本概念的理解。了解缓冲溶液的缓冲作用及 配制。 (2)掌握难溶电解质的多相离子平衡及沉淀的生成和溶解的条件。
____________________ 3 ________________________________________________________________________________________________________________________________ 0.1 mol - dm Na2S溶液,振荡,观察沉淀的颜色变化,解释所观察到的现象。 3 -3 - 试管中加入2滴0.1 mol - dm Pb(NQ)2溶液,再用滴管加入4滴0.1 mol - dm N&SQ溶液,有白色沉淀硫酸铅生成;用电动离心机离心沉降,然后在沉淀中加入8滴0.1 mol - dm-3 KI溶液,振荡, 发现白色沉淀转为黄色沉淀。再在沉淀物中加入4滴Na2CQ饱和溶液,振荡,发现黄色沉淀转为白色沉淀。 3 - 再用滴管加入4滴0.1 mol - dm NaaS溶液,振荡,发现白色沉淀转为黑色沉淀硫化铅。 3 -3 - (4) 在三支试管中分别加入5滴0.1 mol - dm MgC2溶液,再逐滴加入2 mol - dm NH水溶液, _3 、. -3 此时生成的沉淀是什么?然后分别加入 2 mol - dm HCl溶液、固体NHAc和2 mol - dm NaQH溶液, 观察沉淀是否都溶解?解释之。 在三支试管中用滴管分别加入5滴0.1 mol - dm-3 MgC2溶液,再用滴管逐滴加入2 mol - dm-3 NH3 3 - 水溶液,有白色沉淀氢氧化镁生成;用滴管向其中一支试管加入 2 mol - dm HCl溶液,沉淀溶解;用滴 3 - 管向其中另一支试管加入NTAc固体,沉淀溶解;用滴管向最后一支试管中加入 2 mol - dm NaQH沉 淀不溶解。对比三支试管现象,说明氢氧化镁无酸性。 (5) 在试管中加入2滴0.1 mol - dm-3 CuSQ和2滴0.1 mol - dm-3 N Q S溶液,观察黑色沉淀的生 3 - 成。离心沉降,弃去清液。加入10滴6 mol - dm HNQ溶液,微热,沉淀是否溶解?写出反应式。 3 __ 3 用滴管向试管中加入2滴0.1 mol - dm CuSQ,再加入2滴0.1 mol - dm Na?S溶液,有黑色沉淀CuS, Cu + S = CuS J。 用电动离心机离心沉降,弃去清液,用滴管向试管中加入10滴6 mol - dm-3 HNQ溶液,用酒精灯微 热,沉淀溶解,3CuS+8HN3=3Cu(NQ)2+3S+2NQT +4HQ 五、实验现象及结论 (1)何谓同离子效应? (2 )盐的水解有哪些类型?试各举一例,并以离子方程式表示。 (3)常见的缓冲溶液有哪几种类型?如何用 1 mol - dm-3 HAc和1 mol - dm-3 NaAc配 3 制100 crn pH = 5的缓冲溶液? (4)如何用SnCl2配制澄清的SnCl2溶液。
液体洗涤剂的配制实验报告
实验日期成绩 同组人××× 闽南师范大学应用化学专业实验报告 题目:液体洗涤剂的配制 应化×××B1组 0 前言 实验目的:1.掌握配制液体洗涤剂的配方原理和工艺:2.了解配方中各组分的作用。 概述:现代洗涤剂是含有多种成份的复杂混合物。其中表面活性剂是起清洁作用的主要成份,洗涤剂中的其他成份或是为改善和增加表面活性剂的清洗效能、或是为适应某些特殊需要、或是为制成所需产品形式而加入的。各种表面活性剂和各种助剂都具有各自的特性,这些性质各异的成份混在一起,由于它们之间相互作用便会产生更加理想的洗涤效果。反之,若配方设计不当,各组份的性质也会相互抵消,产生不利的影响。因此洗涤剂的配方是决定某种洗涤产品成功与否的关键因素。洗涤剂配方的变化始终反映着洗涤工业的技术水平和社会生活水平。[1] 液体洗涤剂制造简便,只需将表面活性剂、助剂和其他添加剂,以及经过处理的水,送入混合机进行混合,即得产品。液体洗涤剂的制造不用一系列的加热干燥设备,具有节约能源、使用方便、溶解迅速等优点。液体洗涤剂要求各组分的相容性最为重要。因是液体,配方中的组分必须良好相容,才能保证产品的稳定,使之在一定温度、一定时间内无结晶、无沉淀、不分层、不混浊、不改变气味、不影响使用效果。稳定性主要取决于配方的组成,但也与制备工艺条件、操作技术以及保管条件等有关。[2] 配方的设计原理:洗涤剂的组成主要包括表面活性剂、助剂和辅助剂。在选择液体洗涤剂的主要组分时,可遵循以下一些通用原则:(1)有良好的表面活性和降低表面张力的能力,在水相中有良好的溶解能力;(2)表面活性剂在油/水界面能形成稳定的紧密排列的凝聚态膜;(3)表面活性剂能适当增大水相黏度,以减少液滴的碰撞和聚结速度;(4)要能用最小的浓度和最低的成本达到所要求的洗涤效果。[3] 1 实验方案 1.1 实验材料 仪器:传热式恒温加热磁力搅拌器、台秤、酸式滴定管、烧杯(200ml、100ml)、玻璃棒、量筒(10mL、100mL)、滴管、托盘天平、秒表、精密pH试纸、磁石
EDTA标准溶液的配制与标定实验报告.doc
EDTA标准溶液的配制与标定 一、实验目的 (1)、掌握EDTA标准溶液的配制与标定方法。 (2)、掌握铬黑T指示剂的应用条件和终点颜色变化。 二、实验原理 EDTA(Na2H2Y)标准溶液可用直接法配制,也可以先配制粗略浓度,再用金属Zn、ZnO、CaCO3或MgSO4· 7H2O等标准物质来标定。当用金属锌标定时,用铬黑T(H3In)做指示剂,在pH=10的款冲溶液中进行,滴定到溶液呈蓝色时为止。滴定反应式: 指示剂反应 Hln2- + Zn2+ = Znln- + H+ 滴定反应 H2Y2- + Zn2+ = ZnY2- + 2H+ 终点反应 Znln- + H2Y2-?ZnY2- + Hln2- + H+ 二、实验注意事项 (1)、称取EDTA和金属时,保留四位有效数; (2)、控制好滴定速度; (3)、加热锌溶解时,用表面皿盖住以免蒸发掉。 三、主要仪器与药品 仪器:酸式滴定管、25ml移液管、250ml容量瓶、250ml锥形瓶、250ml烧杯、表面皿。 药品:EDTA二钠盐、金属锌、1:1的氨水、1:1的HCl 、铬黑T指示剂、氨水—NH4Cl缓冲液(PH=10) 四、实验过程及原始数据记录 (1)、称取分析纯EDTA二钠盐1.9g左右,配制成500ml溶液。 (2)、称取0.15~0.2g金属Zn,加入1:1 HCl 5ml,盖好表面皿,使锌完全溶解,用水冲洗表面皿及烧杯内壁,然后将溶液移入250ml容量瓶中,再加水至刻度摇均,用25ml移液管吸此溶液置于250ml锥形瓶中,滴加1:1 氨水至开始出现Zn(OH)2白色沉淀,再加PH=10的缓冲溶液10ml ,加水稀释至100ml ,加入少许(约0.1g)铬黑T指示剂,用待标定的EDTA溶液滴定至溶液由酒红色变 为纯蓝色,即为滴定终点。 EDTA的标定[ m(Zn) = 0.1815g ] 试验次数ⅠⅡⅢ V初 EDTA /ml 0 0 0 V末 EDTA /ml 29.70 29.65 28.60 V EDTA (mol/L) 29.70 29.65 28.60 c EDTA (mol/L) 0.0094 0.0094 0.0098 C EDTA(mol/L)平均值0.0095 相对平均偏差 1.7544%
实验二 缓冲溶液的配制和性质
实验二缓冲溶液的配制和性质 一、实验目的 1、学习缓冲溶液的配制方法,并试验其缓冲作用。 2.、学习并掌握pHS-3C 型pH 计的正确使用方法。 二、实验原理 弱酸及其共轭碱(如HAc-NaAc)的水溶液,或者弱碱和它的共轭酸(如NH3.H2O-NH4Cl)的水溶液,能抵抗外来的少量酸、碱或稀释的影响而使其pH 值保持稳定,具有这种缓冲作用的溶液叫缓冲溶液。对于弱酸及其共轭碱组成的缓冲溶液,其pH值的计算公式为: pH=pka+lg(C共轭碱/C酸) 对于弱碱及其共轭酸组成的缓冲溶液,其pH值的计算公式为: pH=PK w - pk b+lg(C碱/C共轭酸) 缓冲溶液的有效缓冲范围为pKa±1。 三、仪器和药品 仪器:pHS-3C 型精密pH 计 试剂:HN3.H2O(1.0 mol.L-l)、NH4Cl(0.1 mol.L-l)、HAc(0.1 mol.L-l;1.0 mol.L-l)、NaAc (0.1 mol.L-l;1.0 mol.L-l)、NaOH(0.1 mol.L-l)、HCl(0.10 mol.L-l)、标准缓冲溶液。 四、实验内容 1、缓冲溶液pH值的配制及其pH值的测试 按下表配制4种缓冲溶液,测定前将溶液搅拌均匀,分别插入擦洗干净的复合电极,测定其pH值,待读数稳定后,记录测定结果,并进行理论计算,将理论计算值与测定值进行比较。 2、试验缓冲溶液的缓冲作用 在上面配制的第4号缓冲溶液中加入0.5ml(约10滴)0.10mol/L HCI溶液,摇匀,用酸度计测定其PH值,再加入1.0 ml(约20滴)0.10mol/L NaOH溶液,摇
实验完成后,清洗电极,整理仪器。 三、设计和配制PH=3.9、PH=6.0的磷酸盐缓冲溶液和PBS缓冲溶液PH=3.9,配一个磷酸溶液(pH应该在1.8左右),用NaOH调到想要的pH即可 PH=6.0,0.2 Mol/L Na2HPO4(12.2ml) 0.2Mol/L KH2PO4(87.8ml) 五、思考题 1、怎样根据缓冲溶液的PH值选定缓冲物质? 2、为什么在通常情况下配制的缓冲溶液中酸(或碱)的浓度与其共轭碱(或共轭酸)的浓度接近?这种缓冲溶液的PH值主要决定于什么? 3、将10mL0.2mol.L-1 HAc和10mL0.1mol.L-1 NaOH混合,问所得到溶液是否有缓冲作用?这个溶液的pH值在什么范围内?
化学实验报告配置氯化钠溶液
化学实验报告 【实验目的】 1、练习配制一定溶质质量分数或量浓度一定的溶液。 2、加深对溶质的质量分数以及量浓度概念的理解。 【实验器材】 托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。 氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。 【实验步骤】 1、配置质量分数为6%的氯化钠溶液 (1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。 (2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。 (3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。 (4)溶解:用玻璃棒搅拌,使氯化钠溶解。 2、用已配制好的质量分数为6%的氯化钠溶液(密度约为cm3),配制50g质量分数为3%的氯化钠溶液。 (1)计算:所得溶液中,氯化钠的质量为50g*3%=,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml) (2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。 (3)混匀:用玻璃棒搅拌,使溶液混合均匀。 将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。 3、配制250ml,2mol/L的稀盐酸 (1)计算所需浓盐酸的体积 设所需浓盐酸的体积为V1,则 C1*V1=*2mol/L 12mol/L*V1=*2mol/L 解得该体积为 (2)用量筒量取的浓盐酸 (3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。 (4)使用漏斗将烧杯内的溶液转移到容量瓶中。 (5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。 (6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。 (7)压紧容量瓶瓶盖将溶液摇匀。
大学溶液的配制实验报告
大学溶液的配制实验报告 篇一:实验报告_酸碱标准溶液的配制和标定 实验一酸碱标准溶液的配制和标定 实验目的 1. 掌握标准溶液的配制方法。 2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及 滴定操作。 3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。 实验原理 酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。 按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH值称为化学计量点,达到化学计量点时,应满足如下基本关系: cAVA ?cBVB ?A?B 式中,cA、VA、?A分别为酸的“物质的量”浓度、体积、化学计量系数;cB、 VB、?B分别为碱的“物质的量”浓度、体积、化学计量
系数。其中,酸、碱的 化学计量系数由酸碱反应方程式决定。 由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂往往是一些有机的弱酸或弱碱,它们在不同pH值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的pH值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致; ②颜色变化明显;③指示剂用量适当。 酸碱滴定中常用HCl和NaOH溶液作为标准溶液,但由于浓HCl容易挥发,NaOH固体容易吸收空气中的H2O和CO2,直接配成的溶液其浓度不能达到标准溶液的精度,只能用标定法加以标定。基准物质H2C2O4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H2C2O4·2H2O,摩尔质量为126.07g·mol-1)为基准物质,配成H2C2O4标准溶液。以酚酞为指 示剂,用H2C2O4标准溶液标定NaOH溶液;再以甲基橙为指示剂,用标定后的NaOH标准溶液滴定HCl溶液,从而得到HCl标准溶液。 仪器与试剂 电子天平,酸式滴定管(50 mL),碱式滴定管(50 mL),容量瓶(250 mL),移液管(25 mL),吸耳球,锥形瓶(250
大学实验化学 缓冲溶液
缓冲溶液 难题解析 [TOP] 例4-1 计算pH=5.00,总浓度为0.20 mol·L -1的C 2H 5COOH(丙酸,用HPr 表示)- C 2H 5COONa 缓冲溶液中,C 2H 5COOH 和C 2H 5COONa 的物质的量浓度。若向1 L 该缓冲溶液中加入0.010 mol HCl ,溶液的pH 等于多少? 分析 ⑴ 用Henderson —Hasselbalch 方程式直接计算丙酸和丙酸钠的浓度。 ⑵ 加入HCl 后,C 2H 5COOH 浓度增加, C 2H 5COONa 浓度减小。 解 ⑴ 查表4-1,C 2H 5COOH 的p K a = 4.87,设c (HPr) = x mol·L -1。则c (NaPr) =(0.20-x )mol·L -1 pH =p K a +lg Pr) (H )Pr (-c c =4.87+lg 1-1L mol L mol )20.0(??--x x =5.00 解得 x = 0.085 即c (HPr) = 0.085 mol·L -1 c (NaPr) = (0.20 - 0.085) mol·L -1 = 0.12 mol·L -1 ⑵ 加入0.050 mol HCl 后: pH =p K a +lg ) HPr ()Pr (-n n =4.87+lg 0.010)mol (0.0850.010)mol (0.12+-=4.91 例4-2 柠檬酸(缩写H 3Cit )常用于配制供培养细菌的缓冲溶液。现有500 mL 的0.200 mol·L -1柠檬酸溶液,要配制pH 为5.00的缓冲溶液,需加入0.400 mol·L -1的NaOH 溶液多少毫升? 分析 配制pH 为5.00的缓冲溶液,应选NaH 2Cit-Na 2HCit 缓冲系, NaOH 先与H 3Cit 完全反应生成NaH 2Cit ,再与NaH 2Cit 部分反应生成Na 2HCit 。 解 查表4-1,柠檬酸的p Ka 2= 4.77,设H 3Cit 全部转化为NaH 2Cit 需NaOH 溶液V 1 mL ⑴ H 3Cit(aq) + NaOH(aq)NaH 2Cit(aq) + H 2O(l) 0.400 mol·L -1 × V 1 mL = 0.200 mol·L -1 × 500 mL V 1 = 250 即将H 3Cit 完全中和生成NaH 2Cit ,需0.400 mol·L -1NaOH 溶液250 mL ,生成NaH 2Cit 0.200 mol·L -1 ×500 mL=100 mmol 设NaH 2Cit 部分转化为Na 2HCit 需NaOH 溶液V 2 mL , ⑵ NaH 2Cit(aq) + NaOH(aq) Na 2Hcit(aq) + H 2O(l)
配制一定物质的量浓度的溶液实验报告(新)
配制一定物质的量浓度的溶液实验报告 实验目的 1、练习配制一定物质的量浓度的溶液。 2、加深对物质的量浓度概念的理解。 3、练习容量瓶、胶头滴管的使用方法。 实验原理 n=C V,配制标准浓度的溶液 实验用品 烧杯、容量瓶(100mL)、胶头滴管、量筒、玻璃棒、药匙、滤纸、托盘天平、NaCl(s)、蒸馏水。 实验步骤 (1)计算所需溶质的量 (2)称量:固体用托盘天平,液体用量筒(或滴定管/移液管)移取。 (3)溶解或稀释(用玻璃棒搅拌) (4)移液:把烧杯液体引流入容量瓶(用玻璃棒引流)。 (5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。 (6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。(要求平视) (7)盖好瓶塞,反复上下颠倒,摇匀。 实验结果 计算出溶质的质量 实验结论 (1)配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。 (2)不能配制任意体积的一定物质的量浓度的溶液。这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50 mL、100 mL、250 mL、500 mL、和1000 mL等。所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。 备注 重点注意事项: (1)容量瓶使用之前一定要检查瓶塞是否漏水; (2)配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积相同; (3)不能把溶质直接放入容量瓶中溶解或稀释; (4)溶解时放热的必须冷却至室温后才能移液; (5)定容后,经反复颠倒,摇匀后会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。因为定容后液体的体积刚好为容量瓶标定容积。上述情况的出现主要是部分溶液在润湿容量瓶磨口时有所损失; (6)如果加水定容时超过了刻度线,不能将
实验2缓冲溶液的配制与pH值的测定
实验2 缓冲溶液的配制与pH 值的测定 一、实验目的 1、理解缓冲溶液的定义及其特点。 2、理解缓冲溶液的缓冲原理。 3、掌握溶液的粗略配制方法和缓冲溶液的配制方法。 3、学习pH 计的使用方法。 二、实验原理 在共轭酸碱对组成的混合溶液中加入少量强酸或强碱,溶液的pH 值基本上无变化,这种具有保持溶液pH 值相对稳定性能的溶液称为缓冲溶液。缓冲溶液的特点是在适度范围内既能抗酸、又能抗碱,抵抗适度稀释或浓缩。常见的缓冲体系有:HAc-NaAc 、NH 3-NH 4Cl 、Na 2B 4O 7·10H 2O-Na 2CO 3、KH 2PO 4- Na 2HPO 4等。 对于弱酸HB 及其共轭碱B -组成的缓冲溶 液: 对于弱碱B 及其共轭酸BH +组成的缓冲溶液: 一般配制缓冲溶液时,常使c b =c a ,此时缓冲容量最大,缓冲能力最强。 三、实验用品 1、仪器 PB-10酸度计、电子天平(常数双杰JJ600) b a c c HB pKa pH B c HB c HB pKa pH B c HB c Ka H c B O H O H HB lg )()()(lg )() ()()(32-=-==+?+--+-+θ θθ a b b c c pK pOH lg -=θ
2、器材 5mL量筒(1个)、10mL量筒(1个)、50mL烧杯(10个)、标签纸、玻璃棒(1根) 3、试剂 浓氨水(28%)、NH4Cl(s)、冰醋酸(99%)、NaAc(s)、KCl(3mol·L-1)标准缓冲溶液(;) 四、实验内容 1、溶液的粗略配制 (1)·L-1NH4Cl溶液的配制 用精度为的电子天平称取固体NH4Cl,倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。 (2)·L-1氨水溶液的配制 用5mL量筒量取浓氨水(28%),倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。(需在通风厨中操作) (3)·L-1NaAc溶液的配制 用精度为的电子天平称取固体NaAc,倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。 (4)·L-1NaAc溶液的配制 用10mL量筒量取·L-1NaAc溶液,倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。(5)·L-1HAc溶液的配制 用10mL试管量取冰醋酸(99%),倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。(需在通风厨中操作) (6)·L-1HAc溶液的配制 用10mL量筒量取·L-1HAc溶液,倒入50mL带有刻度的洁净烧杯中,加入
实验报告_酸碱标准溶液的配制和标定
实验一 酸碱标准溶液的配制和标定 实验目的 1. 掌握标准溶液的配制方法。 2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及 滴定操作。 3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。 实验原理 酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。 按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH 值称为化学计量点,达到化学计量点时,应满足如下基本关系: B B B A A A V c V c υυ= 式中,A c 、A V 、A υ分别为酸的“物质的量”浓度、体积、化学计量系数;B c 、 B V 、B υ分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的 化学计量系数由酸碱反应方程式决定。 由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂往往是一些有机的弱酸或弱碱,它们在不同pH 值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的pH 值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。 酸碱滴定中常用HCl 和NaOH 溶液作为标准溶液,但由于浓HCl 容易挥发,NaOH 固体容易吸收空气中的H 2O 和CO 2,直接配成的溶液其浓度不能达到标准溶液的精度,只能用标定法加以标定。基准物质H 2C 2O 4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H 2C 2O 4·2H 2O ,摩尔质量为126.07g ·mol -1) 为基准物质,配成H 2C 2O 4标准溶液。以酚酞为指
普通化学实验报告模板
实验一天平称量 实验一天平称量 姓名学号实验日期 一.实验预习与思考 1.电子天平使用过程中需要注意哪几点? 2.称样中常用哪几种称量方法?在什么情况下使用直接称量法?什么情况下使用差减称量法? 3.请说明称完样品后应做的结束工作。
实验一天平称量二.实验结果与讨论 1.直接法称量 钢块编号: 重量g 2.加量法(固定重量称量法)称量 按照g称量要求,称取样品一份。 实际称得g。 3.差减法称量 按照g称量范围,称取样品三份。 ⑴⑵⑶ W初 W终 W(g)
实验二氯化钠的提纯 姓名学号实验日期 一.实验预习与思考 1.请简述本实验所应用的原理,并写出本实验涉及的主要的化学反应式。2.本实验中先除SO42-,后除Ca2+ 、Mg2+ 等离子的次序能否颠倒?为什么?3.去除Ca2+、Mg2+、Ba2+ 等离子时能否用其它可溶性碳酸盐代替Na2CO3?4.为何要用HCl把溶液调节为pH 3~4?能否用其它酸?
5.蒸发浓缩过程中,为什么应将蒸发皿周边析出的固体及时拨入溶液中? 6.在检验产品纯度时,能否用自来水溶解NaCl?为什么? 7.仔细阅读实验基础知识中p.24试剂取用规则,p.16煤气灯使用,p.33蒸发浓缩与结晶,p.35常压过滤、减压过滤、离心分离等有关内容。 二.实验部分 1.提纯步骤及相应现象和数据记录 提纯实验步骤(包括所用试剂与实际用量):现象和数据:
2.定性分析 三.实验结果与讨论 1.实验结果: 原料粗盐重g,获得提纯产物NaCl重g,产率 产物纯度分析结论: 2.问题与讨论: (1).用化学方法除去杂质时,选择除杂试剂的标准是什么? (2). 加沉淀剂除杂质时,为了得到较大晶粒的沉淀,沉淀的条件是什么? (3).你认为本实验中影响提纯产物产率的主要因素是什么?
溶液配制与滴定操作实验报告
溶液配制与滴定操作实验报告 (文章一):实验报告_酸碱标准溶液的配制和标定实验一酸碱标准溶液的配制和标定实验目的 1. 掌握标准溶液的配制方法。 2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及滴定操作。 3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。实验原理酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH值称为化学计量点,达到化学计量点时,应满足如下基本关系:cA V A ?cBVB ?A?B 式中,cA、V A、?A分别为酸的“物质的量”浓度、体积、化学计量系数;cB、VB、?B分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂往往是一些有机的弱酸或弱碱,它们在不同pH值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的pH值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。酸碱滴定中常用HCl和NaOH溶液作为标准溶液,但由于浓HCl容易
挥发,NaOH固体容易吸收空气中的H2O和CO2,直接配成的溶液其浓度不能达到标准溶液的精度,只能用标定法加以标定。基准物质H2C2O4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H2C2O4·2H2O,摩尔质量为12 6.07g·mol-1)为基准物质,配成H2C2O4标准溶液。以酚酞为指示剂,用H2C2O4标准溶液标定NaOH溶液;再以甲基橙为指示剂,用标定后的NaOH标准溶液滴定HCl溶液,从而得到HCl标准溶液。仪器与试剂电子天平,酸式滴定管(50 mL),碱式滴定管(50 mL),容量瓶(250 mL),移液管(25 mL),吸耳球,锥形瓶(250 mL),试剂瓶,量筒,洗瓶,滴定台,蝴蝶夹,烧杯,玻棒,滴瓶,滴管。H2C2O4标准溶液(约0.05 mol·L-1,学生通过直接法[1]自行配制),HCl溶液(0.1 mol·L-1),NaOH溶液(0.1 mol·L-1),酚酞(1%),甲基橙(0.1%)。实验内容 1. 准备用自来水冲洗酸式滴定管、碱式滴定管、容量瓶、移液管,再用去离子水洗涤2~3次,备用。用去污粉洗涤锥形瓶、量筒、烧杯,依次用自来水,去离子水洗净。 2. 0.1 mol·L-1 HCl溶液和0.1 mol·L-1 NaOH溶液的配制(实验室备好)HCl溶液的配制:用洁净的量筒量取浓盐酸4~ 4.5 mL,倒入洁净的试剂瓶中,用水稀释至500 mL,盖上玻璃塞,摇匀,贴上标签备用。NaOH溶液的配制:通过计算求出配制1 L NaOH溶液所需固体NaOH数量,在电子天平上用小烧杯称氢氧化钠,加水溶解,然后将溶液倾入洁净的试剂瓶中,用水稀释至1 L,以橡
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定 实验目的 1.掌握标准溶液的配制方法。 2.掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及 滴定操作。 3.熟悉甲基橙和酚酞指示剂的使用和终点的确定。 实验原理 酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。 按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH 值称为化学计量点,达到化学计量点时,应满足如下基本关系: c A V A c B V B A B 式中, c A、V A、A 分别为酸的“物质的量”浓度、体积、化学计量系数;c B、V B、 B 分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的 化学计量系数由酸碱反应方程式决定。 由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7 处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂 往往是一些有机的弱酸或弱碱,它们在不同pH 值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的 pH 值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。 酸碱滴定中常用 HCl 和 NaOH 溶液作为标准溶液,但由于浓 HCl 容易挥发,NaOH 固体容易吸收空气中的 H2O 和 CO2,直接配成的溶液其浓度不能达到标 准溶液的精度,只能用标定法加以标定。基准物质H2C2O4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H2C2O4·2H2O,摩尔质量为 126.07g· mol-1)为基准物质,配成 H2C2O4标准溶液。以酚酞为指
实验八酸碱反应与缓冲溶液
实验八酸碱反应与缓冲溶液 实验目的 1.进一步理解和巩固酸碱反应的有关概念和原理(同离子效应盐类水解及其影响因素) 2.学习试管实验的一些基本操作 3.学习缓冲溶液的配制及其PH的的测定,了解缓冲溶液的缓冲性能 4.学习酸度计的使用方法 实验原理 1.同离子效应 强电解质兹水中全部解离。弱电解质在水中部分解离。在一定温度下,弱酸弱碱的竭力平衡如下; HA(ag)+H2O(l)?H3O+(ag)+A-(ag) B(ag)+H2O(l)?BH+(ag)+OH-(ag) 在弱电解质溶液中,加入弱电解质含有相同离子的强电解质解离平衡向生成弱电解质的方向移动,是弱电解质的接力度下降。这种现象成为:同离子效应。 2.盐类水解 强酸、强碱盐在水中不水解。强酸弱碱盐(如NH4Cl)水解溶液显酸性,强酸弱碱盐(如NaAc)水解溶液显碱性。弱酸弱碱盐(如NaAc)水解溶液的酸碱性取决于强酸弱碱的相对强弱。例如: Ac-(ag)+H2O(l)?HAc(ag)+OH-(ag) NH4+(ag)+Ac-(ag)+H2O(l)?NH3·H2O(ag)+HAc(ag) 水解反应时酸碱中和反应的逆反应。中和反应是放热反应水解反应时吸热反应。因此升高温度有利于盐类的水解 3.缓冲溶液 由弱酸(或弱碱)与弱酸(或弱碱)盐(如HAc-NaAc;NH3·H2O-NH4Cl;H3PO4-NaH2PO4;NaHPO4;NaHPO4-Na3PO4等)组成的溶液具有保持溶液PH相对稳定的性质,这类溶液称为缓冲溶液。 由弱酸弱碱盐组成的缓冲溶液的PH可由下列公式计算: PH=PKg?(HA)-lgc(HA)/c(A-) 由弱酸-弱碱盐组成的缓冲溶液的PH可用下式计算;
液体药剂的制备实验报告
液体药剂的制备实验报告 篇一:实验报告4:(药学专业、09制药)液体制剂的制备药剂学实验实验报告 实验四液体制剂的制备(药学专业、09制药工程) 一、实验目的和要求 1. 掌握溶液型液体制剂的种类及其概念与特点。 2. 掌握几种典型的溶液型液体制剂的制备方法、质量标准及其检查方法。 3. 了解低分子、高分子溶液型液体制剂中常用附加剂的正确使用,作用机制及其常用量。 二、实验内容和原理 1. 实验内容 (1)低分子溶液型液体制剂的制备 实验1:芳香水剂(薄荷水)的制备(分散溶解法) 以薄荷油、滑石粉(或轻质碳酸镁、活性炭)等为原料,制备芳香水剂(薄荷水)。 实验2:复方碘溶液的制备(助溶法)
以碘、碘化钾为原料,通过助溶法,制备复方碘溶液。 实验3:硫酸亚铁溶液剂的制备(溶解法) 以硫酸亚铁、枸橼酸为原料,通过冷溶法制备糖浆剂。 (2)胶体溶液型液体制剂的制备 实验4:胃蛋白酶合剂的制备(溶解法) 以胃蛋白酶、甘油等为原料,制备高分子型液体制剂胃蛋白酶合剂。 2. 实验原理 (请根据实验教材自己补充,包括助溶法的原理;高分子溶液剂的定义,其热力学稳定性等。) 三、主要仪器设备 1. 实验材料:薄荷油、滑石粉、轻质碳酸镁、活性炭、碘、碘化钾、胃蛋白酶、硫酸亚铁、新鲜牛奶、冰醋酸、氢氧化钠。 2. 设备与仪器:恒温水浴箱、研钵、具塞玻璃瓶、烧杯、量筒等。 四、实验步骤、操作过程 (根据实验过程填写,必须列出处方)
实验1:教科书44页芳香水剂(薄荷水)的制备(分散溶解法) 实验2:教科书45页复方碘溶液的制备(助溶法) 实验3:教科书45页硫酸亚铁糖浆(溶解法制备) 实验4:教科书47页胃蛋白酶合剂的制备,并按照48页附录方法,测定所得酶制剂的活力。 五、实验结果与分析 实验1:薄荷油的制备,比较用三种不同分散剂制备的液体制剂的异同,将结果 记录于表2-1中。 滑石粉 轻质碳酸镁 活性炭 实验2:复方碘溶液,描述成品外观性状,观察碘化钾溶解的水量与加入碘的溶解速度。 实验3:硫酸亚铁糖浆描述成品外观形状,讨论冷溶法存在的不足。 实验4:胃蛋白酶合剂,描述(Ⅰ)法和(Ⅱ)法的成
缓冲溶液配置实验报告
竭诚为您提供优质文档/双击可除缓冲溶液配置实验报告 篇一:缓冲溶液配制实验 实验报告(二)缓冲溶液的配制和ph的测定 区县____________学号____________姓名___________ 成绩_________ 实验内容: 1.hAc-naAc缓冲溶液的配制 注意:百里酚蓝指示剂的变色范围如下: 在试管中加入3mL0.1mol·L的hAc和3mL0.1mol·L的naAc溶液就 配制成了该缓冲溶液.加百里酚蓝指示剂5滴,显示 ___________色.计算此缓冲溶液的ph 将配制的缓冲溶液为为3份. (1)取一份,加入5滴0.1mol·L的盐酸,则颜色变化是__________________________________________.再加入过量的0.1mol·L的盐酸,则颜色的变化是 _________________________________.
(2)取一份,加入5滴0.1mol·L的naoh溶液,则颜色变化是_____________________________________.再加入过 量的0.1mol·L的naoh溶液,则颜色的变化是 _________________________________. (3)取一份,加入5滴水,则溶液的颜色变化是 _________________. 2.nh3·h2o-nh4cl缓冲溶液的配制 将25mL0.1mol·L的nh3·h2o和25mL0.1mol·L的nh4cl 溶液混合在烧杯中,即成缓冲溶液.测定ph值后,分成2分,分别加入0.5mL0.1mol·Lhcl溶液和0.5mL0.1mol·Lnaoh 溶液.填写下表: 思考题:什么是缓冲溶液? 答: -1-1-1-1-1-1-1-1 篇二:4缓冲溶液的配制与ph值的测定 实验三缓冲溶液的配制与ph值的测定 1.实验目的 (1)掌握缓冲溶液的配制原理和方法;(2)熟悉有关缓冲溶液配制的计算公式;(3)了解缓冲溶液的有关性质; (4)学习用ph计测定溶液的ph值; 2.实验原理 在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶
