(完整版)初中常见化学式及化学方程式大全
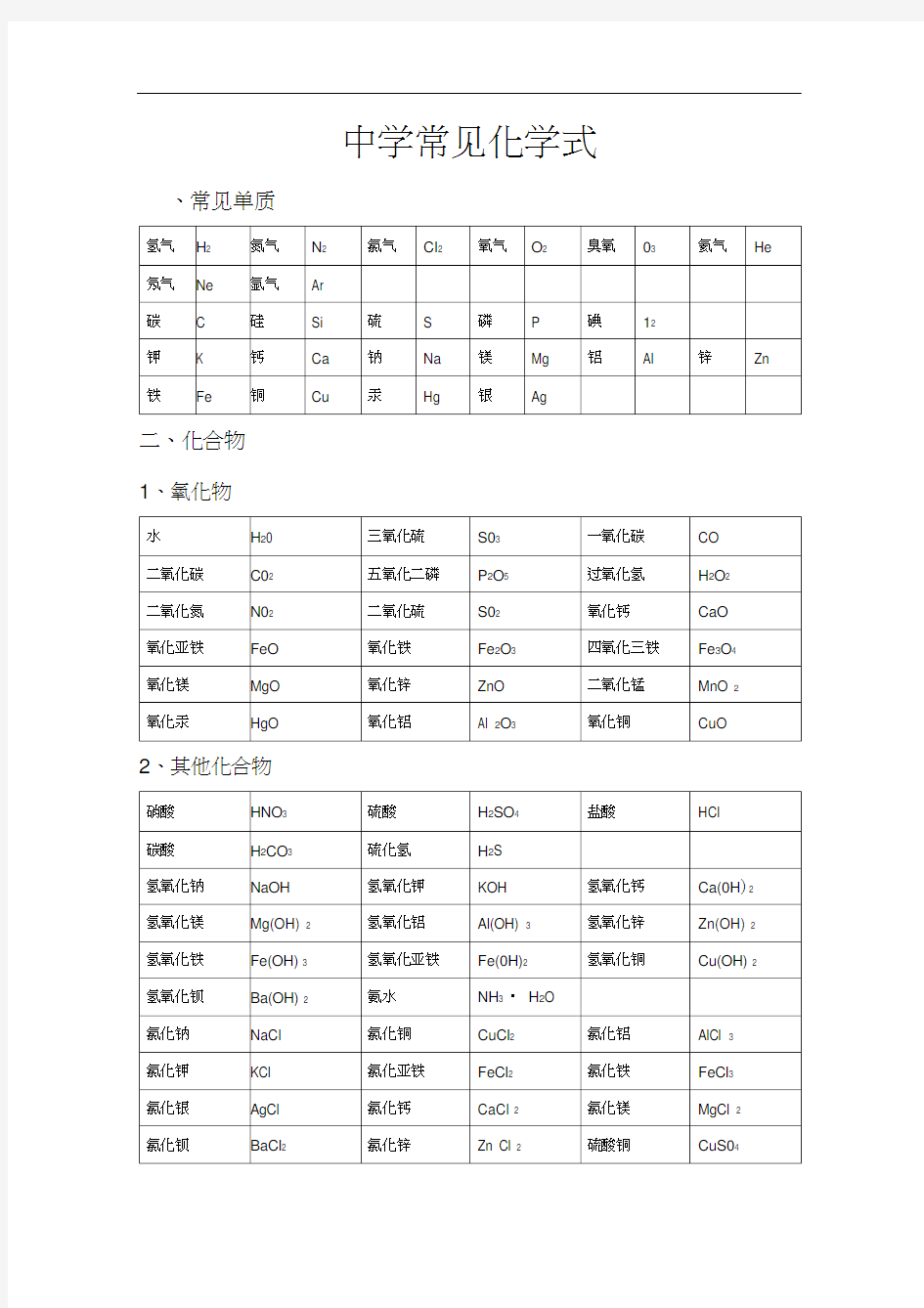

中学常见化学式、常见单质
二、化合物
1、氧化物
2、其他化合物
初中化学方程式汇总
氧气的性质:
(1)单质与氧气的反应:(化合反应) 5. 氢气中空气中燃烧:2H 2 +O 2点燃 2H 2O
6. 红磷在空气中燃烧(研究空气组成的实验):
7. 硫粉在空气中燃烧:S +O 2点燃 SO 2
8. 碳在氧气中充分燃烧:C +Q 点燃 CQ
9. 碳在氧气中不充分燃烧:2C +Q 点燃 2CO (2) 化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO+O 点燃 2CQ 11. 甲烷在空气中燃烧:CH +2O 2点燃 CQ +2H 2O 12. 酒精在空气中燃烧:C 2H 5OH +3O 点燃 2CQ +3H 2O (3) 氧气的来源: —
13?玻义耳研究空气的成分实验 2HgO 加热Hg +O 2 T
14. 加热高锰酸钾:2KMnO 加热K 2MnO+MnO +O 2T (实验室制氧气原理1) 15.
过氧化氢在二氧化锰作催化剂条件下分解反应: H 2Q MnQ2HO+ Q T (实 验
室制氧气原理2)
1. 镁在空气中燃烧
2. 铁在氧气中燃烧
3. 铜在空气中受热
4. 铝在空气中燃烧 2Mg+ O 点燃 2MgO 3Fe+ 2O 2 点燃 Fe a O 4 2Cu+ O 加热 2CuO 4AI +3O2■^燃 2AbQ 4P +5Q 点燃 2P 2O
、自然界中的水:
16. 水在直流电的作用下分解(研究水的组成实验):2HO通电2H2? +O T 17?生石灰溶于水英语六级作文:CaO +HO == Ca(OH)2
18. 二氧化碳可溶于水:H2O+C2==HCO
三、质量守恒定律:
19. 镁在空气中燃烧:2Mg+ O点燃2MgO
20. 铁和硫酸铜溶液反应:Fe+ CuSO=== FeSQ+ Cu
21 .氢气还原氧化铜:H +CuO加热Cu +H2O
22. 镁还原氧化铜:Mg+ CuO加热u +MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2点燃CC2
24. 木炭还原氧化铜:C + 2CuO高温2Cu+ CQ T
25. 焦炭还原氧化铁:3C + 2Fe2Q 高温4Fe + 3CO 2 T
(2)煤炉中发生的三个反应:(几个化合反应)
26. 煤炉的底层:C +Q点燃CQ
27. 煤炉的中层:CO+ C~^温2CO
28. 煤炉的上部蓝色火焰的产生:2CO +O点燃2CQ
(3)二氧化碳的制法与性质:
29. 大理石与稀盐酸反应(实验室制二氧化碳):
CaCO+ 2HCl == CaCl 2+ H2O +CO T
30. 碳酸不稳定而分解:HCO == H2O +CO T
31. 二氧化碳可溶于水:H2O +CO== H2CO
32. 高温煅烧石灰石(工业制二氧化碳):CaCO高温CaO+ CO T
33. 石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):
Ca(OH£ +CQ === CaCO J +H2O
(4)一氧化碳的性质:
34. 一氧化碳还原氧化铜:CO+ CuO加热Cu +CQ
35. 一氧化碳的可燃性:2CO +O点燃2CO
其它反应:
36. 碳酸钠与稀盐酸反应(灭火器的原理):
NaCO 2HCl == 2NaCI+ H 2O +CO T
五、燃料及其利用:
37. 甲烷在空气中燃烧:CH +2O2 魁CQ +2H2O
38. 酒精在空气中燃烧:C2H5OH +3O2点燃2CO +3出0
39. 氢气中空气中燃烧:2H+ O2 魁2H2O
六、金属
(1)金属与氧气反应:
40. 镁在空气中燃烧:2Mg+ O点燃2MgO
41. 铁在氧气中燃烧:3Fe +2O2 沁Fe3。
42. 铜在空气中受热:2Cu +Q加热2CuO
43. 铝在空气中形成氧化膜:4AI+ 3O2 = 2AI 2。
(2)金属单质酸 ------ 盐氢气(置换反应) 44. 锌和稀硫酸 Zn+ H 2SQ = ZnSO 4+ H 2 T 45. 铁和稀硫酸 Fe +H 2SO = FeSO +H 21 46. 镁和稀硫酸 Mg +HSO = MgSC 4+ H 2T 47. 铝和稀硫酸 2Al+ 3H 2SQ = Al 2(SO )3+3H 2f 48. 锌和稀盐酸 Zn+ 2HCl == ZnCl 2+ H 2T
49. 铁和稀盐酸 Fe +2HCl == FeCl 2 +H 2T 50. 镁和稀盐酸 Mg +2HCl == MgCb+ H 2T 51. 铝和稀盐酸 2Al+ 6HCl == 2AICI 3 +3H 2T
(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐 52. 铁和硫酸铜溶液反应: Fe +CuSO 4 == FeSO 4 +Cu 53. 锌和硫酸铜溶液反应: Zn +CuSO 4 ==ZnSO 4 +Cu
54. 铜和硝酸汞溶液反应: Cu +Hg (NO 3) 2 == Cu (NO 3) 2 +Hg ( 3)金属铁的治炼原理:
55. 3CO +2FeC 3 高温 4Fe +3CQ T
七、酸、碱、盐
61. 盐酸和氢氧化钙反应: 2HCl+ Ca (OH )2 == CaCl 2+2H 2O
62. 氢氧化铝药物治疗胃酸过多: 3HCl +Al (OH ) 3 == AlCl 3 +3H 2O 63. 硫酸和烧碱反应: H 2SO 4+ 2NaOH == Na 2SO 4 +2H 2O (4)酸盐 ----- 另一种酸另一种盐
64. 大理石与稀盐酸反应: CaCO 3+2HCl == CaCl 2 +H 2O+ CO 2T 65. 碳酸钠与稀盐酸反应 : Na 2CO 3 +2HCl == 2NaCl+ H 2O+ CO 2T 66. 碳酸氢钠与稀盐酸反应: NaHC 3O+HCl== NaCl+H 2O+ CO 2T 67. 硫酸和氯化钡溶液反应: fSQ +BaCl 2 == BaSO J +2HCl 2、碱的幼儿园小班音乐教案化学性质 (1)碱非金属氧化物 ------- 盐水
68. 苛性钠暴露在空气中变质: 2NaOH+C 2 O== Na 2CO 3+ H 2O 69. 苛性钠吸收二氧化硫气体: 2NaOH +S 2O== Na 2SO 3 +H 2O 70. 苛性钠吸收三氧化硫气体: 2NaOH+ S 3O== Na 2SO 4 +H 2O 71. 消石灰放在空气中变质: Ca (OH )2+ CO 2 == CaCO 3J +H 2O 72. 消石灰吸收二氧化硫: Ca (OH )2 +SO 2 == CaSO 3J + H 2O 2) 碱酸 ----- 盐水(中和反应,方程式见上) 3) 碱盐 ---- 另一种碱另一种盐
73. 氢氧化钙与碳酸钠: Ca (OH )2 +Na 2CO 3 == CaCO 3J + 2NaOH
1、酸的化学性质 (1) 酸金属 ------ (2) 酸金属氧化物 -----
氧化铁和稀盐酸反
应: 氧化铁和稀硫酸反应: 氧化铜和稀盐酸反应: 氧化铜和稀
硫酸反应: 盐
56. 57. 58. 59. 盐氢气(见上)
-- 盐水 Fe 2O 3 +6HCl ==2FeCl 3 +3H 2O Fe 2O 3 +3H2SO4 == Fe 2(SO4)3 +3H 2O
CuO +2HCl ==CuCl 2 +H2O
CuO+ H 2SO4 == CuSO 4+ H 2O
水(中和反应) (3)酸碱 ------ 60. 盐酸和烧碱起反应: HCl +NaOH == NaCl+H 2O
3、盐的化学性质
(1)盐(溶液) 金属单质——另一种金属另一种盐
74. 铁和硫酸铜溶液反应:Fe+ CuSQ== FeS04 +Cu
(2)盐酸 ----- 另一种酸另一种盐
75. 碳酸钠与稀盐酸反应:Na 2CO+2HCI == 2NaCI +H 2O+ COT
碳酸氢钠与稀盐酸反应:NaHCGHCI== NaCI+ H 2O +COT
(3)------------------ 盐碱另一种碱另一种盐
76. 氢氧化钙与碳酸钠:Ca(OH) +NaCO== CaCO j + 2NaOH
(4)盐盐----- 两种新盐
77. 氯化钠溶液和硝酸银溶液:NaCI +AgNO == AgCI J +NaNO
78. 硫酸钠和氯化钡:NaSO +BaCl2 == BaSO4; +2NaCI
其他反应类型
1、二氧化碳通入澄清石灰水中:CO+ Ca(OH)2 == CaCOj + H2O
2、氢氧化钠在空气中变质:CO+ 2NaOH = N Q CO+ H2O
3、氢氧化钠溶液吸收二氧化硫:SO + 2NaOH ==NaSO+ H2O
4、一氧化碳还原氧化铜:CO + CuO-^Cu + CO 2
5、酒精燃烧:C2H5OH + 3Q 点燃2CO 2 + 3H2O
&甲烷燃烧:CH + 2O2 -点燃O 2 + 2H2O
化学方程式反应现象应用
I. 2Mg+ O2点燃或△2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹
2. 2Hg +O2点燃或△2HgO银白液体、生成红色固体拉瓦锡实验
3. 2Cu+ O2点燃或△2CuO红色金属变为黑色固体
4. 4AI+ 3O 2点燃或△2AbQ银白金属变为白色固体
5. 3Fe+ 2O 2点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热
6. C+ O2点燃CO剧烈燃烧、白光、放热、使澄清石灰水变浑浊
7. S +O2点燃SO剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰
8. 2H Q点燃2H2O淡蓝火焰、放热、生成使无水CuSO变蓝的液体(水) 高能燃料
9. 4P +5O2点燃2P2O剧烈燃烧、大量白烟、放热、生成白色固体证明空气中
氧气含量
10. CH4+2Q点燃2HO+ CO蓝色火焰、放热、生成使石灰水变浑浊气体和使无
水CuSO变蓝的液体(水)甲烷和天然气的燃烧
II. 2C2H+ 5O2点燃2HO +4CO蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO变蓝的液体(水) 氧炔焰、焊接切割金属
12. 2KCIOMnO2 △ 2KCI +3O T生成使带火星的木条复燃的气体实验室制备氧气
13. 2KMn鱼K2MnOMnO+Q T紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气
14. 2HgO A 2Hg+ Q T红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验
15. 2H2O通电2HH T + O2 T水通电分解为氢气和氧气电解水
16. Cu 2(OH)2CO^2CuO +HO+ COT绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热
17. NMHC% NH T + H2O+ CO T白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失
18. Zn+ H 2S8ZnSO+N T有大量气泡产生、锌粒逐渐溶解实验室制备氢气
19. Fe +H 2SO=FeSO+H2 T有大量气泡产生、金属颗粒逐渐溶解
20. Mg +H2SO二MgSQ+出T有大量气泡产生、金属颗粒逐渐溶解
21.2Al+ 3H 2SQ=Al2(SO4)3+ 3H2T有大量气泡产生、金属颗粒逐渐溶解
22. Fe 2Q+3H £ 2Fe +3H2O红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原
23. Fe 3Q +4H2 £3Fe+ 4HO黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性
24. WQ +3H2 £ W +3H2O冶炼金属钨、利用氢气的还原性
25. MoO a +3H? £ Mo +3HO冶炼金属钼、利用氢气的还原性
26. 2Na+ Cl 2△殳点燃2NaCI剧烈燃烧、黄色火焰离子化合物的形成、
27. H 2 +CI 2点燃或光照2HCI点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸
28. CuSQ +2NaOH二Cu(OH) + Na z SQ蓝色沉淀生成、上部为澄清溶液质量守恒定律实验
29. 2C +O2点燃2CO煤炉中常见反应、空气污染物之一、煤气中毒原因
30. 2CO +O2点燃2CO蓝色火焰煤气燃烧
31. C+ CuO高温2Cu+ CO T黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属
32. 2Fe 2Q+ 3C 高温4Fe+ 3CQ T 冶炼金属
33. Fe aQ +2C高温3Fe+ 2CO T冶炼金属
34. C+ CO2 高温2CO
35. CO2+ HO = H2CO碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文
36. H 2CO £CO T + H2O石蕊红色褪去
37. Ca(OH) 2 +CO= CaCOj + H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁
38. CaCQ +HQ+ CO二Ca(HCQ)2白色沉淀逐渐溶解溶洞的形成,石头的风化
39. Ca(HCQ) 2£ CaCO J + H2O +COT白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成
40. 2NaHCQ£ N&CO+ H2O +CO T产生使澄清石灰水变浑浊的气体小苏打蒸馒头—
41. CaCQ高温CaO +COT工业制备二氧化碳和生石灰
42. CaCQ +2HCI=CaC2+ H2O +COT固体逐渐溶解、有使澄清石灰水变浑浊的气
体实验室制备二氧化碳、除水垢
