天津大学化工学院硕士研究生培养方案范本

天津大学化工学院硕士研究生培养方
案
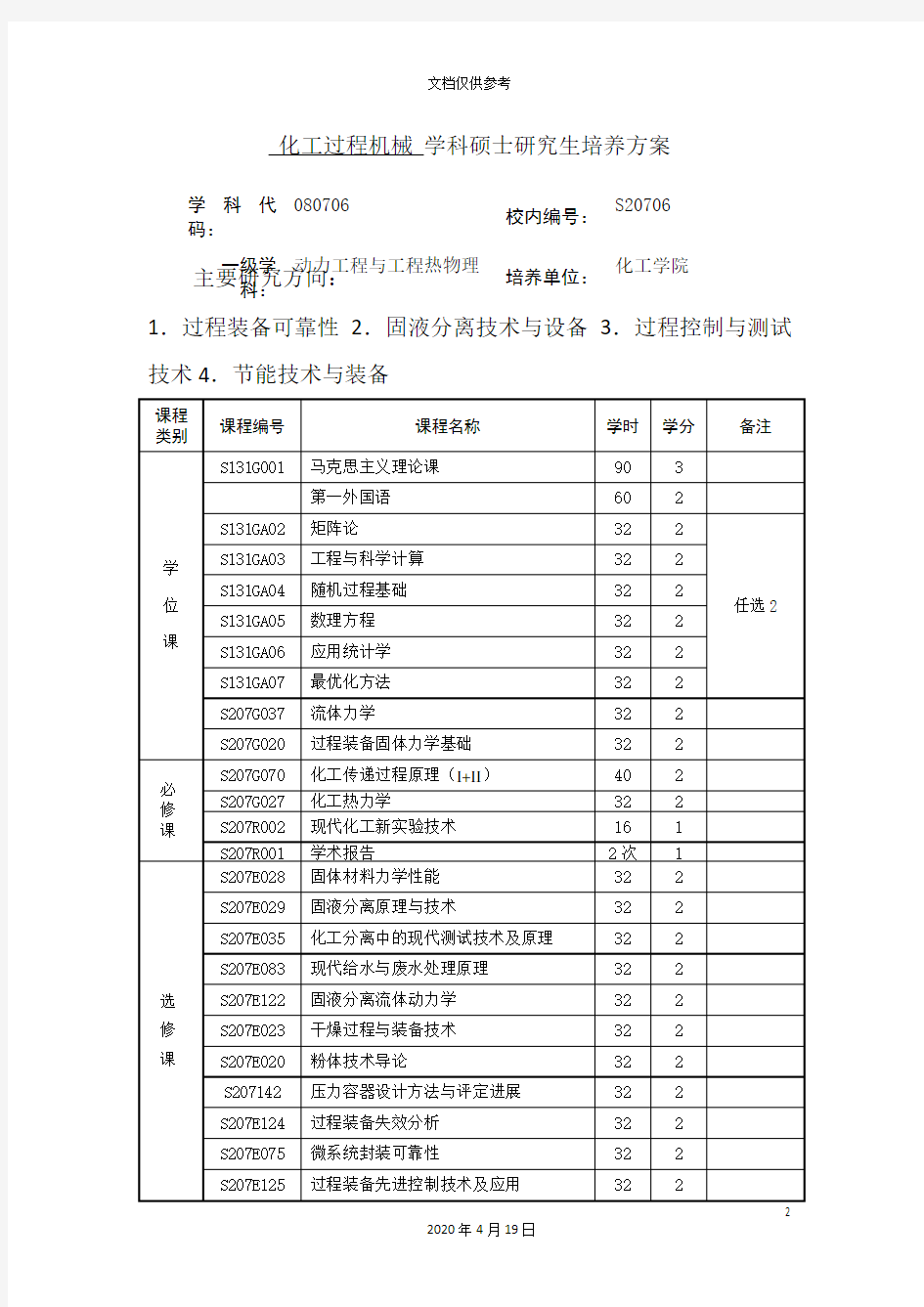
化工过程机械学科硕士研究生培养方案
学科代码:080706
校内编号:
S20706
一级学科:动力工程与工程热物理
培养单位:
化工学院
主要研究方向:
1.过程装备可靠性2.固液分离技术与设备3.过程控制与测试技术4.节能技术与装备
化学工程 学科硕士研究生培养方案
主要研究方向:
1.界面传质理论与精馏技术2. 工业结晶及粒子科学与技术 3. 膜过程与环境化工4. 新能源化工与资源高效利用技术5. 酶催化与反应工程
学科代码:
081701 校内编号: S20701 一级学化学工程与技术 培养单位:
化工学院
化学工艺 学科硕士研究生培养方案
3.生物质能源与生物质的化学加工
课学科代码:
081702 校内编号:
S20702
一级学科: 化学工程与技术 培养单位:
化工学院
主要研究方向:1.一碳化学与化工2.功能化学品及新材料
的绿色合成
生物化工 学科硕士研究生培养方案
学科代码:
081703
校内编号: S20703 一级学科: 化学工程与技术 培养单位:
化工学院
主要研究方向:
1.生物信息学2.生物分离工程3.生物反应与代谢工程4.生物制药工程
天大无机化学第四版 思考题和习题答案要点
第八章配位化合物 思考题 1. 以下配合物中心离子的配位数为6,假定它们的浓度均为0.001mol·L-1,指出溶液导电能力的顺序,并把配离子写在方括号内。 (1) Pt(NH3)6C14(2) Cr(NH3)4Cl3(3) Co(NH3)6Cl3 (4) K2PtCl6 解:溶液导电能力从大到小的顺序为[Pt(NH3)6]C14>[Co(NH3)]6Cl3>K2[PtCl6]> [Cr(NH3)4Cl2]Cl 2. PtCl4和氨水反应,生成化合物的化学式为Pt(NH3)4Cl4。将1mol此化合物用AgN03处理,得到2molAgCl。试推断配合物内界和外界的组分,并写出其结构式。 解:内界为:[PtCl2(NH3)4]2+、外界为:2Cl-、 [PtCl2(NH3)4]Cl2 3.下列说法哪些不正确? 说明理由。 (1) 配合物由内界和外界两部分组成。不正确,有的配合物不存在外界。 (2) 只有金属离子才能作为配合物的形成体。不正确,有少数非金属的高氧化态离子也可以作形成体、中性的原子
也可以成为形成体。 (3) 配位体的数目就是形成体的配位数。不正确,在多齿配位体中配位体的数目不等于配位数。 (4) 配离子的电荷数等于中心离子的电荷数。 不正确,配离子电荷是形成体和配体电荷的代数和。(5) 配离子的几何构型取决于中心离子所采用的杂化轨道类型。正确 4.实验测得下列配合物的磁矩数据(B.M.)如下: 试判断它们的几何构型,并指出哪个属于内轨型、哪个属于外轨型配合物。 5.下列配离子中哪个磁矩最大? [Fe(CN)6]3-[Fe(CN)6]4-[Co(CN)6]3-[Ni(CN)4]2-[Mn(CN)6]3-
2015年天津大学无机化学期中试卷
无机化学期中试卷 2015.11.17 班级 姓名 学号 分数 一、 选择题 ( 共10题 20分 ) 1. 2 分 (3778) 3778 对于一个氧化还原反应,下列各组中所表示的 m r G ?, E 和K 的关系应 是…………………………………………………………………………………………… ( ) (A) m r G ?>0; E <0;K <1 (B) m r G ?>0; E >0;K >1 (C) m r G ?<0; E <0;K >1 (D) m r G ?<0; E >0;K <1 2. 2 分 (0438) 0438 关于熵,下列叙述中正确的是…………………………………………………………( ) (A) 298K 时,纯物质的 m S = 0 (B) 一切单质的 m S = 0 (C) 对孤立体系而言, m r S ?> 0的反应总是自发进行的 (D) 在一个反应过程中,随着生成物的增加,熵变增大 3. 2 分 (3515)
25℃,2NO 2(g)N 2O 4(g),K c 与K p ( K )的比值( p = 100 kPa )K c /K p 等于… ( ) (A) 298 0831.01 ?= 0.0404 (B) 8.31 ? 25 = 207.8 (C) 0.0831 ? 298 = 24.8 (D) 0.0821 ? 298 = 24.5 4. 2 分 (3871) 3871 HI 的生成反应的焓变为负值,HI 的分解反应的焓变为正值,则HI 分解反应的活化能 E a ……………………………………………………………………………………………( ) (A) E a <ΔH 分解 (B) E a >ΔH 分解 (C) E a = 0 (D) E a =ΔH 分解 5. 2 分 (6709) 6709 常用的三种甘汞电极,即 (1) 饱和甘汞电极 (2) 摩尔甘汞电极 (3) 0.1 mol ·dm -3 甘汞电极 其电极反应为:Hg 2Cl 2(s) + 2e - = 2Hg(l) + 2Cl - (aq),在25℃ 时三种甘汞电极的 ?的大小次序为………………………………………………………………………………… ( ) (A) 1?> 2?> 3? (B) 2?> 1?> 3? (C) 3?> 2?> 1? (D) 1?= 2?= 3? 6. 2 分 (0436)
无机化学(天大版)复习资料
第六章分子的结构和性质 6.1 键参数 6.2 价键理论 目的要求: 1.了解键能、键长、键角等键参数; 2.掌握价键理论; 3.掌握共价键的特点、类型; 4.了解离子键的特点。 重点、难点: 掌握价键理论;掌握共价键的特点和类型。 作业: 1. P193 2(1)、(2) 2. P195 4 教学内容: 6.1 键参数 一、键能 1.键参数的含义: 能表征化学键性质的量称为键参数。主要有键能、键长、键角等。 2.键能: (1)含义: 近似为气体分子每断裂单位物质的量的某键(6.022×1023个化学键)时的焓变。(2)意义: 双原子分子:键能等于键解离能(D) 多原子分子:键能等于同种键逐级解离能的平均值。 二、键长 1.含义 分子内成键两原子核间的平衡距离,用L b表示。可用分子光谱或X射线衍射方法测得。 2.决定因素:
(1)内因: 成键原子的本性 (2)外因: 相同原子形成不同类型化学键时具有不同的键长 3.意义: 相同原子形成不同化学键时,键长越短,键能越大,键越稳定。 三、键角 1.含义: 在分子中两个相邻化学键之间的夹角。可用分子光谱和X射线衍射实验测得。2.意义: 根据分子内全部化学键的键长和键角数据,可确定分子的几何构型。 6.2 价键理论 一、共价键 1.共价键的形成 原子间由于成键电子的原子轨道重叠而形成的化学键。 2 (1)理论基础 以相邻原子间电子相互配对为基础。 (2)理论要点 A.组成分子的两个原子必须具有未成对的电子,且它们的自旋反平行,即原子中的1个未成对电子只有以自旋状态反平行的形式与另一个原子中的1 B 条件。即自旋方向相反的未成对电子相互接近时,必须考虑其波函数的正、负号,只有同号轨道(对称性匹配)才能实行有效的重叠 C.原子轨道重叠时,总是沿着重叠最大的方向进行,重叠部分越大,共价键越牢固,这就是原子轨道的最大重叠条件。除s轨道外,其它轨道都有一定的空间取向, 3.共价键的类型 (1)按照键的极性分:
工厂供电课程设计
本科课程设计题目: 院(系)信息科学与工程学院 专业电气工程及其自动化 届别 学号 姓名 指导老师 华侨大学教务处印制 2013年4月21号
目录 第1章概述....................................................................................................错误!未定义书签。第2章负荷计算与负荷等级确定...........................................................................错误!未定义书签。第3章变压器选择及主接线设计...........................................................................错误!未定义书签。第4章短路电流计算 . (10) 第5章电气设备选择 (17) 第6章课设体会及总结 (20) 参考文献 (21) 附录 (22)
第1章概述 通过这个供配电系统的设计,能对工厂供电的知识有一个系统的认识和更深入的了解,对书中的很多理论知识能更深入了解,能将书中的知识都系统化。本次课程设计是对南阳防爆厂降压变电所的电气设计,设计的主要内容包括: (1)负荷计算与负荷等级确定; (2)变压器选择与主接线设计; (3)短路电流计算; (4)电气设备选择; 后有此次课程设计的体会及总结和参考文献. 由于设计者知识掌握的深度和广度有限,很多知识都只能参考网上知识,所以本设计尚有不完善的地方,敬请老师批评指正! 设计任务如下: (一)设计题目 南阳防爆厂降压变电所的电气设计 (二)设计要求 要求根据本厂所能取得的电源及本厂用电负荷的实际情况,并适当考虑到工厂生产的发展,按照安全可靠、技术先进、经济合理的要求,确定变电所的位置与型式,确定变电所主变压器的台数与容量、类型,选择变电所主结线方案及高低压设备和进出线,确定一次回路方案,最后定出设计说明书。 (三)设计依据 1.工厂总平面图,如图(1)所示。 2.工厂负荷情况:本厂多数车间为两班制,年最大负荷利用小时为4000h,日最大负荷持续时间为10h。该厂除铸造车间、锻压车间和锅炉房属二级负荷外,其余均属三级负荷。低压动力设备均为三相,额定电压为380V。照明及家用电器均为单相,额定电压为220V。本厂的负荷统计资料如表(1)所示。 3.供电电源情况:按照工厂与当地供电部门签订的供用协议规定,本厂可由附近一条35kV的公用电源干线取得工作电源。该干线的走向参看工厂总平面图。该干线的导线牌号为LGJ—120导线为等边三角形排列,线距为1m;干线首端(即电力系统的馈电变电电站)距离本厂约20km,该干线首端所装高压断路器300MV A,此断路器配备有定时限过电流保护和电流速断保护,其定时限过电流保护整定的动作时间为1.5s。为满足工厂二级负荷的要求,可采用联络线由邻近的单位取得备用电源。已知与本厂高压侧有电气联系的架空线路总长度达100km,电缆线路总长度达80km。 4.气象资料本厂所在地区的年最高气温为37 ℃,年平均气温为24℃,年最低气温为-8℃,年最热月平均最高气温为33℃,年最热月平均气温为26℃,年最热月地下0.8处平均温度为25℃。当地主导风向为东北风,年雷暴是数为20。 5.工厂最大负荷时的功率因数不得低于0.92。 主要参考资料 1 刘介才主编供配电技术北京:机械工业出版社 2 张华主编电类专业毕业设计指导北京:机械工业出版社 3 王荣藩编著工厂供电设计与指导天津:天津大学出版社
天津大学无机化学教研室《无机化学》复习全书(分子的结构与性质)
第6章分子的结构与性质 6.1 复习笔记 一、键参数 1.键能 (1)定义 键能是指气体分子每断裂单位物质的量的某键(6.022×1023个化学键)时的焓变。(2)特性 ①键能可作为衡量化学键牢固程度的键参数,键能越大,键越牢固; ②对双原子分子,键能在数值上等于键解离能(D); ③多原子分子中若某键不止一个,则该键键能为同种键逐级解离能的平均值; ④可通过光谱实验测定键解离能以确定键能,还可利用生成焓计算键能。 2.键长(L b) (1)定义 键长是指分子内成键两原子核间的平衡距离。一些双原子分子的键长如表6-1所示: 表6-1 一些双原子分子的键长
(2)特性 ①一个键的性质主要取决于成键原子的本性; ②两个确定的原子之间,如果形成不同的化学键,其键长越短,键能就越大,键就越牢固。 ③键长可以用分子光谱或X射线衍射方法测得。 3.键角 (1)定义 键角是指在分子中两个相邻化学键之间的夹角。 (2)特性 ①键角可以用分子光谱或X射线衍射法测得; ②可以通过分子内全部化学键的键长和键角数据来确定这个分子的几何构型。 二、价键理论 1.共价键 (1)共价键的形成 共价键是指原子间由于成键电子的原子轨道重叠而形成的化学键。 (2)价键理论要点 ①两原子接近时,自旋方向相反的未成对的价电子可以配对,形成共价键; ②成键电子的原子轨道如能重叠越多,则所形成的共价键就越牢固(最大重叠原理)。 (3)共价键的特征 ①共价键具有饱和性; ②共价键具有方向性。
(4)原子轨道的重叠 ①两个原子轨道以对称性相同的部分相重叠(正重叠) 图6-1所示为原子轨道几种正重叠的示意图。 (a)s-s (b)p x-s (c)p y-p y(d)d xy-p y 图6-1 原子轨道几种正重叠示意图 ②两个原子轨道以对称性不同部分相重叠(负重叠) 图6-2所示为原子轨道几种负重叠的示意图。 (a)p x-p y(b)p x-s (c)p y-p y(d)p x-d xy 图6-2 原子轨道几种负重叠示意图 (5)共价键的类型 ①按是否有极性来分类: ②按原子轨道重叠部分的对称性来分类: a.键 若原子轨道的重叠部分,对键轴(两原子的核间连线)具有圆柱形对称性,所形成的键称为键。图6-3给出了几种不同组合形成的键示意图。
天津大学无机化学第一章__思考题
第一章思考题 1.一气柜如下图所示: A 假设隔板(A)两侧N2和CO2的T, P相同。试问: (1)隔板两边气体的质量是否相等? 浓度是否相等?物质的量不等而浓度相等 (2)抽掉隔板(假设不影响气体的体积和气柜的密闭性)后,气柜内的T和P 会改变?N2、CO2物质的量和浓度是否会改变?T和P 会不变,N2、CO2物质的量不变而浓度会改变 2.标准状况与标准态有何不同? 标准状况指气体在27.315K和101325Pa下的理想气体,标准态是在标准压力下(100kPa)的纯气体、纯液体或纯固体 3.化学反应方程式的系数与化学计量数有何不同?对某一化学反应方程式来说,化学反应方程式的系数和化学计量数的绝对值相同,但化学反应方程式的系数为正值,而反应物的化学计量数为负值,生成物的化学计量数为正值 4.热力学能、热量、温度三者概念是否相同? 试说明之。 5.试用实例说明热和功都不是状态函数。
6.判断下列各说法是否正确: (1)热的物体比冷的物体含有更多的热量。× (2)甲物体的温度比乙物体高,表明甲物体的热力学能比乙物体大。× (3)物体的温度越高,则所含热量越多。× (4)热是一种传递中的能量。√ (5)同一体系: (a)同一状态可能有多个热力学能值。× (b)不同状态可能有相同的热力学能值。√ 7.判断下列各过程中,那个ΔU最大: (1)体系放出了60kJ热,并对环境做了40kJ功。 (2)体系吸收了60kJ热,环境对体系做了40kJ功。√ (3)体系吸收了40kJ热,并对环境做了60kJ功。 (4)体系放出了40kJ热,环境对体系做了60kJ功。 根据ΔU=Q+W, (1) ΔU=-60+(-40)=-100KJ (2) ΔU=+60+40=+100KJ ,(3) ΔU=+40+(-60)=-20KJ (4) ΔU=-40+60=+20KJ因此通过计算可以看出,(2)过程的ΔU最大. 8.下列各说法是否正确: (1)体系的焓等于恒压反应热。× (2)体系的焓等于体系的热量。× (3)体系的焓变等于恒压反应热。√
基于RBF网络的混沌动力系统辨识
基于RBF 网络的混沌动力系统辨识 X 李冬梅,王正欧 (天津大学系统工程研究所,天津300072) 摘 要:提出用RBF 神经网络对混沌动力系统进行辨识,设计了一个三层RBF 网络结构,仿 真实验说明了RBF 网络用于学习混沌动力系统时的基本性质.用辨识模型重建吸引子方法定性地评价辨识模型,通过计算辨识模型的L yapuno v 指数定量地评价辨识模型的性能,同时推导了R BF 网络模型L yapunov 指数的计算公式.仿真结果表明,该辨识模型能很好地逼近原混沌动力系统,准确地体现原混沌系统的动力学特性.关键词:混沌系统辨识;R BF 神经网络;混沌动力系统 中图分类号:T P 183 文献标识码:A 文章编号:0493-2137(2002)02-0191-05 混沌是自然界与人类社会普遍存在的运动形态, 其本质是系统对初值有着敏感的依赖性,由此导致了混沌系统只具备短期可预测性,而系统的长期行为是不可预测的.对于混沌系统的研究现已成为动力系统研究的中心内容之一.研究混沌系统,首先要对其进行辨识,得到辨识模型,然后才能把握系统的动力学特性和变化规律,进行预测、控制或同步等方面的研究.对混沌系统的辨识效果直接影响着各项研究的有效性和准确程度,因此混沌系统的辨识在混沌系统的研究中占有举足轻重的地位,是混沌系统研究的基础. 人工神经网络具有自学习、自组织和逼近任意非线性映射的能力,因此,神经网络技术已开始应用于混沌系统的辨识研究中.文献[1~5]探讨了BP 网络在混沌系统辨识中的应用问题.用BP 网络进行混沌系统的辨识,辨识精度较低,收敛速度很慢,运行时间相对较长. 本文采用径向基函数神经网络(RBF 网络)对混沌系统进行辨识.RBF 网络具有良好的逼近任意非线性映射和处理系统内在难以解析表达的规律性的能力,并且具有极快的学习收敛速度.作者探讨了RBF 网络用于混沌系统辨识时的基本性质,采用定性和定量两类方法来评价辨识模型,实验结果表明,此方法辨识精度高,收敛速度极快,运行时间很短,辨识模型能准确地逼近原混沌系统,辨识效果远远优于用BP 网络所得到的模型. 1 待辨识的混沌动力系统 本文重点研究了以下两种离散动力系统的辨识问题,分别用这两种系统产生的数据训练RBF 网络. 1)H non m ap x (t +1)=y (t )+1-ax 2(t ) (1) y (t +1)=bx (t )(2)当参数a = 1.4,b =0.3时,H no n 系统将处于混沌状态,其奇怪吸引子如图1所示.本文假设x 和y 都是可观测的 . 图1 H non 系统的奇怪吸引子Fig .1 Strange attractor of H non system 天津大学学报 第35卷 第2期2002年3月 JO U RN A L OF T IA N JIN U N IV ER SIT Y V ol.35 N o.2 M ar. 2002 X 收稿日期:2001-12-20. 作者简介:李冬梅(1963- ),女,博士生.
最新-天津大学无机化学第五版习题答案 精品
第1章 化学反应中的质量关系和能量关系 习题参考答案 1.解:1.00吨氨气可制取2.47吨硝酸。 2.解:氯气质量为2.9×103 g 。 3.解:一瓶氧气可用天数 33111-1 222()(13.210-1.0110)kPa 32L 9.6d 101.325kPa 400L d n p p V -???= ==?? 4.解:pV MpV T nR mR = = = 318 K 44.9=℃ 5.解:根据道尔顿分压定律 i i n p p n = p (N 2) = 7.6?104 Pa p (O 2) = 2.0?104 Pa p (Ar) =1?103 Pa 6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ? (2)222(N )(O )(CO )p p p p =--43.7910Pa =? (3) 4224(O )(CO ) 2.6710Pa 0.2869.3310Pa n p n p ?===? 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) = pVM RT = 0.194 g 8.解:(1)ξ = 5.0 mol (2)ξ = 2.5 mol 结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。 9.解:?U = Q p - p ?V = 0.771 kJ 10.解: (1)V 1 = 38.3?10-3 m 3 = 38.3L (2) T 2 = nR pV 2 = 320 K (3)-W = - (-p ?V ) = -502 J (4) ?U = Q + W = -758 J (5) ?H = Q p = -1260 J 11.解:NH 3(g) + 45O 2(g) 298.15K ????→标准态 NO(g) + 2 3H 2O(g) m r H ?= - 226.2 kJ ·mol -1 12.解:m r H ?= Q p = -89.5 kJ m r U ?= m r H ?- ?nRT = -96.9 kJ 13.解:(1)C (s) + O 2 (g) → CO 2 (g)
大学无机化学期末考试(天津大学第四版)归纳.doc
第一章 化学反应中的质量和能量关系 重要概念 1.系统:客观世界是有多种物质构成的,但我们可能只研究其中一种或若干物质。人为地将一部分物质与其他物质分开,被划分的研究对象称为系统。 2.相:系统中具有相同物理性质和化学性质的均匀部分称为相。 3.状态:是指用来描述系统的诸如压力P 、体积V 、温度T 、质量m 和组成等各种宏观性质的综合表现。 4.状态函数:用来描述系统状态的物理量称为状态函数。 5.广度性质:具有加和性,如体积,热容,质量,熵,焓和热力学能等。 6.强度性质:不具有加和性,仅决定于系统本身的性质。如温度与压力,密度等。 系统的某种广度性质除以物质的量或者质量之后就成为强度性质。强度性质不必指定物质的量就可以确定。 7.热力学可逆过程:系统经过某种过程由状态1到状态2之后,当系统沿着该过程的逆过程回到原来状态时,若原来的过程对环境产生的一切影响同时被消除(即环境也同时复原),这种理想化的过程称为热力学的可逆过程。 8.实际过程都是不可逆的,可逆过程是一种理想过程。 9.化学计量数:0=∑B VB B表示反应中物质的化学式,VB是B 的化学计量数, 量纲为一;对反应物取负值,生成物取正值。 10.化学计量数只表示当安计量反应式反应时各物质转化的比例数,并不是各反应物质在反应过程中世界所转化的量。 11.反应进度ξ:b b v /n ?=?ξ 对于化学反应来讲,一般选未反应时,0=ξ 引入反应进度这个量最大的优点是在反应进行到任意时刻时,可用任一反应物或产物来表示反反应进行的程度,所得的值总是相等的。 12.习惯对不注明温度和压力的反应,皆指反应是在298.15K ,100kPa 下进行的。 13.一般没有特别的注明,实测的反应热(精确)均指定容反应热,而反应热均指定压反应热。 14.能量守恒定律:在任何过程中,能量不会自生自灭,只能从一种形式转化为另一种形式,在转化过程中能量的总值不变。也叫做热力学第一定律。ΔU=Q+W 15.热力学能具有状态函数的特点:状态一定,其值一定。殊途同归,值变相等。周而复始,值变为零。 16.系统与环境之间由于存在温差而交换的热量称为热。若系统吸热值为正,若系统放热值为负。 17.系统与环境之间除了热以外其他形式传递的能量都称为功。系统得功为正,系统做功为负。在一定条件下由于系统体积的变化而与环境交换的功称为体积功?-=pdV W ,除体积功以外的一切功称为非体积功如电功。 18.功和热都是过程中被传递的能量,它们都不是状态函数,其数值与途径有关。而热力学第一定律中的热力学能的改变量只有过程的始态和终态决定,而与过程的具体途径无关。 19.化学反应热是指等温过程热,即当系统发生了变化后,使反应产物的温度回到反应前始态的温度,系统放出或吸收的热量。
天津大学检测技术与自动化装置专业考研
天津大学检测技术与自动化装置专业考 研 一、研究方向及硕士指导教师 本学科分别于1996、198年经国务院学位委员会批准为博士、硕士学位授予单位。主要研究方向为: (1)在线检测技术及系统; (2)两相流/多相流在线检测技术; (3)传感技术及信息处理; (4)计算机过程控制系统及工程应用。 该硕士点现有博士点导师3名,硕士生导师8名,教授4名,副教授4名。获博士和硕士学位的青年教师10名,工程技术人员4名。 二、专业特点 本专业主要培养过程参数检测与控制系统以及智能化测控装置的科研人员及高等学校师资。 三、科研状况 本专业教学科研设备齐全,共分为4个实验室: (一)流量实验室:主要设备有大型水塔,可进行水流量标定实验;小风洞实验室,进行气体流量实验研究; (二)过程控制系统实验室:过程参数计算机控制系统(温度、流量、液注),集教控制系统(DCS)以及局域网仿真模拟研究; (三)传感技术及信息处理实验室:可进行多种过程参数检测,信号分析并可通过计算机构成多种参数的测控系统; (四)两相流、三相流检测实验室:可进行气/液两相流及油/气/水三相流的流型识别、分相含率及体积(质量)实验研究和理论研究。
自1990年以来,鉴定完成国家科技攻关、国家自然科学基金、国际科学合作等项目10项,各部委及其它项目46项,获国家教委科技进步奖7项,其它奖5项,获国家专利9项。科研成果转化为产品的8项。已发表论文200余篇。该学科于2001年批准为国家重点学科。已聘任1名长江学者,3名客座教授,并准备对两相流/多项流实验室及传感技术及信息处理实验室进行重点投资建设,发展学科优势。 四、近几年报考简况 该硕士点每年计划招生15~20名,报考人数与招生数平均为3:1左右。 五、硕士期间主要课程及论文要求 研究生阶段主要课程分为学位课及选修课,其中学位课主要包括:应用数学基础;计算机技术及应用基础;线性控制理论;随机过程及系统辨识;检测系统设计基础。 选修课:模糊理论及应用;自适应控制系统;电磁场理论;检测技术及信息处理;计算机过程控制系统;现代信号与信息处理。 论文要求:论文阶段主要结合实际项目进行研究,论文不仅应具有一定理论水平,而且应突出应用理论解决实际问题的方法及技术,综合反映分析和解决实际问题能力。 六、就业方向 ①石油、化工、冶金、电力等过程检测控制系统 ②计算机网络与通讯 ③楼宇自动化 ④高校师资。 小提示:目前本科生就业市场竞争激烈,就业主体是研究生,在如今考研竞争日渐激烈的情况下,我们想要不在考研大军中变成分母,我们需要:早开始+好计划+正确的复习思路+好的辅导班(如果经济条件允许的情况下)。2017考研开始准备复习啦,早起的鸟儿有虫吃,一分耕耘一分收获。加油!
天津大学化工学院10届毕业生就业单位
专业单位名称 化学工程(硕) 录取天津大学博士 化学工程(硕) 中国石油天然气管道工程有限公司天津分公司化学工程(硕) 河北省冶金研究所 化学工程(硕) 上海医药工业研究院 化学工程(硕) 中国科学院深圳先进技术研究院 化学工程(硕) 中国石化集团南京工程有限公司 化学工程(硕) 录取天津大学博士 化学工程(硕) 上海市对外服务有限公司 化学工程(硕) 录取天津大学博士 化学工程(硕) 聊城东昌完全中学 化学工程(硕) 南京金凌石化工程设计有限公司 化学工程(硕) 中国石油化工股份有限公司镇海炼化分公司化学工程(硕) 北京燕山石油化工有限公司 化学工程(硕) 中国核电工程有限公司 化学工程(硕) 河北省石油化工设计院有限公司 化学工程(硕) 天津渤海化工集团公司 化学工程(硕) 浙江新和成股份有限公司 化学工程(硕) 中国瑞林工程技术有限公司 化学工程(硕) 中国核电工程有限公司 化学工程(硕) 中国寰球工程公司 化学工程(硕) 上海兖矿能源科技研发有限公司 化学工程(硕) 天津匡宝天辰能源设备技术咨询服务有限公司化学工程(硕) 录取天津大学博士 化学工程(硕) 山东三维石化工程股份有限公司 化学工程(硕) 上海医药工业研究院 化学工程(硕) 南京炼油厂有限责任公司 化学工程(硕) 录取天津大学博士 化学工程(硕) 天津市教育委员会(选调生) 化学工程(硕) 天津天大凯泰化工科技有限公司 化学工程(硕) 湖南中创化工股份有限公司 化学工程(硕) 录取天津大学博士 化学工程(硕) 录取天津大学博士 化学工程(硕) 上海工程化学设计院有限公司 化学工程(硕) 河北省石油化工设计院有限公司 化学工程(硕) 天津亦龙正嘉科技发展有限公司 化学工程(硕) 东华工程科技股份有限公司 化学工程(硕) 录取天津大学博士 化学工程(硕) 烟台万华聚氨酯股份有限公司 化学工程(硕) 录取天津大学博士 化学工程(硕) 录取天津大学博士 化学工程(硕) 中国石化集团洛阳石油化工工程公司 化学工程(硕) 录取天津大学博士 化学工程(硕) 吉林设计院
天津大学无机化学考试试卷(上册) 答案
天津大学无机化学考试试卷(上册)答案 一、填表题(20分) 1. (g) 2CO2 (g) (?r H m<0),在密闭容器中达到平衡: 2. 反应2CO (g) + O 3. 4. 5. 在0.1mol?L-1NH3?H2O中加入下列物质,写出NH3?H2O的解离度α和pH值变化趋势 二、填空题(20分) 1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、 不变、不变。 2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶 体的硬度大;I2晶体比NaI晶体在水中的溶解度小。 3. 健康人血液的pH值为7.35~7.45。患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为正常状态的28~35 倍。 4. 已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2pzσ*2px,则B2的分子轨道分布式为
(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。 5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最 强的是 PbO 2 ,还原性最强的是 Sn 2+ 。 6. 表示θm r H ?=θ m f H ?(AgBr, s)的反应式为 Ag(s) + 1/2 Br 2(l) → AgBr(s) 。 7. 用电对MnO 4-/Mn 2+,Cl 2/Cl -组成的原电池,其正极反应为 MnO 4- + 8H + + 5e → Mn 2+ + 4H 2O ,负极反 应为 2 Cl - -2 e → Cl 2 ,电池的电动势等于0.15V ,电池符号为(-)Pt,Cl 2(p θ)|Cl -‖MnO 4-,Mn 2+,H +|Pt(+)。(E θ4;E θ(Cl 2/Cl -)=1.36V ) 8. 下列各溶液浓度均为0.1 mol ?L -1,按pH 值从小到大顺序排列NH 4NO 3, NH 4F, NH 4OAc, KCN, Na 2CO 3。 KCN, NH 4F, NH 4OAc, NH 4NO 3, Na 2CO 3。 (已知K θ(NH 3?H 2O)=1.8×10-5, K θ(HF)=6.6×10-4, K θ(HCN)=6.2×10-10, K θ(HOAc)=1.8×10-5, θ1K (H 2CO 3)=4.4×10-7, θ2K (H 2CO 3)=4.8×10-11) 9. 已知V E A /θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则E θ(Cr 2O 72- / Cr 2+)= 0.917 V ,Cr 2+能否发生歧化反应 不能 。 10. 已知氨水溶液中,c(OH -)=2.4×10-3 mol ?L -1, 则此氨水的浓度为0.32 mol ?L -1。(K θ(NH 3?H 2O)=1.8×10-5) 11. 因为SnCl 2强烈水解,在配制其溶液时应加入HCl ,水解反应式为 SnCl 2+H 2O Sn(OH)Cl+HCl 。 12. K θ、θi K 、Δχ分别用来衡量 反应限度的大小、 电解质强弱 、 键的极性 。 13. HF 的沸点比HI 高,主要是由于 HF 中存在氢键 。 14. 物质NaCl 、MgO 、Na 2O 、KCl 的熔点由低到高的顺序是KCl 、NaCl 、Na 2O 、MgO 。 15. 在元素周期表中,同一主族自上而下,元素第一电离能的变化趋势是逐渐 减小 ,因而其金属性依次 增强 ;在同一周期中自左向右,元素的第一电离能的变化趋势是逐渐 增大 ,元素的金属性逐渐 减弱 。 三、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×) (10分) 1. 乙烷裂解生成乙烯:C 2H 6 (g) C 2H 4 (g) + H 2 (g) 。在实际生产中常在恒温恒压下采用加入过 量水蒸汽的方法来提高乙烯的产率,这是因为随着水蒸汽的加入,同时以相同倍数降低了p (C 2H 6)、 p (C 2H 4)、p (H 2),使平衡向右移动。………………………………………………………………………( √ ) 2. 波函数ψ表明微观粒子运动的波动性,其数值可大于零,也可小于零,2 ψ表示电子在原子核外空间出现的几率密度。…………………………………………………………………………………….…..(√ ) 3. 因为I - 的极化率大于Cl -,所以θsp K (AgI) <θsp K (AgCl)。 ……………………………………………( √ ) 4. 在298K 时,最稳定纯态单质的θ θθm m f m f S G H ,,??均为零。…………………………………….. ( × ) 5. Δr G m 代数值越小,K θ就越大,反应进行得越完全。……………………………………..…………….. ( × ) 6. 在相同温度下,纯水或0.1 mol ?L -1HCl 或0.1 mol ?L -1NaOH 溶液中,水的离子积都相同。………. ( √ ) 7. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快。…………………. ( × ) 8. 当溶液中含有多种离子均可与沉淀剂发生沉淀反应时,溶度积小的对应离子一定先沉淀。……. ( × ) 9. 溶度积规则适用于任何难溶电解质,质量作用定律只适用于基元反应。………………………. ( √ ) 10. 偶极矩可衡量分子极性大小,极化率可衡量分子变形性大小,晶格能可衡量离子晶体的稳定性。( √ )
工厂供电第9章
第9章电气安全、防雷与接地 本章首先介绍过电压和雷电的有关概念以及防雷设备和防雷措施,然后介绍接地的有关概念及电气装置的接地和接地电阻,然后讲述接地装置的装设、计算以及低压配电系统的接地故障保护和等电位联接,最后讲述电气安全和触电急救的有关知识。
第9章电气安全、防雷与接地 ?9.1 过电压与防雷 ?9.2 电气设备的接地 ?9.3 电气安全与触电急救
9.1 过电压与防雷 过电压是指在电气线路或电气设备上出现的超过正常工作要求的电压。可分为外部过电压(大气过电压)和内部过电压两大类。 9.1.1 过电压及雷电的有关概念 1、大气过电压 大气过电压是由于电力系统内的设备或建筑物遭受来自大气中的雷击或雷电感应而引起的过电压。雷电过电压产生的雷电冲击波,其电压幅值可高达1亿伏,其电流幅值可高达几十万安,供电系统的危害极大。 (1)雷电的形成 雷电是带有电荷的“雷云”之间或雷云对大地之间产生急剧放电的一种自 然现象。据观测,在地面上产生雷击的雷云多为负雷云。 当空中的雷云靠近大地时,雷云与大地之间形成一个很大的雷电场。由于静电感应作用,使地面出现雷云的电荷极性相反的电荷。当两者在某一方位的电 场强度达到25~30kV/cm时,雷云就会开始向这一方位放电,形成一个导电的空气通道,称为雷电先导。先导相通道中的正、负电荷强烈吸引中和而产生强 大的雷电流,并伴有强烈的雷鸣电闪。这就是直击雷的主放电阶段,时间一般 约50~100μs。
(2)直接雷击 雷电直接击中电气设备或线路,其过电压引起强大的雷电流通过这些物体 放电入地,产生破坏性极大的热效应和机械效应,还有电磁脉冲和闪络放电。 (3)间接雷击 雷电未直接击中电力系统中的任何部分而是由雷对设备、线或其他物体的 静电感应所产生的过电压。 (4)雷电波侵入 雷电过电压还有一种是由于架空线路或金属管道遭受直接或间接雷击而引 起的过电压波,沿线路或管道侵入变配电所,这称为雷电波侵入或高电位侵入。据统计,其事故占整个雷害事故的50%~70%,因此对雷电波侵入的防护应予 以足够的重视。 架空线路在附近出现对地雷击时极易产生感应过电压。当雷云出现在架空线路上方时,线路上由于静电感应而积聚大量异性的束缚电荷,当雷云对地或其他雷云放电后,线路上的束缚电荷被释放而形成自由电荷,向线路两端泄放,形成电位很高的过电压波,对供电系统危害也很大。
天津大学无机化学思考题完整版
天津大学无机化学思考 题 集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]
第一章思考题 1.一气柜如下图所示: A 假设隔板(A)两侧N2和CO2的T, P相同。试问: (1)隔板两边气体的质量是否相等浓度是否相等物质的量不等而浓度相等 (2)抽掉隔板(假设不影响气体的体积和气柜的密闭性)后,气柜内的T和P 会改变?N2、CO2物质的量和浓度是否会改变?T和P 会不变,N2、CO2物质的量不变而浓度会改变 2.标准状况与标准态有何不同 标准状况指气体在27.315K和101325Pa下的理想气体,标准态是在标准压力下(100kPa)的纯气体、纯液体或纯固体 3.化学反应方程式的系数与化学计量数有何不同?对某一化学反应方程式来说,化学反应方程式的系数和化学计量数的绝对值相同,但化学反应方程式的系数为正值,而反应物的化学计量数为负值,生成物的化学计量数为正值
4.热力学能、热量、温度三者概念是否相同 试说明之。 5.试用实例说明热和功都不是状态函数。 6.判断下列各说法是否正确: (1)热的物体比冷的物体含有更多的热量。× (2)甲物体的温度比乙物体高,表明甲物体的热力学能比乙物体大。× (3)物体的温度越高,则所含热量越多。× (4)热是一种传递中的能量。√ (5)同一体系: (a)同一状态可能有多个热力学能值。× (b)不同状态可能有相同的热力学能值。√ 7.判断下列各过程中,那个ΔU最大: (1)体系放出了60kJ热,并对环境做了40kJ功。 (2)体系吸收了60kJ热,环境对体系做了40kJ功。√ (3)体系吸收了40kJ热,并对环境做了60kJ功。
基于PC机的磁悬浮控制系统研究_第一章绪论_12_20
第一章绪论 磁悬浮技术是集电磁学、电子技术、控制工程、信号处理、机械学、动力学为一体的典型的机电一体化技术。磁悬浮技术是利用磁场力使一物体沿着或绕着某一基准框架的一轴或者几轴保持固定位置,由于悬浮体和支撑之间无任何接触,克服了由摩擦带来的能量消耗和速度限制,具有寿命长,能耗低,安全可靠等优点,目前各国已广泛开展了对磁悬浮控制系统的研究。随着电子技术、控制理论、电磁理论、及新型电磁材料的发展,磁悬浮技术得到了长足的发展。 1.1 磁悬浮方式的分类及技术应用背景 磁悬浮可分为以下3种主要应用方式[1]: (1)电磁吸引控制悬浮方式 这种控制方式利用了导磁材料与电磁铁之间的引力,绝大部分磁悬浮技术采用这种方式。虽然原理上这种吸引力是一种不稳定的力,但通过控制电磁铁电流的大小,可以将悬浮气隙保持在一定数值上。随着现代控制理论和驱动元器件的发展,该方式在工业领域得到了广泛运用。在此基础上也有研究人员将需要大电流励磁的电磁铁部分换成可控型永久磁铁,这样可以大幅度降低励磁损耗。 (2)永久磁铁斥力悬浮方式 这种控制方式利用永久磁体之间的斥力,根据所用的磁材料的不同,其产生的斥力也有所差别。由于横向位移的不稳定因素,需要从力学角度来安排磁铁的位置。近年来随着稀土材料的普及,该方式将会更多的应用于各个领域。 (3)感应斥力方式 这种控制方式利用了磁铁或励磁线圈和短路线圈之间的斥力,简称感应斥力方式。为了得到斥力,励磁线圈和短路线圈之间必须有相对的运动。这种方式主要运动于超导磁悬浮列车的悬浮装置上。但是,在低速时由于得不到足够的悬浮力,限制了这种方式的广泛应用。 近年来,磁悬浮技术作为新兴机电一体化技术发展迅速,与其它技术相比, 1
天津大学 化学工艺导师 姜浩锡
天津大学化工学院硕士生导师——姜浩锡 职称:副研究员 职务:副研究员 导师类型:硕士生导师(硕导) 专业:化学工艺 联系电话: +86(0)22-27406119 传真: +86(0)22-27406119 通讯地址: 电子信箱:hxjiang@https://www.360docs.net/doc/b81246867.html, 主要教育经历 1998-2003,天津大学化工学院工业催化专业,获工学博士学位。 1992-1995,天津大学化工学院有机化工专业,获工学硕士学位。 1983-1987,天津大学化工学院工业催化专业,获工学学士学位。 主要研究方向: 应用催化,超临界流体技术 目前承担的主要科研项目 应用催化: 乙醇一步法制备乙酸乙酯工业催化剂开发 合作开发回收烯烃制取化工产品技术集成项目催化剂开发分项 超临界流体技术: 国家自然科学基金:具有纳米晶结构的MnOx-CeO2 中空纳米球催化剂合成调控机制研究 天津市自然科学基金:纳米晶Cu-Ce-Zr复合氧化物催化剂的SAS制备研究 代表性论著及专利 论文论著: 1. 超临界抗溶剂法纳米Al2O3-ZrO2颗粒的制备与表征,无机材料学报2010, l. 25(10):1065-1070 2. 超临界抗溶剂法制备纳米氧化铝颗粒,催化学报,2007, 28(10):890-894 3. Two Kinds of Active Sites on Cu Cr Catalysts for the Dehydrogenation of Ethanol to Ethyl Acetate, The 4th International conference on green and sustainable
天津大学无机化学考试试卷下册 及 答案
天津大学无机化学考试试卷(下册)答案 一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分) 1、(X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。 2、(X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。 3、(X)磁矩大的配合物,其稳定性强。 4、(X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。 5、(√)已知[HgCl4]2-的K=1.0?10-16,当溶液中c(Cl)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-) 的比值为1.0?10-12。 6、(√)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。 7、(X)硼是缺电子原子,在乙硼烷中含有配位键。 8、(√)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。 9、(√)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。 10、(X)Pb(OAc)2是一种常见的铅盐,是强电解质。 二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分) 1、在下列各种酸中氧化性最强的是...............(B)。 (A)HClO3;(B)HClO;(C)HClO4;(D)HCl。 2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是...............(C)。 (A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。 3、用于说明Pb(Ⅳ)具有强氧化性的是...............(D)。 (A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。 4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金................(C)。 (A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。 5、在一溶液中加入淀粉溶液和少量NaClO溶液,得到蓝色溶液(a),继续加入NaClO后得一无色溶液,然后加入适量Na2SO3溶液,又复原为(a),Na2SO3溶液逐渐过量时,蓝色褪去,成为一无色溶液(b)。由此可推断,(a)和(b)溶液含有...............(B)。 (A)(a)I2,(b)SO42-、IO3-;(B)(a)I2,(b)SO42-、I-; (C)(a)I-,(b)H2S、IO3-;(D)(a)I-,(b)H2S、I-。 6、下列各组离子中每种离子分别与过量NaOH溶液反应时,都不生成沉淀的是...............(B)。 (A)Al3+、Sb3+、Bi3+;(B)Be2+、Al3+、Sb3+; (C)Pb2+、Mg2+、Be2+;(D)Sn2+、Pb2+、Mg2+。
